摘要
背景
吸收种子整合环境和内源信号,在最佳条件下打破休眠并启动生长。种子的成熟在决定发芽种子的存活方面起着重要的作用,例如休眠的作用之一是在不适宜的条件下错开发芽以防止大量生长。FUSCA3 (B3-domain transcription factor FUSCA3,简称FUS3)是种子发育的主要调控因子,也是种子发育过程中激素互作网络的重要节点拟南芥.其功能主要表现在胚胎发育阶段FUS3通过调节ABA/GA水平,促进种子成熟和休眠。
结果
在这项研究中,我们提出证据证明FUS3在超理想的温度下延迟种子发芽,这对正在发育的幼苗是致命的。种子在超适温度下的吸胀过程中,种子的吸胀率达到最大值FUS3启动子被重新激活和诱导从头综合FUS3其次是FUS3蛋白的积累。遗传分析表明FUS3有助于延缓种子在高温下的萌发。与野生型不同,种子过度表达FUS3(ML1:FUS3-GFP)在吸收期间对高温过敏并且不发芽,然而,它们可以在控制温度恢复后完全发芽,达到90%的幼苗存活。ML1:FUS3-GFP在ABA生物合成抑制剂氟利酮的存在下,对高温的超敏反应可以部分恢复,表明这种超敏反应部分是由于该突变体中较高的ABA水平。转录组学分析表明,在超理想温度下吸收的WT种子激活了种子特异性基因以及ABA生物合成和信号抑制基因,同时抑制促进发芽和生长的基因,如GA生物合成和信号基因。
结论
在这项研究中,我们发现了种子成熟的主要调控因子的一个新功能,FUS3,在超适温度下延缓发芽。生理学上,这是重要的,因为延迟萌发在高温下具有保护作用。转录组分析种子汲取了在supraoptimal温度显示,一个复杂的程序,其中包括不仅热量和脱水反应基因的调节调节细胞功能,但也seed-specific程序的激活和抑制germination-promoting项目推迟发芽。
背景
种子成熟开始于胚胎发生中期,并控制着种子质量和生存力等重要性状。在拟南芥中,在胚胎发生的中期,胚胎会积累贮藏化合物,如种子贮藏蛋白(SSP)和脂质,这些物质在萌发的头几天被分解,以维持幼苗的生长。随着胚胎发育到晚期,各种保护蛋白,包括晚期胚胎发育丰富蛋白(LEA)和热休克蛋白(HSP)被合成,为胚胎干燥和休眠的最后阶段做准备[1].遗传和分子研究表明,通过激素脱酸(ABA)和转录因子网络策划了种子成熟,包括包括的转录因子叶状鹅卵石1(LEC1.CCAAT结合因子和b3结构域转录因子,LEC2.那FUSCA3(FUS3),脱落酸不敏感3(ABI3) [2-4.].这些基因被认为是种子成熟的整体调控因子,因为功能缺失的突变胚胎跳过后期胚胎发育,提前进入营养程序。因此,未成熟的突变体种子休眠较少,可以提前发芽,积累较少的种子贮藏化合物。此外,种子fus3那abi3和lec1突变体也不耐干燥,干燥时无法存活[5.-11].在更高阶突变体和转录调控研究中显示的这些表型的增强表明,这些基因共同作用,控制种子成熟、休眠和脱水耐性[8.-10那12-14]遗传和化学研究证实了ABA在调节种子成熟和休眠中的重要作用,表明ABA水平的降低也会降低种子休眠[3.那15].进一步的研究表明,B3-结构域转录因子是激素信号传导途径中的重要节点,并控制激素生物合成中的重要步骤。例如,FUS3促进休眠,并通过刺激GA生物合成的同时通过刺激ABA合成来预防未诱导的未经成果的萌发[16-18].在反馈调节中,ABA和GA分别通过涉及FUS3 c端区域的机制稳定和不稳定FUS3蛋白[17那19].除了在种子发育中的作用,ABI3是ABA信号的正调控因子,如abi3种子在萌发过程中对ABA极不敏感[5.那6.那20.].ABA敏感性在试验中不受影响fus3, lec1和lec2,表明ABA敏感性和种子成熟可以是未耦合的[9.那10].b3结构域蛋白也参与生长素的敏感性和生物合成。的启动子FUS3和ABI3由蟾蜍诱导,而养肝生物合成基因是正常调节的LEC2.和FUS3[17那21-23].
该b3结构域结合了许多种子特异性基因启动子中发现的Sph/RY (CATGCA)核心元件,一些b3结构域靶标包括LEA和新兴市场[24-26].这些基因也在ABA的控制下[27].RY/Sph元件已被证明与ABA响应元件(ABRE)协同作用,这表明种子特异性和ABA调控因子的复杂相互作用控制着胚胎晚期发生和种子成熟[28-30.].热休克因子(HSF),热休克,在热胁迫(HS)中快速诱导,在种子中含量丰富,也是b3结构域和ABA靶标。特别是对种子的表达具有特异性HSFA9.是由ABI3以ABA依赖的方式通过Sph/RY。激活HSFA9.反过来,调节选择的表达海关基因(31].
委员会的成绩单水平LEC,FUS3和ABI3基因在胚胎发生时丰富,在萌发时减少,在营养器官中低水平表达[13那19那32-34]这些基因在萌发过程中的抑制是进入营养体发育所必需的,因为FUS3和LEC胚胎后导致胚胎标志物的表达和植物生长期间胚胎结构的发展[17那33那35-37].更具体地说,过度表达FUS3(ML1:FUS3-GFP)导致种子萌发延迟和对ABA过敏。由于休眠的作用之一是在次优条件下错开萌发和阻止大量生长,我们测试了在非生物胁迫下吸胀期间FUS3将被重新激活以延缓发芽。在本研究测试的应力中,我们发现高温诱导新创FUS3吸收种子中的mRNA合成和蛋白质积累。与野生型相比,ML1:FUS3-GFP种子overexpressingFUS3在萌发过程中,对超适(高温)温度敏感,不能萌发ML1:FUS3-GFP超适宜温度下萌发部分依赖于ABA的生物合成,是一个可逆过程ML1:FUS3-GFP种子在高温下被吸收六天,当温度达到最适合生长时,就能恢复发芽。转录组分析表明,在超适宜温度下,种子在抑制发芽促进程序的同时,重新激活了胚后期和种子成熟程序的表达,从而延缓了种子在超适宜温度下的萌发。
结果
上升温度发芽激活FUS3启动子,诱导FUS3 mRNA和蛋白的积累
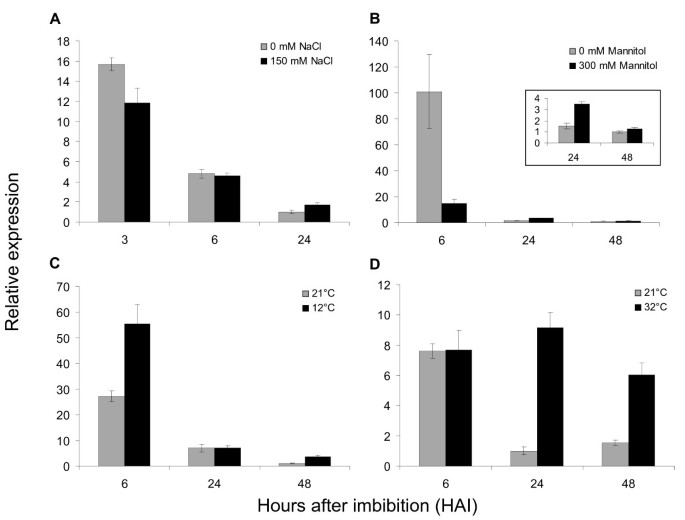
测试是否FUS3在非生物胁迫下的萌发过程中起作用FUS3WT种子的mRNA水平在高盐(150mM NaCl)上,在渗透压(300mM甘露醇)和低(12℃)和高(32°C)温度下(图1)这些条件先前已被证明会延迟野生型种子的萌发[38].我们筛选了模式的变化FUS3在种子吸胀的早期(3或6小时)和晚期(24或48小时)表达FUS3在萌发期间,转录本水平迅速下降[19].FUS3150 mM NaCl对mRNA表达量影响较小,300 mM甘露醇和12℃时表达量波动较大。相比之下,FUS3mRNA水平在32°C上增加2-4倍,在32℃下24小时和48小时,因此我们调查了这一作用FUS3种子在高温下萌发的过程更为详细。
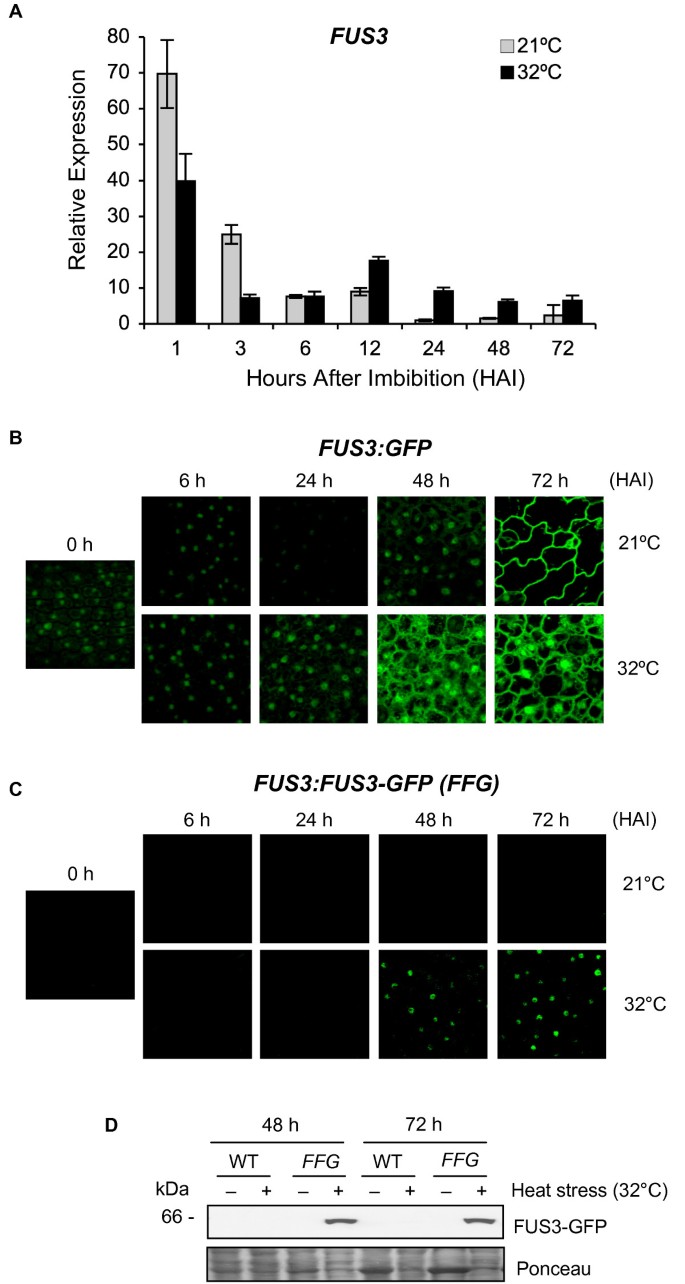
我们进行了一个更详细的时间-过程实验并进行了监控FUS3在32°C下吸收最多3天的种子中的表达水平(图2).我们发现FUS3MRNA在HS的前3小时内减少更快,达到6小时的对照水平。此后,mRNA开始增加并且仍然高于对照至少3天(图2).来测试是否增加FUS3HS暴露较长时间后,mRNA的表达与HS暴露时间延长有关FUS3促进或增加FUS3mRNA稳定,我们使用了FUS3:GFP转录报告(图2 b) [19].与21°C对照相比,32°C的GFP荧光在24 - 72 h之间有明显的增加,反映在FUS3启动子活性。因此,种子暴露在高温下会导致种子迅速降解FUS3最初3小时内的mRNA,随后转录激活(或去表达)导致12小时后的新mRNA合成。这些发现反映在FUS3蛋白水平的增加上,通过使用FUS3:FUS3-GFP(FFG.)先前描述的翻译报告器(图2 c, D) [17].在32℃浸泡48和72 h的种子中,表皮细胞核和免疫印迹中检测到FUS3-GFP蛋白(图)2 c, D).与之前的研究一致,在21°C下浸泡3天的种子中没有检测到FUS3-GFP(图)2 c, D) [19].
上升温度的种子吸收激活FUS3启动子和诱导De Novo Fus3 mRNA合成和Fus3蛋白积累.(一)相对FUS3qPCR检测种子在21°C或32°C恒光下浸泡72 h的mRNA水平。三个重复的平均值被归一化使用肌动蛋白7作为内部控制。结果被绘制成与最低检测水平的比率。进行了两个独立的实验,得到了相似的结果,并给出了一个具有代表性的结果。(B)共聚焦图像显示GFP荧光在表皮FUS3:GFP种子的胚胎在21°C或32°C下吸胀。吸胀后数小时。(C,D)共聚焦图像(C)和免疫印迹(D)显示FUS3-GFP荧光和蛋白质在细胞中的积累FUS3P:FUS3-GFP(FFG)种子在21°C和32°C条件下在恒定光照下吸吮72小时。D)中的WT显示为阴性对照。用抗GFP抗体检测FUS3-GFP(~MW 61 kDa)。在B)和C)中显示的所有图像中使用可比共焦设置。进行了重复实验,并显示了一名代表。
接下来,我们测试了在32℃下FUS3-GFP蛋白的后期积累是否由于种子ABA/GA比的增加,因为在高温下被吸收的拟南芥种子抑制了GA的生物合成并诱导从头ABA的合成导致24h ABA水平升高[39].未检测到FUS3-GFPFUS3:FUS3-GFP种子在ABA或多效唑(GA生物合成抑制剂)作用下在21℃萌发,表明FUS3在高温下的积累并不仅仅依赖于较高的ABA水平1).有趣的是,FUS3蛋白只在已经开始发芽的种子(胚根突出)中检测到,而在热抑制的种子(胚根不突出)或从种皮发芽的幼苗中检测不到。这表明,在高温萌发过程中,FUS3可能在幼苗从种皮出苗之前的一个小发育窗口中起作用。这些结果表明,在超最佳温度32°C下的自吸会导致FUS3转录水平在12-24小时,随后在48小时FUS3蛋白水平增加。
种子萌发和wt和幼苗存活fus3在高温下吸收的损失和功能突变体
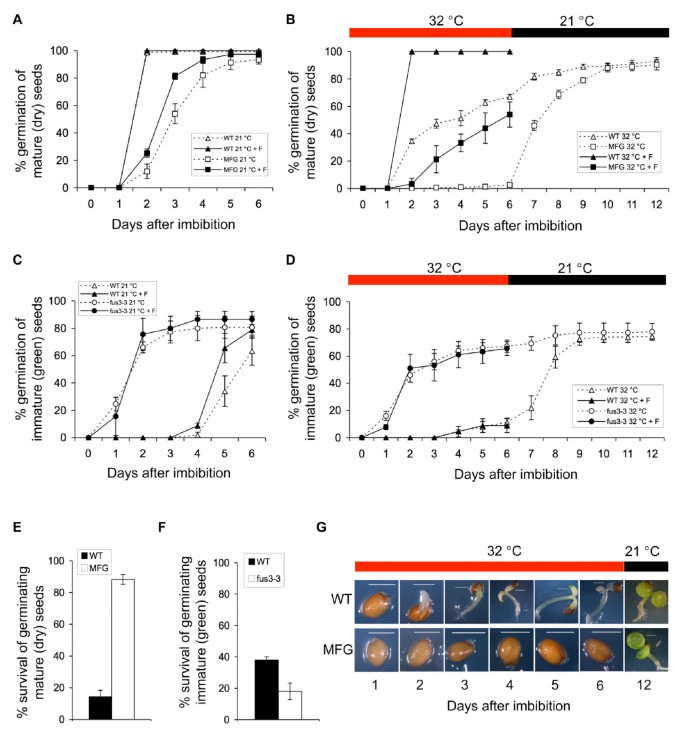
解剖角色FUS3在超适温度下,我们监测了WT的萌发率和存活率,fus3功能丧失(fus3-3)和过度表达(fus3-3那ML1:FUS3-GFP)在32°C下吸收的突变种子(图3.).的ML1:FUS3-GFP构造之前被证明可以拯救fus3-3功能缺失突变和过度表达FUS3胚胎后期的整个营养和生殖发育[17].在21°C下,成熟的WT种子在2天内100%萌发,而在21°C下,成熟的WT种子在2天内100%萌发ML1:FUS3-GFP种子休眠时间较长,萌发速度较慢,在5-6天内萌发率可达90%(图)3).尽管成熟的WT种子在6天内可以达到60-100%的发芽(取决于种子批次),但在32℃下,成熟的WT种子会延迟发芽(图)3 b).所有种植的幼苗表现出与高温胁迫相关的表型,包括被捕的生长和漂白的子叶和缺口(图3 g)。这些幼苗即使转移到21°C也无法恢复和生长,这表明长期暴露在32°C下对拟南芥幼苗生长是致命的(图1)3 b, E).相反,发芽成熟ML1:FUS3-GFP在32°C条件下,种子被大大减少或抑制(取决于种子批次)达6天,这表明ML1:FUS3-GFP种子对高温过敏(图3 a, B, G).虽然在3到6天之间种子胚根突出的百分比非常低,但没有幼苗从种皮出现(图)3 b, G).有趣的是ML1:FUS3-GFP当转移到控制温度时,种子恢复萌发,这导致更高的发芽率ML1:FUS3-GFP与WT相比的存活率(图3 b, E).
种子发芽率和幼苗成活率FUS3超适宜温度下自吸过程和热应激后恢复过程中功能的丧失和获得突变体.(A-G)野生型(WT)的发芽率和幼苗成活率,FUS3功能丧失的突变(fus3-3),ML1:FUS3-GFP(MFG.)对照组(21°C)和超适温度(32°C)下吸胀期间功能突变体的获得。(A,B,E)成熟WT和MFG.在21°C (A)和32°C (B)下,在没有或存在10 μM氟脲酮(+F)的情况下,用MS板滤纸吸附干燥种子。在32°C下吸附6天后,(C, D, F)未成熟WT和WT的萌发(胚根突出)率。(C, D, F)未成熟WT和WT的胚根突出率fus3-3在21°C (C)和32°C (D)条件下,10 μM氟脲酮(+F)存在或不存在时,绿种子在MS介质滤纸上被吸收。盘子D)都被转移到控制温度(21°C)六个额外的天,幼苗存活的%(显示绿色子叶和绿叶)计算(F)。(G)的代表WT和生产厂种子从实验B所示)。平均一式三份±道。(n≥300种子)所示。实验至少重复了两次,得到了相似的结果,并给出了一个具有代表性的结果。F, fluridone。红酒吧、32°C。黑条,21°C。
成熟的fus3功能丧失(fus3-3)突变的种子是干燥的不宽容并诱导,但如果在干燥之前,如果在仍然在绿色时收获未成熟的种子可以救出。因此,我们比较了未成熟的绿色种子的萌发速率fus3-3和在受控高温下吸收的WT(图3 c, D).在21℃下,未成熟的WT种子在吸胀4天后开始萌发,6天后萌发率达到~60%。这是预料之中的,因为未成熟的WT种子处于休眠状态。而在32℃下,未成熟的WT种子表现出较强的热抑制,6天后萌发率达到~10%。转至21℃后,WT未成熟种子恢复萌发。相比之下,不成熟fus3-3种子在21°C和32°C下6 d萌发率分别达到~80%和~60%,对热抑制具有很强的抗性。正如所料,不成熟fus3-3种子在32℃萌发率高于未成熟WT种子,但在21℃恢复后幼苗存活率低于未成熟WT(图)3D,F).综上所述,该数据表明,过表达FUS3抑制种子在超最适温度下萌发,当温度达到最适生长温度时,幼苗存活率增加。这也说明在超适温度下抑制萌发是一个可逆过程,对胚具有保护作用。
ML1:FUS3-GFP在吸收期间对高温的过敏率取决于ABA生物合成
在34℃下被吸收的拟南芥种子由于ABA的激活和GA生物合成的抑制,ABA/GA比更高,从而导致种子萌发受到热抑制[39].ML1:FUS3-GFP种子在萌发和FUS3瞬时激活过程中对ABA异常敏感ML1中引入:FUS3-GR构建提高胚胎发育后ABA水平[17].鉴于此,我们研究了是否ML1:FUS3-GFP在32°C下抑制发芽是由于ABA生物合成的改变。为了测试这一点,我们将WT和ML1:FUS3-GFP在ABA生物合成抑制剂氟利酮存在下的种子。氟利酮可完全逆转32℃下WT萌发的延迟,并部分恢复对ABA生物合成的抑制ML1:FUS3-GFP在32°C萌发(图3 b).氟立酮还能提高种子的发芽率ML1:FUS3-GFP种子在21°C(图3).这表明ML1:FUS3-GFP种子在控制温度下的抑制,与高温下的抑制,似乎部分依赖于从头ABA的生物合成。此外,由于过表达FUS3的种子更休眠,部分原因是由于ABA生物合成的增加,所以增加的休眠可能在中华温度的发芽期间具有积极的效果。
氟立酮对未成熟种子的萌发无明显影响fus3-3而WT种子在21℃时萌发率略有提高(图2)3 c).不敏感的fus3-3预计将种子为氟酮,如fus3-3种子的ABA水平较低[16那17].然而,氟酮对未成熟的WT种子萌发的缺乏影响令人惊讶。由于未成熟的WT种子恢复萌发,当板转移到最佳温度时,Fluridone对WT萌发的缺乏效果不能归因于WT绿色种子的损伤或死亡。这表明了从头ABA合成在WT未成熟种子高温萌发的调控中可能没有主要作用(图)3 d和3 e).
高温吸收种子的转录组分析
我们的数据表明,在超理想温度32°C下的种子萌发诱导新创FUS3mRNA的合成,以及最重要的FUS3蛋白的积累。此外,FUS3过表达强烈抑制拟南芥的萌发,部分是通过ABA的生物合成。因为高温不仅会引起ABA/GA水平的变化,而且还会重新激活FUS3在吸水种子中的功能,我们预测高温也会激活部分由B3蛋白网络调节的种子成熟程序,以延迟发芽。此外,由于FUS3控制ABA/GA比率,并且由于ABA和GA已被证明在热抑制过程中发挥重要作用,我们有兴趣鉴定激素在FUS3激活时,l网络起作用。因此,我们对在高温下吸收的野生型种子的转录组学反应进行了表征。我们对在最佳(21°C)或超最佳(32°C)条件下吸收的野生型拟南芥种子进行了时程微阵列(Affymetrix ATH1)1、12和24小时的温度。选择这些时间点来确定早期(1小时)和晚期(12和24小时)的热应激反应(高铁)基因。选择后一个时间点也是因为它们与ABA水平的增加和FUS3表达,因此可以识别FUS3和ABA共表达基因。
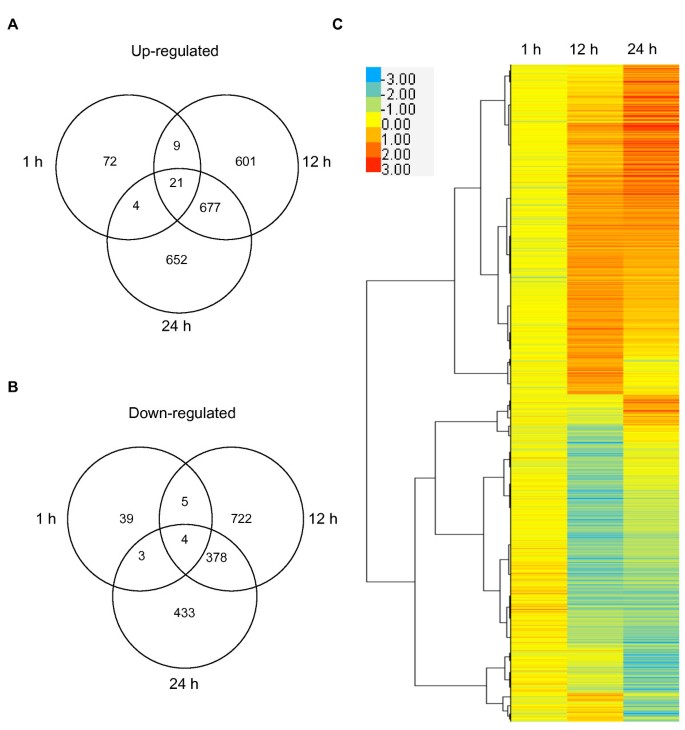
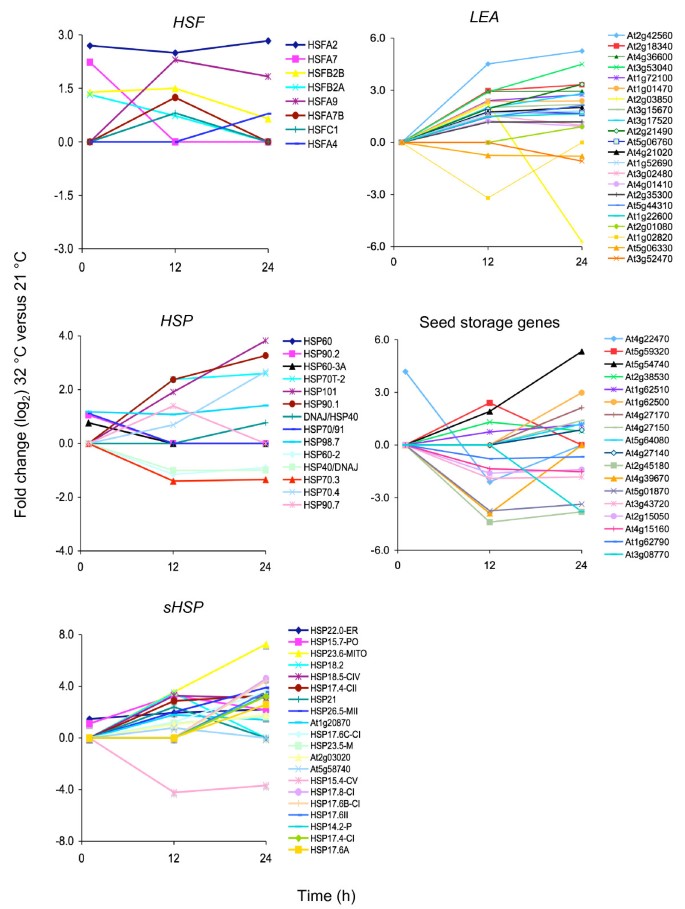
热处理1小时后,只有一小部分157个基因的表达水平发生变化,而在12小时和24小时,超过2000个基因的差异表达,表明在HS后期有大量转录重编程(图1)4.;附加文件2那3.那4.).虽然早期和晚期之间的重叠相对较小高铁基因,大量基因在12小时和24小时的表达增加(677)或减少(378)。为了确定细胞对HS的反应,我们使用基因本体(GO)富集分析(附加文件)分析转录变化5.那6.那7.那8.那9.那10) [40].在所有时间点,富集的最大的Go函数类别是包含“细胞和代谢过程”的那些,而富集的最重要的功能是“对刺激的响应”(附加文件5.)。暴露于32°C下1小时后,吸收的种子反应有限,对“高温反应”和“蛋白质折叠”重要的基因在早期阶段最为丰富高铁(额外的文件6.).而在32℃下吸胀12和24 h后,种子的细胞反应变得更加复杂。氧化石墨烯富集分析表明,HS反应的特异性通过激活耐热性所需的基因、调节细胞代谢和抑制生长发育而增强(附加文件)7.那8.那9.那10).而最显著的生物学功能在晚期富集高铁s也是“对刺激的反应”,“胚胎发育”和“种子休眠”也在go功能类别中显著丰富(附加文件)7.那8.那9.那10)。最丰富的“刺激”包括非生物(高温、氧化、强光和缺水)和化学(ABA、GA和生长素)刺激。
在超适温度下,种子自吸过程中,胁迫相关基因和成熟基因被激活
热休克和hsf众所周知,它们在高温下对细胞功能具有保护作用,并且在HS后被迅速诱导,然而,它们也在其他应激中发挥作用[41].七热休克和四个hsf1 h表达增加,包括HSFA2.和HSFA7.,它们在幼苗获得耐热性方面的作用已经被很好地描述了(图5.) [42那43].大量的热休克(49个基因)和hsf(7个基因)在12小时和/或24小时的转录本丰度增加,具有强烈的高表达诱导HSFA2.和建议的种子特异性和hs独立,HSFA9.(数字5.) [31].这些晚期诱导HSF可能需要长期细胞反应对高温的基因。
正如所料,在高温下吸收12和24小时的种子显示出晚期胚胎发生和种子成熟基因表达水平的大幅增加,包括LEA SSPs储存脂质(42个基因;数字5.).与分子伴侣和其他保护化合物一起,LEA基因被认为与直接的非生物胁迫耐受性有关,并由几种非生物胁迫诱导[41].SSP和贮藏脂质是种子成熟的典型标志,其中一些已被证明是由b3结构域蛋白直接或间接调控的,包括FUS3 [6.-10那13那23-26那28那37].在已知的胚胎晚期发生和种子成熟的全球调节因子中,FUS3是唯一由HS诱导的基因,表明它可能在超最佳温度下吸胀过程中种子特异性程序的激活中发挥重要作用(附加文件4.额外的文件5.).有趣的是,三种尚未鉴定的含b3蛋白(At4g33280, At2g35310, At5g25475)的转录水平也在24小时被诱导(附加文件)5.),并与FUS3在超最佳温度下的自吸过程中起互补作用。
HS延长激活ABA,抑制GA代谢基因
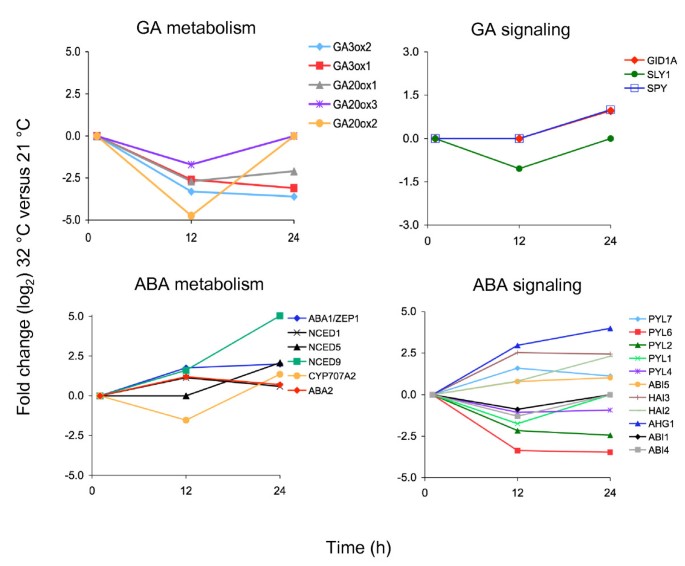
参与激素代谢和信号转导的基因,主要是ABA和GA激素,在晚期富集高铁基因(附加文件7.那8.那9.那10).调节ABA代谢途径的基因mRNA水平升高,而GA生物合成基因的转录水平降低(图)6.).只有少数已知的GA信号基因被鉴定为高铁在我们的微阵列中,包括GA受体,GID1A,以及信令组件,如间谍和狡猾的.相反,参与ABA信号传导的几个基因在高温下差异表达。这些包括ABA受体家庭的几名成员(所有/ RCARs),以及其他下游信号成分,如PP2C磷酸酶(ABI1那海2那海3.那AHG1)和转录因子(ABI4那ABI5)(图6.).在热应力期间,超过100个激酶具有改变的表达水平,包括成员SnRK2/3丝氨酸/苏氨酸激酶家族,包括ABA信号和非生物胁迫反应的正调节因子(补充文件3.额外的文件4.) [44].大多数基因,包括几个所有供试/ RCARs那PP2Cs和SnRK2/3激酶具有未被描述的功能。因此,对高温吸收的种子进行转录组学分析表明,选择已知的ABA信号基因和未鉴定的成员Pyl / RCar.那PP2C.和SNRK.在超适温度下萌发过程中,家族间存在差异,并可能在热抑制过程中发挥特定作用。
在12和24小时,参与其他激素或胁迫信号通路的不同转录因子家族的编码基因也受到不同程度的调控。干旱和热胁迫反应的转录水平DREB2A[45],生长素(ARF11那ARF18还有几个索尔)及乙烯(EIN3 EIN4,人那小块土地应答基因是在12和/或24小时表达水平波动的基因之一(附加文件3.额外的文件4.).因此,除ABA和GA外,其他激素可能在超适温度下的萌发过程中发挥作用。
核心高铁基因
25个基因的转录水平在所有三个时间点增加或减少,构成核心高铁基因(表格1).除了组成性和高度表达的HSFA2.,本列表中的所有其他基因尚未检测其在HS期间的作用。有趣的是,PDX1.2是高度表达的并且是最强的高铁基因的突变PDX1基因影响吡哆醇(维生素B6)生物合成,但是,作用PDX1.2尚未澄清[46].众所周知,维生素B6在抗氧化应激方面起着保护作用,它是许多生化过程中的辅助因子[46那47].因此,维生素B6可能是种子对高温反应的重要组成部分。
讨论
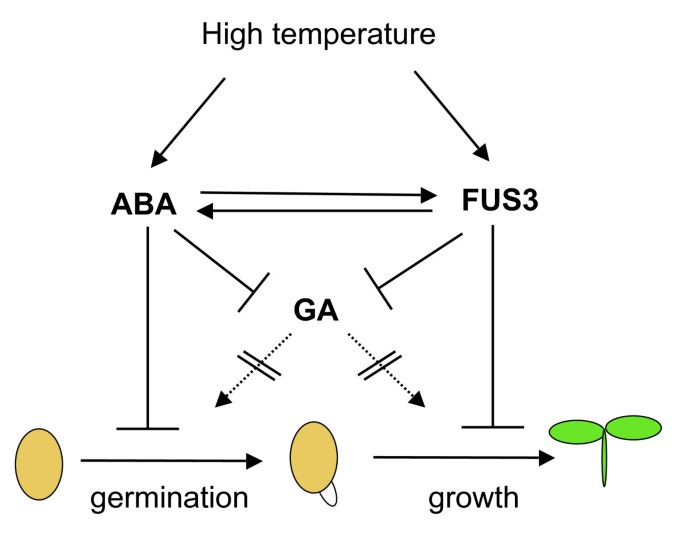
种子萌发受内源因素(如休眠程度)以及环境因素(包括光照、温度和水分)控制。在拟南芥中,野生型种子的萌发在28至32°C之间延迟或中度抑制,但在34°C时完全抑制[39那48].生理,遗传和分子研究突出了ABA和GA在促进和缓解热侵蚀种子萌发中的重要和相反的作用[39那48-52].种子成熟的主要调节器,FUS3,通过负调控GA的生物合成来控制ABA/GA比值,而正向调节ABA水平[16那17].在这里,我们展示了FUS3通过延缓种子萌发,部分通过调节ABA生物合成抑制幼苗生长,来调节种子对高温的反应(图)7.;另见下文)。
高温引起新创FUS3自吸过程中mRNA的合成和FUS3蛋白的积累
FUS3在胚胎中后期发生中起主导作用,促进种子休眠和成熟,同时抑制未成熟种子的过早萌发[10].因此,FUS3mRNA水平在胚胎发生的中后期较高,在萌发和整个营养生长过程中显著下降[19那32].此外,FUS3蛋白的水平与其mRNA的水平与其mRNA的水平不相关,并且在中胚胎发生后仍未被未被发现[17那19].鉴于非常低的水平FUS3这些研究提出的一个问题是胚胎后表达的生理作用FUS3在post-embryonic发展。在这里,我们发现种子在32°C被吸收后迅速降解FUS3mRNA在种子中储存和诱导新创FUS3在12小时合成mRNA,然后在48小时内积累FUS3蛋白(图2).值得注意的是,FUS332°C下的mRNA水平比21°C下吸胀1小时后测得的低约15至70倍。尽管mRNA水平较低,但在32°C下吸胀的种子中检测到FUS3蛋白,但在21°C下未检测到。我们之前已经证明FUS3是一种短寿命蛋白,翻译后调节是维持FUS3蛋白水平的机制之一胚胎发生中期和萌发期间els非常低(不可检测)[19].因此,FUS3-GFP蛋白在32℃的积累很可能是由于HS诱导的翻译和/或翻译后调控。
考虑到未检测到FUS3-GFP蛋白FUS3:FUS3-GFP种子在21°C下吸收ABA(附加文件1),单独ABA似乎不足以诱导FUS3-GFP蛋白在高温自吸过程中积累。然而,ABA可能是通过正反馈调节来维持FUS3蛋白水平高的,因为之前的研究表明ABA正调节FUS3蛋白的丰度ML1:FUS3-GFP苗木(图7.) [17].有趣的是,我们发现,在32℃下,蛋白只能在开始发芽的种子中检测到Fus3蛋白(种系涂层的胚根突起),并且在抑制种子(无胚胎出现)或完全出现的幼苗中未检测到种子涂层。这表明FUS3在高温发芽期间的小型发育窗口中仅活跃,并且可能是延缓萌发和抑制幼苗生长的重要(图7.;另见下文)。
过度的FUS3在超适温度下抑制种子萌发部分是通过ABA生物合成的正向调控
过表达FUS3对胚在高温下萌发具有保护作用。的确,在32℃下,WT种子的萌发比最适温度21℃时延迟,并遭受热胁迫相关的损害。相反,种子过度表达FUS3胚胎后(ML1:FUS3-GFP)表现出强烈的热抑制作用,在21°C移动时,其幼苗存活率远高于野生型(图3.).Thermoinhibition展出的ML1:FUS3-GFPABA生物合成抑制剂氟里酮可缓解32℃下种子的生长,表明其依赖于从头ABA的生物合成。此外,ML1:FUS3-GFP在21℃下,种子比野生型更容易休眠,且萌发延迟ML1:FUS3-GFP在最佳温度下的种子也可以被氟酮拯救。考虑到FUS3在胚胎后期的瞬时激活增加了ABA水平ML1:FUS3-GFP即使在21°C的最适温度下,种子也对ABA过敏[17,我们得出种子过度表达的结论FUS3对高温过敏并引起热浸润从头ABA生物合成的激活。这些发现与之前的研究结果一致,表明在34°C下萌发的热抑制部分是由于从头ABA生物合成以及受ABA生物合成影响的功能缺失突变体表现出对热抑制的抗性[39].因此,增加种子休眠和/或ABA的生物合成是有利的,因为它可以延迟或阻止高温下的萌发,并保护正在发育的幼苗免受温度诱导的伤害。
未成熟的绿色种子fus3-3功能缺失突变体在胚胎发生过程中积累较少的ABA,在21°C下比WT休眠更少(图)3.) [10那16那17].因此,fus3-3在32°C时,比WT更耐热。令人惊讶的是,WT不成熟的绿色种子的热量抑制不依赖于ABA生物合成,因为它不能被氟酮救出。因此,似乎不同的机制可以调节在中升温度下的未成熟和成熟的种子萌发。将来,应评估未成熟种子不同阶段的敏感性,以确定ABA在热侵蚀种子中的作用。实际上,在拟南芥和许多物种的种子发育过程中发生了两峰。第一次母动衍生的ABA峰是需要预防早熟的发芽,而第二ABA峰由胚胎制成,并且重要的是诱导和维持休眠[2那3.]因此,未成熟种子对氟利酮的反应可能取决于发育阶段。
超适宜温度下WT种子的转录组分析
对32℃下吸收的种子的转录组分析显示,参与ABA和GA代谢及信号转导的几个基因表达差异。ABA生物合成基因中,NCED1, NCED5那NCED9那ABA1和ABA2显示12和/或24小时的表达增加,而CYP707A2,是萌发过程中最丰富的ABA分解代谢基因[39],在12小时时表现出短暂的表达减少。这些基因表达的变化与先前在34°C下吸收期间对几个ABA代谢基因转录水平的定量一致[39].的增加FUS312和24小时的mRNA水平与ABA生物合成基因相似。有趣的是,在该微阵列中鉴定的所有ABA代谢基因除NCED1含有RY元素,与b3结构域蛋白相互作用[24-26].自从FUS3正调控ABA水平,这些基因可能直接受FUS3和/或其他B3结构域蛋白。
遗传分析表明,ABA生物合成和信号是热侵蚀萌发,也需要在营养生长期间获取热能[39那48那53].在对单一或高阶ABA生物合成突变体的高温的反应程度中观察到差异,aba1和三倍nced2 nced5 nced9突变体强烈抵抗热量抑制[39那48].的协议,ABA1那NCED5和NCED9显示在我们的微阵列中转录水平的最高增长(图6.).
ABA不敏感(阿布斯ABA信号转导突变体对高温表现出不同的敏感性;例如,abi1是强烈抵抗热抑制,而abi3具有中等抗性abi2那abi4和abi5对热抑制敏感[48].一些ABA信号成分在高温自吸过程中表达改变(图)6.),包括ABA受体家族的几个成员(所有供试/ RCARs)及下游信号和反应基因(PP2C.磷酸酯酶,SNRK.激酶和转录因子)[44那54那55].其中大部分基因在高温萌发过程中的调控和功能尚未得到验证。此外,到目前为止,并不是所有的ABA信号突变体都对热抑制具有抗性,这表明ABA途径的不同成分被用来延缓或抑制高温下种子的萌发。
我们的转录组分析表明,几个GA生物合成基因的表达水平在高温反应中降低。有趣的是,GA3ox1那GA3ox2和GA20ox1,显示出最强和最长的mRNA水平下降FUS3介导的镇压(17那18].遗传和化学研究表明,拟南芥种子萌发的热抑制需要GA生物合成和信号传导的抑制[39].事实上,添加外源GA可以部分缓解热抑制。此外,一些GA信号负调控因子的功能缺失突变(间谍和rgl2)赋予热量抑制,而其他几种突变(rgl1那rgl3.那rga和时至今日) 不要 [39].为了充分理解GA信号元件在热抑制中的作用,可能需要对多个DELLA突变体组合进行分析。有趣的是,我们的转录组分析表明,在高温下,GA信号的抑制开始于瞬时的下调SLY1在12小时,然后是上调GID1A和间谍24小时时(图6.).因此,表达下调SLY1,编码涉及多个Della蛋白的降解的F箱蛋白[56那57,可能足以抑制在高温下萌发的GA信号。诱导24 hGID1A,编码在干燥和被吸收的种子中最丰富的GA受体,可能是由于ABA/GA比值的变化触发的反馈调节,如前所述[58].的增加GID1A24小时的水平也可能抵消减少的效果SLY1此时的mRNA,因为GID1过度表达下调Della镇压[59].遗传分析狡猾的和盖需要用突变体来分析赤霉素在热抑制萌发中的作用。
种子特异性基因和种子成熟相关基因在12和24 h的高温下被诱导。这些基因中有大量在干性种子中表达量最高的[30.,在32°C下的种子中也显示出最高的转录本丰度(附加文件)2那3.那4.)一项对公共微阵列的调查显示,大多数SSP /李在32°C条件下,在种子吸胀期间表现出最高mRNA水平的基因在种子发育期间优先表达[60].此外,大多数SSP /李在32°C下表达增加的基因,在种子或幼苗中也显示了ABA的诱导[60].这表明在高温下SSP /李基因可能会随着ABA水平的变化而波动。这也证实了SSP /李基因受到ABA的强烈调控,但在种子成熟之外发挥着不同的作用[41].在已知的全球晚期胚胎发生调节者中,FUS3是我们微阵列中唯一由HS诱导的基因,因此可能在高温萌发过程中的种子特异性程序调节中发挥主要作用(其他文件)2那3.那4.).这令人惊讶,因为abi3在耐高温突变体的遗传筛选中,突变体已被恢复[48].降低了传感器的灵敏度abi3这可能是该突变体无法对ABA反应的结果。高温可能会影响ABI3的翻译和/或翻译后调控和/或与ABI3协同作用所需的其他成分,如ABI5,而不产生影响ABI3直接转录(61].虽然ABI4和5.32°C时表达水平改变,abi5而且abi4突变体在种子萌发的热抑制中具有WT反应[48].几个没有特征的bZIP基因在热应激后12和/或24小时的表达水平变化,并且可能比统一的角色发挥ABI4和ABI5在高温下发芽(附加文件3.额外的文件4.).
在我们的微阵列中,有几个与应激相关的基因是由高温诱导的,包括HSF那HSP以及LEA基因,其中大多数在种子成熟过程中是丰富的,也被认为在几种非生物应激反应中发挥作用[41那62].在HS相关基因中,HSFA9.体外表达已被证明是由ABI3诱导的,而不是FUS3。此外,HSFA9.ABA吸收的种子的mRNA含量是ABA吸收的10倍,这表明ABA对种子有一定的调控作用HSFA9.由ABA和ABI3编写[31那60].虽然ABI3转录本不增加,种子在高温下吸收,激活HSFA9.HS期间的启动子可能需要ABI3旁边的其他因素。在高温下的种子吸收会诱导几个的表达hsf在不同的时间,其中一些(HSFA2.)在获取幼苗中的热能局期间发挥重要作用,而其他作品(HSFA4.和HSFC1)以前未显示受HS管制。这可能是由于与以前的基因芯片相比,该基因芯片使用了较长的HS暴露时间(12和24小时)和发育阶段(种子吸胀)[43那63-65].它们的作用HSF在热抑制和延长HS期间仍有待阐明。
结论
在这项研究中,我们发现了种子成熟的主要调控因子的一个新功能,FUS3在超适温条件下延缓萌发和抑制幼苗生长。诱导FUS3 mRNA和蛋白水平从头当种子在超适宜温度下吸收时。此外,超休眠ML1:FUS3-GFP种子对热抑制非常敏感,这在一定程度上取决于温度从头ABA合成。生理上,这是重要的,因为休眠增加可以延迟或预防高温发芽,因此对胚胎具有保护作用。在高温下吸收的种子的转录组分析显示,复合程序被激活,这不仅涉及调节热量和脱水反应基因以调节细胞功能,还涉及ABA和抑制Ga代谢和响应基因的抑制。最后,我们的研究表明,在高温下吸收的种子也激活了种子成熟程序中涉及的基因的表达,以及FUS3是在超适宜温度下吸胀期间激活的唯一晚期胚胎发育主调节器。考虑到FUS3该基因由热胁迫诱导,受ABA/GA水平调控,自身调节ABA/GA水平和种子成熟程序,可能在种子对高温的反应中发挥重要作用。
我们提出了一种模型,其中Fus3蛋白和ABA水平在总升至温度下的种子吸收过程中增加,以通过共用以及独立的途径延迟或抑制萌发(图7.).一旦被HS诱导,FUS3可能通过对ABA合成的正向调控,在不利条件下延缓种子萌发,阻止幼苗生长。ABA反过来稳定FUS3水平,建立一个正反馈调节。FUS3和ABA负调控GA的生物合成,在超适温度下延缓或阻止萌发。
方法
植物材料、生长条件及种子萌发
对于萌发测定,50-100拟拟南芥(哥伦比亚生态型)或ML1:FUS3-GFP(MFG.;[17将过表达的干种子消毒,并在MS板上按指定的时间用滤纸吸收。的功能丧失fus3-3种子(10]以同样的方式处理,但它们是从未成熟的(绿色/黄色)角果中收获的,因为它们的干燥不耐受表型[10].所有的发芽试验均在3个重复中进行。种子在21或32°C的受控种子培养箱中恒光下发芽。在回收阶段,滤纸在21°C下转移到新鲜的MS板上,持续6天。发芽率以胚根突出程度为基础进行评分。进行了两个独立的实验,并给出了典型结果。
共聚焦显微镜
吸收FUS3:GFP[19),FUS3: FUS3-GFP (FFG)[17]将胚胎从种子涂层中解剖,安装在水中的载玻片上并通过共聚焦显微镜进行成像,如前所述[19].使用相同的共聚焦设置检测21和32°C时的GFP荧光强度。
免疫印迹
如所述进行蛋白质分离和免疫印迹[19]用兔抗GFP(1:3000)多克隆抗体(Abcam)和驴抗兔结合辣根过氧化物酶(HRP)(1:10000)抗体(Cederlande)检测GFP和FUS3-GFP。
芯片分析和实时定量PCR (qPCR)
将种子灭菌并在放在MS板上的滤纸上进行灭菌,以用于指示的时间。种子在受控种子培养箱的恒定光下发芽,在21或32℃下,在1,12和24小时后收集样品。如前所述使用附加文件中列出的引物如前所述,完成总RNA提取和QPCR11[19].三个重复的平均值被归一化使用ACTIN7或UBC28作为内部对照。结果以最低检测水平的比率绘制。进行了两个独立实验,结果相似,其中一个显示。根据《Affymetrix基因芯片表达分析技术手册》,RNA用于Affymetrix ATH1阵列的cDNA合成、标记和杂交(http://www.affymetrix.com),由CAGEF Affymetrix基因芯片设施(细胞与系统生物学,多伦多大学)。重复的生物复制被杂交成分离的阵列。数据文件量化和归一化采用GCOS/MAS5算法,TGT值为100。通过使用内部控制和比较重复数据来确认数据质量。然后使用包括Eisen实验室的Cluster和TreeView程序在内的工具组合分析数据[66]多伦多大学的生物阵列资源[67],Bioconductor / R [68以及微软的Excel。从重复阵列的归一化数据中生成每个基因在每个实验条件下的平均表达值。只有在检测概率为的情况下,基因才被标记为存在P.< 0.05。数据通过与具有代表性的一组基因的实时PCR进行比较验证(附加文件)12).数据被进一步过滤,如果有少于1.8倍的变化,基因被排除在外20.85)。通过该过滤的基因进一步分析。使用Promomer对1000bp的上游基因序列进行启动子元素分析(http://bar.utoronto.ca;[67])和TAIR的母题分析(http://www.arabidopsis.org/tools/bulk/motiffinder/index.jsp).基于Agrigo基于Web的工具(http://bioinfo.cau.edu.cn/agriGO)用于基因本体论(GO)富集分析[40].使用Northern对所选基因组进行进一步的表达分析(http://bar.utoronto.ca) [67].利用艾森实验室的聚类程序进行了聚类分析[66在三个时间点的折痕变化数据集上。首先在基因之间生成自组织图,然后使用皮尔逊(居中)相关系数和平均连锁进行层次聚类时,使用自组织图的隶属度来指示基因聚类顺序。使用TreeView将生成的聚类图和数据矩阵可视化。
参考
- 1.
种子萌发与休眠。acta botanica sinica(云南植物学报). 1997,9:1055-1066。10.1105 / tpc.9.7.1055。
- 2.
Finkelstein RR,Gampala SSL,岩霉菌:种子和幼苗中的脱落酸信号传导。植物细胞。2002,14:S15-S45。
- 3.
李志强,李志强,李志强:种子休眠的分子机制研究。植物生态学报。2008,59:387-415。10.1146 / annurev.arplant.59.032607.092740。
- 4.
杨志强,杨志强,杨志强:控制种子发育的B3网络的功能对称性。植物生态学报。2008,11:548-53。10.1016 / j.pbi.2008.06.015。
- 5.
Koornneef M,Reuling G,Karssen CM:水稻脱落酸不敏感突变体的分离和鉴定拟南芥《生理植物》,1984,61:377-383.10.1111/j.1399-3054.1984。tb06343.x。
- 6.
Nambara E, Naito S, McCourt P:一个在种子发育和贮藏蛋白积累方面存在缺陷的拟南芥突变体阿布斯等位基因.植物杂志1992,2:435-441.10.1111/J.1365-313X.1992.00435.x。
- 7.
拟南芥ABI3基因内部缺失突变体的分离。植物生理学报。1994,3:509-513。
- 8.
杨志强,杨志强:拟南芥叶片子叶突变体的研究。植物学报。1994,6:1049-1064。
- 9.
叶子叶1是拟南芥胚胎发育后期和子叶鉴定的重要调控因子。植物学报。1994,6:1731-1745。
- 10.
Keith K, Krami M, Dengler NG, McCourt P:fusca3:一种影响拟南芥晚期胚胎发育的异细突变。植物细胞。1994年,6:589-600。
- 11.
Parcy F, Valon C, Raynal M, Gaubier-Comella P, Delseny M, Giraudat J:拟南芥种子发育过程中基因表达程序的调控:ABI3位点和内源脱落酸的作用。植物学报。1994,6:1567-1582。
- 12.
Raz V,Bergervoet JH,Koornneef M:拟南芥种子发育停滞的顺序步骤。发育。2001,128:243-252。
- 13.
陈志强,陈志强,陈志强,等:拟南芥贮藏蛋白基因表达的调控。发展。2003,130:6065-6073。10.1242 / dev.00814。
- 14.
【关键词】拟南芥;种子成熟;基因调控;植物营养与肥料学报。2006,18(4):442 - 451。10.1105 / tpc.105.039925。
- 15.
ABA在种子中的作用及相互作用。植物科学进展。2003,8:213-217。10.1016 / s1360 - 1385(03) 00060 - 8。
- 16.
Nambara E, Hayama R, Tsuchiya Y, Nishimura M, Kawaide H, Kamiya Y, Naito S: Arabidopsis thaliana中ABI3和FUS3基因座在胚胎发育后期到萌发阶段转变中的作用。生物医学进展。2000,22:412-423。10.1006 / dbio.2000.9632。
- 17.
Gazzarrini S, Tsuchiya Y, Lumba S, Okamoto M, McCourt P:转录因子FUSCA3通过激素赤霉素和脱落酸控制拟南芥的发育时间。应用生态学报,2004,27(5):593 - 598。10.1016 / j.devcel.2004.06.017。
- 18.
拟南芥(Arabidopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliopsis thaliana)植物营养与肥料学报。2004,31(4):591 - 598。10.1104 / pp.104.047266。
- 19.
关键词:拟南芥,FUSCA3, mRNA,蛋白水平,激素脱落酸,赤霉酸植物学报,2010,64:100-113。
- 20。
Giraudat J,Hauge BM,Valon C,Smalle J,Parcy F,Goodman HM:通过定位克隆分离拟南芥ABI3基因。植物细胞。1992,4:1251-1261。
- 21。
Brady SM,Sarkar SF,Bonetta D,McCourt P:Asscisic酸不敏感3(ABI3)基因被法呢基化调节,并参与拟南芥中的疾病信号传导和侧根发育。工厂J. 2003,44:67-75。10.1046 / J.1365-313x.2003.01707.x。
- 22。
Stone SL、Braybrook SA、Paula SL、Kwong LW、Meuser J、Pelletier J、谢长廷、费舍尔RL、戈德堡RB、原田JJ:拟南芥多叶子叶2诱导成熟性状和生长素活性:体细胞胚胎发生的意义。美国国家科学院学报,2008,105:3151-3156。10.1073/pnas.0712364105。
- 23.
Yamamoto A, Kagaya Y, Usui H, Hobo T, Takeda S, Hattori T:微阵列分析揭示的拟南芥种子成熟主调控因子FUS3的不同作用和机制。植物营养与肥料学报。2010,31(4):441 - 446。10.1093 /卡式肺囊虫肺炎/ pcq162。
- 24.
Reidt W, Wohlfarth T, Ellerström M, Czihal A, Tewes A, Ezcurra I, Rask L, Bäumlein H:胚胎发生后期的基因调控:成熟特异性基因启动子的RY基元是FUS3基因产物的直接靶标。植物营养学报,2000,21(4):491 - 498。10.1046 / j.1365 - 313 x.2000.00686.x。
- 25.
Mönke G, Altschmied L, Tewes A, Reidt W, Mock HP, Baumlein H, Conrad U:种子特异性转录因子ABI3和FUS3与DNA的分子相互作用。植物营养学报。2004,19(4):457 - 461。10.1007 / s00425 - 004 - 1206 - 9。
- 26.
Braybrook SA, Stone SL, Park S, Bui AQ, Le BH, Fischer RL, Goldberg RB, Harada JJ:叶叶子叶2直接调控的基因为胚胎成熟和体细胞胚胎发生的控制提供了见解。美国国家科学院学报。2006年,103:3468 - 3473。10.1073 / pnas.0511331103。
- 27.
Busk PK,Pagès M:脱落酸诱导转录的调节.植物分子生物学.1998,37:425-435.10.1023/A:100605870720。
- 28.
Ezcurra I,EllerströmM,Wycliffe P,StålbergK,raskL:纳帕启动子复合元素之间的相互作用:B盒ABA响应复合物和RY / G复合物都是种子特异性表达所必需的。植物mol biol。1999年,40:699-709。10.1023 /答:1006206124512。
- 29.
Vasil V, Marcotte WR, Rosenkrans L, Cocciolone SM, Vasil IK, Quatrano RS, McCarty DR:在Em启动子中Viviparous1 (VP1)和脱落酸反应元件的重叠:G-box元件对于VP1的转位激活是充分的,但不是必需的。acta botanica sinica(云南植物研究),2011,29(5):531 - 534。
- 30
Nakabayashi K,Okamoto M,Koshiba T,Kamiya Y,Nambara E:拟南芥种子萌发中储存mRNA的全基因组图谱:种子转录的表观遗传和遗传调控。植物杂志,2005,41:697-709.10.1111/J.1365-313X.2005.02337.x。
- 31.
Kotak S,Vierling E,BäumleinH,von Koskull-döringpp:一种新的转录级联调节拟南芥种子发育过程中热应激蛋白的表达。植物细胞。2007,19:182-195。10.1105 / TPC.106.048165。
- 32.
Luerssen H,Kirik V,Herrmann P,Misera S:FUSCA3编码一种具有保守的VP1/ABI3样B3结构域的蛋白质,该结构域对拟南芥种子成熟的调节具有重要功能。Plant J.1998,15:755-764.10.1046/J.1365-313X.1998.00259.x。
- 33.
Lotan T,Ohto M,Yee KM,西马州,Lo R,Kwong RW,Yamagishi K,Fischer RL,Goldberg RB,Harada JJ:拟南芥多叶子叶1足以在营养细胞中诱导胚胎发育。Cell.1998,93:1195-1205.10.1016/S0092-8674(00)81463-4。
- 34.
fuchiya Y, Nambara E, Naito S, McCourt P: FUS3转录因子通过表皮调控因子TTG1在拟南芥胚胎发生中的作用。植物学报,2004,37:73-81。10.1046 / j.1365 - 313 x.2003.01939.x。
- 35.
Stone SL,Kwong LW,Yee KM,Pelletier J,Lepiniec L,Fischer RL,Goldberg RB,Harada JJ:叶子叶2编码一种诱导胚胎发育的B3结构域转录因子。美国科学院学报,2001,20:11806-11811。
- 36.
Kagaya Y, Toyoshima R, Okuda R, Usui H, Yamamoto A, Hattori T:叶状子叶1通过调节FUSCA3和脱落酸inscisic ACID INSENSITIVE3调控种子贮藏蛋白基因。植物营养与肥料学报。2005,32(4):429 - 434。10.1093 /卡式肺囊虫肺炎/ pci048。
- 37.
关键词:拟南芥,种子贮藏蛋白基因,aba依赖,FUSCA3转录因子植物营养与肥料学报。2005,32(4):451 - 457。10.1093 /卡式肺囊虫肺炎/ pci031。
- 38.
Kim JY,Kwak KJ,Jung HJ,Lee HJ,Kang H:MicroRNA402通过靶向去甲肾上腺素样蛋白3 mRNA影响胁迫条件下拟南芥种子萌发。植物细胞生理学。2010, 51: 1079-1083. 10.1093/pcp/pcq072。
- 39.
Toh S,Imamura A,Watanabe A,Nakabayashi K,Okamoto M,Jikumaru Y,Hanada A,Aso Y,Ishiyama K,Tamura N,Iuchi S,Kobayashi M,Yamaguchi S,Kamiya Y,Nambara E,Kawakami N:高温- 诱导脱落酸生物合成及其在拟南芥种子中胃蛋白作用抑制作用的作用。植物理性。2008,146:1368-1385。10.1104 / pp.107.113738。
- 40
周杜,周X,凌Y,张Z,甄苏:agriGO:农业社区的GO分析工具包。Nucl Acids Res.2010,38:W64-W70.10.1093/nar/gkq310。
- 41
平山、筱崎:后基因组时代植物非生物胁迫反应的研究:过去、现在和未来。植物学报,2010,6:1041-1052。
- 42
Charng Yy,Liu HC,Liu Ny,Chi Wt,王CN,Chang Sh,王TT:拟南芥中获得的热能突出所需的热诱导转录因子HSFA2。植物理性。2007,143:251-262。
- 43。
Larkindale J,Vierling E:核心基因组反应涉及到高温的适应性。植物理性。2008,146:748-761。
- 44。
Cutler SR, Rodriguez PL, Finkelstein RR, Abrams SR:脱落酸:核心信号网络的出现。植物生态学报,2010,31(6):651-679。10.1146 / annurev - arplant - 042809 - 112122。
- 45。
关键词:拟南芥,转录因子DREB2A,水胁迫,热胁迫,基因表达美国国家科学院学报。2006年,103:18822 - 18827。10.1073 / pnas.0605639103。
- 46。
维他命B6:一石二鸟?植物营养与肥料学报。2010,31(4):495-501。10.1016 / j.phytochem.2009.12.015。
- 47.
Raschke M, Boycheva S, Crevecoeur M, Nunes-Nesi A, Witt S, Fernie AR, Amrhein N, Fitzpatrick TB:维生素B水平的提高增加了拟南芥的气生器官大小,并对逆境耐受性产生积极影响。植物保护学报,2011,33(6):714 - 724。10.1111 / j.1365 - 313 x.2011.04499.x。
- 48.
田村N,吉田T,田中a, Sasaki R, Bando A, Toh S, Lepiniec L, Kawakami N:拟南芥耐高温萌发突变体的分离与鉴定。植物营养与肥料学报。2006,27(4):489 - 494。10.1093 /卡式肺囊虫肺炎/ pcj078。
- 49.
Yoshioka T, Endo T, Satoh S:用一种脱落酸生物合成抑制剂氟烷酮在超适温度下恢复种子萌发。植物生理学报。1998,39(4):497 - 503。
- 50
Gonai T,Kawahara S,Tougou M,Satoh S,Hirhiba T,Hirai N,Kawaide H,Kamiya Y,Yoshioka T:Asscisic酸在热抑制种子萌发和吉布林毒素的增强粘合剂。J Exp Bot。2004年,55:111-118。
- 51
Cadman CS,Toorop PE,Hilhorst HW,Finch Savage WE:拟南芥Cvi种子在休眠周期中的基因表达谱表明了一种共同的潜在休眠控制机制。植物杂志,2006,5:805-822。
- 52
Leymarie J,Robayo-Romero Me,Gendreau E,Benech-Arnold RL,Corbineau F:ABA参与诱导大麦中休眠(大麦芽L)种子。植物营养与肥料学报。2008,29(4):489 - 498。10.1093 /卡式肺囊虫肺炎/ pcn164。
- 53
关键词:拟南芥,热胁迫,突变体,信号通路植物营养与肥料学报。2005,32(4):489 - 494。10.1104 / pp.105.062257。
- 54
杨永强,杨永强,杨永强,杨永强,杨永强。PP2C磷酸酶活性调节因子在细胞脱落酸传感器中的作用[j]。中国科学:地球科学。
- 55.
公园SY, Fung P,西村N, Jensen博士,藤井裕久H,赵Y, Lumba年代,圣地亚哥J,罗德里格斯,Chow TF,阿尔弗雷德,Bonetta D,芬克尔斯坦R, Provart新泽西,Desveaux D,罗德里格斯PL,麦考特P,朱镕基J - k,施罗德,Volkman BF,卡特勒SR:脱落酸抑制2型C通过PYR蛋白质磷酸酶/所有的家庭开始蛋白质。自然科学进展。
- 56.
McGinnis Km,Thomas SG,Soule JD,Strader LC,Sun T-P,Steber CM:拟南芥困乏的基因编码了SCF E3泛素连接酶的推定的F箱亚基。植物细胞。2003,15:1120-1130。10.1105 / TPC.010827。
- 57.
莳萝a,托马斯sg,胡j,steber cm,sun tp:theArabidopsF-box蛋白SLEEPY1针对赤霉素诱导降解的赤霉素信号抑制剂。植物细胞。2004,16:1392-1405。10.1105/tpc.020958。
- 58.
张志龙,张志龙,张志龙,龚峰,孙tp .拟南芥GID1赤霉素受体的遗传特征和功能分析。植物学报。2006,12:3399-3414。
- 59.
Arizumi T,Murase K,Sun TP,Steber CM:胃肠苷受体Gibberellin不敏感Dwarf1的拟南芥中Della抑制的蛋白水解下调。植物细胞。2008,9:2447-2459。
- 60.
Goda H,佐佐木E,秋山K, Maruyama-Nakashita, Nakabayashi K,李W,小川M,山内Y,普雷斯顿J, K,青木牙T, Takatsuto年代,Fujioka年代,Asami T, Nakano T,加藤H,美津浓T,神H,山口,Nambara E, Kamiya Y,高桥H,平井一夫,樱井T, Shinozaki K,齐藤K,吉田年代,岛田Y:AtGenExpress激素和化学治疗数据集:实验设计、数据评估、模型数据分析和数据访问。植物营养学报,2008,32(5):526-542。10.1111 / j.1365 - 313 x.2008.03510.x。
- 61.
Lopez-molina L,莫兰兰德S,McLachin DT,Chait Bt,Chua NH:Abi5在Abi3下游作用于萌发期间的ABA依赖生长停滞。工厂J. 2002,32:317-328。10.1046 / J.1365-313x.2002.01430.x。
- 62.
Kosová K, Vitámvás P, Prášil IT, Renaut J:非生物胁迫下植物的蛋白质组变化——蛋白质组学研究对了解植物胁迫反应的贡献。中国蛋白质组学杂志。2011,34(4):441 - 446。10.1016 / j.jprot.2011.02.006。
- 63.
里兹斯基L,梁H,舒曼J,舒拉耶夫V,达夫列托娃S,米特勒R:当防御途径发生冲突时。拟南芥对干旱和热胁迫的反应。植物生理学。2004,134:1683-1696。10.1104/pp.103.033431。
- 64
Lim CJ, Yang KA, Hong JK, Choi JS, Yun DJ, Hong JC, Chung WS, Lee SY, Cho MJ, Lim CO:拟南芥悬浮培养细胞热驯化过程中的基因表达谱。植物营养学报,2006,19(2):241 - 241。10.1007 / s10265 - 006 - 0285 - z。
- 65
Kilian J, Whitehead D, Horak J, Wanke D, Weinl S, Batistic O, D’angelo C, Bornberg-Bauer E, Kudla J, Harter K: AtGenExpress全球胁迫表达数据集:UV-B光、干旱和冷胁迫响应的协议、评估和模型数据分析。植物学报,2007,50:347-363。10.1111 / j.1365 - 313 x.2007.03052.x。
- 66
eeisen MB, Spellman PT, Brown PO, Botstein D:全基因组表达模式的聚类分析和显示。美国国家科学院学报。1998年,95:14863 - 14868。10.1073 / pnas.95.25.14863。
- 67。
Toufighi K, Brady SM, Austin R, Ly E, Provart NJ:植物阵列资源:E - northern,表达垂线,和启动子分析。植物学报,2005,43:153-163。10.1111 / j.1365 - 313 x.2005.02437.x。
- 68。
绅士RC,凯里VJ,贝茨DM Bolstad B, Dettling M, Dudoit年代,埃利斯B, Gautier L,通用电气Y,贵族J, Hornik K, Hothorn T, Huber W, Iacus年代,伊R, Leisch F,李C, Maechler M,罗西尼AJ, Sawitzki G、C史密斯,史密斯G, Tierney L,杨司法院,张J: Bioconductor:打开软件开发计算生物学和生物信息学。基因组学杂志。2004,5:R80-10.1186/gb-2004-5-10-r80。
确认
我们感谢布赖特克罗伊兹对手稿的批判性阅读。这项工作得到了NSERC和Connaught New Staff Matching基金对S.G, NSERC对N.J.P., CAGEF对H.N.的支持
作者信息
隶属关系
相应的作者
电子辅料
fus3-gfp蛋白表达
额外的文件1:FUS3:FUS3-GFP在32°C下吸胀期间以及在21°C下存在或不存在ABA或多效唑时的种子.(A,B)共聚焦图像显示表皮中的FUS3-GFP荧光FUS3:FUS3-GFP胚胎。种子在有或没有激素或抑制剂的MS培养基上浸泡72 h。在MS培养基上萌发时,在32°C下检测到FUS3-GFP荧光(左二图;红色条),但在21°C(黑色条)共聚焦显微镜。ABA(0.4、0.8、1.2 μM)和多效唑(PAC;在吸胀(HAI)后72小时内,0.4 μM的荧光不足以诱导FUS3-GFP荧光。在48 HAI时也得到了类似的结果(数据未显示)。进行了重复实验,并给出了一个实验结果。所有图像都使用了可比的共焦设置。A)绿色通道,GFP;B)绿色通道(GFP)和红色通道(碘化丙啶)的合并图像。 (PDF 656 KB)
1小时内上调和下调基因列表
附加文件2:。上调(标签1)和下调列表(标签2)高铁32°C与21°C对照相比,种子中基因在1 h内的表达量最高或被抑制的基因在1 h内表达量最高(表3)。(XLS 79 KB)
12小时内上调和下调基因列表
附加文件3:.上调(表1)和下调(表2)的列表高铁与21℃的控制相比,在32℃下在32℃下吸收的种子中的基因,并且在12小时的顶部最高表达或抑制基因(Tab 3)。如方法所述过滤基因。(XLS 628 KB)
24小时上调和下调基因列表
附加文件4:。上调(标签1)和下调列表(标签2)高铁32°C与21°C对照相比,种子中的基因在24小时内表达量最高或被抑制的基因在24小时内表达量最高(表3)。(XLS 570 KB)
go -term在上调和下调基因中富集的综述
附加文件5:。利用agriGO在每个时间点的上调和下调基因中富集氧化石墨烯术语[40].y轴是由该术语绘制的基因百分比,代表GO术语的丰度。每个时间点的百分比是由映射到GO项的基因数量除以每个时间点的所有基因数量(蓝色列)计算出来的。将相同的计算应用于默认引用列表(绿色列)。x轴是GO术语定义。go术语类别中的亚生物功能的详细描述可以在附加文件6-10中看到。(PDF 263 KB)
在1小时的上调基因中的GO-术语富集
附加文件6:。使用Agrigo的海运生物过程类别中的超级逗人术院术语的分层树图[40].图中的方框代表以GO ID、术语定义和统计信息标注的GO术语。重要项(调整后)P.≥0.05)用颜色表示,不显著项用白框表示。在图中,盒子的颜色饱和度与该术语的富集水平呈正相关(从黄色开始,P.= 0.05到红色,P.= 5平台以及)。实线、虚线和虚线分别表示该线连接的两端的两个充实项、一个充实项和零充实项。(PDF 75 KB)
在微阵列中差异调节的选定基因的qPCR验证
附加文件12:。A)选择的相对表达水平高铁qPCR检测的基因。ACTIN7作为内部控制。三个重复的平均值被归一化使用肌动蛋白7作为内部对照。结果绘制为最低检测水平的比率。进行了两个独立实验,结果相似,其中一个显示为。B)倍数变化(对数2)在32°C和21°C下a中基因的表达(PDF 12kb)
作者为图像提交的原始文件
以下是与作者的原始提交的图像的链接。
权利和权限
开放获取本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
Chiu,R.S.,Nahal,H.,Provart,N.J.et al。拟南芥的作用FUSCA3高温抑制种子萌发过程中的转录因子。BMC植物杂志12,15(2012)。https://doi.org/10.1186/1471-2229-12-15
收到了:
公认:
发表:
关键字
- 高温
- FUSCA3
- 种子萌发
- 激素
- 阿巴
- 转录组