摘要
背景
宿主转录组的控制是植物与病原体相互作用的关键战场。具体来说,植物已经进化出复杂的防御系统,在应对病原体攻击时诱导深刻的转录变化,而病原体已经进化出破坏或破坏这些防御的机制。一些NAC转录因子如ATAF2与植物的防御反应有关,包括那些针对病毒的防御反应。复制蛋白烟草花叶病毒(TMV)已被证明与ATAF2的降解相互作用并靶向ATAF2。这些发现表明ATAF2的转录靶点参与了对TMV的防御。
结果
为了检测潜在的ATAF2转录靶点,利用基因组下拉试验鉴定ATAF2启动子结合序列。随后的迁移转移和DNA足迹分析鉴定了一个30 bp的ATAF2结合序列。一个在活的有机体内GUS报告系统证实了鉴定的30bp结合序列作为ATAF2特异性转录激活因子的功能在足底。纯化ATAF2蛋白的凝胶过滤研究和30bp结合序列的诱变研究表明,ATAF2是一个二聚体。通过对相互作用启动子序列的计算分析,确定了一个具有重复[GC]AAA基序的25 bp a / t丰富的一致性序列。在ATAF2诱导后,实时qRT-PCR研究证实了启动子包含这一共识序列的选择基因转录本的积累。
结论
我们报告a独联体- ATAF2的调控结合序列。与其他已知的NAC蛋白结合序列不同,富含A/ t的ATAF2结合基序代表了一种新的NAC家族蛋白结合序列。这些信息的结合为ATAF2靶基因的鉴定提供了一种独特的工具。
背景
植物已经进化出复杂的传感系统,利用多种成分将对病原体的感知转化为防御反应的诱导。特别是,在防御相关转录因子(如ERF、NAC、WRKY和bZip)的指导下,基因表达的改变代表了病原体攻击期间发生的重要宿主反应[1- - - - - -3.]。相比之下,重编程基因表达是病原体用来破坏宿主防御和增强其建立感染能力的重要策略。为了对抗这些防御的诱导,病原体已经进化出一种机制,通过有针对性地破坏与防御相关的tf或通过产生自己的因子来控制转录,从而覆盖宿主的转录反应[4,5]。因此,鉴定病原体靶向tf及其控制的调控网络对于全面了解植物防御反应至关重要。
在此之前,我们报道了拟南芥TF ATAF2 (At5g08790)在a的诱导下被诱导烟草花叶病毒(TMV)感染,TMV随后通过与病毒126 kDa复制蛋白的相互作用靶向ATAF2降解[6]。ATAF2是NAC (N点,一个TAF1/2,CUC2)家族植物特异性TFs,是对组织损伤和病原体感染的诱导[6,7]。我们还观察到ATAF2的过表达导致水杨酸(SA)介导的防御相关标记基因的诱导PR1和PR2相反,这些基因在ATAF2敲除或抑制系中转录水平降低[6]。此外,ATAF2过表达抑制了TMV在接种组织中的积累。这些发现表明ATAF2在宿主基础防御反应的调节中起作用,TMV将ATAF2作为破坏这些防御途径的一种手段。
NAC结构域TFs(如ATAF2)组成了一个庞大的植物特异性蛋白家族,在拟南芥中有~105个NAC基因,在水稻中有~ 75个NAC基因。8]。该家族的所有成员都包含一个高度保守的n端NAC结构域和一个发散的c端转录激活区(TAR)。NAC基因已被广泛报道参与植物形态发生/器官发育、衰老和非生物/生物胁迫[9- - - - - -13]。此外,据报道,几种NAC蛋白与病毒蛋白相互作用。这些包括含有GRAB蛋白的NAC与双病毒RepA蛋白之间的相互作用[14]和拟南芥TIP蛋白萝卜皱病毒衣壳蛋白[15]。这些相互作用涉及到病毒复制的调节和宿主防御反应的诱导。综上所述,NAC结构域蛋白是控制病毒生物学中重要分子通路的关键TFs。
为了进一步了解ATAF2在病毒生物学中的作用,我们利用基因组下拉试验从拟南芥基因组中鉴定潜在的ATAF2靶序列。对ATAF2结合的DNA序列进行分析,鉴定出一个25bp的ATAF2特异性一致结合序列。该结合序列足以促进ATAF2介导的基因转录,与先前报道的NAC蛋白结合域相比是独一无二的[16,17]。
结果
ATAF2结合序列的鉴定
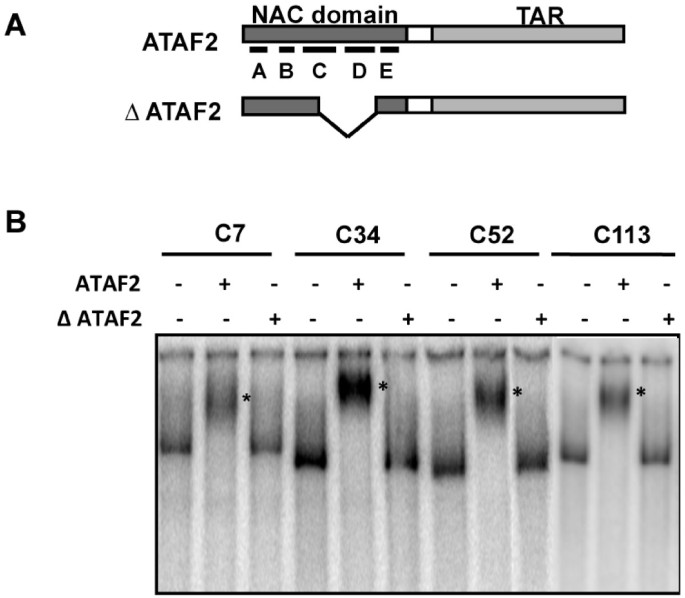
利用纯化的六组氨酸标记ATAF2和分离的基因组DNA,通过免疫下拉试验鉴定ATAF2结合序列拟南芥生态型Shahdara。此外,六组氨酸标记的ATAF2缺失构建物ΔATAF2缺乏假定的DNA结合亚结构域C和D,核苷酸172 - 377,作为阴性对照(图2)1A).在本实验中,将六组氨酸标记的ATAF2或ΔATAF2蛋白混合EcoR我和Taq我切割Shahdara基因组DNA,用抗polyhis抗体沉淀[18]。ATAF2和ΔATAF2结合的DNA片段随后被pcr扩增并克隆到质粒载体中。ATAF2结合复合物得到的DNA克隆数(约600个克隆)比ΔATAF2结合复合物得到的DNA克隆数(12个克隆)高出50倍,这反映了假定的DNA结合区域的缺失。在随机选择的97个ATAF2克隆中,有47个位于已知或预测的基因组翻译起始位点的上游3000个碱基对(bp)范围内1)。
为了证实ATAF2与免疫沉淀的基因组DNA片段结合,我们选择了四个具有代表性的克隆,覆盖了At1g08540、At1g68907、At3g26540和At1g01210翻译起始位点1000 bp以内的序列,使用纯化的重组六组氨酸标记ATAF2进行了电泳迁移量转移试验(EMSA)。我们推测,接近翻译起始位点将提高这些序列在ataf2介导的基因调控中发挥作用的可能性。采用PCR扩增和P32end-labeled。所有被测试的克隆在纯化的ATAF2蛋白存在的情况下都产生了迁移率的变化,而在纯化的ΔATAF2蛋白存在的情况下则没有(图2)1B)。
一个30bp的ATAF2结合序列的鉴定
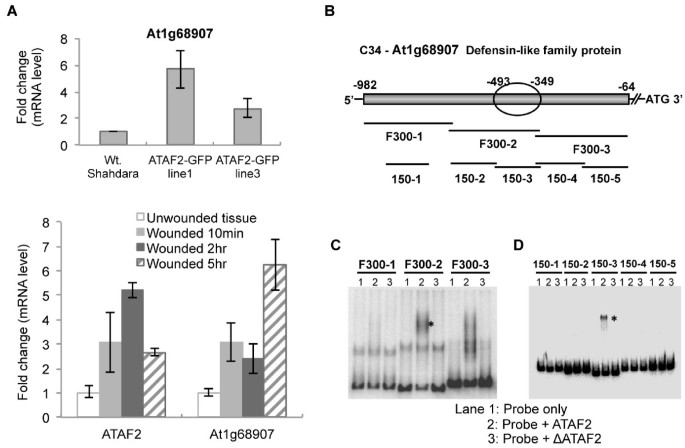
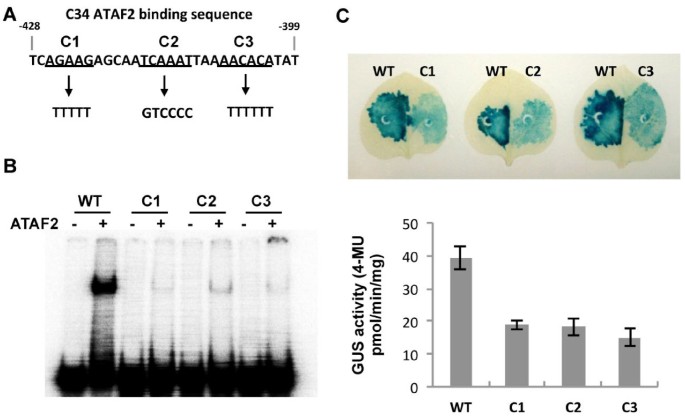
一个在ATAF2存在下表现出强烈迁移的克隆,命名为C34,被选中进行进一步的研究,旨在鉴定ATAF2靶向的特定DNA序列。C34 DNA克隆位于拟南芥防御素样蛋白At1g68907编码区的上游(−64 ~−982 nt)。为了确定防御素样基因受ATAF2调控的可能性,从而确定其为进一步分析的良好候选基因,我们检测了其在两个独立的拟南芥生态型Shahdara ATAF2过表达系中的表达水平以及对组织损伤的反应(图2)2) (6]。定量RT-PCR分析显示,At1g68907在2个ATAF2过表达系以及同样诱导ATAF2表达的伤叶组织中被平均4倍的转录诱导(图2)2A).因此,At1g68907的转录诱导与ATAF2的表达相对应,无论是通过转基因过表达还是内源基因的创伤诱导,这与ATAF2在该基因的调控中所起的作用一致。
为了缩小ATAF2结合序列,将C34片段细分为三个片段,并通过EMSA检测每个片段是否与ATAF2结合(图2)2B)。第二个300-bp片段F300-2显示出明显的结合活性,第三个片段F300-3的结合活性相对较弱,第一个片段F300-1没有结合活性(图3)2C).没有一个片段绑定到ΔATAF2(图2)2C).片段F300-2和F300-3进一步细分为4个~ 150bp的片段。F300-1的150 bp片段150-1作为阴性对照,该片段不显示ATAF2结合活性。结果表明,覆盖原918 bp C34克隆nt - 493至- 349的150-3片段负责观察到的ATAF2结合(图2)2D)。
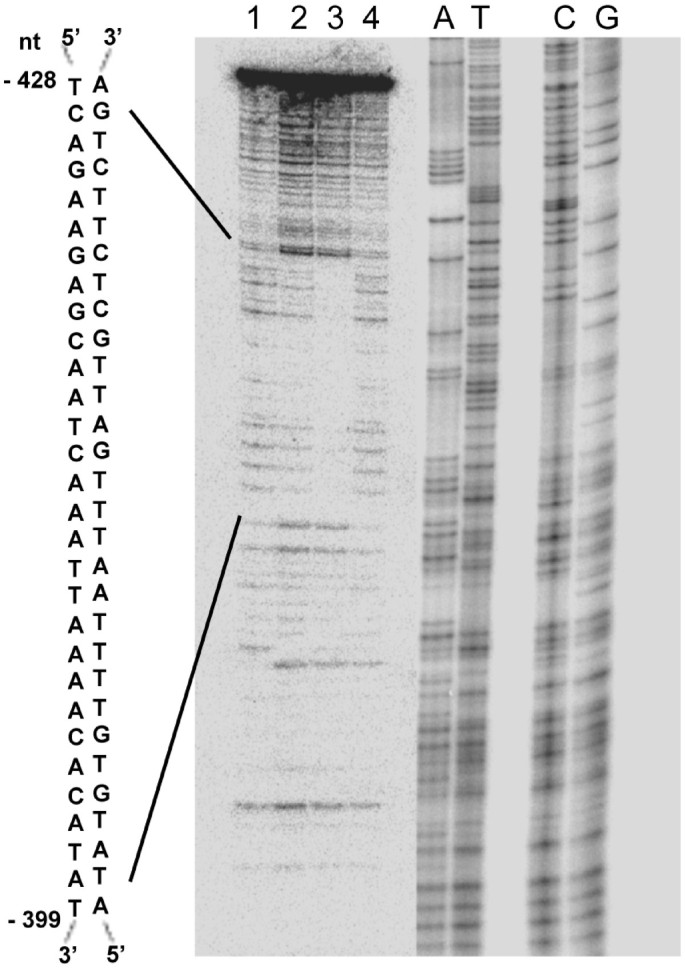
DNase I足迹用于鉴定受ATAF2结合保护的相互作用150-3 C34片段的特定区域。结果表明,只有一个区域受到DNase I酶切的保护(图2)3.)。序列分析表明该区域为30 bp序列(nt - 428, tcagaagcaatcaaattaaaacacatat, nt - 399)。这个受保护的区域可能代表ATAF2独联体监管元素。
ATAF2 30bp结合序列在转录激活中起作用
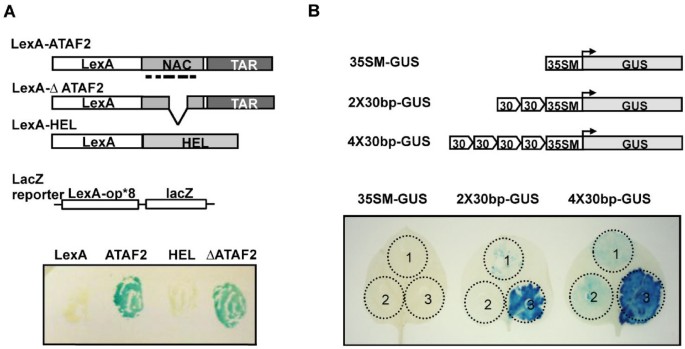
以确定所识别的30bp片段是否足以促进在活的有机体内通过ATAF2的转录激活,我们首先使用酵母lacZ报告系统来确定ATAF2和ΔATAF2构建体(两者都包含假定的转录激活区域)在融合到LexA dna结合域时是否可以在酵母中作为转录激活剂发挥作用(图2)4A).结果表明,当ATAF2和ΔATAF2蛋白融合到LexA DNA结合域时,ATAF2和ΔATAF2蛋白都在LexA DNA的转录激活中起作用LacZ打开阅读框(图14A).因此,给定DNA特异性结合域的存在,两种ATAF2结构体都可以作为转录激活剂起作用。
要确认在足底鉴定出的30-bp的功能独联体在ataf2介导的基因表达中,含有两个(2X)或四个(4X)串联重复序列的30 bp序列的报告构建物在最小35S CaMV启动子的上游(- 49 nt)工程化,并研究了驱动β-葡萄糖醛酸酶(GUS)转录的能力(图2)4B).得到的GUS报告基因构建物被农渗透到玉米叶片中烟草benthamiana结合35S ATAF2农业表达构建物,ΔATAF2或空盒式载体。结果显示,与2倍或4倍重复构建体和空盒载体共浸润的植物组织中GUS活性很小(图2)4然而,当ATAF2表达载体与2X或4X重复结构共浸润时,GUS活性显著增加(图2)4B).相比之下,35S最小启动子构建与ATAF2表达载体共表达时,GUS活性很小。此外,2X或4X重复构建体与ΔATAF2构建体的共表达,缺乏假定的ATAF2 DNA结合域,也未能诱导显著的GUS活性(图2)4B).综合这些结果表明,ATAF2可以利用鉴定的30 bp的调节结合元件在活的有机体内转录激活。
TMV感染增加GUS活性,由30bp ATAF2结合元件驱动
先前,我们证明了ATAF2在TMV接种的叶组织中的转录诱导作用[6]。为了确定鉴定的30-bp结合序列是否对感染过程中内源性产生的ATAF2起作用,在4 dpi时用2X或4X GUS报告基因构建物浸润TMV接种的拟南芥叶片组织。GUS活性在农业入渗后2 d进行定量测定。在农业浸润的模拟接种组织中,ATAF2 mRNA水平和GUS活性均增加,表明仅农业浸润就足以诱导ATAF2(图2)5A)。然而,在TMV感染的组织中,含有30 bp调控序列的2X和4X构建体都比模拟接种组织或35S最小启动子构建体浸润的组织中观察到的GUS活性显著增加(在不同处理中平均增加2倍)5C)。这一结果与TMV感染叶片中检测到的较高水平的ATAF2 mRNA相对应(图2)5这些发现与TMV感染诱导ATAF2一致,表明30bp结合元件是内源性表达ATAF2的功能靶标。
TMV感染增强了由ATAF2结合序列驱动的GUS活性。(一个实时qRT-PCR分析显示,在农业浸润和tmv接种组织中,ATAF2的表达在6 dpi时增加。0.1和0.5为接种用病毒的mg/ml。从三个独立的试验植物中提取RNA。数据为三次qRT-PCR反应的平均值±标准差。(B) TMV外壳蛋白特异性Western-blot显示三个独立的TMV接种组织样本中的病毒积累水平。(C)在tmv接种组织中观察到GUS活性增强。在4 dpi时,用35S最小启动子(35SM-GUS)、2X30bp-GUS或4X30bp-GUS报告基因构建物对感染tmv的拟南芥植株进行农业浸润。在6 dpi时,收集3个独立叶片的组织孔,用荧光法检测GUS活性。数据为平均值±标准差。
ATAF2结合元件的突变分析
为了分析鉴定出的ATAF2结合元件,我们在30bp的结合序列中创建了3个取代5 - 6个核苷酸的替换,并对这两个替换进行了测试在体外和在活的有机体内(图6A).设计替换来改变结合元件的片段,以确定是否任何特定区域在ATAF2结合中发挥更大的作用。第一个突变覆盖nts 3-7,将AGAAG替换为TTTTT(称为C1)。第二个突变体覆盖nts 13-18,将TCAAAT替换为GTCCCC(指定为C2)。第三个突变体覆盖nts 22-27,将AACACA转换为TTTTTT(指定为C3)。EMSA结果显示,这三种取代都显示ATAF2结合的显著减少>85%,这表明ATAF2结合需要整个序列(图2)6B)。
携带C1、C2和C3的ATAF2结合元件也被引入到农杆菌2X-GUS报告基因构建中,并在与ATAF2共表达时检测GUS活性n benthamiana叶子。在这些实验中,与未修饰的结合元件2X-GUS结构相比,所有三种替代都显示GUS活性水平降低了>50%(图2)6C).这一发现与EMSA分析一致,表明整个结合元件需要充分发挥活性。
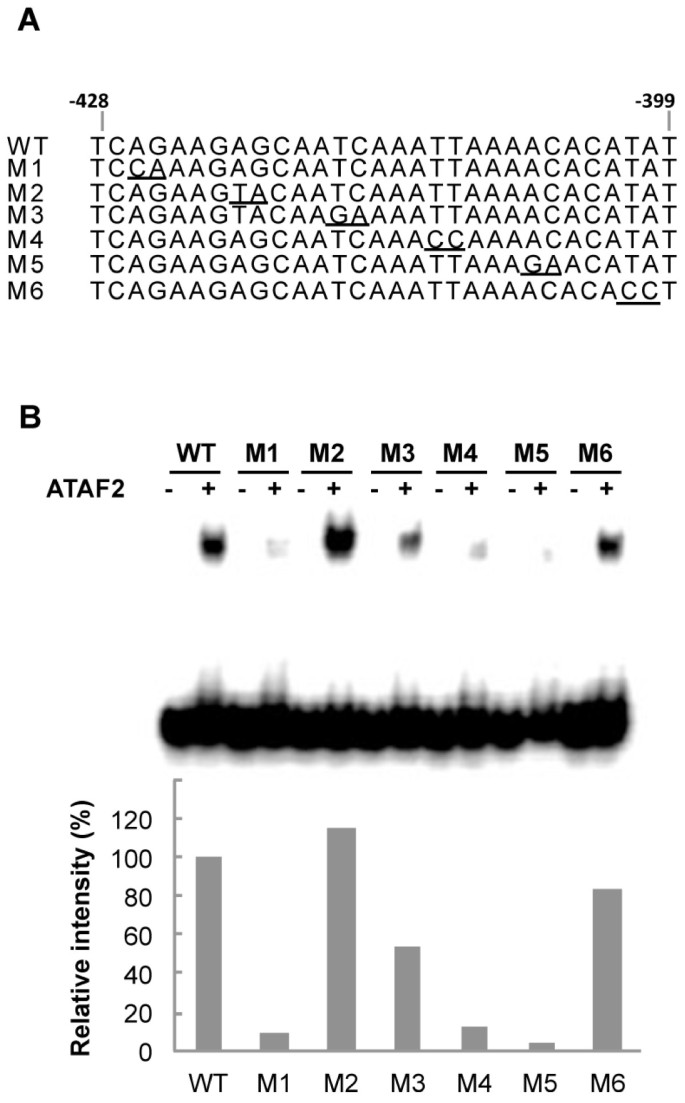
为了进一步研究ATAF2结合序列,在鉴定的30 bp DNA片段中创建了一系列6个双碱基替换,并测试了它们对ATAF2结合的影响(图2)7A)。凝胶移位实验显示,突变M1(在nt位置3和4从AG碱基替换为CA)、M4(在nt位置18和19从TT碱基替换为CC)和M5(在nt位置23和24从AC碱基替换为GA)分别显著降低了91%、87%和96%的ATAF2结合活性(图5)7突变M3(从nt位置13和14的TC到GA)显示了47%的部分减少(图2)7B)。另外两个突变M2和M6并没有显著降低ATAF2与鉴定的30bp元件的结合(图2)7B).这些发现进一步表明,几乎覆盖整个30 bp结合域的序列有助于ATAF2的结合。
ATAF2 NAC结构域的二聚化
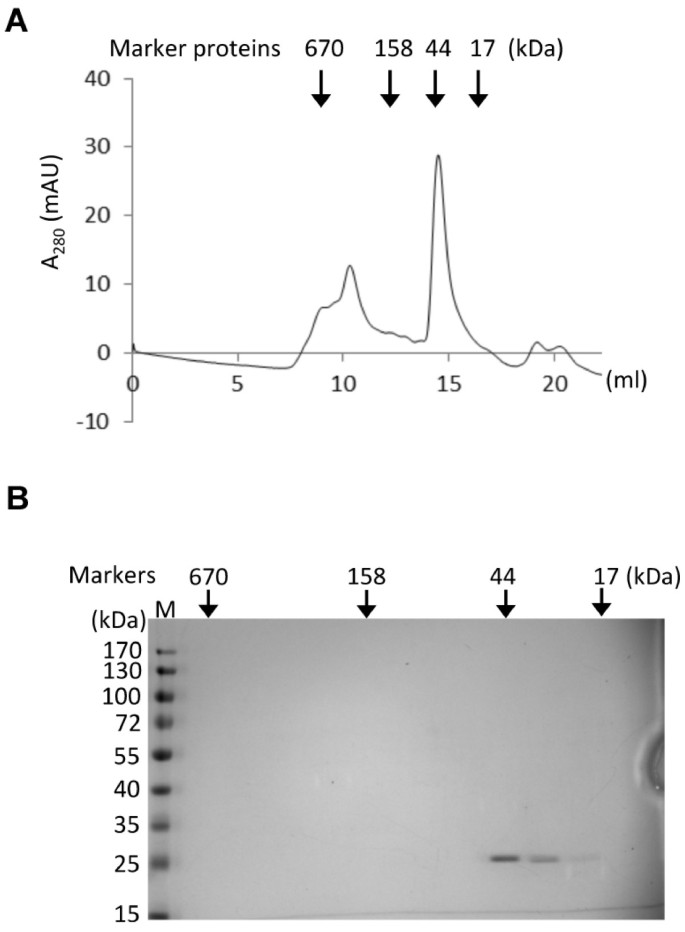
在证明了ATAF2的最佳结合几乎需要整个30 bp的序列后,我们推测ATAF2可能作为二聚体或多聚体发挥作用,类似于其他已报道的NAC结构域蛋白[19,20.]。为了表征ATAF2的四级结构,我们从细菌中表达了ATAF2的dna结合结构域(NAC结构域),并用大小排斥层析法对纯化蛋白进行了检测。结果表明,纯化后的ATAF2 NAC结构域肽洗脱为约44 kDa的蛋白质,是单体NAC结构域(22.8 kDa)的两倍(图2)8A & B),表明ATAF2的DNA结合域形成二聚体。
ataf2介导的下拉序列调控
为了研究ATAF2改变拉下实验中鉴定的基因转录的能力,我们选择了9个基因,并通过实时qRT-PCR检测了ATAF2敲除(KO)株系(SALK_136355)和野生型损伤叶片组织中ATAF2基因的表达。用损伤法诱导5小时后收获的组织内源性ATAF2表达[6,7]。根据ATAF2结合序列在翻译起始密码子1000 bp内的位置选择基因。另外,将克隆C34对应的防御素样蛋白At1g68907作为对照组。与我们之前的结果一致,At1g68907转录本显示ATAF2 KO系损伤组织中的积累减少(表1)2)。此外,研究的8个额外转录本中有7个显示ATAF2 KO系受伤组织内的积累至少减少了两倍(表1)2)。这些发现表明,启动子序列被ATAF2拉低的基因中有很大一部分直接受到其存在的影响,因此可能携带有功能的ATAF2结合序列。
ATAF2一致结合序列的鉴定
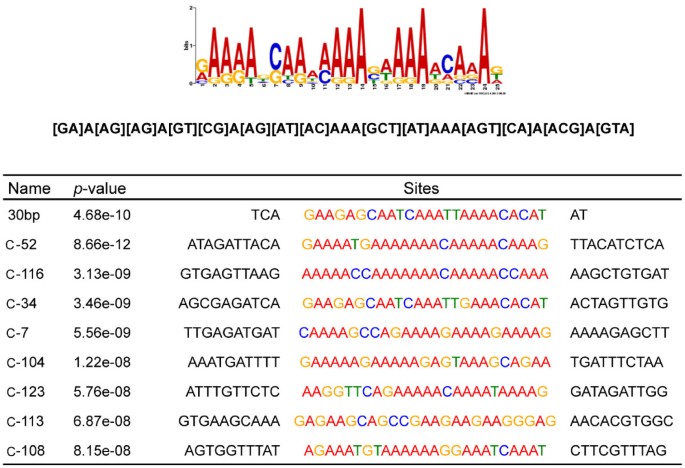
为了扩展ATAF2结合序列的特征,选择在翻译起始位点1000 bp以内的下拉序列,并通过EMSA显示ATAF2结合和/或在ATAF2 KO植物中显示改变的转录物积累,使用MEME程序进行基序分析[21,22]。这个选择标准产生了8个不同的下拉克隆,有次要证据支持ATAF2结合。对这些下拉序列的MEME分析显示,一致的25 nt序列与上述从原始C34克隆中鉴定出的30 bp序列相对应(图2)9)。共识序列主要是A/T丰富,但也包含正向或反向重复的[CG]AAA基序。随后,我们将分析范围扩大到21个通过下拉试验鉴定的原始克隆,这些克隆位于已知或预测的翻译起始位点1000 bp以内的上游。对这些基因的模因分析也在每个额外的克隆中发现了类似的a /T丰富序列(表1)1)。
讨论
基础抗性反应的诱导可以显著影响病毒的积累和传播,甚至在易感宿主内也是如此[23]。因此,旨在增强基础抗性的方法可以为创造新的抗病形式提供新的途径。许多研究表明,SA介导了几种有助于宿主基础防御的抗病毒途径[23,24]。Lee等人最近的研究,[25表明,在TMV感染过程中,sa介导的信号控制抗性机制涉及替代性氧化酶途径、RDR1介导的RNA沉默系统和其他尚未表征的防御机制。这些发现表明,抗病毒防御需要多个宿主过程的调节。随后,病毒可能会编码多种对抗措施,旨在克服这些防御。TMV对ATAF2的靶向降解表明,这种TF调节了影响感染周期的宿主过程。这一可能性得到了研究的支持,研究表明ATAF2过表达会诱导防御相关基因,增强植物对TMV的抗性[6]。相比之下,T-DNA敲除或转录抑制植物系在这些防御相关基因的激活上显着减少。特别是,SA相关的防御基因包括PR1和PR2在没有ATAF2的情况下,通过敲除、转录抑制或TMV定向降解,转录激活减少[6]。这些发现表明,ATAF2可以增强宿主的基础防御过程,其靶向降解代表了一种潜在的tmv导向的反防御机制。
为了更好地了解ATAF2调节宿主基因表达的能力,我们试图表征ATAF2在细胞过程转录调节中的功能。NAC蛋白高度分化的c端TAR区域被认为赋予特定细胞功能的转录激活,包括发育和防御信号通路[19,26,27]。在酵母中,ATAF2的c端TAR区可诱导lacZ基因表达(图2)4A),证实ATAF2作为转录激活因子的作用。随后,六组氨酸标记的ATAF2蛋白很容易发挥作用,拉下来自不同基因启动子区域的拟南芥基因组DNA。随后,一个位于防御蛋白样蛋白At1G68907翻译起始位点1000 bp内的代表性序列被用来鉴定一个30 bp的序列,该序列具有防御蛋白样蛋白的功能独联体- ATAF2的调控结合序列。最明显的是共表达在足底与ATAF2一起,这个30 bp的序列指导GUS报告结构的表达(图2)4B).该30 bp序列也定向在足底GUS在TMV感染后的表达(图1)5)。因此,诱导内源性ATAF2对感染的反应足以驱动已鉴定的ATAF2结合序列的基因表达。组织损伤也可诱导ATAF2的转录[6,7]。随后对9个原始ATAF2下拉克隆的转录水平分析表明,与野生型植物系的受伤组织相比,ATAF2 KO系受伤组织中的8个转录水平至少降低了2倍(表1)2)。在没有ATAF2的情况下,这些基因的转录激活降低,表明ATAF2参与了这些基因的转录调控,进一步证实了在这些基因启动子中鉴定的ATAF2结合序列的重要性。
在原始ATAF2下拉试验中鉴定的基因的伤口诱导激活表明,这些基因含有ATAF2特异性结合序列。使用鉴定出的30bp结合序列和启动子序列进行Motif分析搜索,发现在诱导ATAF2或直接结合ATAF2时调节基因表达,结果显示在所有分析的下拉序列中都存在25bp的一致序列(表1)1)。所鉴定的25bp序列A/T丰富,包含[CG]AAA基序的连续或反向重复。先前的研究已经确定了几个NAC家族的DNA结合元件。在一项研究中,在体外采用选择方法鉴定了两种功能不同的NAC蛋白的DNA结合位点:与应激有关的ANAC019和与形态发生有关的ANAC092 [16]。鉴定了CGT[GA]的一个核心结合元件。该序列是从三个NAC蛋白(ANAC019、ANAC055和ANAC072)中鉴定出的核心结合序列的反向补充,该序列识别了一个含有CACG作为核心DNA结合位点的63 bp序列[28]。综上所述,不同的NAC蛋白可以结合相似的序列。然而,其他NAC蛋白似乎结合不同的序列。例如,NAC1结合到一个21-bp的DNA片段,其中包含一个1元件(TGACG) [19]。在小麦中,NAC蛋白结合一致序列鉴定为[AG]G[AT]NNCGT[AG]NNNNN[CT]ACGT[AC] a [CT][CT] [29]。这些先前鉴定的NAC结合序列,包括其核心结合基序,并不存在于鉴定的ATAF2结合序列中,这表明ATAF2识别的结合序列不同于其他NAC蛋白使用的结合序列。ATAF2结合域的A/T丰富性质确实与其他植物转录结合域有相似之处。例如,豌豆质体氧化蛋白基因启动子的调控区域同样富含A/T,并被含有高迁移率组盒结构域的蛋白质识别,这些结构域可能调节基因表达[30.]。这种序列识别的多样性反映了NAC蛋白的大家族以及该TF家族的广泛功能。
诱变研究表明,DNA核酸酶保护片段的30bp长度及其几乎完全的活性要求(图2)6,7)建议ATAF2作为多定时器。这与先前的研究一致,表明几种NAC蛋白以二聚体的形式形成和起作用[19,20.]。此外,ANAC019的晶体学数据揭示了α-螺旋两侧的反平行β片,具有明确的二聚体界面,可促进homo-和hetero-相互作用,并具有被认为可促进DNA结合的正电荷面[1,31]。为了确认ATAF2的低聚状态,纯化后的ATAF2 NAC结构域通过尺寸排斥色谱进行检测,观察到一个峰代表NAC结构域的二聚体形式(图2)8)。细菌纯化ATAF2 NAC结构域的寡聚化表明ATAF2可能具有二聚体的功能。功能性ATAF2低聚物是与另一种NAC蛋白形成的同二聚体还是异二聚体尚不清楚,但可以明确的是,ATAF2在损伤或应激反应中的诱导是编码鉴定结合序列的基因启动子转录激活所必需的。
ATAF2在基础防御中的作用尚未明确。然而,有趣的是,本研究中发现的几个ATAF2靶基因与防御反应有关。例如,多胺氧化酶3蛋白(PAO3)在ATAF2 KO组织中表现出显著的转录减少,表明它受到ATAF2的正向调节(表2)2)。此外,已知多胺在应对包括病原体攻击在内的许多环境压力时积累[32]。PAO3在过氧化物酶体内起作用,催化积累的多胺并产生H2O2(33]。Uehara等。[34]提议生产H2O2多胺的催化作用是作为信号换能器激活防御反应。另一个例子是氧化应激3蛋白(OXS3),它也受到ATAF2的正向调节。OXS3对镉的抗性是必需的,它与核小体组蛋白H4共定位于细胞核,它被认为是一种重塑因子,移动核小体的位置并改变基因表达[35]。有趣的是,镉处理与植物对TMV的抗性有关,并与间连丝和维管组织内胼胝质的沉积有关[36,37]。Ueki和Citovsky [38鉴定出镉诱发的G甜菜碱-R我P定位于血管细胞壁并促进胼胝质沉积的蛋白质(cdiGRP)。cdiGRP的过表达增强了TMV耐药性,而其敲低导致病毒传播增加。在上述两个例子中,ATAF2定向调控PAO3和OXS3可以通过H的产生增强病毒的抗性2O2和诱导cdiGRP。这种防御反应表明TMV对ATAF2的靶向降解是一种防御对抗。然而,确认ATAF2在调节这些抗性途径中的作用及其在介导对TMV的防御中的作用需要进一步的研究。
结论
我们在此报道了ATAF2结合序列的鉴定及其在损伤和TMV感染的基因调控中的功能。该结合序列的鉴定是鉴定与ATAF2表达相关的基础防御过程以及了解针对这些过程的TMV反防御的重要一步。
方法
植物材料、农业渗透、伤害和病毒接种
植株在23℃下生长,光照周期为10小时/黑暗周期为14小时。如前所述[39]。总之,根癌土壤杆菌携带所需表达构建体的菌株GV3101在30℃下培养过夜。培养物离心浓缩,在10 mM MES, pH 5.7, 10 mM MgCl的浸润培养基中重悬2, 150 μM乙酰丁香酮)至OD600叶片入渗前的0.5。农业渗透后48小时,植物组织处理如下所述。在伤害处理中,用刀片在中脉上多次伤害四周龄植物的完全成熟叶片。受伤五小时后,叶子被收集起来进行分析。接种病毒时,将0.1 ~ 0.5 mg/ml的TMV溶液摩擦接种于碳粉叶片上。
质粒构建及蛋白表达
ATAF2的全长编码序列(AT5g08790)及其只包含NAC结构域的截断版本(ATAF2-165, 1 aa ~ 165 aa)分别被pcr扩增为包含5 'Xho1和3 'Kpn我的网站。将扩增的片段连接到表达载体pTrcHisA (Life Technologies, Grand island, NY)中,生成带有n端六组氨酸标签的pTrcHisA/ATAF2和pTrcHisA/ATAF2-165。通过pcr扩增覆盖核苷酸1至171的ATAF2片段,得到ΔATAF2缺失结构。Xho1和3 '太平洋标准时间I位和核苷酸376到852带5 'Nsi1和3 'Kpn我的网站。这两块碎片被绑在一起Xho我和Kpn我切割pTrcHisA矢量,生成pTrcHisA/ΔATAF2。重组his标记ATAF2和ΔATAF2蛋白的纯化如前所述[39]。简单地说,大肠杆菌BL21(+)细胞37℃培养至OD600在16°C下用1mm异丙基-1-硫-β-d-半乳糖苷诱导pTrcHisA。收集细菌细胞,在含有10 mM Tris、pH 8.0、10%甘油(v/v)、500 mM NaCl和10 mM咪唑的裂解缓冲液中重悬。超声和离心(17000 g,离心10分钟)后,细胞提取物与1 ml(床体积)Ni-NTA亲和柱(GE Healthcare, Piscataway, NJ)在4°C下孵育1 - 2小时。然后用10柱体积的洗涤缓冲液(裂解缓冲液加10 mM咪唑)洗涤。蛋白在缓冲液中洗脱(裂解缓冲液加140 mM咪唑)。洗脱蛋白用SDS-PAGE分析,Bradford法测定蛋白浓度[40]。
对于GUS报告基因构建,将−49 CaMV 35S最小启动子和30 bp ATAF2结合序列串联重复序列依次导入β-葡萄糖醛酸酶(GUS)编码序列上游的pBI101载体(Clonetech, Palo Alto, CA)。综上所述,两个引物(5”TCGACCGCAAGACCCTTCCTCTATATAAGGAAGTTCATTTCATTTGGAGAGGA克−3.”和5”GATCCTCCTCTCCAAATGAAATGAACTTCCTTATATAGAGGAAGGGTCTTGCGG3”)覆盖CaMV 35S启动子的−49至+1区域萨尔我和BamHI个位点(下划线)插入pBI101生成pBI/35SM-GUS。引物携带两个拷贝30bp的ATAF2结合序列和aXba限制性酶切位点(5)”AGCTTGTCTAGAGATCAGAAGAGCAATCAAATTAAAACACATATTAGGATCAGAAGAGCAATCAAATTAAAACACATATTAG克−3.”和5”TCGACCTAATATGTGTTTTAATTTGATTGCTCTTCTGATCCTAATATGTGTTTTAATTTGATTGCTCTTCTGATCTCTAGAC一个−3.”),然后导入pBI/35Sm-GUS后三世和萨尔I个站点(下划线)创建pBI/2X30bp-GUS。同样地,再复制两个30bp序列(5”AGCTTGATCAGAAGAGCAATCAAATTAAAACACATATTAGGATCAGAAGAGCAATCAAATTAAAACACATATTAGT−3.”和5”CTAGACTAATATGTGTTTTAATTTGATTGCTCTTCTGATCCTAATATGTGTTTTAATTTGATTGCTCTTCTGATC一个−3.”)都被引入了后三世和Xba1个pBI/2X30bp-GUS位点生成pBI/4X30bp-GUS。三个GUS报告基因构建体均转化为根癌土壤杆菌应变GV3101 [41]。
粒径排除色谱法
纯化的ATAF2 NAC结构域(ATAF2-165)在含有25 mM Tris-HCl pH 7.5、10%甘油(v/v)、500 mM NaCl和0.5 mM EDTA的缓冲液中室温孵育20分钟。然后将孵育蛋白(~ 160 μg)通过Superdex-200 HR 10/30色谱柱(GE Healthcare, Piscataway, NJ),用孵育缓冲液预平衡。各提取250 μl,每提取50 μl, SDS-PAGE分析,考马斯蓝染色。
基因组下拉试验
采用标准的CTAB基因组DNA分离方法从4周龄拟南芥生态型Shahdara叶片组织中提取植物基因组DNA [42]。植物组织在含有2%十六烷基三甲基溴化铵、100 mM Tris、pH 8.0、20 mM EDTA、1.4 M NaCl和0.2% β-巯基乙醇的CTAB缓冲液中研磨。55℃孵卵1小时后,将CTAB/植物提取物混合物离心12000 g,离心10分钟。收集上清,用苯酚/氯仿提取基因组DNA,乙醇沉淀。
ATAF2的靶序列是使用先前描述的基因组下拉试验确定的[18]。简单地说,拟南芥基因组DNA是用EcoR我和TaqI和连接到两个具有相应限制性位点的短连接子序列[18]。然后用重组his标记的ATAF2孵育DNA片段,然后用抗polyhis抗体和蛋白A琼脂糖(Life Technologies, Grand island, NY, Carlsbad, CA)沉淀。用苯酚/氯仿去除结合蛋白后,将DNA片段进行PCR扩增,并使用TOPO TA克隆试剂盒(Life Technologies, Grand island, NY)克隆到pCRII中。
电泳迁移率转移测定(emsa)
双链DNA探针可以通过pcr扩增或将互补单链DNA一起退火制备。DNA探针在5 '端用[γ-]标记32P]ATP通过T4多核苷酸激酶(新英格兰生物实验室,伊普斯维奇,MA)。在EMSA检测中,每个凝胶纯化的标记DNA片段100至300 fmol与不同浓度的纯化ATAF2蛋白在10 μl反应中混合,其中含有20 mM Tris-HCl, pH 8.0, 60 mM KCl, 5 mM MgCl2100 μg/ml BSA, 5%甘油,1 mM DTT, 0.5 μg poly(dI-dC)。结合反应在25°C下孵育30分钟,然后加载到5% (w/v)的天然聚丙烯酰胺凝胶上。电泳在0.5倍TBE缓冲液中进行,在100 V下电泳2-3小时。凝胶在滤纸上真空干燥,通过磷酸化成像仪(Molecular Dynamics, Sunnyvale, CA)进行可视化。利用ImageJ分析工具在扫描凝胶上定量分析重组ATAF2的DNA结合亲和力。
DNase I足迹
5 '端标记的DNA探针片段装载在5%非变性聚丙烯酰胺凝胶上。凝胶电泳后,切除探针,在10 mM Tris-HCl, 1 mM EDTA, pH 8.0中扩散过夜后恢复。采用纯化的ATAF2蛋白(20 nM或200 nM)和10 fmol探针DNA进行上述DNA-蛋白结合反应。在25℃下孵育30 min,加入50 μl Ca/Mg溶液(5 mM CaCl)2和10毫米MgCl2)。1分钟后,加入3 μl RQ1 DNase,从1 mg/ml的原液中稀释至少1:100(经验测定)。用90 μl 20 mM EGTA酶切1 min后终止RQ1酶切。用苯酚:氯仿:异戊醇(25:24:1)提取反应,用乙醇沉淀DNA,进行变性尿素-聚丙烯酰胺凝胶电泳,然后用磷酸化成像仪(Molecular Dynamics, Sunnyvale, CA)进行可视化。
格斯化验
GUS在植物组织中的活性通过5-溴-4-氯-3-吲哚基-β- d -葡萄糖醛酸(X-Gluc)的组织化学染色可见,如前所述[6]。用于GUS活性的定量测量,一种改进的荧光法格斯采用测定法[43]。简单地说,植物组织在含有150 mM磷酸钠、pH 7.0、10 mM EDTA、10 mM β-巯基乙醇、0.1% Triton X-100、0.1%肌醇和140 μM PMSF的萃取缓冲液中研磨。在20000 g条件下制粒15分钟后,将荧光底物4-methyl- umbellliferyl -β-D-glucuronide (4-MUG)加入到上清液中至终浓度为1.0 mM。混合产物在37℃下黑暗孵育20分钟。每个反应取10 μl等分,与190 μl停止缓冲液(0.2 M Na)混合2有限公司3.)在黑壁清底96孔板中。GUS反应产生的荧光4- methylumbellliferone (MU)使用SpectraMax M2微孔板阅读器(MTX Lab systems, Vienna, VA)测定,激发波长为365 nm,发射波长为455 mm。每个平板都包含由6个MU标准得到的标准曲线。用Bradford法测定提取物中的蛋白质浓度[40]。最终GUS活性以pmol MU/min/mg蛋白表示。所有实验重复2次,并根据CaMV 35S最小启动子驱动的相对GUS活性进行归一化。
实时的存在
从3到5个单独的试验植物中提取叶片组织进行RNA提取。总RNA采用RNeasy RNA提取试剂盒(Qiagen, Valencia, CA)提取。用RQ1 DNase (Promega, Madison, WI)预处理总RNA 1 μg,用SuperScript进行首链cDNA合成反应TMII逆转录酶(生命技术,格兰德岛,纽约州)。如前所述,使用SYBR绿色PCR混合物(Fermentas, Glen Burnie, MD)和ABI Prism 7100 (Applied Biosystems, Foster City, CA)进行实时qRT-PCR反应[6]。使用18s rRNA作为归一化的内部对照物,用于每个选定基因的引物序列列在附加文件中1表S1。
统计分析
使用motif search MEME程序对统计上代表性过高的motif进行识别[22]。选择30 bp的ataf2短结合序列以及从基因组下拉试验中鉴定出的每个候选靶基因进行分析。motif搜索选项定义为“每个序列出现一次”,motif宽度设置为25至30 bp之间。
缩写
- TFs:
-
转录因子
- 南京:
-
N点,一个TAF1/2,CUC2
- 山:
-
水杨酸
- 烟草花叶病毒:
-
烟草花叶病毒
- EMSA:
-
电泳迁移率转移试验
- KO线:
-
淘汰赛。
参考文献
- 1.
Olsen AN等:NAC转录因子:结构独特,功能多样。植物科学进展,2005,10(2):79-87。10.1016 / j.tplants.2004.12.010。
- 2.
王晓明,王晓明,王晓明,等。植物抗逆转录因子的研究进展。植物学报,2002,5(5):430-436。10.1016 / s1369 - 5266(02) 00289 - 3。
- 3.
[2]刘建平,王晓明,王晓明,等。植物基因对病原菌的转录调控。植物生态学报,1998,31(4):391 - 391。10.1016 / 1369 - 5266(88) 80052 - 9。
- 4.
Boch J, Bonas U:黄单胞菌AvrBs3家族ⅲ型效应因子的发现与功能。植物酚类植物学报,2010,48:419-436。10.1146 / annurev -发朵- 080508 - 081936。
- 5.
Endres MW等:两种植物病毒沉默抑制因子需要乙烯诱导的宿主转录因子RAV2来阻断RNA沉默。PLoS病原体。2010, 6 (1): e1000729-10.1371/journal.ppat.1000729。
- 6.
王晓明,郭高科,王晓明,等。烟草花叶病毒复制酶蛋白与NAC结构域转录因子的相互作用与系统防御的抑制有关。中国生物医学工程学报,2009,32(1):1 - 7。10.1128 / JVI.00941-09。
- 7.
Delessert C, et al .:转录因子ATAF2抑制拟南芥发病相关基因的表达。植物学报,2005,43(5):745-757。10.1111 / j.1365 - 313 x.2005.02488.x。
- 8.
Ooka H,等:Oryza sativa和Arabidopsis thaliana NAC家族基因的综合分析。生物医学工程学报,2003,26(6):559 - 564。10.1093 / dnares / 10.6.239。
- 9.
Aida M, et al .拟南芥器官分离相关基因:杯形子叶突变体的分析。植物细胞。1997, 9(6): 841-857。10.1105 / tpc.9.6.841。
- 10.
郭莹,甘珊:NAC家族转录因子AtNAP在叶片衰老中起重要作用。植物杂志:细胞和分子生物学。2006, 46(4): 601-612。10.1111 / j.1365 - 313 x.2006.02723.x。
- 11.
uway C,等:调节衰老的NAC基因可提高小麦籽粒蛋白质、锌和铁含量。科学通报,2006,31(5):1298-1301。10.1126 / science.1133649。
- 12.
colinge M, Boller T:马铃薯Stprx2和StNAC基因对疫霉侵染和伤害的差异诱导。植物化学学报,2001,26(5):521-529。10.1023 /: 1010639225091。
- 13.
Hegedus D,等。甘蓝型油菜NAC结构域转录激活因子在生物和非生物胁迫下的分子特征。植物生理学报,2003,31(3):383-397。
- 14.
谢强,等:通过与双病毒蛋白相互作用分离出NAC结构域家族的新成员GRAB蛋白。植物化学学报,1999,39(4):647-656。10.1023 /: 1006138221874。
- 15.
任涛,曲峰,Morris TJ: HRT基因功能需要NAC蛋白与病毒衣壳蛋白相互作用才能获得对萝卜皱病毒的抗性。植物学报,2000,12(10):1917-1926。
- 16.
Olsen AN,等:NAC转录因子的dna结合特异性和分子功能。植物科学,2005,32(4):785-797。10.1016 / j.plantsci.2005.05.035。
- 17.
Kim HS,等:拟南芥中钙调素结合NAC蛋白转录抑制因子的鉴定。生物化学学报,2007,32(5):369 - 369。10.1074 / jbc.M705217200。
- 18.
苗阳,等:拟南芥WRKY53转录因子的靶点及其在叶片衰老中的作用。植物化学学报,2004,25(6):853-867。
- 19.
谢强等:拟南芥NAC1在TIR1下游转导生长素信号,促进侧根发育。基因工程学报,2000,14(3):344 - 344。10.1101 / gad.852200。
- 20.
Olsen AN等:植物特异性NAC转录因子家族成员ANAC的NAC结构域的初步晶体学分析。晶体学报,2004,60(1):112-115。
- 21.
Bailey TL等:MEME SUITE: motif发现和搜索工具。核酸学报,2009,37 (Web Server issue): W202-W208。
- 22.
李建军,李建军。基于期望最大化的混合模型在生物聚合物中发现基序。分子生物学智能系统国际会议论文集/…ISMB。分子生物学智能系统国际会议。1994,2:28-36。
- 23.
王晓明,王晓明,王晓明,等。诱导抗性信号转导的研究进展。病毒研究进展。[j] .中国科学:地球科学,2010。
- 24.
Singh DP,等:水杨酸激活多种抗病毒防御机制。分子植物病理学。2004,5(1): 57-63。10.1111 / j.1364-3703.2004.00203.x。
- 25.
李卫生,等:本胺烟(Nicotiana benthamiana)替代呼吸基因改造对基础和水杨酸诱导的马铃薯病毒x抗性的影响。2011, 11: 41-10.1186/1471-2229-11-41。
- 26.
徐佩杰,等:冷激活质膜系链NAC转录因子诱导拟南芥病原菌抗性反应。植物杂志:细胞和分子生物学。2010, 61(4): 661-671。10.1111 / j.1365 - 313 x.2009.04091.x。
- 27.
Duval M等:拟南芥NAC结构域超家族成员AtNAM的分子表征。植物化学学报,2002,25(2):344 - 344。10.1023 /: 1016028530943。
- 28.
Tran LS,等:拟南芥胁迫诱导NAC转录因子的分离和功能分析,该转录因子与干旱响应顺式元件在脱水胁迫1启动子的早期响应中结合。植物细胞。2004,16(9): 2481-2498。10.1105 / tpc.104.022699。
- 29.
薛平平:一种快速测定新型植物dna结合蛋白dna结合序列特异性的celd融合方法。植物杂志:细胞和分子生物学。2005, 41(4): 638-649。10.1111 / j.1365 - 313 x.2004.02323.x。
- 30.
Webster CI等人:高迁移率组蛋白HMG-1和HMG-I/Y结合到豌豆质体青素基因启动子的正调控区域。植物杂志:细胞和分子生物学。中国生物医学工程学报,1997,11(4):703-715。10.1046 / j.1365 - 313 x.1997.11040703.x。
- 31.
Ernst HA等:转录因子NAC家族成员ANAC的保守结构域结构。中国生物医学工程学报,2004,5(3):297-303。
- 32.
王晓明,等。多胺在植物抗逆性研究中的应用。生物工程学报,2011,29(3):300-311。10.1016 / j.biotechadv.2011.01.003。
- 33.
Moschou PN等:弥合植物和哺乳动物多胺分解代谢之间的差距:一种新的过氧化物酶体多胺氧化酶,负责拟南芥的完整反向转化途径。植物生理学报,2008,37(4):559 - 557。10.1104 / pp.108.123802。
- 34.
Uehara Y,等:烟草ZFT1,一个具有Cys2/His2型锌指基序的转录抑制因子,在精胺信号通路中起作用。植物化学学报,2005,29(3):444 -448。10.1007 / s11103 - 005 - 0272 - 0。
- 35.
Blanvillain R, et et:氧化应激3是与重金属和氧化应激耐受有关的染色质相关因子。植物杂志:细胞和分子生物学。2009, 57(4): 654-665。10.1111 / j.1365 - 313 x.2008.03717.x。
- 36.
李春华,等。胞间连丝中胼胝质(β -1,3-葡聚糖)转化的生物学研究。生物医学工程学报,2011,32(1):393 - 393。10.1007 / s00709 - 010 - 0247 - 0。
- 37.
Ueki S, Citovsky V:一种镉离子诱导的富含甘氨酸的蛋白可以抑制烟叶病毒的全身运动。自然细胞生物学。2002, 4(7): 478-486。
- 38.
王晓明,王晓明,王晓明,等。镉离子诱导的富含甘氨酸蛋白在植物脉管系统钙质水平调控中的作用。中国科学院学报,2005,32(4):1289 - 1294。10.1073 / pnas.0505927102。
- 39.
王晓明,王晓明,王晓明。烟草花叶病毒解旋酶ATPase活性对复制酶复合体组装的调控。病毒学杂志,2010,32(2):292-302。10.1016 / j.virol.2010.03.019。
- 40.
一种利用蛋白质-染料结合原理快速、灵敏地定量测定蛋白质微克量的方法。生物化学学报,2006,32(2):559 - 564。10.1016 / 0003 - 2697(76) 90527 - 3。
- 41.
Holsters M,等:肿瘤农杆菌的转染和转化。中国生物医学工程学报,1997,26(2):391 - 391。10.1007 / BF00267408。
- 42.
Doyle JJ, Doyle JL:从新鲜组织中分离植物DNA。焦点。1990,12:13-15。
- 43.
Jefferson RA, Kavanagh TA, Bevan MW: GUS融合:β -葡糖醛酸酶在高等植物中的敏感和多功能基因融合标记。中华生物医学工程杂志,1997,6(3):391 - 397。
致谢
我们要感谢dr。郭荣和Anne Simon协助进行DNase I足迹分析。苗攀和Zvi Kelman在粒径排除色谱研究方面的帮助。这项工作得到了美国农业部国家研究计划竞争性资助(2008-35319-19168)和美国国家科学基金会(ISO-1120044)的部分资助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们没有竞争利益。
作者的贡献
XW和JNC构思、设计并撰写了手稿。XW完成了所有的实验。两位作者都阅读并批准了最终的手稿。
权利和权限
本文由BioMed Central Ltd.授权发表。这是一篇基于知识共享署名许可(http://creativecommons.org/licenses/by/2.0),允许在任何媒体上不受限制地使用、分发和复制,前提是正确引用原创作品。
关于本文
引用本文
王鑫,Culver, J.N.烟草花叶病毒NAC结构域转录因子ATAF2的DNA结合特异性。BMC Plant Biol12,157(2012)。https://doi.org/10.1186/1471-2229-12-157
收到了:
接受:
发表:
关键字
- 转录重新编程
- 南汽绑定
- 独联体管理序列