- 研究文章
- 开放访问
- 发布:
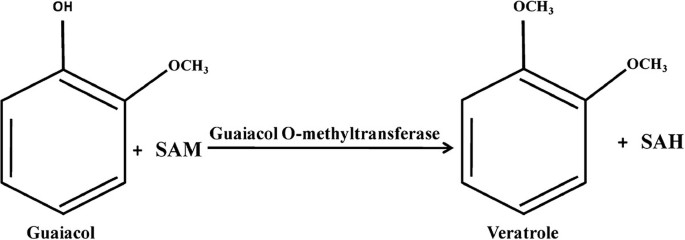
识别白菜(SILON LATIFOLIA.)愈创木酚O-甲基转移酶参与veratrole的生物合成,veratrole是吸引传粉者的关键挥发性物质
BMC植物生物学体积12., 文章编号:158(2012年)
摘要
背景
SILON LATIFOLIA.及其传渣器,夜区蛾Hadena Bicruris,代表一种开放的苗圃授粉系统,其中花挥发物,尤其是术治疗(1,2-二甲氧苯苯苯),丁香醛和苯乙酰甲醛对花卉信号具有重要意态。尽管花香在确保生殖成功方面存在重要作用S. Latifolia.目前尚不清楚该植物气味生物合成的分子基础。
结果
我们孤立两个全长CDNAS. Latifolia.表现出与玫瑰奥替尼洛尔的相似之处O- 甲基转移酶。生物化学分析表明S. Latifolia Guaiacol O-甲基转酯酶1(SlGOMT1)&S. Latifolia Guaiacol O-甲基转酯酶2(SlGOMT2)编码催化愈合Guaiacol的甲基化以形成术治疗的蛋白质。大K.米SLGOMT1(〜10μm)和SLGOMT2(〜501μm)之间的值差异导致SLGOMT1比SLGOMT2更催化有效31倍。QRT-PCR表达分析表明Slgomt.基因在花和男性中具体表达S. Latifolia.花高3- 4倍GOMT比雌花组织的基因转录本要多。两个相关的互补,S. Dioica O-甲基转移酶1(SDOMT1),S. Dioica O-甲基转移酶2(SDomt2.),也从姐妹种类获得硅二恶英但是,它们编码的蛋白质没有甲酸盐胍醇,一致于此物种花中缺乏术治术。我们的进化分析揭示了SlGOMT1和SlGOMT2然而,基因是在积极选择下进化的SDOMT1和SDomt2.基因没有显示出选择的证据。
结论
我们报道了该基因的鉴定和功能特征,SlGOMT1有效地催化Veratrole形成,而该基因的另一种副本只有一个氨基酸差异,SlGOMT2在S. Latifolia..
背景
白剪秋罗属植物,SILON LATIFOLIA.(蛛网曲霉),发出各种挥发物,以吸引鞘氨酸,地质肌瘤和授粉的Noctuid飞蛾[1- - - - - -4].该物种还展示了气味排放中明显的昼夜节律,主要化合物主要是在夜间发出的[4- - - - - -7].在这个物种常见的传粉者中,Hadena Bicruris,夜蛾,是一种专门的苗圃传粉者和专性的种子捕食者[8,9].女性H. Bicruris.不仅被蜜饯所吸引,而且还为卵体吸引到女性中S. Latifolia.花朵 [10.].幼虫培育种子[11.食用几乎四分之一生长的水果[12.,13.].可用的实验证据表明Hadena-Silene.关系可以在共同主义和对抗之间摆动[9].
最近,气味组成S. Latifolia.已经确定了相关物种,并研究了传粉者的行为活动[4,10.,14.].大量的挥发性化合物已在S. Latifolia.花卉气味花束[6,7,13.,15.]这些化合物包括三个主要类别:脂肪酸衍生物,芳烃和三萜类化合物[6,7].使用风洞生物测定,Dötterl等[13.[]研究了传粉昆虫与单个气味化合物的相互作用,发现只有7种(veratrole、癸醛、芳樟醇、愈橘醇、苯乙醛、异戊醛肟和丁香醛)在植物中产生化合物S. Latifolia.鲜花显示行为活动H. Bicruris..一项基于香味成分分析的进一步研究表明,授粉后veratrole和丁香醛的释放减少了4倍,而其他行为活性和非活性化合物没有变化[10.].因此,除了参与粉丝器吸引力之外,术治和丁香醛排放的减少可能会减缓产卵和随后的种子捕食哈特纳授粉后。苯基乙醛是最丰富的行为活性化合物之一,参与了花卉隔离S. Latifolia.从密切相关的物种美国dioica[6].这些研究表明,veratrole、丁香醛和苯乙醛是关键的气味化合物,在吸引传粉者和隔离花中起着核心作用[6,7,10.,14.].目前目前不清楚哪种化合物诱导产卵哈特纳女性进入女性S. Latifolia.花。H. Bicruris.很少oviposits进入美国dioica[11.].然而,在挥发性有机化合物(VOC)之间的定性差异美国dioica和S. Latifolia.只涉及少数化合物。Veratrole,愈创木酚,苯甲酸苄酯只在S. Latifolia.但是一种脂肪酸衍生物,壬醛只能通过美国dioica[6].因此,除了定量的气味差异[6,会产生三种化合物S. Latifolia.涉及物种分化,并且可能是维持Hadena-Silene latifolia关系。
在过去的二十年中,分子研究silene.主要专注于性别决定[16.- - - - - -19.],异型性染色体的进化[20.- - - - - -24.],杂交[25.,26.],并为物种分化或标记发育的测序[27.,28.].大量的行为活性挥发性化合物的生产也使silene.研究挥发性生物合成基因的理想系统。然而,目前,气味生物合成途径仍然没有特征silene..在迄今为止已知的几种香味酶中,植物O-甲基转移酶(OMT)家族酶在二级代谢中发挥着重要作用,并将一个甲基从s -腺苷- l-蛋氨酸消除到底物的羟基[29.].除了在木质素生物合成中发挥作用[30.,31.],花青素生物合成[32.,33.,以及抗病能力[34.- - - - - -36.],这些omt也参与挥发性生物合成[37.- - - - - -40].例如,丁香酚O- 甲基转移酶(eomt)和chavicolO-甲基转移酶(CVOMT)将底物甲基化,分别合成甲基丁香酚和甲基chavicol [41,42].对玫瑰的功能特性进行了研究苔黑素O-methyltransferases(OOMT1和OOMT2)基因参与了3-羟基5-甲氧基甲苯和3,5 -二甲氧基甲苯(DMT)的形成,这是玫瑰品种的两种关键香味化合物[43,44].到目前为止,由于其参与花香生成生物合成和调味特性,在功能表征几种植物甲基转移酶[42,45,46].
作为正在进行的研究项目的一部分,以表征涉及花香生成生物合成的主要基因silene.物种,我们最近发展了一个S. Latifolia.通过构建一个标准和两个减法cDNA文库(Gupta等人)的花卉EST资源3,072序列。对这些序列的分析使我们允许我们表征各种候选基因,包括具有高相似性的若干OMTS,与其他物种中的功能表征省略。在这里,我们表明,两个从这些库的两个全长编码cdnas表示S. Latifolia Guaiacol O-甲基转酯酶1(SlGOMT1),S. Latifolia Guaiacol O-甲基转酯酶2(SlGOMT2(1)异源表达蛋白是否催化veratrole的形成S. Latifolia.和美国dioica?2)白天和夜间之间的Veratrole排放差异如何S. Latifolia.受控?3)是Slgomt.花和叶组织之间以及性别之间的基因表达差异?4)做Slgomt.和S. Dioica O-甲基转移酶(SDOMT.)基因显示选择的证据?
结果
GOMT和GOMT样CDNA的隔离和表征
搜索的EST数据库构建S. Latifolia.鲜花(Gupta等人。在prep)以序列与已知的序列O-甲基转移酶鉴定出了ESTs,利用这些ESTs的序列信息分离出了两条全长1059 bp的编码cDNA序列,分别命名为SlGOMT1和SlGOMT2。这些序列编码353个氨基酸的肽序列,在SDS-PAGE上,两个纯化的slgmt蛋白的分子质量约为37kd,类似于其他基于植物的甲基转移酶[29.)(图1).SLGOMT1和SLGOMT2几乎相同,除了两个核苷酸差异,导致在74位的一个氨基酸差异。这种弱分歧表明,两个序列对应于相同基因座的不同等位基因。Defuct Slgomt1和SlgomT2蛋白序列与其他特征蛋白序列的对准如图所示2.SLGOMTS(SLGOMT1和SLGOMT2)之间推导的氨基酸序列的比较和其他植物的生物化学表征OMTS揭示了来自奥替诺尔省的54-55%的同一性Rosa Hybrida[43与白藜芦醇OMT的同源性为54%vitis.[35.].进一步的爆炸搜查也显示了45%的身份罗勒属丁香酚OMT [4231%的人认同Solanum.儿茶酚OMT [47].基于为SLGOMT1和SLGOMT2指定的引物,我们还能够从RNA提取的RNA获得1,062bp的2062 bp的含量相同的CDNA美国dioica鲜花,我们指定了他们sdomt1和sdomt2。这些两个序列都与SLGOMT1和SLGOMT2共享了89-90%的身份。
SLGOMT1的对齐(SILON LATIFOLIA.),slgomt2(SILON LATIFOLIA.),sdomt1(硅二恶英)和sdomt2(硅二恶英).在黑背景的白色信件显示至少五个序列的相同的氨基酸。突出了涉及催化效率差异的氨基酸(在黄色背景中).三个保守的sam结合域也显示在红色块中。GenBank登录号码如下:Rosa Hybrida, NCBI: AF502433), RhOOMT2 (Rosa Hybrida, NCBI:AF502434), vromt (葡萄, NCBI:CAQ76879), oomt (OCimum Basilicum.,ncbi:af435008)和ctomt1(Solanum lycopersicum,Sol基因组学网络:SGN-U582403)。
SLGOMTS和SDOMTS的生化特征
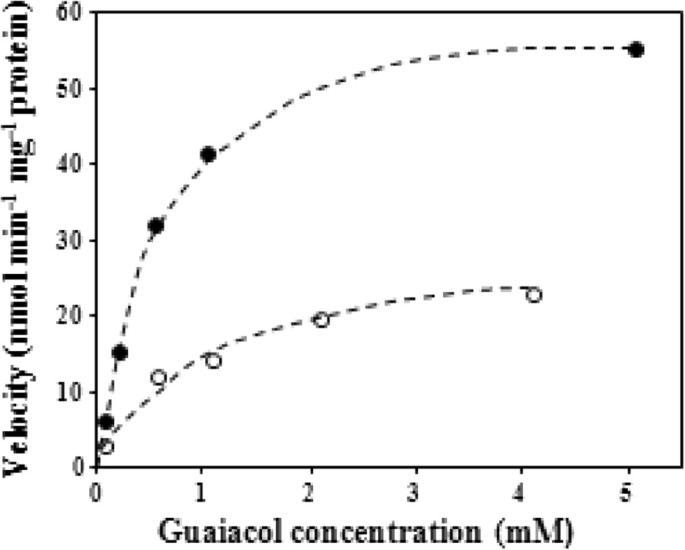
SlGOMTs和SdOMTs在大肠杆菌和用愈橘醇(估计是veratrole的底物)、orcinol (OOMT的底物)、丁香酚(EOMT的底物)和邻苯二酚(一种化合物,最近被证明是番茄中一个甲基转移酶的底物,可将其转化为愈橘醇)测试甲基化活性的蛋白质[47].没有可甲基化的甲磺酸,其没有甲基化,用作对照(表1).SLGOMT1与愈牙酚显示出优选的活性,并有效地能够甲酸胍甲酸盐(图3.,4,5和额外的文件1:图S4),以K开头米Guaiacol的值为9.8μm(表2).SLGOMT2具有较低的活性,具有几种基材,包括愈牙醇(表1)和k米Guaiacol的价值,501μm,比slgomt1高51倍(表2),由此产生的酶对愈创木酚的效率是SlGOMT1的31倍2).SdOMT1和SdOMT2没有将这些测试底物甲基化。
邻二甲氧基苯排放
来自女性和雄性花的Veratrole排放量在夜晚的夜晚比白天(Z = -3.321)()是50-77级的数量级p= 0.001;表格3.).正如预期的那样,没有从叶组织中检测到Veratrole发射,表明Veratrole是一种花卉特异性化合物(叶子挥发性数据未在表中显示3.).雄花和雌花的veratrole排放差异不显著(Z = 0,p= 1)。
基因表达分析
确定是否Slgomt.花和叶之间的基因表达有差异S. Latifolia.,进行qRT-PCR分析(表3.).我们的结果表明Slgomt.基因在花组织中优先表达,而在叶组织中未检测到表达3.,该表中未显示数据未显示数据)。令人惊讶的是,发现没有显着差异Slgomt.在白天和夜间采集的花中基因表达(Z =−0.680,p = 0.529). However,Slgomt.在白天和夜晚期间,雌性比女性更高的表达(3-4倍)比女性更高(Z = -3.250,p= 0.001)。
进化分析
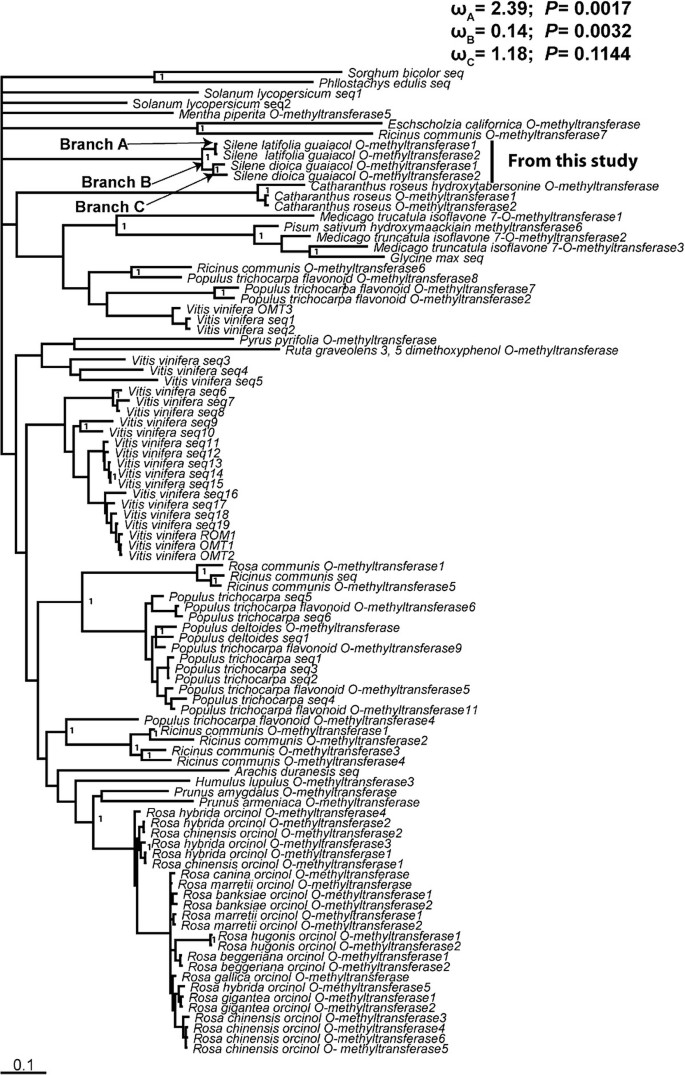
分析进化关系与序列演化模式SlGOMTs和SDOMTS.序列,我们从NCBI中检索了92种植物OMT序列(附加文件2:表S1)在方法部分中描述的标准之后。这些序列与我们的序列相结合SlGOMTs和SDOMTS.序列构建贝叶斯推理系统发育。所有的确认silene.序列形成了一个单独的疏水板,并与之显示出远距离关系M. truncatula异黄酮7-O-甲基转移酶(Iomt.)基因。对同义突变与非同义突变进行了最大似然分析,以检验选择的特征。我们的分析显示了阳性选择的有力证据(ω = 2.38;p = 0.0017) along the branch leading toSlGOMT1和SlGOMT2,而沿着分支没有发现阳性选择的证据SDOMT1和SDomt2.(附加文件3.:表S2)。沿着链接的分支发现净化选择Slgomt.和SDOMT.序列(ω= 0.14;p= 0.0032;数字6).
讨论
本文报道了从愈创木酚中生成veratrole(1,2 -二甲氧基苯)的一种新酶的鉴定SILON LATIFOLIA..Veratrole在植物中广泛存在,是一些植物-昆虫相互作用的关键化合物。在S. Latifolia.和其他silene.物种,Veratrole是Collinator吸引力的关键化合物[5,13.,48].相关的1,4-二甲氧基苯挥发性化合物已从花中鉴定出来萨利克里斯物种和该化合物用作寡聚蜜蜂的引诱剂[49].schiestl&dötterl[50最近还表明了甲氧化芳族化合物的进化重要性,包括植物植物及其粉丝群,但直到我们的研究,植物植物的分子基础是未知的。
GOMT和veratrole的生物合成
黛西SILON LATIFOLIA.作为其具有显着特征的植物模型系统,包括若干生态和进化主题,包括良好的特征,包括良好的差异化的异形性染色体,苗圃授粉系统和相关的花香芳香[6,7,13.,23.,51- - - - - -55].在S. Latifolia.,芳香(例如,veratrole,苯基丙醛,甲基丙烯酸甲酯和苯甲酸苄酸盐)和单萜类化合物(例如,丁香,丁香醛和醇,α-折烯和丙键)化合物包括总花香气味排放的重要部分[6,7].参与这些广泛分布的花挥发物的合成的基因已经在许多植物中被描述,大部分来自两性的物种。例如,参与苯乙醛合成的基因已经在佩妮[56],罗莎[57],Lycopersicum.[58),而拟南芥[59].同样,大量的萜烯合酶基因已被隔离并在几种植物物种中表征[60- - - - - -66].然而,很少在雌雄异株物种中检测到气味基因,只有两个例外萜烯合酶对某些Sesquiterpenes合成负责的基因海葵deliciosa花朵 [67].这两个萜类合成酶基因中的一个被发现具有针叶树二萜内部序列(CDIS)域,这通常是许多二萜合成酶的特征,决定了它们的活性[67,68].
Veratrole是花卉香味的关键引诱剂化合物S. Latifolia.并且它与其他化合物一起被调节,随后授粉后[10.].我们在这种雌雄异株植物中研究了两个候选的“veratrole形成基因”,SlGOMT1和SlGOMT2.对其编码的酶的活性分析表明,SlGOMT1是一种高效、特异的愈创木酚甲基转移酶(见表)1,2,数据3.5)其活性导致术治疗的合成。SLGOMT1也具有较低的活性(<11%,与其与Guaiacol的活性相比),除了儿茶酚外,除了儿茶之外(表2).另一方面,与SlGOMT1相比,SlGOMT2在愈创木酚中的活性水平较低1,2,图5),并且具有测试的几个其他基材的相对低的水平。因此,在这一点上不可能得出结论,花液中的SLGOMT2在花中的存在会导致术治疗的合成,特别是因为k米与SLGOMT1的相应值相比,SLGOMT2的值相对较高(APP.500μmvs.10μm,表2).需要检查花组中的愈缩菌的内部浓度来解决这个问题。
最近据报道,儿茶酚是番茄果(CTOMT)中甲基转移酶的底物,其将其转化为Guaiacol [47].因此,儿茶酚可以用作愈缩症的前体S. Latifolia.也是。虽然SLGOMT1确实显示对番茄CTOMT的相对较低水平的氨基酸相似性,但我们观察了与儿茶酚的SLGOMT1的中等程度的活性(表1).虽然这个结果很有趣,但是额外的工作,如测量邻苯二酚的浓度S. Latifolia.必须进行花实验,以确定该系统中邻苯二酚是否确实是愈创木酚的前体。在番茄中,在果实中检测到邻苯二酚和愈创木酚,但在S. Latifolia.鲜花,只有愈缩菌排放,但不是儿茶酚,已被观察到[6,7,10.,47].
众所周知,在许多物种中,花的气味释放是由生物钟和/或光线控制的,显然是为了适应授粉者的时间活动[37.,38.,69- - - - - -71].我们的研究与wälti等。[6]表明香味排放S. Latifolia.白天和黑夜是不同的。此外,Slgomt.在白天和夜间,雄花的表达量都是雌花的3-4倍,但雌雄异花的veratrole释放量没有这种差异。Wälti等[7与女性相比,在男性中发现了显着的术术释放S. Latifolia.在我们的研究中,植物和缺乏显著的性别特异性差异可能是相对较低的样本量和veratrole排放的高变异性的结果。然而,值得注意的是,Nieuwenhuizen等人[67]发现了答:deliciosa女性花比男性花卉产生更多的气味,即使在两性的花朵之间没有发现基因表达的差异。
GOMT的演变
SLGOMT1和SLGOMT2之间的单个氨基差异的观察结果负责Gratrole合成的催化效率的巨大差异S. Latifolia.是有趣的。同样,两个复制的基因副本被描述为丁香酚合成Clarkia Breweri.其中一个副本的效率大约是另一个的3.5倍[72].
与此相反S. Latifolia.它在其花气味中发出术术,美国dioica不释放veratrole [6].在那种密切相关的物种中发现的两个基因SlGOMTs,SDOMT1, 和SDomt2.,被发现在花组织中表达,但是,我们的数据表明SDOMT1和SDomt2.在本研究中没有测试的愈合菌,儿茶酚或其他底物的活性。这些酶可能含有使它们不活跃的突变。Koeduka等。[73发现编码区中的单个核苷酸取代矮牵牛腋下亚普藜番茄蛋白酶(PapIGS)基因导致酶活性丧失,从而阻止异丁香酚从花中释放出来。另一方面,一些关于植物OMT家族的研究表明,一个或几个氨基酸的变化可能会导致新的底物特异性,如在山字草ISO(eugenol)OMT [45] 和罗勒属phenylpropene-OMTs [74].这种OMT序列的氨基酸变化已经被发现是在正向选择下进化的[75,76].
因为SlGOMT1和SlGOMT2彼此之间的相似度比彼此的相似度高吗SDOMT1和SDomt2.(图6),我们不知道它们是否代表了两个相同轨迹的等位基因,或者在分裂后发生的复制美国dioica.序列散度分析结果表明,该方法具有正向选择的特点SlGOMT1&SlGOMT2 (正如其重要的DN / DS值,2.39)所证明,建议最近收购GOMT活动年代.拉伸被一些氨基酸取代。这种进化变化可能是由于传粉者对近亲物种进行了更好的甄别,美国dioica,导致增强的花卉孤立[77,78].或者,Veratrole可以是特定关联中的关键信号S. Latifolia.凭借其主要粉刷者,Hadena bicruris.花粉仪介导的选择通常在气味化合物上发生[79,80].较高的veratrole排放量可以在较长的距离上提高花朵的吸引力S. Latifolia.[7,13.,81].虽然没有检测到的选择SDOMTS.,以前在分支中净化选择的证据导致两者SlGOMTs和SDOMTS.提示祖先OMT蛋白具有保守的作用,因此SdOMT酶可能具有另一种尚未确定的功能。
结论
两个新的花特异性甲基转移酶基因被鉴定S. Latifolia.能够甲基化愈菌醇,并且在雄性和女性个体之间表达差异。我们的研究还为将来提供了基础silene.气味分子的研究。综上所述,有关气味产生基因及其进化特征的信息将有助于理解传粉者驱动的植物花香变异选择。
方法
植物材料
S. Latifolia.和美国dioica植物在苏黎世联邦理工学院Hönggerberg和Eschikon实验点的温室条件下生长。花在黄昏(午夜)后收获。采集后用液氮快速冷冻,置于−80°C保存至使用。使用RNeasy植物迷你试剂盒(Qiagen)从花中提取总rna,根据制造商说明使用Oligotex mRNA试剂盒(Qiagen)分离poly A + mRNA。
全长SlGOMTs和SdOMTs的分离
S. Latifolia.利用BLASTX算法搜索与已知植物甲基转移酶家族成员同源的EST文库[82].部分序列与玫瑰相似Orcinol O-甲基转移酶的全长cDNA序列的分离。使用SMART-RACE cDNA amplification kit (Clontech),按照制造商的方案分离完整的编码cDNA序列。利用基因特异性引物对获得全长cDNA序列年代.拉托玉米醇也从美国dioica并且将得到的PCR产物克隆到PSMart载体(Lucigen)中。通过测序验证插入物。两个编码序列S. Latifolia.和美国dioica被孤立。
的准备silene.GOMT建筑物
确定是否SlGOMT1,SlGOMT2,SDOMT1, 和SDomt2.我们扩增了完整的开放阅读框架,包括起始密码子,但在末端没有天然终止密码子。的蛋白质编码区(ORFs)Slgomt.沙SDOMT.采用上游引物和下游引物进行RT-PCR扩增(附加文件)4:表S3)。PCR扩增后进行了30周期初始变性在94°C 2分钟。每个周期由变性1分钟94°C,退火55°C 1分钟和扩展72°C 2分钟的最后7分钟的扩展Biometra thermocycler。PCR产物按照说明书使用pEXP-CT/Topo TA表达试剂盒克隆到表达载体中。对构建物进行完全测序,以确定插入物的方向。
GOMT活性、纯化、酶学分析和产品鉴定
SlGOMT1,Slgomt2,Sdomt1,和SDomt2.构建体被转化为大肠杆菌BL21-CodonPlus (DE3)-RIPL细胞(Stratagene)。载体细胞在LB培养基中培养至OD值6000.6。1-硫代-β- d -半乳糖吡喃异丙基(IPTG)最终浓度为1 mM诱导蛋白表达,18℃孵育16小时。细胞微丸重悬于缓冲液A (100mm Tris-HCl, 5mm MgCl)中2,10%β-巯基乙醇,10%甘油[v / v],pH7.5)随后通过超声破裂。澄清的粗提取物在用缓冲液A平衡的PD-10柱上撤离,并用标准布拉德福法估算蛋白质浓度。基本上如Wang等人所述进行酶活性。[83].将酶(10-20μg脱盐粗提物)以0.2mM底物(Guaiacol,Orcinol,儿茶酚,丁烯醇和甲甲炔醇)和5μmS-[甲基 -14.C]腺囊 -l- 在室温下进行30分钟(40-60mci / mmol)。用200μl乙酸乙酯萃取反应产物,将100μl有机相转移至2ml非水闪烁液,并进行闪烁计数器(2S6800,Beckman)。将大约50μg的脱盐粗提取物孵育在含有1mM的愈合菌1mM的含量为200μl,在室温下在缓冲液A中孵育1mM Sam,并且在室温下30分钟,采用SPME器件进行挥发收集。
制备的重组SLGOMT1和SLGOMT2蛋白大肠杆菌用镍纯化2+亲和层析(Qiagen),根据制造商的说明。简单地说,粗蛋白质提取物被脱盐到缓冲B (100 mM磷酸钾,150 mM NaCl, 10 mM咪唑,pH 7.5),并应用于0.5 mL镍2+树脂。随后用缓冲液B洗涤10柱,用含有250mM咪唑的缓冲液B洗脱与树脂结合的蛋白质。将洗脱的蛋白质脱盐成缓冲液A并使用AMICON Ultra-15过滤器浓缩(Millipore)。通过SDS-PAGE评估洗脱蛋白的蛋白质纯度,并如上所述测定浓度。对于动力学分析,如上所述进行测定,用〜0.5μg纯化的SLGOMT1或2和各种浓度的胍醇,而SAM浓度在200μm处保持恒定。通过加入10μl2NHCl停止反应。双倒数地块用于确定表观k米和V.最大限度对于每种酶。
香味集合
采用动态堆空间法在气候室中采集植物气味。我们在凌晨4点到晚上8点的光照时间和晚上9点到凌晨3点的黑暗时间收集气味。雌雄各5个个体采集花挥发物,雌雄各3个个体采集叶挥发物。这些个体完整的新开的整朵花和新叶被密封在一个烤箱烤袋(Nalophan®)中,使用电池操作的泵从这些袋子中吸出空气(PAS-500个人空气取样器,Spectrey, Redwood city, California, USA)。挥发物在自制的充满Tenax的吸收玻璃管中日夜捕获30分钟。为了区分周围空气污染物中的化合物,还收集了对照样品,并从每个样品中减去它们的平均值。所有的玻璃过滤器都用特氟隆胶带盖上,并封装在铝箔中,以避免污染,并保存样品,以便在−20°C下进行后续气相色谱仪(GC)分析。
气相色谱定量分析及化合物鉴定
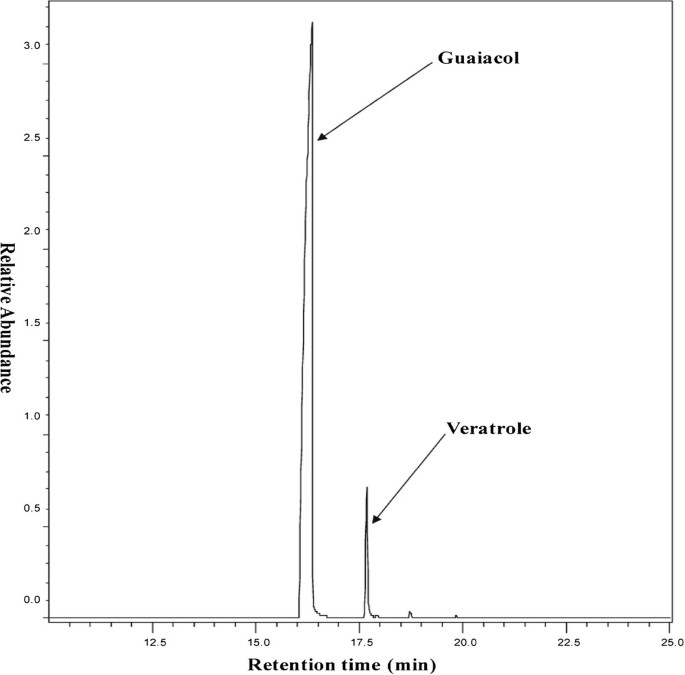
4天内挥发性样品分析挥发性集合的气相色谱仪(GC,安捷伦6890 N)连接到一个HP5列(30 m×0.32毫米内直径×0.25μm膜厚度)和一个安捷伦5975质量选择检测器相关的热解吸系统(TDS2陈健民,Muhlheim德国)。TDS温度从30°C(0.5分钟保持)调整到240°C(1分钟保持),每分钟60°C。CIS(冷注射系统)温度设置为- 50°C(保持0.5分钟),以每秒16°C的速度升至150°C(保持0.5分钟),以每秒12°C的速度升至250°C(保持0.5分钟)。GC6890的烤箱温度从50°C(3分钟保持)上升到230°C,每分钟8°C。使用Agilent ChemStation和MSD ChemStation E.02.00.493 (Agilent Technologies, Palo Alto, California, USA)软件对峰和保留时间进行表征。合成邻二甲氧基苯(Sigma-Aldrich,进一步采用瑞士)作为质谱色谱中比较保留时间以及校正峰面积与绝对量的标准。定量的veratrole的数量估计在ng每升空气采样。
实时RT-PCR分析
我们使用相同组的花和叶样品进行基因表达分析,其也用于挥发性收集。在每个挥发性收集后,立即收获花和叶组织并在液氮中冷冻冷冻。将所有这些样品储存在-80°C直至需要。使用RNeasy植物迷你试剂盒(QIAGEN)从花和叶中提取总RNA。随后使用RQ1 RNase的DNase(Promega,Madison,Wisconsin,USA)进行DNase治疗,遵循制造商的说明书。通过M-MLV逆转录酶(Promega,Madison,Wisconsin,USA)和Oligo(DT)合成第一链cDNA15.底漆。作为可能的DNA污染的对照,有酶和没有酶都进行了逆转录。rt -PCR采用SYBR Master Mix (Applied Biosystems, Foster City, USA),在7500 Real Time PCR系统(Applied Biosystems, Foster City, USA)上进行。采用Actin、EF1A、CL285引物作为内控,qRT-GOMT引物进行扩增(附加文件)4:表S3)。所有样品包括对照反应均进行3次。结果由7500 Software v 2.0.1 (Applied Biosystems, Foster City, USA)记录。至少进行了三组独立实验来计算平均周期阈值(Ct)值和标准差。
统计分析
采用非参数Mann - Whitney u检验分析不同性别和昼夜间veratrole释放和基因表达的差异。所有分析均使用SPSS统计软件包(SPSS Inc.)进行。芝加哥)。
系统发育重建和选择分析
选择SlGOMT1序列作为种子,利用BlastN搜索从NCBI中检索同源序列,并与本研究生成的序列结合。根据一般参数(最大目标序列100,期望阈值10,单词大小11,匹配/不匹配评分2,-3),使用“有点相似的序列”选项优化BlastN搜索。DNA序列与BioEdit v7.0.5进行比对,从筛选出的100个序列中剔除比对较差的8个序列用于后续分析。最佳替代模型使用Mr. Modeltest 2.3进行估计[84].采用Markov Chain Monte Carlo (MCMC)方法近似树的后验概率,采用MrBayes 3.1.2 [85].采用BaseML优化得到的共识树的分枝长度。CodeML进一步用于基于密码子的模型。两个程序都属于PAML 4.4包[86].
参考
- 1。
Brantjes N:夜飞蛾对花朵的感觉反应。学术出版社,伦敦,1978:13-19。
- 2。
王志强,王志强,王志强,等。传粉昆虫的访花模式、花的奖励和传粉的概率Microbotryum violaceum是植物的一种性病。中国海洋大学学报(自然科学版)。10.2307 / 2261557。
- 3.
JürgensA,Witt T,Gottberger G:中欧人口中的复制和授粉silene.和Saponaria物种。机器人acta。1996,109:316-324。
- 4.
Dötterl S, Jurgens A:花的空间香气模式SILON LATIFOLIA.:Lilac化合物作为嗅花蜜指南?植物系统中的Evol。2005,255:99-109。10.1007 / s00606-005-0344-2
- 5.
Jürgens A, Witt T, Gottsberger G:夜花的花香成分silene.物种(石竹科)。生物化学学报。2002,30:383-397。10.1016 - 1978年颁布/ s0305该政令旨在(1)00106 - 5。
- 6.
Wälti M, Muhlemann J, Widmer A, Schiestl F:两种植物的花香味和生殖隔离silene..J EVOL BIOL。2008,21:111-121。
- 7.
Wälti M, Page P, Widmer A, Schiestl F:如何成为一个有吸引力的雄:花的二型性和对传粉者的吸引力在雌雄异株植物。BMC Evol Biol. 2009, 9: 190-10.1186/1471-2148-9-190。
- 8.
Brantjes N:关于授粉的谜语Melandrium专辑(磨)Garcke(蛛网)在卵巢期间Hadena bicrurishufn(noctuidae,鳞翅目).2。Koninklijke Nederlandse Akademie Van Wetenschappen系列C-生物和医学科学的诉讼程序。1976,79:127-141。
- 9.
凯普art S, Reynolds R, Rutter M, Fenster C, Dudash M:昆虫对授粉和种子的捕食silene.和盟军的血腥曲率:评估模型系统,以研究相互主义的演变。新植物。2006,169:667-680。10.1111 / J.1469-8137.2005.01619.x。
- 10。
Mühlemann J, Wälti M, Widmer A, Schiestl F:授粉后花的气味变化SILON LATIFOLIA.种子捕食者避免的自适应机制?J Chem Ecol。2006,32:1855-1860。10.1007 / s10886-006-9113-0。
- 11.
Gottsberger:重要性SILON LATIFOLIA.SSP。阿尔巴和美国dioica(蛛网苜蓿)作为寄生式传染案的宿主植物Hadena bicruris(鳞翅目、科)。《中国科学》2004年第4期。10.1111 / j.0030-1299.2004.12625.x。
- 12.
Wolfe LM:为什么外星人入侵者成功:支持逃避 - 敌人的假设。我是nat。2002,160:705-711。10.1086 / 343872。
- 13。
dötterls,jürgensa,seifert k,laube t,Weissbecker B,Schutz S:幼儿园授粉SILON LATIFOLIA.:气味在引起触角和行为反应方面的作用。植物营养学报,2006,29(6):717 -718。10.1111 / j.1469-8137.2005.01509.x。
- 14。
Dötterl S, Burkhardt D, Jürgens A, Mosandl A:紫丁香醛的立体异构模式SILON LATIFOLIA.,涉及托儿所授粉系统的植物。植物化学。2007,68:499-504。10.1016 / J.Phytochem.2006.11.013。
- 15.
Jürgens - y:昼夜花香组成silene.物种(蛛网):系统发育限制或适应花游客?生物学习系统系统。2004,32:841-859。10.1016 / J.BSE.2004.03.009。
- 16.
Scutt C,Li Y,Robertson S,Willis M,Gilmartin P:DIORACIOUS的性别测定SILON LATIFOLIA.- Y染色体和寄生黑穗病菌的影响(Ustilago violacea.关于花发育过程中的基因表达。植物理性。1997,114:969-979。10.1104 / pp.114.3.969。
- 17.
植物的性别决定和性染色体。遗传。2002,88:94-101。10.1038 / sj.hdy.6800016。
- 18.
邱小龙,黄志强,黄志强,黄志强SILON LATIFOLIA.常染色体和性连锁基因。中国生物医学工程学报,2010,31(4):593 - 598。10.1098 / rspb.2010.0606。
- 19.
Bergero R,Charlesworth D:在1000万岁的植物性染色体系统中保存Y转录组。Curr Biol。2011,21:1470-1474。10.1016 / J.CUB.2011.07.032。
- 20。
Vyskot B,Araya A,Veuskens J,Negrutiu I,Mouras A:DNA甲基化性染色体在脱衣厂,Melandrium专辑.Mol Gen Genet。1993年,239:219-224。
- 21。
Zluvova J,Georgiev S,Janousek B,Charlesworth D,Vyskot B,Negrutiu L:早期事件在演变中SILON LATIFOLIA.Y染色体:男性专业化和重组逮捕。遗传学。2007,177:375-386。10.1534 / genetics.107.071175。
- 22。
Marais G, Nicolas M, Bergero R, Chambrier P, Kejnovsky E, Moneger F, Hobza R, Widmer A, Charlesworth D:雌雄异株Y染色体退化的证据SILON LATIFOLIA..Curr Biol。2008,18:545-549。10.1016 / J.Cub.2008.03.023。
- 23。
在性染色体的独立起源的两个种的属silene..中国生物医学工程学报。10.1534 / genetics.107.085670。
- 24。
Chibalina MV, Filatov DA:单倍体纯化选择延缓植物Y染色体退化。中国生物医学工程学报。2011,21:1475-1479。10.1016 / j.cub.2011.07.045。
- 25。
Minder A,Rothenbuehler C,Widmer A:杂交地区的遗传结构SILON LATIFOLIA.和硅二恶英石竹科:渐渗杂交的证据。生态学报。2007,16:2504-2516。10.1111 / j.1365 - 294 x.2007.03292.x。
- 26。
Minder Am,Widmer A:物种边界的人口基因组分析:中性过程,两个杂交植物物种之间的适应性分歧和血投。Mol Ecol。2008,17:1552-1563。10.1111 / J.1365-294x.2008.03709.x。
- 27。
mocia M, Oger-Desfeux C, Marais G, Widmer A: A White Campion (SILON LATIFOLIA.)花表达序列标签(EST)库:注释、EST- ssr特征、可转移性和用于比较作图的实用工具。中国生物医学工程学报。2009,10(1):243-10.1186/1471-2164-10-243。
- 28。
Blavet N,Charif D,Oger-Desfeux C,Marais G,Widmer A:比较高吞吐量转录组测序和午睡的发展,silene.EST注释数据库。BMC基因组学。2011,12:376-10.1186 / 1471-2164-12-376。
- 29。
易卜拉欣RK,Bruneau A,Bantignies B:植物O-甲基转移酶:分子分析,常见签名和分类。植物mol biol。1998年,36:1-10。10.1023 /答:1005939803300。
- 30.
Gowri G,Bugos RC,Campbell WH,Maxwell CA,Dixon Ra:苜蓿中的压力响应(Medicago Sativa.木质素生物合成关键酶s -腺苷- l-蛋氨酸咖啡酸3- o -甲基转移酶的克隆与表达。植物生理学报,1999,19(4):457 - 461。10.1104 / pp.97.1.7。
- 31。
叶志,瓦纳JE:二的微分表达式O木质素生物合成中的-甲基转移酶Zinnia线虫.植物理性。1995,108:459-467。10.1104 / pp.108.2.459。
- 32。
Hugueney P, Provenzano S, Verriès C, Ferrandino A, Meudec E, Batelli G, Merdinoglu D, Cheynier V, Schubert A, Ageorges A:一部新的阳离子依赖小说O- 甲基转移酶参与葡萄树中的花青素甲基化。植物理性。2009,150:2057-2070。10.1104 / pp.109.140376。
- 33。
Fournier-Level A,Hugueney P,Verrièsc,这个P,致力于造粒术语A:葡萄中花青素甲基化水平的遗传机制(葡萄l .)。植物学报。2011,32(6):759 - 762。
- 34。
何志忠,陈志强:大豆异黄酮的遗传调控O-甲基转移酶增强紫花苜蓿4'- o -甲基化类异黄酮的生物合成和抗病能力。植物学报。2000,12:1689-1702。
- 35。
Schmidlin L, Poutaraud A, Claudel P, Mestre P, Prado E, Santos-Rosa M, Wiedemann-Merdinoglu S, Karst F, Merdinoglu D, Hugueney P:胁迫诱导的白藜芦醇o -甲基转移酶参与葡萄中pterostilbene的生物合成。植物营养与肥料学报。2008,31(4):457 - 461。10.1104 / pp.108.126003。
- 36。
Schmitt D,Pakusch AE,Matern U:Caffeoyl-CoA 3-O-甲基转移酶的分子克隆,诱导和分类分布,患有疾病性的酶。J Biol Chem。1991,266:17416-17423。
- 37。
Dudareva N, Murfitt LM, Mann CJ, Gorenstein N, Kolosova N, Kish CM, Bonham C, Wood K:金鱼花中苯甲酸甲酯生物合成和排放的发育调控。植物学报。2000,12:949-961。
- 38。
Kolosova N, Sherman D, Karlson D, Dudareva N: s -腺苷-l-甲硫氨酸:苯甲酸羧基甲基转移酶的细胞和亚细胞定位,该酶负责在snapdragon花中挥发性苯甲酸甲酯的生物合成。植物生理学报。2001,26(6):956-964。10.1104 / pp.126.3.956。
- 39.
吴S,Watanabe N,Mita S,Dohra H,Ueda Y,Shibuya M,Ebizuka Y:甘油酸的关键作用O- 甲基转移酶在生物合成中罗莎对挥发性1,3,5-三甲氧基苯。植物理性。2004,135:95-102。10.1104 / pp.103.037051。
- 40.
Tieman D,Zeigler M,Schmelz E,Taylor Mg,Rushing S,Jones JB,Klee HJ:番茄水杨酸甲基转移酶的功能分析及其在合成香料挥发性甲基水杨酸甲基的作用。工厂J.2010,62:113-123。10.1111 / J.1365-313x.2010.04128.x。
- 41.
Lewinsohn E, Ziv-Raz I, Dudai N, Tadmor Y, Lastochkin E, Larkov O, Chaimovitsh D, Ravid U, Putievsky E, Pichersky E, Shoham Y:甜罗勒中雌二醇和甲基丁香酚的生物合成(OCimum Basilicum.l)。烯丙酚o-甲基转移酶活性的发育和趋化性关联。植物SCI。2000,160:27-35。10.1016 / s0168-9452(00)00357-5。
- 42。
帮派博士,Lavid N,Zubieta C,Chen F,Beuerle T,Lewinsohn E,Noel JP,Pichersky E:苯丙烯的表征O- 来自甜罗勒的甲基转移酶:植物内底物特异性和收敛演变的容易变化O- 甲基转移酶家庭。植物细胞。2002,14:505-519。10.1105 / TPC.010327。
- 43。
Scalliet G, Lionnet C, Le Bechec M, Dutron L, Magnard J-L, Baudino S, Bergougnoux V, Jullien F, Chambrier P, Vergne P, etal .:花瓣特异性orcinol o -甲基转移酶在玫瑰香味进化中的作用。植物营养与肥料学报,2006,30(4):429 - 434。
- 44。
Scalliet G,Piola F,Douady CJ,Rétys,raymond o,Baudino S,Bordji K,Bendahmane M,Dumas C,Cock JM,Hugueney P:中国玫瑰的香味演变。PROC NATL ACAD SCI。2008,105:5927-5932。10.1073 / pnas.0711551105。
- 45。
Wang J ., Pichersky E . Identification of specific residues involved in substrate discrimination in two plants O-methyltransferases。生物化学学报。1999,32(6):723 - 729。10.1006 / abbi.1999.1304。
- 46。
Dunlevy J, Soole K, Perkins M, Dennis E, Keyzers R, Kalua C, Boss P:两个O参与甲氧基吡嗪生物合成的-甲基转移酶:对葡萄酒风味重要的葡萄衍生香气化合物。植物生态学报,2010,36(6):779 - 784。10.1007 / s11103 - 010 - 9655 - y。
- 47。
Mageroy MH, Tieman DM, Floystad A, Taylor MG, Klee HJ: ASolanum lycopersicum儿茶酚- o -甲基转移酶参与了风味分子愈创木酚的合成。植物学报,2012,69:1043-1051。10.1111 / j.1365 - 313 x.2011.04854.x。
- 48。
Jhumur US,Dötterls,jürgensA:天真和条件回复Culex pipiens pipiens生物型鼹鼠(双翅目:库蚊科)对花的气味。中华医学昆虫杂志。2006,43:1164-1170。10.1603 / 0022 - 2585 (2006) 43 [1164: NACROC] 2.0.CO; 2。
- 49。
Dötterls,Füsselu,jürgensa,aas g:1,4-二甲氧基苯,柳树中的花香香气化合物吸引寡头植物。J Chem Ecol。2005,31:2993-2998。10.1007 / s10886-005-9152-y。
- 50。
传粉者花的气味和嗅觉偏好的进化:共同进化还是预先存在的偏见?地球科学进展。2012,66(7):2042-2055。10.1111 / j.1558-5646.2012.01593.x。
- 51。
Bernasconi G,Antonovics J,Biere A,Charlesworth D,Delph L,Filatov D,Giraud T,引擎盖M,Marais G,McCauley D等人:silene.作为生态和演化的模型系统。遗传。2009,103:5-14。10.1038 / hdy.2009.34。
- 52。
Labouche A-M, Bernasconi G:雄性蛾子提供授粉的好处SILON LATIFOLIA.- - - - - -Hadena bicruris托儿所授粉系统。生态学报。2010,24:534-544。10.1111 / j.1365-2435.2009.01658.x。
- 53。
BIERE A,HONDERS SC:应对第三方在苗圃授粉共同主义中:Hadena bicruris避免在病原体感染上产卵,回报较少SILON LATIFOLIA..植物营养学报,2006,29(6):719-727。10.1111 / j.1469-8137.2005.01511.x。
- 54。
Dötterl S, Wolfe L, Jürgens A:花香味的定性和定量分析SILON LATIFOLIA..植物营养与肥料学报。2005,22(4):457 - 461。10.1016 / j.phytochem.2004.12.002。
- 55。
一种性染色体突变SILON LATIFOLIA..植物营养与肥料学报,2011,27(4):427 - 434。10.1007 / s00497 - 011 - 0163 - 2。
- 56。
Kaminaga Y,Schnepp J,Peel G,Kish Cm,Ben-Nissan G,Weiss D,Orlova I,Lavie O,Rhodes D,Wood K,等:植物苯乙酰甲醛合成酶是催化苯丙氨酸脱羧和氧化的双官能同源聚明酶。J Biol Chem。2006,281:23357-23366。10.1074 / JBC.M602708200。
- 57。
利用功能互补法鉴定玫瑰苯乙醛合成酶。植物生态学报,2010,32(6):759 - 762。10.1007 / s11103 - 009 - 9564 - 0。
- 58。
Tieman D,Taylor M,Schauer N,Fernie Ar,Hanson Ad,Klee HJ:番茄芳族氨基酸脱羧酶参与合成风味挥发物2-苯基乙醇和2-苯基乙醛。PROC NATL ACAD SCI。2006,103:8287-8292。10.1073 / pnas.0602469103。
- 59。
引用本文:Gutensohn M, Klempien A, Kaminaga Y, Nagegowda DA, negres - zakharov F, Huh J-H, Luo H, Weizbauer R, Mengiste T, Tholl D, Dudareva N:芳香醛合成酶在植物伤害/草食反应和花香味产生中的作用拟南芥生态型。植物J 2011,66:591-602。10.1111 / J.1365-313x.2011.04515.x。
- 60.
关键词:火花松,(+)-α-蒎烯合成酶,(-)-α-蒎烯合成酶松果体taeda):Pinene生物合成中的立体电池。拱生物学生生物糖。2003,411:267-276。10.1016 / s0003-9861(02)00746-4。
- 61.
陈福平,陈峰,陈志强,陈志强。倍半萜类化合物的合成及其合成机理研究进展拟南芥花。植物学报,2005,42:757-771。10.1111 / j.1365 - 313 x.2005.02417.x。
- 62.
Nagegowda DA, Gutensohn M, Wilkerson CG, Dudareva N:两个几乎相同的萜烯合成酶催化金鱼草花中橙花醇和芳樟醇的形成。植物营养学报,2008,32(5):514 - 514。10.1111 / j.1365 - 313 x.2008.03496.x。
- 63.
Dudareva N,Martin D,Kish Cm,Kolosova N,Gorenstein N,FäldtJ,Miller B,Bohlmann J:(E) -β-Ocimene和月桂烯合酶Snapdragon中花香气味生物合成的基因:三个功能和表达萜烯合酶新的萜烯合酶亚家族的基因。植物细胞。2003,15:1227-1241。10.1105 / TPC.011015。
- 64.
Bohlmann J,Steele Cl,Croteau R:来自大杉的单萜合成酶(冷杉属茅).牛键合酶,( - ) - (4S) - 二烷基合酶和( - ) - (1S,5S) - 丁烯合酶的cDNA分离,表征和功能表达。J Biol Chem。1997年,272:21784-21792。10.1074 / JBC.272.35.21784。
- 65.
Bohlmann J,Phillips M,Ramachandiran v,Katoh S,Croteau R:cDNA克隆,表征和四种新的单萜合酶成员的功能表达TPSD.来自大冷杉的基因家族(冷杉属茅).生物化学学报。1999,32(4):453 - 457。10.1006 / abbi.1999.1332。
- 66。
Falara V,Akhtar Ta,Nguyen Tth,Spyropoulou Ea,Bleeker Pm,Schauvinhold I,Matsuba Y,Bonini Me,Schilmiller Al,最后RL等:番茄萜烯合酶基因家族。植物理性。2011,157:770-789。10.1104 / pp.111.179648。
- 67。
Nieuwenhuizen NJ, Wang MY, Matich AJ, Green SA, Chen X, Yauk Y-K, Beuning LL, Nagegowda DA, Dudareva N, Atkinson RG:两种萜烯合成酶负责猕猴桃花中释放的主要倍半萜(猕猴桃deliciosa).中国生物医学工程学报。2009,30(6):593 - 598。10.1093 / jxb / erp162。
- 68。
Bohlmann J,Meyer-Gauen G,Croteau R:植物萜类合成酶:分子生物学和系统发育分析。PROC NATL ACAD SCI。1998,95:4126-4133。10.1073 / pnas.95.8.4126。
- 69。
气候因子对花挥发物原位释放的影响。植物学报。1994,19(4):457 - 461。
- 70.
Helsper JPFG,Davies Ja,Bouwmeester Hj,Krol AF,Van Kampen MH:昼夜节律在挥发性化合物排放Rosa HybridaL. cv。诚实。Planta。1998年,207:88-95。10.1007 / S004250050459。
- 71.
Schiestl FP, Ayasse M, Paulus HF, Erdmann D, Francke W:花的香气释放和授粉后的变化崖顶无性系种群。sphegodes.J Chem Ecol。1997年,23:2881-2895。10.1023 /答:1022527430163。
- 72。
Koeduka T, Louie GV, Orlova I, Kish CM, Ibdah M, Wilkerson CG, Bowman ME, Baiga TJ, Noel JP, Dudareva N, Pichersky E:两者中的多个苯丙烯合成酶Clarkia Breweri.和矮牵牛织布达代表两种不同的蛋白质谱系。植物学报,2008,54:362-374。10.1111 / j.1365 - 313 x.2008.03412.x。
- 73。
Koeduka T, Orlova I, Baiga TJ, Noel JP, Dudareva N, Pichersky E:异丁香酚的合成和释放的缺乏佩妮axillaris无性系种群。parodii是由于异丁子香酚合酶基因。工厂J. 2009,58:961-969。10.1111 / J.1365-313x.2009.03834.x。
- 74。
罗勒中苯基丙烯的合成与贮藏研究。植物生理学报。2001,31(4):531 - 534。10.1104 / pp.125.2.539。
- 75。
Barkman TJ:用于花香基因Isoeugenol-O-甲基转移酶的阳性选择的证据。mol Biol Evol。2003,20:168-172。10.1093 / molbev / msg030。
- 76。
Barkman TJ, Martins TR, Sutton E, Stout JT:单一氨基酸变化的积极选择促进植物挥发物产生酶的底物鉴别。中国生物科学(英文版),2007,24(4):497 - 503。10.1093 / molbev / msm053。
- 77。
马ais GAB, Forrest A, Kamau E, Käfer J, Daubin V, Charlesworth D:雌雄异株和性染色体进化的多核基因系统发育分析silene..公共科学图书馆。2011,6:e21915-10.1371/journal.pone.0021915。
- 78。
Markova M, Michu E, Vyskot B, Janousek B, Zluvova J:利用GISH技术研究植物种间亲缘关系的一种工具。中国生物医学工程学报,2007,15:1051-1059。10.1007 / s10577 - 007 - 1180 - 8。
- 79。
Schiestl FP:花香气味和昆虫化学沟通的演变。ECOL LETT。2010,13:643-656。10.1111 / J.1461-0248.2010.01451.x。
- 80.
Galen C:测量轮匠介导的形态学花卉特征选择:大黄蜂和高山Skypilot,Polumonium粘膜.进化。1989,43:882-890。10.2307 / 2409315。
- 81.
Schiestl F,Huber F,Gomeber F,Gomebz J:在花香香味的表型选择:吸引力与威慑之间的权衡?EVOL ECOL。2011,25:237-248。10.1007 / s10682-010-9409-y。
- 82.
Altschul S, Gish W, Miller W, Myers E, Lipman D:基本的局部对齐搜索工具。中华生物医学杂志,1996,15(4):427 - 434。
- 83.
王家,达拉维加,布卡塔,拉格萨·雷,Pichersky E:花香香味Clarkia Breweri.(onAgraceae):II。酶S-腺苷-1-甲硫氨酸的定位和发育调节:(ISO)丁香醇O-甲基转移酶和苯丙烷丙烷发射。植物理性。1997,114:213-221。10.1104 / pp.114.1.213。
- 84.
Nylander J:进化生物学中心。MrModeltest v2。由作者分发的程序。2004年,乌普萨拉大学
- 85.
Ronquist F, Huelsenbeck J: MrBayes 3:混合模型下的贝叶斯系统发育推断。生物信息学。2003,19:1572-1574。10.1093 /生物信息学/ btg180。
- 86.
杨Z:PAML 4:最大可能性的系统发育分析。mol Biol Evol。2007,24:1586-1591。10.1093 / molbev / msm088。
致谢
作者谨此感谢Claudia Michel和Niklaus Zemp在QRT-PCR实验中的帮助。我们还要感谢Aria Minder博士的请求S. Latifolia.作为qRT-PCR实验的参考引物,Edward Connor博士在挥发性收集和GC-MS分析方面的帮助,Philipp Schlüter博士在进化分析方面的帮助,以及苏黎世联邦理工学院遗传多样性中心(GDC)提供进行qRT-PCR实验的设施。这项研究得到了瑞士国家科学基金会(SNF;项目编号:31003A-112342)和ETH Zürich博士奖学金。
作者信息
隶属关系
通讯作者
额外的信息
竞争利益
提交人声明他们没有竞争利益。
作者的贡献
AKG,FPS和EP构思了该项目。AKG进行了实验,分析并写了手稿。TA有助于SLGOMTS生物化学分析和蛋白质纯化。FPS,EP和AW协助实验设计并导致稿件准备。所有作者都阅读了手稿并批准了它。
作者为图像提交的原始文件
权利和权限
本文在BioMed Central Ltd.的许可下发布了这是一个开放的访问文章,根据Creative Commons归因许可(http://creativeCommons.org/licenses/by/2.0.),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
Gupta,A.K.,Akhtar,T.A.,Widmer,A.et al。识别白菜(SILON LATIFOLIA.)愈创木酚O-甲基转移酶参与veratrole的生物合成,veratrole是吸引传粉者的关键挥发性物质。BMC植物杂志12,158(2012)。https://doi.org/10.1186/1471-2229-12-158
已收到:
接受:
发表:
关键字
- 花的香味
- 挥发性有机化合物
- 1,2-二甲氧基苯
- 授粉
- Hadena bicruris