抽象的
背景
橄榄 (Olea Europaea果实含有大量的次生代谢产物,主要是酚类、萜烯类和甾醇类,其中一些因其营养特性而特别有趣。本研究旨在进一步了解橄榄酚类化合物在果实发育过程中的分布,并确定酚类化合物代谢的主要遗传决定因素。
结果
测定了12个橄榄品种发育过程中橄榄苦苷、去甲基橄榄苦苷、3-4 DHPEA-EDA、ligstroside、tyrosol、hydroxytyrosol、毛蕊花苷和木脂素等主要酚类化合物的含量。这些化合物的含量在不同品种间存在显著差异,在果实发育和成熟过程中呈下降趋势,其中一些化合物对某些品种具有特异性。从橄榄果实转录组的大量测序数据或cDNA-AFLP分析中,鉴定出35个与主要次生代谢产物途径相关基因同源的橄榄转录本。利用RT-qPCR分析高、低酚品种果实的mRNA水平(Coratina和温柔的d 'Andria在三个不同的果实发育阶段。研究发现酚类化合物浓度与可能参与其生物合成的转录本之间存在很强的相关性,提示相应途径的转录调控。OeDXS,Oeges.,OeGE10H和oeadh.其中,1-脱氧-d -木酮糖-5- p合酶、香叶醇合酶、香叶醇10-羟化酶和arogenate脱氢酶在开花后45 d几乎完全存在,表明这些化合物可能在果实发育过程中调控环烯醚萜积累方面起关键作用。
结论
代谢和转录谱分析导致鉴定了一些主要的参与者,推定参与橄榄树次生化合物的生物合成。我们的数据代表了决定橄榄果实品质的重要基因的功能特征的第一步。
背景
橄榄果实Mesocarp积累了各种次级代谢物。次级代谢物的主要类别由Secoiridoids表示,一组单萜类单萜类单调合物,其具有切割的甲基环戊烷骨架,这是烯糖和其他几种双子叶族家族的典型。Secoiridoids在橄榄中丰富,作为酚类缀合的化合物,其可能含有糖苷部分。橄榄果实和初榨橄榄油的最重要的secooidoids是油孔,去甲基脲素,油脂糖苷,韧带,Nüzhenide及其糖糖形式,例如与3,4-dhpea或p-hpea连接的脱羧甲基elenolic酸的二醛形式(3,4-dhpea-EDA和P-HPEA-EDA,分别是Oleuropein aglycon(3,4-Dhpea-EA)和韧带糖苷(P-HPEA-EA)的异构体[1].在特级初榨橄榄油中鉴定了SecoIridoid化合物p-HPEA-EDA,也鉴定在特制橄榄油中,但在果实中从未观察过,这可能是收获后酶活性的结果[2].其他橄榄酚类包括酚酸、酚醇(如羟基酪醇(3,4- dhpea)和酪醇(p-HPEA)、类黄酮和木脂素[3.].这些化合物在污水的所有部分中观察到,纸浆中的最高浓度[4].几种橄榄品种的果实也含有大量的毛蕊糖苷[5]和其他酚类存在于成熟时,如Homovanillic醇,3,4-二羟基乙酰乙酸(DHPAC),咖啡酸,P-香豆酸,氯酸,香草酸[6]和少量的橘子苷[7].
橄榄蛋白酶蛋白核桃蛋白,Exocarp,种子,石和叶片中酚醛型的研究表明,不同的组织含有不同的化合物。例如,在橄榄种子中仅观察到纳朱丙和沙西吡硼化硒酰基8]而黄酮类黄酮醇素-7-葡糖苷,芦丁和槲皮素专门存在于水果剥离中[9].
橄榄果中的其他化合物包括三萜酸,如谬误和烯醇酸[10.]生育酚[11.].
角鲨烯是甾醇途径的中间体,是α-和β-amyrin和三萜二醇、红二醇和uvaol的前体。角鲨烯是另一种已知对人体健康有影响的重要化合物,它只在橄榄油和其他植物油中有一定量的存在[12.].甾醇,如β-谷甾醇,环烯醇和24-甲基二氨基醇,当橄榄果达到最终尺寸和Veraison开始时逐渐积累[13.].
Secoiridoids不溶于油,机械提取后,只有一小部分在油中回收,代表了初榨橄榄油最重要的微量成分的健康和感官特性[14.].实际上,橄榄塞托卫生素在预防动脉粥样硬化和低密度脂蛋白过氧化的抑制中发挥作用[12.].众多研究清楚地证明,这些化合物表现出癌症预防性活动[15.]并可促进骨质疏松症的营养预防[16.].特别是Oleuropein,羟基吡咯醇[15.'油神经[2]显示对人类健康的影响。Secoiridoids有助于橄榄油的质量,影响油味,负责苦味和血液感官笔记以及作为原发性抗氧化剂,Secoiridoids参与氧化稳定性[5].
酚类在对环境提示的植物反应中发挥着至关重要的作用,是对脱叶昆虫的最重要的防御化合物[17.].它们还会影响芽的分枝[18.],并被假设保护细胞和防止真菌侵入形成层[19.,20.].一些数据支持对特定病原体的抗性也可能与某些类型的酚类有关[21.,22.].Oleuropein负责植物释放[23.]并且还是一种多价烷基化器,其用作理想的蛋白质交联剂,其表现出用于植物代谢物的最强的活性,这通过降低膳食蛋白的营养价值而产生不利影响食草动物[24.].
迄今为止,Secoiridoid代谢尚未澄清,但已经提出了一些烯糖物种的途径[25.,26.].secoiridoid积累是一种受控过程,其具有表达和组合物在品种,组织,发育阶段和响应于不同的环境条件中的显着变化[27.].
尚未表征调节橄榄果实中二次化合物的合成和降解的关键基因,除了涉及三萜生物合成中的几种基因[28.,29.],由于缺乏橄榄基因组序列的信息。最近发布了第一个橄榄果转录组数据[30.,31.],代表鉴定果实代谢参与基因的重要资源。
由于缺乏有效的诱变,转化和转换和缺乏有效的方案,难以在多年生木质物种中进行功能遗传学研究。在体外再生;因此,了解感兴趣特征的自然变化代表着一个有价值的工具。在植物科学中,目前正在试图研究基因表达和代谢数据集的整合研究代谢途径[32.].
这项工作的目的是提供进一步了解橄榄果实酚类化合物的进化,并确定其主要遗传决定因素。
结果与讨论
根据品种和果实发育阶段的酚类浓度
根据本化合物或经验信息的子组进行的许多研究,所选择的分析选择的品种代表了水果酚醛含量的高度变化。温柔的d 'Andria和Tendellone这是一种传统的食用橄榄,可以直接食用,不需要经过脱苦过程。据我们所知,我们的工作是第一次尝试直接比较在相同环境条件下生长的橄榄品种的酚谱。事实上,这些品种在意大利的不同地区,在不同的气候条件、土壤、水分有效性和农业技术下种植,这些都极大地影响了果实中的酚含量。此前对这些品种的分子特征已经确定,它们都是独立起源的,在高酚和低酚品种(Baldoni, unpub)之间没有观察到密切的遗传关系。数据)。
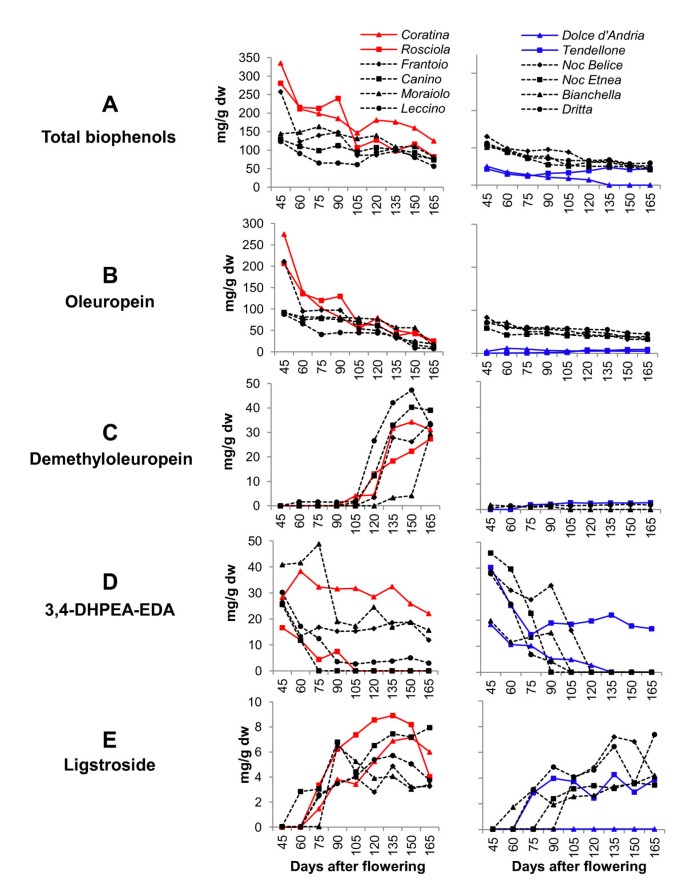
果实发育过程中的总酚含量降低,并在第一次采样时间(45个DAF),它范围为50至350 MGG-1对12个品种进行分析(图1A).主要化合物如橄榄苦苷、去甲基橄榄苦苷、3-4 DHPEA-EDA、ligstroside、tyrosol、hydroxytyrosol、毛蕊花苷和木脂素的浓度因品种而异,有些品种的平均酚水平高于150 mg g-1DW(Coratina和rosciola.),而其他人的水平低于50毫克-1DW(Tendellone和温柔的d 'Andria),剩余品种的水平平均为60至130 mg g-1DW(数字1和2额外的文件1额外的文件2和附加文件3.).
在高酚类(HP)栽培品种Coratina和rosciola.,橄榄苦苷代表了最丰富的化合物(高达82%的总数),在果座后浓度下降,正如之前在其他橄榄品种中观察到的[33.].在低酚类(LP)品种,Tendellone和温柔的d 'Andria,主要的酚类化合物不是大于15mg g-1dw在成熟过程的所有阶段(图1b),但3-4个Dhpea-EDA,果实开发开始时占酚类内容总量的94%。
而去甲基苦苷则相反,在果实发育的最后阶段积累,在105 DAF后积累,在cvs中含量最高。Coratina,Rosciola,弗朗托奥,Canino,Moraiolo,和Leccino.相反,只有痕量的该化合物(低于3mg g-1DW)被检测到Tubellone,Bianchella,和Dritta,去甲基oleuropein表达完全缺失温柔的d 'Andria,Nocellara del Belice和nocellara etnea,建议反应中的块导致该化合物的合成或积累(图1C)。在HP品种中,大型血红素浓度的逐渐降低与去甲基脲素含量的增加相对应。在具有最低浓度的油孔素的阶段观察到最高浓度的去甲基脲素。该观察结果支持从油孔蛋白酶的去甲基化的去甲基脲素衍生的假设,如先前所设想的et al。[1].此外,在LP品种和Nocellara del Belice,Nocellara Etnea,Bianchella和Dritta,Oleuropein表达和Demethyloleuropein含量在水果发育期间保持恒定的观察结果符合该假设。
在cvs的果实发育早期,化合物3-4 DHPEA-EDA占总酚类物质的比例是一致的。Tubellone,Dritta,Nocellara del Belice,和Nocellara Etnea,(分别为95%、31.5%、29.7%和42.3%),但大多数品种在90 DAF时其浓度降至接近0的值1d)。有趣的是,在温柔的d 'Andria它是在果实开发的早期检测到的唯一检测到的secoiridoid,表明在该品种的secoiatidoid合成中没有完全阻断,并且该化合物可以定位在油孔素前的途径上游,如Ryan报道et al。[8].
在所有表达ligstroside的品种中,该化合物的浓度随果实发育而增加(图1e)。这种趋势与Oleuropein观察到的趋势相反,这表明该化合物可能来自油冬芯,而不是作为其前体来衍生。
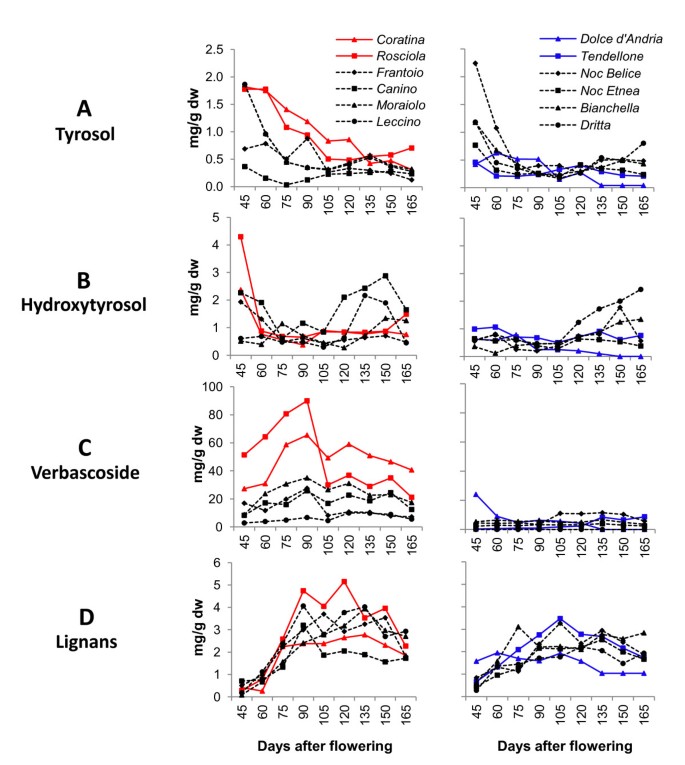
在酚类中,酪冬醇浓度显示出低于2mg g的降低模式-1DW,虽然羟基吡咯醇浓度低于4毫克-1DW,品种和果实发育阶段的轻微变异;值得注意的是,在120个DAF后观察到羟基吡喃醇浓度的轻微增加坎诺诺,Leccino,Dritta和Bianchella(图2A-B分别)。
毛蕊草苷,一种由酪醇/羟基酪醇和肉桂衍生物组成的分子[1]以一致量检测到(高达90 mg g-1dw)在Coratina和rosciola.在90 DAF时,其浓度保持在30 mg g以下-1在所有发展阶段的其他品种中DW(图2c),按照Jemai的结果et al。[34.].这些作者仅在CV的早期成熟阶段检测到术术。Dhokar.基于我们的数据,似乎橄榄水果,油脂和血管内的两种主要酚类化合物,含有常见的酪蛋白/羟基葡萄球菌部分,并没有显示任何明显的关系。
木脂素乙酰氧基吡诺酯和松脂醇(图2D)在果实发育过程中表现出适度的表达增加,前者大于后者。这些化合物的相对含量差异最大的是在温柔的d 'Andria,乙酰毒素素含量比Pinoreinol的含量高约10倍(附加文件4).
代谢分析使我们选择HP和LP品种进行进一步转录分析,因为这些品种的对比表型可能反映参与酚类代谢的基因表达的差异。
鉴定了从水果EST数据集中鉴定的主要次生代谢产物的合成的转录本
共有27个转录物(表1额外的文件5)从Olea Fruit Est数据库中识别[30.,35.选择次级代谢物途径中的推定功能,考虑到橄榄水果中存在的主要化合物,如脱丙固醇,酚醛酸,萜烯和甾醇(图3.).虽然参与secoiridoid途径的基因是未知的,因为它们只在有限数量的物种中合成,而这些物种的基因组序列数据还没有得到,但仍然有可能通过观察拟议的生物合成步骤来预测一些必需的酶功能。此外,许多提议的反应与那些在具有良好特征的植物物种中工作的平行途径相似(例如,在Catharanthus Roseus.)[36.- - - - - -38.].
选择最佳Tblastn评分的unigenes与在其他物种中功能形式的蛋白质序列的蛋白质序列选择用于后续转录分析。为了限制候选者的数量,仅考虑了由每叠角的EST数量推断出最高含量的表达水平的数量。事实上,考虑到酚类化合物代表橄榄果实最丰富的次生次生代谢物,我们认为代谢应该强烈地定向到它们的生物合成。已经报道了所选基因的E值和已知蛋白质的百分比(表1额外的文件5).尽管这种方法有一定程度的不确定性,需要进一步的研究来确认提出的功能,考虑到与已知蛋白质的相似性的候选基因的鉴定是一个强有力的方法,正如许多其他物种所证明的那样。
转录物已重新开始CVS。Coratina和温柔的d 'Andria并根据他们推定的功能命名。
在所选择的转录物中,有些转录物参与血浆2-C-甲基-D-赤藓糖醇4-磷酸(MEP)和胞岩甲酸胞菌(MVA)途径,而其他候选转录物涉及SecoIridoids的合成(单萜和酚类部分)),其他酚类,三萜类化合物和甾醇(表1).
此外,一个编码LUPS (LUPS)的橄榄基因[Genbank: AB025343]参与了酵母中三萜的生物合成[28.]被认为是表达分析。
从cDNA-AFLP分析鉴定其他转录物
为了确定可能在次生代谢中发挥作用但未包含在果实EST数据集中的基因,我们进行了cDNA-AFLP分析。比较HP cvs的果实转录谱。Coratina和rosciola.和lp cvs。Tendellone和温柔的d 'Andria在三个发育阶段(45,90和165个DAF)中,允许鉴定显示差异表达模式的93片段。对于59个片段,获得高质量序列并针对蛋白质数据库喷射。四十五个转录物(约76%的选定序列)与具有已知功能的蛋白质显示出显着的相似性。这些转录物的BLAST结果和表达式模式如附加文件所示6.cDNA-AFLP序列与果实EST数据库中的条目匹配,由于品种等位基因变异、EST序列不确定或同一家族的不同基因,差异较小。
Blast2GO分析的结果可以根据三个主要的基因本体论词汇对表达的序列进行注释。大多数转录本编码推定的蛋白质具有结合或催化活性(分别为44%和37%)(附加文件7).
其中24份转录本的表达谱通过半定量PCR (sqPCR)分析得到证实,23份转录本的表达谱与cDNA-AFLP分析中观察到的表达谱相似(附加文件)8).
七份转录物(17,7%)涉及Secoiridoids的合成或降解(表1).转录物的序列OeDXS,Oendhd,Oegt.,OeADH, OeCuAO,Oeglu.和OePOX使用RACE-PCR分别延伸至574,643,1050,790,1843,857和1,182bp。序列OeNDHD和OePOX包括完整的编码和部分5'和3'UTR区域。
的OeDXS序列具有较高的同一性(同一性86%,相似性92%)DXS.II型[Genbank:CAD22531]M. Truncatula.,这是涉及次生新陈代谢,较低的BLASTP得分(79%的身份,86%相似)DXS.I型[Genbank:CAD22530],建议在初级新陈代谢中发挥作用[39.].
橄榄果MRNA的定量表达分析
从EST Datasets鉴定的28个候选基因的表达和来自CDNA-AFLP分析的七种选定的基因,用于使用RT-QPCR的特征在于依赖于锡,酚醛化,萜烯和甾醇代谢的酶的酶的诱导编码,以检测可能的相关性代谢数据。
该分析在45,90和165个DAF中使用HP的果实进行(Coratina)及LP (温柔的d 'Andria)品种。
推测参与MEP和MVA途径的转录本的相对表达
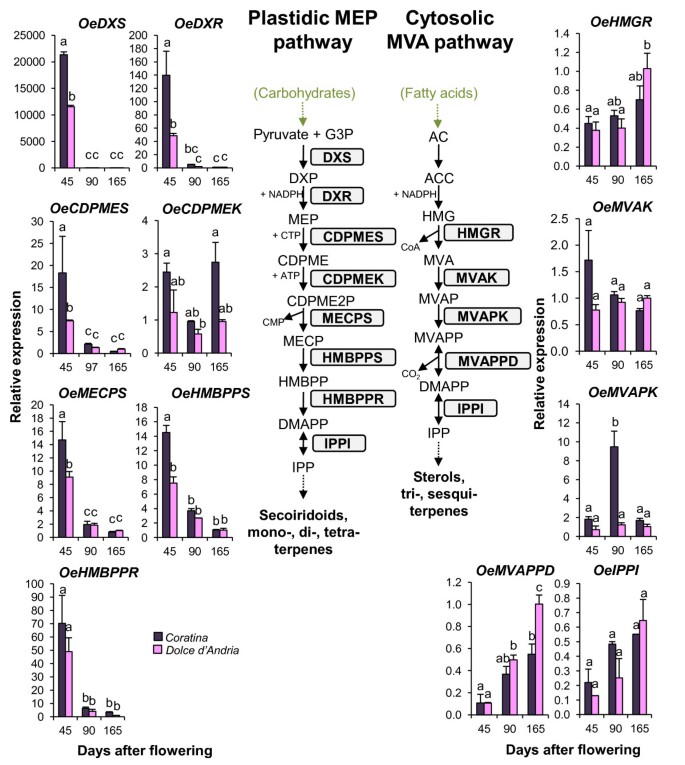
在高等植物中,所有三萜类化合物,异戊烯基二磷酸(IPP)和二甲基丙烯酸二磷酸二磷酸(DMAPP)的五碳积木可以衍生自体积局部化的MEP途径和细胞溶质MVA途径。两种途径中的酶和相关基因是众所周知的并且已经表征。
推测参与MEP途径的6个转录本(OeDXSOeDXROECDPMES,OEMECPS.和oehmbppr.和oehmbpps.)(附加文件9)表达从45个DAF表达到后续发育阶段的强烈显着降低,而OECDPMEK.没有显示出显着的表达调制(图4).OeDXSOeDXR和oehmbppr.具有最强的差异表达,这与它们在MEP通路中的关键作用一致,这已经在其他植物中被提出[40- - - - - -42.].特别是,我们的结果表明OeDXS,参与MEP途径的第一步,在两个品种的第一个发育阶段(45 DAF)均有特异性表达。根据目前的研究,dsx有两种类型。I型在光合组织中组成表达,可能参与初级代谢中类异戊二烯的生物合成,如类胡萝卜素和植物醇,而II型DXS似乎参与类异戊二烯的生物合成以进行专门代谢[43.].在橄榄中有可能有多于一个DXS同种型,以及我们的推导的氨基酸序列OeDXS显示相似之处DXS.II型,表明其参与Secoiridoid生物合成而不是初级代谢的异戊二烯。据报道,葡萄一个DXS.基因与主要QTL共同定位,影响单萜含量[44.,它被认为是麝香葡萄酒风味的来源[45.].在45个DAF,OeDXSOeDXROECDPMES,OEHMBPPR.明显更加表达Coratina比在温柔的d 'Andria.OeIPPI,编码涉及MEP和MVA途径的酶,用于将IPP转化为二甲基allyl焦磷酸(DMAPP),在样品中没有显示出显着的表达差异(图4).
借助于涉及MEP和MVA途径的基因的表达。使用RT-QPCR测定,借助于2-C-甲基-D-赤藓糖醇4-磷酸(MEP)和甲戊酸(MVA)途径的基因的mRNA表达,以及这些途径的示意图。G3P:甘油醛3-磷酸盐;DXP:1-脱氧-D-Xylulose-5-P;DXS:DXP合成酶;DXR:DXP氧化氢异构酶;MEP:2-C-甲基-D-erythrool-4-P;CDPME:4-(CDP)-2-C-甲基-D-赤藓糖醇;CDPMES:CDPME合成酶;CDPMEK:CDPME激酶;CDPME2P:4-(CDP)-2-C-甲基-D-eryThrool-2-P; MECP: 2-C-methyl-D-erythritol 2,4-cyclo-PP; MECPS: MECP synthase; HMBPP: 1-hydroxy-2-methyl-2-(E)-butenyl-4-PP; HMBPPS: HMBPP synthase; HMBPPR: HMBPP reductase; DMAPP: Dimethylallyl diphosphate; IPP: Isopentenyl diphosphate; IPPI: IPP delta isomerase; AC: Acetyl-CoA; ACC: Acetoacetyl-CoA; HMG: 3-hydroxy-3-methylglutaryl-CoA; HMGR: HMGC reductase; MVAK: MVA kinase; MVAP: mevalonate phosphate; MVAPK: MVAP kinase; MVAPP: Mevalonate diphosphate; MVAPPD: MVAPP decarboxylase; and DAPP: Dimethylallyl diphosphate. The relative mRNA levels are expressed as ΔΔCt. Bars = ±SE, n = 3. Different letters indicate significant differences between samples, as determined using analysis of variance (Bonferroni’s post hoc tests, P < 0.05).
这四种转录本推测编码的酶参与了MVA途径(OeHMGR,oemvak.,Oemvapk.,OEMVAPPD.)与MEP转录物相比,显示出完全不同的曲线。特别是,OeHMGR和oemvak.在发育阶段或品种中没有显示出强烈差异,除了在CV中以165个DAF的表达较弱增加。Coratina(图4).
鉴定了两种酶Hmgr的同种型咖啡阿拉伯里卡同种型的水果和转录物cahmgr1.仅在水果开发的初始阶段表达,而同种型cahmgr2.构成表达[46.].这两种同种型也可以在橄榄果中表达,并且可能已经鉴定了本构形式。
Coratina Oemvapk.在果核硬化处表达较多(90 DAF),在温柔的d 'Andria,在三个发育阶段均有相同水平的表达。OEMVAPPD.果实开发期间mRNA增加,总是更高度表达(高达13倍)Coratina比在温柔的d 'Andria.
与MVA途径的转录本不同,MEP途径的转录本在果实发育过程中表达模式与secoiridoid一致,表明MEP途径在橄榄中也存在,可能参与了secoiridoids的萜类部分。这些结果与其他植物的研究结果一致,其中MEP和MVA途径产生不同的萜类。事实上,人们普遍认为,MEP途径衍生的香叶基二磷酸(GDP)和香叶基二磷酸(GGDP)被用于质体中作为单萜、二萜和四萜合成的底物,而胞质中MVA途径获得的法尼基二磷酸(FDP),参与三萜和倍半萜的生物合成[47.].然而,已经记录了这两种不同的IPP生物合成途径之间的串扰,并且每个途径对各类萜烯生物合成的相对贡献仍然不确定[48.].在橄榄中,只发布了对比报告[49.],表明MVA途径在Secoiridoid地层中的参与ofereae.但不提供酶学和分子数据。
近秒状萜烯萜部分生物合成参与的转录物的相对表达
导致形成锡萜和锡骨萜烯和酚类部分的生物合成步骤仍然没有很好地阐明,因此,参与这些途径的酶仍然不确定。
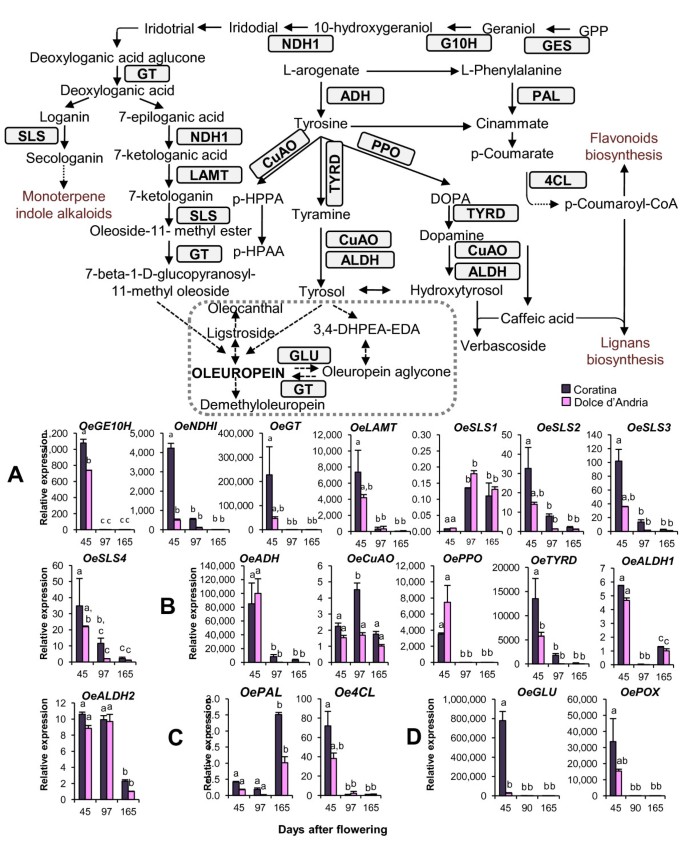
缺乏涉及Secoiridoids的三萜部分的合成的转录物(附加文件10.),Oeges.,OeGE10H,OeNDHD,oegt.,Oelamt.和Secologanin合酶的额定编码的四个转录物,Oesls1.,Oesls2.,Oesls3.和Oesls4.,分析了(图5A).它们的表达量从45 DAF急剧下降到165 DAF,变化最大的是在45和90 DAF之间,这与果实成熟过程中观察到的橄榄苦苷浓度的衰减有关。品种间也有显著差异OeGE10H和OeNDHI,这似乎更加表达Coratina比在温柔的d 'Andria在45个DAF。
推测参与环烯醚萜类和其他酚类化合物代谢的基因的表达。推测参与萜烯生物合成的基因的mRNA表达一个)和酚基(B),用于苯丙素的生物合成(C)、酚类化合物的降解,以及它们代谢的示意图。RT-qPCR检测mRNA水平。充电器:香叶醇合成酶;G10H:香叶醇10-hydroxylase;NDHI: NADH脱氢酶I;GT: SLS: Secologanin synthase;LAMT:马酸甲基转移酶;抗利尿激素:Arogenate脱氢酶;CuAO:铜胺氧化酶;p-HPPA:p- 羟基苯吡咯酸;p-HPAA:p- 羟基苯基乙酸;Tyrd:酪氨酸/多糖脱羧酶;ALDH:酒精脱氢酶;PPO:多酚氧化酶;PAL:苯丙氨酸氨酶;和4CL:4-香豆素辅酶是一个连接酶。相对mRNA水平表示为ΔΔct。条=±SE,n = 3.不同的字母表示使用方差分析确定的样本之间的显着差异(Bonferroni的Hoc测试,P <0.05)。灰色虚线盒包括Secoiridoids化合物。虚线箭头表示不确定的生物合成步骤。
GES是一种参与香叶醇合成的单萜合成酶[50.[GE10H是一种细胞色素P450单氧基酶,其在C-10位置羟基化单萜类聚苯基醇以产生10-羟基甲基醇。据报道,该酶涉及虹膜单萜类化合物的生物合成,以及在各种植物物种中观察到的几种单萜类化合物[51.].喂养实验紫丁香和fraxinus.(OleAeae系列中的其他属)表明,甲氧化物型Secoiridoids的生物合成通过Iridodial进行[25.,26.,52.],其可能来自大竺葵和10-羟基吡喃醇[1,49.,53.](附加文件10.).有趣的是,最近已显示使用在体外酶的分析也是一样Oeges1.我们分析的是涉及Geraniol的合成[54.[展示了我们识别酚类生物合成的候选转录物的方法的有效性。
g10hc . roseus也叫(CRG10H)还催化纳林宁的3'-羟基化,以产生与催化活性效率的ERIODICTYOL,与Geraniol羟化相比,催化活性效率为10倍。这些研究表明,除了在Terpenoids的代谢中的先前描述的作用外,G10h在黄酮类化合物中起重要作用[51.].基于这些研究,我们不能排除OEG10H也可能参与橄榄中的黄酮类生物合成。
尽管NDHI和GT是不同途径所需的酶,但强烈的差异表达OeNDHI和oegt.在LP和HP品种以及在水果发育的不同阶段,表明SecoIridoid代谢中这些转录物的推定作用。这些酶可能在途径的各个步骤中发挥作用。NDHI可能在两者中工作,虹膜转化为脱氧糖酸性酸性酸和7-丙醛酸的转化率至7-酮糖酸。Terpenic和酚类级分需要GTS,将葡糖基团转移到脱氧阳氨酸中,以形成脱氧糖酸,甲钠11-甲酯至7-β-1-D-吡喃葡萄糖糖基11-甲基 - 甲基糖苷和催化的OleulopeinOleuropein糖苷酮,这是途径的最后一步(附加文件10.).
3,4- dhpea - eda在环烯醚酮通路上的位置仍有争议。它被认为是橄榄苦苷的衍生物,由内源性β-葡萄糖苷酶降解产生[14.](附加文件2),或作为导致橄榄苦苷形成的替代生物合成途径的中间化合物[1,8,55.].编码酶的基因表达的高水平表达促进3,4-Dhpea-EDA转化为Oleuropein,例如oegt.在HP cv中,水果发展的早期阶段。Coratina支持3,4-DHPEA-EDA的假设作为油核素前体。该假设在观察中发现了3,4-DHPEA-EDA是在CV中检测到的唯一的塞托曲线。温柔的d 'Andria在果实开发的早期阶段,表明下游块可能会阻止形成其他塞多瓦片。
在O. EuropaeaSecologanin和Secoxyloganin的氮氧化物可以是油肺蛋白素的前体[49.,53.].将7-酮蛋白转化为油苷-11-甲酯所需的氧化类似于拟机,以便将Loganin转化为Secologanin。因此,我们认为编码该酶功能的基因可能与Secologanin合酶(一种细胞色素P450酶)具有高序列相似性。此外,Loganin和Secologanin在Secoiridoid生物合成中发挥的作用Olea Europaea仍然存在争议,不能排除这些化合物可能是Secoiridoid生物合成的中间体[52.],进一步支持Secologanin合酶的参与。
在水果EST数据库中,我们确定了四个成绩单(Oesls1.Oesls2.Oesls3.Oesls4.)显示与Secologanin合酶的高相似性。使用RT-QPCR分析,Oesls2.Oesls3.Oesls4.显示了一种类似于其他转录本的模式,包括在环烯醚萜合成,支持他们参与这一途径的假设。然而,Oesls1.在第一次取样时表现出低水平的表达,随后增加。这个结果可以用假定的介入来解释Oesls1.在其他植物物种中报道的其他次级化合物的生物合成,例如萜烯吲哚生物碱[56.]而不是在油冬芯合成中发挥重要作用。
7-酮烷酸的甲基化可能通过类似于逻酸O-甲基转移酶(LAMT)的酶催化,其将逻酸与Loganin(分别为7-酮糖酸和7-酮烷蛋白的基础)转化为功能表征c . roseus也叫(CrLAMT),表明该酶对马酸底物具有很高的特异性[38.].因此,我们确定了一个推定的橄榄同源物(Oelamt.) 的兰特基因。
患有酚类生物合成的转录物的相对表达
SecoIidoids的酚类部分可能衍生自酪氨酸,并通过酪蛋白进行[1,8](附加文件11.).在大多数植物中,酪氨酸由芳酸脱氢酶(ADH)由芳酸脱羧合成(ADH)[57.,58.,而羟酪醇则由酪氨酸通过多巴胺和多巴胺合成。近年来,对羟基酪醇的生物合成进行了研究Olea Europaea使用培养细胞[59.].在其他植物物种中报道了酪冬醇形成的另一种途径,其中酪术可能由a制成p-香豆酸前体,主要由苯丙氨酸衍生[60.].然而,在橄榄中,从未证明这种替代途径的存在。相反,已经提出了来自酪蛋白素的两条替代路线:考虑韧带剂作为直接油肺蛋蛋白前体的替代路线[49.[其他通过Oleuropein糖苷酮[8](附加文件11.).替代的生物合成途径被提出用于血管内酯,例如通过多巴胺或通过羟基吡咯醇从酪胺或来自羟基吡喃醇[59.].
图中给出了推定的橄榄酚生物合成途径的示意图5根据上面讨论的先前发现。基于这些发现,我们搜索了秘诀涉及塞焦异丙醇的酚部分的生物合成和其他相关酚类化合物,例如酪术,羟基羟基吡咯和血管内。
我们选择并分析了以下可能在考虑的途径中起作用的基因:oeadh.OeCuAOOePPOoetyrd.OeALDH1和OeALDH2.ADH脱羧,产生酪氨酸的芳酸酯[61.].Cuao将各种化合物与生物活性胺一起脱去,产生它们相应的氨基醛,H2O2和nh.3.[62.].PPO催化器o单苯酚的 - 羟基化o-diphenols,它可能涉及酚类代谢的不同步骤[63.].酪氨酸中酪氨酸中的酪氨酸和多巴胺中的DOPA中的转化需要类似于酪氨酸/多糖脱羧酶(Tyrd)的酶[64.,65.].将酪胺与酪术和多巴胺转化为羟基吡喃醇,需要氨基 - 氧化酶(AO)和醇脱氢酶(ALDH)[59.,60.].
六个基因中的四种表达谱(oeadh.,OePPO, OeTYRD和OeALDH1)与烯醚萜含量相关,在果实发育过程中下降,类似于涉及萜类部分的基因(图5b)。MRNASoeadh.,OePPO和oetyrd.仅在45 DAF时出现,而OeALDH1和OeALDH2在第一次采样中更高度表达,并随着水果发育强烈减少。oetyrd.更有表达Coratina与45个DAF相比温柔的d 'Andria.只有OeCuAO在90 DAF处表达较高,在165 DAF处表达较低Coratina, 然而OeCuAO在开发过程中表达仍然不变温柔的d 'Andria.
在苯丙醇丙醇代谢中,研究了两个关键基因:朋友和4 cl.它们参与了大群化合物的合成,例如黄酮类化合物,木质素和血管内酯。表达oepal.在165 DAF水平上,两品种均有显著性差异OE4CL.仅在两种品种的第一次取样时显示出最高表达(图5故选Coepal.165 DAF的mRNA水平与花青素的积累一致,果子颜色的变化与紫色黑色的果实颜色发生在本阶段[66.].观察到的相反趋势OE4CL.与木脂素和黄酮类化合物含量无关。事实上,木脂素的浓度在所有品种的果实生长过程中先升高后降低,而主要的类黄酮,芦丁和木犀草素7- o -葡萄糖苷,据报道在橄榄果实成熟过程中升高[67.].它可能是OE4CL.可能与木兰类或类黄酮形成无关,但具有独特的苯基丙醇末端产物,如一些物种,例如拟南芥,白杨和大豆(AspeNis)[68.].
推测参与酚类降解的转录本的相对表达
假定的表达Oeglu.和OePOX分析了直接同源。GLU和POX酶参与酚类降解;此外,GLU还参与了橄榄苦苷和ligstroside衍生物的形成[5](附加文件2).
Oeglu.在果实发育早期(45 DAF)几乎全部表达Coratina, 然而OePOX在两个品种中几乎都只表达45 DAF(图5d)。这些型材类似于考虑因素涉及Secoiridoid合成的转录物的谱。这些结果证实了这些酶在导致90和165个DAF中观察到的酚醛浓度降低的过程中的作用,并且每当油孔素,它们的主要基质的可用性发生时,它们的表达可能会下调[69.].类似的机制可以解释LP品种中两种类型的转录物观察到的较低表达,其中缺乏大型油蛋白素可能是由于其生物合成中涉及的酶的调控而不是其降解。
推测参与萜类和甾醇生物合成的转录本的相对表达
表达osel.,推测导致柠檬烯的合成,一种重要的挥发性单萜,在果实发育过程中表现出强烈的变异。特别是,在两个被分析的品种中,它几乎都在最后一次取样时被检测到(图)6A).这一模式与未成熟和成熟水果中的柠檬烯含量完全一致[70].
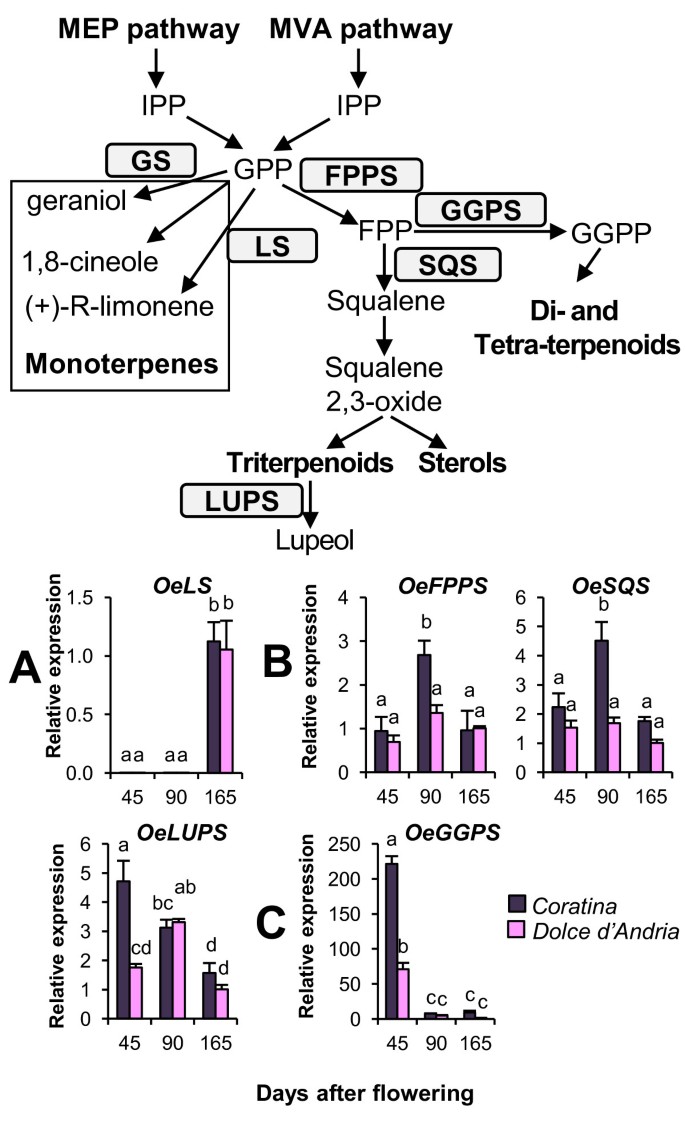
推测参与萜类和甾醇生物合成的转录本的表达。缺乏挥发性单波培生物合成涉及基因的mRNA表达(一个),三萜类化合物和甾醇(B),二萜件(C),使用RT-QPCR确定,以及该途径的示意图。IPP:异戊烯基二磷酸;GPP:二烷基二磷酸;充电器:香叶醇合成酶;LS:Limonene合成酶;FPP:法呢基二磷酸盐;FPPS:FPP合成酶;GGPP:Geranyl Geranyl焦磷酸盐;GGPS:GGPP合成酶;SQS:squalene合成酶; LUPS: Lupeol synthase. The relative mRNA levels are expressed as ΔΔCt. Bars = ±SE, n = 3. Different letters indicate significant differences between samples as determined using analysis of variance (Bonferroni’s post hoc tests, P < 0.05).
OE.FPPS和oesqs.我们还分析了导致角鲨烯合成的两种关键酶的mRNA水平,它们的表达量在90 DAF时达到峰值Coratina(图6B)值得注意的是,角鲨烯氧化物在果实发育开始时就合成了重要的化合物,如山楂酸和齐墩果酸以及α-和β-amyrin [13.].观察到的表达曲线OEFPPS.和oesqs.的Coratina与这些调查结果一致。相比之下,未观察到发育阶段的差异温柔的d 'Andria.
表达曲线基因果实中的表达谱,碱基碱的形成和在酵母中的功能表征的催化[28.,从未被分析过。我们的OeLUPS在45 DAF处显示了两个品种间不同的mRNA表达谱(图6答案:BCoratina比在温柔的d 'Andria在最后两个阶段,它们的模式是一样的。这些结果可以解释为角鲨烯和三萜在果实发育过程中积累的不同温柔的d 'Andria;然而,这些化合物在该品种中的积累尚未被研究。
在45 DAF时,两品种叶片中GGPS的mRNA表达量均高于其他发育阶段,在45 DAF时,GGPS的mRNA表达量均高于其他发育阶段Coratina(图6C)。我们的结果与在橄榄果发育的第一阶段内的类胡萝卜素的积累符合[71.].
结论
我们的研究代表了通过评估在不同果实发育阶段的综合品种中主要酚类化合物的含量来表征患有次疗法中的次生代谢的候选基因的转录概况。这些方法使我们旨在鉴定次生代谢物的候选基因。
我们观察到整体代谢物含量的强烈变化,在特定化合物的水平和基因型和果实发育阶段的积累趋势中。Coratina和rosciola.以45个DAF的最高的油孔浓度为特征。相比之下,温柔的d 'Andria和Tendellone显示所有阶段的最低内容。有趣的是,我们鉴定了以完全没有其他化合物的特征的基因型。特别是,Nocellara del Belice,温柔的d 'Andria和nocellara etnea没有积累去甲基呋喃啉,和温柔的d 'Andria是唯一含有所有Secoiridoids的多样性,除了果实发育早期3,4-Dhpea-EDA。这些发现可能来自导致这些化合物的生物合成的酶促步骤中的嵌段。
当Oleulopein降低时,发生韧带钠的积累的证据,使空间留给韧带素可以从油核苷酸衍生的假设而不是相反的假设。
在品种中,酚类谱的观察到差异可能会反映其生物合成和积累的调节方面的巨大变化。这种可变性可以利用育种程序,以增加重要酚类化合物的果实组成。
橄榄果实EST数据集的最近开发允许使用基于序列相似性的方法的基因信息外推。我们使用先前表征或在其他物种中具有指定功能的蛋白质序列。检测到的高度相似度允许我们预测酶类,并且具有一定程度的近似,底物特异性。作为一种互补方法,CDNA-AFLP分析证明是一种有效的技术,用于分离差异表达的转录物而没有任何序列相似度假设。
基于这些方法,我们鉴定了36个转录本,并对它们的表达谱进行了特征分析,并与相应的代谢物谱相关联。
果实发育过程中特定代谢物的含量与可能参与其生物合成的转录本的表达之间存在很强的相关性,这表明代谢物的含量在转录水平上受到调节,并加强了拟途径中候选基因的参与。在某些基因表达上观察到的差异Coratina和温柔的d 'Andria这可能表明橄榄基因型中参与次级代谢的转录本有不同的调节作用。
特别是,在果实发育过程中,根据橄榄苦苷浓度的下降,大多数推测参与萜类和酚类生物合成的转录本的水平都出现了强烈的下降,许多参与环烯醚萜通路的基因在HP cv中表达较高。Coratina与LP cv相比。温柔的d 'Andria.
我们观察到MEP途径和secoiridoid转录谱之间的相关性,支持了该途径而不是MVA途径主要促进secoiridoid生物合成的假设。
有趣的是,单萜类固醇和酚类生物合成的一些关键基因,如OeDXS,Oeges.,OeG10H和oeadh.当检测到最高秒的秒形骨化浓度时,完全在最早的采样中表达。这些基因可能在水果发育过程中调节这些化合物的积累。
柠檬烯和GGPP生物合成的代谢和转录数据之间也有很强的相关性。osel.当检测到该化合物的最高水平时几乎完全在发育阶段表达。oeggpps.如在其他研究中所报道的那样,借助于类胡萝卜素生物合成,仅在幼叶中表达,当时这些化合物的最高水平出现。
这些数据提供了这种作物物种的功能遗传学研究的有用信息,以及鉴定与影响橄榄果和油的营养素和含油性质的化合物和代谢物的积累有关的功能标志物。
方法
植物材料
根据先前关于其油的酚醛概况的信息,选择以下品种,提出果实酚醛含量的高水平变异:Bianchella,坎诺诺,Coratina,温柔的d 'Andria,Dritta,Frantoio.,Leccino,Moraiolo.,Nocellara del Belice,nocellara etnea,rosciola.和Tendellone.水果用于酚醛成分和cDNA-AFLP分析从45到165天之后盛开(DAF)每15天从植物的橄榄品种收集的实验农场CRA-OLI (Collececco Spoleto,佩鲁贾)在意大利中部(42°48”48 N, 12°39 15”E,海拔356米)。记录取样日果实的物候期。植物是在相同的环境和农艺条件下生长的。为了避免不同水平的水分可用性对树木间酚含量的可能影响,定期监测树木的水分状况,并根据需要偶尔进行灌溉,以使所有植物在采样期间(数据未显示)保持在黎明前水势的相似值。采收后立即用液氮冷冻,在−80°C下保存,待进一步分析。
评价酚类化合物
根据Servili进行酚类化合物的提取et al。[72.),很少有修改,简单地说,3 g的橄榄果实中果皮和外果皮单一化使用匀浆器/ S N(自由/开源软件电动、丹麦)在100毫升的甲醇/水的溶液80:20%,后跟两个进一步均化50毫升的甲醇/水80:20使用Ultra-Turrax T 25 (IKA Staufen,德国)。在37°C氮气流动下真空蒸发甲醇后,进行固相萃取(SPE)从水提取物中分离酚类物质。在固相萃取过程中,900毫克的萃取液高负荷C18.装1ml橄榄提取物,以50ml甲醇为洗脱溶剂。
HPLC分析采用Selvaggini法et al。[73.,使用Spherisorb ODS-1 250 mm x 4.6 mm色谱柱,粒径为5μm (Phase Separation Ltd., deside, UK)。
使用半制备高性能液相色谱(HPLC)分析进行酚类分离,其中9.4mm I.D.500 mm whatman partisil 10 ods-2半浸渍柱;流动相是水(pH 3.1)(a)/甲醇(b)的水中的0.2%乙酸,流速为6.5ml / min,使用二极管阵列检测器(爸爸)进行苯酚检测。使用HPLC测试从直接提取中获得的所有化合物的纯度,并使用核磁共振(NMR)验证其化学结构,在先前的研究中报告了相同的手术条件[72.].考虑以下酚类化合物:Oleuropein,Demethyloleuropein,3,4-Dhpea-EDA,韧带,酪术,羟基羟基吡咯,血管病和木质素。
识别酚类化合物代谢的MRNA
源自Olea EST数据库的序列[35.,共有102,000多张Olea EuropaeaL.水果EST通过454批量测序技术产生读取[30.[分析,分析以鉴定携带萜类化合物,酚类和其他次生代谢物合成的途径的转录物。参与感兴趣的途径和在基因组(KEGG)数据库的京都环族(KEGG)数据库中发表的基因氨基酸序列74.,75.]用于使用基本的局部对准(TBLASTN)在Olea EST数据库中搜索橄榄同源物。对于使用多个独特转录物代表的那些基因,仅使用最大的CONTIG和/或代表最多数量的单身数进行分析。从该集合获得的序列包括异戊二烯(MVP和MEP途径),苯基丙醇,萜烯(单萜,锡,脱萜,二萜和三萜),苯酚,甾醇,木兰和黄酮类生物合成,导致橄榄中存在的主要次生代谢产物水果。所有感兴趣的成绩单都在HP和LP品种中重新开始,Coratina和Dolce d'Andria分别使用基因特异性引物(附加文件12.).
cDNA-AFLP分析
使用Rneasy植物迷你试剂盒(QIAGEN)从果实Mesocarp和Exocarp中分离总RNA,并用DNase I(QIAGEN)处理除去污染基因组DNA。两个HP的样品(Coratina和rosciola.)及两份LP (Tendellone和温柔的d 'Andria)考虑三个采样(45,90和165个DAF)的品种。
PolyA RNA用oligo dT Dynabeads (Invitrogen)从约50 μg总RNA中分离得到。所有纯化的mRNA用SuperScript III (Invitrogen公司)按照制造商的18 bp oligo d(T)协议合成第一链cDNA。双链(ds) cDNA是通过将第一链产物与30 U的DNA聚合酶I (Invitrogen)和3 U的RNase h (Invitrogen)在含有20 mM Tris-HCl, 75 mM KCl, 10 mM (NH)的反应混合物中在16°C孵育2 h合成的4)2所以4, 5毫米氯化镁2和1 mm dtt。随后,在1%琼脂糖凝胶上评估10μL每样的每样样品,并且在500至4,000bp之间可见澄清的DNA涂片。使用苯酚/氯仿程序纯化样品,并在波长为260nm的分光光度计进行量化。
根据Bachem和Codorkers进行CDNA-AFLP程序[76.,只做了一些修改。以10 U的酶切量,以50 μl的体积消化500 ng的cDNAMSE我和20你生态在37°C下2小时。将消化混合物连接至5pmol生态RI适配器和50 pmol的MSEi适配器使用68 u of t4连接酶(新英格兰biolabs)。将反应在37℃下进行2小时。用于前置放大的PCR反应溶液(50μL)含有10μL的消化混合物,使用适配器构建的每种引物的75ng,0.2mM DNTP混合物,1.5mm Mg2+1 U Taq聚合酶(Invitrogen)。PCR反应条件为:94℃2 min, 94℃30秒,56℃1 min, 72℃1 min, 72℃7 min, 25个循环。扩增前产物5 μl,稀释1:10,每条选择引物60 ng, 1.5 mM Mg进行选择性扩增2+,0.2mM DNTP混合物和1U的Taq聚合酶,总反应体积为20μL。使用含有3和2个选择性底漆的选择性引物的共20种组合使用生态ri和MSE分别为赋予荧光素的赋予器。使用以下循环参数进行触控PCR:94℃,2分钟,13个循环:94℃,30秒,65°C(-0.7°C /循环)30秒,72°C为72°C min, 23 cycles at 94°C for 30 sec, 56°C for 30 sec and 72°C for 1 min, followed by 72°C for 7 min. The selected PCR product (5.7 μl) was denatured at 96°C for 12 min and separated on a 4% denatured polyacrylamide gel, pre-run at 6 Watts for 10 min and run at 125 Watts for 1.75 h at 50°C in Genomyx GX 100 (Beckman Instruments, Fullerton, CA). The gel was scanned, and the separated fragments were visualised on a gel using fluorescent emission. Any differentially expressed fragment was excised from the gel, treated in a speed vacuum for 30 sec and incubated in a 100 μl volume of water overnight at 4°C. A total of 5 μl of each sample was reamplified with 50 ng of the same primers used in the preamplification procedure, 1.5 mM Mg2+,0.2mM DNTP混合物和1U的Taq聚合酶,总反应体积为20μL。使用以下条件进行PCR反应:94℃2分钟;35周期:94℃,30秒,56℃,1分钟,72℃,1分钟,其次为72℃,7分钟。在琼脂糖凝胶上运行5μL等份的PCR混合物,并用聚乙二醇(PEG)8000纯化剩余的反应。在10μlH中洗脱cDNA片段2O,直接测序或亚克隆到pGEM-T Easy Vector (Promega),然后用QIAprep Spin Miniprep kit (Qiagen)纯化质粒。使用3130基因分析仪(Applied Biosystems, Foster City, CA)对片段进行测序。
该序列与NCBI的非冗余蛋白序列(NR)数据库对齐[77.]使用BLASTX,其还计算蛋白质相似性并预测了未知片段序列的假设函数。
所有在cDNA-AFLP分析中差异表达的序列,使用Blast2GO软件v1.3.3根据3个主要的基因本体学类别(细胞成分、生物过程和分子功能)进行注释[78.,79.根据Galla和同事[31.],微不足道的修改。所有序列也使用BLASTN算法对齐至OLEA EST数据库以检测可能的同源转录物。
使用直接GO to Enzyme注释对注释序列进行酶标,该程序还用于查询KEGG图,以确定主要代谢途径涉及。使用保守域数据库(CDD)识别保守域[80,81].
进一步表征了显示与相应代谢物的含量相容的表达谱的序列。使用RACE-PCR方法在3'和5'末端延伸片段,得到长部分或全长cDNA克隆。得到的序列用于确认每个化合物的推定功能。使用智能种族cDNA扩增套件(CLONTECH)进行RACE-PCR,具有一些修改。简而言之,使用3'CDS引物II A和智能II寡核苷酸(CLONTECH),将总RNA(2μg)逆转录。将反应孵育在含有50mM Tris-HCl pH 8.3,75mM KCl,6mM MgCl的溶液中2在42°C下,2mm DTT为1.5小时,用上标III(Invitrogen)。对于第二链合成,使用具有ExTaq(Takara)的小等分试样(1/20体积)的初级模板,5'PCR引物II A(CLONTECH)和基因特异性引物进行触控PCR。使用以下条件进行热循环程序:初始变性步骤为94℃,2分钟,其次为30秒的16个循环,68℃,30秒,每周期0.5°C减少0.5°C72℃3分钟。在94℃下进行另外的20个循环30秒,60℃,30℃,72℃,3分钟,最终伸长步骤在72℃下进行5分钟。在某些情况下需要嵌套的PCR以改善扩增的特异性。使用PEG 8000纯化样品,并且在用3130遗传分析仪(Applied Biosystems,CA)克隆到PGEM-T易载体中后直接测序或测序。
半定量rt - pcr
为验证cDNA-AFLP选择克隆的差异表达模式,对24个转录本进行了初步的半定量PCR实验。使用RNeasy Plant Mini Kit (Qiagen)从用于cDNA-AFLP分析的橄榄样品的生物复制中分离出2 μg总RNA。根据制造商的协议,用SuperScript III进行cDNA合成。伸长率因子(EF1α.)作为样本归一化的内源性基因[31.].具体的EF1α.采用引物对cDNA样品进行归一化处理,总反应体积为25 μl,第一链cDNA按1:50稀释,1.5 mM Mg2+, 0.2 mM dNTP混合物和1.25 U Taq聚合酶(Invitrogen)。PCR扩增条件如下:94°C 3 min,在94°C 30秒,60°C 30秒,72°C 50秒,72°C 7 min, 20 ~ 45个循环(取决于非饱和PCR条件下扩增的信号强度)。根据条带强度将cdna归一化。样品归一化后,利用前面描述的条件,用包含限制性位点序列的16 bp特异性引物(生态我和MSEI)用于cDNA-AFLP分析和片段特异性区域(附加文件13.)验证任何感兴趣基因的表达和等位基因多态性。
定量RT-QPCR
对次级代谢物地图的主要分支的最代表性候选者进行RT-QPCR实验。RT-QPCR在最强大的37个推定转录物的子集上进行,以验证它们的表达曲线是否对应于Secoiridoid,酚类和其他次级代谢物的形式合成或降解。Coratina和温柔的d 'Andria用作参考HP和LP品种。用RNEasy植物迷你试剂盒(QIAGEN)从0.2g水果Mesocarp和Exocarp中提取总RNA,并用DNase I(QIAGEN)处理。使用寡核苷酸(DT)进行2μgRNA的逆转录18.根据制造商的说明,上标III逆转录酶试剂盒(Invitrogen)。根据制造商的协议,对PCR实时7300(Applied Biosystems,Foster City,CA)进行定量实时PCR,并使用试剂盒进行Sybr绿色分析(应用生物系统)和基因特异性引物(附加文件14.).经琼脂糖凝胶电泳后,PCR产物单条带的存在验证了引物。所有反应均为3个重复。每次分析后,进行解离动力学分析,以验证扩增产物的特异性。计算所有mrna的相对数量——ΔΔCT方法 [82],其中Δct= ct目标基因- CT.参考基因使用Dolce d'Andria165 DAF作为对照样品。管家伸长因子1-α基因用作内源性参考基因,用于cDNA标准化。使用差异分析(ANOVA)分析三种生物复制的数据,然后用BOOC的后HOC测试(P <0.05)进行R软件(2.14.0版)[83].
缩写
- DAF:
-
开花后的日子
- 惠普:
-
高的酚醛树脂
- LP:
-
低酚类
- CVS:
-
畴
- RT-QPCR:
-
实时逆转录聚合酶链反应
- G3P:
-
甘油醛3-磷酸盐
- DXP:
-
1-脱氧-D-木糖糖-5-P
- DXS:
-
1-脱氧-D-木糖-5-P合成酶
- DXR:
-
1-脱氧-D-木糖糖-5-P还原异构酶
- MEP:
-
2-C-甲基-D-erythritol-4-p
- CDPME:
-
4-(CDP)-2-C-甲基-D-赤藓糖醇
- CDPMES:
-
2-C-甲基-D-赤藓糖醇4-磷酸胞嘧啶细胞基转移酶
- cdpmek:
-
4-(CDP)-2-C-甲基-D-赤藓糖激酶
- CDPME2P:
-
4-(CDP)-2-C-甲基-D-eryThrool-2-P.
- MECP:
-
2-C-methyl-D-erythritol 2, 4-cyclo-PP
- MECPS:
-
2-C-methyl-D-erythritol 4-cyclodiphosphate合成酶
- HMBPP:
-
-butenyl-4-PP 1-hydroxy-2-methyl-2 (E)
- HMBPPS:
-
1-羟基-2-甲基-2-(e) - 丁烯基-4-PP合成酶
- HMBPPR:
-
1-hydroxy-2-methyl-2——(E) -butenyl-4-PP还原酶
- DMAPP:
-
Dimethylallyl二磷酸
- IPP:
-
异戊烯基二磷酸酯
- IPPI:
-
异戊烯基二磷酸二磷酸二磷酸异构酶
- AC:
-
乙酰CoA
- ACC:
-
乙酰乙酰基 - COA
- HMG:
-
3-hydroxy-3-methylglutaryl-CoA
- HMGR:
-
HMGC还原酶
- MVAK:
-
MVA激酶
- MVAP:
-
纯磷酸盐
- mvapk:
-
mvap激酶
- MVAPP:
-
甲戊二醇酯二磷酸
- mvappd:
-
甲羟戊酸二磷酸脱羧酶
- DAPP:
-
Dimethylallyl二磷酸
- 电气:
-
小醇合成酶
- G10H:
-
小醇10-羟化酶
- ndh1:
-
NADH脱氢酶I.
- GT:
-
葡萄糖基转移酶
- SLS:
-
Secologanin合酶
- LAMT:
-
律酸甲基转移酶
- ADH:
-
Arogenate脱氢酶
- CuAO:
-
铜胺氧化酶
- p-HPPA:
-
p- 羟基苯基吡咯酸
- p-HPAA:
-
p-hydroxyphenylacetic酸
- TYRD:
-
酪氨酸/多糖脱羧酶
- ALDH:
-
醇脱氢酶
- PPO:
-
多酚氧化酶
- 朋友:
-
苯丙氨酸ammonia-lyase
- 4 cl:
-
4-香豆素辅酶是一个连接酶
- GPP:
-
香叶二磷酸
- LS:
-
柠檬烯合成酶
- FPP:
-
通过二磷酸
- FPPS:
-
通过二磷酸合酶
- GGPP:
-
焦烷基焦磷酸甘油磷基
- GGPS:
-
香叶基香叶基焦磷酸合酶
- SQS:
-
Squalene合成酶
- 羽扇:
-
Lupeol合成酶。
参考
- 1。
HK,Prentler Pd,Ryan D,Servili M,Tyaticchi A,Esposto S,Robards K:来自Olea Europaea L. Nat Prod Rep.2008,25(6):1167-1179的生物合成和生物转移。10.1039 / B719736E。
- 2。
林俊杰,李春华,李春华,李春华,李春华,李春华:特级初榨橄榄油中布洛芬类活性的植物化学研究。自然科学学报。2005,437(7055):45-46。10.1038 / 437045。
- 3.
Oliveras López MJ, Innocenti M, Ieri F, Giaccherini C, Romani A, Mulinacci N: HPLC/DAD/ESI/MS检测西班牙和意大利油橄榄果实中木脂素的含量。食品科学,2008,21:62-70。10.1016 / j.jfca.2007.04.012。
- 4.
Owen RW,Haubner R,Mier W,Giacosa A,Hull We,Spiegelhalder B,Bartsch H:培养橄榄滴水中主要酚类和黄酮化合物的分离,结构阐明和抗氧化潜力。食品化学毒素。2003,41(5):703-717。10.1016 / s0278-6915(03)00011-5。
- 5。
Servili M, Selvaggini R, Esposto S, Taticchi A, Montedoro G, Morozzi G:初榨橄榄油亲水酚的健康和感官特性:影响其在油中出现的农学和技术方面的生产。中国有色金属学报,2003,23(4):427 - 434。
- 6。
Boskou G, Salta FN, Chrysostomou S, Mylona, Chiou A, Andrikopoulos NK:希腊市场鲜橄榄的抗氧化能力和酚谱。食品化学学报,2006,29(4):558-564。10.1016 / j.foodchem.2004.12.005。
- 7。
B:超声辅助固液萃取(USLE)对橄榄酚类化合物的研究。食品化学。2010,123(1):175-182。
- 8。
Ryan D,AntoLovich M,Herlt T,Prenzer Pd,Lavee S,Robards K:鉴定新型橄榄栽培哈迪猛犸象组织中酚类化合物。JAgric Food Chem。2002,50(23):6716-6724。10.1021 / JF025736P。
- 9.
Servili M,Baldioli M,Selvaggini R,Macchioni A,Montedoro G:橄榄果的酚类化合物:Nuzhenide的单一和二维核磁共振特征及其在果实组成部分中的分布。JAgric Food Chem。1999,47(1):12-18。10.1021 / JF9806210。
- 10。
Goulas V,Manganaris Ga:朝着橄榄果中测定三萜酸的有效方案:干燥和提取方法的比较研究。Phytochem肛门。2012,23(5):444-449。10.1002 / PCA.1378。
- 11.
Dabbou S,Issaoui M,Esposto S,Sifi S,Tyaticchi A,Servii M,Montedoro Gf,Hammami M:突尼斯初学和欧洲介绍的橄榄油次要化合物的品种和日益增长的面积影响。J SCI食物农业。2009,89:1314-1325。10.1002 / jsfa.3588。
- 12.
Waterman E,洛克伍德B:橄榄油的活性成分和临床应用。22(4):331-342。
- 13。
STITI N,Triki S,Hartmann Ma:在Olea Europaea Frouthy中形成三萜类化合物。脂质。2007,42(1):55-67。10.1007 / s11745-006-3002-8。
- 14。
Servili M,Montedoro GF:酚类化合物对初榨橄榄油质量的贡献。欧洲血脂科技杂志。2002,104:602-613。10.1002 / 1438-9312(200210)104:9/10 <602 :: AID-EJLT602> 3.0.co; 2-x。
- 15.
Omar Sh:Oleuropein在橄榄质及其药理作用。SCI Pharm。2010,78(2):133-154。10.3797 / scipharm.0912-18。
- 16。
Puel C,Mathey J,Agalias A,Kati-Coulibaly S,Mardon J,Clowet C,Davicco MJ,Lebecque P,Horcajada Mn,Skaltsounis Al等,Skaltsounis Al等:Oleuropein,橄榄油多酚的作用的剂量 - 反应研究大鼠骨质损失的卵巢切除术/炎症实验模型。Clin Nutr。2006,25(5):859-868。10.1016 / J.CLNU.2006.03.009。
- 17。
Mumm R,Hilker M:针对致命昆虫的直接和间接化学防御。趋势植物SCI。2006,11(7):351-358。10.1016 / J.Plants.2006.05.007。
- 18。
Umehara M, Hanada A, Yoshida S, Akiyama K, Arite T, Takeda-Kamiya N, Magome H, Kamiya Y, Shirasu K, Yoneyama K, et al .:新萜类植物激素对植物分枝的抑制作用。《自然》,2008,455(7210):195-200。10.1038 / nature07272。
- 19.
贮藏酚类细胞:在植物抗枯萎病和一般防御反应中细胞程序性死亡和周皮形成的关键?植物营养与肥料学报。2000,19(4):441 - 446。10.1006 / pmpp.2000.0287。
- 20。
叶松林树皮对树皮甲虫和其他害虫的解剖和化学防御。植物学报,2005,27(2):353-375。10.1111 / j.1469-8137.2005.01436.x。
- 21。
ONCHELS FS,Eyles A,McPherson Ba,Wood DL,Bonello P:海岸的酚类化学活性橡木反应对植物冬季ramorum感染。J Chem Ecol。2007,33(9):1721-1732。10.1007 / s10886-007-9332-z。
- 22。
Wallis C, Eyles A, Chorbadjian R, McSpadden Gardener B, Hansen R, Cipollini D, Herms DA, Bonello P:系统诱导韧皮部次生代谢及其与奥地利松树抗溃疡病的关系。植物生态学报,2008,32(3):457 - 461。
- 23。
Kubo I,Matsumoto A,Takase I:苦橄榄橄榄欧洲欧洲欧洲欧洲欧洲欧洲欧洲欧洲欧洲欧洲橄榄球(Oleaceae)的多化防御机制。Oleuropein是一种phytoalexin前体吗?J Chem Ecol。1985,11:251-263。10.1007 / BF00988207。
- 24。
Konno K,Hirayama C,Yasui H,Nakamura M:酶活性的油孔:蛋白交联剂用作Privet树中的化学防御。PROC NATL ACAD SCI。1999,96(16):9159-9164。10.1073 / pnas.96.16.9159。
- 25。
Damtoft S,Franzyk H,Jensen SR:Fontanesia中Secoiridoids的生物合成。植物化学。1995,38(3):615-621。10.1016 / 0031-9422(94)00683-k。
- 26。
Damtoft S,Franzyk H,Jensen SR:紫荆花和植物中的虹膜素生物合成:碳环虹塑前体。植物化学。1995,40(3):785-792。10.1016 / 0031-9422(95)00210-x。
- 27。
橄榄(Olea europaea L.)叶片提取和加工过程中橄榄苦苷和其他酚类化合物的回收率和稳定性。农业环境科学学报,2008,6:8-13。
- 28。
Shibuya M, Zhang H, Endo A, Shishikura K, Kushiro T, Ebizuka Y:植物氧化角鲨烯环化酶分子进化中lupol合酶基因的两个分支。王志强,王志强。生物化学研究进展。中国生物医学工程学报。1999,27(1):1 - 7。10.1046 / j.1432-1327.1999.00875.x。
- 29。
Saimaru H,Orihara Y,Tansakul P,Kang Yh,Shibuya M,Ebizuka Y:通过欧洲欧洲橄榄肉细胞悬浮培养生产三萜酸。Chem Pharm Bull(东京)。2007,55(5):784-788。10.1248 / cpb.55.784。
- 30.
Alagna F,D'Agostino N,Torchia L,Servili M,Rao R,Pietrella M,Giuliano G,Chiusano ML,Baldoni L,PerrotaG:比较454在水果开发期间的两种橄榄基因型的转录物的比较454焦点。BMC基因组学。2009,10:399-10.1186 / 1471-2164-10-399。
- 31。
Galla G, Barcaccia G, Ramina A, Collani S, Alagna F, Baldoni L, Cultrera NG, Martinelli F, Sebastiani L, Tonutti P:油橄榄果实发育过程中差异表达基因的计算注释。生物技术学报。2009,29(9):1281 - 1289。
- 32。
Saito K, Hirai MY, Yonekura-Sakakibara K:用共表达网络和代谢组学解码基因——“预言者的大多数报告”。植物科学进展,2008,13(1):36-43。10.1016 / j.tplants.2007.10.006。
- 33。
Morello JR,Romero MP,Motilva MJ:橄榄果实果实成熟过程对阿尔卡内纳,Farga和Morrut品种的脱水和油的酚类分数。JAgric Food Chem。2004,52(19):6002-6009。10.1021 / JF035300P。
- 34。
Jemai H,Bouziz M,Sayadi S:突尼斯甜橄榄品种关于果实成熟的酚类组成,糖含量和抗氧化活性。JAgric Food Chem。2009,57(7):2961-2968。10.1021 / JF8034176。
- 35。
Olele EST数据库:Olea EST数据库。http://140.164.45.140/ oleaestdb/,
- 36。
Collu G,Unver N,Peltenburg-Looman Am,Van der Heibden r,Verpoorte r,Memelink J:Geraniol10-羟基化酶,一种涉及Terpenoid Indole生物碱生物合成的细胞色素P450酶。费用。2001,508(2):215-220。10.1016 / S0014-5793(01)03045-9。
- 37。
Irmler S, Schroder G, St-Pierre B, Crouch NP, Hotze M, Schmidt J, Strack D, Matern U, Schroder J: Catharanthus roseus吲哚生物碱的生物合成:新的酶活性和细胞色素P450 CYP72A1作为secologanin合成酶的鉴定。植物学报,2000,24(6):797-804。10.1046 / j.1365 - 313 x.2000.00922.x。
- 38。
Murata J, Roepke J, Gordon H, De Luca V: Catharanthus roseus叶表皮层揭示了其生化特化。植物学报。2008,20(3):524-542。10.1105 / tpc.107.056630。
- 39。
沃尔特MH,HANS J,Strack D:编码1-脱氧-D-木糖糖5-磷酸合成酶的两个远端相关基因:射击中的差异调节和逐渐积累的菌根菌根。工厂J.2002,31(3):243-254。10.1046 / J.1365-313x.2002.01352.x。
- 40.
Cordoba E,Salmi M,Leon P:解开调节高等植物MEP途径的调节机制。J Exp Bot。2009,60(10):2933-2943。10.1093 / JXB / ERP190。
- 41。
Estevez JM,Cantero A,Reindl A,Reichler S,Leon P:1-脱氧-D-Xylulose-5-磷酸合酶,植物中塑性异戊二酚生物合成的限制酶。J Biol Chem。2001,276(25):22901-22909。10.1074 / jbc.m100854200。
- 42。
兴S,Miao J,Li S,Qin G,唐S,Li H,Gu H,曲LJ:破坏1-脱氧-D-木糖-5-磷酸盐还原酶(DXR)基因导致白化病,矮化和缺陷拟南芥中的滴毛组发起和气孔闭合。细胞res。2010年,20(6):688-700。10.1038 / Cr.201010.54。
- 43。
Zulak kg,Bohlmann J:Terpenoid生物合成和针叶树防御专用血管细胞。J Intent Plant Biol。2010,52(1):86-97。10.1111 / J.1744-7909.201010.00910.x。
- 44。
battillana J, Costantini L, Emanuelli F, Sevini F, Segala C, Moser S, Velasco R, Versini G, Stella Grando M: 1-脱氧-d: -木糖5-磷酸合酶基因与影响葡萄单萜含量的主要QTL共定位。应用电子学报。2009,118(4):653-669。
- 45。
陈志强,陈志强,陈志强,等。葡萄中麝香香气的基因关联研究。植物生态学报。2010,30(4):481 - 486。
- 46。
Tiski I,Marachini P,Pot D,Vieira Lg,Pereira LF:两个cDNA编码3-羟基-3-甲基谷辅酶的表征和表达咖啡(Coffea Arabica L.)中还原酶异构族。omics。2011,15(10)):719-727。
- 47。
Aharoni A, Jongsma MA, Kim TY, Ri MB, Giri AP, Verstappen FWA, Schwab W, Bouwmeester HJ:植物萜类生物合成代谢工程。植物化学学报。2006,5:49-58。10.1007 / s11101 - 005 - 3747 - 3。
- 48。
Dudareva N, Andersson S, Orlova I, Gatto N, Reichelt M, Rhodes D, Boland W, Gershenzon J:非甲戊酸途径支持金鱼草花中单萜和倍半萜的形成。中国科学(d辑:地球科学),2005,32(3):534 - 538。10.1073 / pnas.0407360102。
- 49。
杨志强,王志强,王志强:木犀科植物环烯醚萜苷的合成。植物化学。1993,34(5):1291-1299。10.1016 / 0031 - 9422 (91) 80018 - v。
- 50。
Iijima Y,Gang Dr,Fridman E,Lewinsohn E,Pichersky E:来自甜罗勒的绒毛腺体的大醇合成酶的表征。植物理性。2004,134(1):370-379。10.1104 / pp.103.032946。
- 51.
宋ph, Huang FC, Do YY, Huang PL:香叶醇10-羟化酶的功能表达揭示了其在萜类和苯丙类生物合成中的双重功能。农业食品化学学报,2011,59(9):4637-4643。10.1021 / jf200259n。
- 52。
Jensen SR,Franzyk H,Wallander E:奥莱核桃的趋化工:Iridoids作为分类标记。植物化学。2002,60(3):213-231。10.1016 / S0031-9422(02)00102-4。
- 53。
Soler-Rivas C,EspìnJC,Wichers HJ:Oleuropein和相关的化合物。J SCI食物农业。2000,80:1013-1023。10.1002 /(SICI)1097-0010(20000515)80:7 <1013 :: AID-JSFA571> 3.0.co; 2-C。
- 54。
Vezzaro A,KRAUE ST,Nonis A,Ramina A,Degenhardt J,Ruperti B:萜烯合成酶的分离和表征可能涉及成熟橄榄(Olea Europaea)果实的风味发展。J植物理性。2012,169(9):908-914。10.1016 / j.jplph.2012.01.021。
- 55。
Ryan D, Prenzler PD, Lavee S, Antolovich M, Robards K:不同品种(Olea europaea)猛犸象(Mammoth)生理发育过程中酚含量的数量变化。农业食品化学学报,2003,51(9):2532-2538。10.1021 / jf0261351。
- 56。
王俊杰:单萜吲哚生物碱合成的化学与生物学研究。国家自然科学基金,2003,23(4):532-547。10.1039 / b512615k。
- 57。
Legrand P, Dumas R, Seux M, Rippert P, Ravelli R, Ferrer JL, matinge M: Synechocystis arogenate dehydrogenase的生化特性和晶体结构为催化反应提供了线索。结构学报,2006,14(4):767-776。10.1016 / j.str.2006.01.006。
- 58。
Rippert P, Puyaubert J, Grisollet D, Derrier L, matinge M:拟南芥质体内合成酪氨酸和苯丙氨酸。植物生理学报。2009,49(3):1251-1260。10.1104 / pp.108.130070。
- 59。
Saimaru H,Orihara Y:Olea Europaea培养细胞中的雌激素生物合成。J Nat Med。2010,64(2):139-145。10.1007 / s11418-009-0383-z。
- 60.
张爵士,马LQ,yu hs,张h,王ht,qin yf,shi gl,王yn:酪氨酸脱羧酶催化Salidroside生物合成途径在Rhodiola sachalinensis中的初始反应。植物细胞批准。2011,30(8):1443-1453。10.1007 / s00299-011-1053-7。
- 61.
Rippert P,Matringe M:具有两个高度相似且活性蛋白质结构域的拟南芥芳樟醇脱氢酶的分子和生物化学特征。植物mol biol。2002,48(4):361-368。10.1023 /答:1014018926676。
- 62.
Sebela M,Frebort I,LEMR K,Brauner F,PEC P:C3和C4脂族二胺植物铜胺氧化酶反应的研究。拱生物学生生物糖。2000,384(1):88-99。10.1006 / ABBI.00.2081。
- 63.
Ortega-Garcia F,Blanco S,Peinado MA,Peragon J:多酚氧化酶及其与橄榄(Olea Europaea)CV水果和叶片的大量血红素浓度的关系。在果实成熟期间的“皮肤”树。树生理。2008,28(1)):45-54。
- 64.
Guillet G,Poupart J,Basurco J,De Luca V:色氨酸脱羧酶和酪氨酸脱羧酶基因在烟草中的表达导致改变的生化和生理表型。植物理性。2000,122(3):933-943。10.1104 / pp.122.3.933。
- 65.
Facchini PJ,De Luca V:罂粟中酪氨酸/多糖脱羧酶的差异和组织特异性表达。J Biol Chem。1994,269(43):26684-26690。
- 66。
Agati G, Pinelli P, Cortes Ebner S, Romani A, Cartelat A, Cerovic ZG:用原位叶绿素荧光光谱法无损评价橄榄(Olea europaea)果实花色苷。农业工程学报,2005,53(5):1354-1363。
- 67。
戈麦斯- rico A,萨尔瓦多MD,弗雷加帕尼G:品种和成熟对西班牙橄榄果实及其相应的初榨橄榄油中微量成分的影响。国际粮食与环境研究,2008,31(4):423 - 427。10.1016 / j.foodres.2008.02.003。
- 68。
Kumar A,Ellis是:4-作香豆酸盐:CoA Ligase基因家族在Rubus Idaeus:cDNA结构,演化和表达。植物mol biol。2003,51(3):327-340。10.1023 /答:1022004923982。
- 69。
Sivakumar g,uccella n,briccoli bati c:Demethyloleuropein和β-葡萄糖苷酶活性在橄榄水果中。Biotechnol J. 2007,2(3):381-385。10.1002 / Biot200600118。
- 70。
Flamini G, Cioni PL, Morelli I:油橄榄叶、果实和初榨油的挥发物。来自意大利的Olivastra Seggianese。农业食品化学学报,2003,51(5):1382-1386。
- 71。
Roca M, Minguez-Mosquera MI:不同橄榄品种(Hojiblanca, Picual和Arbequina)果实生长和成熟期间的类胡萝卜素水平。植物营养与肥料学报。2003,19(4):451-459。10.1078 / 0176-1617-00759。
- 72。
Servili M,Badioli M,Selvaggini R,Miniati E,Macchioni A,Montedoro GF:高效液相色谱评价橄榄水果,初榨橄榄油,植被水域和焊渣和ID-核磁共振特征。J AM Oil Chem SoC。1999,7(76):873-882。
- 73。
Selvaggini R, Servili M, Urbani S, Esposto S, Taticchi A, Montedoro G:直接注射高效液相色谱-荧光检测法评价初榨橄榄油中的酚类化合物。农业工程学报。2006,54(8):2832-2838。10.1021 / jf0527596。
- 74。
基因和基因组(Kegg)的Kyoto百科全书。http://www.genome.jp/kegg.,
- 75.
Kanehisa M,Araaki M,Goto S,Hattori M,Hirakawa M,Itoh M,Katayama T,Kawashima S,okuda S,Tokimatsu T,等,用于将基因组联系到生活和环境。核酸RES。2008,36(数据库问题)):D480-D484。
- 76。
基于AFLP的RNA指纹技术可视化差异基因表达:分析马铃薯块茎发育过程中的基因表达。植物学报,1996,9(5):745-753。10.1046 / j.1365 - 313 x.1996.9050745.x。
- 77。
国家生物技术信息中心。http://blast.ncbi.nlm.nih.gov,
- 78。
Conesa A,Gotz S,Garcia-Gomez JM,Terol J,Talon M,Robles M:Blast2Go:功能基因组学研究中的注释,可视化和分析的通用工具。生物信息学。2005,21(18):3674-3676。10.1093 / Bioinformatics / BTI610。
- 79。
BLAST2GO软件,。http://www.blast2go.org.]
- 80.
保守域数据库(CDD):保守域数据库(CDD)。http://www.ncbi.nlm.nih.gov/structure/cdd/wpsb.cgi.]
- 81.
Marchler-Bauer A, Anderson JB, Chitsaz F, Derbyshire MK, dewees - scott C, Fong JH, Geer LY, Geer RC, Gonzales NR, Gwadz M,等:CDD:基于保守域数据库的特定功能注释。核酸Res. 2009, 37(数据库版):D205-D210。
- 82.
Livak KJ,Schmittgen Td:使用实时定量PCR和2(-Delta Delta C(T))方法分析相对基因表达数据。方法。2001,25(4):402-408。10.1006 / meth.2001.1262。
- 83.
R项目。www.r-project.org.,
致谢
该研究得到了Olea-Genomics和橄榄基因组学和育种的支持,由MIPAF,意大利资助的橄榄油资助,由Project FISR - 提高了植物食品的植物食品的风味和营养特性,意大利的研究部。
作者信息
隶属关系
相应的作者
额外的信息
利益争夺
提交人声明他们没有竞争利益。
作者的贡献
LB, MS, FA构思了研究计划。SC、SU、GV、SE、AT采用高效液相色谱法对橄榄酚类化合物进行分析。AR和SC监测和控制树木植物水分状况。FA进行cDNA-AFLP分析。FA和FP从EST数据中鉴定候选基因。FA和RM进行RT-qPCR实验,并对候选基因进行重测序。FP和FA对RT-qPCR数据进行统计分析。FA和LB起草了手稿。FP, GP, MS, AR和RR对手稿进行了严格的修改。所有作者阅读并批准了手稿。
电子辅料
橄榄果实主要酚类化合物的化学结构。
附加文件1:Secoiridoid葡萄糖苷(Oleuropein,Demethyloleuropein,韧带)和血管内酯(在橄榄水果中观察到的羟基毒态衍生物)(来自Serviliet al。[5])。(PDF 13 KB)
环烯醚萜衍生物形成的可能生化机制。
附加文件2:来自Servili的图形et al。[5].(PDF 53 KB)
12870_2012_1089_moesm3_esm.pdf.
文件3:橄榄果实中果皮和外果皮中总酚的平均浓度。(PDF 86 KB)
12870 _2012_1089_moesm4_esm.pdf
文件4:橄榄果实中松脂醇和乙酰氧基松脂醇含量。研究了12个品种(45、60、75、90、105、120、135、150和165 DAF)果实成熟过程中松脂醇(A)和乙酰氧基基松脂醇(B)的含量。红色和蓝色线分别代表高(HP)和低(LP)品种。图中没有显示标准误差,因为这些值低于5%。(PDF 20 KB)
12870 _2012_1089_moesm6_esm.pdf
附加文件6:通过cDNA-AFLP分析获得的转录衍生片段(TDF)。显示与已知蛋白质的相似性,其推定功能,GenBank登录号,他们在Olea数据库中的表达趋势和同源物的相似性的片段。(PDF 166 KB)
12870 _2012_1089_moesm7_esm.pdf
附加文件7:GO条款分发。GO术语分布在生物过程(a),分子函数(b)和细胞组分(c)词汇表中。(PDF 8 KB)
cDNA-AFLP(A)和SQ-PCR(B)之间的比较显示了相同的表达模式。
附加文件8:报告了LP的一些示例(温柔的d 'Andria和Tendellone)和惠普(Coratina和rosciola.)三个阶段的果实成熟(1,2,3分别对应于45,90,165个DAF)的品种。伸长因子1α用作参考基因(c)。据报道,推定的热休克蛋白紫酸性磷酸酶,1,3-β-葡糖苷酶,富勒沙霉素叶绿体前体,多糖酶酶和4-羟基-3-甲基丁基-2-烯基二磷酸还原酶。(PDF 194 KB)
12870_2012_1089_moesm9_esm.pdf.
附加文件9:Secoiridoids等异性单位的生物合成。报道了异戊二烯化生物合成的MEP途径。通过DXP合成和还原,获得MEP并通过透磷苷部分的转移转化为CDPME。CDPME磷酸化至CDPMEP并将其循环至MECP。在氧化反应CDPMS降至HMBPP之后,最终转换为IPP或DMAPP。(PDF 117 KB)
Secoiridoids三萜部分的生物合成。
附加文件10:制备油肺素萜烯部分的生物合成步骤Olea Europaea根据Obiedet al。[1报告了一些修改。根据我们的数据,我们提出在橄榄水果中,用于Secoiridoid合成的脱氧醇来自MEP途径。通过一系列羟基化和氧化反应在大竺葵中进行,然后是环化反应产生。进一步的氧化产生虹膜和脱氧糖酸糖苷。将脱氧糖酸转化为7-epi- 通过环戊烷环的羟基化,羟基酸氧化以形成7-酮糖酸。将酯化反应转化为7-酮糖酸至7-酮糖蛋白,随后,通过酮酮氧化产生甲钠11-甲酯。在通过葡萄糖苷转移酶催化的反应中,将油皂苷11-甲酯转化为7-β-1-D-吡喃葡萄糖糖基11-甲基醇溶糖苷,这是韧带和油孔素的前体。(PDF 99 KB)
环烯醚萜酚基团的生物合成。
额外的文件11:用于生产油孔素和3,4-DHPEA-EDA的生物合成途径Olea Europaea,据瑞安说et al。[8据报道。第一的p用酶胺氧化酶脱次脱羟苯基丙氨酸(酪氨酸)以形成p- 羟基苯基吡咯酸。随后,p通过脱羧的脱羧剂产生 - 羟基苯基乙酸p- 羟基苯基吡咯酸。通过减少p-hydroxyphenylacetic酸,p形成羟基苯基乙醇(酪蛋白),并通过与油皂苷的一系列缩合反应,该产物产生韧带,3,4-DHPEA-EDA和Oleuropein。(PDF 83 KB)
12870_2012_1089_moesm12_esm.pdf.
附加文件12:用于扩增橄榄次级代谢物合成中涉及的转录物的引物。提供了引物序列和扩增子尺寸。(PDF 24 KB)
作者的原始提交的图像文件
权利和权限
本文在BioMed Central Ltd.的许可下发布了这是一个开放的访问文章,根据Creative Commons归因许可(http://creativecommons.org/licenses/by/2.0)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
Alagna, F, Mariotti, R, Panara, F。et al。橄榄酚类化合物:果实发育过程中的代谢和转录谱。BMC植物BIOL.12,162(2012)。https://doi.org/10.1186/1471-2229-12-162
已收到:
接受:
发表:
关键字
- Olea Europaea
- 酚类
- Secoiridoids
- RT-qPCR
- 转录组
- 次生新陈代谢