摘要
背景
苋属cruentus而且答:hypochondriacus是亚热带国家为生产粮食而种植的作物。最近,大规模转录组数据的产生为研究初级代谢的代表性基因提供了可能,从而更好地理解这些物种耐落叶的生化机制。采用多级方法进行基因表达分析、酶活性和代谢物测量。
结果
昆虫食草(HD)或机械损伤(MD)引起的落叶导致所有被检测组织中非结构性碳水化合物(NSC)的快速和短暂减少。这与叶片蔗糖溶解活性的短期诱导、液泡转化酶及其抑制剂的差异基因表达以及蔗糖转运蛋白基因的诱导有关。脱叶植物叶片淀粉含量与β-淀粉酶-1基因的酶解活性和表达呈负相关,与可溶性淀粉合酶基因呈正相关。根中脂肪酸的积累与磷酸烯醇丙酮酸/磷酸转运体基因的高表达相一致。在所有组织中,大多数代谢物库都有长期的补充,这使得受损的植物保持不变的生长和产量。adp -葡萄糖焦磷酸化酶和液泡转化酶基因启动子分析表明存在独联体-支持它们对落叶反应的调控元件。HD和MD对转录物、酶活性和代谢产物的影响存在差异。然而,转录物丰度与酶活性之间的相关性非常有限。酶、代谢物水平与生长和繁殖参数之间有较好的相关性。
结论
综上所述,籽粒苋菜叶片、茎和根中NSC储量的迅速减少和长期恢复是其耐受落叶的基础。这需要基因/酶的协调作用,这些基因/酶受到叶片损伤方式的不同影响。籽粒的脱叶耐受是一个复杂的过程,仅在转录组水平上不能完全解释。
背景
属苋属植物由60多个物种组成。它属于苋科这个家族还包括甜菜,菠菜,土荆芥几种盐生植物[1].他们是C4双子叶一年生植物,其中许多是无处不在的杂草(例如。答:spinosus,答:tuberculatus而且答:retroflexus),而其他(例如:答:三色而且答:hybridus),都是富含维他命和矿物质的叶面蔬菜,主要分布在亚洲和非洲[2,3.].它们也可能是谷物的来源答:caudatus,答:cruentus而且答:hypochondriacus).后者是伪谷物,其氨基酸平衡良好,消化后可能释放生物活性肽,角鲨烯含量相对较高,因而能够产生具有高营养和营养价值的种子[3.,4].它们是耐寒植物,能够在贫瘠的土壤或不利的生长条件下生长,主要是低水分利用率、高盐度和/或高光照强度[3.,5,6].
蔬菜和谷物苋属植物据报道,在野外条件下,某些物种会受到草食昆虫的高侵扰率,这对生产力有不同的影响[7,8].对落叶的耐受力答:hybridus与地上营养生物量相比,地下生物量的投资更大,主要是由于开花前碳水化合物(CHOs)和氮资源分配到主根[9,10].植物苋菜已被证明能很好地从蚱蜢和鳞翅目幼虫造成的食草动物伤害中恢复过来[11].然而,某些害虫可显著降低粮食产量,并增加根和茎真菌病原体的倒伏和感染风险[12- - - - - -14].鳞翅目幼虫在籽粒苋菜的早期发育阶段导致叶片脱落,也被发现会导致植株大小和产量的长期减少[2,15,16].在干旱胁迫条件下,虫害危害更大[8].对照实验表明苋属植物物种可以从完全的机械落叶中完全恢复,对适应度和产量的影响很小,甚至可以忽略不计(Vargas-Ortiz E,未发表数据)。此外,墨西哥某些地区还采用机械去除10- 40%的谷物苋菜植物的初级芽,以提高二次分枝和生物量生产力[17].
植物可以通过部署大量的直接和/或间接防御来应对包括落叶在内的伤害[18,19].然而,当产生防御的成本较高或防御的资源需求与生长和繁殖的资源需求相竞争时,受损的植物可能会发生生理变化,如休眠分生组织的激活、植物结构的修改、光合能力的增强和/或在生长、储存和繁殖之间的资源分配等,以应对落叶所带来的压力[20.- - - - - -22].
植物的源库关系和碳分配受到复杂的代谢和信号网络的调控[23].贮藏器官的碳水平影响源组织的净光合活性,而叶片中光合作用相关酶的表达则受糖水平的影响[24- - - - - -26].然而,糖调控源基因表达的机制在C4植物仍相对未经研究[27].
以往的研究大多集中在生态背景下的籽粒苋菜的落叶响应。在这里,我们进行了一项更全面的研究,涉及多方面的方法,包括基因组、启动子、基因表达和代谢产物分析以及酶活性测定。两种不同的落叶处理,昆虫食草(HD)和机械损伤(MD)进行了测试,考虑到人工落叶的反应可以在定性和/或定量上与自然草食产生的反应不同[见上文;也(28,29].的现有基因组信息苋菜疑病症(啊)[30.]作为基因选择和后续特异性引物设计的基础,用于实时PCR分析,分离和表征非结构性碳水化合物(non-structural carbohydrate, NSC)代谢的关键基因。研究了受损植株和对照植株的库源组织在不同时间的基因表达。这种反应强烈地依赖于落叶的方式,因为食草性损伤通常会导致更强烈的表达变化。许多转录本、酶和代谢物(已糖、蔗糖、淀粉和脂肪酸)的水平因叶片脱落而发生变化(即短期下降后长期恢复),这表明苋菜对叶片脱落的耐受性可能取决于由关键代谢酶/基因控制的NSC储备的调节使用。因此,我们详细分析了在其他植物模型中影响碳分配和库源关系的候选粒苋菜基因,并克隆了其中的一些基因。然而,转录本和酶之间的关系并不总是像预期的那样直接。
结果与讨论
苋菜基因的选择与克隆
先前对其他模式物种的初级代谢和胁迫耐受性的了解,以及苋菜的初步表达数据指导了总共25个基因的选择。有关更详细的描述,请参阅附加文件1.此外,还鉴定了参与碳(C)分配的7个cdna和2个关键基因的基因组序列(表2)1而且2).在转录组分析中检测到7种蔗糖合成酶(SuS)异构体中的2种[30.]被选作进一步分析。系统发育分析(附加文件2)显示AhSuS-1和AhSuS-2与SBSS1-2亚型高度同源甜菜属.这些已被证明受到发育和几种类型的压力的调节[31].植物转化酶属于另一个多基因家族,在碳水化合物(CHO)的动员中起重要作用。在粒苋菜中,这个科至少有19个异构体。考虑到两种碱中性转化酶亚家族的亚型AhA/NI1-2与叶绿体中定位的转化酶的相似性,选择它们进行进一步研究;在小麦和拟南芥中,它们的活性被环境胁迫上调[32,33].另一方面,AhVI-1是基于其与植物中液泡转化酶的高度相似,从总共4个液泡转化酶亚型中选择出来的b .寻常的, BvVI,它已被证明在C分区中发挥重要作用[34].AhCWI是迄今为止在苋菜中发现的唯一的细胞壁转化酶(cell wall invertase, CWI)亚型b .寻常的(BvExINV),蚕豆根尖(VfCWI2)和番茄(茄属植物lycopersicum;SlWI1),它们分别以调节种子和根的下沉强度和参与损伤反应而闻名,[34,35](附加文件3.).在谷物苋菜中发现的ADP葡萄糖焦磷酸化酶(AGP)之间的系统发育关系表明,符合酶四聚体的亚基至少由四个基因编码,其中两个aahagp - l1和−3可能参与胁迫反应。这暗示了它们与番茄中的AGPL1-2的相似性,后者已被证明是由盐胁迫以ABA和渗透胁迫独立的方式诱导的[36].相比之下,在粒状苋菜中只鉴定出一个AGP亚基,即AhAGPS-1。这种蛋白与其他植物中的同源蛋白有关,如烟草、玉米和豌豆,已知它们参与发育程序和抗应激反应[37- - - - - -39](附加文件4).六种植物转化酶抑制剂的部分序列,它们是针对多种物种的细胞壁或液泡的小蛋白质(15-23 kD) [40],也被用来确定它们的系统发育关系。分析表明AhInvI-4与已证实的液泡转化酶抑制剂拟南芥AtC/VIF-1密切相关AhInvI1-2类似于在发育过程(ZM-INVINH1)和应激反应过程(AtC/VIF-1)中分别参与的外质体定位抑制剂[41](附加文件5).液泡转化酶的基因组序列(AhVI-1)和质体adp -葡萄糖焦磷酸化酶小亚基基因(AhAGPS-1)包括相当一部分各自的启动子区域。adp -葡萄糖焦磷酸化酶和液泡转化酶基因启动子分析表明存在独联体-支持它们对落叶反应的调节元素(其他文件678).不足为奇的是,分析的大多数苋菜基因和蛋白质与以前在甜菜中报道的类似蛋白质具有最高水平的相似性,除了AhA/NI-1,它与从胡萝卜中分离出的转化酶有更高的相似性[42].这恰好与苋属植物种虫害和b .寻常的[43,44].启动子区域的一个有趣的方面AhAGPS-1基因在防御反应中所涉及的调控元件比在茄属植物tuberosum[45].另一方面,在基因的启动子区域之间发现了显著的差异AhVI-I和b .寻常的液泡转化酶基因的丰度较低,在前者中,ABA和JA信号通路中重要的顺式调控元件的基因被激活,以响应(a)生物胁迫和伤害(例如ABRE, G-box和W-box motif)(补充文件)8).我们分析了所选基因的表达,并将其与碳水化合物(CHO)含量和酶活性的变化进行了相关性分析,如下所述。
叶片部分脱落对植物CHO水平的影响答:cruentus
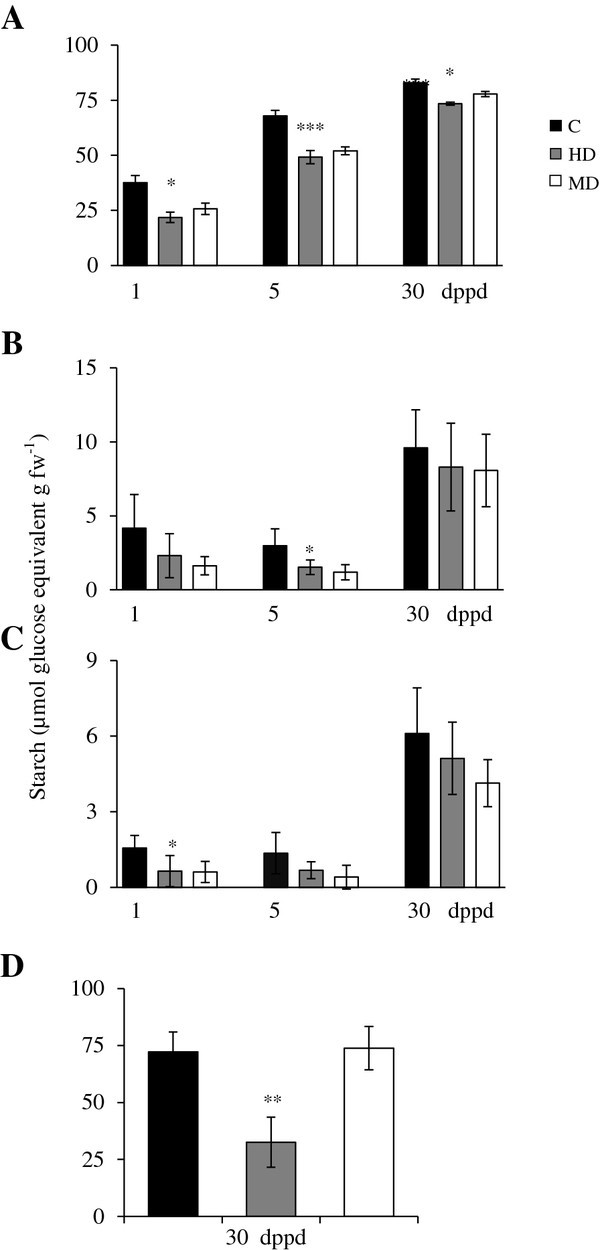
在30日龄植株中,由于机械损伤(机械性脱叶,MD)或昆虫取食(草食性脱叶,HD)导致叶片组织的部分脱落(叶片组织损失约30%)。测量是在不同的日子进行的帖子部分落叶(dppd):在三个独立实验中分别为1,5,30和110 dppd。这些时间点的选择是基于初步的实验[15,16].
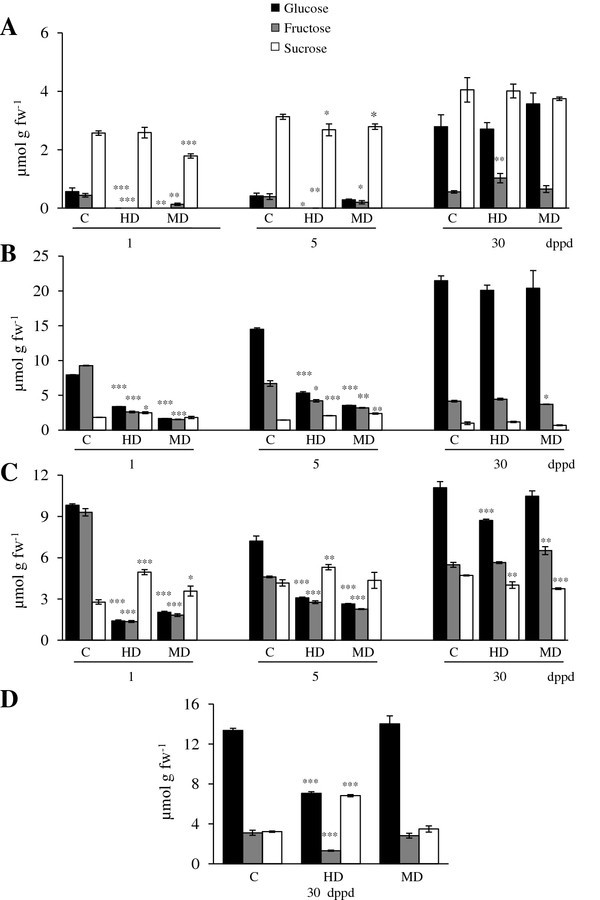
测定了源叶、茎、根和穗中淀粉、SUC、GLC和FRC的含量答:cruentus(交流)植物(图1而且2).总的趋势是,由于落叶,大多数组织中的所有非结构性碳水化合物(NSC)水平都降低了(图)1而且2).脱叶对淀粉和己糖的影响更大。与未受损对照相比,MD和HD植物叶片中的淀粉主要减少(图1A),而与未受损对照相比,MD和HD植物的叶、茎和根中的己糖均已耗尽(图2).效果是迅速的,因为它在1 dppd时发生得最显著,在5 dppd时仍然很明显(图1而且2).当蔗糖分解活性高时(如5 dppd;(见下文)表明它们在去叶植物中的利用率超过了它们从蔗糖中释放的酶解速率。在落叶反应中,NSC储备迅速而普遍地减少,这与植物连续三天在遮阳下缺乏c时所观察到的情况非常相似(Vargas-Ortiz E,未发表数据)。这种相似性支持了我们的观点,即当影响叶片中C获取的因素(如叶面积减少或光照限制)耗尽叶片淀粉和其他C储备时,它们会迅速代谢以维持生长。
部分去叶后(A)源叶、(B)茎、(C)根和(D)穗的蔗糖、葡萄糖和果糖含量(dppd)测定苋属cruentus植物。叶片的脱落主要是由昆虫食草(HD)和机械损伤(MD)引起的。更多详细信息请参见图1.
从长期来看,大多数NSC水平恢复或维持在30 dppd的控制水平,在一些孤立的情况下超过了它们(图2).同样明显的是,MD和HD导致了类似的NSC水平变化,但在圆锥花序中,HD对除SUC外的所有NSC都有强烈的负面影响(图)1而且2).
淀粉是大豆叶片中NSC储备最丰富的物质交流植物(图1).这与苋菜的近亲甜菜叶片中淀粉的高积累相一致[64].叶和穗的淀粉含量比根和茎高10倍(图1).淀粉在发育过程中增加了大约2倍,但与对照植物相比,HD和MD处理的淀粉水平持续降低(图1).这一规律表明,大豆叶片中丰富的淀粉储备被充分调动交流可能是落叶后恢复的关键因素。这与经常观察到的动员淀粉储备以维持新植物在落叶后的生长是一致的,也与提出的叶和茎淀粉作为对抗非生物和生物胁迫的缓冲作用是一致的[65].奇怪的是,这些结果与木本植物对落叶的长期反应更相似,而不是一年生草和灌木。在前者中,经常发现落叶会导致C储存的短期减少,主要存在于叶片中,但在反复落叶后不会长期减少[66- - - - - -70].另一方面,季节性落叶研究与C3.草本植物(如。Agropyron spp。而且多年生黑麦草)和灌木(例如锦鸡儿几种而且Ruellia nudiflora)的调查结果更加多样化。这些包括l为, C储备的积累,随后被用于在反复放牧后确保生存[71].相比之下,可溶性碳库的急剧减少被检测到Agropyron经过严重落叶处理后的束草,由于补充能力有限而无法完全恢复[72].在灌木中,叶片寿命的缩短和地下碳储量的积累使落叶的果实产量得到充分补偿r . nudiflora[73),而c .几种依赖于资源优先分配给营养组织进行再生,以果实生产为代价[74].
必须指出的是,在一项实验中,叶片中的淀粉水平比平常高2倍,MD导致茎和根中的淀粉在30 dppd时增加2- 3倍(附加文件)9B和C)。这表明塑料对落叶的反应交流当有利的生长条件允许积累大量的叶淀粉时,这些植物可以将C隔离在不那么脆弱的储存组织中。此外,观察到组织和个体发生依赖性的NSC水平变化(图1,2),这意味着在某些发育阶段,C资源可以优先分配给某些组织,用于生长、繁殖或防御。这就提出了一个问题,即哪些酶可以调节谷物苋菜中的碳分配。
植物叶片部分脱落对SuS活性和表达的影响答:cruentus
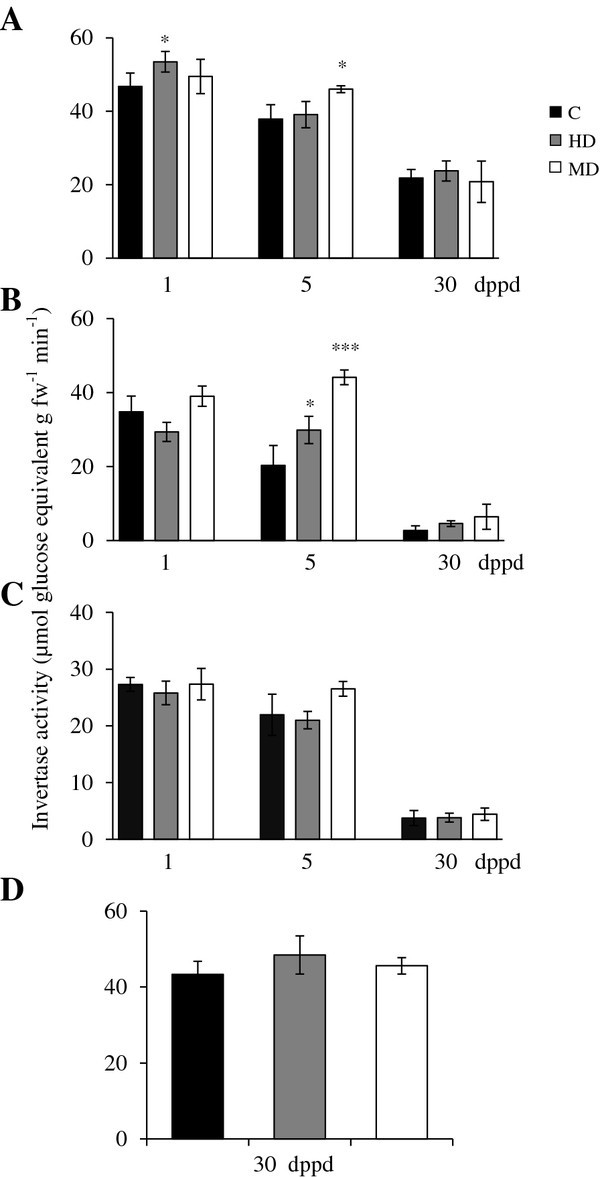
观察到的NSC水平波动在库和源组织响应部分落叶(图2)可能是由不同亚细胞区室和组织中不同的蔗糖分解活性的变化引起的。因此,我们在HD或MD后的不同时间测定了SuS、中性转化酶、可溶性酸和细胞壁结合转化酶的活性。酶学分析辅以选择的异构体和C分配和转运相关基因的qPCR表达分析(表2)3.,4,5,6).
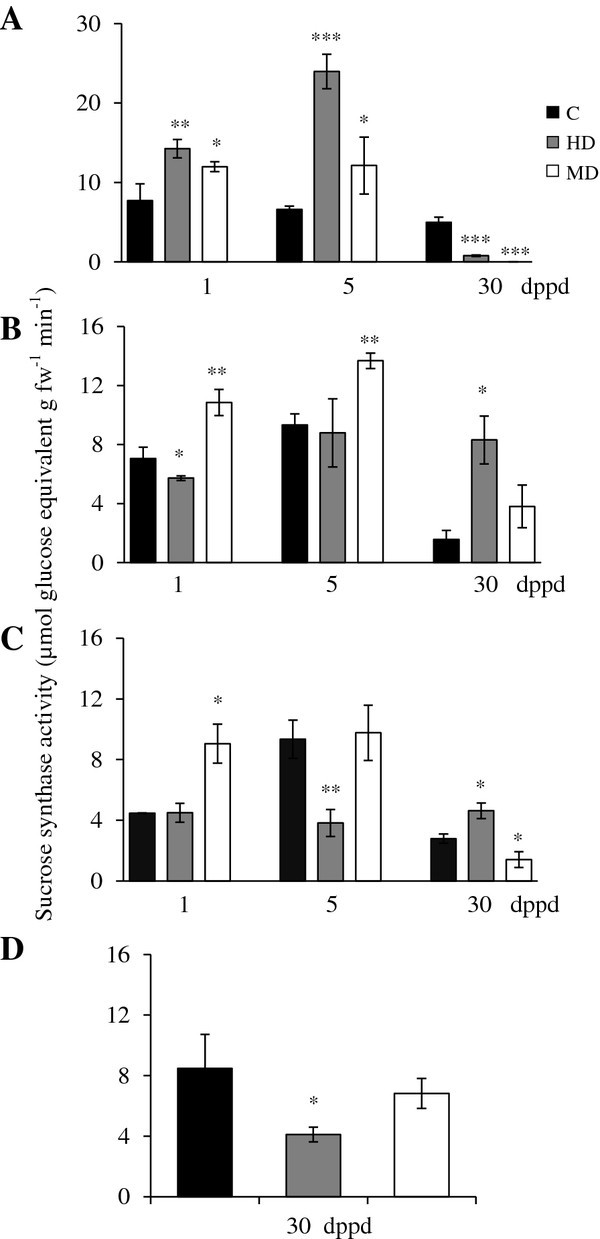
除35日龄植株茎和根中出现短暂的活性峰值(相当于脱叶植株的5 dppd)外,未受损植株的SuS活性在脱叶实验期间保持相对稳定(图)3.).落叶对SuS活性有明显影响(图3.).例如,在叶片中,MD和HD在1和5 dppd时诱导SuS活性增加2- 4倍(图3.A).在30 dppd时,效果相反,两种处理都导致SuS活性急剧降低(图3.A). SuS活性的变化可能反映了叶片代谢状态的转变,从库组织到源组织,随着叶片的NSC储备逐渐恢复,如图所示1而且2.
部分去叶后(A)源叶、(B)茎、(C)根和(D)穗的蔗糖合酶活性水平以每分钟释放的每克鲜重的μmol葡萄糖当量(dppd)测定苋属cruentus植物。叶片的脱落主要是由昆虫食草(HD)和机械损伤(MD)引起的。更多详细信息请参见图1.
可溶性酸(空泡的)在部分去叶(A)源叶、(B)茎、(C)根和(D)穗部分去叶(dppd)后不同日,蔗糖酶(SAI)活性水平以每克鲜重每分钟释放的μmol葡萄糖当量来测量苋属cruentus植物。叶片的脱落主要是由昆虫食草(HD)和机械损伤(MD)引起的。更多详细信息请参见图1.
的AhSuS-1而且AhSuS-2基因对HD比MD更敏感3.).后一种处理仅影响这些基因在茎中的表达,在茎中它们表现出相反的行为(表3.;见下文)。此外,两相模式之间没有发现一致性AhSuSHD植物叶片的基因表达(1dppd低,30 dppd高)和酶活性水平,在落叶后不久高于对照,然后在30 dppd下降到几乎无法检测到的水平。
在MD植株的茎中,SuS活性在1和5 dppd时暂时高于未受损对照。相比之下,HD在1 dppd时导致快速下降,但在30 dppd时保持长期稳定,导致比对照组更高的活动水平(图3.B). HD植株在30 dppd时茎秆中持续存在显著较高的SuS活性,这与两者诱导较晚一致AhSuS-1而且AhSuS-2(表3.).在根中,MD对SuS活性有快速的诱导作用,而不伴有两者的诱导AhSuS-1而且AhSuS-2基因。同样,HD植株穗SuS活性降低约2倍,与两者诱导表达相反AhSuS在HD植物的这些组织中的基因(图3.D和表格3.).观察到之间缺乏直接的相关性AhSuS-1而且AhSuS-2SuS的表达水平和活性类似于在损伤或缺氧的甜菜根中观察到的SuS基因表达和酶活性之间的差异,这归因于转录后机制[31,75].SuS活性和表达之间的差异也可以通过其他假定的参与来解释SuS亚型。与其他各种植物种类相似[76),SuS粒苋菜的基因符合至少由七个不同成员组成的多基因家族[30.].
两者的系统诱导AhSuS脱叶植物茎、根和/或穗的基因和活性与频繁的诱导相一致SuS胁迫条件下植物根和/或芽的基因[77].这表明,在脱落的苋菜植物中产生了创伤衍生的系统信号,这可能是JA,相关的氧脂素甚至H2O2(见下文)。
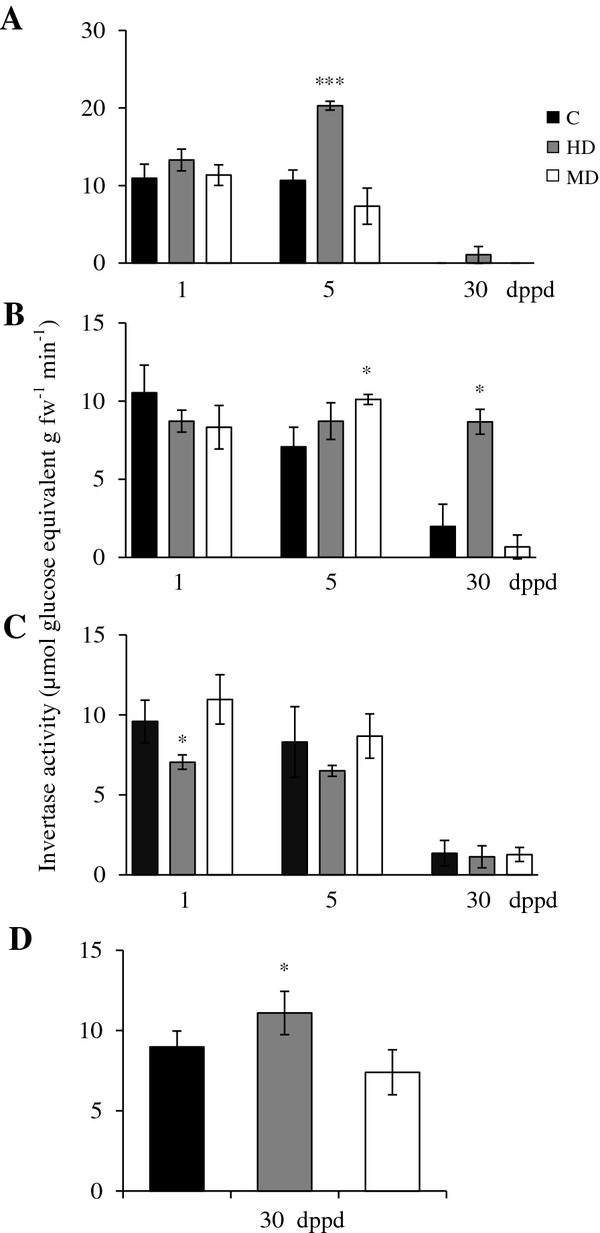
植物叶片部分脱落对转化酶活性和表达的影响答:cruentus
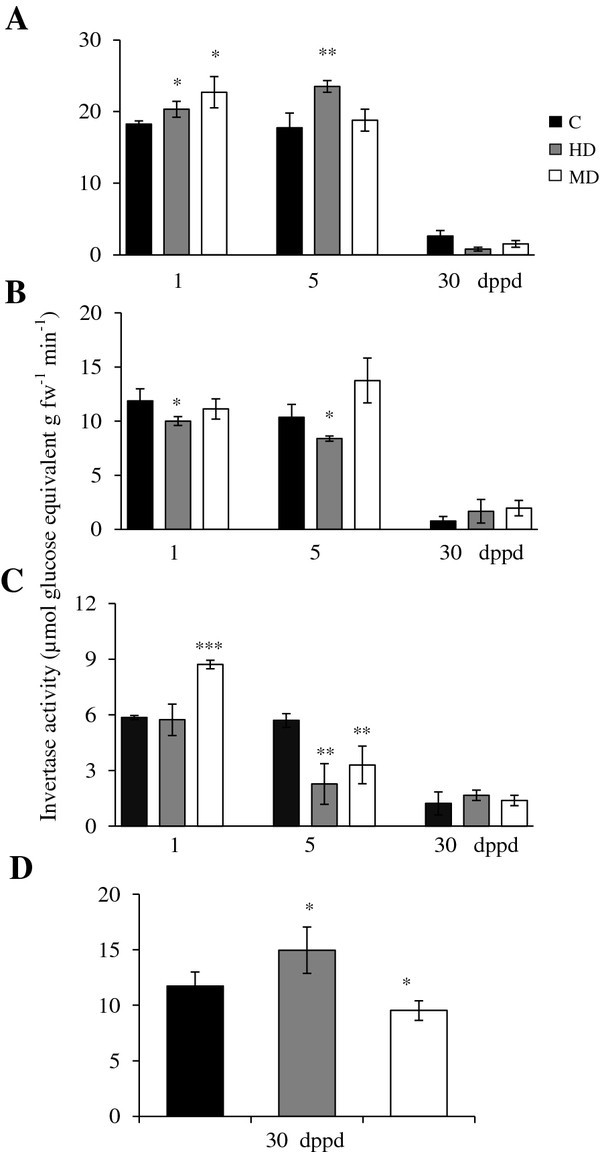
可溶性酸性转化酶(SAI)活性(如“液泡转化酶”)在受损幼树叶片中较高交流植株(31和35日龄植株),茎中等,根低(图4a - c)。60天龄植株的SAI活性在所有组织中急剧下降(30 dppd),除了在穗中SAI活性水平与在年轻植株茎中检测到的水平相似(图4D)。在叶片中,SAI的去叶效应与SuS活性的去叶效应非常相似(除了MD植物在5 dppd时未观察到诱导)(图4A)。在茎中,HD在1和5 dppd时的短期效应是负面的,而MD是中性的(图4B).在根中,5 dppd时落叶的影响为负,尽管在MD植物中观察到1 dppd时的短暂诱导,而HD植物的穗中检测到SAI活性的增加(图4C和D)。
不溶酸(细胞壁在部分去叶(A)源叶、(B)茎、(C)根和(D)穗(D)中,部分去叶(dppd)后不同日,转化酶(IAI)活性水平以每克鲜重每分钟释放的μmol葡萄糖当量来表示苋属cruentus植物。叶片的脱落主要是由昆虫食草(HD)和机械损伤(MD)引起的。更多详细信息请参见图1.
AhVI-1可以解释HD植物叶片和MD植物5 dppd时SAI活性的增加,以及MD植物茎5 dppd时SAI活性的增加3.).此外,后期归纳了假定AhInvI-4抑制基因有望靶向AhVI-1 [41](附加文件5)与HD和MD植物叶片SAI活性水平在30 dppd时的降低相关(表3.和图4A).在叶片中观察到该抑制基因在1 dppd时的抑制表达也可能有助于检测到SAI活性的增加。
液泡处理酶基因的表达(Ah -γ汽相外延)对落叶的反应也在本研究中进行了监测,因为已知它参与了液泡转化酶活性的调节在足底[56,78,79].然而,对于HD和MD,只有其在叶片中的诱导较晚(30 dppd),以及其在MD植物中的早期和强烈抑制(1 dppd),与改良SAI活性水平相一致(表2)3.和图4).奇怪的是,在5 dppd时,该基因在脱叶植物叶片中被观察到强烈的抑制。除叶片外,该基因在茎和根的表达也存在明显的损伤依赖效应,在HD植物中为阳性,而在MD植物中为阴性。两者之间普遍缺乏相关性Ah -γ汽相外延表达和SAI水平交流指出了该基因在逆境植物中的其他可能功能,类似于最近在烟草benthamiana[80].
增加AhVI-1脱落叶片受损叶片和下沉组织中转录体丰度和酸性转化酶活性交流植物与已知的转化酶上调是一致的,在一些植物物种中,因伤害或昆虫食草而导致叶片损伤后,经常观察到这种上调,这些上调被认为是导致受损叶片中发生的源-库关系改变的原因[21,35,81,82].此外,模式AhVI-1表达和SAI活性表明,这种特殊的蔗糖水解酶,可能与SuS活性结合(见上文),可能在早期利用C储备中发挥重要作用,主要是在叶片中,以支持在落叶胁迫下的生长交流植物。
不溶性(如“细胞壁结合”)酸性转化酶(IAI)的活性,一般来说,是最活跃的转化酶类型检测交流植物。在未受损的幼苗中,叶和茎中的IAI水平相似,而根中的IAI水平较低交流随着植物老化,这些组织逐渐减少。幼穗的IAI活性相对较高(图5).叶片中IAI活性的脱叶效应是零星的,仅在1 dppd和5 dppd时HD和MD分别在叶片中诱导,在茎中5 dppd时诱导5A和B)。CWI活动的这些微小变化反映在CWI活动中没有明显变化AhCWI基因表达水平(结果未显示)。
AhInvI-2(编码一个假定的cis抑制剂)显示出广泛不同的表达模式(表3.和图5).该抑制基因在HD植物叶片中的表达也与CWI活性模式呈负相关(图5A和表格3.),因为其下调1 dppd与CWI活性水平增加相关。的AhInvI-1编码另一种假定的CWI抑制剂的基因,也表现出组织和损伤依赖的表达,因为HD在所有被检测的组织中导致1 dppd的强烈和短暂抑制,而MD主要导致茎和叶中5 dppd和30 dppd的延迟诱导。然而,这些特定抑制剂在SUC代谢中的靶酶和生理作用交流植物还有待确定。
中性(例如“细胞质”)转化酶(NI),一般来说,是检测到的最不活跃的转化酶类型交流植物。在未损伤幼鼠的所有组织中,NI活性水平起初变化不大交流但与SAI和IAI类似,NI活性在60天龄植株中急剧下降,在叶片中达到无法检测到的水平(图2)6).这与中性转化酶低到无法检测的表达水平相吻合啊哈/ NI-1在30 dppd处理下,对照植物和脱叶植物的叶片和根中均有基因表达3.).与其他蔗糖水解酶类似,在穗中未观察到与发育相关的NI活性下降,其水平与较年轻的营养组织中检测到的水平相似(图6D).然而,基因表达分析表明,在穗中观察到的持续NI活性不是由于啊哈/ NI-1基因,没有检测到该基因的表达。另一方面,该基因在HD和MD植物茎中5 dppd的强烈上调仅与MD植物茎中NI活性水平的显著升高相一致。在较老的茎中没有观察到这种相关性,在HD植物中,30 dppd检测到的出乎意料的高活性并不伴随着相应的增加啊哈/ NI-1表达式(图6B和表格3.).的啊哈/ NI-1该基因在根和穗中没有表达,在叶片中表达量主要下调,在茎中表达量在5 dppd时强烈诱导,表明其具有刚性组织特异性。这同样暗示了他人的参与倪啊/决定细胞质中碱性/中性转化酶活性变化的基因,可能还有质体和/或线粒体[83].这与在粒苋菜中检测到的至少14种NI异构体是一致的[30.].
可溶性中性(胞质在部分去叶(A)源叶、(B)茎、(C)根和(D)穗(D)中,部分去叶(dppd)后不同日,转化酶(NI)活性水平以每克鲜重每分钟释放的μmol葡萄糖当量来表示苋属cruentus植物。叶片的脱落主要是由昆虫食草(HD)和机械损伤(MD)引起的。更多详细信息请参见图1.
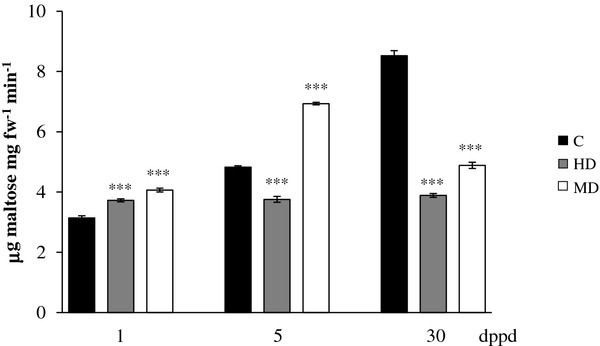
植物叶片部分脱落对淀粉代谢的影响答:cruentus
的表达式AhAGPS-1而且AhGBSS大多不受落叶影响或下调(表4).可溶性淀粉合成酶III类基因(AhSS-III)。相比之下,这两个AhAGPL在这项研究中检测的基因,在落叶反应中表现出完全不同的表达模式,两者都是关于AhAGPS-1和彼此(表4).叶片脱落对基因表达有中性或负性影响AhAGPL-1,且在叶片和茎叶脱落(1和5 dppd)后的早期表现最为强烈。相比之下,AhAGPL-2对HD植物高度敏感,表现为时间和组织依赖性,表现为在所有组织中诱导表达,特别是在5 dppd时表达,并在HD后始终在根中持续上调。MD是一个较弱的刺激,不导致根的系统性诱导。有趣的是,这两种方式的叶片脱落都强烈地诱导了该基因在穗中的表达,而在这些组织中淀粉的积累并没有反映出来。上述结果表明,这些淀粉生物合成基因的表达交流植物是组织依赖的,并受到用于落叶的损害类型的影响。然而,这种表达模式与观察到的叶片脱落后淀粉水平的短期和长期变化不一致。这可能反映了已知在植物中起作用的淀粉合成的复杂翻译后调节[84- - - - - -86].但是,强而迟的表达AhSS-IV在HD和MD植物叶片中观察到的30 dppd,可能有助于脱叶植物叶片淀粉水平的恢复,与完整对照相似(表2)4).可溶性淀粉合成酶基因在淀粉生物合成中所起的重要作用支持了这种可能性拟南芥[87,88].
另一方面,叶片淀粉储备的短期减少以及随后的恢复,与图中所示的淀粉溶解活性模式呈负相关7.因此,1和5 dppd诱导的活性(HD植物除外,5 dppd)与淀粉水平的降低相一致,而在30 dppd诱导的活性降低几乎两倍可能与脱叶植物叶片淀粉水平的恢复有关。β-淀粉酶-1基因在脱叶植物叶片中的表达谱(表1)4)也与观察到的淀粉水平和淀粉溶解活性的变化一致。这些结果与一篇关于淀粉分解是β-淀粉酶在植物中的主要功能的报道相一致[89],也有几项研究发现,落叶引起的淀粉降解与增强的淀粉酶活性和/或诱导的淀粉酶基因表达有关[90- - - - - -92].
在部分去叶(dppd)后不同天数,以每分钟释放的每毫克鲜重的μg麦芽糖为淀粉酶活性水平测定苋属cruentus植物。叶片的脱落主要是由昆虫食草(HD)和机械损伤(MD)引起的。更多详细信息请参见图1.
假设的诱导表达SnRK1落叶植物叶片中的调控基因表明,该基因参与了响应叶片损失而产生的C分配的控制,可能是为了改变资源分配,以增加对落叶的耐受性,这与野生烟草中报道的情况类似[93].有趣的是,该基因在HD植物中表达迅速且短暂,而在MD植物中表达延迟且持久(表2)4).
蔗糖转运基因表达的改变(AhSUT1)的部分落叶的反应答:cruentus
即使韧皮部加载的机制交流植物是未知的,鉴定的AhSUT1,编码蔗糖转运蛋白基因,支持外质体韧皮部装载过程的参与,这与其他几种植物物种中报道的情况类似[94].
这个基因也受到不同方式的影响交流植物的叶片脱落,对HD的反应比MD的反应更灵敏。这种效应也与组织和时间有关,因为AhSUT1在HD植株中,叶片(1 dppd时)和穗部有较强的诱导作用,而根系(5 dppd时)的诱导作用为负;MD植物的根在30 dppd时也表现出该基因的抑制。在茎中,HD和MD植物在1 dppd时都有强烈的早期抑制。在高清环境下,这种效果在30 dppd时被逆转5).与其他几项研究相似的是,在放牧或昆虫食草导致的落叶过程中,SUC转运蛋白快速而短暂地表达[21,71,90,95,96],支持AhSUT1作为叶片SUC转运的促进因子,在籽粒苋菜对叶片脱落的耐受响应中发挥重要作用。
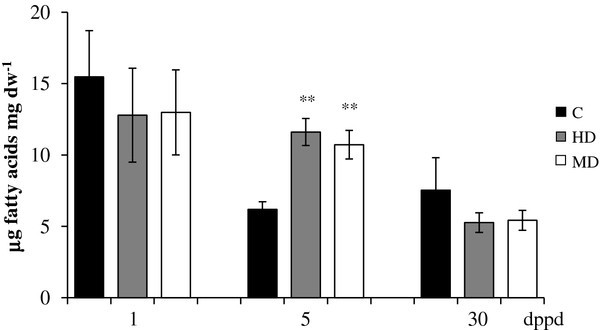
磷酸烯醇丙酮酸/ Pi转位基因表达的变化(AhPPT)基因对部分叶片脱落的反应答:cruentus:可能与根系中脂肪酸的短暂积累有关。
与大多数检测的基因相反,推测的磷酸烯醇丙酮酸/ Pi转位的表达模式(AhPPT)结果表明,除少数病例外,MD可引起全身性堆积AhPPT在所有被检查的组织中,转录本在根中特别强(表5).在HD和MD植物根系中检测到的该基因在5 dppd时的强烈诱导与根系中检测到的脂肪酸的瞬时积累相关(图8;额外的文件10).这种相关性与这样一个事实相一致,即PPTs是非光合质体中已知的可塑性磷酸盐易位子谱的一部分,这些易位子将磷酸烯醇丙酮酸(PEP)从细胞质传递到质体,通过丙酮酸激酶的作用支持脂肪酸的生物合成[97,98].此外,该基因在叶片中5 dppd的高表达可能是PEP导入叶绿体以支持损伤后的组织恢复所必需的[99].
在部分脱叶(dppd)后不同日龄,以每mg干重脂肪酸μg为单位测定了对照根和脱叶根的总脂肪酸含量苋属cruentus植物。叶片的脱落主要是由昆虫食草(HD)和机械损伤(MD)引起的。更多详细信息请参见图1.
Kunitz蛋白酶抑制剂的表达变化(AhKTI)和脂氧合酶(AhLOX2)基因作为创伤反应和茉莉酸信号的标记答:cruentus。
蛋白酶抑制剂AhKTI被用作创伤反应标记的基因显示,叶片对HD和MD的反应具有预期的快速和稳定的诱导,这表明在1和5 dppd时表达显著增加(表6).更强的影响AhKTIHD的表达与叶片中胰蛋白酶抑制剂活性的差异表达一致答:hypochondriacus受到机械伤害或草食的苗[One hundred.].该基因在未损伤组织中的诱导,如HD (1 dppd)和MD (5 dppd)植物的根,以及MD植物的茎(在1和30 dppd时表现出双相表达模式)进一步支持产生尚未确定的创伤诱导信号,这是本研究中分析的该基因和大多数其他基因系统性表达所需要的。落叶也导致了意想不到的高水平AhKTI圆锥花序的表达同样有趣的是延迟下调AhKTI在MD植物叶片中观察到30 dppd。相比之下,AtLOX2作为JA合成的标记物,该基因主要在HD植物的叶片中表达,尽管在根中也检测到该基因的表达改变,其中MD导致在1 dppd时早期诱导,而HD抑制它(表6).该基因在HD和MD植物茎中均在5 dppd时被明显抑制。的高表达AhLOX2考虑到植物受到咀嚼叶子的食草动物攻击以诱导抗性或耐受反应时通常会产生JA水平的明显上升,HD植物叶片中的基因在某种程度上是预期的[101- - - - - -103].此外,高AtLOX2HD植株叶片中的表达可能导致JA水平的增加,这可能是本研究中观察到的HD和MD植物之间基因表达显著差异的一个因素。昆虫的食草性也可能通过其对活性氧(ROS)合成和细胞氧化还原代谢的影响影响了应激信号网络[104].同样,JA作为HD植物远端基因诱导的系统信号的可能作用与在答:hypochondriacus表明茉莉酸盐可以调节对昆虫的防御反应[8,One hundred.]并强烈诱导各种草食反应基因的系统性表达,包括重获, JA生物合成基因[105].值得注意的是,JA还可以诱导资源分配的变化,以增强植物对落叶的耐受性[101,106- - - - - -108].然而,JA在籽粒苋菜抗性/耐受性应答中的信号通路作用尚不明确。
植物对昆虫食草性和机械损伤的不同反应经常被报道,这是由于无法用机械手段模拟昆虫食草性,这往往低估了昆虫取食产生的损害。此外,机械方法瞬时去除叶片组织与昆虫下颌骨引起的较慢的组织去除明显不同。其他未被普遍认识的微妙影响可由食草动物踩踏、排便或传播病原体引起[28],而昆虫的唾液是反应差异的一个明确的决定因素。在这方面,已有充分证据表明,当昆虫唾液或口腔分泌物中含有的草食动物特异性激发子(例如,脂肪酸缀合物,如volicitin)被引入伤口时,抗性信号的引发与简单的损伤不同[109- - - - - -112].
与衰老相关的(AhSAG)基因作为衰老和发育的标志,部分叶片脱落答:cruentus
的表达式AhSAG基因被用作发育和衰老的标记,在HD植物的叶片中产生了预期的模式,即在1 dppd时减少/抑制其表达,随后在5和30 dppd时明显增加(表6).在MD植物的叶和茎中也观察到类似的趋势,但较弱,而在HD植物的茎中则观察到AhSAG吉恩受到了强烈的压抑。HD和MD植物根中1 dppd的早期表达表明,该基因可能是创伤应激的系统标记,而不是在该组织中发育。这得到了一些报告的支持,这些报告显示,在衰老过程中上调的几个基因也会积累起来,以应对生物和非生物应激[113].该基因在HD植株的圆锥花序中有很高的表达。这可能反映了在HD植物中观察到的花期加速开始(结果未显示)。HD和MD对基因表达的差异影响在茎中再次得到证实,其中对基因表达的影响明显相反AhSAG在30 dppd时观察。
除了提早开花,HD还会缩短叶片寿命,增加分枝(数据未显示)。然而,这些变化对生理成熟植株的株高或种子产量没有负面影响(数据未显示)。这些变化表明,与机械伤害相比,昆虫食草对籽粒苋菜产生了更强的个体发生转移。这种差异表现为提前开花(一种逃避策略?)和成熟叶片加速衰老。这与一项相关研究部分一致,该研究发现剪接答:cruentus产生了植物结构的巨大变化,并导致了过度补偿反应,从而增加了种子产量[17].
结论
众所周知,谷物苋菜植物可以在恶劣的环境条件下茁壮成长,而这些环境条件不适合其他作物,特别是谷物。抗旱和抗盐胁迫的机制被归因于几种生理、生化和/或遗传适应,包括优越的水分利用效率、根长和结构的变化、相容溶质的积累和/或关键胁迫相关基因的表达[30.].相反,对于观察到的粒苋菜维持落叶的能力,我们知之甚少。本研究获得的NSC数据表明,在籽粒苋菜幼苗中,单一的一次去叶事件导致库组织和源叶中的NSC水平迅速下降,并在去叶后一段时间内恢复。我们认为,叶片淀粉储备的快速调动以及所有NSC储备的有效恢复支持了籽粒苋菜对叶片脱落的耐受反应,表现为未改变的植株生长和繁殖适应性。此外,当叶片中淀粉含量异常高时,观察到淀粉在根和茎中的长期隔离,以及脂肪酸在根中的暂时积累,表明籽粒苋菜对落叶的可塑性反应。值得注意的是,只有少数基因表达和酶活性的变化可能与上述变化有关。这一结果与植物中CHO代谢通量的高度复杂性质相一致,预测单个基因对其只有有限的影响,如果有的话。尽管植物对两种处理的反应非常相似,但在HD和MD植物之间也观察到基因表达模式的巨大差异。这可能与引起昆虫食草性的更强的个体发生变化有关,这表现为过早开花,改变植物结构和加速叶片衰老。
根据本研究和其他相关研究,可以得出结论,更好地理解C的分配如何影响对落叶的耐受性,也许还影响对包括过度盐度在内的其他胁迫的耐受性[36],在未来的栽培作物改良中有很大的潜力,特别是那些不耐胁迫和落叶的作物,如玉米。
方法
植物材料,昆虫和处理
本研究采用的两种基因型种子,苋属cruentus栽培品种“Tarasca”和苋属hypochondriacus品种“Revancha”,由Eduardo Espitia (INIFAP, México)提供。种子按前面所述的方式发芽[30.].夏威夷甜菜网虫的幼虫Spoladea recurvalis这是苋菜和相关物种的常见害虫,在附近田野收集的标本建立的群落中饲养。随后,幼苗在发芽21天后被移植到16升的塑料盆中,其中含有无菌的普通土壤混合物,并被运送到温室进行实验。移栽一周后,按照生产商的说明(Peters Professional;scott - sierra园艺产品,马里斯维尔,OH,美国),直到他们有6到8个膨胀的叶子。所有草食实验均为30日龄答:cruentus在cinvestv - irapuato的温室植物,México,(20°40”18”N 101°20”48”W)在自然光照和温度条件下。的选择答:cruentus因为脱叶实验是基于它对光周期的不敏感性,这是一个有用的特性,可以在一年的早期和晚期进行实验,这是不适合的答:hypochondriacus[12].通过昆虫食草,每株植物放置3个幼虫4天,导致叶片组织损失约30%。机械损伤的脱叶是通过用直径0.5厘米的软木钻去除相同百分比的叶面组织来实现的。注意与机械性组织移除模式相匹配的植食性组织移除模式。在去叶处理后的0、1、5和30天,分别从3株植物上采集受损源叶(每株3片)、茎(15 cm段,从基部开始)和根的样品。在处理后30天,圆锥花序出现后不久取样。对照实验同时进行。在3个时间点分别测定株高和总叶数。每茎节间数在30 dppd测定。在两个实验中,从对照组和允许达到完全成熟(≥110 dppd)的脱叶植物中收获种子。 Tissue samples of each three plant group were pooled and were flash frozen with liquid N2在−80°C保存直到使用。混合样本用于分析NSC、脂肪酸、基因表达和蔗糖水解活性水平。每个实验重复三次,一次在2010年秋冬,两次在2011年春季。
完整的叶组织答:hypochondriacus而且答:cruentus利用植物进行RNA提取和基因组DNA提取,进行全长cDNA和基因分离。
总RNA的提取和cDNA的制备
根据制造商说明书进行修改,使用Trizol试剂(Invitrogen, Carlsbad, CA, USA)从100-200 mg冷冻组织中提取总RNA。这些包括在异丙醇以1:1 v/v的比例沉淀时添加盐溶液(柠檬酸钠0.8 M + 1.2 M NaCl),并在4°C下用LiCl (8 M)进一步纯化1小时。所有RNA样品均采用甲醛琼脂糖凝胶电泳分析,并在溴化乙锭染色时目测核糖体RNA条带。将总RNA样本(1 μg)用寡核苷酸dT反转录得到第一链cDNA20.引物和200单位SuperScript II逆转录酶(Invitrogen)。
实时定量RT-PCR (qRT-PCR)基因表达分析
qRT-PCR所使用的cDNA最初由4 μg总RNA制备。然后在qRT-PCR前用无菌去离子蒸馏水(dd)稀释10倍。使用SYBR Green检测化学方法进行扩增,并使用StepOne™实时PCR系统在48孔反应板中进行三次扩增(应用生物系统公司,perkins - elmer, Foster City, CA, USA)。反应总体积为8 μl,其中:模板1 μl,扩增引物(2 μM)各0.8 μl, SYBR®Green JumpStart™4 μlTaqReady Mix™(Sigma-Aldrich St. Louis, MO, USA)和1.4 μl无菌dd水。使用附加文件中列出的引物对每个样品进行三次定量实时PCR11.根据从转录组分析中获得的部分cDNA序列,为每个基因设计引物啊[30.]或来自本研究中生成的完整cdna(见上文)。引物设计使用DNA计算器软件(Sigma-Aldrich)进行,并在可能的情况下包括部分唯一的3 '非编码区域,以确保特异性。
所有qRT-PCR运行均遵循以下规程:在95°C下启动JumpStart™15分钟Taq聚合酶(Sigma-Aldrich),然后在95°C变性15秒,60°C退火1分钟,循环40次。需要超过32个周期的缓慢扩增不被考虑用于分析。通过40循环后的熔化曲线分析和琼脂糖凝胶电泳验证扩增子的特异性。采用Real-Time PCR系统软件自动确定基线和阈值循环(Ct)。所有基因的PCR效率均大于95%。相对表达量采用比较周期阈值法计算[114],其中未受损对照cDNA的delta (Δ)周期阈值定义为100%转录本存在。
转录丰度数据根据三个参考基因的平均转录丰度进行归一化:肌动蛋白(isotig 10321),β微管蛋白(isotig 05486)和伸长因子1α(EF1α) (isotig 13098)。这些都是从上述转录组学研究中获得的。利用下式计算各处理下靶基因表达的倍数变化——ΔΔCt,式中ΔΔCt = (Ct靶基因-平均Ct内参基因)治疗- (Ct靶基因-平均Ct内参基因)控制.报告的值是一个代表性实验的三次重复±SE的平均值。qRT-PCR分析了本研究中包含的大部分基因的表达,除了所有的蔗糖水解基因,AGP和转化酶抑制剂基因,先前被半定量RT-PCR检测显示具有可复制的表达模式(未显示),在至少两个独立的实验中得到验证。
全长cDNA扩增
为了放大全长AhSuS-1,AhSuS-2,AhAGPS-1,啊哈/ NI-1而且AhVI-1将籽粒苋菜叶片总RNA (1 μg)逆转录得到上述第一链cDNA。然后直接将这些反应(2 μl)作为模板,在每个100 pmol的特定引物的存在下进行所有PCR反应啊转录组(30.](见附加文件12).对获得的片段进行克隆和测序,以确认它们与感兴趣的基因相对应。5 '和3 ' cDNA末端的扩增由RACE (cDNA末端的快速扩增)和smart™RACE cDNA扩增试剂盒(Clontech, Laboratories, Mountain View, CA)根据制造商的说明进行。所有完整cDNA序列存入GenBank,编号JQ012918 (AhSuS-1), jq012919 (AhSuS-2), jq012920 (啊哈/ NI-1), jq012921 (AhVI-1)及HM021763 (AhAGPS-1).
细胞壁转化酶(AhCWI)部分cDNA序列的PCR扩增
简并寡核苷酸OIN3 (5”CCTTCACYTNTTYTAYCARYAYAAYCC 3”, (115INV5 (5”NGTCTTGGWDGCGTAAATAYTTMCCATA 3”)是从保守细胞壁转化酶(证照)序列甜菜属(AJ278531),红藜属(x81792 - 94)胡萝卜胡萝卜(M58362.1),作为引物进行PCR扩增。在25 μl的反应体积中,用2 μl cDNA进行PCR反应答:hypochondriacus作为模板,引物(每个100 pmol), dNTPs(每个100 mM), 10 × Taq反应缓冲液,50 mM MgCl21u的Taq聚合酶(表达载体)。在94℃预变性3 min后,扩增包括在94℃30 s, 60℃30 s, 72℃45 s的35个循环,最终在72℃延伸10 min。所得PCR片段经琼脂糖凝胶电泳分离纯化。从主要条带中提取PCR片段进行纯化、克隆和测序。
全长基因组扩增
从叶片中提取基因组DNA答:hypochondriacus按指示栽种植物[116]并用四种不同的限制性内切酶(DraI,EcoRV,PvuI,StuI).产生的片段被钝端连接到Genome-Walker kit (Clontech)提供的Genome-Walker Adaptor上,以生成相应的文库。这些文库被用作PCR和使用引物嵌套PCR的模板(见附加文件)12)设计在完整的cdna上AhVI-1而且AhAGPS-1先前获得(见上文)。在3'和5'方向上进行扩增,以获得这些基因的完整序列,包括其启动子区域的相当一部分。由此获得的基因组序列与其各自的cDNA模板之间的重叠证实了新生成片段的身份。所有PCR扩增物使用TOPO TA克隆试剂盒(Invitrogen)克隆并测序。这两个AhVI-1而且AhAGPS-1基因组序列分别存入GenBank,编号为JQ012921和JQ034321。
DNA测序和序列分析
制备重组质粒DNA并进行测序。测序由生物多样性基因组学国家实验室(Langebio,在Cinvestav- Irapuato)和生物技术研究所(IBT-UNAM, México)提供。采用FastPCR 6.0、AnnHyb 4.944、chroma - lite 2.01软件进行计算机分析。使用BLAST程序在GenBank数据库中验证序列同源性[117].
系统发育分析
在boque 1.7.157软件中使用PhyML方法进行氨基酸序列比对和系统发育分析。
假定的亚细胞定位
进行了推测的基因亚细胞定位在网上通过以下在线程序:PSORT, SignalP, TargetP, Protein Prowler和MitoProt。(psort.hgc.jp / form.html,http://www.cbs.dtu.dk/services/TargetP/pprowler.imb.uq.edu.au /,http://www.cbs.dtu.dk/services/SignalP/和ihg.gsf.de /洲际酒店/ mitoprot.html)。
Bio-informatic分析
启动子序列AhVI-1而且AhAGPS-1基因受到一个在网上使用以下数据库进行分析:http://www.dna.affrc.go.jp/PLACE/)、PlantCARE (http://bioinformatics.SlPSb.ugent.be/wetools/plantcare/html/)、SolGenomics Network (solgenomics.net)和Genomatix软件套件(http://www.genomatix.de),以确定假定的顺式监管要素的存在。
非结构性碳水化合物水平测定
所有组织(叶、茎、根和穗)在黑暗期开始时(下午6:30)收集,并在液氮中快速冷冻。用500 μl 80%乙醇水溶液(v/v)提取冰冻组织(200 mg),在4℃下搅拌10 min。在10,000 rpm(4°C, 10分钟)冷冻离心后,将清除的上清转移到新管中,通过离心浓缩(Heto Maxi Dry Lyo, Heto- holten, Denmark)。在500 μl 100 mM Hepes缓冲液、pH 7.4和5 mM MgCl中重新溶解2,用于可溶性糖的测定。离心步骤得到的球团用于淀粉的测定。为此,用500 μl 10 mM KOH均质,99℃孵育2小时。按照指示(Boehringer Mannheim/R-Biopharm, Darmstadt, Germany)采用酶法测定蔗糖(SUC)、葡萄糖(GLC)、果糖(FRC)和淀粉含量,但将最终反应体积减小到适合微板形式(每次反应250 μl)。
脂肪酸含量测定
脂肪酸含量根据[118i)甲基化步骤用BF进行3.在稍苛刻的条件下(100°C, 15分钟),和ii)有机相在N流下干燥2在加载到气相色谱仪之前在异辛烷中重新溶解。
转化酶、蔗糖合酶和淀粉酶的体外活性
酸溶性(液泡)和不溶性(细胞壁)、中性(细胞质)转化酶和蔗糖合酶活性根据[119,120].总淀粉溶解活性的测定方法见[121].
统计分析
数据的统计分析是在R统计语言(R Development Core Team 2004, Version 1.9.0;http://www.R-project.org).
参考文献
- 1.
花TJ, Colmer TD:盐生植物的耐盐性。中国生物工程学报,2008,29(3):344 - 344。10.1111 / j.1469-8137.2008.02531.x。
- 2.
Akubugwo IE, Obasi NA, Chinyere GC, Ugbogu AE:尼日利亚Afikpo苋菜叶片的营养和化学价值。生物工程学报,2007,6:2833-2839。
- 3.
Brenner D, Baltensperger D, Kulakow P, Lehmann J, Myers R, Slabbert M, Sleugh B:苋属植物的遗传资源与育种。植物学报,2000,19:227- 227。
- 4.
Huerta-Ocampo J, Barba de la Rosa A:苋菜:一种具有营养特性的伪谷物。中国食品科学,2011,7:1-9。10.2174 / 157340111794941076。
- 5.
李志强,李志强:大平原北部籽粒苋菜的水分利用模式。王志强,2002,44(1):1 - 4。10.2134 / agronj2002.1437。
- 6.
Omami EN, Hammes PS, Robbertse PJ:部分苋菜(Amaranthus spp.)基因型生长耐盐性和水分利用效率的差异。新热忱作物学报,2006,34:11-22。10.1080 / 01140671.2006.9514382。
- 7.
Aragón-García A, Huato MAD, Lara MH, Sáenz-de-Cabezón F, Pérez-Moreno I, Marco-Mancebón V, López-Olguín JF:墨西哥普埃布拉地区苋属植物因植食性物种引起的昆虫发生与损失。农学通报,2011,30(6):529 - 529。
- 8.
Délano-Frier JP, Martínez-Gallardo NA, Martínez-de la Verga O, Salas-Araiza MD, Barbosa-Jaramillo ER, Torres A, Vargas P, Borodanenko A:外源茉莉酸对苋菜(Amaranthus hypochondriacus)诱导抗性和生产力的影响受环境条件的影响。化学学报,2004,30:1001-1034。
- 9.
Gassmann AJ:光合效率和水分有效性对苋菜叶片去除耐性的影响。环境科学学报,2004,29(3):344 - 344。10.1111 / j.0022-0477.2004.00920.x。
- 10.
韦弗SE,麦克威廉姆斯EL:加拿大杂草的生物学。44。中国植物科学,2000,30(1):1 - 4。10.4141 / cjps80 - 175。
- 11.
Grubben GJH:苋菜作为一种热带叶蔬菜的栽培,特别参考南达荷美。1976,阿姆斯特丹:皇家热带研究所农业研究部
- 12.
埃斯皮蒂亚-兰赫尔E, Mapes-Sánchez C, Escobedo-López D,德拉O-Olán M,里维斯-瓦伦西亚P, Martínez-Trejo G, Cortés-Espinosa L, Hernández-Casillas JM: Conservación y uso de los recursos genéticos de amaranto en México。2010,塞拉亚,瓜纳华托,México: SINAREFI-INIFAP-UNAM, Centro de Investigación区域中心
- 13.
Weber LE, Irwin MD, Baltensperger DD, Applegate WW, Lehmann JW, Putnam DH:苋菜谷物生产指南。1990年,艾玛斯,PA:罗代尔出版社
- 14.
Wilson RL:中西部以谷物苋菜为食的昆虫研究。中国昆虫学报,2004,26(4):344 - 344。
- 15.
Fomsgaard I, Añon M, Barba de la Rosa A, Christophersen C, Dusek K, Délano- Frier J, Espinoza Pérez J, Fonseca A, Janovská D, Kudsk P, Labouriau R, Lacayo-Romero M, Martínez N, Matus F, Matusová K, Mathiassen S, Noellemeyer E, Pedersen H, Stavelikova H, Steffensen S, de Troiani R, Taberner A:为神圣谷物增加价值:为开发阿兹特克富含蛋白质的谷物Amaranth提供关键工具。欧洲-拉丁美洲联合研究项目的结果,2010年,丹麦:奥尔胡斯大学农业科学学院病虫害综合管理系
- 16.
Vargas-Ortiz E: Estudio de la redistribución de碳hidratos y nitrógeno como可能的机制de耐受a pérdida de tejido叶por herbivoría y/o daño mecánico苋菜。硕士论文。2009, Irapuato政府部门,Biotecnología y Bioquímica
- 17.
Martínez-Moreno D, Nuñez-Farfán J, Terrazas T, Muiz LD, Trinidad-Santos A, Trejo C, Larque-Saavedra A:来自墨西哥北普埃布拉山脉的两种苋的塑料响应。作物学报,1998,29(2):377 - 377。10.1023 /: 1008605531633。
- 18.
Bruce TJ, Pickett JA:生物攻击诱导植物防御信号。植物学报,2007,10:387-392。10.1016 / j.pbi.2007.05.002。
- 19.
植物对昆虫食草动物的免疫。植物学报,2008,29(4):344 - 344。10.1146 / annurev.arplant.59.032607.092825。
- 20.
Nuñez-Farfán J, Fornoni J, Valverde PL:对草食动物抗性和耐受性的进化。中国生态环境学报,2007,38(4):541-566。10.1146 / annurev.ecolsys.38.091206.095822。
- 21.
Schwachtje J, Baldwin IT:为什么食草动物的攻击会重新配置初级代谢?植物科学学报,2008,29(3):344 - 344。10.1104 / pp.107.112490。
- 22.
Stowe KA, Marquis RJ, Hochwender CG, Simms EL:容忍消费者损害的进化生态学。生态学报,2000,31:565-595。10.1146 / annurev.ecolsys.31.1.565。
- 23.
Farrar JF:下沉强度:它是什么?我们如何测量它?植物细胞环境学报,1993,16:1015-10.1111/j.1365-3040.1996.tb02047.x。
- 24.
McCormick AJ, Cramer MD, Watt DA:碳汇强度调节甘蔗光合作用。中国生物工程学报,2006,29(4):457 - 457。10.1111 / j.1469-8137.2006.01785.x。
- 25.
Paul MJ, Pellny TK:碳代谢产物反馈调控叶片光合作用和发育。应用物理学报,2003,34(4):539-547。10.1093 / jxb / erg052。
- 26.
李志强,李志强,李志强,等。植物糖信号的研究进展。植物科学学报,2006,27(3):344 - 344。
- 27.
McCormick AJ, Cramer MD, Watt DA:甘蔗源库扰动过程中叶片光合速率和基因表达的变化。学报学报,2008,101:89-102。
- 28.
Baldwin IT:生态研究中的草食模拟。生态环境学报,1999,5:91-93。10.1016 / 0169 - 5347(90) 90237 - 8。
- 29.
Lethilä K,博尔特E:人工草食在植物食草动物研究中的使用和有用性。生态研究。编辑:Wiesser WW SE。2004,柏林海德堡:Springer-Verlag, 257-273。
- 30.
Délano-Frier JP, Avilés-Arnaut H, Casarrubias-Castillo K, Casique-Arroyo G, Castrillón-Arbeláez PA, Herrera-Estrella L, Massange-Sánchez J, Martínez-Gallardo NA, Parra-Cota FI, varga - ortiz E, Estrada-Hernández MG:谷物苋菜(Amaranthus hypochondriacus)的转录组分析:与A. tuberculatus的比较,茎的表达谱以及对生物和非生物胁迫的响应。BMC基因组学杂志,2011,12:363-10.1186/1471-2164-12-363。
- 31.
Klotz KL, Haagenson DM:损伤、缺氧和低温诱导甜菜蔗糖合酶转录变化,与蛋白质表达和活性无关。植物营养学报,2008,29(4):344 - 344。10.1016 / j.jplph.2007.02.001。
- 32.
Vargas WA, Pontis HG, Salerno GL:碱性和中性转化酶在环境胁迫下的差异表达:小麦叶片中碱性异构体作为胁迫反应酶的特征。植物学报,2007,26(3):344 - 344。10.1007 / s00425 - 007 - 0590 - 3。
- 33.
Xiang L, Le Roy K, Bolouri-Moghaddam MR, Vanhaecke M, Lammens W, Rolland F, Van den Ende W:拟南芥中性转化酶-氧化应激防御关系的研究。应用物理学报,2011,29(3):344 - 344。10.1093 / jxb / err069。
- 34.
王志刚,王志刚,王志刚,等。甜菜叶柄液泡转化酶表达的昼夜节律和发育调控。植物学报,2005,22(3):366 - 366。10.1007 / s00425 - 005 - 1542 - 4。
- 35.
大山A,西村S,平井M:番茄(Lycopersicon esculentum)细胞壁酸性转化酶cDNA的克隆及可溶性转化酶和细胞壁转化酶在番茄和番茄损伤叶中的表达。植物遗传工程学报,1998,29(3):344 - 344。10.1266 / ggs.73.149。
- 36.
尹永g,小林Y, Sanuki A,近藤S,福田N, Ezura H, Sugaya S, Matsukura C:盐度诱导番茄碳水化合物积累和糖调节淀粉生物合成基因的研究'Micro-Tom')的果实不受ABA和渗透胁迫的影响。应用物理学报,2010,29(3):344 - 344。10.1093 / jxb / erp333。
- 37.
Kwak MS, Min SR, Lee SM, Kim KN, Liu JR, Paek KH, Shin JS, Bae JM: adp -葡萄糖焦磷酸化酶基因(NtAGP)在“Xanthi”烟草花瓣扩张生长中是必需的。中国农业科学,2007,27(3):457 - 457。10.1104 / pp.107.102095。
- 38.
Adhikari TB, Balaji B, Breeden J, Goodwin SB:小麦对小麦真菌病的抗性涉及基因表达的早期和晚期高峰。中国生物医学工程学报,2007,29(3):344 - 344。10.1016 / j.pmpp.2007.10.004。
- 39.
Weigelt K, Kuster H, Rutten T, Fait A, Fernie AR, Miersch O, Wasternack C, Emery RJ, Desel C, Hosein F, Muller M, Saalbach I, Weber H:缺乏adp -葡萄糖焦磷酸化酶的豌豆胚胎揭示了碳氮代谢和应激反应的特异性转录和代谢变化。植物科学进展,2009,29(3):349 - 349。10.1104 / pp.108.129940。
- 40.
Rausch T, Greiner S:植物蛋白转化酶抑制剂。生物化学学报,2004,16(3):344 - 344。10.1016 / j.bbapap.2003.09.017。
- 41.
Castrillón-Arbeláez PA, Délano-Frier JP:抑制的甜面:转化酶抑制剂及其在植物发育和胁迫反应中的重要性。中国生物医学工程学报,2011,29(3):377 - 377。10.2174 / 157340811798807588。
- 42.
Sturm A, Chrispeels MJ:胡萝卜胞外果糖苷酶cDNA的克隆及其在损伤和细菌感染中的表达。植物科学学报,2000,22(2):357 - 357。
- 43.
王晓东,张晓东,张晓东,赵建军:植物叶绿体ORF2280同源序列的系统发育分析。[J] .计算机工程学报,1997,33(4):344 - 344。10.2307 / 2446087。
- 44.
Ray T, Roy SC:利用RAPD和ISSR标记研究下恒河平原苋科和藜科植物的系统发育关系。孟加拉国学报,2007,36:21-28。
- 45.
王晓明,王晓明,王晓明,等:马铃薯adp -葡萄糖焦磷酸化酶小亚基的结构和表达。中国生物医学工程学报,2004,26(4):497 - 497。
- 46.
Müller-Rober B, Nast G, Willmitzer L:甜菜adp -葡萄糖焦磷酸化酶一个小亚基和一个大亚基cDNA克隆的分离与表达分析。植物分子生物学杂志,1995,27:191-197。10.1007 / BF00019190。
- 47.
张志刚,张志刚,张志刚,张志刚。拟南芥蔗糖合成酶基因家族分析。植物学报,2007,29(3):344 - 344。10.1111 / j.1365 - 313 x.2006.03011.x。
- 48.
王晓明,王晓明,王晓明,等:红藜中蔗糖合酶表达的调控:光自养悬浮培养中糖诱导的表达及其在植物库组织中的特异性表达。植物营养学报,2004,26(3):531 - 531。10.1016 / s0176 - 1617(11) 82046 - 8。
- 49.
黄志刚,李志刚,李志刚:甜菜蔗糖合酶基因在器官特异性和发育性表达上的差异。植物营养学报,2006,29(3):344 - 344。10.1016 / j.jplph.2005.05.006。
- 50.
小松A, Moriguchi T,小山K, Omura M, Akihama T:柑橘蔗糖合酶基因的不同作用和系统发育关系分析。应用物理学报,2002,53:61-71。10.1093 / jexbot / 53.366.61。
- 51.
Hesse H, Willmitzer L:甜菜(Beta vulgaris L.)蔗糖合酶基因的表达分析。植物化学学报,1996,30:863-872。10.1007 / BF00020799。
- 52.
苏柏亚,杨晓明,杨晓明,杨晓明,杨晓明。玉米蔗糖合酶线粒体定位及其信号功能的研究。中国生物医学工程学报,2006,28(1):457 - 457。10.1074 / jbc.M600355200。
- 53.
Sturm A, Hess D, Lee HS, Lienhard S:中性转化酶是一种新型蔗糖裂解酶。化学工程学报,1999,27(3):344 - 344。10.1034 / j.1399-3054.1999.100202.x。
- 54.
Vargas WA, Pontis HG, Salerno GL:蔗糖代谢的新见解:叶绿体中活性A/N-Inv的证据揭示了细胞内碳运输的新成分。植物学报,2008,27(3):344 - 344。10.1007 / s00425 - 007 - 0657 - 1。
- 55.
Nonis A, Ruperti B, Pierasco A, Canaguier A, Adam-Blondon AF, Di Gaspero G, Vizzotto G:葡萄中性转化酶及其与拟南芥、杨树和水稻的比较分析。植物学报,2008,29(4):344 - 344。10.1007 / s00425 - 008 - 0815 - 0。
- 56.
黄龙,Bocock PN, Davis JM, Koch KE:转化酶的调控:一套转录和转录后机制。植物学报,2007,34:499-507。10.1071 / FP06227。
- 57.
Rae AL, Casu RE, Perroux JM, Jackson MA, Grof CPL:可溶性酸性转化酶通过信号锚定机制定向到液泡。中国植物学报,2011,29(3):344 - 344。10.1016 / j.jplph.2010.11.003。
- 58.
Maas C, Laufs J, Grant S, Korfhage C, Werr W:玉米-1基因第一个外显子上的刺激元件与内含子1的结合可使报告基因表达提高1000倍。植物分子生物学杂志,1997,16:199-207。10.1007 / BF00020552。
- 59.
阮丽丽,金勇,杨玉军,李国军,Boyer JS:蔗糖酶介导的糖输入、代谢和信号通路:在植物发育、产量潜力和干旱高温响应中的作用。植物学报,2010,3:942-955。10.1093 / mp / ssq044。
- 60.
朱艳,蔡小玲,王志智,洪明敏:水稻Wx基因的转录调控与MYC蛋白与EREBP蛋白的相互作用有关。中国生物医学工程学报,2003,27(3):357 - 357。10.1074 / jbc.M302806200。
- 61.
Alberto F, Bignon C, Sulzenbacher G, Henrissat B, Czjzek M:海洋热toga转化酶(β -果糖苷酶)的三维结构揭示了一种双模块排列以及保留和转化糖苷酶的进化关系。中国生物医学工程学报,2004,29(3):344 - 344。10.1074 / jbc.M313911200。
- 62.
潘文杰,张志刚,张志刚:白杨转化酶基因的多样性与进化。植物学报,2008,27(3):344 - 344。10.1007 / s00425 - 007 - 0639 - 3。
- 63.
彭志强,李志强,李志强,马奎斯,马奎斯,李志强,李志强,李志强。糖苷水解酶家族32的结构模型。蛋白质学报,1998,33:383-395。10.1002 / (SICI) 1097 - 0134 (19981115) 33:3 < 383:: AID-PROT7 > 3.0.CO; 2 r。
- 64.
光合淀粉的形成与根与梢间干重分配的关系。《中华人民共和国学报》,2003,29(4):379 - 379。10.1139 / b83 - 298。
- 65.
Orians CM, Thorn A, Gomez S:食草动物诱导的植物资源隔离:为什么要麻烦?生态学报,2011,37(3):344 - 344。10.1007 / s00442 - 011 - 1968 - 2。
- 66.
陈志伟,陈志伟,陈志伟,陈志伟,陈志伟,陈志伟,陈志伟,陈志伟,陈志伟,陈志伟。资源限制对大叶桉叶片再生的影响。树物理学报,2012,32:24-35。10.1093 / treephys / tpr128。
- 67.
Kosola KR, Dickmann DI, Paul EA, Parry D:重复昆虫脱叶对杨树生长、氮获取、碳水化合物和根系种群的影响。生态学报,2001,29(4):344 - 344。10.1007 / s004420100694。
- 68.
Palacio S, Hester AJ, Maestro M, Millard P:毛桦树的碳不受限制。生态学报,2008,22:808-815。10.1111 / j.1365-2435.2008.01433.x。
- 69.
潘建平,陈晓明,陈晓明,陈晓明,陈晓明:不同木材结构对植物环内碳分配的影响。树物理学报,2011,31:150-159。10.1093 / treephys / tpq110。
- 70.
Tschaplinski TJ, Blake TJ:杂交杨树枝条脱叶和断头后碳水化合物的迁移。树物理学报,1994,14:141-151。10.1093 / treephys / 14.2.141。
- 71.
李JM, Sathish P, Donaghy DJ, Roche JR:植物改变生物过程以确保碳消耗后的生存:黑麦草模型。PLoS ONE。2010, 5: e12306-10.1371/journal.pone.0012306。
- 72.
李志刚,李志刚,李志刚,李志刚,李志刚:植物光合能力和资源分配的研究进展。生态学报,1981,50:14-24。10.1007 / BF00378790。
- 73.
Rivera-Solís G, Abdala-Roberts L, Cervera JC, Parra-Tabla V, Ruiz-Ruiz J, betancr - ancona D:裸花Ruellia的落叶补偿机制与性状。植物生态学报,2012,29(3):344 - 344。10.1007 / s11258 - 011 - 9977 - 0。
- 74.
方晓伟,李建辉,熊玉春,徐德华,范晓伟,李芬芬:柠条的响应。去芽:再生的机制。生态学报,2008,23:863-871。10.1007 / s11284 - 007 - 0449 - x。
- 75.
杨晓明,杨晓明,杨晓明,等:玉米厌氧幼苗蔗糖合酶表达的转录后调控。中国农业科学,2004,29(4):457 - 457。10.1104 / pp.90.4.1359。
- 76.
Barrero-Sicilia C, Hernando-Amado S, Gonzalez-Melendi P, Carbonero P:大麦四种不同蔗糖合酶基因的结构、表达谱和亚细胞定位。植物学报,2011,34(3):366 - 366。10.1007 / s00425 - 011 - 1408 - x。
- 77.
Baud S, Vaultier MN, Rochat C:拟南芥蔗糖合酶多基因家族的结构和表达谱。应用物理学报,2004,55:397-409。10.1093 / jxb / erh047。
- 78.
蔗糖代谢:调节机制和关键作用在糖感测和植物发育。中国植物学报,2004,27(3):349 - 349。10.1016 / j.pbi.2004.03.014。
- 79.
王晓明,李志刚,李志刚,李志刚,李志刚。拟南芥蛋白质加工和降解机制的研究进展。美国国家科学研究院。2003, 21(4): 389- 394。10.1073 / pnas.1230987100。
- 80.
张海军,董明敏,王文明,王伟,宋文文,窦晓阳,郑小斌,张志刚:本色烟液泡加工酶(VPE)在诱导诱导的高敏感反应和气孔关闭中的作用。应用物理学报,2010,29(3):344 - 344。10.1093 / jxb / erq189。
- 81.
杨永强,杨永强:诱导沉陷强度是杨树叶片诱导单宁生物合成的前提。生态学报,2002,29(3):344 - 344。10.1007 / s00442 - 001 - 0839 - 7。
- 82.
Roitsch T, Gonzalez MC:植物转化酶的功能和调节:甜的感觉。植物科学进展,2004,9:606-613。10.1016 / j.tplants.2004.10.009。
- 83.
Murayama S, Handa H:水稻碱性/中性转化酶基因:碱性/中性转化酶位于植物线粒体和质体中。植物学报,2007,25(3):344 - 344。10.1007 / s00425 - 006 - 0430 - x。
- 84.
Tetlow IJ, Morell MK, Emes MJ:高等植物淀粉代谢调控研究进展。应用物理学报,2004,29(3):344 - 344。10.1093 / jxb / erh248。
- 85.
Tiessen A, Hendriks JH, Stitt M, Branscheid A, Gibon Y, Farre EM, Geigenberger P:马铃薯块茎淀粉合成受adp -葡萄糖焦磷酸化酶翻译后氧化还原修饰的调控:一种将淀粉合成与蔗糖供应联系起来的新调控机制。植物学报,2002,30(4):344 - 344。10.1105 / tpc.003640。
- 86.
Tiessen A, Prescha K, Branscheid A, Palacios N, McKibbin R, Halford NG, Geigenberger P: snf1相关激酶和己糖激酶参与单独的糖信号通路,调节薯茎中adp -葡萄糖焦磷酸化酶翻译后氧化还原激活的证据。植物学报,2003,35:489 - 497。10.1046 / j.1365 - 313 x.2003.01823.x。
- 87.
李江,Ezquer我巴哈吉,蒙特罗M, Ovecka M, Baroja-Fernandez E,穆尼奥斯FJ,梅里达,Almagro G,伊达尔戈M, Sesma MT, Pozueta-Romero J:微生物volatile-induced异常高的拟南芥叶片的淀粉含量积累是一个过程涉及NTRC和淀粉合酶III和IV类。摩尔植物微生物相互作用。2011年,24:1165 - 1178。10.1094 / mpmi - 05 - 11 - 0112。
- 88.
Szydlowski N, Ragel P, Raynaud S, Lucas MM, Roldan I, Montero M, Munoz FJ, Ovecka M, Bahaji A, Planchot V, pozuta - romero J, D’hulst C, Merida A:拟南芥淀粉粒的形成需要IV类或III类淀粉合酶的存在。植物学报,2009,21:2443-2457。10.1105 / tpc.109.066522。
- 89.
柯士曼,劳埃德。J:理解和影响淀粉生物化学。中国生物化学学报,2004,26(3):344 - 344。
- 90.
陈松,李小强,赵安,王玲,李霞,史强,陈明,郭娟,张娟,祁东,刘刚:水稻幼苗叶片脱落早期响应的基因及其诱导途径。分子生物学杂志,2009,11:81-100。
- 91.
方晓文,李亚波,徐德华,杨晓明,王刚:柠条地上部去枝后根系淀粉水解酶活性及淀粉动员。树结构功能,2007,21:93-100。
- 92.
Gallagher JA, Volenec JJ, Turner LB, Pollock CJ:白三叶草脱叶后淀粉水解酶活性的研究。作物科学,1997,37:1812-1818。10.2135 / cropsci1997.0011183X003700060025x。
- 93.
Schwachtje J, Minchin PEH, Jahnke S, van Dongen JT, Schittko U, Baldwin IT: snf1相关激酶通过分配碳到根中使植物耐受食草性。自然科学进展,2006,29(3):344 - 344。10.1073 / pnas.0602316103。
- 94.
高等植物蔗糖转运体的分子生理学研究。中国农业科学,2007,29(4):489 - 497。10.1016 / j.febslet.2007.03.048。
- 95.
Berthier A, Desclos M, Amiard V, Morvan-Bertrand A, Demmig-Adams B, Adams WW, Turgeon R, Prud'homme MP, Noiraud-Romy N:脱叶黑麦草蔗糖转运的激活:异体韧皮部负载可塑性的一个例子。植物生理学报,2009,30(4):344 - 344。10.1093 /卡式肺囊虫肺炎/ pcp081。
- 96.
Meyer S, Lauterbach C, Niedermeier M, Barth I, Sjolund RD, Sauer N:拟南芥筛元和沉库组织中蔗糖转运体AtSUC3的表达增强。中国农业科学,2004,27(4):344 - 344。10.1104 / pp.103.033399。
- 97.
Kubis SE, Pike MJ, Everett CJ, Hill LM, Rawsthorne S:油菜(Brassica napus, L.)发育胚胎中的质体对磷酸烯醇丙酮酸的导入及其作为脂肪酸合成底物的潜力。应用物理学报,2004,29(3):344 - 344。10.1093 / jxb / erh157。
- 98.
Prabhakar V, Lottgert T, Geimer S, Dormann P, Kruger S, Vijayakumar V, Schreiber L, Gobel C, Feussner K, Feussner I, Marin K, Staehr P, Bell K, Flugge UI, Hausler RE:拟南芥配子体和孢子体发育中磷酸烯醇式pyruvate的供给是必不可少的。中国生物医学工程学报,2010,29(4):344 - 344。10.1105 / tpc.109.073171。
- 99.
李志刚,李志刚,李志刚,李志刚:转运蛋白在植物质体能量供给中的作用。应用物理学报,2011,32(2):344 - 344。10.1093 / jxb / erq361。
- One hundred.
Sánchez-Hernández C, Martínez-Gallardo N, Guerrero-Rangel A, Valdés-Rodríguez S, Délano-Frier J:苋菜(Amaranthus hypochondriacus)叶片中胰蛋白酶和A -淀粉酶抑制剂对生物和非生物胁迫的响应差异。中国生物医学工程学报,2004,29(3):344 - 344。10.1111 / j.0031-9317.2004.00398.x。
- 101.
Babst BA, Ferrieri RA, Gray DW, Lerdau M, Schlyer DJ, Schueller M, Thorpe MR, Orians CM:茉莉酸诱导胡杨碳运输和分配的快速变化。中国农业科学,2005,27(3):344 - 344。10.1111 / j.1469-8137.2005.01388.x。
- 102.
Baldwin IT:茉莉酸甲酯诱导烟叶产生尼古丁:在田间诱导防御而不伤人。中国昆虫学报,1998,20(3):326 - 326。10.1111 / j.1570-7458.1996.tb00921.x。
- 103.
Thaler JS, Stout MJ, Karban R, Duffey SS:外源茉莉酸在实验室和田间模拟番茄植物(Lycopersicon esculentum)昆虫伤害。化学学报,1996,22:1767-1781。10.1007 / BF02028503。
- 104.
Kerchev PI, Fenton B, Foyer CH, Hancock RD:植物对昆虫食草性的反应:光合作用、活性氧和激素信号通路的相互作用。植物生态学报,2012,35:441-453。10.1111 / j.1365-3040.2011.02399.x。
- 105.
Massange-Sánchez J: Análisis de la expresión y caracterización分子del gen Ah24诱导por daño mecánico, herbivoría y adición exógena de MeJA en plantas de Amaranthus疑病。硕士论文。2011,伊拉普托联合政府,政府部门Biotecnología y Bioquímica
- 106.
Babst BA, Ferrieri RA, Thorpe MR, Orians CM:舞毒蛾草食诱导黑杨树碳运输和分配的快速变化。中国昆虫学报,2008,29(2):344 - 344。10.1111 / j.1570-7458.2008.00698.x。
- 107.
胡杨营养贮藏蛋白基因与茉莉酸甲酯基因的相互作用及蛋白质积累和生物量分配。中国林业科学,2000,30:1066 - 1066。
- 108.
拟南芥茉莉酸甲酯过量生产对种子产量、抗落叶能力和竞争效应及反应的影响。中国生物工程学报,2007,29(3):344 - 344。10.1111 / j.1469-8137.2006.01882.x。
- 109.
Halitschke R, Gase K, Hui DQ, Schmidt DD, Baldwin IT:鳞翅目(Sphingidae)特殊食草动物Manduca sexta与其自然宿主烟叶的分子相互作用。微阵列分析显示,大多数食草动物特异性转录变化是由脂肪酸-氨基酸缀合物介导的。植物科学学报,2003,31(4):344 - 344。10.1104 / pp.102.018184。
- 110.
McCloud ES, Baldwin IT:草食性和毛虫反刍物放大了樟脑叶烟草中茉莉酸的伤口诱导的增加,而不是尼古丁。植物学报,1997,33(4):457 - 457。10.1007 / s004250050210。
- 111.
Steinbrenner AD, Gomez S, Osorio S, Fernie AR, Orians CM:食草动物诱导番茄初级代谢的变化:全植物视角。化学生态学报,2011,37:1294-1303。10.1007 / s10886 - 011 - 0042 - 1。
- 112.
植物对食草动物的各种反应。植物生长学报,2000,19:195-216。
- 113.
Gepstein S, Sabehi G, Carp MJ, Hajouj T, Nesher MFO, Yariv I, Dor C, Bassani M:叶片衰老相关基因的大规模鉴定。植物学报,2003,36(3):344 - 344。10.1046 / j.1365 - 313 x.2003.01908.x。
- 114.
Livak KJ, Schmittgen TD:利用实时定量PCR和2-ΔΔCt方法分析相关基因表达数据。方法,2001,25:402-408。10.1006 / meth.2001.1262。
- 115.
Roitsch T, Bittner M, Godt DE: d -葡萄糖和葡萄糖类似物及组织特异性表达诱导红藜的外质体转化酶,提示其在库源调节中的作用。植物营养学报,2004,18(4):457 - 457。10.1104 / pp.108.1.285。
- 116.
Murray MG, Thompson WF:高分子量植物DNA的快速分离。中国生物医学工程学报,2000,28(4):439 - 439。10.1093 / nar / 8.19.4321。
- 117.
Altschul SF, Gish W, Miller W, Myers EW, Lipman DJ:基本的局部对齐搜索工具。中华分子生物学杂志,2000,26(3):344 - 344。
- 118.
Teska JD, Coyne SR, Ezzel LJW, Allan CM, Redus SL:使用细胞脂肪酸气相色谱分析和商业可用数据库鉴定炭疽芽孢杆菌。安捷伦科技有限公司,2003,1-5。
- 119.
王志刚,王志刚,王志刚:VA菌根侵染对三叶草光合作用和生物量的影响。植物生态学报,1998,21(3):379 - 379。10.1046 / j.1365-3040.1998.00280.x。
- 120.
Scholes JD, Lee PJ, Horton P, Lewis DH:转化酶:了解白粉病感染大麦叶片光合作用和碳水化合物代谢的变化。环境科学学报,1994,26(3):344 - 344。10.1111 / j.1469-8137.1994.tb03939.x。
- 121.
P:淀粉酶,α和β。生物化学学报,1995,12(3):344 - 344。
确认
这项工作在很大程度上得到了欧盟委员会第6个框架计划AMARANTH: FUTURE-FOOD的资金支持,合同编号032263。同时感谢México Tierra de Amaranto a.c.和Deborah Presser-Velder基金会的财政支持。PACA和HAA由美国国家科学技术委员会(CONACyT, México)授予的研究生奖学金(代码分别为228820和191369)资助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
JPDF设计并协调了这项研究。所有实验由PACA完成。她在统计学和基因组学方面得到了HAA的帮助,在代谢物和酶的测定方面得到了NAMG的帮助。PACA和JPDF对数据进行了分析。ATF帮助实时PCR方法。JPDF和ATF撰写了手稿。所有作者都阅读并批准了手稿的最终版本。
电子辅助材料
12870 _2012_1151_moesm1_esm.doc
附加文件1:在脱叶植物的不同组织中选择用于分析的粒苋菜基因的特征,以确定它们在C动员和耐受中的可能作用。(doc 90kb)
12870 _2012_1151_moesm4_esm.docx
附加文件4:植物adp -葡萄糖焦磷酸化酶(AGP)推导氨基酸序列的比较。(docx266kb)
ADP葡萄糖焦磷酸化酶一个小亚基编码苋菜基因的结构(
附加文件6:AhAGPS-1)和液泡转化酶(AhVI-1).(docx64kb)
调控元件鉴定的启动子区域
附加文件7:AhAGPS-1而且AhVI-1基因。利用PLACE、PlantCARE和Genomatix Matinspector数据库分析5’调控区。(docx33 kb)
在adp -葡萄糖焦磷酸化酶和空泡转化酶基因中鉴定的5 '调控区域的比较
附加文件8:茄属植物tuberosum,s . lycopersicum甜菜属而且苋属hypochondriacus。(docx16kb)
12870 _2012_1151_moesm9_esm.docx
附加文件9:一项非典型实验的结果表明,淀粉在MD植物的茎和根中长期积累。(docx118 kb)
引物用于扩增该基因的5 '和3' cDNA末端(RACE)和基因组序列,包括部分启动子区域
附加文件12:AhVI-1而且AhAGPS-1基因。(docx18kb)
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
Castrillón-Arbeláez, p.a., Martínez-Gallardo, N., Arnaut, H.A.et al。苋菜籽粒碳动员、利用和补充相关的代谢和酶促变化(苋属cruentus),以应对因机械损伤或昆虫食草而导致的部分落叶。BMC植物生物学12日,163(2012)。https://doi.org/10.1186/1471-2229-12-163
收到了:
接受:
发表:
关键字
- 碳水化合物代谢
- 碳水化合物动员
- 碳封存
- 落叶
- 粮食苋菜
- 可塑性
- 宽容