抽象的
背景
在所有生物体内观察到的某些蛋白质的本质上的非结构状态是基本细胞功能所必需的。在这一领域,从植物中获得的信息有限,但已经达到了一个水平,这些蛋白质可以根据紊乱、功能和进化进行综合分类。
结果
我们对植物基因组的分析证实,核编码蛋白质遵循与其他多细胞真核生物相同的趋势;然而,叶绿体和线粒体编码的蛋白质保留了古生菌和细菌的模式,与它们的系统发育起源一致。基于目前关于从叶绿体到细胞核的基因转移的知识,我们报道了转移的紊乱率和核编码蛋白之间的强相关,甚至是在叶绿体中发挥功能作用的多肽。我们进一步调查这一趋势评估的叶绿体核糖体蛋白质,传输的最具代表性的一个基因簇,发现核糖体亚基,由多数nuclear-encoded蛋白质,显然比小,更非结构化集成主要plastid-encoded蛋白质。
结论
我们的观察表明,植物细胞核的进化动力学会给基因添加无序片段,无论它们的来源如何,但目前在两个基因组中编码的蛋白质除外,这可能是由于功能限制。
背景
基因组的相关分数编码用于与结构无序区的蛋白质。本质蛋白障碍是指段或到不折叠成定义良好的规则三维结构中隔离全蛋白(IE。不束缚其他分子)[1那2].该疾病涵盖局部柔性环,延伸域,熔化球域和折叠域,具有柔性接头[3.].因此,蛋白质可能完全无序或部分紊乱,其特征在于仅跨越几(<10)连续无序残留物(否则结构良好的蛋白质的环)或连续无序残留物的长拉伸(> 30)。思想蛋白质障碍的存在赋予蛋白质的动态灵活性,从而允许不同结构状态之间的过渡[4.].这种增加的灵活性有利于蛋白质识别多个目标分子,如DNA、RNA、其他蛋白质或小配体[3.那5.].预测,30%至60%的蛋白质含有30个或更多的无序残留物的延伸,多细胞真核生物具有比单细胞真核生物更高的预测疾病[6.].有证据表明,所有生物都共有的非结构状态对基本的细胞功能至关重要[5.那7.].全细胞NMR实验表明,可以存在内在疾病在活的有机体内[3.那8.因此,这种状态不会仅从未能找到折叠或配体结合的正确条件。尽管它们缺乏定义的三维(3D)结构,但这些蛋白质进行了基本功能,大多与细胞中的调节过程相关,包括转录,翻译,细胞信号转导,蛋白质磷酸化,小分子的储存,以及通常需要对大型多蛋白质复合物的自组装的调节,其中通常需要与多个伴侣和高特异性/低亲和力相互作用的相互作用。无序区域提供的功能多样性补充有序蛋白质区域的互补性[9.-11].还报告了无序界面在调制细胞调节响应中的重要性,通过对不同的结合伙伴切换其特异性来参与微妙的规则[12].
在植物中,与其他真核生物相比,有关蛋白质内在紊乱的信息是相当有限的拟南芥蒂利亚纳这是第一个完成基因组测序的项目。特别是有人指出,具有伴侣活性的晚期胚胎发育丰富(LEA)蛋白和脱水蛋白缺乏稳定的三维结构,可能完全无序[13-15].这些蛋白质与非生物胁迫耐受性有关,特别是具有冷应激和脱水。铲球的计算预测等等。[1]没有揭示蛋白质组之间的显着紊乱差异答:芥以及其他真核生物。然而,目前还不知道这种情况是否适用于所有的植物蛋白质组。另外,另一个被忽略的方面是比较细胞器和核蛋白质组的紊乱程度。进化分析A. Thaliana,蓝藻和叶绿体基因组揭示了许多基因在植物进化过程中从质体转移到细胞核[16].特别是,据估计在答:芥从塑性水的蓝杆菌祖先获得大约18%的蛋白质编码基因。
目前的计算分析被认为是关键的,并且对非结构化蛋白的鉴定和表征是至关重要的[2那17].几种方法已经被开发,以从氨基酸序列,如DisEMBL [预测固有紊乱18];GLOBPROT2 [19];Disopred2 [20.那21];iupred [22];PONDR VL-XT [23-25]等等。在这些中,我们决定使用Dispred2软件,其在蛋白质结构预测实验(Casp6-9)的四个连续评估中,在四个连续的批判性评估中实现了0.95的特异性,并且已被证明是长期无序的最佳预测因子Casp9中的地区[26那27].
本文采用DISOPRED2方法对8种维管植物、1种苔藓植物和3种绿藻的质体、线粒体和核基因组中编码的蛋白质进行了无序分析。为了获得生物学和进化的见解,我们聚焦于叶绿体基因的子集,这些基因在植物进化过程中移动到细胞核。研究发现,原来的叶绿体编码蛋白在其基因转移到细胞核后获得了紊乱。相反,仍然编码在叶绿体染色体中的蛋白质几乎没有紊乱。最后,为了进一步评估这些发现,我们回顾了在叶绿体核糖体亚单位(最具代表性的转移基因簇之一)中失调的合并,并将其与细菌的对应基因进行了比较。
结果
蛋白质序列中氨基酸的紊乱和发生的分析
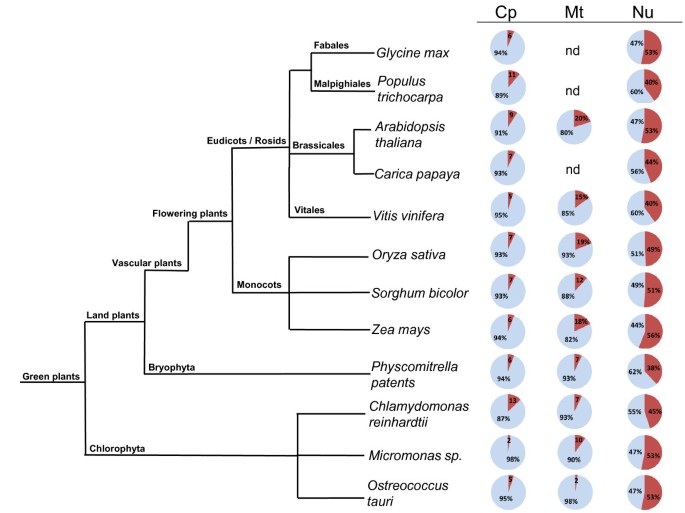
我们分析了12种完全植物蛋白质蛋白质蛋白质疾病的发生(参见材料和方法)。叶绿体(加利福尼亚州.平均85种蛋白质)、线粒体(加利福尼亚州。平均64种蛋白质)和核(加利福尼亚州。分别分析蛋白质组,计算不同长度(L)紊乱区域的发生情况。在植物核蛋白质组中,L≥30、L≥40和L≥50的预测紊乱片段的百分比被测定(详细信息见附加文件)1:表S1)。数据显示,紊乱的平均范围分别为40 - 56%、26 - 44%和19 - 33%。数字1汇总L≥30的预测无序片段对应的数据。最高比例的失调是在Zea Mays.(56.2%),甘氨酸最大(53.3%),Physcomitella Thaliana.(52.6%),Micromonassp。RCC299(52.9%)和欧洲核心糖陶里(52.5%)。总体而言,维管植物(8种)与苔藓植物(1种)、绿藻植物(3种)间差异无统计学意义(Χ2Brophyta的2.367的值和0.060用于叶绿藻,见附加文件2:表S2)。尽管如此Physcomitrella金属盘具有最低百分比,38.2%,靠近古痤疮和细菌中发现的值。值得一提的是,单像和拒于在单焦和逃税之间没有观察到明显差异。
叶绿体(2-13%)和线粒体(2 - 19%)蛋白质蛋白质显然表现出比核损失更少(附加档案1:表S1)。In chloroplasts for L ≥ 30,MicromonasSP显示最低的疾病(2%),也许令人惊讶葡萄显示值(4.6%)接近微藻。线粒体的比例最低(2.3%)欧洲核心糖陶里.
为了验证我们对疾病的预测,我们在蛋白质数据库(PDB)中搜索了与答:芥如材料和方法中所述,在我们的分析中鉴定为本质上紊乱的蛋白质。这是一个非常有限的验证工作,因为只能恢复70个序列的数据。然而,我们发现49/70(如果我们认为与预测的无序区域部分对齐的末端序列,则认为末端序列)包含未解决的3D结构的段。
计算L≥30的无序片段沿蛋白质全序列的分布情况,使蛋白质分裂n终端(40 AA),C-终端(40个氨基酸)和内部区域。表格中的结果1表明,在核蛋白质中,与蛋白质序列的极端(14-30%)相比,在蛋白质的内部区域(50-65%)中,无序区域在蛋白质的内部区域(50-65%)略微较大(50-65%)。N-末端部分(20 - 31%)比C-末端1(14 - 20%)。这种分布与计算叶绿体和线粒体的分布不同;在细胞器中,结果显示内部区域(叶绿体中21 - 41%,线粒体中28 - 46%)与末端区域(叶绿体中15 - 44%,线粒体中24 - 41%)发生的紊乱更为相似。这种情况在所有研究的植物蛋白质组中都很常见,除了来自植物的叶绿体c . reindhartii,其紊乱分布与在核蛋白质组中观察到的分布相似(IE。,内部部分比终端区域更混乱)。
无序的蛋白质的氨基酸的频率进行了分析。在从核蛋白质组内在无序区的氨基酸残基Ser,Pro中,谷氨酰胺,赖氨酸和Glu超限额。相反,用最低的频率的氨基酸残基是色氨酸,半胱氨酸,酪氨酸,苯丙氨酸,异亮氨酸,亮氨酸和Val(附加文件3.:图S1A)。在叶绿体和线粒体中观察到一些差异:Lys和Met的频率较高,Ser和Pro的频率较低3.:图S1B和S1C)。
在细胞核中由可塑基因编码的蛋白质的紊乱
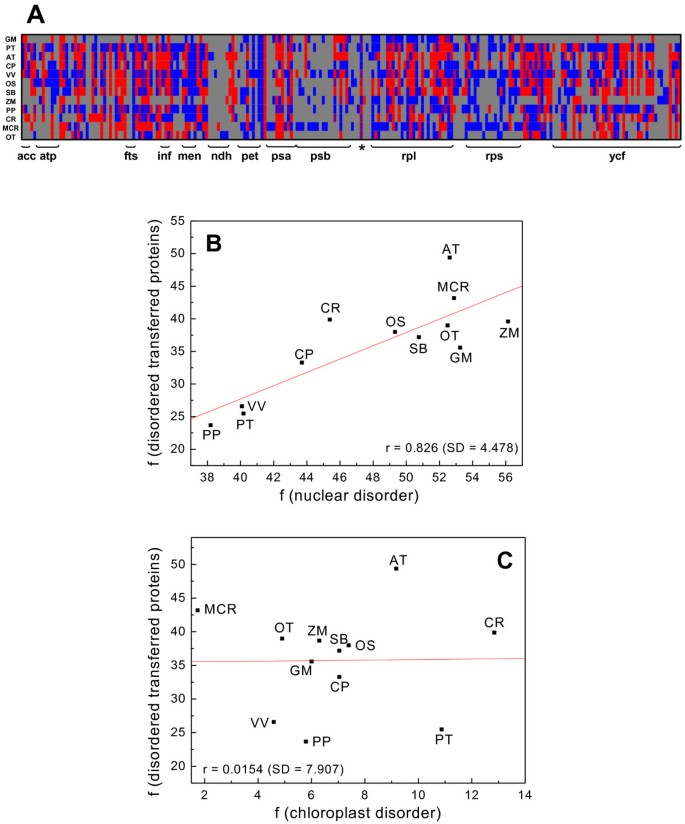
在据信最初在叶绿体基因组中编码的蛋白质中研究了本质疾病,随后在进化过程中转移到核基因组中。使用此目的,我们从Plaza数据库中检索(详情请参阅材料和方法)所有拟南芥蒂利亚纳核基因组中具有质体起源的蛋白质编码基因等等。[16].分析表明答:芥总蛋白质(49.3%)的147例含有L≥30分段。用同源性鉴定的转移核基因进行其余植物蛋白质蛋白酶的分析(参见材料和方法)。我们发现无序的蛋白质为253(33.2%)卡里卡番木瓜,203例中72例(35.5%)甘氨酸最大,480名的122名(25.4%)杨树trichocarpa,404项中的107项(26.5%)葡萄,311中的118名(37.9%)栽培稻,106 of 286(37.1%)高粱二色的,78 of 202(38.6%)玉蜀黍属梅斯,112 of 379(23.6%)Physcomitrella金属盘在美国,191名学生中有76人(39.8%)Chlamydomonas Reindhartii.,144名的62名(43.1%)Micromonassp。RCC299,56,共150名(38.9%)欧洲核心糖陶里.计算最低病症Physcomitrella金属盘(23.6%)和最高的拟南芥蒂利亚纳(49.3%).如图所示2A,通过转移蛋白质的紊乱在植物物种上不均匀。在226组中的125组中,存在有些情况,其中蛋白质在某些物种中含有长无序的细分,但不在其他物种中。
转移蛋白的紊乱百分比似乎与相应蛋白质组的整体紊乱的趋势相同。为了进一步验证这一观察结果,我们绘制了L≥30时核蛋白的无序频率相对最初由叶绿体基因编码、目前放置在核基因组中的蛋白质紊乱的频率(图2b)。The Pearson correlation obtained was r = 0.826. However, when we plotted the frequencies of protein disorder in the chloroplast for L ≥ 30相对转移叶绿体基因的疾病频率(图2c),所获得的相关系数是微不足道的(r = 0.0154)。
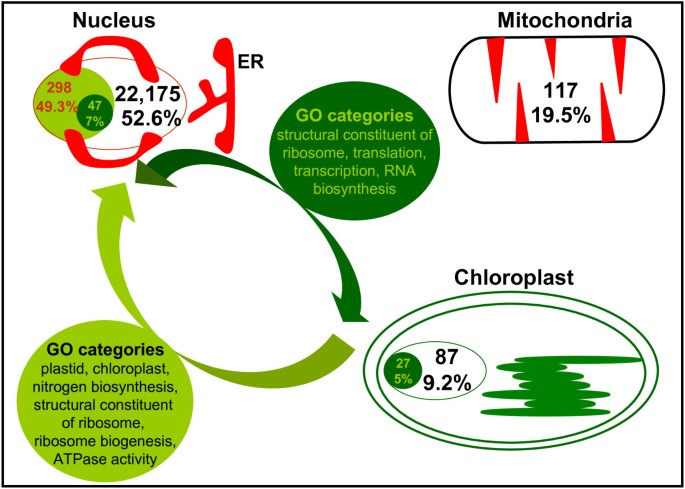
马丁等.[16据报道,在植物核基因组中编码用于蓝藻蛋白并鉴定的一些基因仍然保护叶绿体基因组中的副本。我们发现这组蛋白质的疾病百分比较低(加利福尼亚州。7%),而失去原来的叶绿体序列(20 - 52%)。在…的情况下答:芥我们的结果显示,在叶绿体的染色体中,一组47个核编码蛋白维持假定的同源拷贝。特别地,我们发现这些核蛋白与27个叶绿体非无序蛋白相对应,表明其中一些可能是类似物。例如,叶绿体NAD(P)H-醌氧化还原酶2B亚基(AtCg01250)、NAD(P)H脱氢酶(AtCg01090)、RNA聚合酶β亚基(AtCg00180)或依赖dna的RNA聚合酶的第二大亚基(AtCg00190)就是这样。此外,最保守的核糖体蛋白L14 (AtCg00780)、L22 (AtCg00810)、S8 (AtCg00770)和S19 (AtCg00820)分别与23S和16S rRNAs直接结合,也被纳入本组[28-30.)(附加文件4.:表S3)。如上所述,这些保守的蛋白质几乎没有获得疾病。图中的方案3.总结了叶绿体向细胞核转移蛋白质的过程一种.芥。
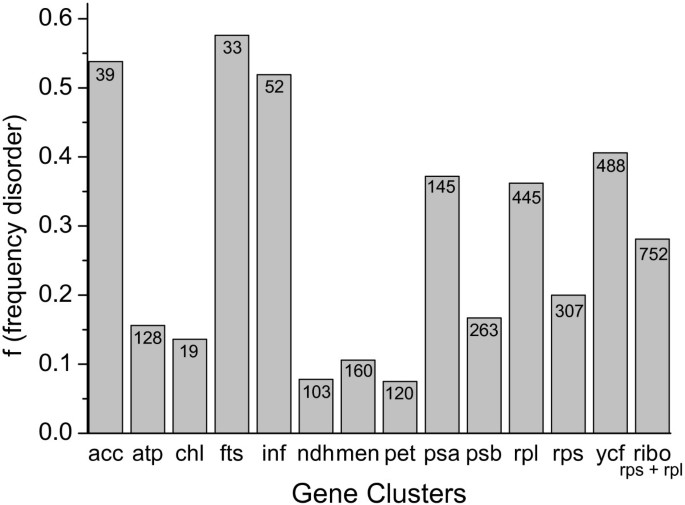
我们进一步将转移的内在无序的蛋白质分组在基因簇中(图)4.),让人想起祖先的细菌操纵子,发现了罚球那Inf, acc, psa, RPL和ycf基因簇对无序的蛋白质(40-58%的疾病)进行编码。这些基因涉及细胞分裂,翻译引发和乙酰-COA羧化酶途径,或光系统I,大核糖体亚基。相比之下,atp,王晓初ndh那男人,宠物,PSB和RPS基因簇,编码ATP合酶亚基、原叶绿素内酯还原酶、nadh -质体醌氧化还原酶亚基、琥珀酰或萘酸合酶、细胞色素B.6./F,光系统II的亚基和核糖体的小蛋白,包含较少的无序蛋白质(8 - 病症的25%)。这些观察到的差异不会出现可能与蛋白质的长度,为本质无序蛋白的平均长度被认为是390个氨基酸,一个类似的值,非无序蛋白(391个氨基酸)组成。
质起源的无序蛋白质的基因本体注释
为了更好地理解前人的研究成果,我们利用基因本体论(GO)对12种植物中无序蛋白的注释功能进行了研究。在检测过程中,如果一个蛋白质含有连续的L≥30个氨基酸的预测无序残基,则认为该蛋白质是无序的。分析结果显示,核基因编码的紊乱蛋白在29个生物过程(P)、39个细胞组分(C)和13个分子功能(F) GO类别中富集,被认为是可塑性来源P.-values < 10E-5(参见附加文件5.:表S4)。至于细胞组分,我们发现这些蛋白质主要与“塑性”(4.60e-43)和“叶绿体”类相关联,这支持我们的同源性的叶绿体转移基因。特定生物方法中最重要的关联是“细胞氮化合物生物合成过程”(1.10E-13),包括辅因子,杂环和四吡咯生物合成过程。最后,发现一些分子函数与这些无序蛋白质相关,例如“核糖体的结构组分”(8.01E-09)和“ATP酶活性”(4.35E-06)。这些报告的纠正p值相对于答:芥这可能是最具注释的植物基因组,因为它是一种模式生物。总之,这些结果表明,作为一个整体,紊乱的转移蛋白与任何一种功能都没有很强的联系。此外,质体染色体上仍保持拷贝的核编码基因主要与GO细胞组分“核糖体”(5.43E-30)和“核糖核蛋白复合物”(2.24E-26)相关。在生物学过程中,主要与“基因表达”相关(5.35e-36),包括“翻译”(2.61E-25)、“转录”(5.97E-14)或“RNA生物合成”(9.8E-11)。最后,在分子功能水平上,这些蛋白被注释为“核糖体的结构成分”(2.95E-32)、“结构分子活性”(1.56E-28)、“dna定向RNA聚合酶活性”(2.18E-15)或“NADH脱氢酶活性”(2.45E-7)(图)3.).
我们还回顾了叶绿体起源的非无序蛋白的注释功能,结果更令人信服,因为这组蛋白更同质(见附加文件)6.:表S5)。在生物学过程中,几种与“核糖体生物发生”(1.28E-31)如“核糖体生物发生”等几种翻译相关注释。这些与发现的最重要的细胞成分很好,“细胞源大核糖体亚基”是(1.05E-46)。此外,在分子函数水平下发现的最强的关联是“核糖体的结构组分”(4.59E-45)。
此外,本质上无序核编码的蛋白质的功能也进行了分析(数据未示出)。其中最显着的注释分别涉及“调节”生物过程,包括“核碱基的调节”(1.96E-267),“氮化合物的调节”(2.48E-266),“大分子生物合成过程的调节”(5.94E-265)或“RNA代谢过程的调节”(9.61E-265)。在细胞成分的电平,显著协会发现具有“核”(7.63E-162),“膜结合的细胞器”(5.78E-144)和“细胞器”(8.79E-129)。这些注释与这些分子功能的类别对应好,如“核酸结合转录因子活性”(1.19E-260),“核酸结合”(1.38E-250)或“DNA结合”(2.23E-209).总体而言,这些功能类别匹配报道一般[真核生物5.].
核糖体蛋白的紊乱
对叶绿体核糖体蛋白进行深入分析,目的是更好地理解植物中蛋白质疾病的演变。选择这些蛋白质是出于三个原因:一世)它们是转移到核基因组的最大基因集群e;II)它们是高度保守和必要的蜂窝系统的一部分,以及3)它们在上述GO注释研究中突出显示。这个想法是比较答:芥(eudicot)和o .漂白亚麻纤维卷(单子叶蛋白酶)蛋白质,其原核核糖体(4次古痤疮,3克+,4个蓝藻,7个噬菌体和4种噬菌体)。有关详细信息,请参阅材料和方法和附加文件7.:表S6A和S6B。我们计算出30%和65%的这些蛋白质分别在叶绿体30s和50s亚基中固有无序。数据显示细菌种类中蛋白质障碍并不均匀。存在蛋白质在某些物种中含有长期无序的情况的情况,但不在其他物种中。值得一提的是,两种植物物种之间没有发现差异。
数字5.A / C和5.进行预测,B / d色核糖体蛋白,以在我们的分析是无序的,(如描述在一些情况下实验观察到的[3.,分别在至少一个原核生物(上)和一个植物叶绿体(下)基因组中。可以观察到,在叶绿体核糖体中,小(30S)亚基的无序程度并没有增加(图)5.b)。相反,该疾病显着增加了叶绿体大(50s)亚基(图5.D).可能解释这一发现的一个有趣的特征是,大多数l蛋白是核编码的(33/42),而在s蛋白的情况下,这个比例更低(12/22)。有趣的是,在某些植物基因组中(即,O. Sativa,S.Bicolor,Z.Mays,P.Trichocarpa,V.Vinifera,G.Max,P. P. Patens),发现一些核糖体蛋白是由核基因和质体基因共同编码的,在大多数情况下产生的蛋白产物是相同的。
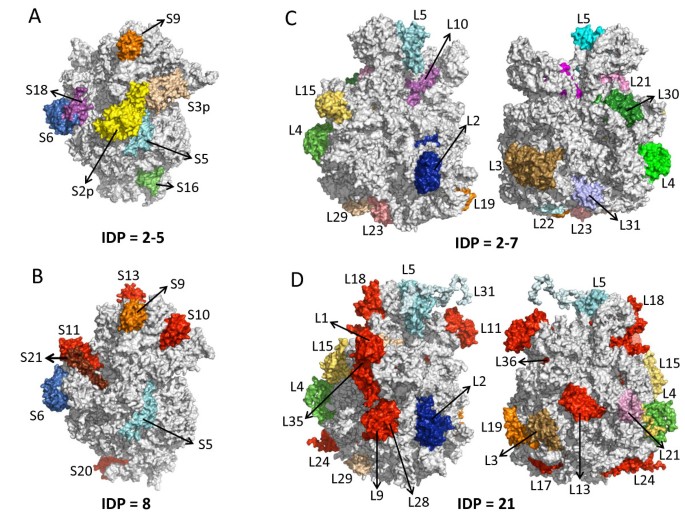
细菌(A,C)和叶绿体(B,D)核糖体(分别通过PDB条目1JOO,1VQ8,3BBN和3BBO分别分别分布蛋白质的分布。A和B组对应于30S亚基,C和D对应于50S。细菌核糖体亚基中的紊乱蛋白以淡黄色、淡蓝色、浅蓝色、深蓝色、橙色、绿色、品红和粉红色突出显示。它们的叶绿体在拟南芥蒂利亚纳都用同样的颜色标注。在叶绿体30S和50S亚基中发现的其他内在紊乱的蛋白质用红色突出显示。S和L后面的数字分别识别小的和大的亚基蛋白。叶绿体50S亚基中的紊乱蛋白L7/L12未被标记,因为PDB检索到的结构数据中没有该蛋白。为每个核糖体亚基计算的内在紊乱蛋白(IDP)的平均数量如下(详情见附加文件)7.:表S6)。使用pymol 1.4.1(Schrodinger LLC)吸制三维漫画。
在小亚基中,我们发现叶绿体蛋白S10,S11,S13和S20相对于它们的原核原始原因产生了紊乱,但在细菌中也丧失了失序的段(例如,在S2,S3和S18中)。注意,植物S10,S13和S20蛋白质序列比其原核相提并论要长得多(见附加文件8.:表S7),这可能解释了无序部分的增益。总的来说,这个亚基在这个亚基中没有明确的净增益(见附加文件7.:表S6A)。在大亚基,L1,L6,L7 / L12P,L9,L11,L13,L17,L18,L24,L27,L28,L34,L35和L36蛋白在叶绿体中增益。除L36外,所有这些都是核编码的。
讨论
对12种植物蛋白质蛋白质的分析表明,在其他真核生物中发现的混乱蛋白质相似[1].因此,在预测的紊乱段的总量计动物,酵母和植物中没有明确的分离。属于苔藓,绿藻和维管植物,或真双子叶植物和单子叶植物中不同的植物物种中也没有观察到明显的差异。
植物中无序片段的氨基酸组成与报道的其他真核生物的氨基酸组成很一致[3.那5.那11[可以通过低频的疏水性残基来定义,该残基通常形成折叠蛋白的核心,以及有助于净电荷的极性残基的高频。在无序区域内半胱氨酸残基的少量存在也是在叶绿体,线粒体或核蛋白中观察到的特征,其与其他预测的无序蛋白质谱配合很好[5.].该发现支持在进化期间稳定的蛋白质区域中的这些特征是稳定的。另一方面,在内部零件中沿完全蛋白质序列的无序区域的分布略高于蛋白质的末端部分。该特征对于所研究的所有植物蛋白质群是常见的,并且在不同物种中没有发现差异。该观察结果与来自蛋白质数据库的蛋白质3D结构获得的数据不同[31].这些作者报告说,在附近的40个残基构成的终点部分(72%)中,无序残留物的级别更加丰富。N终端和C- 与中间部分(所有其他残基)相比。
有趣的是,一项对叶绿体和线粒体的调查显示,与核基因组相比,在发生紊乱区域方面存在显著差异。在这些细胞器中计算的百分比与古菌和细菌中测定的百分比的数量级相同[1].这些数据与编码这些蛋白质的基因的细菌起源是一致的。我们还观察到蛋白质链中无序区域分布的差异。
有人提出,基因在800和2000之间拟南芥蒂利亚纳基因组可能来自Cyanobacteria,其中大多数蛋白质包括在生物合成和新陈代谢的功能类别中[32-35].此外,对15个已测序的叶绿体基因组的分析显示,117个核编码蛋白仍然存在于至少一个叶绿体基因组中[16].基于这些报告,我们评估了核编码蛋白质中的紊乱程度,这些蛋白质从血液基因组转移到核基因组中,并且转移到核中的那些也仍然保护叶绿体基因组中的拷贝。我们的结果表明,转移的蛋白质获得了与核编码蛋白质类似的频率的疾病。在进化期间,细胞器将它们的基因输出到核,但是许多这些蛋白质在瞬时肽和蛋白质进口机械的帮助下进口到叶绿体中,以进行其功能。可以假设这种无序的增益是在双膜屏障的进口通路期间是一个优点。然而,这些无序区段不优先与局长的肽与N-末端区域局部化的肽相关联。实际上,在蛋白质链的内部区域中被发现它们略微丰富。此外,在叶绿体基因组中维持拷贝的转移蛋白质编码基因表现出比丢失塑体拷贝的含量低得多,类似于叶绿体或细菌基因编码的蛋白质。这一事实可能在进化期间揭示选择压力。这些蛋白质主要涉及翻译,转录或RNA生物合成,是核糖体和核糖核蛋白复合物的结构成分。 The disorder in proteins encoded by ancient chloroplast genes but currently in the nucleus follows the order bryophyta < vascular plants < chlorophyta. In this context, the data suggest that the level of disorder introduced into plastid proteins that have moved to the nuclear genome has increased during evolutionary time, but further investigations will be necessary to clarify this issue.
转运蛋白紊乱的获得或丧失在某种程度上可能是一个随机过程,因为在不同植物物种中发现的同源拷贝不一定保留紊乱的片段,尽管可能执行相似的功能。这一观察结果与以下发现一致:从叶绿体到核基因组的基因转移事件发生的频率比一般认为的要高得多,这对遗传变异起了重要作用[35].在这方面,还注意到,在细菌物种中核糖体蛋白分布紊乱而出现随机(附加文件7.:表S6)。
如果掩埋氨基酸残基受到严重限制,可能预期非折叠非结构化蛋白和区域在进化期间在演化期间更快地变化,而无序区域不受结构的限制[11].据信,无序蛋白质不存在,作为一个单一结构,而是作为状态的构象平衡,其相互转化成彼此在一定范围的时间尺度。该特征可以是用于适配进化优势,为的情况下,在胁迫条件下。此外,本质上无序的蛋白质可能对蛋白水解降解更敏感体外。经典的害虫假设表明,富含蛋白质中的Arc / Lys残基的Pro,Glu(ASP)和Ser / Th中富含的段的存在与细胞中的短寿命相关[36那37].因此,与核糖体生物发生有关的一组蛋白质在转移到细胞核后仍保持其有序特征,这一事实可以解释为在蛋白质合成机制中应维持的这一关键作用。
另一方面,预计将在我们的分析中转移到细胞核中的大约25%的叶绿体核糖体蛋白。在这方面,有人认为,灵活性有利于大络合物组分的结构组装,例如参与核糖体的那些,因此在某些核糖体蛋白中应该普遍存在[38].此外,rna结合蛋白通常包含非结构区域,如核糖体蛋白L5,据报道与5S rRNA相关[39].我们的结果还表明,内在疾病是一些核糖体蛋白质中的保守症状。这是L4和L15的情况,预测含有分析的所有细菌和植物蛋白质中的非结构化段。核糖体蛋白L4在细菌核糖体的肽基转移酶中心附近局部化[40]并显示重要的RNA伴侣活动[41].L15蛋白在组装期间涉及后期阶段[41].
比较细菌和叶绿体核糖体蛋白的紊乱,发现叶绿体大50S亚基的紊乱增加,其中的蛋白质平均长55个残基,正如Yamaguchi和Subramanian之前报道的[42[大多数是由核基因产生的。该发现与用整个蛋白质组获得的数据形成对比,其在无序和无序蛋白质之间没有差异。在小30s亚基的情况下,这种差异不太清楚,可能是由于叶绿体编码蛋白质的含量较高,其中大多数它们预计是非无序的。这些结果支持我们的假设,即在核基因组中编码的蛋白质更有可能随机造成疾病。然而,另一方面,我们不能排除叶绿体(23s,5s和4.5s)和细菌(23s和5s)大50s核糖体亚基之间RRNA组成的差异也可以解释该亚基观察到的病症的增益[43那44].
质体(原核生物)和核(真核生物)之间的遗传机制差异也有助于解释我们的观察结果。当质体基因到达细胞核时,它们从一个紧凑的、含有操纵子和内含子贫乏的遗传器官转移到一个更复杂的、具有操纵子分裂和内含子丰富的遗传器官[45].虽然在许多情况下无序的获得被认为是有利的或中性的,但必然存在选择性压力来限制这一显然随机的过程,如叶绿体RUBISCO小亚基蛋白的情况,它是一种质体起源的核编码蛋白质,在大多数被调查的植物蛋白质组中都发现了这一规律(见图2).
通过比较细菌和叶绿体核糖体亚基的三维结构,揭示了额外紊乱蛋白的定位。例如,S11定位在mRNA路径中,紧挨着本质无序的S21,它直接与mRNA的5 '非翻译区域相互作用[46].在核糖体50S亚基中,L24和L29定位于多肽通道出口位点周围。值得注意的是,这些叶绿体紊乱蛋白中的一些通常在蓝藻细菌中发现(见附加文件7.:表S6),但在某些情况下,在革兰氏阳性细菌中并非在蓝藻中非结构化(IE。S9,L29和L31)。这可能与事实有关更多拟南芥蛋白质与革兰氏阳性细菌的同源物分枝(分枝杆菌)比用蓝藻(原,球藻集胞藻属).这被解释为好像拟南芥革兰氏阳性菌系与酵母系分离后获得的基因[16].
结论
在一起,我们的基于叶绿体的分析表明,由于植物演化过程中的核整合过程,蛋白质的蛋白质是蛋白质获得的紊乱。然而,我们观察到,祖先细胞中存在的祖先叶绿体和线粒体细胞器的某些部分被归因于获取无序的段,可能是由于功能的限制和进化压力。
方法
蛋白质组学和去数据库
叶绿体,线粒体和核完全植物蛋白质,以及基因本体(GO)注释拟南芥蒂利亚纳(在),番木瓜(CP),Chlamydomonas Reindhartii.(CR),oryza sativa(OS),杨树trichocarpa(PT)Physcomitrella patens(PP)、高粱二色的(某人),葡萄(VV)从Plaza V.1中检索,甘氨酸最大(通用), Micromonassp。RCC299 (MRC),奥斯特科科克·托特(OT)和Zea Mays.ZM来自PLAZA v.2(http://bioinformatics.psb.ugent.be/plaza/).
基因转移分析
根据马丁报告的数据等等。[16]测序叶绿体基因组中的蛋白质编码基因并鉴定核同源物答:芥使用(AT)使用(http://bioinformatics.psb.ugent.be/plaza/).相应的同源物被鉴定在中c .木瓜(CP),C. REINDHARTII.(CR), o .漂白亚麻纤维卷(OS),p. trichocarpa.(PT),P. Patens.(PP),S. Bicolor.(某人),V. Vinifera(VV),G. Max。(通用), Micromonassp。RCC299 (MRC),o. tauri.(OT)和Z.Mays.(ZM)从广场取回。为了鉴定那些在叶绿体基因组中仍然保持同源拷贝的核基因编码的蛋白质,我们使用BLAST双向最佳命中,以叶绿体蛋白或核蛋白作为查询。
来自细菌的核糖体蛋白序列海床furiosus(Pyf),甲烷细菌属sp.(Meb),Methanocaldococcus jannaschii(MTJ);古生球菌(af),支原体肺炎(我的C),枯草芽孢杆菌(BAS),结核分枝杆菌(我的T),念珠藻属punctiforme(nos),Prochlorocccus Marinus.(亲),SyneChocysistis sp..PCC 6803 (Syn);synechocccus sp..(Sych),包柔氏螺旋体burgdorferi(Bob),Chloroflexus aggregans.(CHLA),将绿chlorochromatii(Chlb);梅毒螺旋体(TREP),Chlamydia肺炎(chlp),Clostridium hathewayi(克洛斯);Aquifex Aeolicus.(Aqa),立克次氏体prowazekii(RIP),Heliobacter幽门(HEP),流感嗜血杆菌(海),大肠杆菌(EC)从NCBI检索(http://www.ncbi.nlm.nih.gov).马丁的工作选择了这组原核生物进行分析等等。(2002)。相应的同系物答:芥和o .漂白亚麻纤维卷使用(http://bioinformatics.psb.ugent.be/plaza/)和Uniprot(http://www.uniprot.org).
内在有序与无序的预测器
disopred2 v2.42 [21对12种植物(包括细胞器基因组编码的蛋白质)和22种细菌的所有蛋白质序列进行了紊乱预测。所有输入序列,加上参考数据库Uniref90.,为低复杂度PFILT过滤,扫描3次迭代BLASTPGP.e值下限为0.001。
植物蛋白中的疾病预测有限的基准
利用植物蛋白序列对DISOPRED2失序预测进行了计算实验。蛋白质组的答:芥与截至2012年2月7日的蛋白质数据库的内容进行了比较,寻找相关结构。检索≥70%的序列同一性和分辨率≤2Å的70个晶体结构的总数,并用作金标准。如果与违约开发人员的方法相一致,则验证了至少30个残基的预定紊乱的段,但在SEQRES记录中报告的残留物中缺席[20.].
基因本体(GO)分析
perl模块go :: termfinder v0.86,从cpan获得(http://search.cpan.org/dist/GO-TermFinder/),用于估计与无序蛋白质组相关的GO术语的富集。所有12个蛋白质镜头的映射是从Plaza和Creichment获得的,使用默认参数计算,错误发现率为1%。必须注意的是,从Plaza获取的Go Annotations为大多数基因组检索到过时的GO条款。关于官方Gene_ontology.1_2.obo发布的确切数字是:答:芥(350),c .木瓜(0),c . reindhartii(1405),o .漂白亚麻纤维卷(2824),P. Trichocarpa.(5200),P. Paten.(3055),美国二色的(1814),V. Vinifera.(1491),g·马克斯(539),micromonas sp。RCC299(49),O. TAURI.(35)和Z. Mays.(344)。
缩写
- ACC:
-
乙酰辅酶a羧化酶
- ATP:
-
ATP合酶
- chl:
-
蛋白氯化物
- FTS:
-
青霉素结合蛋白,推测的细胞/细胞器分裂蛋白
- INF:
-
翻译起始因子
- 男人:
-
琥珀酰苯甲酸酯、琥珀酰羧酸酯和萘酸合成酶
- ndh:
-
NADH-塑性醌氧化还原酶
- 宠物:
-
细胞色素B.6./F复杂的
- PSA:
-
光系统I子单元
- 公安局:
-
电影系统II亚基
- RPL:
-
核糖体l-蛋白
- rps:
-
核糖体S-proteins
- ribo:
-
核糖体l蛋白和核糖体s蛋白。
参考
- 1。
Dunker k, Obradovic Z, Romero P, Garner EC, Brown CJ:全基因组内固有蛋白紊乱。基因组学杂志。2000,11:161-171。
- 2.
Schlessinger A,Schaefer C,Vicedo E,Schmidberger M,Punta M,Rost B:蛋白质障碍 - 进化的突破CurrOgin struct Biol。2011,21:412-418。10.1016 / J.SBI.2011.03.014。
- 3.
本构非结构蛋白及其功能。中国生物医学工程学报,2003,19(6):593 - 598。10.1038 / nrm1589。
- 4.
radvojac P, Obradovic Z, Smith DK, Zhu G, Vucetic S, Brown CJ, Lawson JD, Dunker AK:蛋白质弹性与内在紊乱。蛋白质科学与技术。2004,13:71-80。10.1110 / ps.03128904。
- 5.
TOMPA P:本质上非结构化的蛋白质。趋势Biochem SCI。2002,27:527-533。
- 6.
Radivojak P, Iakoucheva LM, Oldfield CJ, Obradovic Z, Uversky VN, Dunker AK:内在障碍与功能蛋白质组学。acta botanicologica sinica(云南植物学报),29(4):457 - 461。10.1529 / biophysj.106.094045。
- 7.
Iakoucheva LM,布朗CJ,劳森JD,奥布拉多维奇Z,Dunker的AK:在细胞信号传导和癌症相关蛋白的内在障碍。J Mol Biol。2002年,323:573-584。10.1016 / S0022-2836(02)00969-5。
- 8.
(2) FlgM在活细胞中获得结构。美国国家科学院学报。2002年,99:12681 - 12684。10.1073 / pnas.202331299。
- 9.
Dunker Ak,Brown CJ,Lawson JD,Iakoucheva LM,Obradovic Z:内在疾病和蛋白质功能。生物化学。2002,41:6573-6582。10.1021 / bi012159 +。
- 10。
本质上非结构蛋白的结构和功能之间的相互作用。FEBS Lett. 2005, 579: 3346-3354。10.1016 / j.febslet.2005.03.072。
- 11.
Dunker Ak,Silman I,Uversky VN,Sussman JL:固有无序蛋白质的功能和结构。CurrOgin struct Biol。2008,18:756-764。10.1016 / J.SBI.2008.10.002。
- 12.
基序转换:细胞调控中的决策。中国生物医学工程学报。2012,22:1-8。10.1016 / j.sbi.2012.01.001。
- 13.
Kovacs D, Kalmar E, Torok Z, Tompa P: ERD10和ERD14这两个紊乱的胁迫相关植物蛋白的伴侣活性。植物营养与肥料学报。2008,31(4):457 - 461。10.1104 / pp.108.118208。
- 14.
作为分子伴侣的紊乱植物LEA蛋白。植物遗传资源学报,2008,30(3):457 - 461。10.4161 / psb.3.9.6434。
- 15.
Mouillon J-M, Eriksson SK, Harryson P:通过大分子拥挤来模拟水分胁迫下的植物细胞内部:无序的脱水蛋白高度抵抗结构崩溃。植物生理学报。2008,31(4):457 - 461。10.1104 / pp.108.124099。
- 16.
Martin W, Rujan T, rich E, Hansen A, Cornelsen S, Lins T, Leister D, Stoebe B, Hasegawa M, Penny D:拟南芥、蓝藻和叶绿体基因组的进化分析揭示了质体系统发育和细胞核中数千个蓝藻基因。美国国立科学研究院。2002年,99:12246 - 12251。10.1073 / pnas.182432999。
- 17.
Dostányiz,Meszárósb,西蒙I:生物信息化方法,以表征内在紊乱/非结构化蛋白质。简短生物形式。2010,11:225-243。10.1093 / bib / bbp061。
- 18.
Linding R,Jensen LJ,Diella F,Bork P,Gibson TJ,Russell RB:蛋白质障碍预测:对结构蛋白质组学的影响。结构。2003,11:1453-1459。10.1016 / J.Str.2003.10.002。
- 19.
林鼎发R,罗素RB,Neduva V,吉布森TJ:GlobPlot:探索globularity和病症的蛋白质序列。Nucl。酸res。2003,31:3701-3708。10.1093 / NAR / gkg519。
- 20。
Ward JJ,Sodhi JS,McGuffin LJ,Buxton BF,Jones DT:三个王国蛋白质原生障碍的预测和功能分析。J Mol Biol。2004,337:635-645。10.1016 / J.JMB.2004.02.002。
- 21。
Ward JJ,McGuffin LJ,Bryson K,Buxton BF,JONES DT:用于预测蛋白质障碍的富有服务器。生物信息学。2004,20:2138-2139。10.1093 / Bioinformatics / Bth195。
- 22。
Dostányi Z, Csizmok V, Tompa P, Simon I: IUPred:基于估计能量含量预测蛋白质本质非结构区域的网络服务器。生物信息学。2005,21:3433-3434。
- 23。
罗梅罗P,奥布拉多维奇Z,Dunker的AK:在钙调磷酸酶家族长期无序区域的预测序列数据分析。基因组通知。1997年,8:110-124。
- 24.
Romero P,Obradovic Z,Li X,Garner Ec,Brown CJ,Dunker Ak:序列复杂性无序蛋白质。蛋白质。2001,42:38-48。10.1002 / 1097-0134(20010101)42:1 <38 :: AID50> 3.0.co; 2-3。
- 25.
Obradovic Z,Peng K,Vucetc S,Radivojac P,Brown CJ,Dunker AK:预测来自氨基酸序列的内在疾病。蛋白质:结构功能和遗传学。2003,53:566-572。10.1002 / prot.10532。
- 26.
Yumi J, Roland L, Dunbrack RL: CASP6障碍预测的评估。蛋白质:结构、功能和生物信息学。2005,61:167-175。10.1002 / prot.20734。
- 27.
Monastyrskyy B,Fidelis K,Moult J,Tramontano A,Kryshtafovych --:Casp9中的疾病预测评估。蛋白质。2011,10:107-118。
- 28.
穆勒楼Sommer的I,巴拉诺夫P,Matadeen R,Stoldt男,WoehnertĴ,Goerlach男,面包车鞋跟男,Brimacombe R:在23S和5S rRNA基因在大肠杆菌中的所述的3D布置大肠杆菌基于一个低温电子50S核糖体亚基7.5埃分辨率的显微重建。J Mol Biol。2000,298:35-59。10.1006 / jmbi.2000.3635。
- 29.
高H,Sengupta J,Valle M,Korostelev A,Eswar N,Stagg Sm,Van Roey P,Agrawal RK,Harvey SC,Sali A,Chapman Ms,Frank J:使用真实的核糖体的结构动态研究- 空间改进。细胞。2003,113:789-801。10.1016 / S0092-8674(03)00427-6。
- 30.
关键词:核糖体蛋白S8/spc操纵子mRNA复合物;RNA。2004年,10:954 - 964。10.1261 / rna.7030704。
- 31。
Lobanov MY, Furletova EI, Bogatyreva NS, Roytberg MA, Galzitskaya OV:三维蛋白质结构中的无序模式库。中国生物医学工程学报,2010,31(6):693 - 698。
- 32。
Abdallah F,Salamini F,Leister D:预测拟南芥叶绿体蛋白质蛋白质组的尺寸和进化起源。趋势植物SCI。2000,5:141-142。10.1016 / s1360-1385(00)01574-0。
- 33。
骑士 - 史密斯T:膜遗传和早期演化的叶绿体。趋势植物SCI。2000年,5:174-182。10.1016 / S1360-1385(00)01598-3。
- 34。
Rujan T,Martin W:拟南芥中有多少基因来自Cyanobacteria?估计来自386个蛋白质系统。趋势类型。2001,17:113-120。10.1016 / s0168-9525(00)02209-5。
- 35。
Stegemann S, Hartmann S, Ruf S, Bock R:从叶绿体基因组到细胞核的高频基因转移。美国国家科学院学报。2003年,100:8828 - 8833。10.1073 / pnas.1430924100。
- 36.
Rechsteiner M,Rogers SW:植物序列和由蛋白水解的调节。趋势Biochem SCI。1996,21:267-271。
- 37.
Sekhar KR,Freeman ML:蛋白质中涉及循环核苷酸信号传导途径的虫序列。作者:王莹,中国受体及信号转导研究CHINESE。1998,18:113-132。10.3109 / 10799899809047740
- 38.
Ban N, Nissen P, Hansen J, Moore P, Steitz TA: 2.4 Å分辨率下大核糖体亚基的完整原子结构。科学通报。2000,32(4):457 - 461。10.1126 / science.289.5481.905。
- 39.
DiNitto JP, Huber PW:非洲爪蟾核糖体蛋白L5与5S-rRNA的相互诱导拟合结合。中国生物医学工程学报。2003,33(6):749 - 752。10.1016 / s0022 - 2836(03) 00685 - 5。
- 40.
Worbs M,Huber R,Wahl MC:核糖体蛋白L4的晶体结构显示了S10操纵子的核糖体掺入和反馈控制的RNA结合位点。Embo J. 2000,19:807-818。10.1093 / EMBOJ / 19.5.807。
- 41.
大肠杆菌大核糖体亚单位蛋白的RNA伴侣活性。RNA。2004年,10:1855 - 1860。10.1261 / rna.7121704。
- 42.
质体核糖体蛋白。细胞器核糖体(叶绿体)50亚基中所有蛋白质的鉴定。中国生物医学工程学报。2000,27(4):486 - 486。
- 43。
生物信息学与蛋白质合成。微生物学修订版,58:700-754。
- 44。
Chi W,He B,Mao J,Li Q,Ma J,Ji D,Zou M,张L:RH22,死RNA螺旋酶的功能,在拟南芥核苷酸的50s核糖体亚基的生物发生中。植物理性。2012,158:693-707。10.1104 / pp.111.186775。
- 45。
赫尔曼:从细胞器到细胞核的基因转移:多少,发生了什么,为什么?植物生理学报。1998,19(4):417 - 422。10.1104 / pp.118.1.9。
- 46。
Sharma Mr,Wilson DN,Datta PP,Barat C,Schluenzen F,Fuciny P,Agrawal RK:Cryo-EM研究菠菜氯蛋白核糖体揭示了塑体特异性核糖体蛋白的结构和功能作用。美国国家科学院学报。2007,104:19315-19320。10.1073 / pnas.0709856104。
确认
我们感谢JM Ortega对手稿的评论。这项工作得到了Ministerio de Economía y Competitividad (MAT2011-23861至I.Y.)和Gobierno de Aragón (DGA-GC B18至I.Y.和DGA-GC A06至B.C-M)的资助。所有这些拨款的部分资金来自欧盟联邦基金计划。
作者信息
隶属关系
通讯作者
附加信息
利益争夺
两位作者宣称他们没有相互竞争的利益。
作者的贡献
IY进行了序列分析,参与了研究的设计和协调,并写了稿件。BC-M参与了研究的设计和数据分析,并帮助写了稿件。两位作者都读过并批准了最终手稿。
电子辅料
12870_2012_1073_MOESM1_ESM.pdf
附加文件1:表S1。L≥30、L≥40、L≥50预测无序片段在叶绿体、线粒体和核植物蛋白质组中的分布(PDF 141 KB)
12870 _2012_1073_moesm2_esm.ods
附加文件2:表S2。使用Chi Square Tests(A)和学生的T检验(B)紊乱含量的统计比较。(ods)
12870_2012_1073_moesm3_esm.pdf.
附加文件3:图S1。植物蛋白质组中无序蛋白质中氨基酸残基的分布。核(A)、叶绿体(B)和线粒体(C)蛋白质组。(PDF 87 KB)
表S3。
附加档案4:用叶绿体中具有推定的正非副本的核编码蛋白拟南芥蒂利亚纳.1ATC是由叶绿体基因编码的蛋白质。(PDF 124 KB)
12870_2012_1073_moesm5_esm.pdf.
附加文件5:表S4。对叶绿体基因编码并转移到核基因组的内在无序蛋白的基因本体论(GO)类别的选择结果。A)生物过程(P)氧化石墨烯类;B)细胞成分(C) GO类别;C)分子功能(F)氧化石墨烯类别。(PDF 164 KB)
12870 _2012_1073_moesm6_esm.pdf
附加文件6:表S5。由叶绿体基因编码并转移到核基因组的非无序蛋白质中基因本体类别的选择结果。A)生物过程(P)氧化石墨烯类;B)细胞成分(C) GO类别;C)分子功能(F)氧化石墨烯类别。(PDF 204 KB)
12870_2012_1073_MOESM7_ESM.pdf
附加文件7:表S6.从细菌和植物叶绿体中的小(A)和大(B)核糖体亚基中的本质上无序蛋白分布。(PDF 341 KB)
作者为图像提交的原始文件
权利和权限
本文由BioMed Central Ltd授权发表。这是一篇基于知识共享署名许可协议(http://creativecommons.org/licenses/by/2.0)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
植物的蛋白质紊乱:从叶绿体的角度看。BMC植物杂志12,165(2012)。https://doi.org/10.1186/1471-2229-12-165
已收到:
公认:
发表:
关键词
- 叶绿体
- 内在蛋白障碍
- 植物基因组
- 基因转移
- 进化