摘要
背景
端粒作为复杂的核蛋白复合物,确保染色体的稳定性。当受损时,线性染色体的末端可以被细胞修复机制识别为双链DNA断裂,并可以通过非同源末端连接活动愈合,产生双中心染色体。在细胞分裂过程中,特别是在分裂后期,双中心可以断裂,从而产生裸露的染色体尖端,容易产生额外的不需要的染色体融合。许多端粒构建蛋白复合物与端粒相关,以确保其适当的封顶功能。然而,已经发现一些修复复合体也有助于端粒的稳定性。
结果
我们使用拟南芥利用基因敲除技术研究DNA修复亚基NBS1在端粒稳态中的可能功能nbs1突变体。结果表明,虽然缺乏nbs1的植株能够存活,并且没有任何发育异常的迹象,并且通过许多代自交受精产生可育种子,但植株也缺少功能性端粒酶(双突变体),在三代内迅速表现出严重的发育缺陷。细胞遗传学检查的循环体细胞揭示了一个非常早期的大规模基因组不稳定的发作。用分子方法检测双纯合突变体的端粒长度,发现端粒缩短的速度比端粒酶基因缺乏的植物快得多。
结论
我们的研究结果表明,NBS1与端粒酶协同作用,在植物端粒更新中发挥着重要作用。
背景
线性真核染色体的末端受到称为端粒的特定染色质结构的保护,端粒由串联重复的端粒DNA和蛋白质组成。在脊椎动物中,有六种特定的蛋白质与端粒有关,它们与单链或双链端粒DNA有亲和力,它们统称为庇护蛋白[1]。这些复杂的结构对染色体的稳定性至关重要,因为它们将染色体末端与DNA双链断裂(DSBs)区分开来[2]。它们保护染色体末端免受核溶解攻击和不需要的重组。端粒也通过传统的DNA聚合酶抵消末端DNA的不完全复制[3.];细胞进化出了特定的端粒酶逆转录酶(TERT),它可以使用自己的RNA模板合成端粒重复序列,从而确保适当的端粒长度。一般来说,真核生物的端粒由串联的富含G/C的重复序列组成,这些重复序列以单链3'悬垂结尾,可以折叠并侵入双重复序列形成所谓的t环[4]。在端粒酶缺失的情况下,端粒失去功能,随着细胞的连续分裂而缩短,染色体末端由于去保护而融合。它们的融合是非同源末端连接(NHEJ)的结果,这是植物中DSB愈合的主要机制。尽管已经进行了许多尝试来评估植物中类似的庇护蛋白,但迄今为止这些蛋白质尚未被确定(见[5[供复习]。除了端粒中固定存在并提供端粒“封盖”功能的蛋白质外,真核生物的端粒中还经常发现许多额外的蛋白质复合物。矛盾的是,这些蛋白质中有许多参与DNA修复或重组,这似乎不适合端粒末端,因为端粒末端应该隐藏在重组事件和端到端融合之外。
在过去的十年中,越来越多的数据已经积累在DNA完整性破坏后的DNA修复因子和各种蛋白激酶的协同网络上,包括有害的外部因素,DNA复制错误,检查点信号以及减数分裂和体细胞重组。MRN复合体在DNA修复、重组、DNA复制以及细胞周期检查点激活和端粒维持中起着至关重要的作用。6,7])。它由三个亚基(MRE11-RAD50-NBS1)组成。一个NBS1分子与MRE11和RAD50的两个二聚体相关。MRE11和RAD50蛋白形成一种异源四聚体,其中包含两个DNA结合和加工结构域,可以连接游离DNA末端[8]。在酿酒酵母,该复合体包括亚基MRE11、RAD50和XRS2。尽管MRE11和RAD50两种蛋白在各种真核生物中具有高度的同源性,但XRS2蛋白与NBS1的同源性较低,这是哺乳动物和植物特有的[9],尽管在…中发现了NBS1的功能同源物Schizosaccharomyses非洲酒(10]。
在人类中,基因突变NBS1基因导致染色体不稳定障碍,奈梅亨断裂综合征。除了其他临床特征外,这种综合征还与对电离辐射的敏感性增强和染色体不稳定有关,这甚至会导致癌症的早期发展NBS1+ /−杂合子(11]。小鼠NBS1+ /−杂合子在表型上是正常的,尽管完全去除NBS1在小鼠中是胚胎致死的[12]。越来越多的证据表明,至少在人类和小鼠细胞中,NBS1与端粒相互作用并有助于其稳定性(参见[11])。nbs1与端粒重复结合因子1 TRF1的直接相互作用已被证明存在于端粒酶阴性的永生化细胞中[13这意味着这种相互作用可能与端粒的选择性延长有关。此外,间接免疫荧光显示,在培养的HeLa细胞的S期,NBS1与一种庇护蛋白成分——端粒重复结合因子2 (TRF2)共定位[14],可能是通过调节t型环的形成。同样,在小鼠胚胎成纤维细胞中,观察到NBS1主动募集到功能失调的端粒[15]。
众所周知,MRE11和RAD50以及蛋白激酶ATM和ATR对于植物端粒的正常维持也是必不可少的(综述于[5,16,17])。失活的拟南芥RAD50或MRE11导致对电离辐射或放射性模拟物过敏,降低植物健康,甚至不育。在淘汰赛RAD50或MRE11突变体拟南芥植物基因组的不稳定性被诱导,包括染色体端到端融合[18- - - - - -21]。缺少RAD50会导致端粒的快速缩短和端粒重复序列的丢失,并伴有染色体末端融合,而在双突变植物中(rad50 /叔)已发现RAD50和端粒酶对桥的频率有协同作用[19],证明了RAD50蛋白在植物中的双重作用。第三种MRN成分NBS1的同源物已从高等植物中分离出来。拟南芥和栽培稻(22]。两种植物的NBS1蛋白都比动物的NBS1小,但都含有典型的结构域,如FHA (forkhead-associated)、BRCT (BRCA1 C Terminus)结构域、mre11结合结构域和atm相互作用结构域。酵母双杂交功能分析表明操作系统NBS1蛋白不仅能与植物MRE11相互作用,还能与动物MRE11相互作用。OsNBS1mRNA的表达量在茎尖和幼花中较高AtNBS1当植物暴露于x射线时,表达增加[22]。细胞遗传学分析显示大量异常,包括At的减数分裂染色体断裂nbs1敲除突变体[23],尽管在植物ATM同时失活。
在本研究中,我们研究了NBS1在植物模式物种端粒维持中的作用拟南芥。利用缺乏这两种基因的植物,NBS1和叔,我们发现植物甚至在早期几代就表现出严重的基因组不稳定性。这些表型随着自花授粉的世代增加而恶化,植株发育出现严重的缺陷,导致不育th的一代。通过比较双突变体和单突变体的端粒长度,我们观察到前者的端粒缩短速度更快,频率更高。
结果
叔/ nbs1突变体在增加的世代中表现出严重的形态发育缺陷
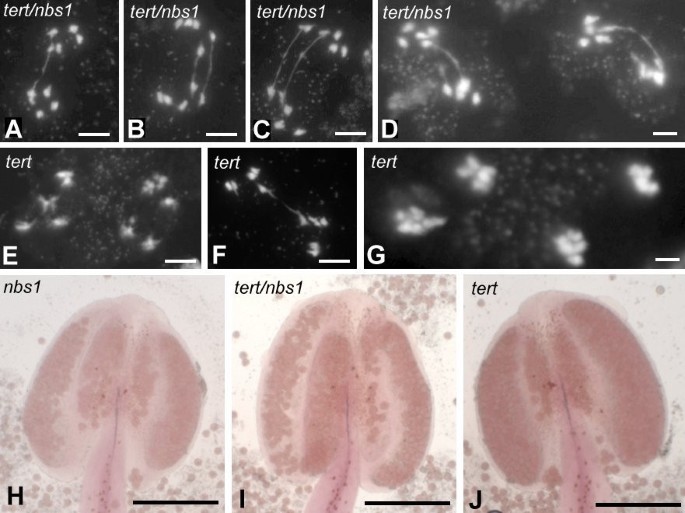
我们进行了一次交叉nbs1和叔纯合子的植物。从分离的F2幼苗,野生型植株,nbs1变种人,两个独立的叔采用t - dna特异性引物和基因特异性引物分别对69-1和69-2系以及双纯合子进行基因分型。两个独立的叔/ nbs1选择K12和L2进行进一步分析。这些线进一步被称为第1代(G1)。自花授粉后,我们获得了连续5代,G2到G6,直到植物形态出现缺陷(图2)1B),产生了不育的种子(图2A),并且不能进行后续的培养。G5植株(K12和L2两个品系)的果实仅含12±4颗种子,育性为45%。虽然G6植株的种子荚数与G5系相同,但种子在土壤或MS琼脂培养中均未能发芽(图5)2D,相比之下,single叔突变体种子在69-1和69-2中都没有表现出从G2到G6的适应度衰减迹象(图2)2B)。
基因组不稳定性叔/ nbs1与单次相比加速了吗叔突变体
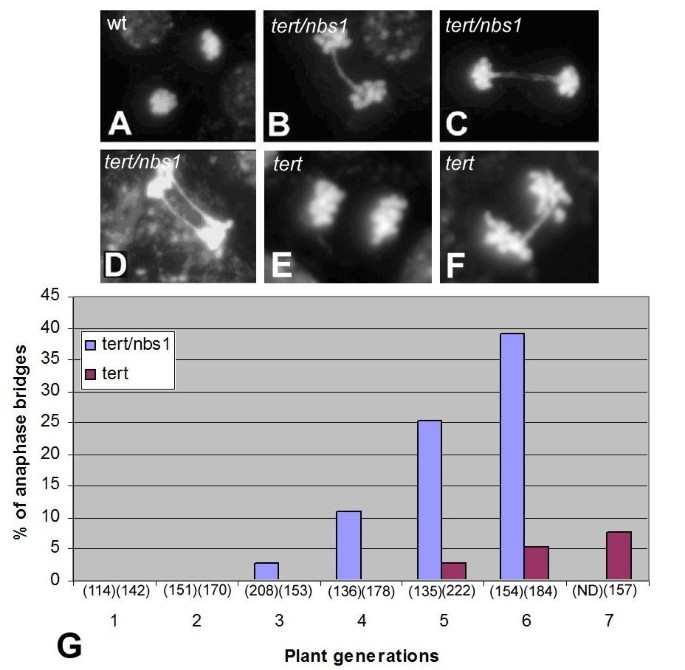
我们预测与单纯合子相比,双纯合子体细胞组织中基因组不稳定的加速迹象叔突变体。拟南芥叔已知突变体在连续几代中由于端粒去保护而逐渐越来越容易发生染色体融合[24从6号染色体开始大量融合th代上。在我们的实验中,融合染色体很容易被检测到作为后期桥(图2)3.罪犯)。我们使用了统计数据[25来比较后期桥的频率。与研究结果一致[24,26,27)单叔突变体似乎拥有5.4%的后期桥(图2)3.F), G7的桥接发生率增加至7.6%(图6)3.G).相比之下,双突变体叔/ nbs1从G3开始发育有丝分裂后期桥,在G6代K12系和L2系分别达到39.4%和38.1%(表2)1)。显微检查未发现后期桥nbs1世代,如野生型植物(叔/ NBS1)在基因分型过程中选择。
基因组不稳定性叔/ nbs1表现为有丝分裂后期桥。对实验植物的雌蕊进行显微处理,组织固定、压实,并用4′,6-二氨基-2-苯基吲哚(DAPI)染色。(一个) G6野生型植物后期,(BD)双纯合子的后期叔/ nbs1, K12线,G6代,分别为单相桥、双桥和两座单相桥。(EF)单纯合子的后期叔工厂,69-2线,G6代。然而在这里叔种子代,大部分后期无桥接(E),有5.4% (F)。(G)包含后期的桥接频率,无论各个后期之间的桥接数量如何叔/ nbs1, L2行,(蓝色列)和叔,第69-2行(紫色列),连续几代。最后阶段的总得分用括号表示。未检测到桥接期nbs1杂合子或野生型植物。95%置信区间[25]显示出G3和G6代之间的值有显著差异。(ND =由于严重的发育缺陷,没有植物可用于细胞学)。
的减数分裂缺陷叔/ nbs1突变体
尽管显微镜检查显示野生型和野生型植物的雄性减数细胞没有畸变nbs1变种人,双变种人(叔/ nbs1)在后期I的二价体和后期II的单价体之间显示了大量的染色体桥接(图2)4模拟)。从G2起花粉母细胞的制备中可见到这些桥。没有观察到减数分裂畸变的其他迹象。粗线素二价体完全排列,雄性减数分裂以形态完美的四分体结束。花粉活力叔/ nbs1为100%(图4I).从分析叔来自G6的突变体,在55个单独的后期I图中,69-1和69-2系,只有两个含有桥接二价(图2)4F).雄性减数分裂产物明显正常叔G6植物(图4G)。比较花药中乙酰胭脂红染色的花粉粒,检测的基因型之间没有差异,所有花粉粒都明显具有可育性(图5)4H-J)。
突变细胞的染色体融合点只涉及染色体末端
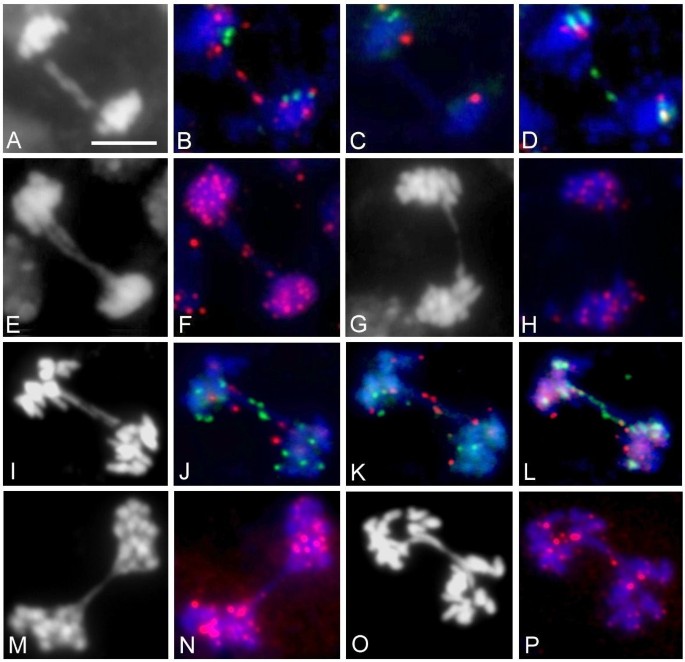
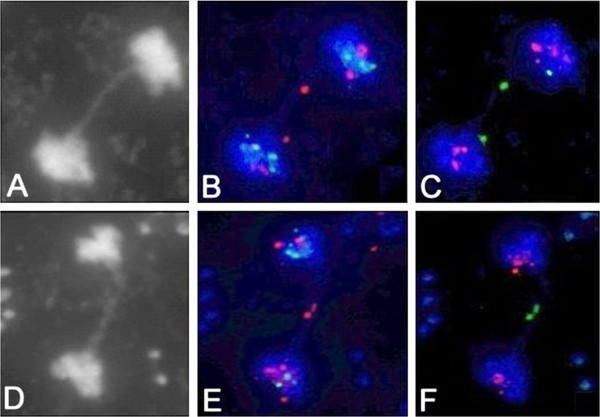
为了判断染色体的末端或间位是否参与融合位点叔/ nbs1突变体,我们使用染色体特异性BAC探针直接相邻进行了多轮双色FISH拟南芥端粒就像[26]。的后期桥叔/ nbs1突变体中,我们几乎只发现了来自染色体末端的信号(图2)5罪犯)。使用FISH和直接标记的PNA端粒探针,我们在两个细胞系的G3部分桥上检测到了端粒束(表2)2), K12(图5F)和L2。从G4代开始,双突变体的后期桥上未检测到端粒信号(图2)5H)。这一发现可以解释为端粒缩短到原位杂交程序无法检测到的程度,这与我们的假设一致叔/ nbs1突变体比只有端粒酶敲除基因的植物缩短得快得多。后期桥叔突变体(至少在第G6代)也含有端粒邻近BAC探针或染色体末端序列作为rnas的FISH信号(图6)5J-L)。通常是融合的叔在G5代和G6代染色体中含有端粒特异性信号(表5)2,图5N和P)。
FISH显示的染色体融合点。(一个-H)叔/ nbs1双纯合子,(我-P)叔。(模拟)叔/ nbs1突变体,G6代,K12系有丝分裂后期桥的序列FISH显示参与了1号染色体的右端。(一个) DAPI用由两条染色单体组成的桥染色后期。(B)来自BAC探头F5I6 (Cy3标记为红色)的信号显示在两个桥上。在第二个FISH (C)上没有信号,而在(D)绿色探针(SpectrumGreen标记,BAC F5I6)突出显示与(B)。根据FISH设置,颜色的变化明确地揭示了1R染色体末端的融合。(E-H端粒特异性探针FISH。使用端粒特异性cy3标记的PNA-C3.助教3.-探针,在K12系G3代厂的两条染色单体后期桥上检测到融合点(F),而在更高代(G4)中,在后期桥上无法检测到来自pna探针的信号(H)。为了展示桥的形态,DAPI染色图像呈现(E,G)。(我) DAPI染色的后期显示双后期桥叔突变体,69-2系,G6代。(J-l)顺序FISH。(J,K) 3号染色体左端依次被3个l特异性T4P13 BAC标记,在第一个FISH中为绿色(J),而第二个FISH (K)。在第三个FISH中,来自45S rDNA探针的绿色信号照亮了2l染色体末端(l)。因此,证明了3l和2l染色体末端的直接互惠融合。(米-P)后期桥接叔突变体用端粒PNA探针探测。(N)叔69-1、G5及(P)第69-2行,第6代。在这两种细胞系中,融合点由G5代开始的端粒特异性探针修饰。(米,O) DAPI用桥染色晚期。Bar表示所有图像的10 μm。
从各自染色体末端可能参与形成后期桥的检查叔/ nbs1双突变体,我们发现2号染色体右臂的融合明显偏向(图2)6、表3.)。这种2R染色体末端更频繁地参与融合,只属于突变系K12,从G3到G6都可以观察到。在叔两个变种,69-1和69-2,还有叔/ nbs1的L2线路后期桥基本上携带随机终端信号。
端粒的叔/ nbs1植物迅速缩短,在更大程度上比叔行
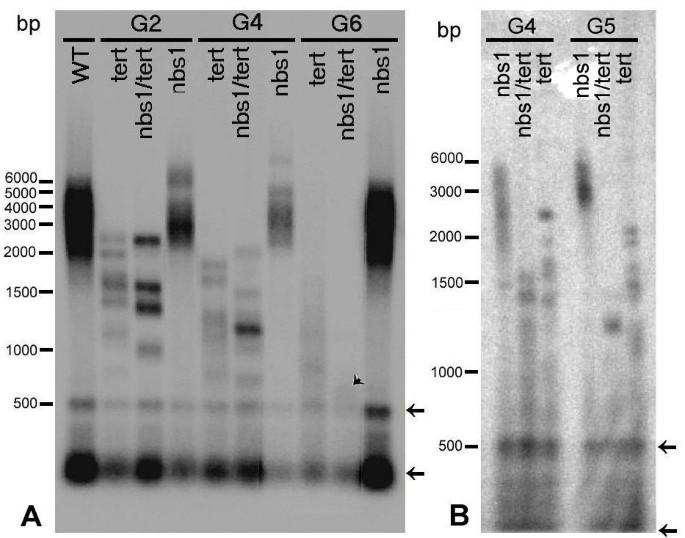
评估体细胞端粒束的总长度叔/ nbs1我们将TRF方法(末端限制性片段分析)应用于从不同世代的单株和K12和L2两个系分离的dna。而野生型拟南芥哥伦比亚生态型的染色体端粒长度在2 ~ 5kb之间,突变系表现出明显的缩短。当比较叔和叔/ nbs1,后者的端粒缩短明显更快(图2)7)。与野生型相比,我们发现在这两个突变体中,单个条带代表单个端粒长度,范围从4到1 kb叔和叔/ nbs1在G1。在植物的连续世代中,长度差异更为明显,为1.5 ~ 0.7 kb叔在G6植株中,69-2系,而在G6植株中仅为0.6 kb叔/ nbs1G6植物(图7一个箭头)。的端粒加速缩短的趋势叔/ nbs1在比较G4和G5植株时,也可以看到双突变体(图5)7B)。纯合子nbs1在同样的实验中,植物端粒没有缩短的迹象。
突变植株的TRF分析。对代表性植物第二代、第四代和末代(G2、G4、G6)的DNA进行酶切,得到末端端粒片段Tru1限制性内切酶,在1%琼脂糖凝胶上分离,Southern转移,通过32P标记C3.助教3.调查。(一个)野生型和nbs1突变体的端粒长度为5000 ~ 2000bp。的逐渐缩短叔突变体(第69-2行)在双纯合子中伴随着更显著的端粒缩短叔/ nbs1,(线K12)至G6短至600 bp(箭头)。信号强度的差异反映了每条通道中装载的DNA数量的细微变化。(B)植物G4和G5的TRF片段比较。双纯合子的片段长度逐渐减少叔/ nbs1(L2线)从1600-700 bp到1300-700 bp在连续代之间是明显的。长度的范围明显短于叔(第69-1行),G4代和G5代分别显示2500 - 1400bp和2000 - 1000bp。箭头指向()的间隙端粒序列一个)及(B)。
讨论
实验设置和植物形态
近年来,MRN植物复合体的个别成分已被逐步分析。MRE11T-DNA插入突变体已被描述为对植物生长和纯合子的育性有严重影响[20.,28]。同样,突变体拟南芥含有T-DNA的植物RAD50基因是不育的[18,29,30.并且只能在体外培养中存活。
在本研究中,我们分析了NBS1在端粒长度动态平衡中的可能作用。我们用的是一样的拟南芥突变系GK-570B0923]。T-DNA插入导致n端截断蛋白缺乏功能性FHA和BRCT结构域,而MRE11结合结构域被保留。这种缺陷并不影响玉米的生长和肥力nbs1 / nbs1比如(图1),如[23]。纯合子植物缺乏叔基因已被广泛研究[24,26,31,32并被证明没有端粒酶活性[31]。然而,在我们的实验中,这些植物是可以存活的,并且在七代的时间里提供了肥沃的种子,类似于[31]。相比之下,双纯合子叔/ nbs1从G3代开始,植物表现出发育障碍的迹象(图2)1B),伴随着种子产量的逐渐下降(图2)2A).矮株G6虽然提供了种子,但没有萌发能力(图6)2D)。
基因组的不稳定性叔/ nbs1比如
在我们的实验中,基因组不稳定性的测量是有丝分裂后期桥的发生(图2)3.罪犯)。而在野生型植物中,未检测到后期桥,但在双纯合子中叔/ nbs1从G3上检测到后期桥的存在(图2)3.G)。在接下来的三代种子(G6为终末)中,桥接后期的比例急剧增加,在G6中达到近40%(图6)3.)。比较两个独立的叔/ nbs1线,K12和L2,桥的频率没有差异(表2)1)。相比之下,叔突变体在G5开始出现后期桥接,但比例仍然相对较低,G5、G6和G7分别为2.7%、5.4%和7.6%(图5)3.G)。nbs1纯合子在显微镜下没有表现出任何后期桥,在我们的双纯合子中观察到的后期桥的频率显著增加和加速发生只能通过两种缺陷的协同相互作用来解释。
我们还在双突变体的花粉母细胞减数分裂后期检测到后期桥4),而减数分裂的其他阶段则明显正常。我们未观察到单株减数分裂缺陷nbs1研究了所有世代的突变体。用这个相同的nbs1突变,但在一个自动取款机背景,在减数分裂早期出现大量缺陷,这表明NBS1在控制减数分裂过程中具有独立于ATM信号的作用[23]。
融合染色体叔/ nbs1完全卷入的染色体末端
通过NHEJ机制进行的染色体融合是端粒脱帽的结果,可能是各种复制染色体随机融合的结果,也可能是同一染色体的姐妹染色单体融合的结果[27]。FISH分析与BAC探针起源于染色体直接邻近端粒拟南芥染色体显示,大多数桥含有末端BAC信号(图2)5B-D),特别是,没有来自不同染色体的信号组合。因此,染色体连接的普遍机制是姐妹染色单体的融合。这与叔突变体,其中各种染色体末端被随机招募到69-1和69-2两条细胞系的融合中(图2)5J-L)。在双纯合子G3稀疏出现的桥中,我们能够在桥上观察到高比例的清晰的端粒信号(图2)5F,表2),这与更高代(G4至G6)形成鲜明对比,后者从未检测到后期桥上的端粒束(图2)5H)相反,叔突变体通常包含端粒序列的痕迹,至少在G5和G6中是这样5N和P;表2)。端粒DNA的丢失已被注意到的有丝分裂桥拟南芥rad50突变体(19]。然而,双杂合子叔/ rad50经常包含端粒重复序列[19],因此认为RAD50在端粒去保护或端粒因缺乏TERT而缩短时具有两种不同的作用。
在一些拟南芥经常描述的突变体表现出体细胞后期桥梁的参与,无论是同源染色体或单染色单体融合;这适用于mre11-3 / ku70突变体(44%的fish鉴定的融合体由单个端粒邻近探针修饰)[20.],或foratm /叔在融合连接处也检测到单染色体末端的突变体[33]。同样,当我们测试序列FISH测定评估染色体末端融合的可行性时[26]通过分析G5叔在植物中,我们发现47%的已鉴定的融合含有来自同一染色体末端的信号。在本研究中,我们描述了双突变体中2R染色体末端融合的普遍发生,线K12(图2)6、表3.)。这可以通过早期代中2r端粒的严重缩短以及通过体细胞组织和种系的克隆繁殖来解释。尽管在这些不同的遗传背景下染色体融合的原因是相当不同的,但相当大比例的无帽端粒融合是由姐妹染色单体相互作用造成的。
NBS1在保护端粒中的可能作用
我们观察到,与野生型或单型相比,双纯合子的后期桥的发生率和频率更高叔突变体。通过使用末端限制性内切片段(TRF)分析测量端粒总长度,我们发现双突变体的单个染色体端粒相对于叔突变体(图7)。同时,端粒的长度nbs1不受影响,与野生型植物相当。
RAD50和MRE11及其在DNA修复和端粒生物学中的作用的研究取得了实质性进展拟南芥,而nbs1相关数据仍有待收集。从我们的实验中,我们无法判断观察到的协同作用是由于功能缺陷还是由于NBS1与植物端粒直接物理相互作用的存在。可能第一次直接观察到NBS1蛋白与端粒(TRF2蛋白)的共定位是在细胞周期的S期在HeLa细胞中发现的,这表明NBS1蛋白可能在端粒复制中起作用[14]。同年,在端粒酶阴性永生化细胞中也观察到NBS1与TRF1蛋白的相互作用[13]。在从NBS1综合征患者分离的培养细胞中进行的实验中,NBS1蛋白被认为是端粒酶的积极调节因子,但问题仍然是该蛋白是否将这种酶招募到端粒[34]。使用cre-lox重组系统灭活小鼠胚胎成纤维细胞中的TRF2和NBS1,发现NBS1向功能失调的端粒募集是细胞周期依赖性的[15]:在G1期间,NHEJ通过atm依赖的信号传导被诱导,而在G2期间,NHEJ通过5'端切除机制被抑制,该机制在复制染色体上产生NHEJ不相容的3'悬垂。
在TRF分析中,观察到两种不同的模式,野生型和野生型都有模糊信号nbs1代表不同端粒长度的植物,以及代表端粒缩短的植物的单个端粒的单个条带(图2)7)。这些离散的条带是端粒缩短的标志[31并提供缩短的端粒在植物组织和/或连续代中无性繁殖的证据。严重发育缺陷拟南芥植物和丰富的端到端染色体融合atm /叔突变体证明植物胚胎中的所有细胞都遗传了一个严重缩短的端粒[33]。虽然分析表明短端粒是由于大端粒快速缺失(TRD)事件而产生的,但FISH分析显示融合染色体表现出过多的单染色体末端。值得注意的是,在我们叔/ nbs1突变体,K12系,我们在FISH分析的所有代的融合点检测到过度代表的2R染色体末端(图2)6)。有趣的是,从G2代开始检测到端粒缩短(图2)7A),远早于在G3中检测到端到端染色体融合。这一事实有力地支持了NBS1和端粒酶代谢之间的协同作用的存在拟南芥并排除了结果影响的可能性nbs1去保护端粒上的突变。
我们没有解决的问题是,是否仅仅是NBS1的缺乏导致了双突变体中观察到的表型,或者是否在MRN复合物的正常组装中存在干扰,从而对表型产生影响。的半胚突变NBS1结果,转录本的n端部分被截断,因此缺乏FHA和BRCT结构域,而含有mre11结合和假定的atm相互作用基序位点的c端结构域被保留[23]。因此,MRN复合体的组装似乎不受影响。功能性NBS1的FHA和BRCT基序中存在磷酸化肽结合结构域,与大量需要磷酸化才能在dna损伤修复或端粒维持中发挥作用的蛋白质相互作用[35- - - - - -37]。因此,NBS1的功能障碍可能与缺失的FHA/BRCT结构域有关。
结论
NBS1在端粒上的直接物理接触/存在及其在端粒维持中的功能已在人类中得到证实,但在植物中尚未得到证实。到目前为止,在植物中还没有描述过类似的遮蔽物,这一事实阻碍了对这一问题的理解。通过我们的研究,我们现在提供了NBS1和端粒之间相互作用的间接证据。目前尚不清楚n端结构域的蛋白质截断是否导致了在叔/ nbs1突变或某些未知的端粒保护途径的破坏是负责任的。
方法
拟南芥突变体
突变株(均为哥伦比亚背景)在21°C的环境生长室中培养,光照/黑暗周期为16/8 h。在琼脂板上培养时,使用含有B5维生素(杜奇法)的Murashige和Skoog培养基,在0.8%的Plant agar(杜奇法)中添加20 g/L的蔗糖,在永久光照下发芽。叔突变体是从Karel Riha博士的实验室获得的(见[31])。nbs1突变系570B09从GABI-KAT [38]。纯合子的nbs1和叔利用t - dna特异性引物和基因特异性引物,采用PCR分型的方法筛选植株叔突变LB6: GAACATCGG TCTCAATGCAA [31]和TERT6: CTAGGACATATCCATCAAGGGCT [31]和nbs1突变NBSF: GGTTGTCCTTAATTCCGCTTG和8409:ATATTGACCATCATACTCATTGC。对分离的F2幼苗进行纯合子杂交,得到双纯合子叔/ nbs1以及野生型叔(两条独立线路,69-1和69-2),以及nbs1采用TERT7筛选单突变体并进行PCR确认:GAAAGGAAGCTGTATTGCACGAA [31]、TERT6、NBSF、NBFR: ggctgtatccaggaattttcg。从双纯合子中,选择两个独立的株系K12和L2进行进一步分析。这些被进一步称为第一代(G1)。通过自花授粉,我们获得了连续5代,G2到G6,直到植物产生不育种子。
DNA提取及末端限制性片段(TRF)分析
根据[39]在发芽后3周从花序或幼叶中萌发。TRF分析依据[40]。简单地说,dna是用Tru1I (Promega)在65°C下过夜,在1%琼脂糖中电泳。Southern印迹后,膜与32p - γ - atp末端标记的(T3AG3)4寡核苷酸杂交。在台风FLA 9500扫描仪上显示放射性信号,并使用ImageQuant软件(GE Healthcare)进行分析。
有丝分裂和减数分裂染色体的制备
在制备有丝分裂样品时,将整个顶生花序固定在3:1乙醇和乙酸的混合物中。用自来水冲洗花序,并转移到10 mM柠檬酸缓冲液(pH为4.5)中。在解剖显微镜下从花芽中取出雌雌花,用0.5% Onozuka纤维素酶(SERVA Electrophoresis Ltd., Heidelberg, Germany)和0.5% Pectolyase (Sigma Chemical Co., Saint Louis, MO, USA)的混合物在37°C的湿室中浸泡3小时。将雌蕊转移到载玻片上60%醋酸的滴液中,并在盖玻片下压扁。将载玻片在液氮中冷冻并除去盖片后,用3:1乙醇与乙酸的混合物将载玻片固定,风干。未成熟花蕾(1-2毫米长)的花药经过相同的浸渍过程后获得减数分裂制剂。
细胞质染色
花药在1%胭脂红45%醋酸溶液中固定/染色30分钟,然后在盖玻片下轻轻压扁。成熟和健康的花粉粒染成浅紫色。
双色FISH和标记探针
当FISH探测单个末端时拟南芥选择染色体,细菌人工染色体(BAC)克隆,并使用重复FISH程序准确评估融合点,如[32]。用于鉴定拟南芥各特定染色体末端的BAC克隆分别为F6F3、F5I6、F11L15、T4P13、F16M2、F6N15、T5J17、F7J8和K9I9。这些bac来自美国俄亥俄州哥伦布市拟南芥生物资源中心。使用QIAGEN质粒Midi试剂盒(QIAGEN Inc., Valencia, CA, USA)严格按照制造商建议从细菌培养物中分离BAC dna。鉴定2号和4号染色体左臂的探针为2478 bp (生态R I) 25S-rRNA基因片段[41]。探针用SpectrumGreen-dUTP (Abbott Molecular, Illinois, USA)或Cy3-dUTP (GE Healthcare UK Ltd, Little Chalfont, England)标记,使用Nick Translation Mix (Roche Applied Science, Mannheim, Germany)标记。端粒束通过定制合成的cy3标记的PNA探针CCCTAAACCCTAAA (Applied Biosystems, Bedford, MA, USA)进行可视化。
FISH程序和图像的获取
显微镜制剂用100 μg/ml 2xSSC RNase A (Promega, Madison, WI, USA)和胃蛋白酶(Sigma, 50 μg/ml, 0.01 N HCl, 10 min, RT)在37℃条件下消化1小时。载玻片用3.7%的中性甲醛后固定。杂交混合物在2xSSC中含有每种标记BAC DNA 50 ng和/或标记rDNA探针20 ng, 10%葡聚糖硫酸盐和50%甲酰胺。将热变性杂交混合物涂于载玻片上,用盖片覆盖载玻片,进行热变性处理。在37°C下杂交过夜后,载玻片在42°C下用0.1倍SSC严格洗涤。用1 μg/ml 4′,6-二氨基-2-苯基吲哚(DAPI, Sigma)装药于Vectashield (Vector Laboratories, Peterborough, UK)。对于端粒PNA探针,使用60%甲酰胺的探针混合物增加了杂交的严格性。显微镜图像使用Olympus AX 70荧光显微镜(Olympus, Tokyo, Japan),配备AxioCam MRm (Carl Zeiss Inc., Goettingen, Germany)相机,并使用ISIS成像软件(MetaSystems Ltd., Altlussheim, Germany)进行处理。
缩写
- ATM机:
-
共济失调毛细血管扩张突变
- ATR:
-
共济失调毛细血管扩张与rad3有关
- BAC:
-
细菌人工染色体
- 乳腺癌易感基因1:
-
乳腺癌1基因
- BRCT:
-
BRCA1 C末端结构域
- 双边带:
-
双股断裂
- 联邦住房管理局:
-
Forkhead-associated域
- KU70:
-
KU70蛋白质
- MRE11:
-
减数分裂重组11基因
- MRN:
-
MRE11-RAD50-NBS1复杂
- NBS1:
-
奈亨断裂综合征1基因
- NHEJ:
-
Non-homologous-end-joining
- 机构:
-
肽核酸
- RAD50:
-
DNA修复蛋白
- 叔:
-
端粒酶,逆转录酶
- TRD:
-
端粒快速删除
- 扶轮基金会:
-
末端限制片段分析
- TRF1:
-
端粒重复结合因子1
- TRF2:
-
端粒重复结合因子2
- XRS2:
-
对x射线敏感,酵母DNA修复蛋白。
参考文献
- 1.
保护蛋白:形成和保护人类端粒的蛋白质复合物。生物医学工程学报,2005,19(2):391 - 391。10.1101 / gad.1346005。
- 2.
端粒和端粒酶:它们的作用机制和改变它们功能的影响。电工技术学报,2005,(5):859-862。
- 3.
王晓东,王晓东,王晓东,等。染色体端粒的克隆与保护。自然科学,2007,44(4):924-931。10.1038 / nature05976。
- 4.
棕榈W,德兰格T:庇护蛋白如何保护哺乳动物的端粒。科学通报,2008,32(2):331 -334。10.1146 / annurev.genet.41.110306.130350。
- 5.
沃森JM, Riha K:端粒的比较生物学:植物的位置。生物医学工程学报,2010,35(4):379 - 379。10.1016 / j.febslet.2010.06.017。
- 6.
Lamarche BJ, Orazio NI, Weitzman MD: MRN复合体在双链断裂修复和端粒维持中的作用。生物医学工程学报,2010,35(4):382 - 395。10.1016 / j.febslet.2010.07.029。
- 7.
Stacker TH, Petrini JHJ: MRE11复合体:从末端开始。生物工程学报,2011,32(2):391 - 391。10.1038 / nrm3047。
- 8.
Hopfner KP, Craig L, Moncalian G, Zinkel RA, Usui T, Owen BA, Karcher A, Henderson B, Bodmer JL, McMurray CT, Carney JP, Petrini JH, Tainer JA: Rad50锌钩是DNA重组和修复中连接Mre11复合物的结构。自然科学,2002,18(4):562-566。10.1038 / nature00922。
- 9.
刘建军,陈建军,陈建军,陈建军,陈建军。拟南芥中ATR激酶和Mre11-Rad50-Nbs1复合物在染色体稳定性维持中的作用。植物学报,2010,22:3020-3033。10.1105 / tpc.110.078527。
- 10.
田文杰,田文杰,田文杰,田文杰,田文杰,田文杰,田文杰,田文杰。分裂糖酵母菌DNA修复和端粒维持相关基因的研究。中国生物医学工程学报,2003,23(3):653 - 663。10.1128 / mcb.23.18.6553 - 6563.2003。
- 11.
张勇,周军,林国克:NBS1在DNA双链断裂修复、端粒稳定性和细胞周期检查点控制中的作用。中国生物医学工程学报,2006,16(1):45-54。10.1038 / sj.cr.7310007。
- 12.
朱杰,Petersen S, Tessarollo L, Nussenzweig A: Nijmegen断裂综合征基因NBS1的靶向破坏导致小鼠早期胚胎致死。中华生物医学杂志,2001,11:105-109。10.1016 / s0960 - 9822(01) 00019 - 7。
- 13.
吴刚,李文华,陈培林:NBS1和TRF1在早幼粒细胞白血病细胞S/G2期晚期共定位。中国生物医学工程学报,2009,31(2):369 - 369。
- 14.
朱晓东,Kuster B, Mann M, Petrini JH, de Lange T:细胞周期调控的RAD50/MRE11/NBS1与TRF2和人类端粒的关联。中国生物医学工程学报,2000,25(5):347-352。10.1038/77139。
- 15.
Dimitrova N, de Lange T: MRN在功能失调端粒中的细胞周期依赖性作用:ATM信号依赖性诱导G1非同源末端连接(NHEJ)和G2切除介导的NHEJ抑制。中国生物医学工程学报,2009,29(3):559 - 563。10.1128 / MCB.00476-09。
- 16.
Zellinger B, Riha K:植物端粒的组成。生物化学学报,2007,17(6):399-409。10.1016 / j.bbaexp.2007.02.001。
- 17.
[J]:植物端粒功能的细胞遗传学研究。中国生物医学工程学报,2008,32(2):374-379。10.1159 / 000167825。
- 18.
Bleuyard J-Y, Gallego ME, White CI:拟南芥rad50突变体减数分裂缺陷指向减数分裂重组早期MRX复合体功能的保护。染色体工程学报,2004,13(3):369 - 369。
- 19.
Vannier JB, Depeiges A, White C, Gallego ME: Rad50在端粒维持中的作用。中国生物医学工程学报,2006,25(5):557 - 557。10.1038 / sj.emboj.7601345。
- 20.
李建军,李建军,李建军,等。拟南芥减数分裂过程中Mre11基因缺失与染色体不稳定性的关系。植物学报,2004,16(1):68- 78。10.1105 / tpc.104.022749。
- 21.
王晓明,王晓明,王晓明,等。拟南芥端粒融合的分子分析。染色体末端连接的多种途径。中国生物医学工程学报,2004,23(3):444 - 444。10.1038 / sj.emboj.7600236。
- 22.
李建军,李建军,李建军,等。基因重组与DNA修复的研究进展。中国生物医学工程学报,2007,35(3):394-398。10.1016 / j.bbrc.2006.12.030。
- 23.
Waterworth WM, Altun C, Armstrong SJ, Roberts N, Dean PJ, Young K, Weil CF, Bray CM, West CE: NBS1参与植物DNA修复并与ATM协同介导减数分裂同源重组。植物学报,2007,32(2):491 - 492。10.1111 / j.1365 - 313 x.2007.03220.x。
- 24.
李建军,李建军,李建军。植物端粒功能紊乱与基因组不稳定性的关系。科学,2001,29(1):1797-1800。10.1126 / science.1057110。
- 25.
纽科姆RG:单一比例的双侧置信区间:七种方法的比较。中华医学杂志,1998,17:857-872。10.1002 / (SICI) 1097 - 0258 (19980430) 17:8 < 857:: AID-SIM777 > 3.0.CO;双电子。
- 26.
王晓明,王晓明,王晓明,等。拟南芥基因突变体染色体融合位点的序列分析。基因工程学报。2006,49:1036-1042。10.1139 / g06 - 082。
- 27.
Gallego ME, White CI: DNA修复和重组功能在拟南芥端粒维持。中国生物医学工程学报,2005,25(3):481-491。10.1007 / s10577 - 005 - 0995 - 4。
- 28.
Bundock P, Hooykaas P:拟南芥MRE11突变体的严重发育缺陷,对dna损伤剂的超敏反应和端粒延长。植物学报,2002,14(4):551 - 562。10.1105 / tpc.005959。
- 29.
Gallego ME, White CI: RAD50功能对拟南芥端粒维持至关重要。《美国科学院学报》。[j] .中国科学:地球科学。10.1073 / pnas.98.4.1711。
- 30.
Gallego ME, Jeanneau M, Granier F, Bouchej D, Bechtold N, White CI:拟南芥RAD50基因断裂导致植物不育和MMS敏感性。植物学报,2001,25(5):391 - 391。10.1046 / j.1365 - 313 x.2001.00928.x。
- 31.
黄晓明,王晓明,王晓明,王晓明,王晓明。拟南芥端粒酶催化亚基基因的研究进展。《美国科学院学报》。[j] .中国科学:地球科学。10.1073 / pnas.96.26.14813。
- 32.
王晓明,王晓明,王晓明,等。端粒酶缺失对拟南芥核糖体DNA重排的影响。染色体工程学报,2003,31(2):369 - 369。10.1007 / s00412 - 003 - 0251 - 7。
- 33.
Vespa L, Ross T, Warrington RT, Mokros P, Siroky J, Shippen DE: ATM调控拟南芥端粒束长度。《美国科学院学报》。[j] .中国科学:地球科学。10.1073 / pnas.0704466104。
- 34.
Ranganathan V, Heine WF, Ciccone DN, Rudolph KL, Wu X, Chang S, Hai H, Ahearn IM, Livingston DM, Resnick I, Rosen F, Seemanova E, Jarolim P, DePinho RA, Weaver DT: NBS和端粒酶催化亚基对奈亨断裂综合征细胞端粒长度缺陷的修复作用。中国生物医学工程学报,2001,11:962-966。10.1016 / s0960 - 9822(01) 00267 - 6。
- 35.
林德生,徐波,林军,林俊,Petrini JH, Kastan MB: p95/nbs1在细胞凋亡中的表达。自然科学,2000,44(4):613-617。10.1038 / 35007091。
- 36.
李建辉,paul TT: DNA双链突破Mre11-Rad50-Nbs1复合物的ATM激活。科学通报,2005,32(3):551-554。10.1126 / science.1108297。
- 37.
李建军,李建军,李建军,等。DNA双链断裂中Mre11-Rad50-Nbs1构象的表达及调控。DNA修复,2010,9:1299-1306。10.1016 / j.dnarep.2010.10.001。
- 38.
王晓明,李勇,李志强,王晓明,王晓明,王晓明。拟南芥T-DNA突变群体(GABI-Kat)的遗传分析。中国生物医学工程学报,2003,25(3):557 - 557。
- 39.
杨建军,杨建军,杨建军:植物DNA的制备。版本二世。植物分子生物学杂志,1998,1:19-21。10.1007 / BF02712670。
- 40.
Watson JM, Shippen DE:端粒快速缺失调控拟南芥端粒长度。中国生物医学工程学报,2007,27(7):1706-1715。10.1128 / MCB.02059-06。
- 41.
Kiss T, Kiss M, Solymosy F:番茄25S rRNA基因的核苷酸序列。核酸学报,1989,17 (7):796-10.1093/nar/17.2.796。
致谢
我们感谢Dr. Karel Riha,格里高尔孟德尔分子植物生物学研究所,维也纳,奥地利为我们提供种子拟南芥突变体。本研究由捷克科学基金会资助,资助号:P501/12 / G090。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们没有竞争利益。
作者的贡献
JS构思概念,LN和JS进行实验,JS和LN撰写论文。两位作者都阅读并批准了最终的手稿。
权利和权限
本文由BioMed Central Ltd.授权发表。这是一篇基于知识共享署名许可(http://creativecommons.org/licenses/by/2.0),允许在任何媒体上不受限制地使用、分发和复制,前提是正确引用原创作品。
关于本文
引用本文
Najdekrova, L., Siroky, J.。NBS1在染色体端粒的维持中与端粒酶起协同作用拟南芥。BMC Plant Biol12,167(2012)。https://doi.org/10.1186/1471-2229-12-167
收到了:
接受:
发表:
关键字
- 细菌人工染色体
- 端粒长度
- 叔
- 端粒的维护
- 奈梅亨破裂综合征