摘要
背景
随着一些主要农作物基因组序列的完成,利用这些数据改进作物和提高粮食安全面临新的挑战。遗传基因组学领域有潜力鉴定与重要表型性状相关的可遗传差异表达基因。在这里,我们描述了在分离马铃薯群体的两个不同马铃薯组织中的表达QTLs (eQTLs)的鉴定,并查询了马铃薯基因组序列,以区分顺式和反式作用的eQTLs与基因亚功能化的关系。
结果
叶和块茎样品进行分析,并筛选保守的,并且组织依赖eQTLs的存在。存在于两个组织中的表达的QTL主要是顺式作用,而对于组织特异性的QTL,的反式作用的QTL的百分比增加。组织相关eQTLs被分配到功能类和代谢途径可视化。我们确定了10号染色体上一个潜在的调控网络,涉及的基因保持昼夜节律和控制时钟输出的基因是至关重要的。此外,我们证明了遗传物质的类型,筛选和抽样策略应用,可以对遗传基因组学研究的输出有很大影响。
结论
基于映射差异表达的组织依赖调控网络的识别不仅使我们对组织依赖性基因子功能的洞察力,但为关键生物过程带来了新的见解,并提供了未来单倍型和遗传标记发育的目标。
背景
缔合基因组学或基因组学的领域试图将产生的〜OMICS数据与通过遗传标记关联的表型变异结合的遗传性[1].旨在的基因组学研究的旨在确定基因组区域,用于控制单一或多种基因,代谢物和/或蛋白质(分别的蛋白质(EQTL),MQTLS和PQTLs)的表达。由于数据生成的成本减少,并且在很大程度上克服了计算瓶颈,但在过去几年中,非模型物种的人口宽〜OMICS数据的数量已经急剧增加。已经证明了许多植物物种,包括拟南芥,大麦,小麦,桉树和杨树的植物物种的成功应用2-8.].特别是,模型植物拟南芥的研究对于发展基因组学的概念至关重要,并推动了软件开发,以应对不同分析平台产生的增加的数据量[1那9.].〜OMICS数据,标记和表型之间的关联突出了植物特质多样性的整体复杂性,并导致了许多监管网络的重建,包括开花[4.硫代葡萄糖酸盐),(10.],黄酮类化合物[11.]和类胡萝卜素[12.].eQTL热点的识别可以指示主要的调节开关直接或间接[控制许多基因的表达的存在13.].在许多研究中证实了EQTL热点的存在是对几个鉴定的区域发现基因功能类别的富集[14.那15.].然而,网络建模仍然严重依赖于目标路径的先验知识[16.].
尽管植物的遗传基因组学研究具有很大的潜力,但由于额外基因与基因组区域的遗传联系,差异基因表达或代谢物浓度与表型变异的关联并不总是披露负责的遗传因素。鉴定多态性的鉴定对于适用的遗传标记的发展是重要的。对于种植基因组学实验,人口规模,标记密度,取样策略,环境因素和筛选平台等因素,极大地影响了检测少量添加剂生物学效应的结果[17.那18.]]。人口宽筛查的高成本通常将基因组基因组学实验限制为单个组织或发育阶段。几项研究表明,基因表达的遗传架构在因反映在EQTL组织特异性中的器官和/或发育阶段之间具有高度发散[5.那19.-21].在poplar中,发现当比较两种不同的器官时,越来越多的eqtls的基因具有共同定位的EQTLS [5.].通过突变基因复制事件和多样化,称为子和neofunctionalization,背后基因表达的差异,并假设为驱动力用于获得新基因功能,因此植物发育的进化[22那23].
土豆品种是高度杂合的四倍体折叠植物,其使遗传分析复杂化了潜在特质变异的分子机制。因此,遗传学研究通常在二倍体基因型和群体中进行。精密育种依赖于负责性状变异的基因鉴定的致病多态性。一旦将基因分配了针对性特征的调节功能,可以确定四倍体品种和野生型探索中基因的等位基因,并可能在标记辅助育种中进行促进[24].
最近已经完成了二倍体马铃薯克隆(DM)的基因组序列[25],这将有利于快速鉴定和克隆相关联性状变异的基因,并且因此单倍型分析的努力。马铃薯遗传基因组学的实验打开了与基因组序列的可用性一个新的层面。与物理以及已知的许多基因的遗传图谱位置,QTL间隔可以更容易地筛选候选基因。在这里,我们在这两个叶片和块茎eQTL分析目前的第一遗传基因组学研究中的山芋。叶和块茎组织之间的比较揭示保护以及基因表达的组织有关的变化。基因相互作用和潜在的调控网络的鉴定和讨论。
结果与讨论
QTL分析和分配
从两个独立的实验中获得叶和块茎RNA提取物的表达谱。对于块茎分析,在双色染料实验中测定每个样品两次,允许基于相关评分(方法)的观察到的变化和随后过滤的交叉验证。表现出可用于QTL映射的显着表达的阵列特征总数比块茎样品更高,叶子(22,193)更高(19,956)。在两个器官之间发现了表达基因(19,590个特征)的宽重叠,这在既有效果和形态,环境暴露和发育阶段,考虑到它们具有比较较大的函数,这有点令人惊讶。然而,收获的器官由多种不同的细胞类型组成,从而降低了整体转录组复杂性,并且对基础或高基因表达没有区别。类似地,马铃薯微阵列基于可用的EST序列,其中时间和空间受限制的转录物具有捕获的较低变化,因此在使用微阵列时不分析。
基于R / QTL封装进行QTL分析,其允许使用单一集成遗传映射(方法)中的易用性物种中的高通量QTL映射。对于叶子和块茎数据,总共鉴定了17,764个QTL,以便可以在可能的阵列上存在于阵列上的基因冗余(即,与马铃薯基因组基因预测序列V3.2)的独立阵列特征类似的Blast评分。
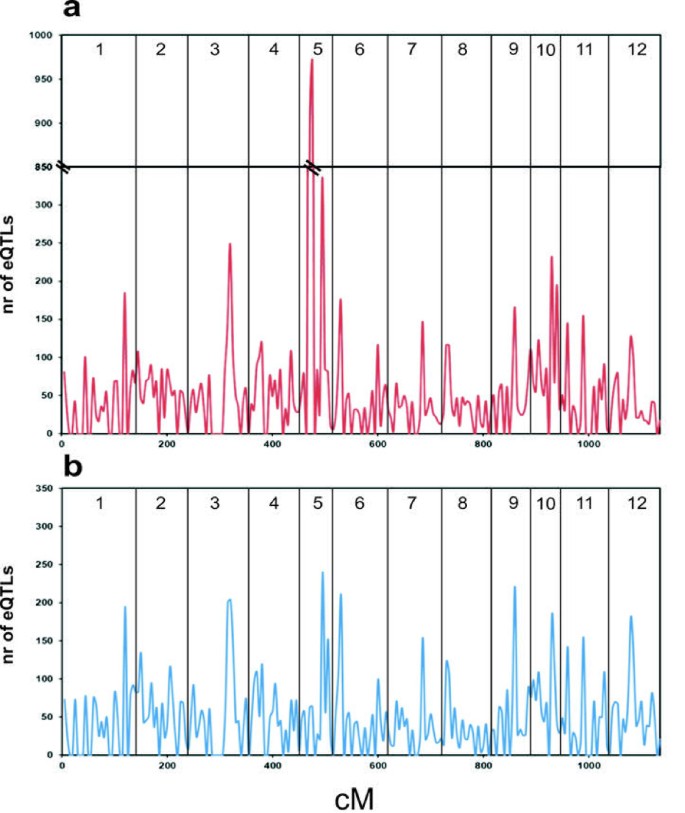
使用不同的连杆组上的QTL的分布作为滑动窗口图,用于使用5cm的块茎和叶子(图1一个和1分别为b)。每个链接组的有效qtl数量在附加文件中提供1。在连杆组5上检测到块茎表达的QTL数量的清晰表示,只有1800多个邻近箱(20-30厘米)映射超过1800 QTL。对于叶片表达数据,EQTL似乎更均匀地分布在基因组上,尽管可以识别出几种遗传间隔,其中QTL的数量高(> 200染色体3,5,6和9)。当可以识别比较叶片和块茎的EQTL分布与高EQTL号码的重叠区域。这些区域可以指示由于低重组频率而覆盖高基因密度的区域或覆盖大的物理序列距离。并非本研究中使用的所有标记都可以与基因组脚手架相关,而不是所有支架已经锚定到物理图上,在回答这些问题之前需要解决。
对于阵列的大多数特征(12,331; 70.1%),只检测到单个QTL,而2503个特征(29.9%),则针对两种组织组合的两个或更多个QTL(表1a)。对于阵列上的两个功能,识别最多5个QTL。一个表现出强烈的同源性Tropenone还原酶II(TRII; ESTCSTB29M16TH.)[26[已知已知在低于和地上马铃薯组织和地上的马铃薯组织中表达的生物合成。具有5种不同QTL的第二个特征(BF_LBCHXXXXXX_0032H04_T3M.SCF)对数据库中存在的任何蛋白质没有显着同源性,也没有其基因结构预测的马铃薯基因组注释中的目前释放[25].对于两个基因,在叶片中检测到四个QTL和块块中的第五非重叠QTL。在West等人的一项研究中。[2[报道的区域的数量以拟南芥中的基因表达为0至11,平均每种基因2.34转录物。在大麦学习中[3.],在调控基因有三分之一只有一个确定eQTL,而基因的其余部分显示2-6 eQTLs。在我们的数据,我们发现,被2个以上的基因组区域(2503个功能)与计算的平均每1.19基因QTL的控制相对少数基因。控制单个基因的表达的平均数量的基因组区域(的QTL)的估计的变化取决于算法中使用的,人口类型和大小[3.那27].本研究中鉴定的每个基因的EQTLS的数量可能是低估的,因为由于相对小的群体尺寸(n = 94)和标记密度导致高洛氏阈值(4.35),具有小添加剂效应的基因可能保持未检测到未被发现(4.35)。此外,在这里,我们具有靶向成熟块茎和开放的叶子,以允许分析源 - 水槽关系,而在器官启动和年轻显影组织中可以发现更多的时间和空间限制的基因表达。
CIS与转运EQTLS
具有全基因组序列的大规模EQTL研究中最令人兴奋的输出之一是可用的,是区分基因表达的CIS-和反式作用调节,这具有揭示监管网络的可能性。随着马铃薯草案的可用性基因组序列,我们能够区分大多数基因的CIS-和反式作用QTLS。基于基于阵列的未成熟的未列工被侵入基因组支架上,如方法中所述。推定的染色体位置可以分配给绝大多数基因(92%)。不能分配染色体位置的基因与基因组上的多个区域类似,在阈值以下具有相似性得分,或者表示的显着等异样。
在物理图谱位置相同的连锁组上已识别的qtl定义为顺式作用qtl,而在不同连锁组上的qtl定义为反式作用qtl。我们的结果表明,在叶片和块茎数据中,cis- eqtl的数量几乎是trans-act eqtl的两倍1B;> 10%解释的方差)。这可能表明,在马铃薯中,对CIS-over作用转录控制有强烈的偏好,这与在其他研究中的观察结果相反,其中反动QTL通常超越的[2那4.那5.那28].虽然低映射分辨率和伴随的宽级别置信区间不允许区分在同一联动组上映射的基因或CIS-EQTL之间的区分,但本身不能解释观察到的大差异。
使用阈值的意义,我们基于解释方差的量分类基因。有趣的是值得注意的是随着解释的QTL的数量与增加的差异(表1b)。几项研究报告了局部(CIS)在反作范学中的局部(CIS)增加,表明平均而言,顺式调节导致更强的差异表达,从而导致遗传变异与反式调节相比[3.那4.那29-31].
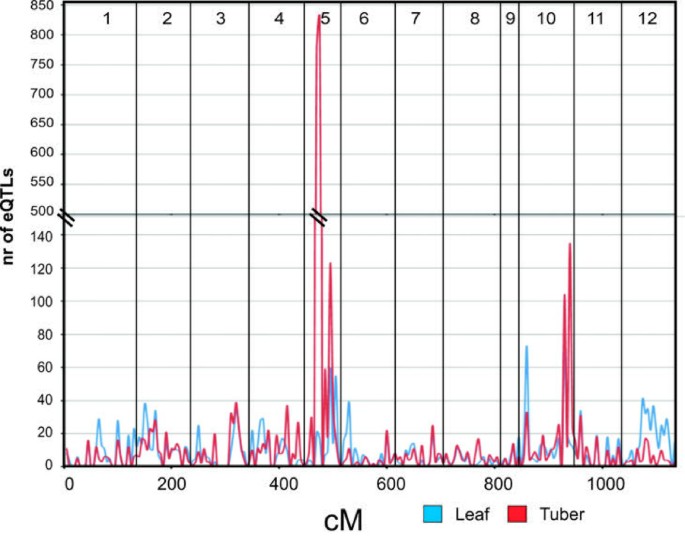
对马铃薯的相对高百分比的CIS-EQTLS的一个解释可以是其高度杂合性的性质,因此可能对更高水平的序列多态性(SNP和INDELS)的耐受性可能是耐受性。因此,转录调节的局部(顺式)控制可能是杂合植物物种如土豆中转录对照的优选机制。或者,在很大程度上根据QTL研究的统计功率来检测具有较小表型效应的Trans-EQTL的能力。应用保守滤波可能导致诸如Petretto等人建议的CIS-EQTL的许多假凸起偏置检测。[31].一个引人注目的观察是在连杆组5中发现的反式作用QTL的大峰(图2)。问题出现了在连杆组5上的该小型基因组区域中发现的大量QTL可以归因于控制许多基因表达的单个“主开关”。衰老和块茎形成的定时的变异在C×E群中已经表现出,并以前被映射为较早的基因座(el),与第5染色体上发现的块茎数据的eQTL热点相同的基因组区域[32].的C×E人口的节目在的块茎形成发病强烈变化(早 - 晚),并允许基因表达的等效生理状态的块茎进行比较,选择被收获到几个“成熟”块茎提取物RNA进行茎叶后杀害周。两种情况下可以设想来解释大量基因的其表达受区域该港口的早熟基因座调节。首先,将取样的块茎可能是假的相似的生理状态的最初的假设;在赛季末形成块茎仍可能代谢更活跃,甚至稻草被杀之后,比块茎在本赛季早些时候形成。在早期和晚期块茎酶活性的差异可能是所观察到的差异基因表达水平的结果。在这种情况下,检测到的eQTLs不是主交换机调节器的直接控制下,而仅仅反映块茎的不同代谢状态作为较早事件(块茎形成的定时)的结果。另一种解释可能是块茎形成的轨迹控制植物成熟和时机确实是直接在整个工厂生命周期调节几个代谢途径。有趣的是,叶表达数据中,没有观察到这种热点。 The variation in gene expression explained by theel第5染色体基因座中,示出了的是,在块茎仍然存在基因表达的调节即使经过块茎收获和整个储存。这些意见强调的遗传基因组学实验结果抽样策略的影响。
除了染色体5上的主要QTL峰值之外,叶片和块茎数据之间的反式作用QTL分布的进一步比较揭示了与包含所有QTLS的分布图相比的高QTL频率的其他重叠区域。两个组织的重叠的Trans-EQTL热点可以在LG 5和10上找到,并且在LG 3,9和11上的程度上。
在叶和块茎中发现总共5,818个重叠QTL(跨越相同的基因组区域),只有401个特征(6.9%),表现出反向作用转录控制(表1c)。先前已经建议,转发QTL更常见的组织特定[5.那28].在本研究中,我们发现了类似的结果,仅考虑在两个组织(叶或块茎)中唯一发现的qtl,叶片和块茎中反式作用qtl的比例分别提高到34.8%和48.8%。在两种组织中,同一基因的不同eqtl的反式作用qtl可能是建立器官依赖转录网络的关键。使用不同的mRNA提取方法,或两个器官的mRNA提取能力的差异,不太可能影响基因表达的遗传调控的鉴定。
组织依赖
随着物料,机构特异性基因调节可能已经发展出来的新机构或机构的特定要求。不同代谢路线的活动是控制器在环境因素和发育阶段的影响下整个生长季节的变化。因此,没有令人惊讶的是,组织或发育阶段特异性的EQTL可以在基因分类学研究中鉴定[5.那19.那20.].分析生物数据集中特定途径中活性基因表示的常见方法是使用基因本体(GO)分类(方法)。在表格中2,我们比较了功能分类,其中特征在块茎和叶片组织中匹配块茎和叶片特异性EQTL。在匹配的匹配EQTL(两个块茎和叶片中)只有很少的反作用eqtls,这与跨调节是分化的重要驾驶员的想法一致(表1c和[5.])。这是通过在开发和照相相关的GO类中缺乏任何跨动手eqtls的例子。尽管在两个块茎和叶片特异性EQTL中,大多数功能类都很好地代表,但有趣的是要注意这些包括不同的基因组,包括不同的基因和反式作用,其可以以组织依赖方式演变。例如,与应力响应相关的相当数量的基因,展示可能反映叶子和块茎需要响应的不同环境影响的叶片或块茎特异性QTL,以及它们自己的反应中的差异。
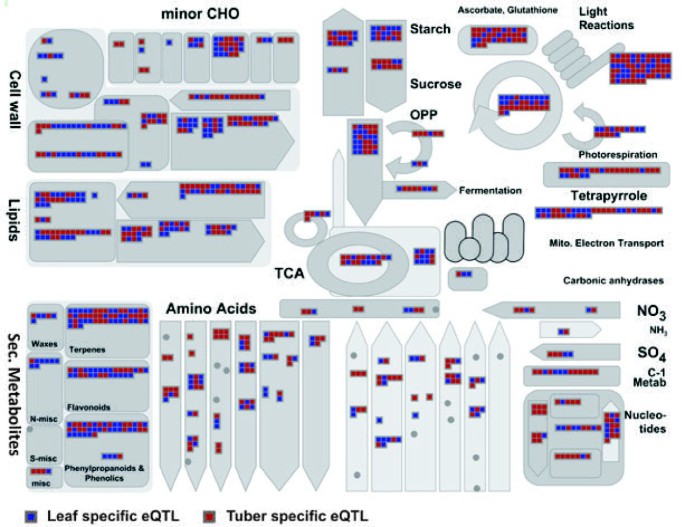
块茎的形成需要表达许多基因,控制地下茎(Stolons)的启动,在有利的条件下能够开发作为水槽器官的块茎。基因组宽的RNASEQ数据[25[表明,少于块茎中的几个基因,这意味着块茎特异性的发育和对环境的反应通过表达调节和基因的子官能化而作出。在图中3.,基于块茎(红色)或叶(蓝色)特异性EQTLS的存在,提供重要代谢途径和相关基因的示意性概述。因此,在遗传对照(EQT1)下的代谢途径内有活性的任何基因表示为红色盒子(块茎)或叶(蓝盒)。没有代表在不属于遗传调节的代谢途径中的基因,因此不会产生EQTL。以这种方式,基于遗传因子的基因表达的组织依赖性变化可以容易地可视化,这提供了在各个组织中鉴定关键调节基因的有用资源。在两根块茎和叶中,我们发现与主要碳水化合物代谢相关的基因组织依赖性差异表达(CHO)(附加档案2和附加文件3.)。在块块中,涉及蔗糖降解和淀粉生物合成的基因的EQTLS呈现超过叶片表达数据集,似乎朝向淀粉降解的差异调节较强的偏差。在这两种组织中,表达了类似的基因官能,但这些功能由不同的转录物编码或者被两种组织中这些基因的各种基因的不同位置反射的差异调节。在这里,我们发现在组织中调节碳水化合物代谢调节的差异与它们的功能强烈地与其功能相关,即块茎作为碳水化合物储存器官(淀粉合成)和产生的瞬时淀粉和随后在叶子中夜间降解。使用MAPMAN可视化工具,可以更详细地分析相关的代谢路径,包括次级代谢物,糖酵解,传输基因或转录因子,提供对组织依赖性调节的洞察,以及潜在的遗传组分是否是CIS或反式作用。这种组织依赖性不仅允许用不同的转录控制(EQTL)的各种组织中活性的基因鉴定,而且还提供了对器官依赖调节的洞察,这是组织特异性网络重建的基础。
跨监管网络的识别
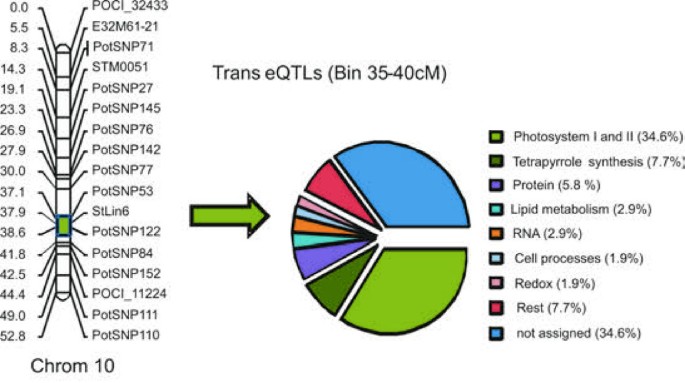
反式作用eQTLs的共定位可能表明转录调控的类似的机制。我们最初考虑在这些地区的GO类别的过度表达在基因组中有大量无论从叶或块茎反式作用eQTLs的。10号染色体上(35-40厘米),我们发现不相称大量具有光系统I,II,和四吡咯代谢有关的块茎特异性eQTLs(42.3%)(图4.和表格2)。在暴露于光线后的土豆块茎的绿化对于消费和加工行业来说是不可接受的,因为它通常与高水平的甘油链含量有关。Edwards等。[33],然而,并未发现叶绿素(叶绿素)和配糖生物碱生物合成之间曝光后直接代谢链接。其他研究已经表明块茎响应于光和配糖生物碱和叶绿素合成的比值,基因型依赖性以及生理状态和本征值的[34那35].转录组范围内的RNAseq数据显示,块茎果皮中许多光合作用相关基因的表达水平相对较高[25].在收获和储存期间,块茎可能不同地暴露在短时间的光照下。这可能会诱导光合作用相关基因的表达,但不能解释这些表达差异的遗传定位。因此,与Chl生物合成相关的基因表达水平的增加可能反映了影响对光暴露敏感性的遗传因素。有趣的是,我们在C × E基因型的叶片中发现了与光反应相关的功能相似的基因(见图)3.;光反应右上角)。
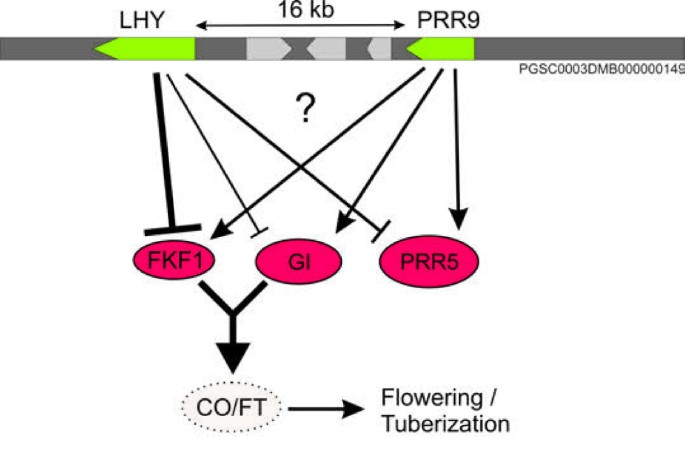
虽然EQTL热点内功能GO类别的过度表示可以揭示监管网络,但有关单个或少数基因的调节的信息也可以非常相关。发现所涉及维持昼夜节律和时钟输出的基因的差异表达被染色体10(0-10cm)顶部的区域部分地调节在叶子中。在跨越QTL间隔的基因组区域中,具有高同源性的基因/阵列特征的CIS-EQTLSLHY(晚细长胚轴; MICRO.14662.C1)和PRR9.(伪响应调节器9;鉴定了Potatof1061.scf)。用于中心时钟的整体组件的基因代码[36-39].有趣的是,对中央时钟成员具有强大同源性的基因的转运eqtls;Gigantea(Micro.7284.C1),FKF1(Micro.157222.C1)和假响应调节器5(PRR5; Micro.7036.C1)蛋白,全部映射到相同的10cm基因组区域。最佳相关的遗传标记是POCI_32433,其在基因组脚手架PGSC0003DMB000000149上映射[25]并包含两个LHY和PRR9.基因,表明LHY和/或PRR9可能参与调节Gigantea.那FKF1,PRR5.基因。LHY表达与下游效应器呈负相关胃肠道,FKF1和PRR5.,而且PRR9.表达量正相关(图5.)。昼夜节日钟参与植物生长和发展的许多方面,与从营养生长转变为开花和适应环境和季节变化的转变有关[[40]]。天然遗传变异在中央时钟基因调节中的标识可以证明在复杂性状如植物成熟,开花和的产率特性的定时的散开有价值。对于马铃薯,知之甚少相对于植物生长时钟控制,但块茎形成的定时似乎是昼夜节律钟的直接控制之下通过的转录调控概要(CO.)[41.[控制与块茎诱导相关的马铃薯开花时间矫正时间的合成和运输[42.].在拟南芥中,中央时钟包括两个MYB基因,CCA1和LHY[37那43.].在马铃薯基因组中,只有一个ortholog(LHY可以识别可能指示时钟控制的不同机制。类似于拟南芥,表达模式GI.和FKF1.马铃薯遵循下午峰表达的昼夜节律而LHY表达峰值出现在黎明,与观测到的负相关(数据未显示)一致。在拟南芥中,GI和FKF1形成一个控制CDF1稳定性的复合物[44.].CDF1反过来控制CO.表达取决于一天中的时间[44.].变异的基因表达的时间GI.和FKF1.因此,在群体中可能导致相移或相位幅度的变化效应下游效应(如CO和FT Orthologs)。在这里,我们提出了LHY或PPR9在通过靶向GI,FKF1和PRR5的表达来控制时钟输出的初步作用(图5.)。与从我们的数据推断出收获时的块茎的生理状态的可能差异类似,当天本身的采样时间点可能对检测到日可控的表达差异至关重要。额外的排序LHY和PRR9.四倍体中的等位基因可以揭示与不同时钟控制相关的特征关联。
在上述例子中使用的演绎推理策略需要先验知识的途径和潜在的相互作用者。对于一个模式物种,如拟南芥,在基因功能、表达模式和蛋白质相互作用方面有丰富的科学证据,可以整合到遗传基因组学研究中。然而,许多基因功能还没有被解决。对于大多数其他植物物种来说,基因生物学功能的注释往往仅仅基于序列相似性,这可能产生各种缺乏科学依据的假设。基因基因组学研究可以通过新发现的基因相互作用和协同调控提供支持基因功能的证据。该方法将有助于更好地理解转录调控,并可能有助于识别性状qtl的关键调控基因。
基于杂合子的QTLS(假CIS-EQTL)
基于代表性单基因与最近公布的马铃薯基因组序列的序列同源性,可以将其物理地图位置归因于大量存在于阵列上的特征。然而,由于马铃薯的杂合子特性,其基因型序列往往与已公布的基因组序列相对不同,这使得在整个基因组中区分等位变异、不同基因家族成员或多拷贝基因并不简单。马铃薯SNP频率估计范围为每29 bp 1 SNP,发现在针对6.6 Mb序列的单相比较[25],在一对随机选择的序列之间每87bp进行1 snp [45.].用于微阵列Oligo设计的马铃薯Unigene集合[46.]推出类似的问题,因为组装中使用的EST起源于含有等位基因变异的各种四倍体品种。因此,unigenes可以包含等位基因变异或代表相同基因的不同等位基因。因此,基于这些序列的设计的寡核苷酸可以根据用于阵列杂交的基因型可能作为等位基因判别。Hughes等。[47.展示即使单核苷酸错配也可以根据错配的位置降低信号强度高达50%。为了评估C×E群体内的等位基因杂交特异性,我们在POCI微阵列阵列(方法)上杂交的父母线的基因组DNA。对于阵列上的94%的马铃薯寡核苷酸,可以获得C和E父母之间的杂交比,其中只有1921个特征在父母之间仅显示信号强度变化大于33%(附加文件4.)。在统计的CIS-EQTL中,分别在块茎和叶数据中仅为391和385个特征,导致CIS-EQTL和差分基因组杂交比(> 33%)。这些CIS-EQTL可能是假的EQTLS,因为观察到的信号强度的变化可能无法反映实际的表达差异。虽然考虑到马铃薯的SNP频率,潜在假EQTLS(4.7%)的百分比似乎很低,但由于几个因素,实际百分比可能更高。首先,C×e群是回复的结果,产生父母系中存在的常见等位基因,并且对于这种常见的等位基因,当杂交的父母基因组DNA杂交时没有特异性。然而,在人口中,任何对常见等位基因(a)的独特特异性的寡核苷酸将在预期的1:2:1(aa:a - : - )比中分离,导致可以被解释为表达差异的差分信号。其次,在基因表达在群体的成员身上相对稳定的情况下,等位基因之间的杂交特异性可以导致鉴定基于基于基于基因组杂交信号的差异大得多的差异的EQTL。第三,基于编码序列设计了阵列的寡核苷酸,并且当这些寡核苷酸跨越内外剪接结时,可以阻碍与基因组DNA的杂交。使用高覆盖RNASEQ数据将绕过这些问题,因为SNP呼叫允许等位基因区分[48.],虽然读数将能够比较等位基因表达水平和EQTL的检测。
结论
在本文中,我们描述了世界上最重要的粮食作物之一的两种不同组织中表达QTLS(EQTLS)的鉴定;土豆。通过完成的马铃薯基因组序列,可以询问人群宽的差异基因表达,以区分CIS-和反式作用的EQTL。在两种组织中存在的重叠QTL主要是CIS作用,而对于组织特异性QTL,反动QTLS的百分比增加。在基因脱盐基因组学研究中筛选和取样策略的筛选材料的类型对遗传基因组学研究的产出产生了高影响力。已经在与照相和昼夜节奏控制相关的染色体10上识别有趣的监管网络。鉴定源或水槽组织独特的关键调节基因和网络不仅为我们提供了组织依赖性基因子官能化的洞察力,而且还将大大提高致病性多态性的鉴定,其基础是重要性状QTL的致病性多态性。
方法
植物材料
九十六个个人,包括亲本克隆,二倍体回交群体(C×E)的在该研究中使用。这个群体是从马铃薯之间的初始横衍生的克隆C(USW533.7)和E(77.2102.37)并详细描述在[32].块茎样品源自野外实验,在荷兰的正常马铃薯生长季节(4月至9月)期间生长在重复期间。从三种植物收集成熟的块茎,并且在研磨成细粉末之前机械地剥离并立即在液氮中冷冻并储存在-80℃。使用先前描述的热苯酚方法从96个样品中提取块茎总RNA [49.使用qiagen rneasy柱(qiagen)处理和纯化DNAsei。C×E群的块茎在温室中种植土壤填充的盆,并生长直至匍匐茎出现后,从两种重复中收集,但仍然生长幼叶,并立即在液氮中冷冻。使用翠鸟柔性系统和Magmax™-96总RNA隔离套件分离出叶RNA,根据制造商的说明和标记前进行DNASEI。
微阵列杂交和数据处理
根据制造商的协议,从2 μg纯化总RNA开始,使用低RNA输入线性扩增试剂盒,PLUS,双色(安捷伦技术),用Cy3和cy5染料标记所有块茎样品。按照与块茎样品相同的方法,用cy3染料标记叶片样品,但起始量为纯化总RNA 200 ng。按照安捷伦双色杂交方案进行杂交和洗涤,变化如下:将1 μg标记的Cy5和/或Cy3 cRNA作为杂交混合物的输入。幻灯片在安捷伦DNA微阵列扫描仪上扫描,数据提取使用特征提取软件包(v9.1.3.1),使用标准的双色协议。剔除一致低表达的基因,使用Genstat提供的分位数归一化程序(均数)对数据集进行独立归一化®11.1。随着块茎样品被测量两次,只有在CY3和CY5数据集之间的94个个体上仅具有高于0.8的Pearson相关系数的基因,导致19,956个特征。为了计算块茎的基因组分布,使用Cy3数据。所有原始和标准化的数据文件都可以作为其他文件使用5.那6.那7.那8.那9.那10.那11.那12.那13.,&14.包括注释和基因组映射信息。叶片和块茎样品的所有归一化表达数据已经沉积在ArrrayExpress(E-MTAB-808,E-MTAB-701)中。
基因组DNA杂交分别标记800从父母双方(C和E)在杜普洛基因组DNA的纳克后进行,使用BioPrime®标记试剂盒(Invitrogen公司)与经修饰的dNTP混合物并在37℃温育16小时(的dATP,的dGTP,dTTP的,0,6毫dCTP和5微升的dCTP-Cy3的或的dCTP-Cy5的安捷伦技术的1.2毫摩尔)。标记的样品使用的PureLink™PCR纯化系统(Invitrogen)进行纯化和片段化热量为导致片段范围从〜150到600bp的30分钟。1微克标记的样品(Cy3和Cy5)的在65°杂交在使用独立标记的样品标准SWOP-染料实验17小时。幻灯片的洗涤和扫描被作为用于基因表达的实验中所述进行。特征归一化和比例计算均使用安捷伦特征提取软件包(v9.1.3.1)可用的默认方法。特征表示父母双方之间是一致的差异表达(> 33%)在附加文件呈现4.。
遗传图谱和联动,以马铃薯基因组
所有QTL研究使用的遗传图谱均使用作图软件Joinmap 4.0生成®[50.是较早的C × E基因图谱的改良版[51.],包括所有基于序列的SNP标记。在Cy3和Cy5杂交信号都可以明确地评分为现在或不存在的情况下,从块茎表达数据集中获得另外的标记。源自块茎表达数据的标记名称具有POCI作为前缀。地图中存在的基于序列的基于序列的标记与EST Contigs或EST Singlerons连接,并将这些序列撞击马铃薯基因组支架(V3.4)。具有独特和重要的基因组脚手架击中(> 90%同源性)的隔离标记可以随后与物理基因组图连接(附加文件15.)。验证C×E生成的遗传图谱对准从PGSC网站可获得的支架/伪分子的序列基的基于序列的标记对齐[25].马铃薯低聚(60聚体)的微阵列(POCI)在实验中使用,包含基于马铃薯单基因组42034个特征[46.].为了允许CIS和Trans-EQTLS之间的歧视,所有unigenes均针对基因组支架序列喷射,预测的编码序列(CDS)和预测的基因区(包括5'和3'-UTR)。具有独特而显着的命中的功能被分配到大多数具有染色体信息的基因组脚手架[25]结果是在附加文件中呈现16.。在物理图谱位置相同的连锁组上已识别的qtl定义为顺式作用qtl,而在不同连锁组上的qtl定义为反式作用qtl。对于没有物理图谱位置可以被分配在阵列上的特征被分类为未知。
QTL分析
我们使用了R / QTL封装的主模块,并优化了在折叠斑块的高吞吐量QTL映射,如马铃薯。r-script在自动将JoinMap分离分数转换为R / QTL分数之前检查缺失值的比率,之后执行QTL映射[52.].本研究中使用的基因型评分和遗传图谱顺序可在附加文件中获得15.和17.。该程序依赖于QTL映射的R / QTL,其中从摘要中提取QTL信息.Scanone方法,并且使用该QTL计算QTL的解释方差makeqtl.和fitqtl功能。采用LOD间隔法计算QTL间隔。默认分析使用Haley-Knott回归执行QTL映射,映射步长为5 cM。确定qtl的LOD阈值采用Li & Ji算法计算[53.].模拟次数重复以执行SIM.Geno函数默认为16,N.Draws参数允许进一步调整。对于块茎和叶片表达数据,数据使用LOD间隔方法运行QTL分析,其中默认步骤尺寸和显着性LOD阈值为4.35。
基因本体和eqtl可视化
之前已经描述了所有马铃薯微阵列特征的基因本体(GO)分配(Kloosterman et al. 2008)。通过安捷伦E-array发布的设计(https://earray.chem.agilent.com/earray/)。每个GO组计算具有EQTLS(CIS或Trans)的数组特征的数量,并且列出了总计。要减少类的数量,则在某些情况下,针对相同的代谢路线的GO标识符已合并(表2)。POCI微阵列的GO分类先前已链接到表达数据可视化工具MAPMAN(Kloosterman等,2008)。Mapman是一个用户驱动的工具,通常将大型数据集(例如基因表达数据阵列)显示到代谢途径或其他过程的图表上(http://mapman.gabipd.org/web/guest/mapman.)。而不是可视化基因表达数据,我们显示存在组织特异性EQTL的存在(在叶片=蓝框中存在的EQTL; eqtl存在于tuber =红色框中)。以这种方式,可以针对每个预先设计的代谢途径获得快速概述,并且可以鉴定基因的基因在分离群体内差异表达(图3.)。可以为每个盒子运行MapMan软件(可公开获得的)时获得的基因名称和功能的附加信息。
缩写
- SNP:
-
单核苷酸多态性
- QTL:
-
定量特质基因座
- LOD:
-
概率的对数
参考资料
- 1。
Jansen RC,NAP JP:基因酸基因组学:来自偏析的附加值。趋势类型。2001,17(7):388-391。10.1016 / s0168-9525(01)02310-1。
- 2.
West Ma,Kim K,Kliebenstein Dj,van Leeuwen H,Michelmore RW,Doerge RW,St Clair DA:全球EQTL映射显示了拟南芥转录级变异的复杂遗传架构。遗传学。2007,175(3):1441-1450。
- 3.
Potokina E,Druka A,Luo Z,Wise R,Waugh R,Kearsey M:16 000麦基基因的基因表达定量性状轨迹分析显示了一种复杂的基因组转录调控模式。工厂J. 2008,53(1):90-101。10.1111 / J.1365-313x.2007.03315.x。
- 4。
Keurentjes JJ,傅Ĵ,特普斯特拉IR,加西亚JM,范登Ackerveken G,斯诺克LB,Peeters的AJ,Vreugdenhil d,Koornneef男,詹森RC:监管网络建设在拟南芥中,通过使用基因组范围的基因表达数量性状基因座。Proc Natl Acad Sci USA。2007年,104(5):1708至1713年。10.1073 / pnas.0610429104。
- 5。
DROST DR,Benedict CI,Berg A,Novaes e,Novaes Cr,Yu Q,Dervinis C,Maia JM,Yap J,Miles B等:杨树器官分化中基因表达和转录网络的多样化。Proc Natl Acad Sci USA。2010,107(18):8492-8497。10.1073 / PNAS.0914709107。
- 6。
乔丹MC,Somers DJ,银行TW:通过映射表达定量特征基因座来识别小麦基因组控制种子发展的区域。植物Biotechnol J. 2007,5(3):442-453。10.1111 / J.1467-7652.2007.00253.x。
- 7。
Kirst M,Basten CJ,Myburg AA,Zeng Zb,Sederoff Rr:分化桉树杂交种的Xylem的转录级变异的遗传建筑。遗传学。2005,169(4):2295-2303。10.1534 / genetics.104.039198。
- 8。
黛内克,Lall S,Nettleton D,Howell Sh:拟南芥拍摄发育过程中基因表达的遗传调节。遗传学。2006,172(2):1155-1164。
- 9。
傅J,Swertz Ma,Keurentjes JJ,Jansen RC:Metanetwork:代谢网络遗传研究的计算协议。NAT PROTOC。2007,2(3):685-694。10.1038 / nprot.2007.96。
- 10。
Keurentjes JJ:遗传性代谢组学:依赖于表型。CurrOp植物BIOL。2009,12(2):223-230。10.1016 / J.PBI.2008.12.003。
- 11.
Morreel K,Goeminne G,Storme V,Sterck L,Ralph J,Coppieters W,Breyne P,Steenackers M,Georges M,Messens E等人:杨树中黄酮类化合物生物合成的势态代谢组学。工厂J.2006,47(2):224-237。10.1111 / J.1365-313x.2006.02786.x。
- 12.
Acharjee A,Kloosterman B,De Vos Rch,Werij JS,Bachem CWB,Visser RGF,Maliepaard C:使用马铃薯随机森林回归的〜OMICS数据进行数据集成和网络重建。分析性Chimica Acta。纠正证明。
- 13.
Breitling R,Li Y,Tesson BM,Fu J,Wu C,Wiltshire T,Gerrits A,Bystrykh Lv,De Haan G,Su Ai,等:基因试验基因组:QTL热点的聚光灯。Plos Genet。2008,4(10):E1000232-10.1371 / journal.pgen.1000232。
- 14.
Terpstra IR,Snoek LB,Keurentjes JJ,Peeters AJ,Van Den Ackerveken G:通过基因组织学的监管网络识别:拟南芥受体样激酶勃起下游的信号传导。植物理性。2010,154(3):1067-1078。10.1104 / pp.110.159996。
- 15.
Wu C, Delano DL, Mitro N, Su SV, Janes J, McClurg P, Batalov S, Welch GL, Zhang J, Orth AP, et al: eQTL数据中的基因集富集识别新的注释和通路调节因子。acta physica sinica, 2008, 32(5): 693 - 698。
- 16。
Kliebenstein DJ,West Ma,Van Leeuwen H,扬声器O,Doerge RW,St Clair DA:控制基因表达网络的QTLS定义了QTLS。BMC生物信息学。2006,7:308-10.1186 / 1471-2105-7-308。
- 17。
Druka A,Druka I,Centeno AG,李H,Sun Z,Thomas Wt,Bonar N,Steffenson BJ,Ullrich Se,Kleinhofs A等:朝着大麦的系统遗传分析:将表型,表达和基因型数据的整合到基因作业中。BMC Genet。2008,9:73-
- 18。
Kliebenstein D:定量基因组学:使用全局基因表达多态性或EQTL分析内部变异。Annu Rev植物Biol。2009,60:93-114。10.1146 / annurev.arplant.043008.092114
- 19。
GERRITS A,LI Y,TESSON BM,BYSTRYKH LV,Weersing E,Ausema A,Dontje B,Wang X,Breitling R,Jansen RC等:表达定量性状基因座对细胞分化状态非常敏感。Plos Genet。2009,5(10):E1000692-10.1371 / journal.pgen.1000692。
- 20。
Potokina E,Druka A,罗Z,莫斯科男,明智的R,沃R,Kearsey L:组织依赖性有限多效性影响大麦基因的表达。植物杂志2008,56(2):287-296。10.1111 / j.1365-313X.2008.03601.x。
- 21。
Sergeeva Li,Vonk J,Keurentjes JJ,Van der Plas LH,Koornneef M,Vreugenhil D:组织化学分析显示了拟南芥中酶活性的器官特异性定量性状基因座。植物理性。2004,134(1):237-245。10.1104 / pp.103.027615。
- 22。
Zahn LM,Leebens-Mack JH,Arrington JM,Hu Y,Landerr Ll,De Pamphilis CW,Becker A,Theissen G,Ma H:疯狂箱基因的敌对亚家族中的保护和分歧:独立的子和内功能化证据事件。evol dev。2006,8(1):30-45。10.1111 / J.1525-142X.2006.05073.x。
- 23。
林奇M,强制答:子官能化重复基因保存的概率。遗传学。2000,154(1):459-473。
- 24。
Li L,Paulo MJ,Strahwald J,Lubeck J,Hofferbert HR,Tacke E,Junghans H,Wouds J,Draffehn A,Van Eeuwijk F等人:候选基因座的天然DNA变异与土豆芯片颜色,块茎淀粉含量有关,产量和淀粉产量。Al Appl Genet。2008,116(8):1167-1181。10.1007 / s00122-008-0746-y。
- 25.
徐X,Pan S,Cheng S,Zhang B,Mu D,Ni P,张G,阳S,Li R,Wang J等:块茎作物马铃薯的基因组序列和分析。自然。2011,475(7355):189-195。10.1038 / Nature10158。
- 26.
Keiner R,Kaiser H,Nakajima K,Hashimoto T,Drager B:Tropinone还原酶II的分子克隆,表达和表征,Solanum Tuberosum(L.)中SDR家族的酶。植物mol biol。2002,48(3):299-308。10.1023 /答:1013315110746。
- 27。
Wang P, Dawson JA, Keller MP, Yandell BS, Thornberry NA, Zhang BB, Wang IM, Schadt EE, Attie AD, Kendziorski:一种表达数量性状位点(eQTL)定位的模型选择方法。中国生物医学工程学报。2011,27(2):362 - 368。10.1534 / genetics.110.122796。
- 28。
Greieve IC,Dickens NJ,Pravenec M,Kren V,Hubner N,Cook Sa,Aitman Tj,Petretto E,Mangion J:多种组织中的基因组共表达分析。Plos一个。2008,3(12):E4033-10.1371 / journal.pone.0004033。
- 29。
Hughes Ka,Ayroles JF,Reedy MM,Drnevich JM,Rowe KC,Ruedi EA,Caceres Ce,Paige KN:转录组中的分离变异:CIS调节和效果的增加。遗传学。2006,173(3):1347-1355。10.1534 / genetics.105.051474。
- 30.
BREM RB,Kruglyak L:酵母中5,700个基因表达性状的遗传复杂性景观。Proc Natl Acad Sci USA。2005,102(5):1572-1577。10.1073 / pnas.0408709102。
- 31。
Petretto E,Mangion J,Dickens NJ,Cook SA,Kumaran Mk,Lu H,Fischer J,Maatz H,Kren V,Pravenec M等:表达量化性状的遗传学和组织特异性。Plos Genet。2006,2(10):E172-10.1371 / journal.pgen.0020172。
- 32。
切利什-Gamboa的C,Struik PC,雅各布森E,维瑟RGF:的块茎的形成和相关过程中马铃薯的交叉人口时空动力学(马铃薯)。安申请生物学。2003年,143(2):175-186。10.1111 / j.1744-7348.2003.tb00284.x。
- 33。
爱德华兹EJ,圣RE,科布AH:是否有在马铃薯(茄tuberosumL)块茎绿化和光增强配糖生物碱的积累之间的链路?Ĵ科学食品农业机器。1998年,76(3):327-333。10.1002 /(SICI)1097-0010(199803)76:3 <327 :: AID-JSFA934> 3.0.CO; 2-G。
- 34。
Griffiths DW,Dale MFB,Bain H:品种,成熟度和储存对马铃薯总糖碱和叶绿素含量的光诱导变化的影响(Solanum Tuberosum)。植物科学。1994,98(1):103-109。10.1016 / 0168-9452(94)90153-8。
- 35。
Percival GC:胶质纤维素和叶绿素积聚对马铃薯块茎(Solanum Tuberosum L.)的影响。植物科学。1999,145(2):99-107。10.1016 / S0168-9452(99)00081-3。
- 36。
单子叶植物和双子叶植物共同祖先的现代昼夜节律钟。BMC Biol. 2010, 8: 55-10.1186/1741-7007-8-55。
- 37.
Schaffer R,Ramsay N,Samach A,Corden S,Putterill J,Carre Ia,偶联G:拟南芥的晚细长胚轴突变破坏了昼夜节律和开花的光周期控制。细胞。1998,93(7):1219-1229。10.1016 / s0092-8674(00)81465-8。
- 38.
Nakamichi N,Kiba T,Henriques R,Mizuno T,Chua NH,Sakakibara H:伪响应调节器9,7和5是拟南芥昼夜节奏中的转录压缩机。植物细胞。2010年,22(3):594-605。10.1105 / TPC.109.072892。
- 39。
Nakamichi N,Kita M,Ito S,Yamashino T,Mizuno T:伪响应稳压器,PRR9,PRR7和PRR5,靠近拟南芥昼夜昼夜临近的基本角色。植物细胞生理。2005,46(5):686-698。10.1093 / PCP / PCI086。
- 40.
imaizumi t:rapidopsis昼夜钟表和光周期:时间思考地点。CurrOp植物BIOL。2010,13(1):83-89。10.1016 / J.PBI.2009.09.007。
- 41.
Martinez-Garcia JF,Virgos-Soler A,PRAT S:通过拟南芥开花时间基因致癌控制马铃薯的光周期调节结节。Proc Natl Acad Sci USA。2002,99(23):15211-15216。10.1073 / pnas.222390599。
- 42。
Navarro C,Abelenda Ja,Cruz-Oro E,Cuellar Ca,Tamaki S,Silva J,Shimamoto K,PRAT S:通过开花基因座T.自然控制马铃薯的开花和储存器官形成。2011,478(7367):119-122。10.1038 / Nature10431。
- 43。
王ZY,托宾em:昼夜节律相关1(CCA1)基因的组成型表达扰乱了昼夜节律并抑制了自己的表达。细胞。1998,93(7):1207-1217。10.1016 / s0092-8674(00)81464-6。
- 44。
Sawa M,Nusinow Da,Kay Sa,Imaizumi T:FKF1和Gigantea复杂的形成是拟南芥中的日期测量所必需的。科学。2007,318(5848):261-265。10.1126 / Science.1146994。
- 45。
Simko I,Haynes Kg,Jones RW:用单核苷酸多态性标记的马铃薯基因组的联动不平衡评估。遗传学。2006,173(4):2237-2245。10.1534 / genetics.106.060905。
- 46。
Kloosterman B,德Koeyer d,格里菲思R,弗林B,Steuernagel B,肖尔茨U,Sonnewald S,Sonnewald U,布赖恩GJ,普拉特S,等:基因驱动马铃薯块茎的萌生和扩展:识别基于使用POCI转录变化阵列。本功能基因组学INTEGR。2008年,8(4):329-340。10.1007 / s10142-008-0083-X。
- 47。
Hughes Tr,Mao M,Jones Ar,Burchard J,Marton Mj,Shannon Kw,Lefkowitz SM,Ziman M,Schester JM,Meyer Mr,Et Al:使用喷墨寡核苷酸合成器制造的微阵列表达分析。NAT BIOTECHNOL。2001,19(4):342-347。10.1038 / 86730。
- 48。
Turro E, Su SY, Goncalves A, Coin LJ, Richardson S, Lewin A:利用多映射RNA-seq reads估计单倍型和亚型特异性表达。中国生物医学工程学报。2011,12 (2):R13-10.1186/gb-2011-12-2-r13。
- 49.
Bachem CW,Van der Hoeven Rs,De Bruijn Sm,Vreugenhil D,Zabeau M,Visser RG:使用基于AFLP的RNA指纹识别的新方法可视化差异基因表达:马铃薯块茎发育过程中基因表达的分析。工厂J.996,9(5):745-753。10.1046 / J.1365-313x.1996.9050745.x。
- 50.
范Ooijen JW:JoinMap®4,实验群体遗传联系地图计算软件。Wageningen:Kyazma B.V.2006。
- 51.
Anithakumari AM,汤Ĵ,面包车埃克HJ,维瑟RG,Leunissen JA,Vosman B,林登CG:一种用于高通量检测和从EST数据库SNP的映射管道。mol品种。2010年,26(1):65-75。10.1007 / s11032-009-9377-5。
- 52.
Broman KW,Wu H,Sen S,Churchill Ga:R / QTL:实验交叉中的QTL映射。生物信息学。2003,19(7):889-890。10.1093 / Bioinformatics / BTG112。
- 53.
Li J,JI L:使用相关矩阵的特征值调整多层分析中的多重测试。遗传。2005,95(3):221-227。10.1038 / sj.hdy.6800717。
致谢
我们要感谢Robert Rap的帮助,他开发了用于马铃薯高通量qtl分析的R/qtl包。该研究由EU-SOL项目(PL 016214-2 EU-SOL)和生物系统基因组学中心(CBSG)的研究项目开展和资助,CBSG是荷兰基因组学计划/荷兰科学研究组织的一部分。
作者信息
隶属关系
通讯作者
额外的信息
作者的贡献
BK设计了块茎表达研究,进行了QTL分析,数据解释并写了稿件。AMA设计并进行了叶表达研究,并与MO一起进行杂交。PC优化了R / QTL程序并执行了QTL和统计分析。GL设计了叶子表达研究并帮助起草了手稿。RGFV和CWBB帮助设计了块茎表达实验并帮助草稿。所有作者均阅读并批准最终手稿。
电子补充材料
12870_2011_978_MOESM2_ESM.XLSX
附加文件2:属于主要碳水化合物代谢组的块茎和叶组织的组织特异性和组织依赖性等qtl。(XLSX 16 KB)
作者的原始提交的图像文件
权利和权限
开放获取本文在“生物资源”中央有限公司的许可下公布了这是一个开放式访问条款,分配根据创意公约归因许可证的条款(https://creativecommons.org/licenses/by/2.0.)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
Kloosterman, B., Anithakumari, A., Chibon, PY.。等等。器官特异性和对代谢途径的转录控制,揭示了源水槽组织在隔离马铃薯种群中的QTL分析。BMC植物BIOL.12,17(2012)。https://doi.org/10.1186/1471-2229-12-17
收到:
接受:
发表:
关键词
- 基因本体论
- 联动组
- 辣椒生物碱
- 代谢途径
- 马铃薯基因组