摘要
背景
虽然主要谷物作物的遗传转化已成为相对常规的,但迄今为止仅在转基因小教中公布了几份报告,并且在该物种中尚未提供关于T-DNA集成和偏析的强大数据。
结果
在这里,我们对稳定的转基因冬季小教徒CV进行了综合分析。博加携带选择标记基因潮霉素磷酸转移酶(哈)和合成绿色荧光蛋白基因(GFP).关于整合T-DNA拷贝的数量,植物基因组集成基因座的数量,单个T-DNA拷贝的完整性和功能以及T转基因的分离,全面研究了四种独立的转基因植物的后代。以及T中的转基因的偏析1和t.2这也使我们能够鉴定纯合子转基因株系。一些整合的t - dna在其左端被截断,同时多个t - dna发生独立分离,无意中产生了一个可选择的无标记纯合子的单拷贝分离体GFP.基因。遗传的表达GFP.受玉米带动UBI-1通过共聚焦激光扫描显微镜证明了启动子。
结论
二手变换方法是对小教物的基因工程的有价值的工具。在这里,我们表明,需要综合分子分析来正确地解释从转基因植物收集的表型数据。
背景
摘要为了将小麦的品质和产量与黑麦在边际环境中的优良表现相结合,培育出了人工小麦×黑麦二倍体小黑麦。自从早期杂交种的发展以来,通过常规方法已经取得了重大的育种进展。然而,全球小黑麦种植面积仍然很低,其大部分生产集中在中欧和东欧[1].鉴于该地区的普遍气候条件,> 90%的作物是由冬季(需求的)品种表示的。其主要终用用途是饲料或饲料,但其谷物铣削和面包质量的改善可以延长其在人类消费中的使用或作为工业原料。特别有吸引力的前景在于它作为生物能源的来源,但为植物产生必要的重大变化,允许这可能需要遗传修改。因此,需要为其遗传转化制定强大的协议。
Trindeee的基因工程仍处于初期阶段。DNA直接递送到原生质体中实现了瞬时转基因表达,但不稳定的整合[2那3.].从分离的原生质体中再生植物的困难促使探索更容易再生的外植体材料,其中未成熟的胚胎已被证明是最有前途的[4.-7.].最早报道的稳定的转基因小教植物依赖于未成熟胚甲基氏菌的生物理处理[8.].靶向单倍体胚状结构的类似方法仅导致转基因的瞬时表达,并且没有再生成年植物[9.].第一个适用方法是由Doshi等人发表的。(2007年)使用胚胎特异性的人LTP1.推动者表现出效果C1.和Bperu玉米基因对小教徒的花青素生物合成[10].
农杆菌属介导的基因转移已被证明是转化每个主要谷物种类的有效手段,包括小麦物种[11-13].然而,对于后者,目前没有提供关于T-DNA集成和分离的强大数据。使用通过先前公布的协议产生的植物[13[我们在这里提供关于T-DNA集成,拷贝数,完整性和继承方面的转基因小教徒的全面信息。此外,我们提供了两代转基因表达的证据。
结果
原发性转基因植物
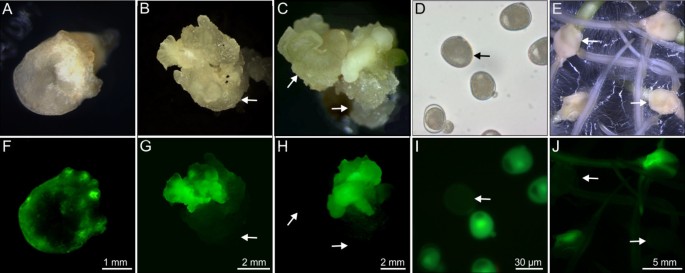
我们在前一篇文章中报道的原发性转基因小教植物提出了几种小谷物谷物的协议[13在本研究中进行了综合分析。在这方面,我们还提供有关先前发布的转型协议的一些互补信息。如表所示 1,两年或五天的预培养(在接触之前根癌农杆菌)来获得转基因植物。此外,接种农杆菌属证明成功提供未成熟的胚胎在用液体共培养介质润湿的滤纸上堆叠,而不是在培养基中浸没。表格 1进一步表明,大麦共培养(BCCM)能获得转基因植株,而小麦共培养(WCCM)在相同条件下不能产生转基因植株。类似地,一种毒性极强的衍生物根癌农杆菌菌株LBA4404导致转基因再生剂的递送,而AgL-1则令人惊讶地在测试的条件下没有这样做。表达GFP.在整个转换过程中被监视(图1A-J)的。共培养与三天根癌农杆菌,在未成熟胚胎的垫子的边缘处可见荧光灶。在进一步的3-6周后,GFP积累在愈伤组织的快速生长部分中特别强烈(图 1F-H),而新兴叶片和根部显示出较低强度的荧光。通过基于PCR的扩增证实的转基因再生剂GFP.片段没有表现出与transgenicity相关的任何明显的形态效果。
集成T-DNA的数量,完整性和生成传输
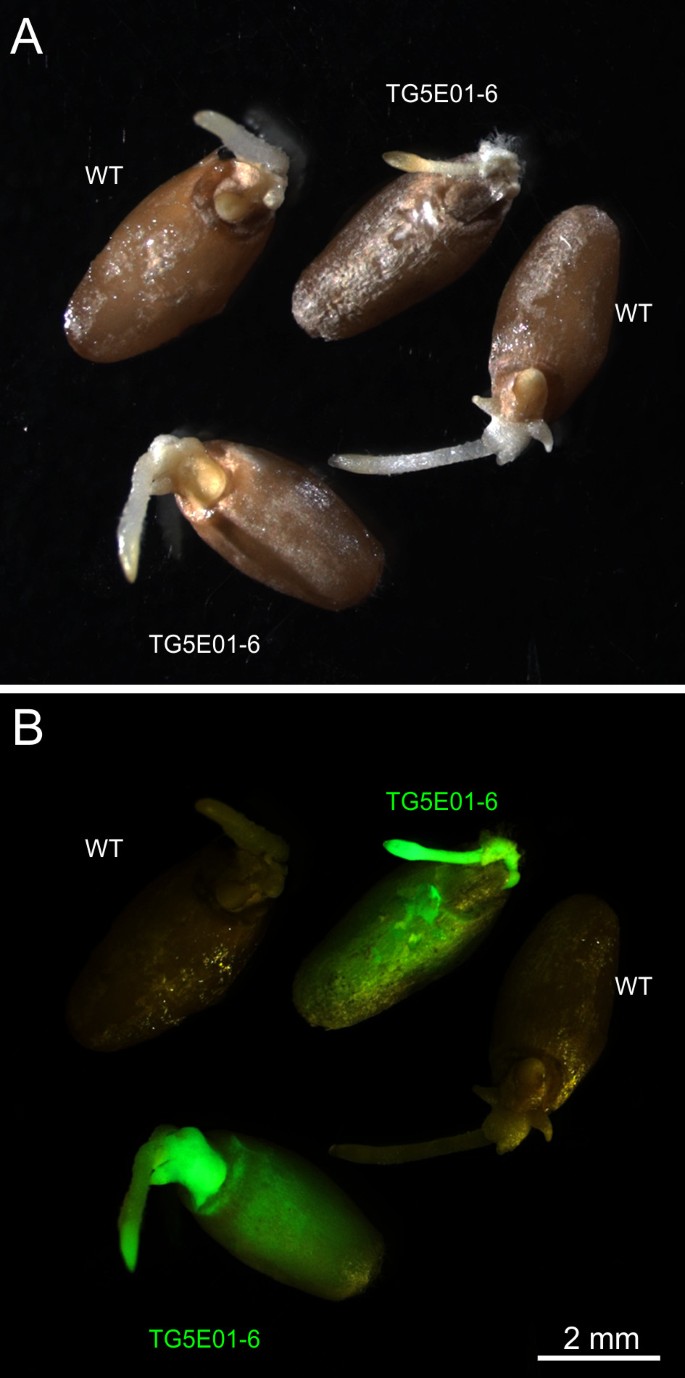
由四个代转基因植物的花粉产生偏析相对于GFP.表达(图 1i)。当由原发性转基因植物形成的胚胎在含湿霉素的培养基上发芽时,GFP.表达强的盾片和新兴的根都与在根尖的特别高的电平(图 1J)选择性培养基转基因携带者和非携带者之间的区别,前者发育正常,后者不再能够胚芽鞘之后出现增长,并不能合成叶绿素(图 2).观察到的偏析比在四个患者中的三种情况下存在于存在单个T-DNA插入基因座中的三种情况下,而原发性转基因TG5E03的后代包括显着较少的转基因载体,而是从单一的分离中预期的转基因载体(表 2).
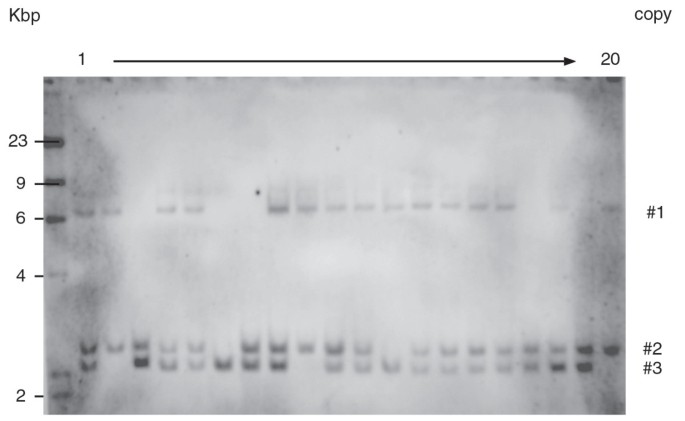
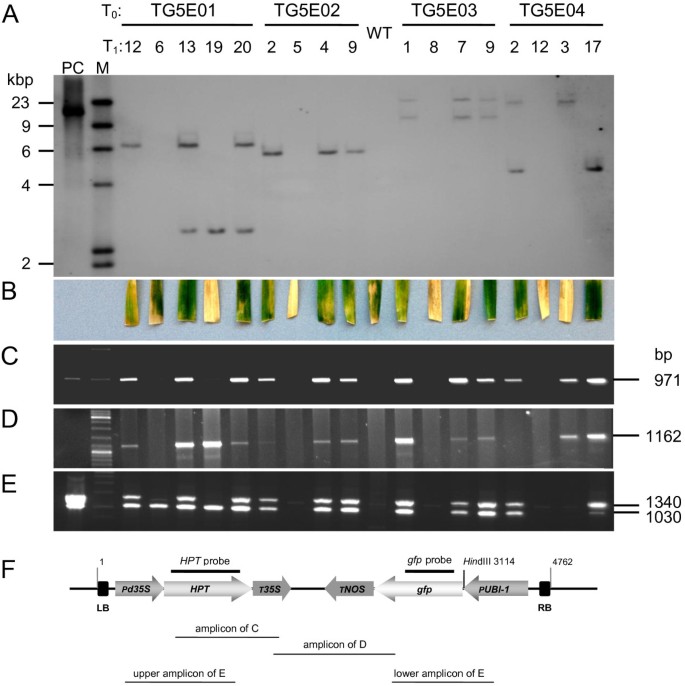
为了全面分析获得的独立转基因事件,T1对兄弟姐妹进行DNA凝胶印迹分析哈和GFP.探针为了表征集成站点。当GFP.- 将TG5E01的后代的预防作为图中的示例 3..当哈图中所示的配置文件 4.A所示,存在于TG5E01,TG5E02,TG5E03和TG5E04 T-DNA拷贝的数目是分别,两个,一个,两个和两个,而GFP.探测还在TG5E01中突出显示第三份(图 3.).分析还显示,TG5E01中存在的所有三个T-DNA拷贝和TG5E04中的两份拷贝彼此独立地隔离,而TG5E03共同中的两份拷贝(图 3.和4.a)。完整的T-DNA的大小为4762 bp。在完全T-DNA的情况下,使用基因组DNA的消化使用hdIII预计会导致杂交片段大于3114bp(图4.F),除了TG5E01的后代之外,在所有植物中都能看到,其中携带拷贝#2和#3的两个片段更小。
转基因事件分析。(A.)DNA从集T的提取1对每个事件的植物进行DNA凝胶印迹,并用DIG标记的片段进行探针HPT。请注意,TG5E01的#3如图所示和在图中所示 3.没有被强调哈这里使用的探针。(B.)转移到含州霉素的培养基后10天分离出叶脱霉素测定。(C.)扩增哈编码区和Camv 35s.终结者。(D.)扩增GFP.编码区和Camv 35s.终结者。(E.)复式PCR靶向Camv 35s.和UBI-1启动子,以及哈和GFP.编码序列。(F.基于T-DNA的转化盒。左边界,P35个年代- 启动子Camv 35s.启动子,哈-潮霉素磷酸转移酶基因,T.35个年代- 终结者Camv 35s.编码序列。T.n- 终结者胭脂氨酸合成酶基因,GFP.- 合成绿色荧光蛋白基因(S65T), PUBI-int- 玉米UBI-1具有第一个内含子,RB的启动子 - 右边界。T-DNA的全长,相对位置hDIII限制性位点以及A中使用的探针的位置(哈探针)和图 3.(GFP.探针)以及所示的扩增子C.那D.和E.表示。
在TG5E02和TG5E03转基因的衍生结构通过基于引物对跨越两种转基因的不同部分的PCR分析证实(图 4.C-F);但是,对于TG5E01,T的PCR分析1植物6只携带T-DNA拷贝#3(见图 3.,植物巷建议哈表达盒是缺席(图 4.C,D,E,植物6)。同样,T-DNA拷贝#2存在于TG5E01 T中1植物19除了复制#3之外,没有显示图中的放大器 4.C和上E也一样,表明它也被截断了哈卡带.在TG5E04中发现了不完全T-DNA的另一个例子,其中单一的单拷贝存在于T中1植物3被截断了哈PCR分析显示表达盒(图4.E,上层乐队)。此外,图中也缺少了较低的波段4.E表明启动子中的另一种删除 -GFP.结,而DNA凝胶印迹分析表明存在两种情况哈和GFP.该植物中的序列,内部哈和GFP.序列均成功扩增。
The The Transgene表达1和t.2一代
当T.1植物叶片患有潮霉素的挑战,那些携带功能副本的人哈保持绿色,而那些缺乏转基因或功能的版本成为漂白(图 4.b)。在所有情况下,测试结果同意从PCR和/或DNA凝胶印迹测定中汲取的结论(图 4.a e)。注意非转换控件的中间反应(图4.B),这表明该分析本身不足以诊断a的合并哈转基因。
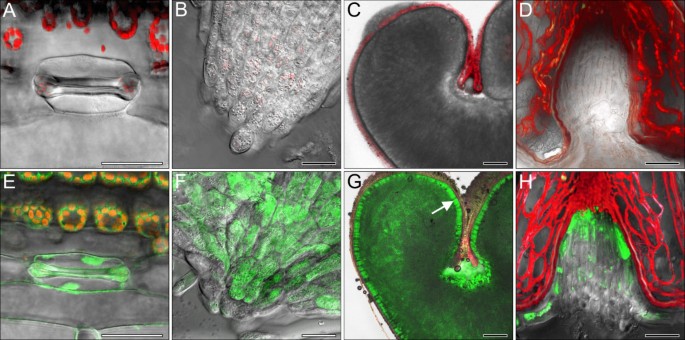
携带单拷贝转基因的植物的根,叶和成熟Caryopsis中可检测到GFP(TG5E02)(图 5.A-H)。特别地,GFP信号大部分限制在细胞溶胶上。水平GFP.在细胞类型之间表达变化很大。在叶中,它在扁氯中和气孔保护细胞中是最高的(图 5.a,e)。在成熟的Caryopsis中,最强烈的信号存在于阿仑酮层中(图 5.c,g)和nucellar投影(图 5.d,h)。
十二吨2来自避免的群体和控制后代1偏析是为表达测试GFP.在根尖(表 3.).正如预期的那样,一些家庭的分离(TG5E01-12,TG5E03-1,TG5E03-7和TG5E04-2),但它是可以识别五个非隔离(大概是转基因纯合子)的植物。A.ll TG5E01-6 T2个人累积了GFP(表 3.,图 6.)虽然它们仅含有截短的T-DNA片段(对于DNA凝胶污染表明 3.plant lane 6, T-DNA截断见图4.C-F)。在这种情况下,T-DNA截短与多个T-DNA的独立偏析无意中导致可选择的标记物分离物,其具有关于纯合的GFP.基因。B.y contrast, none of the TG5E04-3 T2个人测试的表达GFP,从而确认缺失的pcr片段GFP.从相应的表达式磁带1工厂如图所示4.E(较低频段)。鉴于叶潮霉素测试在T结果和失踪PCR片段1植物TG5E04-3(图 4.B,E和F),得出的结论是,存在于该植物中的转基因拷贝包含非功能性序列相对于两个转基因。所有与T-DNA拷贝的完整性,功能性和偏析数据总结在表 4..关于兴趣基因(GFP.),八个独立转基因副本中的五个证明功能,而由于其他T-DNA的存在,两种进一步拷贝的假定功能无法明确显示。在所有这些情况下,观察到的表型可以通过植物的基因型数据来解释。
讨论
我们的初步目的是为冬季小教徒的稳定遗传转化制定强大的协议。采取的方法严重依赖于为其家长,小麦和黑麦制定的转型协议。未成熟胚胎共同栽培的扫抚性根癌农杆菌试验液体培养物,因为这提供了大麦中加工未成熟胚的有效手段[14],同样的方法对黑麦也有效[15].然而,遗憾的是,在小麦(未发表的数据)中似乎并不好,其中似乎似乎似乎改善了转化效率[16].在实践中,在这方面表现出小麦的小麦,因为当在用共培养培养基浸泡的滤纸上共同培养未成熟的胚胎时,仅获得转化(表 1).以春季小黑麦品种‘Wanad’为研究对象的一项类似研究,比较了这三个可选择标记基因的有效性酒吧那哈和NPTII.由玉米之一推动UBI-1花椰菜花叶病毒35个年代或A. Tumefaciens No.推动者分别[12]并得出结论,最好的组合是nos :: nptii,尽管n在单圈宿主中表现不佳[17].在本研究中,哈可选择的标记基因是首选的,该基因也被证明是有用的,例如在大麦[18那19]小麦和玉米[13].当GFP.报告基因是监测转基因及其后续表达的有效工具(图)1f j) [13那20.].
三个多重T-DNA插入事件中有两个涉及独立的整合位点。在大麦中,>50%的农业侵染诱导的多重转基因事件只涉及一个整合位点[21].对转型成果进行了更全面的分析拟南芥蒂利亚纳在这种情况下,整合在一个位点上的T-DNA拷贝的数量似乎不仅取决于个体的身份根癌农杆菌菌株和外植体,还对转化方法以及提供T-DNA的载体的复制起源[22].多个T-DNA拷贝被整合到小黑麦独立基因组位点的转化事件的发生,为产生拷贝数减少的转基因分离体提供了机会。此外,使用两种不同的T- dna共同引入效应基因和可选择的标记基因,可以在T- dna中独立分离位点后产生可选择的无标记转基因1.虽然在本研究中意外发生类似的情况(TG5E01 T.1设备6),采用大麦定向的方法最近已通过Kapusi等人提出。[23].虽然农杆菌属-介导转化通常导致截短转基因整合的频率低于生物转移,多达44%的初级小麦转基因已被证明携带不完整的t - dna [24]许多涉及左t-dna边界的截断[25].与此同时,在大麦中,仅有3%(在分析的260个初级转基因中)保留了完整的T-DNA [26].可以预期T-DNA的截断导致转基因函数的损失,因此本实验中的实际情况是在分析的37.5%的37.5%的37.5%的实验中,突出的情况。
T中的转基因的非孟德梅分离1后代是一种常见的观察,有几个假设被促进解释这种现象,例如T0.逆转,多种独立档案插入基因座和多种转基因拷贝或DNA重排诱导的转基因沉默[24那27-29].在某些情况下,由于非掺入的转基因盒的表达,可能会出现误报,包括持续存在的农杆菌属[30.].非孟德尔分离转基因已在小黑麦已经注意到[12,但由于该观察是基于组织化学报告基因分析,不包括任何DNA分析,其依据无法确定。在本研究中,TG5E03获得的转基因子代比预期的要少,这表明该植物在转基因方面是嵌合的。这一解释得到了DNA凝胶印迹、PCR和叶片分析的证实,表明所有功能元件至少存在于两个偶联的T-DNA拷贝中的一个(图)4.A-F)。尽管如此,其中一种副本可能产生了导致转录后基因沉默的异常mRNA。然而,在T中观察到的非孟德尔分离2预计衍生自TG5E03的家庭将仅通过一些兄弟姐妹中的转基因沉默来引起,因为倾斜度通常可以在几代之后在几代中排除0..
如使用共聚焦激光扫描显微镜监测,GFP.表达被广泛分布,但浓缩在细胞溶胶中(图 5.).这种定位反映了在转基因大麦和小麦中观察到的现象[31.],其中报告基因表达的在糊粉水平和胚乳比得上由任一大麦双功能驱动α淀粉酶/抑制剂枯草杆菌(isa.或者小麦早熟(新兴市场)启动子[31.那32.].
结论
本研究中使用的转化方法是对小教物的基因工程的有价值的工具。可靠的转化技术的可用性应鼓励当前功能基因组学技术,以小黑麦的应用,加快生物技术基础的方法来改进。在本研究中,我们表明,需要综合分子分析来正确解释从转基因植物收集的表型数据。
方法
植物材料
冬季小麦的谷物(X TriticoSecale.在光照时间为136 μmol s、光照周期为12 h、光照时间为14/12°C、昼夜条件下,对wittack (wittack)品种Bogo进行了发芽试验-1 m-2.在三周后,在8小时的光周期下在4℃下培养八周,再培养然后在玻璃盆中种植(18/16℃,16h Photopheriod,170μmols-1 m-2光子通量密度)。
选择A..农应变
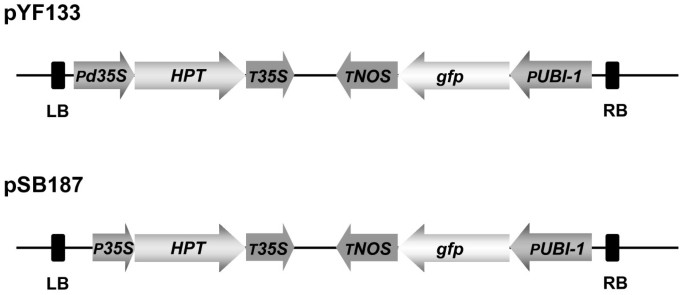
过度吞咽根癌农杆菌菌株AGL-1最初用于感染。ristrbors二元载体pyf133 [33.)提供CaMV d35S::一对作为可选标记基因,合成GFP.序列[34.由玉米驱动UBI-1推动者[35.]作为报告基因,以及Pcambia矢量骨干[36.](图 7.).T-DNA边界来自于一个能产生诺帕林的Ti质粒。后来的实验使用了菌株LBA4404的一种剧毒衍生物[37.],它竖起了二元矢量PSB187;这与选择以驱动的启动子中的PYF133不同哈(Camv 35s.)和源自PLH6000的载体骨干链[38.](图 7.).PYF133和PSB187都被引入根癌农杆菌通过电穿孔。
未成熟胚的分离及其预培养和共培养根癌农杆菌
授粉后12-16天采集未成熟颖果,用70%乙醇浸泡3分钟,再用5% w/v次氯酸钠、0.1% v/v Tween 20浸泡15分钟消毒,然后用无菌蒸馏水洗涤5次。未成熟的胚胎被切除,并在预培养培养基上将盾片一面朝上,如其他地方所述[13].冰冻的甘油储备根癌农杆菌(200 μL,从OD培养基中取样600将2.0悬浮在200μl15%v / v甘油中)将其接种成10ml抗生素的CPY培养基并在28℃下振荡培养过夜。在接种之前,将预培养的未成熟胚胎转移到液体共培养介质(BCCM)中[13],然后立即取代600μL根癌农杆菌文化。真空浸润(500毫巴1分钟)后,用BCCM洗涤未成熟的胚胎。当pre-cultured and inoculated immature embryos were then either stacked on filter paper disks moistened with 300 μL BCCM or WCCM or incubated in 2.5 mL of the same media. The co-cultivation of explants and农杆菌属在21°C黑暗条件下进行48-72小时,无搅拌。共50个未成熟胚胎被分成5组,每组10个胚胎。
组织培养
共培养后,将未成熟的胚胎转移到BCIM [13含150 mg·L-1时间蛋白杀死任何剩余的根癌农杆菌.在接下来的两周内形成的Calli转移到含有25mg L的BCIM-1潮霉素和150毫克L.-1前两周的时间蛋白再除去至K4N再生培养基[39.含25毫克L-1潮霉素和150毫克L.-1时间素。培养板暴露于136μmols-1 m-2光子磁通密度超过16小时光周期。将再生芽转移到含有相同培养基的玻璃管直至植物足够剧烈以浇灌成土壤。
DNA分析
根据制造商的说明,PCR模板包括使用DNAZOL(Invitrogen,Karlsruhe)的〜100mg Snap-Brozen叶中提取的基因组DNA。PCRS基于由表中列出的序列引发的100ng模板的扩增 5..通过琼脂糖凝胶电泳分离扩增子,并被溴化乙锭染色可视化(图 4.).对PCR测定进行阳性的植物进行DNA凝胶印迹分析,以表征整合位点和转基因拷贝数。至少25μg基因组DNA,如[40,被消化了h用琼脂糖凝胶电泳分离,并呈上杂交到杂交中。特异性探针(GFP.或哈)用DIG标记的所推荐的供应商(罗氏,曼海姆,德国)。
丙烯霉素抵抗的胚胎救援与分离分析
T.1授粉后21-28天采集颖果,将未成熟胚置于Gamborg 's B5培养基上孵育24 h [41.以诱导发芽。然后,他们被转移到K4N中[39.]添加100mg L-1潮霉素,在16小时光周期下在24℃下保持最多十天。
潮霉素叶形测定
哈分析了推定转基因植物的叶片段的表达[42.],将叶片划分为MS培养基[43.]含有200 mg l-1湿霉素和0.05% v/v吐温20。平板于24°C、16 h光周期下孵育7-10天。
微观分析
在开花前收获小花,花粉晶粒释放到0.4米甘露醇中。表达GFP.使用配备有38HE滤波器集合(蔡司,蔡司,德国)的的Axiovert 200M荧光显微镜进行分析。Leaf, root and mature grain samples were analyzed with a LSM 510 META confocal laser scanning microscope (Zeiss, Jena, Germany) using a 488 nm laser line for excitation. GFP signals were detected with a 505–530 nm band pass filter. Autofluorescence was recorded with a 650 nm long-pass filter.
参考文献
- 1.
联合国的粮食和农业组织。http://faostat.fao.org/site/567/desktopdefault.aspx?pageid=567##Ack..
- 2.
Stolarz A,Lörzh:原生质体培养和Trindee(x TriticoSecale Wittmack)的转化研究。植物细胞组织兽人崇拜。1988,12:227-230。10.1007 / BF00040092。
- 3.
Zimny J,Rafalski A:对小教物原生质体的转型研究。公牛植物植物品种烤肉。1993年,197:127-132。
- 4。
Immonen AST:小黑麦(x triticcosecale wittack)胚胎体细胞胚胎发生的氨基酸培养基。通讯通讯,1993,21:51-55。
- 5。
Ainsley PJ,Aryan AP:高效植物再生系统,用于小黑麦未成熟胚胎(X TriticoSecale Wittmack)。植物生长调节。1998年,24:23-30。10.1023 /答:1005980410397。
- 6。
小黑麦幼胚和成熟胚体细胞胚胎发生及叶基部器官发生的比较研究。植物细胞组织器官的研究。2001,64:33-38。10.1023 /: 1010627630651。
- 7。
Birsin Ma,Ozgen M:来自小教徒不同胚胎外植体的愈伤组织诱导和植物再生的比较(X Tititicodale Wittmack)。细胞摩尔Biol Lett。2004,9:353-361。
- 8。
ZimnyĴ,贝克尔d,Brettschneider R,洛尔斯H:可育转基因小黑麦(X黑麦Wittmack)。mol品种。1995年,1:155-164。10.1007 / BF01249700。
- 9。
uidA基因的生物转移及其在小黑麦(x triticcosecale wittack)单倍体胚胎结构中的表达。植物营养与肥料学报。2004,29(4):429 - 434。
- 10.
Doshi Km,EUDES E,Laroche A,Gaudet D:在标记出免费转基因小麦和小麦胚胎中的花青素表达。体外细胞驱动Biol植物。2007,43:429-435。10.1007 / s11627-007-9089-7。
- 11.
卢比奥迪亚兹S:Transformación遗传学恩特里戈común(“小麦” L)Y小黑麦(“xTriticosecale” Wittmack)mediantebiolísticaY“农杆菌”。2005年,博士论文阿尔卡拉大学。阿雅德BIOLOGIA Celularÿ遗传学,http://dspace.uah.es/dspace/handle/10017/790?show=full..
- 12.
Nadolska-Orczyk A,Przetakiewicz A,Kopera K,Binka A,Orczyk W:农杆菌介导的Trinthege(X TriticoSecale Wittmack)的介导转化的高效方法。J工厂增长调节。2005,24:2-10。10.1007 / s00344-004-0046-y。
- 13。
Hensel G,Kastner C,Oleszczuk S,Riechen J,Kumlehn J:农杆菌介导的基因转移到谷物作物植物:大麦,小麦,小麦和玉米的当前方案。int j植物基因组学。2009,2009(第835608条):9.101155 / 2009/835608。
- 14。
Hensel G,Valkov V,Middlefell-Williams J,Kumlehn J:高效的转基因大麦的生成:调制植物微生物相互作用的前进方式。J植物理性。2008,165:71-82。10.1016 / J.Jplph.2007.06.015。
- 15.
Popelka JC,Altpeter F:土壤杆菌癌症介导的Rye介导的遗传转化(Secale Cereale L.)。mol品种。2003,11:203-211。10.1023 /答:1022876318276。
- 16。
琼斯高清:小麦转化:目前的技术和应用于粮食开发和组成。j麦片sci。2005,41:137-147。10.1016 / J.JCS.2004.08.009。
- 17。
FROMM M,TAYLOL LP,WALBOT V:通过电穿孔将基因的表达转移到单子叶和二孔植物细胞中。美国国家科学院学报。1985,82:5824-5828。10.1073 / pnas.82.17.5824。
- 18。
Matthews Pr,Wang MB,Waterhouse PM,Thornton S,Fieg SJ,Gubler F,Jacobsen JV:使用与邻近的邻近的土壤杆菌转化载体的共转化,从转基因大麦的标记基因消除。mol品种。2001,7:195-202。10.1023 /答:1011333321893。
- 19。
关键词:大麦,未成熟花粉来源,双单倍体,单倍体作为转基因重组工具的黄金承诺。植物学报。2005,27:591-599。10.1007 / s11738 - 005 - 0063 - x。
- 20。
陈志强,陈志强,陈志强,等。大麦幼胚与农杆菌共培养的遗传转化。世界转基因作物-基本协议。编辑:Curtis IS。2004, Dordrecht Kluwer, 35-43。http://www.springerlink.com/content/r562864662v571mk/.
- 21。
sthl R, Horvath H, Van Fleet J, Voetz M, von Wettstein D, Wolf N:从单盒和双盒载体进入大麦基因组的T-DNA整合。美国国家科学院学报。2002年,99:2146 - 2151。10.1073 / pnas.032645299。
- 22.
德巴克S,波德文N,NolfĴ,Jacobs的A,Depicker一个:拟南芥转化体的T-DNA整合模式由所述转化的靶细胞是高度确定。植物杂志2009年,60:134-145。10.1111 / j.1365-313X.2009.03942.x。
- 23.
Kapusi, Hensel G, Coronado MJ, Broeders S, Marthe C, Otto I, Kumlehn J:共转化大麦植株双单倍体后代中一个可选择标记基因的消除。植物杂志。在修订。
- 24.
程明,庞胜,周华,Hironaka CM, Duncan DR, Conner TW,万永:根癌农杆菌介导的小麦遗传转化。植物营养与肥料学报。1997,19(4):591 - 598。
- 25。
陈志强,陈志强,陈志强:农杆菌介导转基因小麦中T-DNA位点和载体主链序列的特征分析。昆虫学报。2006,18:195-208。10.1007 / s11032 - 006 - 9027 - 0。
- 26。
巴特利特JG,阿尔维斯SC,史沫特莱男,斯内普JW,哈伍德WA:高通量农杆菌介导的大麦转化。植物的方法。2008年,4:22 10.1186 / 1746-4811-4-22。
- 27。
Hiei Y,Ohta S,Komari T,Kumashiro T:由土壤杆菌介导的水稻(Oryza Sativa L.)的高效转化和T-DNA界限的序列分析。工厂J. 1994,6:271-282。10.1046 / J.1365-313x.1994.6020271.x。
- 28。
Ishida Y,Saito H,OHTA S,Hiei Y,Komari T,Kumashiro T:由Tumefaciens介导的玉米(Zea Mays L.)的高效转化。NAT BIOTECHNOL。1996年,14:745-750。10.1038 / NBT0696-745。
- 29。
张松,赵建军,赵建军,杨荣荣,李建军。利用萌发苗离体分生组织培养的燕麦(Avena sativa L.)和大麦(Hordeum vulgale L.)商品化品种的遗传转化。植物学报,1999,18:959-966。10.1007 / s002990050691。
- 30.
农杆菌和花粉途径对谷物转化的影响。植物学报,1992,2:631-638。10.1111 / j.1365 - 313 x.1992.00631.x。
- 31。
Furtado A,Henry RJ,Pellegrineschi A:转基因大麦和小麦的促进剂分析。植物Biotechnol J. 2009,7:240-253。10.1111 / J.1467-7652.2008.00394.x。
- 32。
Furtado A,Henry RJ:麦子EM启动子在转基因大麦和水稻的胚胎和阿仑酮组织中驾驶报告基因表达。植物Biotechnol J. 2005,3:421-434。10.1111 / J.1467-7652.2005.00135.x。
- 33。
方yd,Akula C,Altpeter F:农杆菌介导的大麦(Hordeum vulgare L.)使用绿色荧光蛋白转化为T-DNA ::大麦基因组DNA连接的视觉标记和序列分析。J植物理性。2002,159:1131-1138。10.1078 / 0176-1617-00707。
- 34.
Chiu Wl,Niwa Y,Zeng W,Hirano T,Kobayashi H,Sheen J:设计GFP作为植物的重要记者。Curr Biol。1996年,6:325-330。10.1016 / s0960-9822(02)00483-9。
- 35.
Christensen Ah,鹌鹑pH:泛素启动子基载体,用于单圈植物中可选择和/或筛选标记基因的高级表达。Transgen Res。1996年,5:213-218。10.1007 / BF01969712。
- 36.
柬埔寨:澳大利亚。http://www.cambia.org.au..
- 37。
Komari T,Hiei Y,Saito Y,Murai N,Kumashiro T:携带两种单独的T-DNA的载体,用于农杆菌突发术治疗术介导的高等植物的共转换和无转化体的偏离选择标记。工厂J. 1996,10:165-174。10.1046 / J.1365-313x.1996.10010165.x。
- 38。
豪斯曼L,特普费尔R:发展协会冯质粒-Vektoren。在:Vorträge献给Pflanzenzüchtung。1999年,45:153-171。
- 39。
Kumlehn J,Serazetdinova L,Hensel G,Becker D,Loerz H:通过用土豆杆菌的雄激素花粉培养物感染大麦(Hordeum Vulgare L.)的遗传转化。植物Biotechnol J. 2006,4:251-261。10.1111 / J.1467-7652.2005.00178.x。
- 40。
关键词:大麦,锰效率,RFLP图谱应用计算机学报,2000,101:1100-1108。10.1007 / s001220051585。
- 41。
Gamborg O,Miller R,Ojima K:大豆根细胞悬浮培养的营养需求。Exp Cell Res。1968年,50:151-158。10.1016 / 0014-4827(68)90403-5。
- 42。
Wang MB,Waterhouse PM:一种快速而简单地用潮霉素或PPT抗性基因转化的植物。植物MOL BIOL REP。1997,15:209-215。10.1023 /答:1007446721394。
- 43。
Murashige T,Skoog F:一种修订的培养基,用于快速生长和烟草组织培养的生物测定。physiol植物。1962,15:473-479。10.1111 / J.1399-3054.1962.TB08052.x。
致谢
作者感谢Cornelia Marthe为她出色的技术援助。我们还感谢Sylvia Dr. Sylvia Broeders提供矢量PSB187。
作者信息
隶属关系
通讯作者
附加信息
竞争利益
提交人声明他们没有竞争利益。
作者的贡献
GH的设计转化实验,参加了分子研究的设计和分析,并起草了手稿。SO进行转化实验,并参与起草的手稿。DD进行微观研究。JZ和MM参与研究的设计和组织,并协助起草了手稿。JK构思研究,并参与了它的设计和组织完成了手稿。所有作者均阅读并批准最终手稿。
Goetz Hensel, Sylwia Oleszczuk对这项工作做出了同样的贡献。
作者的原始提交的图像文件
权利和权限
本文由BioMed Central Ltd授权发表。这是一篇基于知识共享署名许可协议(http://creativeCommons.org/licenses/by/2.0.),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
Hensel,G.,Oleszczuk,S.,Daghma,D.E.S.。et al。转基因冬小黑麦T-DNA整合及生殖分离分析(X TriticoSecale.Wittmack)。BMC植物BIOL.12日,171(2012)。https://doi.org/10.1186/1471-2229-12-171
收到:
接受:
发表:
关键字
- 农杆菌属
- 冬季小教徒(X TriticoSecale.Wittmack)
- 性传播
- 转基因表达
- GFP.
- 副本号码