摘要
背景
植物的内源时钟(昼夜钟表)将生理过程纳入光/暗和温度周期。前进和逆向遗传方法拟南芥揭示了生物钟的机制及其基因组中的组成部分。类似的方法也被用于描述几种植物中保守的时钟元素。野生烟草,尼古利亚娜attenuata.已经广泛研究了了解玻璃容器中的生物或非生物压力的反应,也是在他们的本地栖息地。在二十年的田野实验中,我们观察了几个昼夜节奏性状N.Attenuata.在自然界中。为了将我们对生物钟功能的认识扩展到对生态过程重要的特征的夹带中,我们在这里报告了三个核心时钟组件N.Attenuata..
结果
蛋白质的相似性和转录本的积累使我们能够分离出核心昼夜时钟成分的同源基因,LATE ELONGATED HYPOCOTYL (LHY), TIMING of CAB EXPRESSION 1/PSEUDO-RESPONSE REGULATOR 1 (TOC1/PRR1)和ZEITLUPE (ZTL)。记录的积累NaLHY在黎明时达到顶峰NaTOC1在长日照条件下生长的植物在黄昏时达到高峰。异位表达NaLHY和NaZTL在拟南芥导致下胚轴伸长和晚开花表型。通过酵母双杂交试验证实了NaTOC1和NaZTL之间的蛋白质相互作用。最后,当NaTOC1是沉默n . attenuata则在长日照条件下可以明显观察到晚花表型。
结论
我们发现了三个核心生物钟基因N.Attenuata.并证明了功能和生化保护的功能和生化NaLHY那NaTOC1,naztl。
背景
生物钟受地球倾斜轴上24小时自转的影响,在生物体的表现与每日的光和温度周期同步方面发挥着至关重要的作用,使生物体能够在一天的正确时间调节活动[1].例如,植物的内源性时钟影响多种生物过程,包括叶片运动、下胚轴生长、花的过渡以及非生物和生物的抗逆性[2-4.].
生物昼夜节律和生物昼夜时钟的分子机制已经在许多生物体中进行了研究,包括黑腹果蝇那粗糙脉孢菌那Synechoccocus elongatus,以及老鼠[5.-7.].一般来说,几个相互关联的转录/翻译反馈回路参与建立中央时钟振荡[8.-10].在植物中,在二象的模型植物中广泛研究昼夜节律性,拟南芥,并提出了“三回路模型”[11].
驾驶室表达1 /伪响应调节器1(TOC1 / PRR1)和两个部分冗余的MYB转录因子,昼夜时钟相关的1(CCA1)和晚细长的次杆(LHY)的时序包括中央振荡环[12].CCA1和LHY压抑转录表达TOC1.通过直接与其启动子结合,并且如最近显示的,TOC1负面调节转录CCA1和LHY[13那14,建立负反馈循环[11那15].第二个回路由TOC1和晚花复合体(EC)组成,由早花3 (ELF3)、ELF4和LUX心律失常(LUX)组成[14].此外,第三环通过PRR7 / PRR9和LHY / CCA1之间的负反馈建立[16那17].
蛋白质周转调节为昼夜节律钟的调节提供了另一个复杂的层面。值得注意的是,TOC1蛋白受蛋白酶体介导的蛋白质降解的调控。E3泛素连接酶SCF (SKP1-CUL1-F-box蛋白)复合物中的F-box蛋白ZEITLUPE (ZTL)以暗依赖的方式通过直接物理相互作用将TOC1蛋白泛素化[18].ZTL的同源物也参与了光周期花的昼夜周期调节[19那20.].黄素结合、KELCH重复、F-BOX 1/ADAGIO3 (FKF1/ADO3)以蓝光依赖的方式与GI相互作用并调控君士坦斯通过降解Dof转录因子,即循环Dof因子1的表达[19].此外,有报道称ZTL、FKF1和LOV KELCH蛋白2共同调控TOC1和PRR5的降解,导致昼夜节律振荡[21].
最近的研究表明,这些生物钟成分也可以在多种植物中找到,包括水稻、大豆、玉米和杨树[22-25].CCA1/LHY基因广泛保守在奥德氏菌(edictots)和单子叶植物(单子叶植物)植物中[26-29]、CCA1/LHY和TOC1反馈回路被认为在这些植物物种的时钟功能中发挥着核心作用。在几种植物中也发现了ZTL的功能同源物[30.那31],进一步支持昼夜节奏组件在植物中是相当保守的。
尽管内源时钟在纳入环境信号的生理过程中的重要作用,但昼夜节奏如何调节其自然栖息地在其自然栖息地的生态表现在很大程度上。只有一些研究表明,内源性时钟允许植物最大化光合能力和生殖成功[32-34].为了扩展我们对生物和非生物相互作用中的时钟功能的理解,我们在野生烟草中鉴定了三个核心时钟成分(LHY, TOC1和ZTL),尼古利亚娜attenuata.已成为理解本土栖息地的生态表现的模型系统,特别是犹他州的伟大盆地沙漠。N.Attenuata.是一种季节性的茄科植物,在春季和夏季完成其生命周期,在原生栖息地的火灾之间蛰伏在种子库中多年。这些结果为昼夜节律钟基因的保存提供了额外的证据,并为未来揭示生物钟的生态相关性的研究奠定了基础。
结果
假定的核心昼夜节律基因的分离N.Attenuata.
三个推定核心昼夜昼夜钟基因的全长或部分序列(LHY那TOC1.,ZTL) 在N.Attenuata.使用序列被爆炸搜索被爆炸搜索孤立拟南芥生物钟基因。我们在我们的时间序列微阵列数据库中检查了这些转录本的日表达[35,研究了转录因子的积累模式N.Attenuata.叶片和根组织,每4h,一天(图1).确认微阵列数据,并检查所选时钟基因的昼夜节律N.Attenuata.,我们分析了在不同光条件下生长的幼苗中候选基因的成绩单积累。N.Attenuata.植株在16 h光照/ 8 h暗循环(LD)条件下生长2周,随后转入连续光照条件(LL)。LD和LL每2 h采收20株,连续采收3 d。利用基因特异性引物,通过实时荧光定量PCR (qPCR)对mRNA表达进行定量(附加文件)1).我们还构建了全长的编码序列NaLHY那NaTOC1,NaZTL(附加文件2),基于公共EST数据库中现有的正交序列拟南芥数据库。为了研究昼夜钟表在植物物种中的进化关系,使用UPGMA算法构建系统发育树(图2和额外的文件3.).
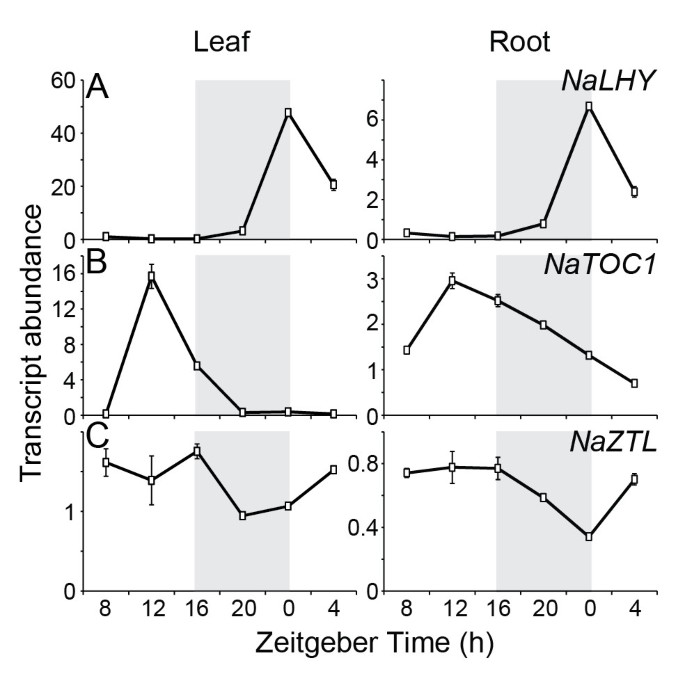
推定昼夜钟表基因的昼夜节律尼古利亚娜attenuata..首先使用我们的时间课程微阵列数据(登录号GSE30287)首先检查昼夜钟表基因的表达。野生型N.Attenuata.植物每4小时从叶子和根中收获一天。在RNA分离后,每个样品在型自动型单色技术阵列上杂交杂交N.Attenuata.转录组(登录号GPL13527)。平均(±SE)的转录性丰度水平(一种)NaLHY,(B.)NaTOC1, 和 (C)NaZTL在每个收获季节的叶片(n = 3)和根(n = 3)中。灰色框表示LD的暗期(16小时亮/ 8小时暗)。Na,尼古利亚娜attenuata.;LHY:晚伸长下胚轴;TOC1, cab表达时机1;ZTL zeitlupe。
拟南芥杨树基因组含有两种MYB转录因子(分别为LHY / CCA1和LHY1 / 2),这在内源时钟的调节中起关键作用[23那36].但是,我们发现只有一个振荡AtLHY类转录本的cDNA文库(图2一种)。转录水平NaLHY在LD达到Zeitgeber时间0 h(ZT 0 H)并保持低至下一个ZT 0 H(图 1一个和3.A),与观察到的模式一致拟南芥和大米(26那37].NaLHYLL下的成绩单累积在主观黎明附近保持了昼夜节律,并且较短的时间段,平均值为6.1小时,而不是在LD下(图3.一种)。蛋白质序列与寰喉(Iderity = 42%,阳性= 54%,间隙= 18%)和ATCCA1(阳性= 38%,阳性= 50%,间隙= 50%,间隙= 50%,间隙= 22%)。系统发育分析表明,Nalhy与Atlhy更密切相关(图2).NaLHY蛋白(767 aa)比AtLHY (645 aa)、AtCCA1 (608 aa)和OsCCA1 (719 aa)更大,但在n端有保守的SANT结构域和两个具有athy和OsCCA1蛋白特征的富含alanine的区域(附加文件)2).
TOC1/PRR1是PRR家族的一员,PRR家族由5个振荡基因组成;TOC1./PRR1那PRR3那PRR5那PRR7和PRR9.每个人PRR基因有它自己的日常表达模式[38].微阵列数据显示NaTOC1转录物在ZT 12 H达到峰值(图1B)按照已知的昼夜节律拟南芥toc1[39那40].QPCR分析表明NaTOC1转录物在LD下ZT 12 H达到峰值和表达NaTOC1与LD表达相比,LL表达的峰值提前了1.3 h(图)3.B). NaTOC1蛋白全长序列与AtTOC1/PRR1具有高度相似性(identity = 49%, positive = 59%, gap = 16%)。系统发育分析显示NaTOC1与AtPRR1的亲缘关系比与其他AtPRRs的亲缘关系更近(图)2).TOC1的n端REC结构域和c端CCT基序被保守N.Attenuata.那拟南芥和o .漂白亚麻纤维卷但线圈-线圈区域仅在双二体中发现拟南芥和N.Attenuata.(附加文件2).
这拟南芥基因组编码三个参与蛋白质劣化的F盒蛋白质[18那19那21].我们发现两个ZTL局部基因(NaZTL和NaFKF1/ADO3.),并根据系统发育分析对其进行命名(图2).NaZTLLL和LD下的转录物在很大程度上不变(数字 1C和3.C),与结果一致拟南芥[41].相比之下,NaFKF1转录本显示出明显的昼夜节律,在LD下zt12小时达到峰值(附加文件)4.).的周期NaFKF1在LL中的表达平均缩短了2小时(附加文件4.).NaZTL与AtZTL (identity = 79%, Positives = 86%, gap = 5%)、NaFKF1与AtFKF1 (identity = 78%, Positives = 85%, gap = 4%)的蛋白序列相似。NaZTL和NaFKF1蛋白在其n端含有LOV/PAS和F-box结构域,在其c端含有Kelch重复区域拟南芥(附加文件2).
异位表达N.Attenuata.生物钟基因在拟南芥
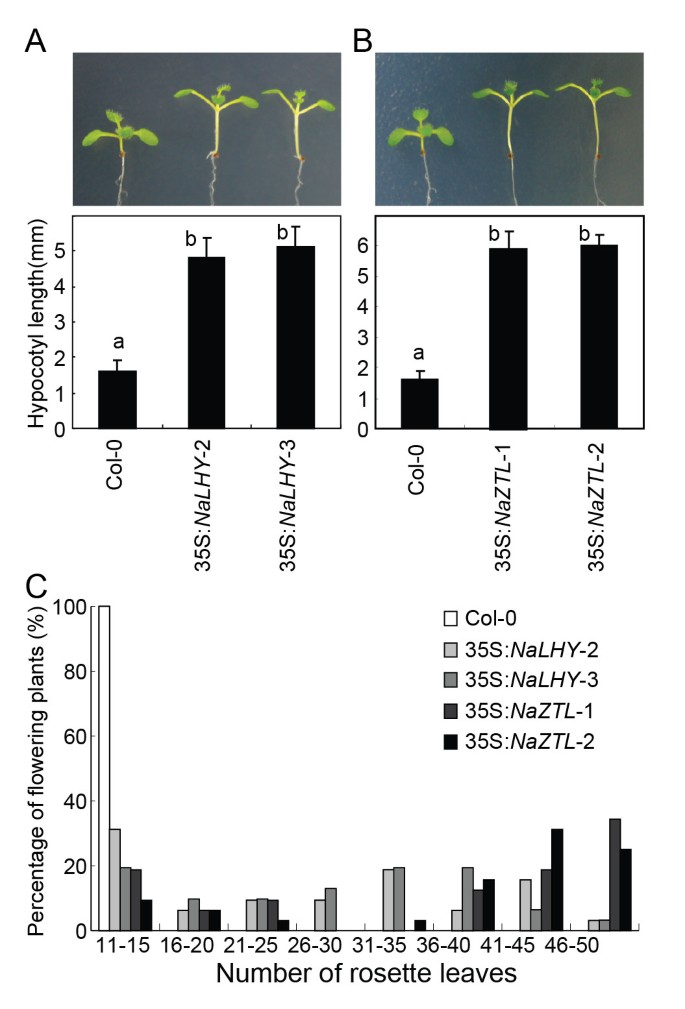
检查时钟组件的功能保护N.Attenuata.,我们生产拟南芥(Col-0)转基因植物异位表达NaLHY和NaZTL花椰菜花叶病毒(CaMV) 35S启动子调控基因(35S:NaLHY和35 s:NaZTL).昼夜钟表夹带低暗循环的次髓细胞伸长,因此植物过表达拟南芥LHY或ZTL与野生型植物相比,它们的下胚轴延长了[37那42].我们测量了35S的下胚轴长度:NaLHY(数字4.)和35 s:NaZTL转基因植物(图4.B).两个独立的35SNaLHY与野生型,COL-0相比,线条显示了缺口长度的显着增加,两个独立的35s:NaZTL行(P.< 0.05,用Fisher 's进行单因素方差分析事后测试)。
异位表达NaLHY和NaZTL在A. Thaliana。拟南芥转基因植物含35岁:NaLHY和35 s:NaZTL构造在幼苗(一种那B.)及开花(C)阶段。野生型Col-0下胚轴长度平均值(±SE)值(n = 11), 35S:NaLHY-2 (n = 12), 35S:NaLHY-3(n = 11),35s:NaZTL-1 (n = 13)和35S:NaZTL-2 (n = 13)不同的字母(a和b)反映了行之间的显著差异(P.< 0.05,用Fisher 's进行单因素方差分析事后测试)。(C) Col-0开花植株百分比和莲座叶数(n = 16), 35S:NaLHY-2(n = 32),35s:NaLHY-3 (n = 31)和35S:NaZTL-1 (n = 32), 35S:NaZTL-2(n = 30)当花序伸长率开始时。
通过生物钟感知季节变化的能力是从营养阶段成功过渡到生殖阶段所必需的。消除早晨的元素,拟南芥LHY或CCA1的表型为早花型,而过表达系的表型为晚花型拟南芥[12那36那37].过度表达拟南芥ZTL还导致LD下的晚开花表型[42].检验…的效果NaLHY和NaZTL论开花时间监管拟南芥,我们记录了在LD下生长的植物在初开花时的莲座叶片数。NaLHY和35 s:NaZTL植株表现出开花延迟和莲座叶数增加的表型(图)4.C)。
NaTOC1与NaZTL蛋白的相互作用
F-Box蛋白ZTL在钟组分的蛋白质转换中起关键作用,包括直接蛋白质 - 蛋白质相互作用[18].我们通过酵母双杂交分析确定NaTOC1是否与NaZTL相互作用。此外,我们还检测了AtTOC1-NaZTL和AtZTL-NaTOC1的种间相互作用。全长NaTOC1蛋白(AtTOC1)与GAL4激活域(AD)融合,NaZTL (AtZTL)与GAL4结合域(BD)融合,在酵母细胞中共表达(见方法)。同时表达NaTOC1和NaZTL的酵母细胞在缺乏亮氨酸、色氨酸、组氨酸和腺嘌呤的情况下生长良好,表现出正相互作用,与拟南芥TOC1和ZTL的相互作用(图5.A).与携带空载体或只有一个结构体的对照酵母细胞相比,表达NaTOC1和NaZTL的转化子也表现出很强的β-半乳糖苷酶活性(图)5.B). AtTOC1-NaZTL和AtZTL-NaTOC1的种间蛋白质互作与TOC1和ZTL的种内互作一样强(图2)5.).
沉默的NaTOC1在N.Attenuata.
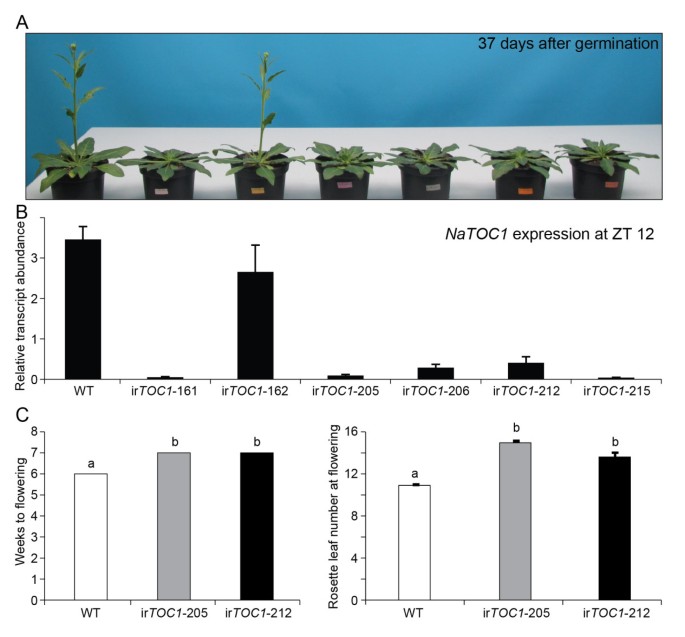
研究昼夜节律钟基因的保守和独特功能N.Attenuata.,我们首先沉默NaTOC1表达通过组成型过度表达NaTOC1- 特异性倒置重复(IR)序列(IRTOC1.行)(43那44].TOC1在拟南芥在花期调控中起关键作用。的semi-dominanttoc1-1突变体在短日情况下显示LD下的晚开花表型和早期开花表型(SD)[39)和toc1-2功能突变突变体显示出在LD下的开花时间没有显着差异,但SD下的早期开花表型[45].在筛选沉默品系的过程中,我们清楚地观察到几个独立的ir的晚花表型TOC1.LD下的线(图6.).用两个独立的株系测量第一朵花开放时的开花时间和莲座叶片数(图6.C).含有RNAi结构的独立株系的沉默效率与流环表型密切相关(图6.B).在一个纯合的ir中TOC1.-162细胞系,筛选的依据是抗生素耐药性,但在其中TOC1.基因表达未沉默,可能是由于T-DNA的IR部分的甲基化或未知的插入效果,显示了WT开花模式(图6.).
讨论
由于时钟基因拟南芥已经确定了,时钟机制拟南芥已扩展到其他双子叶植物;大豆(24],栗[29],Brassica Rapa.[46],杨树[23也适用于单子叶植物;大米(25)、玉米(22],浮萍[28].在这里,我们在一种野生烟草中确定了三个核心昼夜时钟基因,N.Attenuata..转录成分积累和蛋白质相似性的昼夜节律分析使我们能够识别直肠LHY那TOC1.,ZTL的拟南芥在N.Attenuata..TOC1与ZTL的蛋白质相互作用拟南芥也被保守了N.Attenuata..此外,异位表达NaLHY和NaZTL在拟南芥证实了LHY和ZTL的功能保存N.Attenuata..我们也证明了这一点NaTOC1在N.Attenuata.在开花时间的调节中起着重要作用。
的数量LHY(或CCA1)同源基因和基因复制事件发生的时间因植物物种而异[23].LHY / CCA1的一个共同的祖先独立于单焦和拒名在单焦和别人中重复。杨树黑质和p . trichocarpa包含两者LHYorthologs和单码,米饭和高粱二色的包含一个CCA1类基因[23那47].基因复制事件LHY/CCA1在流行和拟南芥将会在N.Attenuata.但我们只能找到一个LHY/CCA1就像基因N.Attenuata..然而,在我们目前的cDNA文库中可能缺少第二个同源基因,我们计划在未来对多种条件下生长的植物进行转录组深度测序和微阵列分析,以阐明其进化关系N.Attenuata.的LHY直接同源。
虽然内源时钟和其相关的昼夜相关的昼夜时钟机制的组件在不同的植物物种上显然保持了,但是响应于不同的选择压力,时钟介导的信号传导已经演变。一常数植物,栗子(齿栗叶的可能)有直觉的AtLHY和AtTOC1在其基因组和成绩单积累的模式中CSLHY.和CSTOC1.和的相似吗拟南芥在22°C的LD中[29].然而,在冬季条件下,两者都是CSLHY.和CSTOC1.转录物失去了昼夜节律并保持高水平的转录物,这可能与冬季休眠的诱导有关[29].即使是在单一物种中,答:芥时钟组件的遗传变化在调整生态型对其本地环境中起着关键作用[48].遗传变异PRR基因与在150中定量特征座位的差异表达中所见的局部适应相关拟南芥指标(48].此外,TOC1调节开花时间的程度不同拟南芥生态型。半导体toc1-1突变体的拟南芥C24生态型在LD中显示出开花表型,而相同TOC1.与野生型相比,LD下Landsberg生态型突变的开花时间没有变化[39].这toc1-2突变体在LD下的开花时间也没有变化[45].然而,沉默TOC1.在N.Attenuata.在LD下具有晚开花表型那这可能是由于寿命越长N.Attenuata.(约3个月)或不同的昼夜时钟功能在各种环境压力下发展。在未来的研究中,我们计划测量IR的开花时间TOC1.检测该转基因品系的光敏性。
我们调查了生态学N.Attenuata.在它的本土栖息地超过二十年。在此期间,我们观察到有趣的昼夜节律特征N.Attenuata.以及依赖于时间的生态相互作用。例如,N.Attenuata.与白天活动的不同食草动物(如蚱蜢、盲蝽和Manduca幼虫)或夜间活动的(如夜蛾幼虫和树蟋蟀),并产生不同的化学物质,作为对这些食草动物的直接防御或作为间接防御和吸引食草动物的捕食者[49].近年来,我们发现了组织特异性的代谢产物及其相关转录产物的日节律N.Attenuata.对食草动物攻击的反应变化,M.Sexta.幼虫(35].我们在叶和根中测量到的总代谢物中有15%以上显示出日变化模式,其中一些已经被证明是植物抵御食草动物攻击的功能。Goodspeed等.[50[最近有报道称tricoplusia ni.是由寄主植物的生物钟预测的吗拟南芥它能增强抗草食动物的防御能力拟南芥.这些相互作用为探索生物钟调控植物-昆虫相互作用的分子机制提供了丰富的舞台。
结论
我们确定了三个核心的生物钟成分N.Attenuata.基于基因表达和在组分中沉默或过表达的线的表型改变。这项工作为操纵昼夜时钟的生态角色提供了自然界的基础。随着喷气式旅行揭示了人类中昼夜调节过程的深度,昼夜突变体N.Attenuata.将被用来阐明植物-环境、植物-植物、植物-昆虫相互作用中的生物钟的生态功能。
方法
植物生长条件
对于我们使用的所有实验尼古利亚娜attenuata.托。例如:瓦茨(茄科)植物(31圣近交系),野生型(WT),源自犹他州的一个种群。种子在带有Gamborg的B5培养基的培养皿中灭菌并发芽,如[43].装有20粒种子的培养皿在长日照条件(LD,光照16 h /黑暗8 h)下保存。
为了检查自由运行期,发芽后15天的一组幼苗被移动到恒定的光线条件下,在取样3天,并在LD下生长另一组幼苗。每2小时收获三种生物学重复(每次重复的10个幼苗)3天,并立即在液氮中冷冻。
RNA分离与基因表达
用TRIZOL试剂提取总RNA,用RT-minus试剂盒(Fermentas, Burlington, Canada)从500 ng总RNA中合成cDNA。采用SYBR Green试剂盒(Eurogentec, Cologne, Germany)对Stratagene MX3005P (Agilent Technologies, Santa Clara, CA, USA)进行定量RT-PCR分析。根据序列设计引物拟南芥从Tair网站检索到一个N.Attenuata.抄本库(NCBI GEO数据库登录号GSE30287)。qRT-PCR引物对序列NaLHY那NaTOC1那NaZTL和NaFKF1在附加文件中列出1.转录本丰度表达相对于表达N.Attenuata伸长因子基因。
系统发育分析
昼夜节律基因的身份NaLHY(NCBI登录号JQ424913),NaTOC1(加入JQ424914数量),NaZTL(登录号JQ424912)和NaFKF1/ADO3.(登录号JQ424915)通过测序确定。采用标准PCR获得全长cDNA,用于分析的引物列表见附加文件1.使用CLONEJET PCR克隆试剂盒(FERMENSA)亚克隆PCR产物进行扩增。
昼夜节律基因的氨基酸序列NaLHY那NaTOC1那NaZTL和NaFKF1/ADO3.从cDNA序列中推导出,并用geneii程序V5.3 (http://www.geneious.com).氨基酸替换的数量由使用BLOSUM 62矩阵的Jukes-Cantor模型估计,通过自由端间隙选项的全局对齐。采用不加权对组算术均值法(UPGMA)重建系统发生树。这些分析是使用Geneious V5.3软件进行的。
过度的NaLHY和NaZTL在拟南芥
全部答:芥使用的线条在Col-0背景中。在长日(LD)条件下(16小时光照/8小时黑暗),在22℃、相对湿度55%、白光照明(120 μmol光子/m)的控制培养室内种植植株2s)由荧光FLR40D/A管(欧司朗)提供。来产生过度表达的转基因植物NaLHY和NaZTL在CaMV 35S启动子(Invitrogen, Carlsbad, CA, USA)的控制下,将全长cdna亚克隆到二进制的pB2GW7载体中。根癌土壤杆菌介导的拟南芥根据改性的花卉浸渍方法(克劳和弯曲,1998)进行转化。T.2转基因植物含有一个单一的T-DNA插入被用于后续的分析,包括下胚轴长度和开花时间的测量。转换时NaTOC1但由于未知的技术原因,我们不可能从它再生植物。选择的细胞株进行RT-PCR检测NaLHY和NaZTL超表达(附加文件5.), 使用答:芥tubulin (TUB)作为内参基因。
酵母 - 双杂交
酵母双杂交试验使用媒质进行TM系统(Clontech, Palo Alto, CA, USA)。用于扩增的引物NaTOC1, AtTOC1那NaZTL,atztl.在附加文件中有描述1.每个RT-PCR产物用限制性内切酶(生态ri,XmaI代表NaTOC1和AtTOC1,NCO一世,Xma我对于NaZTL,NDE.一世,Bam嗨AtZTL)。消化的全长转录本TOC1.年代和ZTLs分别亚克隆到pGADT7和pGBKT7。酵母株AH109(亮氨酸-,色氨酸-,组氨酸-,腺嘌呤-)Lac.Z报告基因与图中所示载体共转化5.A.根据制造商的说明书进行了改造(克隆技术)。在不含Leu、Trp的培养基上获得的单个菌落接种在不含Leu、Trp、His、Ade的培养基上,测定说明书中描述的β-半乳糖苷酶活性(Clontech)。
沉默的NaTOC1在N.Attenuata.
的序列片段NaTOC1在CaMV 35S启动子驱动下,cDNA作为反向重复结构插入pSOL8转化载体[43那44].这NaTOC1矢量被转化为N.attenuata则WT工厂使用根癌土壤杆菌介导的转换;在T0.Gase等人所描述的植物[44],允许选择二倍体转化线。纯合子被证实了2通过湿霉素抗性筛选植株,然后选择6个转化系,并转移到温室中,在Krügel等人所述的条件下进一步生长[43].基因表达水平NaTOC1由QPCR从所选T的组织确定2植物和野生型植物在ZT 12 h采集。
参考文献
- 1.
邓拉普:昼夜节律的遗传和分子分析。中国生物医学工程学报,1996,30(1):579-601。10.1146 / annurev.genet.30.1.579。
- 2.
桑切斯A,Shin J,Davis SJ:非生物压力和植物昼夜钟。植物信号行业。2011,6(2):223-231。10.4161 / PSB.6.2.14893。
- 3.
Yakir E, Hilman D, Harir Y, Green RM:植物生物钟输出的调节。中国海洋大学学报(自然科学版),2007,27(2):335-345。10.1111 / j.1742-4658.2006.05616.x。
- 4.
Barak S, Tobin EM, Green RM, Andronis C, Sugano S:所有在好的时间:拟南芥生物钟。植物科学进展,2000,5(12):517-522。10.1016 / s1360 - 1385(00) 01785 - 4。
- 5.
Golden SS,Canales SR:蓝藻昼夜昼夜时钟 - 时序就是一切。NAT Rev Microbiol。2003,1(3):191-199。10.1038 / nrmicro774。
- 6.
Lombardi LM, Brody S:昼夜节律神经孢子仓库:真菌时钟基因同源物。真菌遗传学Biol。2005,42(11):887-892。10.1016 / J.FGB.2005.06.005。
- 7.
Panda S, Antoch MP, Miller BH, Su AI, Schook AB, Straume M, Schultz PG, Kay SA, Takahashi JS, Hogenesch JB:生物钟对小鼠关键通路的协调转录。细胞。2002,109(3):307-320。10.1016 / s0092 - 8674(02) 00722 - 5。
- 8.
Albrecht U,Eichele G:哺乳动物昼夜时钟。CurrOpin Genet Dev。2003,13(3):271-277。10.1016 / s0959-437x(03)00055-8。
- 9.
Loros JJ,Dunlap JC:昼夜节律的遗传和分子分析n eurospora.Annu Rev Physiol。2001,63(1):757-794。10.1146 / annurev.physiol.63.1.757。
- 10.
果蝇昼夜节律系统的分子组成。acta physologica sinica, 2001, 63(1): 729-755。10.1146 / annurev.physiol.63.1.729。
- 11.
上田:植物时钟领域开花的系统生物学。acta physologica sinica, 2006, 2: 60。
- 12.
王志勇,王志勇生物钟相关1 (cca1)基因扰乱昼夜节律并抑制自身的表达。acta photonica sinica, 2012, 37(7): 1182 - 1188。10.1016 / s0092 - 8674(00) 81464 - 6。
- 13.
Gendron Jm,Pruneda-Paz JL,Doherty CJ,Gross Am,Kang Sa:拟南芥生物钟蛋白TOC1是一种dna结合转录因子。美国国家科学院学报。[j] .地球科学进展,2012,29(8):3167-3172。10.1073 / pnas.1200355109。
- 14.
Pokhilko A, Fernández AP, Edwards KD, Southern MM, Halliday KJ, Millar AJ:生物钟基因电路拟南芥包括一个带有附加反馈回路的阻遏器。中国生物科学(英文版),2012,28(6):574。
- 15.
alabadíd,yyama t,yanovsky mj,harmon fg,másp,kay sa:TOC1和LHY / CCA1之间的互惠调节拟南芥生物钟。科学。2001,293(5531):880-883。10.1126 / Science1061320。
- 16.
Farré EM, Harmer SL, Harmon FG, Yanovsky MJ, Kay SA: PRR7和PRR9的重叠和不同的作用拟南芥生物钟。Curr Biol。2005,15(1):47-54。10.1016 / J.CUB.2004.12.067。
- 17.
Salomé PA, McClung CR:伪响应调节器7和9.部分冗余基因对于温度响应性是必不可少的拟南芥生物钟。植物学报,2005,17(3):791-803。10.1105 / tpc.104.029504。
- 18.
MAS P,Kim W-Y,Somers de,Kay SA:通过ZTL调制昼夜函数的ToC1的有针对性的降解拟南芥.自然科学。2003,426(6966):567-570。10.1038 / nature02163。
- 19.
Imaizumi T, Schultz TF, Harmon FG, Ho LA, Kay SA: FKF1 F-box蛋白介导了CONSTANS抑制因子的循环降解拟南芥.中国科学:地球科学。2005,32(5):591 - 598。10.1126 / science.1110586。
- 20.
Sawa M, Nusinow DA, Kay SA, Imaizumi T: FKF1和GIGANTEA复合体的形成需要在日长测量拟南芥.中国科学:地球科学。10.1126 / science.1146994。
- 21.
Baudry A, Ito S, Song YH, Strait AA, Kiba T, Lu S, Henriques R, Pruneda-Paz JL, Chua N-H, Tobin EM,等:F-box蛋白FKF1和LKP2与ZEITLUPE共同调控拟南芥时钟进程。植物学报。2010,22(3):606-622。10.1105 / tpc.109.072843。
- 22.
王X,吴L,张某,ku l,魏x,谢y:zmcca1与玉米昼夜节律的强大表达与关联。植物细胞代表2011,30(7):1261-1272。10.1007 / s00299-011-1036-8。
- 23.
高田N,齐藤S,田中斋藤C, Nanjo T, Shinohara K, Uemura M:杨树昼夜时钟基因的分子系统发育和表达,LHY1和lhy2..新植物。2009,181(4):808-819。10.1111 / J.1469-8137.2008.02714.x。
- 24.
刘H,王H,高P,徐J,徐T,王J,王B,林C,富Yf:钟基因同源物中使用水管基因同源物中的靶器官在大豆中的靶器官(大豆).植物营养与肥料学报。2009,27(3):427 - 434。10.1016 / j.jplph.2008.06.003。
- 25.
Murakami M,Tago Y,Yamashino T,Mizuno T:时钟相关基因的比较概述拟南芥和栽培稻.植物生理学报。2007,48(1):110-121。
- 26.
Izawa T, Oikawa T, Sugiyama N, Tanisaka T, Yano M, Shimamoto K:光敏色素介导外部光信号抑制水稻光周期开花FT同源基因。基因开发,2002,16(15):2006-2020。10.1101 / gad.999202。
- 27.
Kaldis A- d, Kousidis P, Kesanopoulos K, Prombona A:光和昼夜节律调节在表达中的作用LHY和LHCB基因在菜豆.acta botanica sinica, 2017, 36(5): 591 - 598。10.1023 /: 1025433529082。
- 28.
MiWA K,Serikawa M,Suzuki S,Kondo T,Oyama T:在两种lemna种类中的昼夜节日相关基因的保守表达概况显示出漫长的一天和短日的光周期开花反应。植物细胞生理。2006,47(5):601-612。10.1093 / PCP / PC9027。
- 29.
Ramos A, Pérez-Solís E, Ibáñez C, Casado R, Collada C, Gómez L, Aragoncillo C, Allona I:冬季对栗子生物钟的干扰。美国国家科学院学报。[j] .环境科学学报,2003,22(4):427 - 434。10.1073 / pnas.0408549102。
- 30.
泰勒A,马西亚AJ,托马斯B:保护拟南芥洋葱中的光/周周性开花时间基因(Allium Cepa.L.)。植物细胞生理。2010,51(10):1638-1647。10.1093 / PCP / PCQ120。
- 31.
薛志刚,张学敏,雷春芳,陈晓军,傅艳芳:大豆ZEITLUPE同源物GmZTL3的克隆及功能分析。中国农业科学,2011,39(2):1411-1418。
- 32.
Dodd AN, Salathia N, Hall A, Kévei E, Tóth R, Nagy F, Hibberd JM, Millar AJ, Webb AAR:植物的生物钟增加光合作用、生长、生存和竞争优势。中国科学:地球科学,2019,39(5):531 - 534。10.1126 / science.1115581。
- 33.
yergushalmi S, Yakir E, Green RM:生物钟和适应拟南芥.生态学报,2011,20(6):1155-1165。10.1111 / j.1365 - 294 x.2010.04962.x。
- 34.
格林RM,丁凯S,王志勇,托宾EM:昼夜节律赋予人较高的健康水平拟南芥植物。植物理性。2002,129(2):576-584。10.1104 / pp.004374。
- 35.
acta botanica sinica(云南植物研究中心);acta botanica sinica(云南植物研究中心)烟草attenuata则。中国科学:地球科学,2011,36(10):1161 - 1168。10.1371 / journal.pone.0026214。
- 36.
Mizoguchi T, Wheatley K, Hanzawa Y, Wright L, Mizoguchi M, Song H-R, Carré IA, Coupland G:LHY和CCA1维持昼夜节律是否需要部分冗余基因拟南芥.DEV细胞。2002,2(5):629-641。10.1016 / s1534-5807(02)00170-3。
- 37.
Schaffer R,Ramsay N,Samach A,Corden S,Putterill J,Carré1a,偶联G:晚细长的胚乳突变拟南芥扰乱昼夜节律和开花的光周期控制。acta photonica sinica, 2012, 37(4): 429 - 434。10.1016 / s0092 - 8674(00) 81465 - 8。
- 38.
王志强,王志强,王志强,等。APRR1/TOC1家族基因在大肠杆菌中表达的研究进展[j]拟南芥:深入了解植物的生物钟。植物生理学报。2000,41(9):1002-1012。10.1093 /卡式肺囊虫肺炎/ pcd043。
- 39.
Somers DE, Webb A, Pearson M, Kay SA:短期突变体,toc1-1,在整个发育过程中改变多个输出的生物钟调节拟南芥.发展。1998,125(3):485-494。
- 40。
Millar AJ, Carre IA, Strayer CA, Chua NH, Kay SA:昼夜节律时钟突变拟南芥通过荧光素酶成像鉴定。中国科学:地球科学。10.1126 / science.7855595。
- 41。
Somers DE, Schultz TF, Milnamow M, Kay SA: ZEITLUPE编码一个新的时钟相关PAS蛋白拟南芥.中国生物医学工程学报,2000,101(3):319-329。10.1016 / s0092 - 8674(00) 80841 - 7。
- 42。
Somers de,Kim Wy,Geng R:F-Box蛋白Zeitlupe对昼夜钟表,光学发生和开花时间赋予剂量依赖性控制。植物细胞。2004,16(3):769-782。10.1105 / TPC.016808。
- 43。
Krügelt,lim m,gase k,halitschke r,baldwin it:农杆菌介导的尼古利亚纳attenuata的转化,模型生态表达系统。化学生态。2002,12(4):177-183。10.1007 / PL00012666。
- 44.
陈志强,陈志强,陈志强,等:转基因植物的高效筛选及其在生态研究中的应用。生态学报,2011,11(5):890-902。10.1111 / j.1755-0998.2011.03017.x。
- 45.
Niwa Y, Ito S, Nakamichi N, Mizoguchi T, Niinuma K, Yamashino T, Mizuno T:昼夜时钟相关基因的遗传联系,TOC1, CCA1和LHY,在拍摄时间的光周期控制中拟南芥.植物生理学报。2007,48(7):925-937。10.1093 /卡式肺囊虫肺炎/ pcm067。
- 46.
徐旭,谢强,张荣荣。基因表达的昼夜节律性Brassica Rapa.组织文化。植物营养与肥料学报。2010,29(2):441 - 446。10.1104 / pp.110.155465。
- 47.
单子叶植物和双子叶植物共同祖先的现代昼夜节律钟。中国生物医学工程学报。2010,8(1):55。10.1186 / 1741-7007-8-55。
- 48.
Michael TP,SaloméPa,Yu Hj,Spencer Tr,Sharper Tr,Sharp El,McPeek Ma,Alonso JM,Ecker JR,McClung CR:通过自然发生的昼夜时钟变化赋予了增强的健身。科学。2003,302(5647):1049 .101126 / Science.1082971。
- 49.
植物对昆虫性食草动物攻击反应的新见解。《安徽文学》,2010,44:1-24。10.1146 / annurev -麝猫- 102209 - 163500。
- 50。
Goodspeed D, Chehab EW, Min-Venditti A, Braam J, Covington MF:拟南芥同步茉莉酸介导的防御与昆虫昼夜节律行为。中国科学(d辑:地球科学),2012,39(12):1279 - 1284。10.1073 / pnas.1116368109。
确认
我们感谢Max Planck社会进行财务支持。该工作也得到了韩国国家研究基金会,由农村发展管理局提供的下一代生物生物21节目(植物分子育种中心No.PJ008103)提供的跨国研究计划(20110016440)提供支持植物信号网络研究中心(20110001099),韩国国家研究基金会(20110027355),以及农业研发促销中心(309017-03),韩国食品,农业,林业和渔业部。
作者信息
从属关系
相应的作者
附加信息
作者的贡献
FY, PS, SK设计实验并进行实验室工作,JR进行改造35s:nalhy.和35 s: NaZTL构造成拟南芥由CP、ITB和SK构思并监督研究。所有作者都撰写、阅读并批准了最终的手稿。
Felipe Yon,Pil-Joon SEO同样为这项工作进行了贡献。
电子辅料
用于生物节律钟基因的转录谱分析和全长克隆的引物列表
额外的文件1:N.Attenuata.和A. Thaliana。(PDF 3 MB)
生物钟基因的蛋白质排列
附加文件2:n . attenuata则拟南芥和米饭。使用geneous软件对全长氨基酸序列进行比对。(PDF 3 MB)
几种植物物种中昼夜钟基因的系统发育树。
附加文件3:(A) LHY/CCA1, (B) TOC1, (C) ZTL和(D) FKF1/ADO3的系统发育树。使用geneous软件对全长氨基酸序列进行比对。根据3个主要分类类群(单子叶植物、单子叶植物和1个苔藓)构建了系统发育树Selaginella Moellendorffii对于TOC1和ZTL树。采用基于Jukes-Cantor模型的氨基酸置换数的非加权对组法(UPGMA)。比例尺表示每个位点氨基酸替换的数量。交流,洋葱;在,拟南芥;计算机科学,齿栗叶的可能;通用,大豆;在,番薯零;MC,Mesembryanthemum crystallinum;Na,尼古利亚娜attenuata.;操作系统,栽培稻;Pn,杨树黑质;Pt,杨树trichocarpa;Pv,菜豆;SB,高粱二色的;SL,茄属植物lycopersicum;SM,Selaginella Moellendorffii;vv,葡萄;助教,Triticum Aestivum.;Zm评选,Zea Mays..(PDF 3 MB)
昼夜节律
附加文件4:NaFKF1/ADO3.表达N.Attenuata..(A)转录本丰度平均值(±SE)NaFKF1/ADO3.使用我们的时间程微阵列数据(登录号GSE30287)进行检测。野生型N.Attenuata.每4小时从叶子(n = 3)和根部(n = 3)收获每4小时植物。在RNA分离后,每个样品在型自动型单色技术阵列上杂交杂交N.Attenuata.转录组(登录号GPL13527)。(B)相对转录丰度平均值(±SE)NaFKF1/ADO3.在野生型N.Attenuata.幼苗(n = 20)在每次收获时间下在长期条件下两天(LD,灰线,16小时光/ 8小时暗)和连续光条件(LL,黑线)。通过QPCR和QPCR测定转录物水平N.Attenuata.伸长因子用作参考基因。灰色盒子描绘了LD的黑暗时期。(PDF 3 MB)
作者为图像提交的原始文件
权利和权限
开放获取本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
延夫,徐,PJ。、Ryu J.Y.等等。一种天然烟草中昼夜时钟基因的鉴定和特性分析,尼古利亚娜attenuata..BMC植物杂志12,172(2012)。https://doi.org/10.1186/1471-2229-12-172
收到了:
公认:
发表:
关键词
- 昼夜时钟
- 开花的时间
- NaLHY
- NaTOC1
- NaZTL
- 尼古利亚娜attenuata.
- 蛋白质相互作用