摘要
背景
YABBY (YAB)家族转录因子参与多种过程,包括叶和花的模式,器官的生长,以及茎尖分生组织的组织和活动的控制。目前尚不清楚这些不同的功能是如何被调控的,但基于与leunig类辅抑制子的相互作用,已经有人提出YABs作为转录抑制子。鉴于最近的研究表明,与酵母共抑制因子TUP1相关的dna结合蛋白也可以作为激活剂,我们检测了YABs的转录活性。
结果
四个拟南芥YABs测试在酵母中,只有FILAMENTOUS FLOWER(FIL)活化的报告基因的表达。类似的分析金鱼草属植物YABs鉴定了FIL orlog GRAMINIFOLIA作为激活剂。基于植物的反式激活实验不仅证实了FIL激活转录的潜力,而且还将这一特性扩展到FIL的类似物YABBY3 (YAB3)。随后对表达类固醇诱导的FIL蛋白的细胞系进行转录组分析,发现有几组基因对YAB诱导有阳性或阴性反应。极性调节基因包括在正向调节的基因组中KANADI1(KAN1),生长素反应因子4(ARF4)和不对称LEAVES1(AS1).我们还表明,修饰FIL作为专性抑制因子的功能导致强烈yab丧失功能的表型。
结论
集体这些数据显示FIL在植物中用作转录激活剂,并且该活动涉及叶图案。有趣的是,我们的研究还支持CEL可以作为阻遏物的想法,因为转录组分析鉴定了负调节的泌乳酵母响应基因。为了调和这些观察,我们建议YAB是参与正负监管的双官能转录因子。这些发现适用于叶片开发模型,其中通过由正反馈环组成的监管网络维护了一种曲线/亚速图案。
背景
YABBY (YAB)转录因子家族调控开花植物营养和花器官发育的各个方面。首次发现在拟南芥, YABs的特征结构包括一个n端锌指结构域和一个c端YABBY结构域,该结构域包含一个螺旋-环-螺旋基序,类似于在蛋白质高迁移率基团(HMG)中发现的结构[1,2].对锌指结构域的分析表明,它介导了YABs之间的同源和异源二聚,以及与其他蛋白质的相互作用[3.,4].相比之下,Yabby域与非特异性DNA绑定相关联[5].系统发育分析区分五种在被子植物YABs的子系列,通过丝状FLOWER / YABBY3(FIL / YAB3),YAB2,YAB5,蟹类爪(CRC)和INNER NO OUTER(INO)进化枝表示。在真双子叶植物如拟南芥,所谓的营养YABs -fil,YAB3,YAB2和YAB5-表达于正在发育的叶和花器官原基的背轴域[2,6),而儿童权利公约局限于正在发育的心皮和蜜腺,而伊诺在胚珠的外珠被明确表达[7,8].营养YABs通过突变体和功能获得分析的特征表明,它们在发育器官中调节细胞身份,因此在建立器官极性和随后的薄片生长中发挥重要作用[1,2,4,6,9].这种调节是复杂的,但是,如FIL和YAB3活动的损失与器官的局部adaxialisation [相关联2],而FIL、YAB3和YAB5联合丢失则导致器官轴向化[4].类似的观察结果在金鱼草属植物,其中FIL/YAB3同源基因GRAM的突变与轴向细胞特性的丢失有关,而当与YAB5同源基因PROLONGATA (PROL)的突变结合时,它们会导致轴向细胞特性的丢失[10].YABs适合于一个高度复杂和冗余的转录因子和小rna网络,促进器官极性(例如,参见[11])。促进Adaxial身份的因素包括AS2,ARP和III类同一域 - 亮氨酸拉链(C3 HD-ZIP)转录因子,以及MIR390-TAS3-RDR6途径产生的反式作用小干扰RNA [12- - - - - -14].相比之下,KANADI (KAN1, KAN2和KAN3)和生长素反应因子(ETTIN (ETT)/ARF3和ARF4)类转录因子与microRNAs一起促进了轴向同源性mir165./166[15- - - - - -18].YABs的这些网络内的精确位置并不确定,但基于yab功能缺失表型有人提出YABs整合了近轴-近轴模式与叶片生长程序[6].
营养YABs除了促进叶片生长外,还能阻止生长中的叶原基中茎尖分生组织(SAM)调控因子的表达。在没有营养YAB活性的情况下,诺克斯和WUSCHEL(沃斯)的表达在叶子中被检测到,它与类似sam的结构的形成有关[6,19].YABs在调控SAM活性方面也起着重要作用,如花的花序分生组织费尔突变体明显增大,并表现出异常的叶序[20.,21].此外,这些分生组织缺陷与分生组织调控因子的横向表达有关沃斯和clavata3.(CLV3)[20.].此外,严重扰乱SAM的规模和组织,最终导致SAM被逮捕,其顺序也较高拟南芥和金鱼草yab突变体(4,6,10].最近的一项研究表明,YAB的这一功能在被子植物中显然是保守的TONGARI-BOUSHI1,Afil例如YAB来自稻,控制小花分生组织活性22].作为YAB的积累拟南芥和金鱼草属植物局限于发育的侧器官和花原基的背面区域[20.,23,它们的sam促进活动可能反映了非细胞自主活动[10,20.].
最近的研究已经开始解决YABS如何在分子水平上函数。例如,物理和营养YABs和共阻遏LEUNIG(LUG)和密切相关的LEUNIG_HOMOLOG(LUH)之间的遗传相互作用建议YABs在镇压配合物[行动4].LUG和LUH与酵母中存在的TUP1、Groucho (Gro)和TLE共抑制因子具有结构和功能上的相似性,果蝇和脊椎动物[24].鉴于这种相似性,LUG和LUH与dna结合因子的相互作用范围可能与真菌和动物辅助抑制因子的相互作用范围相似。在这方面,值得注意的是,在酵母中,一些dna结合蛋白在不与抑制因子复合体相关的情况下,能够作为激活因子发挥作用[25,26].最近的几项研究也已经确定了植物转录因子具有双重活动,表现为不同的组靶基因[无论是活化剂或阻遏27- - - - - -29或在不同的组织中[30.].这就提出了一个有趣的可能性,与相关联的一些DNA结合蛋白格罗状辅阻遏也具有双功能活性。在这项研究中,我们测试通过检查营养YABs的调节特性,这种可能性。我们发现,采用瞬时激活测定和全基因组转录组分析相结合,即FIL并可能YAB3功能营养发育过程中的活化剂。与激活活性的生物重要性,在植物中表达时融合镇压主题SRDX以FIL导致显性负表型一致。基于转录组分析,一些极性监管机构认定为FIL目标。显著,其中两个靶基因,KAN1和ARF4被认为位于yab的上游。因此,我们提出了一个模型,YAB蛋白通过建立一个正增强的反馈回路来维持叶片的极性。
结果
FIL和FIL-like YABs在酵母中起激活作用
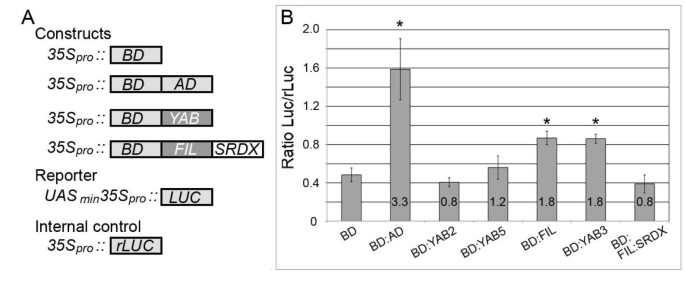
我们之前使用酵母双杂交试验来检测YABs和LUG共抑制复合物的各种成分之间的物理相互作用。在检测YAB结构的自动激活时,我们发现表达GAL4 DNA结合域(BD)的酵母融合到FIL中,在含有X-α-Gal的培养基上生长4小时后产生了明显的颜色变化([4];图1).有趣的是,这一特性并不与密切相关的YAB3或其他植物表达的YABs (YAB2和YAB5)共享(图)1).要确定激活是否是YABs的FIL亚组的保守特征,我们检查是否金鱼草属植物在酵母中,FIL ortholog (GRAM)是一种激活剂。为了比较,我们还测试了YAB5同源物PROL和YAB2同源物AmYAB2。当在含X-α-Gal的培养基上生长时,表达BD:GRAM的酵母系在16 h后产生颜色变化,而BD:PROL或BD:AmYAB2均未检测到颜色变化。虽然YAB蛋白在酵母中的行为并不一定反映它们在植物中的活性,但这些结果仍然提出了一个有趣的可能性,即YAB的FIL亚群作为激活剂的功能。
在足底测定表明,FIL / YAB3可以作为转录激活因子起作用
为了进一步研究拟南芥YABs,我们使用了在活的有机体内通过植物转录分析,确定营养表达的YABs (FIL, YAB2, YAB3, YAB5)是否具有激活作用。YABs与GAL4 BD翻译融合(图)2a)并引入拟南芥和荧光素酶报告器一起离开“无人飞行系统”:卢克.在转染后,从叶组织中提取蛋白质并测定荧光素酶活性。我们首先通过测定从叶子转染的叶子来确定荧光素酶活性的基线水平35个年代箴::双相障碍,然后发现一个表达BD的结构体融合到Gal4激活域(AD;35 s:: BD:广告)生产的荧光素酶活性3.3倍的增加。而BD:YAB2和BD:YAB5构建体产生的不超过基线荧光素酶活性,BD:FIL和BD:YAB3既激活了“无人飞行系统”:卢克记者,导致荧光素酶活性增加1.8倍(图 2B).这些结果不仅证实了FIL在植物中是一种激活剂,而且还将这种功能扩展到了与之密切相关的YAB3蛋白上。
无性表达YAB蛋白的转录活性。(一个用于反式活化测定的结构物概要。AD: GAL4活化域;BD: GAL4-DNA结合域;YAB,营养表达YABs (FIL, YAB2, YAB3, YAB5);SRDX,压制域(详见正文);UAS: BD结合位点;卢克,萤火虫荧光素酶;rLUC,Renilla.荧光素酶。(B)以Gal4 BD和BD- ad分别作为阴性和阳性对照的YAB转录激活试验。rLuc作为内控,测定每个样品的相对生物发光(Luc/rLuc)。阴影框内的数字表示激活折叠,计算方法是将样本的总Luc活性除以产生的基线值35个年代箴::双相障碍构造。星号表示显著差异(学生t-测试;p < 0.05) and error bars indicate SEM.
FIL激活后的全基因组转录谱分析
为了识别在芽发育过程中受FIL正调控的基因,我们选择了在茎叶中检测全基因组变化拟南芥快速诱导FIL活性后的转录组。表示可诱导形式的FIL (35个年代箴:: FIL:GR)是通过将FIL融合到大鼠糖皮质激素受体(GR;[31])。在没有合成激素地塞米松(DEX)的情况下,这些品系的表型正常,但在有地塞米松的培养基上生长或喷洒地塞米松时,它们产生向下卷曲的上翘叶片,积累了高水平的花青素(图)3.A、B)。这些特征与报道的相似35个年代箴::费尔显示中间过表达表型的行(图3.C;[2])。此外,FIL活性的诱导也与叶abaxialisation相关联,如的DEX处理的近轴表皮细胞路面35个年代箴:: FIL:GR树叶有一个背面的形态,出现更小,更不规则形状比模拟处理叶细胞(图 3.D-F)。当GUS活性来源于yab3-2等位基因,产生背面-受限GUS活性的基因陷阱19],在DEX-生长的叶子的正面域检测yab3-2/35S箴:: FIL:GR植物(比较图3.胃肠道)。FIL的激活:GR也完全抑制了窄叶或针状叶的形成yab在此背景技术激活三重突变体时(图 3.J-L)。
与激素诱导的FIL结构性激活相关的营养表型。(一个,B)35个年代箴:: FIL:GR植物在培养基中生长的无DEX(一个)或DEX(B).插图显示后叶的近距离视图。(C)35个年代箴::费尔显示中间表型的植物。(D-F)扫描电子显微照片显示正面(D,F)或背面(E的成熟叶片)表面35个年代箴:: FIL:GR在不含DEX的培养基上生长的植物(D,E)或DEX(F).(G,HYAB3的组织化学染色:GUS活性yab3-2/35个年代箴:: FIL:GR不含DEX的植物(G)或DEX(H).箭头指示萌发后第一个真叶的GUS活性延长。(我)通过在示出的组织化学染色的叶科(H)由暗场光学观察。箭头表示GUS活性的正面积累。(J-l) 21天费尔yab3 yab5(缩写为fy3y5)三重突变体(J)和fy3y5/35个年代箴:: FIL:GR(K,l)用DEX媒体种植的线条(J,l)或没有DEX (K)。比例尺:1毫米英寸(一个-C,G,H,J-l), 100 μm in (D-F,我).
已经表明,FIL:GR融合是FIL生物没有区别,我们评估了十来天,老厂以下FIL激活芽转录变化:GR。由于植物在短日照条件下生长,茎干组织由成熟的子叶,下胚轴,并在不同的发展阶段大约四个完全出现了叶子。这些措施包括叶经历叶片扩展(第一片真叶),以及树叶才刚刚从地上出现了。虽然不可见,启动器官原基也是这些样品的一部分。RNA从这个组织暴露于DEX或mock处理萃取,并且用于探测Affymetrix公司的基因组ATH1微阵列。Each treatment consisted of four biological replicates with expression being sampled at 4 h and 8 h post-DEX induction. Following normalization of the expression data and comparisons between mock and DEX treated samples, differentially expressed genes were ranked according to their fold change in expression. We considered a gene differentially expressed if there was a 1.5 fold or greater change in expression following DEX treatment, and if this expression difference was associated with a 0.05 or smaller问-Value(请参阅附加文件1查找差异表达基因的列表)。4 h数据集中有上调基因252个,下调基因251个,8 h数据集中有上调基因166个,下调基因184个。其中,219个基因(107个上调/112个下调)在两个数据集中都存在,因此代表了一组在8小时时间内对FIL激活持续响应的基因(a组;附加文件2).第二组基因在8小时差异表达,但在4小时数据集中不存在(B组;附加文件2).因为A组代表了对FIL激活具有强大和一致反应的基因,我们主要关注这一组。
DEX处理后A组表达减少的基因数与表达增加的基因数紧密匹配,提示FIL既是激活因子又是抑制因子。为了确定这两种功能是否与不同的生物过程相关,我们使用基因本体论分析来识别在上调和下调基因集中富集的术语。与生长过程相关的氧化石墨烯术语下调的基因被富集(校正)p-value = 0.088) and responses to auxin (correctedp-value = 0.01),而表达上调的基因在代谢过程相关的术语(生长素生物合成;p-value = 0.0466)、对非生物胁迫(渗透)、生物制剂(真菌、细菌)和化学物质(乙烯、几丁质)等刺激的反应,以及参与侧根形成的多细胞生物过程(p = 0.0864)。基于这一分析,FIL可能通过在某些情况下作为激活体和在其他情况下作为抑制体来调控不同的过程。
以前的研究已经证实YABs促进器官极性和异位fil表达与叶片的部分背面化有关(本研究;[1,2,4,6])。与这一功能一致的是,我们发现了两个定义明确的轴向促进调节因子,KAN1和ARF4,在FIL:GR激活后升高约2倍(表1;附加文件1).令人惊讶的是,ETT/ARF3这是一种具有冗余功能的基因ARF4促进远轴细胞命运[18),和其他侃与背轴型相关的家庭成员(KAN2,KAN3[32,33这表明FIL激活部分而非全部的细胞极性调节因子。
验证微阵列数据
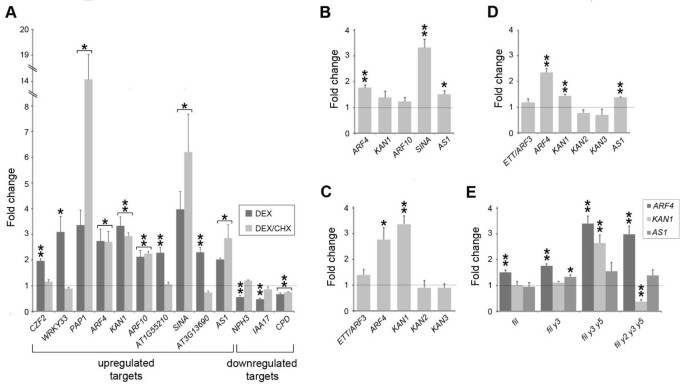
为了验证我们的微阵列数据,选择A组基因在35个年代箴:: FIL:GRshoot tissue exposed to DEX or a mock DEX treatment for 4 h was assessed by quantitative RT-PCR. Included in this group were genes associated with polarity regulation (KAN1,ARF4,AS1)以及与植物蛋白相关的基因(ARF10,IAA7.,NPH3),乙烯反应(ERF5,ERF59)和花青素调控(MYB75/PAP1).除了NAC1., DEX应用后,所有基因表达均有统计学意义的变化,证实了微阵列数据(表)1,图4A).由于在DEX处理4 h后进行了微阵列分析,很可能许多差异表达的基因是FIL的直接下游靶点。在翻译抑制剂环己亚胺(CHX)存在的情况下,通过检测选定的fils靶基因对DEX诱导的响应性来验证这一点。利用诱导性反式激活系统,其中GUS活性由dex诱导性合成转录因子GR-LhG4(缩写为35个年代箴我> > GUS;[34]),我们发现,联合暴露于CHX和DEX是足以抑制GUS活动(见附加文件3.).在确定的CHX治疗效果,接下来我们研究十二A组基因下面结合DEX / CHX曝光的转录反应(在上调的类九三个下调的类)和一个上调B组基因.这些基因中的七个显示在表达下列这些治疗在统计学上显著变化并因此被认为是直接FIL目标(图 4a)。
FIL-反应基因是大部分的立即目标。(一个)对折的FIL反应基因表达的变化在十日龄35个年代箴:: FIL:GRDEX或DEX/CHX处理4 h后的幼苗。括号中显示对两种处理均有显著转录反应的基因,因此标记了FIL的直接靶标。(B)Response of selected positively regulated FIL-response genes in 10 day-oldfil箴:: FIL:GR用地塞米松处理4 h后的幼苗。(C,D)我nduction of abaxial polarity regulators in 10 day-old35个年代箴:: FIL:GR(C)或者35个年代箴:: YAB3:GR(D)。(E)的表达KAN1,ARF4和AS1in.费尔单身,yab双,三,四突变体。使用实时定量RT-PCR确定至少3个生物重复的表达,并首先归一化到一个管家基因,然后模拟处理对照。星号表示由学生的成绩决定的显著差异t-test(1星号,0.01
我们分析的一个复杂因素是FIL:GR表达并不局限于轴向结构域,因此由FIL激活引起的转录变化可能不能反映内源性蛋白的正常行为。为了解决这个问题,我们生成了一个fil箴:: FIL:GR其诱导的FIL活性局限于发育叶片的背面区域。在有DEX的培养基上生长这条线没有导致YAB过表达表型,尽管一些叶片上显着(见附加文件)4).接下来,我们使用定量RT-PCR评估在五个正调控FIL反应基因的转录响应fil箴:: FIL:GR行4小时地塞米松治疗。所有5个基因对诱导均有积极反应,尽管统计上显著升高的只有其中3个:ARF4,新浪和AS1(图4b)。尽管这样调查的有限性,在之间转录响应所观察到的相似性35个年代箴:: FIL:GR和fil箴:: FIL:GR线路表明我们研究中确定的许多内部响应基因确实是菲利亚的即时目标。
来确认侃家庭(KAN2,KAN3)和ARF4有关的基因ETT/ARF3并没有FIL活化反应,我们采用定量RT-PCR法检测其表达35个年代箴:: FIL:GR行4小时地塞米松治疗。与微阵列实验一致,该分析未能检测到这些基因表达的显著变化(图)4C)。我们接下来考虑了菲尔克yab3是否受到监管ARF4,KAN1和AS1.为了测试这种可能性,我们生成了一个诱导因子YAB3线(35个年代箴:: YAB3:GR),并表明在含DEX的培养基上生长诱导了YAB过表达表型(见附加文件4).QRT-PCR显示出显着的升高ARF4,KAN1和AS1接受了地塞米松治疗,但没有ETT/ARF3,KAN2或KAN3(图4D).这一分析不仅表明FIL和YAB3调控相同的靶基因,这与观察到的这些密切的相似谬误之间的冗余一致[2],但也有在本条高度特异性的,因为相关的家人不给YAB感应回应。
突变株中fils极性调节因子的分析
我们的数据表明,FIL,可能还有其他营养YABs,调节ARF4,KAN1和AS1在植物的发展。为了进一步测试这种可能性,我们分析了这些基因在28天龄芽组织中的表达费尔突变体,以及由含有活性营养的逐渐减少补体的突变体的组合YAB基因(费尔yab3,费尔yab3 yab5和yab2 yab3 yab5突变体)。在这个分析中一个复杂的因素是观察到的轴向化yab三倍和四倍突变体[4,这将导致轴向极性调节蛋白的表达升高。与此相一致的是,我们发现两者ARF4和KAN1表达在三重升高yab突变体,ARF4在四重突变体中仍然保持高表达(图4e)。不像ARF4,KAN1表达在四重突变体显著降低,这表明KAN1由YABs直接和正调控。AS1表达式保持不变的倍数yab突变线(图4E), with the exception of费尔yab3突变体中,它显示出轻微的增加。虽然这一分析清楚地表明了YABs在调节KAN1,调节ARF4和AS1大概是涉及的是与YABs冗余功能等因素。
我们的表达研究表明极性调节基因可能存在异位表达KAN1和ARF4以下FIL:GR活化可能是在观察到的极性缺陷的原因35个年代箴:: FIL:GR当持续暴露于DEX时。为了验证这一点,kan1和arf4突变按顺序或一起引入35个年代箴:: FIL:GR背景和它们的表型评估以下连续暴露于DEX。接收DEX处理线中显示的相同的偏上性叶和adaxialisation表型为的35个年代箴:: FIL:GR行(请参阅附加文件5).这表明,与组成YAB活动相关联的表型abaxialisation是多因素叶发育过程中异位表达的结果。
表达式费尔:SRDX诱发yab丧失表型
的ERF-相关联的两亲性阻抑物基序(EAR / SRDX; [35])已用于积极作用的转录因子转化成显性阻遏。因此,以解决YAB功能转录激活的重要性,我们调查组成的影响费尔:SRDX在植物中表达。在进行这些实验之前,我们证实SRDX基元抑制了FIL的激活,在基于植物的反式激活试验中,FIL:SRDX融合不能激活荧光素酶报告基因(图)2b)。
要比较本文的效果:SRDX表达到FIL的表达,植物用A转换35个年代箴:: FIL:SRDX或35个年代箴::费尔构造。而5535个年代箴::费尔在Basta处理后回收原发转化子,同样的选择只产生一个35个年代箴:: FIL:SRDX转化。这家工厂有一个野生型的外观,这表明费尔:SRDX转基因不可能是活跃在这条线。由于故障隔离转基因植物的显著的数字,我们认为胚胎或早期苗的活动费尔:SRDX转基因很可能与杀伤力关联。为了解决这个问题,我们使用了GR:LhG4 / POP激活系统的驱动胚胎后表达fil转基因产品(35个年代箴:: GR:LHG4/ pOP :: FIL;缩写为35个年代箴我> >费尔).生长35个年代箴我> >费尔DEX作用下的株系产生的子叶上倾表型与DEX作用下的株系相同35S :: FIL:GR暴露于DEX的线(图5A、B与图比较3.B),尽管随后的叶片发育表现出较弱的表型,即使DEX浓度增加了一倍(数据未显示)。相反,在早期阶段35个年代箴我> >费尔:SRDX图上与DEX培养基上生长的特点是窄,向上卷边,hyponastic子叶和叶的发育( 5C, D)。事实上,这种表现型不同于与体质相关的表现型fil表达是用FIL一致:SRDX不再作为活化剂起作用。
诱导表型显性负费尔:SRDX构造。(一个,B)35个年代箴我> >费尔在不含DEX的培养基上生长的植物(一个)或DEX(B).(C,D)35个年代箴我> >费尔:SRDX在不含DEX的培养基上生长的植物(C)或DEX(D).(E)费尔yab3/fil箴::费尔植物显示全互补。插入:费尔yab3双突变体植物。(F)费尔yab3/fil箴:: FIL:SRDX幼苗显示狭窄的子叶,有时分叉(星号)。子叶的费尔yab3(G)和费尔yab3 yab5突变体苗(H).(我)费尔yab3/fil箴:: FIL:SRDX工厂用针状树叶。(J)费尔yab3 yab5三种突变植物,有狭窄和针状的叶子。(KYAB3:GUS活性的组织化学染色费尔yab3/fil箴:: FIL:SRDX工厂。YAB3启动子活性在整个年轻径向叶片检测。插入:费尔yab3/fil箴::费尔染色检测GUS活性。(l)费尔/+YAB3/fil箴:: FIL:SRDX工厂用费尔yab3突变体叶片表型。(米-R扫描电镜图显示野生型的下表皮(米),费尔yab3(N),费尔yab3费尔箴::费尔(O)和费尔/+YAB3/fil箴:: FIL:SRDX(P树叶)。(N,P)是由于叶片正面化。(问,R)表示SEM的表皮细胞形态费尔yab3 yab5树叶(针问)和那些费尔yab3/fil箴:: FIL:SRDX植物(R).比例尺直径为5毫米(E,l),并插入(一个);2毫米(一个-D,F-H);1毫米(我,J);200 μm用于(K),并插入(K);100 μm in (米-R).
与之前使用SRDX聚变的实验相比[36,37],这个基序的存在并不足以引起强烈的功能缺失表型35个年代箴我> >费尔:SRDX线条。这可能是由于FIL水平:SRDX不是足够高,与本地FIL / YAB3蛋白的活性干涉。为了解决这个问题,我们引入了一个fil箴:: FIL:SRDX构造成YAB3这是杂合突变费尔突变(费尔/+YAB3),并分析转基因植株的表型费尔yab3突变体在随后的产生。至于这些实验对照,我们首先表明,fil箴::费尔补充了费尔yab3突变表型(n = 19;图5e)。没有fil箴:: FIL:SRDX行补充费尔yab3phenotype, instead, the majority (n = 19/30) had cotyledons that were noticeably smaller than those of费尔yab3突变体,和费尔yab3 yab5,显示频繁的分叉(图 5F-H)。叶子长出一半以上费尔yab3/fil箴:: FIL:SRDX行(n = 13/19)在外观上与费尔yab3 yab5突变体叶片呈放射状且极短(图5I,J;[4])。YAB3的存在:在这些线路的发育的叶GUS活性表明,这些器官被部分或完全abaxialised(图 5在这种轴向表型最普遍的株系中(n = 6/13),转基因费尔/+YAB3兄弟姐妹也有一个费尔yab3叶表型(图5l),与FIL一致:SRDX代理占据抑制本机FIL活动。
叶表皮细胞形态分析证实了这一点fil箴::费尔补充了极性缺陷费尔yab3突变体,如背面细胞显示野生型形态(图5M-O)。相比之下,费尔/+YAB3/fil箴:: FIL:SRDX细胞对的部分adaxialised细胞更大并且比野生型细胞背面少不规则和类似的在外观上费尔yab3突变体(图 5N,P)。事实上,SEM分析费尔yab3/fil箴:: FIL:SRDX针状的叶子显示出椭圆形和锯齿状细胞的混合物;完全相同的细胞形态观察费尔yab3 yab5三重突变叶片(图5Q, R;[4])。综上所述,这些实验表明,通过融合SRDX来逆转FIL的转录活性导致了强的yab在缺乏天然FIL/YAB3活性的植物中表达时,表现为功能缺失表型。对这种表型的一个合理解释是,FIL:SRDX蛋白主要通过阻止YAB2和YAB5激活它们的靶标来发挥作用。因此,本实验首次提供了YABs在叶片发育早期起激活作用的直接证据。
讨论
基于早期研究表明,YABs与植物Gro-like家族的转录辅助抑制子具有物理和遗传相互作用,我们认为YABs具有转录抑制子的功能[4,23].然而,遗传分析表明,YABs独立于这些共压缩机执行其功能。例如,具有显着的丧失关于的Adaxial细胞标识特性yab三倍或四倍突变体在缺乏共抑制活性的品系中看不到,在单或双突变体中也看不到yab突变体与突变体结合在一起耳舌和luh.共阻遏[10,23].在这项研究中,我们调查了营养YABs的调节活性,发现在酵母基础的转录和植物反转录试验中,FIL作为一个激活剂。这一特性可能与YAB3密切相关,但似乎与YAB2和YAB5无关。对胚珠特异性YAB (INO)的分析表明,该因子也具有激活因子的功能,尽管在这种情况下只研究了自动调节[8,38].这一结论是根据观察得出的伊诺成绩单和活动伊诺启动子:报告基因结构强减弱伊诺突变体。
我们的微阵列分析也提供了FIL作为激活剂的直接证据,在dex诱导激活后4 h和8 h评估了基因表达的变化。在已鉴定的应答基因中,约有一半处于正调控,其余处于负调控。随后结合CHX处理的qRT-PCR分析证实,检测的基因中有一半确实可能是fil的直接靶点。建立转录因子是否作为激活因子的一种越来越普遍的方法是通过与SRDX基序融合将其转化为抑制因子,然后表明该嵌合蛋白在表达时产生显性阴性表型在足底.而FIL:SRDX在野生型植物中没有表达yab叶片功能缺失、明显的叶型和生长缺陷费尔yab3突变体的背景。这表明,天然的FIL和YAB3蛋白可能通过竞争靶标结合位点来抑制FIL:SRDX的抑制活性,因为FIL和YAB3都在发育叶片的轴向区域高水平表达。在没有竞争的FIL/YAB3的情况下,FIL:SRDX构成性地抑制由剩余的营养YABs正常激活的基因。这说明这四种营养YABs在叶片发育的早期都起着激活剂的作用。而这与观察到的YAB家族成员之间的功能冗余一致[2,4,6,我们的分析没有显示与YAB2或YAB5相关的激活活性(图)1和2).这可能反映了我们的酵母和反式活化试验的相对不敏感性,或者,也可能是对作为激活剂的yab相互作用蛋白的需求。
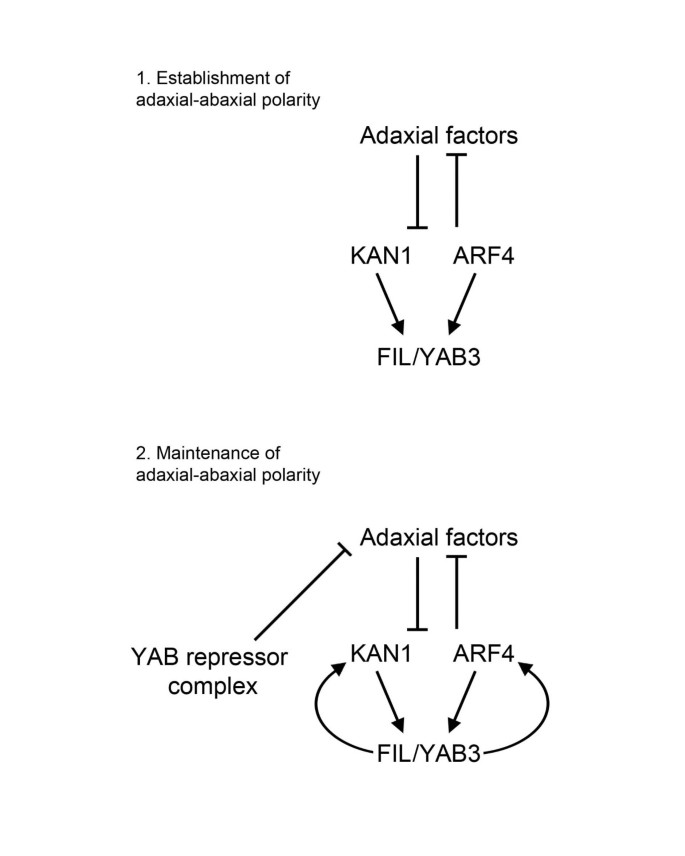
在动物中有报道称转录因子既是激活因子又是抑制因子[39在植物中也有一些例子。例如,分生组织调节器WUSCHEL被激活无性生殖的(AG))花分生组织中的表达[40,但压制了a型拟南芥响应调节器7.(ARR7)在茎顶分生组织中[41].广泛的功能表征已经证实了WUS的双重性,以及表明该活动适用于更多基因[29,42].双功能活性也是与衰老相关的WRKY53因子的一个特征,它根据靶基因启动子中存在的wrky结合基序(W-box)周围的序列作为激活或抑制因子[27].在我们的研究结果的基础上,我们提出了一个模型,其中YABs是双功能,作用无论是作为当LUG和LUH相关的激活剂,或作为阻遏(图 6).
我们的研究中的一个新颖方面是,发现远轴极性调节剂KAN1和ARF4很可能是直接FIL目标。这是由观察到的增加支持KAN1和ARF4在表达35个年代箴:: FIL:GR植物以下组合DEX / CHX治疗。此外,寻找降低KAN1在表达yab四倍突变说明了这一点KAN1调节是其他营养yab的共同特征。相比KAN1,ARF4表达在所有升高yab突变背景检查。这一发现令人惊讶,因为FIL对ARF4.先前的研究的yab突变体已经建立的是,除了叶图案化缺陷,这些系缺乏托叶,显示生长迟缓,并具有在分生组织活性缺陷[4,6].yab突变体在生长素调控的过程中也表现出缺陷,如维管模式和叶缘的形成,并降低了生长素反应报告的活性DR5[6].鉴于此,有可能增加ARF4表达式中观察到yab突变体是肺炎的结果,这使得这掩盖了YABS在调节方面所扮演的作用ARF4.
FIL调控的观察KAN1和ARF4考虑到之前的研究将YABs置于此类监管机构的下游,这也令人惊讶。例如,fil在显影横向器官原基[建立近轴-背面图案化后表达发生43,它本身依赖于C3之间的拮抗作用HD-ZIP探头和侃基因(15,32].因此,侃活动很可能先于YABs的活动,YABs的层次结构被观察到的减少进一步支持fil/YAB3在发育中的叶中的表达菅直人双突变体[15,33].相似地,ARF4和相关的摘要/ ARF3基因被认为在YABs上游起作用[44].如果假设在建立adaxial-aaxial图案后,我们的发现可以与这些附带调节器下游的Yabs进行调整。这种情景是有吸引力的,激活KAN1和ARF4遵循器官模式将产生一个正反馈循环,保持轴向特性(见图)6).这种模型的一个重要试验是为了确定是否表达侃S和C3HD-ZIPs的初始极化的器官原基yab四倍的突变体。这可以通过活细胞成像来监测侃和C3HD-ZIP在侧器官发育早期阶段的表达。我们模型的另一个方面是LUG-YAB调节复合物在叶子的早期模式中所起的作用。虽然我们的微阵列分析没有识别出任何已知的由FIL负调控的正面调控因子,但之前的研究已经表明了这一点凸耳突变体增强的正面表型费尔yab3突变的叶子[4].因此,我们建议凸耳YAB调控复合物参与了正面的监管者的镇压,虽然这是否通过直接或间接的调控,仍有待确定介导的。什么是当前从这个模型缺少的是这些转录活动的时空分布的理解。例如,可以抑制和活化发生在相同的细胞,或者它们在空间上分离的活动?发展茶叶中确定正向和负向调控YAB靶基因的表达模式可能有助于解决这些问题。此外,发育的叶细胞内建立LUG-YAB复杂的精确分布也将提供洞察营养YABs的可能转录活性。虽然在技术上具有挑战性,这可以利用来实现在足底BRET测量(45].
激活KAN1,ARF4和AS1由FIL和YAB3最近被集成到一个计算衍生的萼片模式模型中[11].除了AS1,包括这些调节关系产生了一个与其他已知模式通路相一致的模型。的不一致AS1监管涉及到对…的明显限制AS1在正在发育的萼片的正面区域表达,在那里FIL可能不起作用。然而,仔细观察AS1Sepals中的表达域显示出它与之重叠fil期间的器官形成的早期阶段。因此,FIL调节AS1也可以纳入这个模型,如果它是假定也有正面因素促进AS1抑制的表达和外部因素AS1花萼发育后期的表达[11].
生长素分布在受影响yab功能突变体的缺失,导致发育叶片边缘区域的破坏,以及胚胎发生过程中多子叶的形成[6].如何YABs规范在发展叶片还不是很清楚生长素分布,但可能反映生长素生物合成,运动或信号的作用。我们的研究证实了YABs和生长素反应之间的联系,因为许多基因响应FIL激活有任何生长素应答或生物合成相关的GO术语。此外,我们表明,ARF4和ARF10受FIL正调控,可能影响叶片细胞对生长素的敏感性。然而,生长素相关的缺陷不太可能yab突变体是由于活性降低ARF4,原样ARF4三倍体和四倍体表达升高yab突变体,推测作为与营养YAB活性的丧失相关联的abaxialisation的结果。相反,我们建议YABs中介生长素信号或者通过与ARFs直接关联,或者更可能作为监管复杂的部分。支持这种可能性的证据表明,一些ARFs与LUG监管复杂的组件(交互。46]和我们的未公开的数据),因此可以与也这些复合物的一部分的YABs间接地相关联。
结论
这项研究表明,FIL是一种双功能转录因子,既可以作为激活因子,也可以作为抑制因子。我们的研究发现,FIL转化为专性阻遏因子导致yab在植物中表达的功能缺失表型提供了直接的证据,表明激活是叶片模式形成所必需的。与这一发现相一致的是,FIL可能作为一个直接激活的轴向促进因子KAN1和ARF4,也是正面调节AS1.基于这些结果,我们认为FIL产生了正反馈回路,维持了叶原基初始极化后的近轴-背面极性。因此,该研究为进一步了解YAB的功能提供了重要的新见解,也为进一步研究这些神秘的转录因子奠定了基础。
方法
植物材料及生长条件
拟南芥蒂利亚纳野生型分别为哥伦比亚(Col)和兰兹伯格(Landsberg)erecta(L呃).使用产生的所有转基因植物农杆菌浸花法[47]和鉴定治疗BASTA的转基因株系。类固醇诱导fil构造35个年代箴:: FIL:GR,35个年代箴::费尔和35个年代箴:: FIL:SRDX被引入到植物中。pOP:费尔和pOP :: FIL:SRDX将构建体引入诱导物中35个年代箴:: GR:LHG4司机线(34Miltos Tsiantis(英国牛津大学)好心提供的。fil箴::费尔或fil箴:: FIL:SRDX被引入到yab3-2突变体植株分离fil-8,和转基因FIL-8 yab3-2在T1群体和T2群体中进行PCR分型。由于种族隔离,fil-8在一些转基因T1植株中缺失。这些线被回交到FIL-8 yab3-2双突变体,FIL-8 yab3-2在随后的种群中确定的后代。
将激素诱导的FIL转基因基因导入多种基因中yab突变体的背景,已在任一A L先前描述的和是呃L或混合呃/坳呃背景(4,19].为了最大限度地减少的影响呃和背景变异,我们对10个野生型的F2或F3植物进行了特征分析erecta..的存在yab等位基因突变和转基因是通过PCR基因分型确认。当35个年代箴:: FIL:GR转基因系也被杂交kan1-12和arf4-3突变体(16,48]这是由Scott Poethig(宾夕法尼亚大学)友情提供。纯合突变体F2系通过PCR基因分型鉴定。所有PCR基因分型的详情,可根据要求提供。
Plants were either grown on soil or on 0.5x Murashige and Skoog media, in a growth room at 18°C or growth cabinet kept at 21°C, under lights for 8 h (short days) or 16 h (long days). For DEX induction, plants were grown on media containing 10 μM DEX/0.1% DMSO or media containing 0.1% DMSO for mock treatment. Alternatively, DEX-induction was performed on soil grown plants. In this case, DEX treatment involved spraying plants with a 20 μM DEX solution containing 0.2% ethanol and 0.05% Silwet L-77 every 2–3 days, or with a solution of 0.2% ethanol and 0.05% Silwet L-77 for mock treatments. In addition to spraying, plants receiving a DEX treatment were watered with a 20 μM DEX/0.2% ethanol solution.
构造
为了产生35个年代箴:: FIL:GR构造,fil使用FIL-F3和FIL-R1.1引物从野生型花序cDNA中扩增编码序列(参见附加文件6)和高保真Taq聚合酶(Kod HiFi;Novagen)。的存在Xba我和Bam这些引物中的HI位点允许产物克隆到pBIΔGR的等效位点,pBIΔGR是一个包含花椰菜花叶病毒下游大鼠糖皮质激素受体(GR)配体结合域的二进制载体35个年代(由Robert Sablowski, John Innes Centre提供)。结果,在帧内融合了GR域fil糖基。35个年代箴::费尔通过扩增产生的fil用引物cFIL-KpnI和Fil R-X编码序列(见附加文件6),并将该产品克隆到SMA我和XbaI位点位于35个年代载体pART7的章鱼素合成酶基因启动子和3 ' UTR [49].35个年代箴:: FIL:SRDX是由放大产生的fil用cFIL-KpnI和FILR1.1引物进行编码序列克隆Kpn我和Bam含有12个氨基酸合成erf相关的两亲性抑制基元的穿梭载体BJ36-SRDX的HI位点。[35])。这将SRDX域置于框架与c端端fil编码序列。该FIL:SRDX聚变然后移动到Kpn我和Xba第7部分的位置。当fil箴::费尔构造是通过放置3.8 kbfil推动者[50],从与PFIL-XhoI位和PFIL-KpnI位山口基因组DNA扩增(见附加文件6),到Xho我和Kpn我网站的上游filORF在穿梭载体BJ36。类似的方法也被用来生成fil箴:: FIL:SRDX构造。
fil从pART7和BJ36中截取的磁带不我和引入不二进制矢量pMLBART的I位点[49].然后被引入二进制文件根癌土壤杆菌通过电穿孔(GV3101)。
酵母实验
的编码序列克PROL和AmYAB2从扩增金鱼草利用高保真Taq聚合酶和引物结合的营养cDNA生态RI位点(见附加文件6).当YAB然后序列克隆入生态所述PGBK-T7载体(Clontech),导致编码序列是的并与Gal4的DNA结合基序(BD)帧下游RI位点。将构建体转移到酵母和嵌合BD-YAB蛋白根据公开的方案使用X-α-Gal的基于板的比色测定评估的转录活性。
在活的有机体内植物transactivation化验
为了产生Gal4 BD融合,编码序列fil,费尔:SRDX,YAB2,YAB3和YAB5用附加文件中列出的寡核苷酸扩增6使用高保真度Taq。PCR产物插入SMA矢量pMN6的我的网站[51]、屋宇署下游及35个年代启动子。这导致BD在框架内融合到一个丙氨酸连接器(AAAARS),并被纳入到n端YAB通过PCR编码序列。对于反式激活实验,pMN6单独用作阴性对照,而同时含有由所驱动的GAL4激活(AD)和DNA结合结构域(AD-BD)的载体35个年代启动子(pMN7;[51)作为阳性对照。向量包含Renilla.在荧光素酶(rLUC)基因的控制下35个年代使用促进剂(PRLC)作为内标,转移报告称为PGLL,载体与融合到最小促进剂的多个GAL4 UA下游的萤火虫LUC基因的载体[51].将4微克BD-YAB构建物与萤火虫LUC报告物(1:1质量比)的混合物与0.5 μg内标一起注入成熟体的背面拟南芥根据制造商的建议(BioRad),使用粒子轰击树叶。将轰击后的组织置于0.5 × MS板上光照24 h,然后将蛋白提取到1x荧光素酶细胞培养裂解试剂(Promega)中,其中含有蛋白酶抑制剂(Roche)。在20 μl提取液中加入80 μl荧光素酶细胞培养试剂、蛋白酶抑制剂、0.1 mM EDTA、20 mM Tricine、27 mM MgSO检测LUC活性4, 33 mM DTT, 270 μM CoA, 530 μM ATP和546 nM荧光素。在另一项试验中,在标准磷酸盐缓冲液中加入腔肠拉嗪(Promega)后测定rLUC活性。用密特拉LB940多模酶标仪对三次轰炸进行了光度分析,并重复了三次。
微阵列分析
对于涉及DEX诱导,十日龄四个池实验35个年代箴:: FIL:GR用含10 μM DEX、0.1%乙醇和0.015% Silwet L77的溶液(DEX处理)或含0.1%乙醇和0.015% Silwet L77的溶液(模拟处理)喷洒幼苗,于4 h或8 h收集。使用Plant RNeasy Mini Kit (Qiagen)从幼苗池中提取RNA。根据AtGenExpress协议,在每个样本使用300 ng总RNA进行探针合成之前,通过琼脂糖凝胶电泳确认RNA的完整性[52].Affymetrix ATH1基因组阵列随后使用基因芯片流体站进行杂交和洗涤,并使用基因芯片扫描仪3000进行扫描。扫描数据使用genspring GX软件包(安捷伦)进行处理。采用GC-Robust多阵列平均法分析CEL文件,该方法包含背景减法、归一化和探针求和。一个未配对的学生的t用本杰明-Hochberg的错误发现率校正测试施加到数据以获得问- 值(校正p-value基于错误发现率p= 0.05)。
实时定量RT-PCR
对于DEX诱导,4个独立的10日龄转基因植株池分别接受模拟或上文所述的DEX处理。在DEX/CHX处理中,转基因植株先喷施0.015% Silwet L77中的10 μg/μl环己亚胺溶液,待1 h后再喷施或同时喷施10 μg/μl环己亚胺和10 μM DEX溶液。这些处理后4小时收获植株,使用RNeasy试剂盒(Qiagen)提取RNA。进行分析的yab突变体,28日龄(短日生长)野生型(L呃)植物和yab收集突变体和RNA提取。总RNA使用用Superscript III逆转录酶(Invitrogen)中的寡聚(dT)引物合成cDNA前用DNA酶(Ambion)中的第一处理。PCR反应在SYBR绿色的存在上使用转子 - 基因3200实时循环仪(Corbett Research公司)进行actin2.(ACT2;AT3g18780),TUBULIN7(TUB7;At2g29550)或翻译控制的肿瘤蛋白(TCTP;At3g16640)作为内务控制。表达水平首先归一化到常规对照,然后归一化到模拟处理(DEX或DEX/CHX处理),或者归一化到野生型植物(DEX/CHX处理)yab突变体。用于qRT-PCR的寡核苷酸列在附加文件中6.
显微镜
叶片表面的成像是在环境扫描电子显微镜(FEI Quanta)上进行的,该显微镜配备了在2°C操作的Peltier冷阶段。叶片样品在12.5Kv加速电压和5.3托尔真空条件下,用碳胶粘接在树桩上观察。GUS染色是通过将组织短暂固定在90%丙酮中,然后在37℃下将组织置于含有X-Gluc、铁氰化钾和亚铁氰化物混合物的50 mM磷酸盐缓冲液中过夜。在将组织切片至8 μm并在暗场光学下观察之前,将组织作为整个支架在70%乙醇中检查或嵌入Paraplast Plus中。
生物信息学
登录代码E-MEXP-3726可用于从ArrayExpress网站(http://www.ebi.ac.uk/arrayexpress/).
参考
- 1.
萨瓦S,渡边K,后藤钾,刘YG,柴田d,金屋E,森田EH,冈田K:丝状花,拟南芥的分生组织和器官身份基因,编码与锌指和HMG-相关领域的蛋白质。基因开发。1999年,13:一〇七九年至1088年。10.1101 / gad.13.9.1079。
- 2.
Siegfried KR, Eshed Y, Baum S, Otsuga D, Drews GN, Bowman JL: YABBY基因家族成员在拟南芥中决定了细胞的轴向命运。发展。1999,126:4117-4128。
- 3.
Kanaya E, Watanabe K, Nakajima N, Okada K, Shimura Y:拟南芥丝状花蛋白CH2C6锌指结构域的锌释放诱导自组装。中国生物医学工程学报。2001,27(3):483 - 489。10.1074 / jbc.M009491200。
- 4.
Stahle MI,KuehlichĴ,斯塔龙L,冯阿尼姆AG,Golz JF:YABBYs和转录辅阻遏物和LEUNIG保持LEUNIG_HOMOLOG在拟南芥叶极性和分生组织活性。植物细胞。2009年,21:3105-3118。10.1105 / tpc.109.070458。
- 5.
金屋E,中岛N,冈田K:非序列特异性DNA由来自拟南芥的FILAMENTOUS FLOWER蛋白结合被EDTA降低。J Biol Chem。2002年,277:11957-11964。10.1074 / jbc.M108889200。
- 6.
利用YABBY技术对拟南芥幼苗和叶片进行鉴别。acta botanica sinica(云南植物研究),2010,28(4):593 - 598。10.1105 / tpc.110.075853。
- 7.
Bowman JL, Smyth DR: CRABS CLAW,一个调控拟南芥心皮和蜜腺发育的基因,编码了一个具有锌指和螺旋-环-螺旋结构域的新蛋白质。发展。1999,126:2387-2396。
- 8.
Villanueva JM, Broadhvest J, Hauser BA, Meister RJ, Schneitz K, Gasser CS: INNER NO OUTER调控拟南芥胚珠的轴向-轴向模式。基因工程学报,1999,13:3160-3169。10.1101 / gad.13.23.3160。
- 9.
Eshed Y,鲍姆SF,鲍曼JL:不同的机制促进拟南芥心皮极性建立。细胞。1999年,99:199-209。10.1016 / S0092-8674(00)81651-7。
- 10.
Golz JF,Roccaro男,Kuzoff R,哈德森答:禾叶促进金鱼草叶片的生长和极性。发展。2004年,131:3661-3670。10.1242 / dev.01221。
- 11.
拟南芥萼片原基极性的数据驱动整合模型。acta botanica sinica, 2017, 36(4): 497 - 503。10.1105 / tpc.111.092619。
- 12.
郭敏,陈志强,陈志强,等:植物叶片极性的建立:小分子rna在茎尖位置信号中的作用。发展。2007,134:813-823。10.1242 / dev.000497。
- 13.
Iwakawa H, Iwasaki M, Kojima S, Ueno Y, Soma T, Tanaka H, Semiarti E, Machida Y, Machida C:拟南芥叶片正面结构域非对称LEAVES2基因的表达抑制了该结构域的细胞增殖,并对叶片的正常发育至关重要。acta botanica sinica(云南植物学报),2017,51(6):643 - 648。10.1111 / j.1365 - 313 x.2007.03132.x。
- 14.
李国强,李国强:拟南芥叶片极性与分生组织的形成。发展。1998,125:2935-2942。
- 15.
Emery JF,Floyd Sk,Alvarez J,Eshed Y,Hawker NP,Izhaki A,Baum SF,Bowman JL:征询III类HD-ZIP和Kanadi基因征区拟南芥射击。Curr Biol。2003,13:1768-1774。10.1016 / J.Cub.2003.09.035。
- 16.
Kerstetter RA, Bollman K, Taylor RA, Bomblies K, Poethig RS: KANADI调节拟南芥器官极性。自然科学学报。2001,11:706-709。10.1038 / 35079629。
- 17.
麦康奈尔JR,金刚砂JF,Eshed Y,宝N,鲍曼Ĵ,巴顿MK:在确定在枝条径向构图PHABULOSA和PHAVOLUTA的作用。自然。2001年,411:709-713。10.1038 / 35079635。
- 18.
植物生长素响应因子通过调节拟南芥KANADI活性介导拟南芥器官不对称。acta botanica sinica, 2017, 36(5): 497 - 503。10.1105 / tpc.105.034876。
- 19.
YABBY极性基因介导了拟南芥KNOX同源盒基因的抑制。acta botanica sinica(云南植物研究),2002,14(4):457 - 461。10.1105 / tpc.004911。
- 20。
Goldshmidt A,Alvarez的JP,鲍曼JL,Eshed Y:从YABBY基因活动器官原基导出的信号调节生长和拟南芥枝条顶端分生组织的分割。植物细胞。2008年,20:1217年至1230年。10.1105 / tpc.107.057877。
- 21.
Lugassi N,Nakayama N,Bochnik R,Zik M:丝状花的新等位基因揭示了对花序和花卉营业组织和花生发生之间的联系的新见解。BMC植物BIOL。2010,10:131.101186 / 1471-2229-10-131。
- 22.
田中W,Toriba T,大森Y,吉田A,川井A,真山-土田T,市川H,满田N,奥默-高木男,平野HY:本YABBY基因TONGARI-BOUSHI1参与横向器官发育和分生组织的维护组织在水稻小穗。植物细胞。2012年,24:80-95。10.1105 / tpc.111.094797。
- 23.
纳瓦罗C,Efremova N,Golz JF,鲁别拉R,Kuckenberg男,卡斯蒂略R,Tietz O,Saedler H,施瓦茨 - Sommer的Z:分子和金鱼草中营养生长和生殖发育的控制榄和禾叶之间的遗传相互作用。发展。2004年,131:3649-3659。10.1242 / dev.01205。
- 24.
Groucho/Tup1共抑制因子在植物生长发育中的作用。植物学报,2012,27(7):86-92。10.4161 / psb.7.1.18377。
- 25.
Hickman MJ, Winston F:血红素水平在转录激活因子和转录抑制因子之间切换酿酒酵母Hap1的功能。中国生物医学工程学报。2007,27(4):491 - 498。10.1128 / MCB.00887-07。
- 26.
酵母抑制因子Rfx1/Crt1的分子遗传分析揭示了一种新的两步调控机制。中国生物医学工程学报。2005,25(6):739 - 743。10.1128 / mcb.25.17.7399 - 7411.2005。
- 27.
苗Y,洗衣机。T,齐默尔曼P,Zentgraf酒店U:在WRKY53转录因子在拟南芥叶片衰老过程中的作用的目标。植物mol biol。2004年,55:853-867。
- 28.
冈萨雷斯拉莫思R,博伊尔P,Dulude A,罗伊V,Lezin-Doumbou C,考尔GS,Bouarab K,德普雷C,布里松N:转录激活PTI4需要一个repressosome的在马铃薯通过阻遏SEBF核招募PR-10A基因。植物细胞。2008年,20:3136-3147。10.1105 / tpc.108.061721。
- 29.
池田男,满田N,奥默-高木L:拟南芥WUSCHEL是双功能转录因子充当在干细胞调控的阻遏和作为活化剂的花卉图案。植物细胞。2009年,21:3493-3505。10.1105 / tpc.109.069997。
- 30。
Peaucelle A, Louvet R, Johansen JN, Salsac F, Morin H, Fournet F, Belcram K, Gillet F, Hofte H, Laufs P,等:转录因子BELLRINGER通过调控一种果胶甲基酯酶的表达来调控叶序性。发展。2011,138:4733-4741。10.1242 / dev.072496。
- 31。
加卢瓦JL,伍德沃德C,雷迪GV,Sablowski R:联合SHOOT MERISTEMLESS和WUSCHEL触发异位器官在拟南芥。发展。2002年,129:3207-3217。
- 32.
刘志强,刘志强,刘志强,等:植物侧位器官极性的建立。中国生物医学工程学报。2001,11:1251-1260。10.1016 / s0960 - 9822 (01) 00392 - x。
- 33.
关键词:拟南芥,KANADI, YABBY,叶片发育发展。2004,131:2997-3006。10.1242 / dev.01186。
- 34.
工艺Ĵ,Samalova男,Baroux C,汤利H,Martinez的A,杰普森I,Tsiantis男,摩尔I:新的弹出/ LhG4向量在拟南芥严格糖皮质激素依赖性的转基因表达。植物杂志。2005年,41:899-918。10.1111 / j.1365-313X.2005.02342.x。
- 35.
Hiratsu K, Matsui K, Koyama T, Ohme-Takagi M:拟南芥中包含抑制域EAR基序的嵌合抑制子对靶基因的显性抑制。植物学报。2003,34:733-739。10.1046 / j.1365 - 313 x.2003.01759.x。
- 36.
转录抑制因子ARR1-SRDX抑制拟南芥多效细胞分裂素的活性。植物营养与肥料学报。2008,31(4):457 - 461。10.1104 / pp.107.115436。
- 37.
在拟南芥中,TCP转录因子通过负调控边界特异性基因的表达来控制茎侧器官的形态。植物营养与肥料学报。2007,19(4):481 -484。10.1105 / tpc.106.044792。
- 38.
Meister RJ, Kotow LM, Gasser CS:超人减弱了拟南芥胚珠外部被毛的极性发育。发展。2002,129:4281-4289。
- 39.
Adkins NL,Hagerman Ta,Georgel P:Gaga蛋白:多面转录因子。生物切菜细胞生物。2006,84:559-567。10.1139 / o06-062。
- 40。
陈志强,陈志强,陈志强,等:拟南芥干细胞调控与花模式的分子联系。细胞。2001,105:793-803。10.1016 / s0092 - 8674(01) 00384 - 1。
- 41。
Leibfried A,为了JP,布施W,Stehling S,Kehle A,德马尔男,基贝尔JJ,罗曼JU:WUSCHEL控制由细胞分裂素诱导型反应调节直接调节分生组织的功能。自然。2005年,438:1172-1175。10.1038 / nature04270。
- 42。
Busch W, Miotk A, Ariel FD, Zhao Z, Forner J, Daum G, Suzaki T, Schuster C, Schultheiss SJ, Leibfried A, et al .:一种植物干细胞生态位的转录调控。细胞发育。2010年,18:849 - 861。
- 43。
海斯勒MG,大野C,达斯P,锡伯P,雷迪GV,龙JA,迈耶罗维茨EM:原基发育过程中生长素运输和基因表达模式揭示的拟南芥花序分生组织实时成像。Curr Biol。2005,15:1899-1911。10.1016 / j.cub.2005.09.052。
- 44。
加西亚d,庄SA,拜恩ME,Martienssen RA:经由所述反式作用siRNA的途径在拟南芥叶极性的规格。Curr Biol。2006年,16:933-938。10.1016 / j.cub.2006.03.064。
- 45.
Xu X, Soutto M, Xie Q, Servick S, Subramanian C, von Arnim AG, Johnson CH:在植物和哺乳动物细胞和组织中蛋白质与生物发光共振能量转移(BRET)的相互作用。美国国家科学院学报。2007年,104:10264 - 10269。10.1073 / pnas.0701987104。
- 46.
SEUSS在植物生长素反应和花器官模式中的作用。发展。2004,131:4697-4707。10.1242 / dev.01306。
- 47.
花浸法:农杆菌介导的拟南芥转化的简化方法。植物学报1998,16:735-743。10.1046 / j.1365 - 313 x.1998.00343.x。
- 48.
在拟南芥中,反式sirna介导的ETTIN和ARF4抑制调控了异胚性。发展。2006,133:2973-2981。10.1242 / dev.02491。
- 49.
Gleave AP:一种具有T-DNA组织结构的多功能二元载体系统,有助于将克隆的DNA有效地整合到植物基因组中。植物营养与肥料学报。1992,20(3):492 - 498。10.1007 / BF00028910。
- 50。
Watanabe K, Okada K:两个离散的顺式元件控制拟南芥丝状花基因的双轴侧特异性表达。acta botanica sinica, 2017, 36(5): 592- 598。10.1105 / tpc.015214。
- 51。
光感受器光敏色素B的核转运是其在幼苗光形态建成中的生物学功能所必需的。植物学报2003,35:660-664。10.1046 / j.1365 - 313 x.2003.01836.x。
- 52。
Schmid M, Davison TS, Henz SR, Pape UJ, Demar M, Vingron M, Scholkopf B, Weigel D, Lohmann JU:拟南芥发育的基因表达图谱。王志强。2005,37:501-506。10.1038 / ng1543。
确认
作者希望承认莎拉谢森,马尼西斯索和吉亚纳罗马在维护植物线和罗杰窗帘的帮助下,寻求帮助。我们还要感谢Chris Cobbett,Michael Hynes和Golz Lab的成员,用于批评稿件。艾丽莎白和弗农·普齐研究生奖学金支持果冻。这项工作得到了ARC Discovery Grant(JFG)的支持。
作者信息
隶属关系
相应的作者
附加信息
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
作者的贡献
OB进行微阵列分析,并与JEL一起,通过qRT-PCR定量表达fil应答基因。LP制作酵母结构,并与JEL一起进行酵母检测,观察其转录活性金鱼草属植物和拟南芥YABs。CPS监督基于植物的反式激活和DEX/CHX qRT-PCR分析,并起草了手稿的部分。JFG产生了所有的转基因植物,监督了这项研究,并撰写了手稿。所有作者阅读并批准了最终的手稿。
Oliver Bonaccorso, Joanne E Lee对这项工作也做出了同样的贡献。
电子辅料
微阵列分析
额外的文件1:35个年代箴:: FIL:GR地塞米松处理后的幼苗。此文件包含被确定为的茎干组织被差异表达的基因的清单35个年代箴:: FIL:GRDEX暴露4小时或8小时。(XLSX 124 KB)
12870_2012_1162_MOESM2_ESM.xlsx
附加文件2:地塞米松治疗后4小时和8小时或地塞米松治疗后8小时表达差异的fil -应答基因。这个文件包含了被分成两组的基因列表。A组基因在地塞米松处理后4 h和8 h有差异表达,而B组基因在地塞米松处理后8 h有差异表达,而在4 h无差异表达。((xlsx89 kb)
DEX和CHX处理幼苗的组织化学染色。
附加文件3:该图显示了DEX和DEX/CHX处理对对照植物的效果。10日龄GUS活性的组织化学染色35个年代箴我> > GUS模拟DEX/CHX处理(a)、CHX (B)、DEX (C)和DEX/CHX (D)处理幼苗9 h。比例尺为1mm。(JPEG 83 KB)
与背面表达激素诱导激活相关的营养表型
附加文件4:fil和既定表示YAB3.这张图显示了fil箴:: FIL:GR植物和35个年代箴:: YAB3:GR植物持续接触DEX。(一)Fourteen-day-oldfil箴:: FIL:GR植物生长的土壤和与DEX(见方法)喷洒。(公元前)35个年代箴:: YAB3:GR在没有地塞米松(B)或存在地塞米松(C)的培养基上生长的植株。比例尺为1毫米。(JPEG 72 KB)
与不同突变体背景中的连续滤液激活相关的植物表型。
附加文件5:该图显示了dex诱导的表型和叶表皮细胞形态的突变植物35个年代箴:: FIL:GR构造。(模拟)Twenty-day-old35个年代箴:: FIL:GR(一种),35个年代箴:: FIL:GR/arf4(B),35个年代箴:: FIL:GR/kan1(C)和35个年代箴:: FIL:GR/ARF4 KAN1.(D),在土壤上生长并用DEX喷洒的植物(参见方法)。(e-i)叶子的关于叶子的Adaxial表面的SEM35个年代箴:: FIL:GR植物(E, F)35个年代箴:: FIL:GR/arf4植物(G)35个年代箴:: FIL:GR/kan1植物(H)或一个35个年代箴:: FIL:GR/ARF4 KAN1.植物进行模拟处理(E)或喷施DEX (F-I)。比例尺为2mm (A-D)和100 μM (E-I)。(JPEG 207 KB)
12870 _2012_1162_moesm6_esm.docx
附加文件6:用于qRT-PCR的和克隆的引物序列。此文件包含所有用于产生构建体和导电的qRT-PCR寡核苷酸的列表。(DOCX 110 KB)
作者为图像提交的原始文件
权利和权限
开放获取本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
Bonaccorso,澳,李,J.E.,普瓦,L.等等。丝状的花通过充当激活体和抑制体来控制侧器官的发育。BMC植物杂志12,176(2012)。https://doi.org/10.1186/1471-2229-12-176
收到了:
接受:
发表:
关键词
- YABBYs
- 拟南芥蒂利亚纳
- 叶子的图案和发育
- 叶片
- 横向器官形成