抽象的
背景
花粉粒中含有雄性配子体,该配子体延伸出一个花粉管,花粉管通过雌性组织生长,以便将精子送到胚囊进行双受精。生长中的花粉管形成周期性的胼胝质栓子,被认为可以阻断花粉管较老的部分,并维持生长顶端附近的细胞质。胼胝质栓的形态和沉积模式在物种间有差异,但物种内部的差异尚未被研究。因此,我们系统地检测了胼胝质的沉积拟南芥蒂利亚纳利用不同沉积模式生态型间的互交进行遗传力检验,并研究胼胝质栓与花粉管生长速率的关系。研究了不同种类番茄的胼胝质塞沉积模式。
结果
我们使用的体外种植花粉管14个不同A. Thaliana.生态型并测量从花粉粒孔到第一个胼舌塞(称为第一次间隔)的距离。这个距离变化拟南芥生态型和一些情况下甚至在生态型中。没有胼ins的花粉管比具有胼舌塞的花粉管,平均而言,谷物附近的胼舌塞的管子比第一胼ins塞的胼舌塞在谷物上更长。在不同种类的番茄之间也观察到第一胼ink位置的变化。
结论
我们表明,第一个胼lovel的位置各不相同拟南芥生态型和番茄物种,并且胼insp沉积模式是遗传的。这些发现奠定了映射调节胼inc沉积或确定花粉管长度或生长速率的基因的基础。
背景
在被子植物中,花粉粒含有雄性配子体。雄性配子体伸出花粉管,花粉管穿过雌性组织,将精子送至胚囊进行双受精。胼胝质,一种β 1,3-葡聚糖,是花粉管细胞壁的主要成分[1].用脱色苯胺蓝染色可显示胼胝质[2].越来越多的花粉管形成周期性的胼舌塞,被认为阻止管的较旧的部位并将细胞质保持在生长尖端附近[3.].在所有开花植物的花粉管中存在调用塞子,虽然它们的形态和胼舌沉积的模式在物种之间变化[4].胼胝质栓被认为是在被子植物进化过程中加速花粉管生长的关键新事物[5,如被子植物花粉管有胼胝质壁和胼胝质栓,而裸子植物花粉管无胼胝质栓。
胼call塞沉积与花粉管生长速率相关。例如,调用插头的数量用作花粉管生长速率的指标芙蓉Moscheutos.[6,7].在番茄中,花粉受体激酶Leprk2的反义线显示出异常的胼ins沉积和较慢的花粉管生长,而不是野生型[8].LeSHY是一种与LePRK2相互作用的蛋白质;在佩妮,反义线害羞的在花粉管中没有显示胼舌,几乎所有花粉管未能达到胚珠[9].然而,在拟南芥一份报告[10质疑胼胝质栓的需要,因为花粉管携带一个突变的胼胝质合酶5等位基因,cals5-3,无胼胝质栓,但在体外和体内生长正常。种子上设置cals5-3纯合植物正常,尽管传播cal5-3杂合子的等位基因略微减少(与WT花粉管竞争时)。
拟南芥已被用作遗传研究的模型植物。许多生态型已经用于调查许多生理过程中的遗传变异[11[和重组近交系和双倍单倍体种群已用于映射下面的这种变异的基因[12,13].虽然调用塞形态在不同的物种中的不同[4],尚未检查某种物种内的知识变化。在其他实验过程中,我们注意到了花粉管拟南芥蒂利亚纳eCotypes L.呃而哥伦比亚(Col)似乎在第一个胼spall的位置变化;哥伦比亚在谷物附近有胼舌塞,而在l呃胼舌塞更远。因此,我们决定在许多人中系统地检查调用插头位置拟南芥在番茄种中。在这里我们记录了胼胝质栓沉积的变化拟南芥生态型与番茄种[14[展示胼舌沉积和花粉管生长之间存在关系。
结果与讨论
体外花粉萌发在许多生态型中具有稳健和可重复的
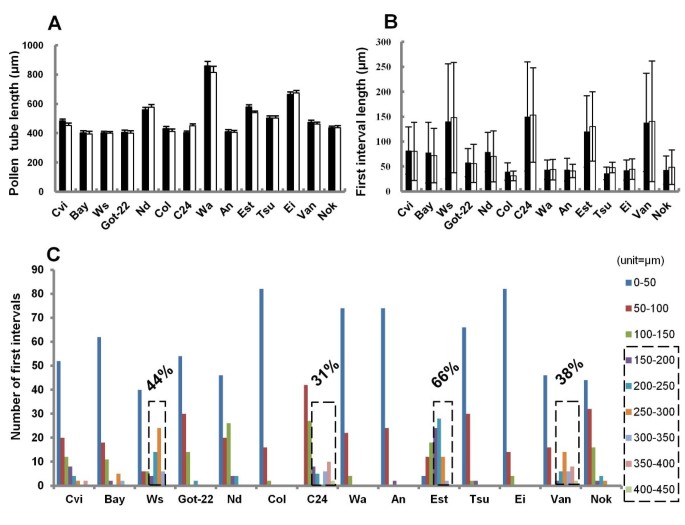
我们首先研究了我们实验室所开发的花粉离体萌发方案拟南芥蒂利亚纳哥伦比亚生态型可用于其他生态型[15].为了一致性,我们始终使用2-3个新鲜开花的萌芽测定。经过6小时萌发后,我们添加了脱色的苯胺蓝色以使胼舌塞进行可视化,将载玻片转移到4°C以停止管生长,并拍摄载玻片,大多数花粉颗粒发芽和花粉管出现健康。除了形成的花粉管和胼舌塞的所有生态型,除了一个生态型之外。对于测量,我们选择了花粉管,其易于将花粉管的长度从颗粒逐步追踪到尖端(如果花粉管在载玻片的一个区域中,则更难以进行这种测量,其中包括许多花粉管纠结在一起)。一个未配对t测试表明,在两个独立实验中,每种生态型的五十个随机选定的健康花粉管的长度没有显着差异(图1).因此,我们得出结论,在每个生态型内的体外花粉萌发和管生长可重现。在这种培养基中发芽的沙发氏菌的花粉非常差,少数表现形式的花粉管具有异常的形态。可以设计适合沙拉拉的发芽介质,但我们将其排除在进一步的实验中。虽然我们初前注意到Col和L中的胼ins插头的位置之间的差异呃,我们没有使用L呃在这些试验中,由于其发芽率明显低于其他生态型。
第一个调用插头位置在生态型之间变化拟南芥
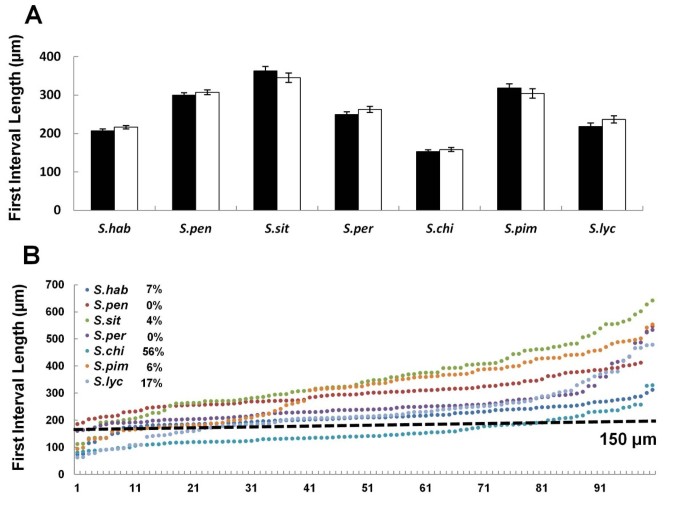
经过6小时的萌发后,我们在14个生态型中测量了50个随机选择的花粉管的第一个间隔长度(从花粉颗粒到第一个胼flow塞)。我们使用了6小时的时间点,以确保所有花粉颗粒都有充足的时间来生长管,因为发芽开始是不同步的[15].在一个生态型内,两个独立实验的第一个间隔的平均长度是可重复的(图1 b),但不同生态型的平均长度不同。在大约50%的指标,第一区间的平均时间约为50μm,表明第一胼胝质塞一直靠近花粉粒,但在Ws, C24,美国东部时间,和Van指标,第一区间长度更长,平均和标准偏差非常大。Cvi、Bay、Nd和Nok的标准差也较大。
为了进一步调查所有生态部分中的第一个胼ins位置的差异,我们汇集了100个独立实验的第一个间隔,并根据第一个间隔的长度分组它们(图1 c).在14个生态型中,在11μm至394μm的范围内具有广泛的第一个间隔长度。我们任意将花粉管分为两组。在第一组中,第一个间隔<150μm,即第一个胼舌塞接近谷物;在第二组中,第一个间隔≥150μm,即第一个胼sppls离谷物较远。所有生态型都有一些花粉管,具有第一个间隔<150μm,但一些生态型也有花粉管,第一间隔≥150μm。具有第一间隔的花粉管的部分≥150μm在这14个生态型中的0%(例如Col)至66%(例如Est)。我们进一步细分了这个群体;如果在一个生态型中具有第一间隔≥150μm的花粉管的部分低于20%,则我们将生态型作为具有一个第一个胼spp沉积的图案,即靠近花粉晶的第一个胼ins。但是,如果一个生态型≥150μm的花粉管的一部分高于20%,我们定义了具有两个沉积图案的生态型。 After applying this criterion, Ws, C24, Est and Van had two patterns for first callose plug position (Figure1 c).因此,第一个召唤插头位置不仅在不同的生态型之间变化,而且在某些生态型内也变化。
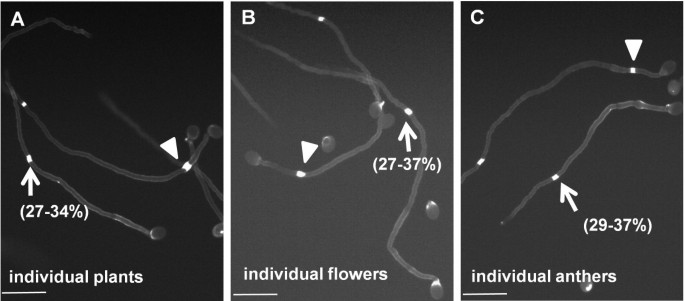
假设生态型是一致的,因此在生态型中第一胼胝质插头位置的变化是出乎意料的。为了测试种子污染是否可能解释这种变异,我们使用了C24。在花粉萌发6小时后,我们对12株单株花粉进行了分析;在12个植株中,花粉管第1个胼胝质突起的位置均有差异,第1个间隔≥150μm的部分在27-34%(图2)2),类似于图中所示的结果1 c,建议变异不是由于种子污染。我们进一步检查了6个单独的花朵或来自各个花树的花粉,每个花盆仍然在第一个胼ins塞位置显示出变化,并且具有与第一个间隔≥150μm的花粉管相似的比例(图2b和c.),表明C24中的核糖插头位置的变化是固有的。一种生态型的这种变化可能是由于表型噪声[16,17].
胼call沉积的模式是遗传的
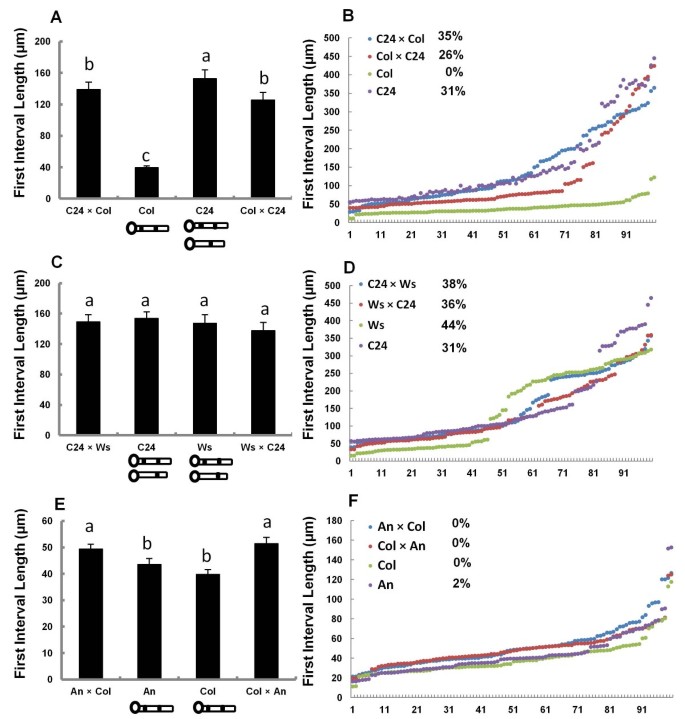
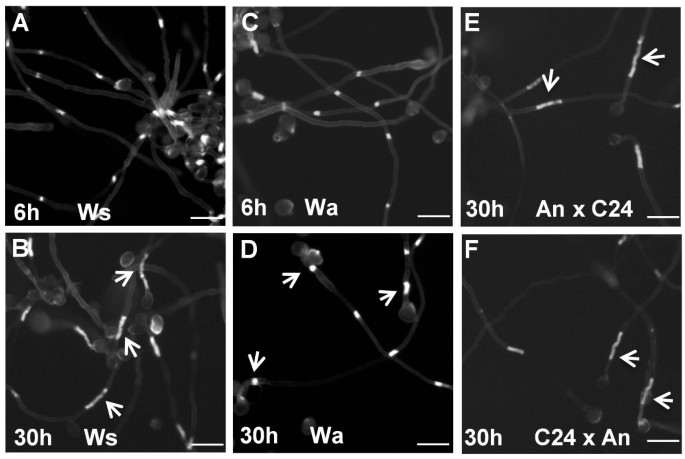
为了检验不同生态型间第一胼胝质插头位置的变异是否可遗传,我们在不同生态型间进行了第一胼胝质插头位置的互交。C24有两个图案,而Col只有一个图案(图1 c).两个F1s中100个首间隔的平均长度为亲本平均长度的中间值(图2)3A).但两个F1s的第一个间隔长度分布与C24相似,且第一个间隔≥150μm的两个F1s的花粉管比例大于20%,与C24相似(图2)3B.).这表明两个F1S有两个第一个胼ins塞位置,如C24一样。这表明第一个召唤插头位置的模式是可遗传的,并且具有两种模式是显性的。两个F1S中的类似的第一个间隔长度表明,对胼ins插头位置没有父母效应。与C24一样,WS有两种第一个胼ins插头位置(图1 b).因此,我们互相交叉的WS和C24来研究F1S中继承的两个核糖插头位置的两种模式。两个F1s中的平均第一间隔长度与父母的平均第一间隔长度没有显着差异(图3C此外,两个F1S中的第一间隔长度的分布也类似于父母的分布。具有第一个间隔≥150μm的花粉管的比例大于20%(图3d),表明两个F1s具有两种沉积模式。我们使用Col和An的交互杂交来研究当亲本只有一种胼胝质插头位置时,如何遗传第一胼胝质插头位置。第一个间隔长度在两个F1s中的分布与亲本相似(图)3F.),第一间隔≥150μm的花粉管均未出现,说明F1和亲本的沉积模式相同。然而,两个Col × An F1s的第一个间隔的平均长度显著长于亲本(图2)3E).上述结果表明,1个生态型中第1个胼胝质突起位置的变化受遗传控制,第1个胼胝质突起沉积的2种模式性状占主导地位。这种优势出乎我们的意料,因为我们预测胼胝质的位置将由配子体控制,因为花粉萌发后,胼胝质的突起会沉积在花粉管中。因此,在配子体控制的情况下,假设一个基因控制性状,我们预计50%的花粉管将具有第一胼胝质的沉积模式,50%的花粉管将具有两种模式。C24有31%的花粉管首次间隔较长,因此F1花粉管中预计只有15%的花粉管首次间隔较长。而col_c24互交f_1中长间隔花粉管的比例分别为35%和26%,远高于预期的15%。这并不支持该性状是由单个配子体基因控制的。如果这个性状是由多个基因控制的,那么在两个亲本表型之间可能会出现一系列中间表型,但事实并非如此。因此,显性与孢子体控制最为一致;然而,我们不清楚孢子体是如何促成这种表型的。 Before attempting to genetically map the responsible gene(s), it will be important to consider other parameters that might influence this trait, such as sporophytically-derived pollen wall proteins, or paternal provisioning.
首先在父母和F1后代的互惠交叉的胼ung。(一个), (C)和(E)显示父母和互惠交叉的F1的平均第一间隔长度。Col、C24及其F1代的比较显示在(一个);Ws、C24及其F1的比较见(C);Col,A及其F1之间的比较显示在(E).(B), (D)和(F)显示父母和F1的第一间隔长度的分布和互易循环的F1。Col,C24及其F1之间的比较(B);Ws、C24及其F1 (D)的比较比较Col、An和它们的F1 (F)。B), (D)和(F)代表花粉管的比例,第一间隔≥150μm。进行ANOVA和具有LSD(最不重要的差异)的多重比较。错误栏(一个), (B)和(E)是SEM。字母表示在P< 0.5。相同字母的值并没有显着差异。
父母和F1杂种的花粉管长度变异性
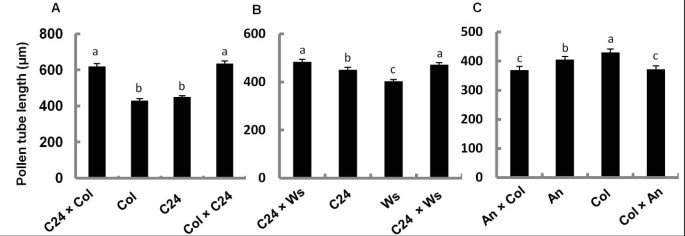
在6小时花粉萌发后,花粉管的平均长度在不同的生态型中变化(图1).大部分生态型的管长在400μm左右,Wa和Ei的管长分别为860μm和665μm。这说明Wa和Ei花粉管的生长速度明显快于其他生态型。在测定亲本和F1杂种胼胝质栓沉积模式时(图3.),我们还注意到花粉管长度在经过测试的F1杂交种中变化,但互核十字架没有差异(图4a,b和c).从C24和Col的杂交产生的F1s的花粉试管显著更长(618μm和634μm)比他们的父母(西:430μm和C24:450μm)(图4A);在C24和WS Crosss的F1杂交体中也观察到这种现象(图4B.),提示杂种优势的可能。然而,这种可能的杂种优势在An和Col组合的F1杂种中没有观察到(图4C).这种差异,即是否存在杂种优势效应,以前曾有过报道,这取决于在杂交中使用的亲本[18].
Callose插头在大多数生态型中继续伸长
我们注意到,在用苯胺蓝色染色之前,在染色的花粉(30小时)之前,COL中的胼ink的长度更长。因此,我们检查了这种现象是否发生在其他生态型中。经过30小时的萌发后,C24,VAN,Bay,CVI,EI,ND,NOK,GOT22,EST和TSU和WS Ecotypes类似地愈合了塞子(图5B.)但是,AN和WA的胼ins塞不再在30小时内(图5D).在30小时内使用较长的胼sppers的eCotypes,主要是伸长的第一个胼ins塞(图5B.).为了测试这种表型是遗传的,我们检查了A和C24之间的互殖交的F1后代。30H发芽后,F1s的花粉管具有更长的胼insp(图5e和f),提示C24表型具有遗传优势。胼胝质插头伸长意味着胼胝质合酶在胼胝质沉积位点继续活跃,但尚不清楚为什么生态型会因这个参数而变化。
胼胝质的沉积与花粉管的长度有关
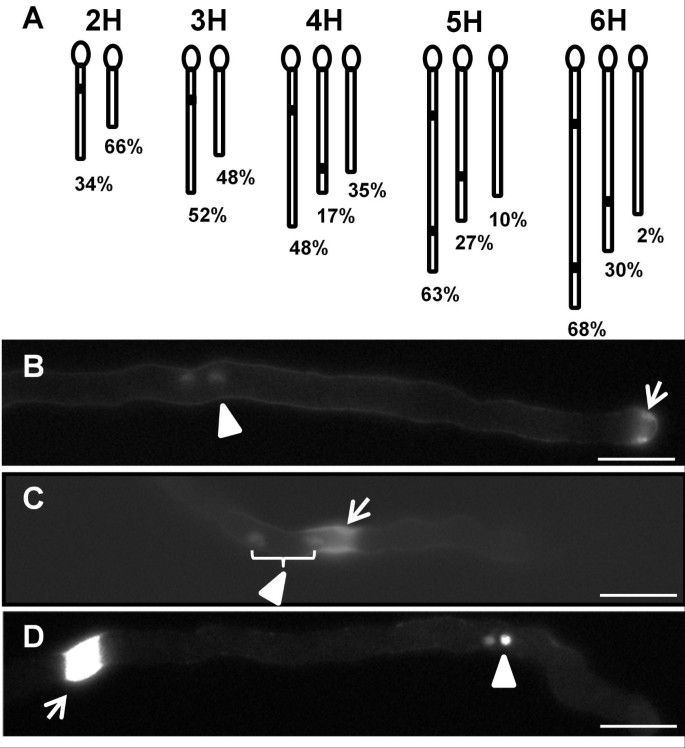
我们感兴趣的是确定胼胝质在何时何地开始形成。但在之前的实验中,大部分胼胝质栓已经完全沉积,我们无法直接观察到胼胝质栓的形成,因为苯胺蓝染色和4℃的培养使花粉管停止生长。因此,我们使用C24和一个时间过程实验(图6A;桌子1)确定调用插头开始形成的近似时间。经过2小时的萌发后,34%的花粉管有一个靠近谷物的第一个胼spp(第一个间隔<150μm),而66%的花粉具有较短的管(图6A),尚未形成胼胝质塞。萌发3小时后,更多的花粉管在籽粒附近形成胼胝质的塞,但约50%的花粉管虽然比萌发2小时时长,但仍然没有胼胝质的塞。发芽后4小时,65%的花粉管形成第一胼胝质塞,包括与第一胼胝质塞接近48%的粮食和17%首先胼胝质塞远离粮食,这表明大部分的第一胼胝质塞形成在4小时的萌发。此外,在萌发3 ~ 4h时,由于第一次间隔<150μm的花粉管百分率从萌发3 ~ 4h逐渐降低,胼胝质栓的形态向第一次间隔≥150μm的形态转变。
C24生态型调用插头形成的时间课程分析。(一个).指示具有不同核糖插头图案的花粉管的示意图,例如,在4小时的花粉萌发中显示的三个花粉管代表了花粉塞,靠近花粉粒(左),胼ins留在距离花粉谷物(中间)和没有胼ins塞(右)的胼ins。百分比代表每种图案的花粉管的比例。示意图中的管长度代表表格中的平均花粉管长度1但它们的规模并不精确。(B)在花粉管尖端(箭头)附近的形成胼ins,精子细胞(箭头)。谷物到左边。(C)通过不完整的胼call(箭头)的精子细胞(箭头)。谷物到左边。(D)完全形成的胼spp(箭头),精子电池位于前面(箭头)。谷物到左边。条=30μm。
为了确定第一个胼ins插头形式的位置,我们选择形成胼sppls的管(2-5小时发芽),然后确定它们开始形成的位置。在花粉管尖端附近发现了几乎所有(93%)的成形胼舌塞(图6B.),表明胼ins沉积沉积在花粉管尖端附近开始。这提出了关于在花粉管生长期间愈合插头位置和精子细胞位置之间的关系的问题。因此,我们使用了一个C24线pDUO1::NLSMRFP.并进行花粉萌发的时间过程。的DUO1启动子在精子细胞中表达[19因此pDUO1::NLSMRFP.报告细胞可以用来成像精细胞核。用于显示苯胺蓝染色的DAPI滤光片与mRFP通道重叠,因此我们可以同时看到精子核和胼胝质栓。一些胼胝质栓(包括形成和完全形成的胼胝质栓)靠近精子的位置(图6B.),有些胼sppls远离精子的位置(图6D.).时间课程显示,在每个时间点的胼spall后面,大约30%的精子细胞(表2).但是,在图像生成的电影中(例如,附加文件1;数字6C),看到精子细胞通过在用苯胺蓝染色后尚未停止生长的花粉管中的核糖塞。因此,核发塞后面观察到的30%精子细胞是在管中的30%精子细胞,其中苯胺蓝色被阻止在通过胼隙塞的精子细胞之前的增长。它以前在烟草中报道,植物派和生成细胞可以被困在胼舌塞后面,但可以通过成型胼ins插头来挤压[20.].
附加文件1:精子在花粉管中的运动,形成胼ins插头。(MOV 245 KB)
由于许多C24生态型花粉管在萌发2小时或3小时后没有胼胝质栓子,我们可以利用C24来研究胼胝质栓子的沉积是否与花粉管的长度相关,而不受任何生态型的影响。时间历程分析(表1)用于比较花粉管的长度,或没有胼ins塞。花粉管的平均管长度比胼ins塞的花粉管的平均管长度明显短。一个dditionally, after 4 hours of germination, the average length of tubes with the first callose plug close to the grain (i.e. first interval <150μm) was significantly longer than tubes with the first callose plug far away from the grain (first interval ≥150μm). We carried out correlation analyses with the 4, 5 and 6 hour time points; the first interval length and pollen tube length were significantly correlated at 5 hours (r=−0.235,P<0.05)和6小时(r= -0.242,P<0.05),但不在4小时。也许在4小时的时间点,由于花粉管引发的不同时间仍然存在残留的变化。
番茄物种中胼inc沉积的变异
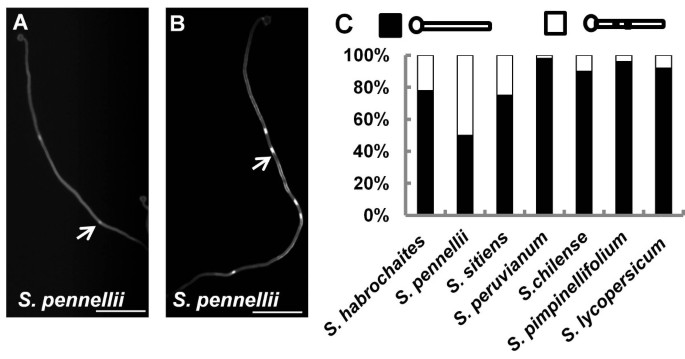
为了确定第一胼胝质的位置是否发生了变异,我们测量了7个不同番茄种的第一和第二间隔和花粉管长度。所述的花粉萌发方法[8] 为了Solanum lycopersicum.对另外六种物种的工作良好,并且没有成对t试验结果表明,从两个单独试验中随机选择50个健康花粉管的平均首次间隔是可重复的(图2)7A).第一个间隔的平均长度在7种中的153μm至363μm之间变化(图7A).将两个单独的试验(共100个花粉管)合并在一起,用于确定第一个胼胝质插头位置的分布。第一个区间长度的分组标准相同拟南芥(图1 c用过)。仅有的S. Chilense.第一间隔长度<150μm的花粉管占比较大(56%),说明S. Chilense.有两种模式为第一个胼spall位置。其他物种中具有第一个间隔<150μm的花粉管的比例小于20%,表明这些物种主要有一个用于第一个胼spl位置的图案。虽然这些物种中的大多数间隔被分组为单一模式,但观察到变化(图7B.).因此,在番茄中也存在在不同物种或一个物种中的第一个召集位置的变化。我们也注意到了美国pennellii为第二个胼une插头显示两个模式:一个接近第一个胼call(图8A)另一个更远的(图8B.).因此,我们检查了所有7种番茄种;所有花粉管都有花粉管,第二个胼call塞位置远离第一个,但是美国habrochaites,美国pennellii和S. Siitiens.还显示了第二个胼舌塞分别的22%,50%或25%的图案。胼ins伸长率的现象(图5在长时间(30小时)萌发后,在任何番茄种类中未观察到)。
结论
我们的研究表明,除了一个拟南芥在体外萌发期间,生态型测试了花粉管。我们表明,第一个胼lovel的位置变化拟南芥生态型,在某些情况下在一个生态型内。胼胝质塞沉积模式具有遗传性;在一个生态型内具有两种胼胝质堵塞模式是占优势的。胼胝质塞沉积与花粉管长度相关,杂种花粉管长度有时超过亲本。胼胝质栓沉积在不同种类的番茄中也有差异。这些检测都是在离体条件下进行的,重要的是要认识到,由于雌性组织的潜在影响,当花粉管在雌蕊中生长时,我们测量的参数可能会有差异。虽然这些胼胝质栓沉积差异的意义尚不清楚,但这些发现为定位调控胼胝质栓沉积或决定花粉管长度和生长速度的基因奠定了基础。
方法
植物材料和生长条件
14个生态型拟南芥蒂利亚纳(COL-0,WS-0,C24,EST-1,Shahdara,Van-1,Bay-0,Tsu-1,CVI-0,NOK-0,EI-2,AN-1,ND-1,WA使用-1和GOT-22)。除了COL-0以外的所有生态部分由Brian Staskawicz的UC Berkeley提供;他们最初从NASC获得,附加号码可用(http://arabidopsis.info/).所有拟南芥植物都在4:1:1的FAFARD 4P混合中的温室中生长:珍珠岩:在21°C的18-H光/ 6-H黑色循环下的蛭石。七种西红柿的花朵(Solanum lycopersicum.,Solanum pimpinellifolium.,茄属植物chilense,秘鲁茄,Solanum Pennellii.,Solanum Habrochaites.)从UC-Davis温室种植的植物中获得。
花粉萌发及苯胺蓝染色
拟南芥在体外花粉管萌发如[15].花粉萌发6h或30h后,加入脱色的苯胺蓝,然后立即将载玻片转移到4℃。用DAPI滤镜观察胼胝质和精子细胞。为了观察在苯胺蓝存在下精子细胞的运动,我们在加入脱色的苯胺蓝(不将载玻片转移到4°C)后立即用40×物镜拍摄图像。番茄花粉萌发遵循[8]。脱色苯胺蓝染色如[21].
用于测量花粉管长度和统计分析的微观成像和软件
显微镜成像使用Axiovert显微镜(Zeiss)。使用Spot数码相机(诊断仪器;http://www.diaginc.com/).使用image J软件测量胼舌塞和花粉粒孔之间的距离(http://rsbweb.nih.gov/ij/) [22].在不通风的t使用SPSS 10.0软件(SPSS Inc.,Chicago,IL,USA)进行测试,相关性分析(ANOVA)和对具有最小重要差异(LSD)的多种比较和多种比较。
参考
- 1.
泰勒LP,毛线仪PK:花粉萌发和管生长。Annu Rev植物植物植物Mol Biol。1997年,48:461-491。
- 2.
拟南芥和雄性不育突变体花粉发育的细胞化学分析。acta botanica sinica(云南植物学报),2010,30(4):427 - 434。
- 3.
富兰克林通讯:发信号和花粉管的调节。植物细胞。1999,11(4):727-738。
- 4.
Mogami N,Miyamoto M,Onozuka M,Nakamura N:在体外发芽的双子叶和单子叶花粉的胼call结构比较。甘蓝。2006,45(4):249-256。
- 5。
威廉姆斯jh:开花植物花粉管的新奇区的关键生活历史阶段的多样化。Proc Natl Acad Sci USA。2008,105(32):11259-11263。
- 6。
Snow Aa,Spira TP:植物中的花粉活力和性能的潜力。自然。1991,352(29):796-797。
- 7。
雪AA,Spirabus Moscheutos中的差动花粉管生长率和非谐波施肥。Amer J Bot。1991,78(10):1419-1426。
- 8。
张丹丹,张文杰,张文杰,唐文华:花粉受体激酶LePRK2介导的促生长信号,正调控花粉萌发和管体生长。植物营养与肥料学报。2008,29(3):429 - 434。
- 9。
Guyon V,W-H T,Monti Mm,Raiola A,Lorenzo Gd,McCormick S,泰勒LP:反义表型揭示了花粉管结构的害羞,花粉特异性幼亮重复蛋白的作用。工厂J.2004,39(4):643-654。
- 10。
Nishikawa S,Zinkl Gm,Swanson RJ,Maruyama D,Preuss D:调用(Beta-1,3葡聚糖)对于拟南芥花粉壁图案来说是必不可少的,但不是管增长。BMC植物BIOL。2005,5:22-32。
- 11.
Beemster GTS:拟南芥生态型之间的生长速率变化与细胞分裂和型细胞周期蛋白依赖性激酶活性相关。植物理性。2002,129(2):854-864。
- 12.
Koornneef M,Alonso-Blanco C,Vreugenhil D:天然存在于Arabidicopsis Thaliana的遗传变异。Annu Rev植物Biol。2004,55:141-172。
- 13.
Seymour DK,Firiault DL,Henry Im,Monson-Miller J,Ravi M,Pang A,Comai L,Chan SWL,Maloof JN:拟南芥的快速创建为定量特质轨迹映射增加了双倍的单倍体线。Proc Natl Acad Sci USA。2012,109(11):4227-4232。
- 14。
佩尔特拉IE,Spooner DM,Knapp S:野生西红柿的分类及其亲属(Solanum Sect。l氏菌,教派。juglandifolia,sect。Lycopersicon; solanaceae)。系统的植物学专着。卷。85:美国植物学会分类师,安娜堡,MI 2008。
- 15.
Boavida LC,McCormick S:温度作为拟南芥中体外花粉萌发的增加和可重复的决定因素。工厂J. 2007,52(3):570-582。
- 16。
Deplancke B,Verstrepen KJ:突变的变量结果。科学。2012,335(6064):44-45。
- 17。
El-Samad H,Weissman JS:噪声规则。自然。2011,480(7376):188-189。
- 18。
Moore S,Lukens L:评估拟南芥杂交性状及其遗传控制。G3(Bethesda)。2011,1(7):571-579。
- 19。
roman N, Durbarry A, Wardle A, Yang WC, Chaboud A, Faure JE, Berger F, Twell D:一类新的MYB因子控制植物精子细胞的形成。生物多样性,2005,15(3):244-248。
- 20。
Laitiainen e,Nieminen K,Vihinen H,Raudaskoski M:烟草花粉管中生成细胞和营养核的运动取决于微管细胞骨架,但与胼ins塞合成无关。性植物团体。2002,15(4):195-204。
- 21。
约翰逊 - 布鲁斯萨,麦考克斯:一种用于表征拟南芥花粉突变体和配子化学表达基因的方法的汇编。工厂J.2004,39(5):761-775。
- 22。
Collins TJ:显微成像。生物技术。2007,43(1增刊):25-30。
致谢
我们感谢Brian Staskawicz的实验室的种子拟南芥从番茄种类中为鲜花的eCotypes和roger t. chetelat。感谢宾莲郑,广武和华江的意见和讨论,以及豪尔斯·穆斯舍蒂和威华唐在稿件上发表评论。这项工作得到了美国农业农业研究服务当前研究信息系统的支持(授予了5335-21000-030-00D)。PQ由中国奖学金委员会的奖学金部分地支持。DT是自然资源学院刺激(本科研究生研究)计划的参与者,UC-BERKELEY是UC-BERKELEY URAP(本科研究学徒计划)的参与者。
作者信息
隶属关系
通讯作者
附加信息
相互竞争的利益
提交人声明他们没有竞争利益。
作者的贡献
PQ和SM设计了该研究,PQ,DT以及执行实验,PQ和SM分析了数据并写了稿件。所有作者阅读并认可的终稿。
电子补充材料
作者的原始提交的图像文件
下面是作者提交的原始图片文件的链接。
权利和权限
开放获取本文在“生物资源”中央有限公司的许可下公布了这是一个开放式访问条款,分配根据创意公约归因许可证的条款(https://creativecommons.org/licenses/by/2.0.),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
秦,P.,Ting,D.,Shieh,A.et al。花粉管中胼胝质塞沉积模式不同拟南芥蒂利亚纳生态型和番茄种。BMC植物BIOL.12,178(2012)。https://doi.org/10.1186/1471-2229-12-178
已收到:
接受:
发表:
关键字
- 调用插头
- 花粉管生长
- 精子