抽象的
背景
植物防御素是一种重要的天然免疫蛋白超家族,对丝状真菌具有很强的抑制作用。由于尚未公布针叶树的基因组序列,因此尚不清楚针叶树中植物防御素的总数量。然而,一些被子植物的基因组为了解植物防御素的多样性提供了线索。在这里,我们报道了5个新的防御蛋白编码基因的鉴定Picea glauca.基因组及其两个基因产物PgD5和endoopiceasin的特性。
结果
筛选A.p . glauca具有已知植物防御素序列的est数据库将四种基因鉴定到已知的同源性p . glaucadefensinPGD1.,被指定为PGD2-5.然而,在成熟的PGD2-4中,只有7-9个氨基酸与PGD1不同,而PGD5只有64%的序列同一性。PGD5.被放大p . glauca基因组DNA的PCR。它编码一个77-氨基酸的前体,在Picea.属,与植物防御素相似。重组PGD5,生产大肠杆菌,具有5.721kDa的分子量,通过质谱法测定。PGD5肽对几种植物病变的抗真菌活性表现出强烈的抗真菌活性,而不会对治疗的真菌菌丝的形态作用,但强烈抑制悬垂伸长率。Sytox摄取测定表明PGD5的抑制活性可以与改变真菌膜的渗透性相关。在EST图书馆中鉴定了另一个完全不相关的防御基因并命名endopiceasin.它的6-半胱氨酸肽的基因编码与真菌防御素plectasin高度相似。
结论
筛选A.p . glaucaEST数据库导致鉴定了五种新的防御素编码基因。PGD5.植物防御素的代码,其显示对测试的植物病变的非形态发生抗真菌活性,可能通过改变膜渗透性来进行植物嗜阴茎。PGD5具有植物生物技术部门的应用潜力。Endopiceasin似乎来自内生真菌或附生真菌菌株,而不是来自植物本身。
背景
植物暴露在各种各样的病原体和害虫中,它们的生存依赖于不同的自卫机制。这种防御包括物理细胞壁屏障[1,以及能抑制微生物病原体生长的多种分子的产生[2-6.].在后者中,阳离子抗菌肽如防御素,是最相关和大量的防御化合物[7.-9.].
植物防御素的特征是小球状、碱性、富含半胱氨酸的蛋白质(45-54个氨基酸),包含一个三股反平行的β-片和一个α-螺旋,通过四个二硫键稳定成紧凑的形状[10-14].这些桥形成半胱氨酸稳定的α-螺旋β-片基序(CSα/β),在抗菌活性肽中保存良好。在植物防御素结构中还描述了另外两个结构基序,即α核,包括连接第一β链和α-螺旋的环,以及γ核,包括连接β链2和3的发夹环(Lβ2β3) [15那16].尽管植物防御素的三级结构高度保守,但一级序列上的相似性仅限于限定位置上的8个半胱氨酸残基、2个甘氨酸残基、1个芳香残基和1个谷氨酸[17].氨基酸序列的变化通过贡献这些肽中观察到的广泛生物活性的环的空间显示的小变化来反映,因为单一氨基酸取代可以改变活性的光谱。
与昆虫和哺乳动物的防御素不同,主要针对细菌[2那8.那18那19],植物防御素,除少数例外,不表现出抗菌活性[20.].它们抑制了广谱谱的生长植物病原体,例如尖孢镰刀菌那verticillium dahliae.和Botrytis cinerea,但也有酿酒酵母酿酒酵母和人类致病真菌如白色念珠菌在非常低的浓度下体外[20.].植物防御素的精确作用模式尚不清楚,对于大多数植物防御素,信号传导和推定的细胞内靶标的分子组分仍然未知[21.那22.].仅用于防御Rs-AFP2萝卜和Dm-AMP1的防御大丽花merckii,已确定真菌膜中可能存在的靶点[23.那24.].最近,据证明植物防御素可以内化到细胞质中并与特定的细胞内靶标相互作用[25.那26.].此外,发现植物防御素家族的一些成员有更多的活动体外.其中包括抑制α-淀粉酶[27.-29.蛋白翻译[30.那31.]和蛋白酶[32.,以及植物中的耐锌介质[33.],离子通道阻滞剂[34.那35.],参与抗坏血酸氧化还原状态的酶活性[36.那37.]哺乳动物细胞的活动[38.-40].
植物防御素及其抗微生物效应已从许多高昂的植物(包括单码和Dicots)。基因组拟南芥包含14种不同的防御素基因,它们能对不同的压力做出反应[8.].然而,在裸子植物中,具有类似性质的多肽的研究尚不充分。已开发的大量表达序列标签(超过30万个ESTs)资源的可用性Picea glauca.[41.那42.结果只发现了一种表达防御素基因,PGD1.[43.和一种抗真菌蛋白[44.].这促使我们进行广泛的生物信息学分析,以筛选新的云杉防御素。
在这里,我们描述新的识别Picea.防御素基因,以及防御素多肽之一PgD5的特性。新防御素的鉴定p . glauca扩展了我们对针叶树基因组学的知识,并提高了研究云杉防御素作为杀菌剂的潜力的兴趣。
结果
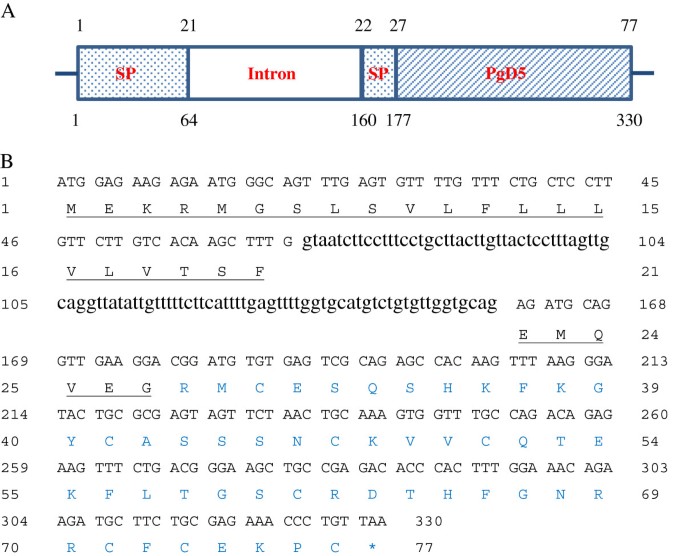
防御蛋白肽Picea glauca.基因组
这p . glauca首先用氨基酸序列筛选est数据库Picea glauca.防御素1 (PgD1, GenBank:AAR84643)由TBLASTN程序。TBLASTN特别适合于发现具有保守序列基序的远端同源物[45.].该初始筛选产生了四种不同的EST命中,GQ03918_C16,GQ02811_I12,GQ03707_G02和GQ01307_A13,其共享相似之处PGD1..然后命名孤立的EST的完整编码序列P.青冈防御素2到5.(PGD2-5),分别。当推导出新的编码序列时PGDS.与PGD1进行比较,对于83-86%的序列同一性,PGD2-4观察到高相似性(图1A).相比之下,PgD1与PgD5相比,只观察到60%的同一性。
氨基酸序列的比对分析Picea glauca.通过数据库搜索发现防御蛋白编码基因。(一种通过筛选所检索的)PGDSp . glauca利用EST数据库的氨基酸序列p . glauca防御素1(PGD1)。与PGD1相比的百分比相似度在最后一列中表示。PGD1和密切相关的PGD2,PGD3和PGD4之间的主要差异由黄色表示。成熟PGD的推导区域由蓝氨基酸表示。(B.)推断的PgD5肽成熟区与防御素家族其他成员的比对分析。与PgD5相比的相似度百分比在最后一列中表示。[基因库:ABK21016.1]未知云杉sitchensis;[Swiss-Prot: A4L7R8.1] defensin 2抗旱性;[GenBank登录号:AAR84643.1]防御素PGD1Picea glauca.;[GENBANK:CAA62761.1]推定的γ-硫蛋白蛋白Picea amies;[基因库:XP_002274353.1] Vv-Amp defensinvitis Vinifera;[GenBank:ABS72000.1齐墩果欧洲公司;[基因库:XP_003628977.1] defensinMedicago Truncatula.;[基因库:AAU04859.1] defensin前体银杏叶;[基因库:AEW08922.1]假设的蛋白质松果体放射虫纲;[Genbank:ACV84381.1]防御素前体小麦属植物硬质;[Swiss-Prot: A3FPF2.1] defensin-like蛋白质莲属椰子;[基因库:AAL15885.1]假定的gamma-thionin齿栗叶的可能;[Genbank:EAY86781.1]假设蛋白质栽培稻;[Genbank:ACB20518.1]防御素前体Saccharum OfficinArum.;[Genbank:ACV84379.1]防御素前体小麦;[Genbank:NP_001234987.1]蛋白酶抑制剂前体大豆;[Genbank:ADR30067.1]防御素D2菜豆;[GenBank登录号:BAA95697.1]硫素样蛋白烟草;[Genbank:ABO36637.1] Defensin蛋白茄属植物lycopersicum;[GenBank:AAL35366.1]防御蛋白前体Capiscum建立;[基因库:ACG30752.1] defensinZea Mays..包括8个半胱氨酸残基,2个甘氨酸,1个芳香残基和1个谷氨酸,所有植物防御素共有的一致序列如下所示。PgD5序列内的二硫键桥结构显示在一致序列下方。
氨基酸序列的比对分析PGD2-5透露,PGD2.与防御素3相似度最高的83个氨基酸前体的编码抗旱性[Genbank:JN980401]在93%相似度(数据未显示)处。PGD3.和PGD4.83个氨基酸肽的代码与未知蛋白质共享100%和99%的身份云杉sitchensis[GenBank:ABK21016],数据未显示。的氨基酸序列PGD3.和PGD4.除了在73的位置替代Ser的Ser替代(根据PGD1的编号)p . glauca) (数字1一种)。PGD5.用于77-氨基酸的前体的码。推导的氨基酸序列的对准表明,PGD5的成熟区域与裸子植物成员的高相似性,向苏格兰松树防御素2显示64%同源性[Swiss-Prot:A4L7R8.1] [46.〕和防御素1从Picea glauca.[GenBank登录号:CAA62761.1] [43.[分别,以及来自不同家庭的无关植物防御素分别(图1例如,它与vv-AMP1的防御蛋白有62%的相似性vitis Vinifera[47.],然后从62%的相似性推测的防卫素1齐墩果欧洲公司[48.].PGD5共享12个保守的氨基酸,包括八个半胱氨酸和两个甘氨酸残基,以及一个在保守位置的谷氨酸和一个芳族残留物。这些氨基酸对所有植物防御素常见[17].用DiPro进行的二硫桥分析证实,PGD5的八个半胱氨酸残基通过四种二硫化物桥连接(图1B)。
当p . glaucaEST数据库进一步筛选了其它几种裸子植物防御素的氨基酸序列,未发现新的防御素。令人惊讶的是,筛选p . glauca含有Plectasin的氨基酸序列的数据库[瑞士 - Prot:Q53i06.1] [49.在美国东部标准时间(EST)发布了GQ0132。B.7._K03, which shared 58% similarity to plectasin ( Additional file1).EST GQ0132.b7_k03的完整编码序列为273bp的尺寸和码,用于预测的90氨基酸肽。SignalP结果表明,用于信号肽的前20个氨基酸代码,然后是30-氨基酸促肽和40个氨基酸的成熟肽(附加文件2).与防御素家族其他成员的推导出的成熟肽氨基酸序列进行比较分析发现,该肽与真菌、昆虫和其他无脊椎动物的防御素具有共同的二硫化物桥模式[50.那51.].它包含三个二硫化物桥,而所有植物防御素通常有四个二硫化物桥(附加文件3.).
最终于相关的PGD5.选择在EST GQ0132.B7_K03中编码的基因进行进一步分析。在这两种情况下,含有相应基因的cDNA文库专门从主动伸长的根尖端孤立,没有菌根瘤。
基因组和在Silico.描述的PGD5.和endopiceasin
根据EST序列GQ01307_A13设计引物,进行PCR扩增PGD5.使用基因组DNAp . glauca.该样本基因组扩增产物约为330 bp,与EST GQ01307_A13进行比较分析发现,96 bp-内含子中断了预测的信号肽(图)2A). SignalP分析显示信号肽的前27个氨基酸编码,然后是50个氨基酸成熟肽(图)2B)。PA-Sub预测PGD5的信号肽将其产物引导至植物细胞的细胞外空间。从外部计算PI / MW工具中获得的肽参数显示PGD5具有5721.56Da的预测单同同位素质量,并且具有高度基本的+5净电荷和8.9以上的等电点。七种不同的云杉种类,即p . glauca和p·马里亚纳(原产于北美),p . smithiana那p . wilsonii和P. Orientalis.(原产于亚洲),和P.云杉和P. Omorika.(原产于欧洲)从基因组DNA中分离出相应的推定防御素。PCR反应扩增出7个基因组拷贝PGD5.,其被测序。这些基因组序列的对准分析揭示了核苷酸水平的序列之间的非常高的相似性(99%),其中大多数错配在内含子区域(附加文件)4.).序列在氨基酸水平上完全一致,表明该肽在属内完全保守Picea..
如果是endopiceasin,基于EST GQ0132设计引物。B.7._K03 sequence and PCR was carried out to amplify the complete coding sequence of the mature peptide using genomic DNA ofp . glauca.基因组扩增不成功,未获得任何产物。这些结果表明,防御素不是由植物基因组本身编码的,我们建议将该防御素命名为endopiceasin.
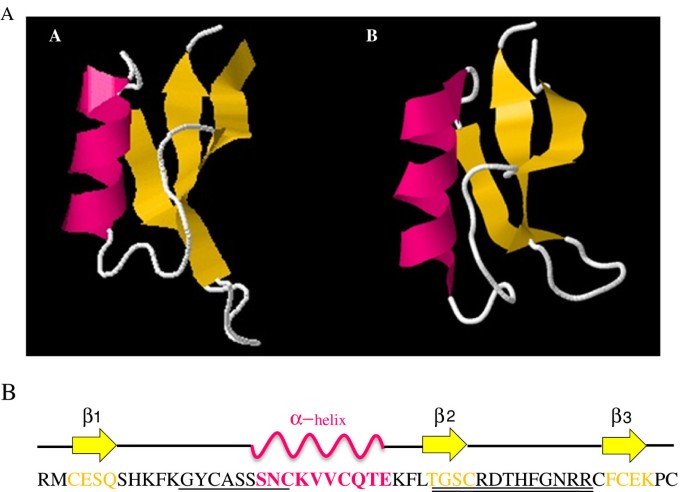
推导的氨基酸序列的比较建模表明,PGD5的三级结构非常类似于NAD1,来自的NAD1烟草(UNIPROTKB:P32026)。这些防御素含有不变的四硫化物阵列,并且具有由三个反平行β-链组成的常见的半胱氨酸稳定的α/β结构(CSα/β),其在βαβ构型中组织(图3.A).对PgD5一级序列的分析鉴定出γ-core和α-core基序[52.,如图所示3.B.
PgD5的重组生产和纯化
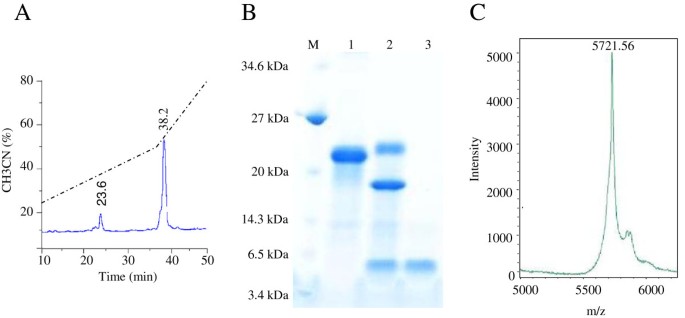
成功表达His6-SUMO-PgD5融合蛋白大肠杆菌BL21(折纸的pLys S)DE3。18kDa的重组融合蛋白以可溶性的形式有效地生产,并在单步中通过Ni-NTA柱色谱法纯化> 90%纯度(图4.一种)。SUMO蛋白酶删除了SUMO-标签。使用C18反相色谱柱和TFA /乙腈梯度进一步纯化所得蛋白质产物。重组PGD5在23.6分钟(在38%溶剂B)时洗脱,而消化的Sumo-标签在38.2分钟洗脱(在52%溶剂B)(图中)(图4.B). SDS-PAGE分析证实PgD5成功地从裂解标签中分离出来,并纯化到均匀性(图)4.一种)。纯化的肽通过MALDI-TOF-MS进一步表征。MALDI-TOF-MS分析得到5721.56 Da的质量为纯化的肽,它是8沓小于与5729.66沓的EXPASY-计算的pI / MW工具计算的理论质量(图4.C)。这些数据表明,所有植物防御素常见的四种二硫桥被正确形成。将肽在2mM DTT中孵育减少二硫桥并完全灭活肽。
纯化PgD5的抗菌活性
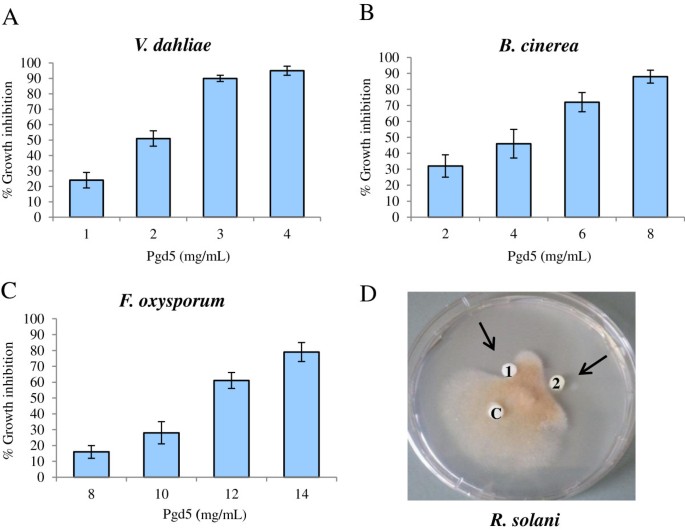
使用剂量反应生长抑制测定法测定PGD5的抗真菌活性。PGD5显着抑制即使在非常低浓度下测试的所有真菌分离物中的真菌生长。PGD5对v最活跃.大丽亚(数字5.a)和B. Cinerea(数字5.B), IC50.值分别为2 μg/mL和4 μg/mL。然而,PgD5对F. oxysporum.与集成电路50.值为11 μg/mL5.C)。治疗V. Dahliae.孢子,枯萎病的因果剂,肽浓度为3μg/ ml导致> 90%的生长抑制,浓度为8μg/ ml完全被捕的孢子萌发(数据未显示)。还测定了PGD5的抗真菌活性体外有一个板式测定辣椒.如图所示5.D、有抑制带R. Solani.在含有无菌滤纸圆盘的区域内使用不同浓度的纯化PgD5。阴性对照为蒸馏水。
重组PGD5具有抗真菌活性。(一种-C)剂量-反应生长抑制试验。生长抑制作用V. Dahliae.(一种),B. Cinerea(B.),F. oxysporum.(C)在重组PgD5的指定浓度的存在通过microspectrophotometric读数确定,每24小时在A截取595与未经处理的真菌对照组相比。数据表示为真菌生长的百分比,与未经处理的控制反应没有肽。实验重复三次,每个反应的标准偏差小于5%。生长抑制在生长48小时后测定F. oxysporum.和B. Cinerea72小时后V. Dahliae..(D.).纯化重组PGD5对菌丝生长的影响R. Solani.:盘C,无菌蒸馏水;磁盘1和2分别对应于3和6μg的重组PGD5。箭头表示生长抑制的区域。
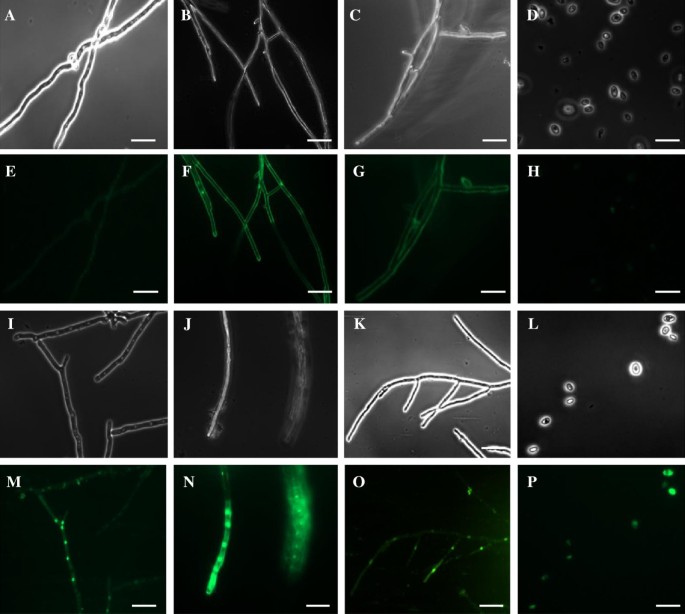
许多阳离子抗菌肽的一个特征是它们能够透过靶生物的质膜。我们使用荧光SYTOX Green染料检测细胞膜通透性,该染料仅被质膜受损的细胞所吸收。用PgD5处理的真菌菌丝的显微镜分析没有显示菌丝分枝增加和形态改变,这通常是由一些植物防御素诱导的[7.那50.那52.)(图6.).然而,PgD5强烈抑制菌丝的伸长率。通过荧光显微镜测量SYTOX绿色吸收,我们观察到PgD5诱导测试的三种真菌膜通透性。菌丝Pgd5处理灰孢镰刀菌,尖孢镰刀菌和V. Dahliae.胞浆中有很强的荧光(图6.M-O),特别是在细胞核中,而未处理的真菌没有荧光(图6.例如)。还测试了PGD5将PGD5透露血浆膜的能力S. Cerevisiae..荧光显微镜下,经pgd5处理S. Cerevisiae.细胞溶胶中显示强烈的SYTOX绿色荧光(图)6.p)与阴性对照相比(没有肽生长的细胞)(图6.h),表明PGD5还诱导酵母细胞中的膜透化物。与这些发现相反,PGD5没有活跃白色念珠菌在50微克的浓度/ mL的(数据未示出)。
的膜通透性测定期间SYTOX绿摄取的荧光显微镜分析。(一种-D.).相位对比图像和(E.-H)未经处理的荧光图像尖孢镰刀菌、灰孢镰刀菌、大丽花镰刀菌和S. Cerevisiae.细胞,分别。(一世-L.)相位对比图像和(m-P.) PgD5处理后的荧光图像尖孢镰刀菌、灰孢镰刀菌、大丽花镰刀菌和S. Cerevisiae.细胞分别。在肽浓度为11 μg/mL的PgD5存在下培养真菌48hF. oxysporum,4μg/ mlB. Cinerea,2 μg/mLV. Dahliae。S. Cerevisiae.在11 μg/mL的PgD5存在下培养1h。随后,用0.1 M Tris-HCl (pH 8.0)洗涤真菌菌丝和酵母细胞,用0.2 mM SYTOX在25°C下定期搅动染色30分钟,并进行荧光显微镜分析。Bar = 20 μm。
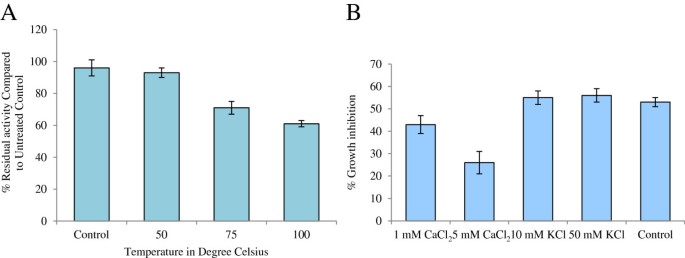
重组PgD5是热稳定和中等敏感的阳离子
采用抗真菌生长试验检测PgD5在不同温度下的稳定性V. Dahliae..PgD5在高达100°C的温度下非常稳定。在75℃处理30分钟后,其抗真菌活性保持了71%,在100℃处理30分钟后,其抗真菌活性保持了61%(图)7.一种)。分析单价和二价阳离子对PGD5抗真菌活性的影响,表明二价阳离子CA2+在5 mM浓度下,肽的抗真菌活性降低了约50%+对PGD5的抗真菌活性没有影响50毫米的抗真菌活性(图7.B)。
讨论
植物防御素编码基因的特征Picea glauca.
植物防御素是植物王国中普遍存在的阳离子肽家族,并代表植物先天免疫系统的重要组成部分。以前,只描述了两种抗真菌蛋白p . glauca.第一PgD1 (Picea glauca.防御素1),是一种含有50个氨基酸的植物防御素,具有抗真菌活性Cylindrocladium floridanum.那尖孢镰刀菌,丛赤壳属galligena在14μg/ mL的[43.].第二种是109个氨基酸的胚胎蛋白质,其与抗真菌蛋白质共享85%相似之处银杏叶[44.,但缺乏植物防御素的特点。
在目前的工作中,筛选p . glauca使用Tblastn算法的EST数据库导致识别五个新的防御素编码基因(图1和附加文件1).除了扩大现有云杉防御素的名单外,我们对p . glaucaDefensins及其编码基因介绍针叶树生物学和基因组学。我们的研究结果表明,在Agiosperms中发现了习惯性的防御素[53.]也存在于裸子植物中,这是植物防御素高度多样性的又一个例子。
防御素在不同的植物组织中表达,包括叶子,豆荚,块茎,水果,根,树皮和花卉器官[2那8.那19].他们提供具体的防守能力的工厂。由mRNA从积极伸长根提示只分离构建含有的EST GQ01307_A13和EST GQ0132.B7_K03 cDNA文库释放菌根,表明PGD5.和endopiceasin基因可能以组织特异性方式表达,只能在根中。据我们所知,这些肽是来自挪威云杉的防御素Spi1(Picea amies) [54.],唯一报告的植物防御素,其专门在植物根系中表达。
Endopiceasin酷似的真菌,昆虫防卫素古典和无脊椎动物的结构与由该稳定CSαβ基序[3二硫桥连接的6个半胱氨酸残基2那8.那55.-57.].孤立的PCRendopiceasin没有产生产物,通过改变PCR条件来扩增基因的努力也没有成功。从高等植物中分离出来的DNA可能来自被称为内生菌的共生微生物,它们以惊人的高频率占据植物组织。因此,很少有报道描述裸子植物和被子植物的DNA序列,它们实际上属于特定的内生植物[58.那59.].我们认为EST GQ0132.b7_k03存在于此p . glaucacDNA文库来源于定殖于植物根系的内生真菌或附生真菌菌株p . glauca.实验正在进行中,以进一步鉴定内皮酶肽的来源。在这种情况下,内皮酶和p1立菌素之间的高度相似性可能具有特殊兴趣,因为Plectasin是具有强治疗潜力的有效肽抗生素[49.那51.].我们还通过分析内啡肽的作用方式,证实了内啡肽与固溶酶的相似性。内源性糖苷仅对革兰氏阳性细菌有活性,其活性基于抑制细胞壁生物合成和脂质II结合(制备中手稿)。事实上,内生菌作为共生菌寄生在植物内部组织中,在保护植物抵抗病原体方面发挥着作用[60.而我们的研究表明内生菌的抗菌防御素可能在这种保护中起重要作用。
PGD5的特征特征
PGD5在氨基酸水平上显示出高度相似性,无关的植物植物(Fymnospermae家族)的无关植物脱蜡素(图1b),支持植物防御素的常见起源的想法。典型分泌信号肽的存在是植物防御素的特征之一[61.].基于前体蛋白质结构,PGD5与Defensin家族的I类[2],含有N-末端信号肽,然后是成熟防御蛋白域。与具有另外的C末端前驱蛋白的II类防御素肽相反。
PGD5出现在属中完全保守Picea..有许多关于植物防御素的报告显示,在同一属中有96%以上的同一性,并且只存在一到两个氨基酸的差异[62.-64.,转化成不同的抗菌活性。然而,据我们所知,这是第一个关于植物防御素在一个属内或至少在七个不同的属内被完全保存的报道Picea.在这项工作中分析了。这表明了一个非常特殊的角色PGD5.基因所属的进化过程中高度保守Picea..
PGD5的抗真菌活性
PgD5表现出较强的抗真菌活性,抑制四种重要农艺病原菌菌丝的生长:B. Cinerea,阔叶和针叶树的支气管病原体;R. Solani,一种经济上重要的农业植物和植物的土传病原体F. oxysporum.和V. Dahliae.,这是枯萎病的主要原因(图5.).基于结构和功能相似性,将PGD5包含在“非形态发生”的植物防御素组中,减缓悬垂伸长率,但不会诱导标记的形态扭曲[8.那18那47.].PGD5施加植物疗法真菌的活性和S. Cerevisiae.与真菌膜渗透性的改变有关。这些渗透性菌丝的核似乎完好无损,并且没有悬垂细胞质的肉芽迹象的细胞质,在一些防御素中观察到。但是,PGD5没有活跃C.老年人浓度为50μg/ ml。可能pgd5与精体膜结构相互作用S. Cerevisiae.那不存在C.老年人,引起膜渗透性的结构破坏和改变。然而,更有的研究是辨别渗透本身是否是植物防御素与膜的组分的相互作用的结果,或者用肽触发的细胞内靶或信号通路[22.].
在阳离子存在的肽的抗真菌效力是用于针对在植物防御微生物容量评价特别重要的。大多数植物防御素显示几乎没有或没有抗真菌活性在一价和二价阳离子在生长培养基中存在的浓度高于50或5mm,分别[20.那64.那65.].在这些条件下,植物防御素与其结合位点的相互作用决定了观察到的抗真菌活性的特异性[21.那22.那66.].在本研究中,发现PgD5具有较高的热稳定性和抗真菌活性V. Dahliae.在一价阳离子K+在第二价阳离子的存在下,适度影响++(数字7.).这使得PgD5在农业生物技术和治疗药物设计领域具有吸引力,并可能作为一种可转移的抗性性状用于作物的分子育种。
结论
筛选环境科学技术数据库p . glauca导致了四个同系物的识别PGD1.,指定PGD2-5和endopiceasin这可能是真菌起源。PGD5.在属内完全保守的防御素的编码Picea..重组PgD5在低浓度下对几种真菌植物病原体表现出非形态发生的抗真菌活性,可能与膜渗透有关。PgD5具有较强的抗真菌活性V. Dahliae.即使在高离子强度培养基中也具有特别兴趣,使PGD5成为工程病原体作物的有吸引力的候选者。
方法
植物材料,微生物菌株
离开Picea glauca.从奥卢大学(芬兰)的植物园植物园收集。大肠杆菌DH5α(本实验室保存)用于克隆和质粒扩增。大肠杆菌BL21(折纸的pLys S)DE3(Novagen公司,USA)用作表达宿主。假丝酵母utilis和酿酒酵母酿酒酵母均来自德国波恩大学Pharmazeutische Mikrobiologie des Universitatsklinikums的收藏。在马铃薯葡萄糖琼脂(PDA)上培养酵母。Rizoctonia以上340.58 (CBS),尖孢镰刀菌(CBS 619.87),Botrytis cinerea125.58 (CBS)verticillium dahliae.(CBS 110272)购自荷兰乌得勒支CBS- knaw真菌生物多样性中心。真菌在25°C的PDA中也能维持到产孢。在dH中收获孢子2O和孢子浓度用托马室测定。
数据库搜索和初级设计
通过筛选,发现了植物防御素编码序列p . glauca使用Tblastn的国家生物技术信息(NCBI)的国家中心数据库。使用氨基酸序列进行筛选该数据库Picea glauca.defensin 1(基因库AAR84643):银杏叶防卫素1 [GenBank登录号:AY695796.1]抗旱性防御1 [Genbank:EF455616.1],抗旱性防御2 [Genbank:EF455617.1],抗旱性防御3 [Genbank:JN980401.1]和Pseudoplectania nigrella防御素[Plectasin,Swiss-Prot:Q53i06.1]。基于EST克隆GQ01307_A13和GQ0132.B7_K03设计引物,以鉴定在EST中编码的完整编码序列。
引物设计与防御素基因扩增
基因组DNA被隔离p . glauca叶子。叶子组织被收集起来,在液氮中冷冻,然后用研钵和杵磨成细粉。采用CTAB法提取DNA [67.].
基因组DNA从p . glauca以PCR为模板,分离PGD5.和endopiceasin.使用的两套引物分别为正向引物PgD5F (5'- atggagaagagaatgggcaga -3')和反向引物PgD5rev (5'-TTAACAGGGTTTCTCGCAGA-3')PGD5.,和EST_K03F (5 ' - ATGAAG TTCACCATCTCCATC-3 ')以及反向引物EST_K03rev (5 ' - ctagtagcacttgcaagtggt -3 ')endopiceasin.扩增条件为95℃,3分钟,30次循环:95℃,1分钟,58℃,45℃,72℃,72℃的最终延伸7分钟。将凝胶(Qiaquick PCR纯化试剂盒,QIAGEN)扩增产物连接到PGEM®-T载体(Promega Corporation,Madison,USA)中,并提交给Eurofins MWG操纵子。使用BLAST算法进行核苷酸和推导的氨基酸序列比较。
序列的分析PGD5.在属内Picea.
叶子从几Picea.物种 (P.云杉那p . smithiana那P..Mariana那P. Orientalis,P. Omorika和p . wilsonii)从波恩大学,波恩(德国)和基因组DNA的植物园收集,如上所述分离。基因同源物PGD5.与不同的不同Picea.如上所述的物种。为不同的基因组序列获得Picea.利用ClustalX对物种进行分析和比对[68.].
推导氨基酸序列的生物信息分析PGD5.
的氨基酸序列PGD5.在Vectornti中生产并使用BLASTP算法进行分析。鉴定的同源序列使用CLUSTALX进一步对准[68.].推断出来PGD5.使用Dianna对序列进行二硫化物桥分析[69.];使用I-Tasser Server进行二次结构分析以及同源性建模[70那71.].利用SignalP对PgD5的肽结构进行评估,以确定信号肽序列的存在[72.[蛋白质组分析师专业的子蜂窝定位服务器(PA-SUB)预先预测由信号肽引导的亚细胞定位[73.].肽质量预测是用拓展工具进行的,肽质量进行[74.].
重组生产PGD5大肠杆菌
冠军™的pET SUMO表达系统从Invitrogen购买和用于在重组生产PgD5的大肠杆菌BL21(折纸的pLys S)DE3。该系统允许在Sumo蛋白的N-末端生产His6标签,然后在C-Terminus(他的)的成熟PGD56.-sumo-pgd5)。PGEM-T-PGD5用作制备成熟PGD5序列的模板。使用引物组MPGD5FWD(5'-CGGATGTGTGGGTCGCA-3')和MPGD5REV(5'-TTAACAGGGTTTTTTCTCGCAGA-3')扩增编码成熟形式的PGD5的153-BP片段。将凝胶洗脱的扩增产物连接到线性化PET-SUMO T / A载体中并称为PET-SUMO / PGD5。PET-SUMO / PGD5转化为大肠杆菌DH5α的同源性和正确的序列方向通过测序得到证实。
已构建的PET-SUMO / PGD5质粒转化为大肠杆菌(折纸帘布层S)通过电镀到Luria-Bertani(LB)琼脂中选择DE3表达菌株和细菌菌落,其中25μg/ ml卡那霉素,34μg/ ml氯霉素和12.5μg/ ml四环素。将单个菌落接种至含有抗生素的10ml LB培养基,并在37℃下生长过夜。过夜培养物在相同培养基中1:50(v / v)在没有抗生素的情况下稀释,并在37℃和200rpm的振动培养箱中生长直至光密度(OD6000.6。通过加入0.4mM IPTG并随后用振荡在25℃下培养蛋白表达并随后培养过夜。在4℃下以10,000×g离心收获细胞15分钟,将颗粒在-80℃下储存直至蛋白质提取。
重组融合蛋白的纯化
表达他的每克粒状细胞(湿重)6.-SUMO-PgD5按说明书重悬于10ml BugBuster Protein Extraction Reagent (Novagen)中,补充1mm PSMF。轻轻混合悬浮液以促进细胞裂解,并在4°C下10000xg离心20分钟。将上清液应用于预平衡的Ni-NTA色谱柱上,并加入结合缓冲液(50 mM NaH)2阿宝4.500毫米氯化钠,20毫米咪唑,pH值7)。广泛的洗后绑定缓冲,融合蛋白与洗脱筛选了缓冲区(氯化钠50 mM NaH2PO4, 500毫米,250毫米咪唑,pH值8)。包含融合蛋白的筛选了分数是汇集和透析过夜在4°C 10毫米Tris-HCl包含150毫米氯化钠,pH值8,并浓缩至最后1 - 5ml体积。重组PgD5用1U SUMO蛋白酶每50 μg融合蛋白在0.5 mM DTT存在下30℃下消化1h。
反相高效液相色谱法,使用反相C18柱(0.46×25厘米)用于最终PgD5纯化步骤。色谱以1毫升/分钟和洗脱,从100%溶剂A(0.1%TFA)进行的线性梯度至溶剂B 60%的流率(100%乙腈,含0.1%TFA)历时40分钟进行.将洗脱液通过在220nm处的吸光度的在线测量监测。洗脱的肽冷冻干燥,溶解在蒸馏水中以100μg/ mL的终浓度,并储存在-20℃。
重组PGD5分析与鉴定
用15% [w/v] Tris-Tricine凝胶分离1 μg肽,以评价洗脱的PgD5的纯度[75.];分离后的肽带通过SimplyBlue™SafeStain (Invitrogen)染色可见。纯化肽的分子质量在MALDI-TOF-MS系统(BIFLEX III, Bruker Daltonics GmbH)上进行分析。取等量的1 μL与2 μL α-氰基-4-羟基肉桂酸混合,在磨钢MALDI靶板(Bruker Daltonics GmbH)上斑点,室温风干。在1000-6000 Da的质量范围内,在激光频率为20 Hz的线性模式下记录光谱,并使用FlexAnalysis(2.0版)软件进一步分析。用多肽标准品对光谱进行外部标定。将所得肽的质量与Expasy-Compute pI/Mw工具生成的肽的预测单同位素质量进行比较。
抗微生物活性测定
pgd5对酵母的活性S. Cerevisiae.和C.老年人使用微量肉汤稀释法,在96孔微量滴定板测定(Nunc公司U96微量滴定板)76.].简而言之,孔填充了50μL肽的连续稀释液,并与含有2×10的50ml马铃薯右旋糖浆(PDB)混合6.菌落形成单位(CFU/mL)。加入20 mM Tris溶液(pH 8.0)作为阴性对照。实验至少进行了三次重复。在30°C无振荡培养16 h后,通过测量600 nm的光密度来评估微生物的生长。最小抑制浓度(MIC)定义为不引起光密度变化的最低肽浓度。
在96孔微量滴定板(Nunc F96微量滴定板)中使用显微分光光度法测定PgD5的定量抗真菌活性[77.]和下列真菌病原体:F. oxysporum.那B. Cinerea和V. Dahlia.e.每个孔含有1000个真菌孢子,100 μl半强度马铃薯葡萄糖肉汤(PDB)和纯化的PgD5,浓度从1到50 μg/mL。对照反应不含肽。在23°C的黑暗中孵育3天,每24小时在A595.PgD5防御素活性在真菌的情况下,48小时后计分F. oxysporum.和B. Cinerea和之后的情况下,72小时V. Dahliae.,以生长抑制率表示。生长抑制率定义为100 × A595控制减去A595在a上的样品595管制的范围[76.].我知道了50.被定义为达到50%抑制的蛋白质浓度。
同时测定了抗真菌活性体外针对真菌R. Solani..均匀尺寸的真菌盘接种在含有约15ml PDB的培养皿的中心,并在25℃下温育。当菌丝体直径达到6厘米时,无菌Whatman No.1滤纸盘(直径直径)放置在距中心等距离的板上。将各种量的纯化的PGD5加入到每盘中。将板在25℃下孵育并定期观察,直到菌丝体生长具有包膜控制盘,其中含有无菌蒸馏水生长抑制区,围绕含有PGD5的活性制剂的圆盘形成。
Sytox绿色吸收
用SYTOX GREEN(分子探针;Invitrogen公司,Carlsbad, CA, USA)吸收如前所述[78.] 在尖孢镰刀菌,灰霉病和V. Dahliae..渗透性测定由含有真菌孢子的200mL半强度PDB组成(2×104.孢子/ ml)和pGD5浓度为11μg/ ml的肽F. oxysporum., 4 μg/mLB. Cinerea2 μg/mLV. Dahliae.隔离。真菌菌株在PgD5存在的条件下在25℃下培养48小时。对照样品中不含PgD5。孵化后样本用0.1 Tris-HCl, pH值8和沾在96 - 0.2μM SYTOX绿色微型板块为30分钟25°C与周期性的风潮,其次是在相差显微镜下观察(Axiophoto蔡司)配备检测荧光素的荧光滤光片组(激发波长450 - 490纳米;发射波长500nm)。细胞内荧光显示真菌膜受损。SYTOX绿色摄取S. Cerevisiae.类似地测量,除了细胞密度约为2×108.在11 μg/mL的PgD5存在下,30°C孵育1h。
热稳定性评估及离子对纯化PGD5活性的影响
通过如上所述的抗真菌测定评估纯化的PGD5肽的稳定性。以2μg/ ml的最终肽浓度评估肽的热稳定性V. Dahliae.孢子,肽在25°C, 50°C, 75°C和100°C预处理30分钟,然后开始抗真菌测定。将PgD5活性与在25°C下进行的对照反应进行评分。在类似的实验中,阳离子的存在对PgD5抗真菌活性的影响也进行了测试。在浓度为10 mM和50 mM的KCl和1 mM和5 mM的CaCl培养基中加入阳离子2.一价和二价阳离子对PgD5活性的影响在没有阳离子的对照反应中进行评分。
参考
- 1.
植物防御反应激活的早期事件。《植物学报》,1994,32:479-501。
- 2。
防卫素——植物先天免疫系统的组成部分。植物保护学报,2005,6(1):85-101。
- 3.
van Loon LC, Rep M, Pieterse CMJ:诱导性防御相关蛋白在受感染植物中的意义。植物病理学杂志。2006,44:135-162。
- 4.
Da Cunha L,McFall AJ,Mackey D:植物中的先天免疫:分层防御的连续性。微生物感染。2006,8(5):1372-1381。
- 5。
琼斯达,Takemoto D:植物先天免疫 - 一般和特异性病原菌相关分子的直接和间接识别。Currogin Immunol。2004,16(1):48-62。
- 6。
Broekaert WF,Terras FR,Cammue BP,Osborn RW:植物防御素:新型抗菌肽作为主体防御系统的组成部分。植物理性。1995,108(4):1353-1358。
- 7。
Benko-Iseppon AM, Galdino SL, Calsa TJ, Kido EA, Tossi A, Belarmino LC, Crovella S:植物抗菌肽概述。中国生物医学工程学报。2010,11:181-188。
- 8。
Thomma BP,Cammue BP,TheVissen K:植物防御素。Planta。2002,216(2):193-202。
- 9。
Garcia-Olmedo F, Molina A, Alamillo JM, Rodriguez-Palenzuela P:植物防御肽。生物聚合物。1998,47(6):479-491。
- 10.
Almeida MS,Cabral Km,Kurtenbach E,Almeida Fc,Valente AP:Pisum Sativum Defensin 1的溶液结构高分辨率NMR:植物防御素,具有不同行动机制的相同骨干。J Mol Biol。2002,315:749-757。
- 11.
FANT F,Vranken W,Broekaert WF,伯克汉语F:测定Raphanus Sativus抗真菌蛋白的三维溶液结构1 H NMR。J Mol Biol。1998年,279:257-270。
- 12.
Shiau Ys,Horng SB,Chen CS,Huang Pt,Lin C,Hsueh YC,Lou K1:对新型Mungbean Defensin VRD1独特杀虫活性的结构分析显示出植物防御素和蝎子神经毒素之间同性化进化的可能性。j mol识别。2006,19:441-450。
- 13。
在毕赤酵母中表达的甜菜防御素AX2的加工、二硫键模式和生物活性。中国生物医学工程学报。1999,16(3):377-387。
- 14。
Lay FT,Schirra HJ,Scanlon MJ,Anderson Ma,Craik DJ:Nicotiana alata的新花病素的Theedimensional溶液结构及其在作物防御蛋白Alfafp的同源模型中的应用。J Mol Biol。2003,325(1):175-188。
- 15.
Yeynt Ny,Yeaman Mr:抗菌肽中的多维签名。PROC NATL ACAD SCI。2004,101(19):7363-7368。
- 16。
Yount NY, Andrés MT, Fierro JF, Yeaman MR: gamma-core motif与来自转铁蛋白的含半胱氨酸的kaliocin-1的抗菌活性相关。生物化学学报。2007,1768(11):2862-2872。
- 17。
Terras FR, Eggermont K, Kovaleva V, Raikhel NV, Osborn RW, Kester A, Rees SB, Torrekens S, Van Leuven F, Vanderleyden J, cammuue B, Broekaert W:萝卜中富含半胱氨酸的抗真菌蛋白在宿主防御中的作用。acta botanica sinica, 2017, 36(5): 593 - 598。
- 18。
Carvalho A,Gomes VM:植物防御素 - 用于生物功能和生物技术性质的研究所。肽。2009,30:1007-1020。
- 19。
黄杰,夏L,NG TB:多元化起源的防御素综述。Curr Prot Pept SCI。2005,6:85-101。
- 20。
Osborn RW, De Samblanx GW, Thevissen K, Goderis I, Torrekens S, Van Leuven F, Attenborough S, Rees SB, Broekaert WF:菊科、豆科、海马科和虎耳草科植物种子中植物防御素的分离和特征。FEBS Lett. 1995, 368: 257-262。
- 21。
植物抗真菌防御素与真菌膜组分的相互作用。高分子学报。2003,24:1705-1712。
- 22.
Thevissen K, Warnecke DC, Francois IE, Leipelt M, Heinz E, Ott C, Zahringer U, Thomma BP, Ferket KK, cammuue BP:来自昆虫和植物的防御素与真菌糖基神经酰胺相互作用。中国生物医学工程学报。2004,27(3):493 - 498。
- 23.
thvissen K, cammuue BP, Lemaire K, Winderickx J, Dickson RC, Lester RL, Ferket KK, Van Even F, Parret AH, Broekaert WF:一个编码鞘脂生物合成酶的基因决定了神经鞘脂生物合成酶的敏感性酿酒酵母酿酒酵母从大丽花中提取的抗真菌植物防御素(大丽花merckii).PROC NATL ACAD SCI。2000,97(17):9531-9536。
- 24.
Thevissen K,FrancâoisIeja,Takemoto Jy,Ferket Kka,Meert Emk,Cammue BPA:DMAMP1,来自大丽花的抗真菌植物防御素(大丽花merckii),与鞘脂的相互作用酿酒酵母酿酒酵母.微生物微生物学杂志。2003,26(4):449 - 454。
- 25.
Van der Weerden Nl,Lay Ft,Anderson Ma:植物防御素,NAD1,进入细胞质尖孢镰刀菌菌丝。中国生物医学工程学报。2008,29(3):441 - 446。
- 26.
Lobo DS, Pereira IB, Fragel-Madeira L, Medeiros LN, Cabral LM, Faria J, bello M, Campos RC, Linden R, Kurtenbach E:抗真菌Pisum sativum defensin 1相互作用粗糙脉孢菌与细胞周期有关的细胞周期素F。生物化学学报。2007,46(4):497 - 497。
- 27.
来自高粱(sorghum bicolor (L) Moench)种子的昆虫α-淀粉酶小(5 kDa)蛋白抑制剂家族与小麦γ-purothionins具有序列同源性。王志强,王志强。
- 28.
Chen Kc,Lin Cy,Kuan CC,Sunng Hy,Chen CS:由Mungbean cDNA编码的一种新型防御素,对Bruchid具有杀虫活性。JAgric Food Chem。2002年,50:7258-7263。
- 29.
刘捷,莱姆,恒氏MP,陈CS,Lyu PC:植物防御素VRD1的溶液结构与绿豆及其在杀虫活性对Bruchids的作用。蛋白质。2006,63:777-786。
- 30.
Mendez E,Moreno A,Colilla F,Pelaez F,LiMAS GG,Mendez R,Soriano F,Salinas M,De Haro C:初级结构和蛋白质合成在一种新型Thionin,Gamma-Hordothionin的真核细胞系统中的抑制作用从大麦胚乳。EUR J Biochem。1990年,194:533-539。
- 31.
Mendez E,Rocher A,Calero M,Girbes T,Citores L,Soriano F:Omega-Hordothionin的初级结构,来自大麦胚乳的新颖家族家族的成员,并抑制了真核生物和原核细胞蛋白质合成的抑制作用系统。EUR J Biochem。1996,239:67-73。
- 32.
Melo Fr,Rigden DJ,Franco Ol,Mello Lv,Ary MB:Grossi de SA MF,Bloch C JR:豇豆胰蛋白酶的抑制:表征,分子建模和对接。蛋白质。2002,48(2):311-319。
- 33.
Mirouze男,SELSĴ,理查德O,Czernic P,洛贝特S,雅基耶A,弗朗索瓦IE,Cammue BP,Lebrun的男,Berthomieu P,Marques的L:对植物防御素推定的新的作用:从锌超积累植物防御素那rapidopsis halleri,赋予锌宽容。植物杂志2006年,47:329-342。
- 34.
Spelbrink RG,Dilmac N,Allen A,Smith TJ,Shah DM,Hockerman GH:结构相关植物防御素之间的差异抗真菌和钙通道阻断活动。植物理性。2004,135:2055-2067。
- 35.
Kushmerick C, Castro MS, Cruz JS, Bloch C, Beirão PS:新型钠通道阻滞剂g-zeathionins的功能和结构特征。中华人民共和国农业部。1998,44:302-306。
- 36.
黄GJ,赖鹤,常益,Sheu MJ,Lu TL,黄SS,林YH:抗菌,脱氢血酸还原酶和甘薯防御素的单次羟基血基酸盐还原酶活性[Ipomoea Batatas.(l)林。'泰农57 ']贮藏根。中国农业科学,2008,29(6):641 - 646。
- 37。
Chen Z,Gallie Dr:脱氢血酸盐还原酶影响叶片生长,发育和功能。植物理性。2006,142:775-787。
- 38。
黄建华,张新强,王红霞,黄志明菜豆).医药科学。2006,27:2075-2081。
- 39。
YE XY,NG TB:来自Pinto Bean和红豆的肽与牛皮10-KDA蛋白前体的序列同源性表现出抗真菌,丝分裂和HIV-1逆转录酶抑制活性。Biochem Biophys Res Communce。2001,285:424-429。
- 40。
YE XY,NG TB:来自米豆的新的抗真菌肽。j肽res。2002,60:81-87。
- 41。
跨国N, Paule C,帕森斯L,乌鸦JA,莫伦西MJ,库克JEK,约翰逊我Noumen E, Guillet-Claude C,巴特菲尔德Y,理发师年代,杨G,刘J,斯托特J,柯克帕特里克R,西迪基,霍尔特R,马拉M·赛甘·A, Retzel E, Bousquet J,麦凯J: 16500代、注释、分析和数据库集成白云杉EST集群。生物医学工程学报。2005,6:144。
- 42。
白云杉针叶树基因组分析的基因目录。植物生理学报。2011,57(1):14-28。
- 43。
Pervieux I,Bourassa M,Laurans F,Hamelin RC,SéguinA:血液防御素显示出强烈的抗真菌活性和伤害后的成绩单累积增加,茉莉酸盐治疗。生理和分子植物病理学。2004,64:331-341。
- 44。
Sawano Y, Miyakawa T, Yamazaki H, Tanokura M, Hatano K:银杏种子抗真菌蛋白的纯化、鉴定和分子基因克隆。中国生物化学学报。2007,32(3):403 - 411。
- 45。
朱S:真菌的六个家庭的发现防御素样肽提供分析上市公司CSalphabeta防御素的起源和演化。Mol免疫酚。2008年,45:828-838。
- 46.
苏格兰松防御素2的分子克隆与鉴定。中国生物医学工程学报。2008,42(6):408-412。
- 47.
De Beer A,Vivier MA:VV-AMP1,来自熟肽的熟肽vitis Vinifera具有较强的抗真菌活性。生物医学工程学报。2008,8:75。
- 48.
Fernández-ocañaa,garcía-lópezmc,jiménez-ruizj,Saniger L,Macíasd,纳瓦罗F,Oya R,Belaj A,De La Rosa R,Corpas FJ,Barroso JB,Luque F:识别所涉及的基因栽培橄榄树中的青少年到成人过渡(Jat)。树遗传学和基因组。2010,6:891-903。
- 49.
Mygind Ph,Fischer RL,Schnorr,Hansen Mt,SönksenCP,Ludvigsen S,Raventósd,Buskov S,Christensen B,De Maria L,Taboureau O,Yaver D,Elvig-JørgensenSG,SørensenMV,Christensen,Kjaerulff S,Frimodt-Moller N,Lehrer Ri,Zasloff M,Kristensen HH:Plectasin是一种肽抗生素,具有来自嗜胞菌真菌的治疗潜力。自然。2005,437(7061):975-980。
- 50.
宿主防御肽的抗菌素活性:比脂质双分子层的干扰更强。中国科学(d辑),2011,28(8):1350-1358。
- 51.
施耐德T,Kruse T,Wimmer R,Wiedemann I,Sass V,Pag U,Jansen A,Nielsen AK,Mygind PH,RaventósDS,Neve S,Ravn B,Bonvin Am,De Maria L,Andersen As,Gammelgaard LK,Gammelgaard LK,Gammelgaard LK,SahlHg,Kristensen HH:Plectasin,真菌防御素,靶向细菌细胞壁前体脂质II。科学。2010,328(5982):1168-1172。
- 52.
Sagaram US,Pandurangi R,Kaur J,Smith TJ,Shah DM:用不同的作用方式对抗Fusarium Graminearum的不同作用模式,抗真菌植物的结构 - 活性决定因素。Plos一个。2011,13:6(4)。
- 53.
拟南芥中300多个防御素类基因的基因组结构。植物营养与肥料学报。2005,32(4):441 - 446。
- 54.
Sharma P,LönneborgA:从挪威云杉根部编码植物防御素样蛋白的cDNA的分离和表征。植物mol biol。1996,31(3):707-712。
- 55.
防御素:天然免疫的抗菌肽。自然免疫学报,2003,3:710-720。
- 56.
Lamberty M,Ades S,Uttenweiler-Joseph S,Brookhart G,Bushey D,Hoffmann Ja,Tumet P:虫免疫。从鳞片中分离Heliothis virescens一种具有强抗真菌活性的新型昆虫防御素。中国生物医学工程杂志。1999,27(4):531 - 534。
- 57.
Lacadena Y:Martinez的德尔Poxo A,加塞特男,帕蒂诺B,Campos的-奥利瓦斯R,Vazquez的C,Martinez的-Ruiz的A,Mancheno JM,Onaderra男,加维拉内斯JG:由模具巨曲霉分泌的抗菌蛋白的表征。弧生物化学生物物理学。1995年,324:273-281。
- 58.
植物内生真菌对被子植物DNA污染的影响。植物学报2001,19:249-260。
- 59.
关键词:云杉针叶树,内生真菌,DNA,污染来源生态学报,1997,6:983-987。
- 60。
Arnold Ae,Mejia Lc,Kyllo D,Rojas Ei,Maynard Z,Robbins N,Herre EA:真菌内心细胞在热带树中限制病原体损伤。PROC NATL ACAD SCI。2003,100:15649-15654。
- 61。
Broekaert WF,Cammue BPA,Debolle MFC,TheVissen K,Desamblanx G,Osborn RW:来自植物的抗菌肽。CRIT Rev Plant Sci。1997,16(3):297-323。
- 62。
de Beer A, Vivier MA:四种来自南非本土芥菜科植物的防御素对两种测试病原体表现出不同的活性,尽管编码基因的序列高度相似。北京科技大学学报(自然科学版)。
- 63。
Slavokhotova AA,Odintsova Ti,Rogozhin EA,Musolyamov Ak,Andreev ya,Grishin Ev,Egorov Ta:来自普通鸡草(Stellaria Media L.)种子的新型防御素的分离,分子克隆和抗微生物活性。生物chimie。2011,93(3):450-456。
- 64。
teras FR, Schoofs HM, De Bolle MF, Van Leuven F, Rees SB, Vanderleyden J, cammuue BP, Broekaert WF:萝卜中两种新型植物抗真菌蛋白的分析(萝卜L.)种子。J Biol Chem。1992,267(22):15301-15309。
- 65。
Terras FR,Torrekens S,Van Leuven F,Osborn RW,Vanderleyden J,Cammue BP,Broekaert WF:一种来自Brassicaceae物种的新碱性半胱氨酸植物抗真菌蛋白质。费用。1993年,316(3):233-240。
- 66。
关键词:神经鞘脂,真菌,选择性抗真菌疗法[j] .中国医药导报,2005,6(8):923-928。
- 67。
Pirttiläma,hirsikorpi m,kämäräinent,jaakola l,Hohtola a:用于药用和芳香植物的DNA隔离方法。植物mol Biol rep。2001,19:273a。
- 68。
汤普森JD,吉布森TJ,Plewniak楼Jeanmougin楼希金斯DG:该CLUSTALX Windows界面:由质量分析工具辅助的多序列比对灵活的策略。核酸研究。1997年,25:4876-4882。
- 69。
Ferrè F, Clote P: DiANNA:二硫化物连接预测的web服务器。核酸学报2005,1:33。
- 70。
Ambrish R,Kucukural A,张Y:I-Tasser:用于自动蛋白质结构和功能预测的统一平台。NAT PROTOC。2010年,5:725-738。
- 71。
张勇:用于蛋白质三维结构预测的I-TASSER服务器。生物信息学。2008,9:40。
- 72。
信号肽的预测:SignalP 3.0。中国生物医学工程学报,2004,30(4):593 - 598。
- 73.
蛋白质组分析专家亚细胞定位服务器。http://www.cs.ualberta.ca/%7Ebioinfo/PA/Sub/index.html.
- 74.
Expasy蛋白质组学工具。http://us.expasy.org/tools/.
- 75.
Schagger H, von Jagow G:用于1 - 100 kDa范围内分离蛋白质的tricine -十二烷基硫酸钠-聚丙烯酰胺凝胶电泳。生物化学学报。1987,33(4):469 - 474。
- 76.
关键词:大麦,抗真菌蛋白,分离纯化,分子生物学Acta physica sinica, 2003,23(4): 427 - 434。
- 77.
Broekaert W,Terras F,Cammue B,Vandereyden J:用于真菌生长抑制的自动化测定。有限元微生物吧。1990,69:55-60。
- 78.
TheVissen K,Terras FR,Broekaert WF:植物防御素的真菌膜渗透抑制真菌生长。申请环境微生物。1999,65:5451-5458。
确认
我们要感谢以下成员Institutfürmikrobiologie和Biotechnologie derUniversität波恩,M Josten负责LC-MS分析,P Saas博士负责活细胞成像显微镜,I Stock负责修改手稿。这项工作得到了欧盟7国资助的玛丽·居里产学研伙伴关系和路径(IAPP)的财政支持TH.研究和技术发展框架计划,新型抗菌素(NAM)项目(PIAP-GA-2008-218191)。
作者信息
隶属关系
相应的作者
附加信息
作者的贡献
HGS和HHK监督工作并帮助概念设计和稿件准备以及最终数据分析。PP,AMP和DR概念和实验设计和PP负责所有研究程序,数据分析和写作纸张。作者宣称没有利益冲突。所有作者阅读并认可的终稿。
电子补充材料
推导的氨基酸序列的比对分析
额外的文件1:endopiceasin数据库搜索发现。EST GQ0132.b7_k03(endopiceasin)是通过筛选发现的p . glauca使用菌丝霉素的氨基酸序列EST数据库。相比于菌丝霉素的百分比相似性在最后一列表示。(PPTX 46 KB)
完整的编码序列和推导的氨基酸序列
额外的文件2:endopiceasin编码在EST GQ0132.B7_K03中。下划线的氨基酸代表信号肽,红色的氨基酸表示促肽,而蓝氨基酸表示成熟肽。(PPTX 55 KB)
与防御素家族的其他成员endopiceasin的成熟区域的比对。
附加档案3:尾剂的对准分析。与尾剂酶素相比的百分比相似于最后一列表示。[Swiss-prot:Q53i06.1]来自真菌的plectasinPseudoplectania nigrella;[Genbank:Bab41027.1] Defenisn A来自节肢动物Ornithodoros moubata.;[GenBank:ABI52817.1]防卫素B来源于节肢动物Argas monolakensis。6个半胱氨酸残基用黄色表示,二硫桥模式如下所示。(PPTX 47 KB)
对准分析
额外的文件4:PGD5.从不同的基因组副本Picea.sp。序列之间的差异用黄色表示。内含子序列用小写表示。(PPTX 89 KB)
作者的原始提交的图像文件
以下是与作者的原始提交的图像的链接。
权利和权限
本文由BioMed Central Ltd授权发表。这是一篇基于知识共享署名许可协议(http://creativecommons.org/licenses/by/2.0)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
Picart, P. Pirttilä, a.m., Raventos, D.等等。的防御素编码基因的识别Picea glauca.:PGD5的表征,保守云杉防御素,具有强抗真菌活性。BMC植物BIOL.12,180(2012)。https://doi.org/10.1186/1471-2229-12-180
收到了:
公认:
发表:
关键词
- 云杉防御素
- Endophyte.
- 抗真菌活动
- 膜透化性