摘要
背景
当环境条件有利时,营养芽为温带环境中的植物提供了生长和繁殖的可能。在葡萄中,重要的发育事件在连续的两个生长季节发生在芽内。在第一个季节,芽内的茎尖分生组织区分了茎的所有基本元素,包括侧面原基的开花过渡和花序原基的发育。这些事件实际上以花蕾休眠而结束。第二个季节,芽恢复与花的形成和发育相关的芽的生长。基因表达之前已经在芽发育的特定阶段进行了监测,但从未在两个生长季节进行过跟踪。
结果
在8个不同时间点沿花蕾年周期分析了基因表达的变化。主成分分析(PCA)结果表明,芽休眠和活跃生长过程以及胁迫响应是导致基因整体表达差异的主要因素。因此,非休眠芽表现出活跃增殖和生长细胞的典型功能类别的丰富,以及属于应激反应途径的过多转录本。在连续时间点之间进行的差异表达分析表明,主要的转录变化与对休眠/内休眠、内休眠/生态休眠和生态休眠/破芽过渡有关。编码生殖发育关键调控因子的转录本被分为三个主要表达簇,对应于:(i)与开花诱导相关的转录本,(ii)与花分生组织规范和启动相关的转录本,以及(iii)与休眠相关的转录本.在这个簇中,一个MADS-box基因(VvFLC2)等具有相似表达模式的转录本可参与休眠调控。
结论
这项工作提供了在葡萄芽发育过程中发生的主要转录变化的全局视图,突出了在芽发育的主要事件中涉及的分子和生物学功能。与其他木本植物的研究结果一样,这一结果表明,葡萄中调控开花的基因也可能参与调控休眠的途径。
背景
与一年生植物相比,多年生木本植物具有特定的形态和生理约束,从而导致了不同的生殖和体细胞发育策略。多果性木本植物发育顶芽或腋芽,胚芽可在特定信号后发育出完整的分枝[1].为了躲避不利的环境条件,这些芽变得休眠,提供了在可行条件下恢复生长的可能性。芽的休眠状态有三种:(1)由植株远端器官诱导的休眠状态;(ii)内休眠,由于芽本身内部的信号;(iii)生态休眠,当芽的生长受到低温等环境因素的阻碍[2,3.].
芽段/内休眠过渡(也称为内休眠开始)通常由环境因素触发。其中,白昼长度和温度是调节温带许多植物物种这一过程的稳定年度线索。Endo/生态休眠转变(或内休眠释放)需要完成一段冷却期,使芽处于生态休眠阶段,在一段有利的温度条件下,芽容易破裂[4- - - - - -7].内休眠的启动和释放调控涉及植物激素,如生长素、乙烯、脱落酸和赤霉素,这些激素也可与糖信号相互作用[4,6].贯穿染色质修饰的表观遗传调控也被提出参与基于几种染色质修饰蛋白差异表达的休眠调控过程[5].
在设置休眠顶芽的木本物种中,营养生长的停止先于休眠的开始,顶芽直接从茎尖分生组织(SAM)分化。因此,芽的形成伴随着休眠的开始[6- - - - - -8].在其他木本植物中,包括葡萄藤,腋芽在感知到触发休眠的环境信号时进入休眠状态,而SAM在环境条件变得不利时停止生长[9,10].
关于木本植物芽休眠的分子机制知之甚少。休眠的光周期调节可能涉及光敏色素(体育)和生物钟,因为过度表达巴防止短日(SD)光周期内休眠的诱导杨树[11,12].此外,有人提出调控休眠开始和释放的信号通路可能与开花调控共享遗传成分,例如开花位点T(英国《金融时报》)/终端花(TFL1)和MADS-box基因家族[5].这两个英国《金融时报》而且TFL1同源物被压抑在杨树环境因素导致的休眠[5,11,12].而且,过度表达巴在转基因杨树防止英国《金融时报》而且TFL1同系词:压抑和休眠的开始[12].最后,两种基因都因低温而上调,导致内休眠释放[13].
MADS-box转录因子家族的一些成员,如开花位点C(方法),短营养期(高级副总裁),参与拟南芥开花反应的温度调节[14,15],可参与调节多年生木本植物的芽休眠。方法同系物在内休眠时表达上调,在休眠解除后表达降低枳壳和绿叶spurge [16,17].同样的,高级副总裁同系物,称为与休眠相关的MADS箱(大坝)基因,也参与了多年生木本植物的生长停止和终端芽的形成,如桃、覆盆子、猕猴桃、杏、多叶重叶草、枳壳或杨树[18- - - - - -24].桃子囱丰(evg)突变体,已被证明携带6个缺失高级副总裁类基因(PpDAM1-6)导致末端芽分生组织完全不休眠[18].考虑到这些证据,有人提出方法而且高级副总裁-like基因可以通过抑制来发挥作用英国《金融时报》表达,如拟南芥开花期间的表达[15].这会引起生长停止和/或内休眠[5,17].
在葡萄中,冬休芽由侧枝的基生腋芽发育而来。这些芽在同一生长季节由芽开始生长。休眠芽是受苞片保护的复杂器官,由一个原芽和一个或两个附加的次生芽组成[9,10,25].这些芽的生长和发育最初受到来自顶端的矛盾信号的阻碍。然而,这些潜伏的芽保持活跃的细胞分裂和分化过程,直到(在夏末)感知到SD光周期和温度下降,这将触发葡萄休眠的开始[2,25].研究表明,当芽已经经历了足够的寒冷时,内休眠就会结束[25,26].然而,在温度允许的情况下,芽仍保持生态气味。当生态通气被释放时,芽会膨胀,原芽中的芽尖分生组织(SAMs)遵循器官分化和生长的程序,从而产生新的季芽[10,27].在北半球,准休眠/内休眠过渡在8月开始,休眠状态在11月解除[28].葡萄开花诱导发生在第一个生长季节的潜伏芽中,而花分生组织和花器官则在连续一年的第二个生长季节发育[10,29,30.].葡萄花序和花的发生和发育过程已被广泛研究。31- - - - - -33].
最近的工作研究了芽对冷却反应的转录特征[34],光周期[35]和打破休眠处理[36,37].他们的结果导致了在开花和休眠中具有双重作用的候选基因的鉴定葡萄属锐利[34,35]并提出氧化应激作为休眠释放机制的一部分的作用[36- - - - - -38].
在这项研究中,我们沿着包括两个生长季节在内的完整的年度周期跟踪了葡萄芽的转录组。芽的转录组分析确定了转录组变化的三个主要阶段,主要与休眠有关。此外,mikc型MADS-box基因家族成员的表达[39),SPL(鳞状细胞启动子结合蛋白样)家庭,FT-TFL1家庭(31]和VFL吉恩(小道消息Floricaula /叶直接同源)[40],在芽发育过程中也进行了分析。
结果与讨论
芽转录组沿年周期变化
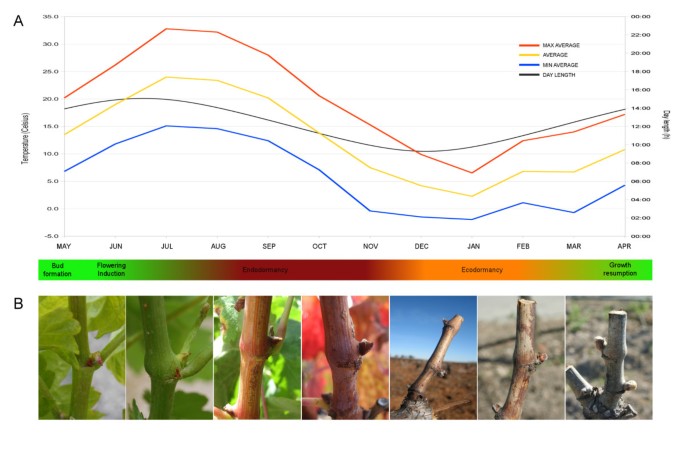
葡萄芽的发育受温度和日照长度等环境因素的调节[25].在我们的实验条件下,丹魄酒。潜伏芽在4月至5月的第一个生长季节(APR-MAY)在幼芽茎中形成,并经历积极的发育过程,包括建立营养和生殖生长,直到次年夏末(图2)1) [32].开花诱导发生在6月中旬左右的潜芽中,花序原基与茎尖发育的侧分生组织不同。花序分生组织沿7月(JUL)和8月(AUG)在复杂花序原基中增殖产生花序分枝分生组织[40].在我们的生长条件下,丹魄花蕾在9月下半月(SEP)进入内休眠状态,并在11月底(NOV)释放内休眠状态,但从12月12日至3月3日,丹魄花蕾仍处于生态抑臭期[41].一旦冬季结束,生态气味被释放,花序分支分生组织增殖,在四月(APR)产生花分生组织,开始第二个生长季节[40].
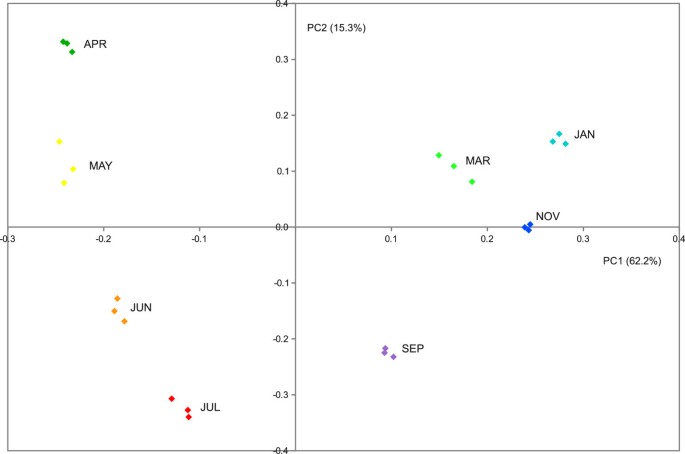
对每年8个不同时间点采集的芽样进行高通量转录分析(见方法)。主成分分析(PCA)在整个表达式数据集(附加文件)上执行1)验证不同生物重复之间的相关性,并确定基因表达变异的主要来源。PCA图的结果在生物重复中显示出一致性,如图所示2.前两个主成分(PC1和PC2)解释了基因表达总变异性的77.5%(分别为62.2%和15.3%)。PC1似乎代表了芽发育阶段的时间进程演变,随着芽的膨胀,PC1似乎被重置到原来的状态,因为第二季的APR芽样本与第一季的MAY芽样本相邻(在同一象限),表明这两个阶段的转录组高度相似。PC2突出JUN、JUL和SEP样本和其余时间点之间的主要转录组差异。
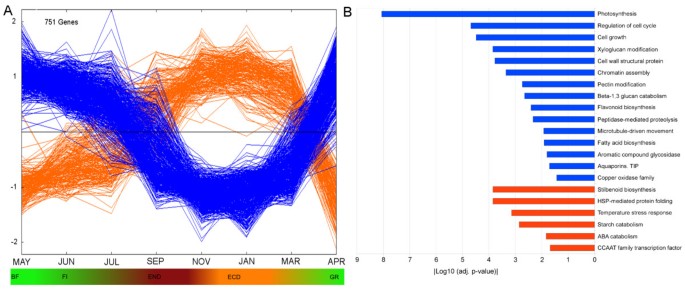
为了研究主成分的生物学基础,根据其PC1和PC2组分评分(CS)的绝对值来确定分析中对各组分贡献最大的转录本(附加文件)2而且3.).数字3.A为主要参与PC1的转录本的表达谱。CS值为负的转录本(547个,蓝色)在非休眠芽中表达上调,在内休眠时表达下降,在生态休眠时表达最低。CS值为正的转录本(204个转录本,橙色)呈现相反的趋势(图3.A).功能富集分析表明,转录本在非休眠芽中上调,具有活跃增殖和生长的细胞特征(图3.B).其中,与细胞分裂、细胞生长和分化(细胞周期调控、微管驱动运动、染色质组装、细胞生长、肽酶介导的蛋白水解和细胞壁代谢)以及与一级和二级代谢(光合作用、脂肪酸生物合成、类黄酮生物合成和芳香族化合物糖苷化)相关的转录本CS值较高。
另一方面,在休眠芽(橙色)中富集PC1的最显著的功能类别是那些与应激反应相关的功能类别(二苯乙烯类生物合成、“热休克蛋白介导的蛋白质折叠”、温度应激反应以及CCAAT转录因子家族)[42].这些功能可能与芽对脱水和温度变化的反应有关,这些反应与休眠一起发生杨树[24].此外,观察到的ABA分解代谢相关基因的上调可能与该激素在休眠释放前的衰退有关[5].最后,淀粉分解代谢基因表达的增加和编码光合蛋白基因的下调,也在杨树[24],与休眠芽的生理状态相一致。
关于PC2,导致其负值的丰富功能类别是与JUN、JUL和SEP样品的应激反应特征相关的功能类别,而与其正值相关的功能类别是与细胞增殖相关的功能类别,在非休眠芽中表达较高(附加文件)4).因此,PC2可以代表花蕾从JUN到SEP所经历的胁迫相对于其余阶段的转录效应。
总之,我们的研究结果表明,主动生长、休眠和应激反应是影响花蕾年周期中观察到的基因表达变异的主要因素。细胞活跃增殖和生长的过程在非休眠芽中上调,而在休眠芽中下调,同时应激反应通路上调。
芽发育转变中的转录组变化
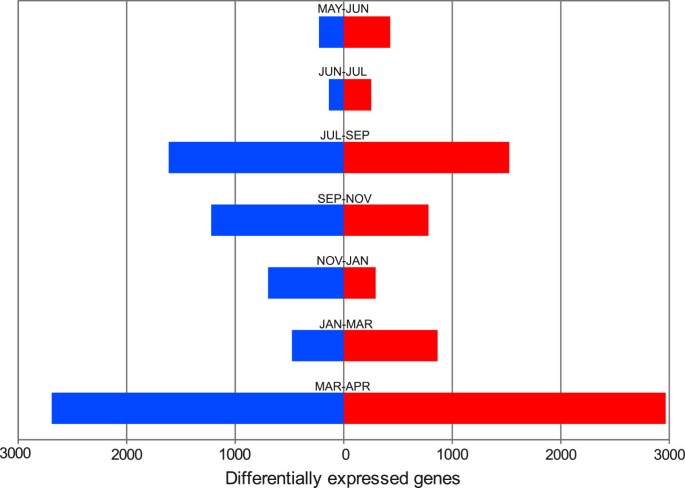
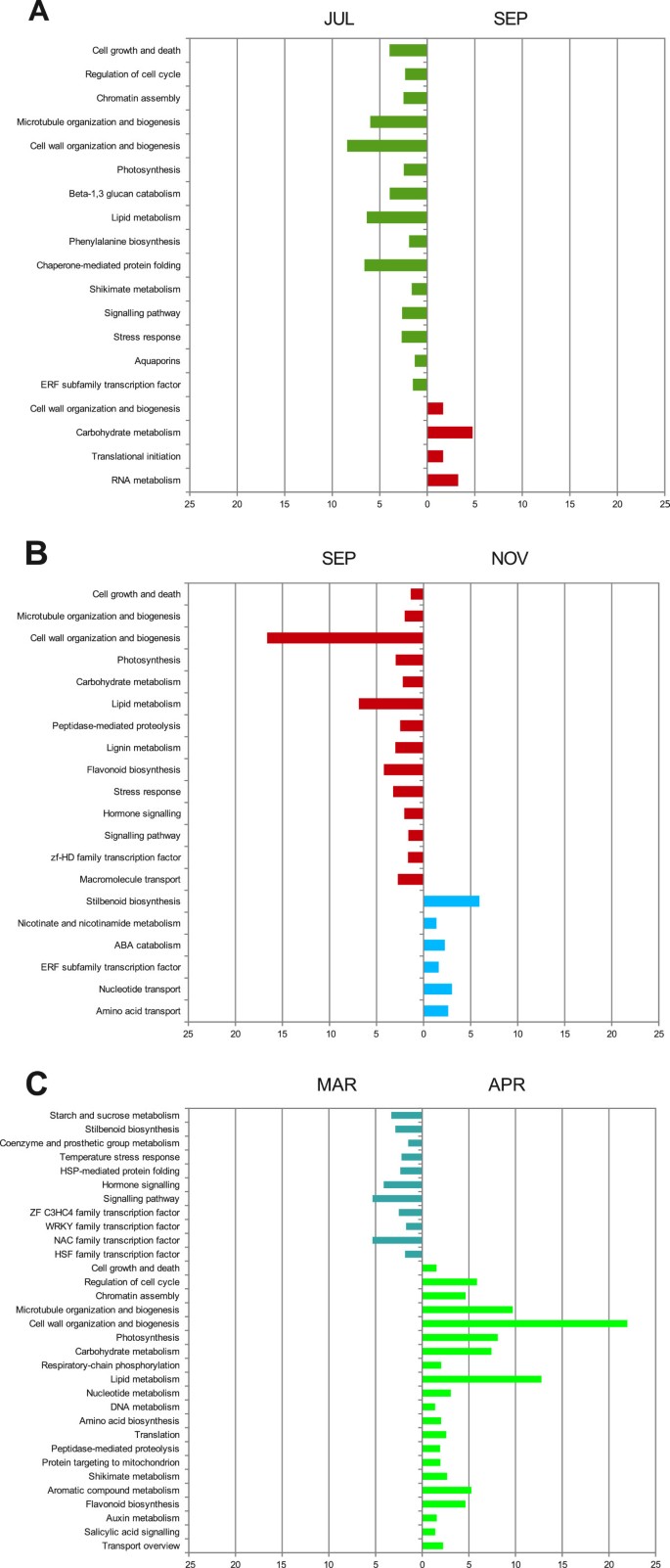
为了确定在芽的年度周期中代表主要转录组变化的发育阶段,我们在连续时间点之间进行了成对差异表达分析。差异表达基因的数量在样本对比较中差异显著(图4).主要变化发生在7月和9月(涉及3139份成绩单)、9月和11月(涉及2002年成绩单)以及3月和4月(涉及5658份成绩单)。有趣的是,这些转变可能分别与拟态/内休眠、内态/生态睡眠期和生态睡眠期/破芽转变的时间有关[28,41].这些结果支持了PCA实验的结论,表明芽休眠和活跃生长之间的转变解释了芽基因表达谱的大部分变化。
为了确定涉及三个主要芽转录变化的生物学功能,我们进行了功能类别富集的研究(图5).段/内休眠过渡(JUL到SEP)(图5A)的特征是丰富的功能类别大幅减少,这主要有助于图中的PC13..其中,与细胞增殖(包括细胞周期、染色质组装、微管组织和生物发生的调控)和细胞生长与死亡相关的范畴从JUL下调至SEP。这些结果与其他系统中描述的芽休眠期间这些过程的关闭一致[24,43].细胞壁组织和生物发生也与细胞过程有关,内休眠显著减少。细胞壁的修饰,主要是木葡聚糖代谢和细胞壁蛋白,在JUL中是富集的一类,而在SEP中不是。而细胞壁生物合成(主要包括纤维素生物合成转录物)在SEP中是显著的一类。碳水化合物的代谢在某些方面与细胞壁代谢相关,因此JUL中以1,3-β-葡聚糖分解代谢为主,而SEP中碳水化合物代谢主要以淀粉和蔗糖代谢为主。这些结果可能与胼胝质封闭胞间连丝以降低其大小限制有关,这一过程依赖于1,3-β-葡聚糖合酶和1,3-β-葡聚糖酶活性。此外,必须修改细胞壁组成,以减少在此阶段细胞间的水和分子运动[44].
在准休眠/内休眠过渡期间,光合作用相关功能类别的表达也减少了,这与文献中报道的结果一致杨树[24].脂质代谢(包括脂肪酸生物合成、甘油脂代谢和氧脂素)在这一转变中也未得到充分代表。这种变化可能与脂质体(LBs)的形成有关,脂质体可以储存三酰甘油,并提高内休眠前的耐冻性,这在其他系统中已经报道过[44].然而,据我们所知,尚无细胞学证据证明葡萄芽中存在LBs的形成。
从JUL到SEP,其他重要的功能类别是与应激反应(主要是非生物和温度)、伴侣介导的蛋白质折叠和水通道蛋白(主要是TIP)相关的功能类别。在杨树,负责适应脱水和低温的基因已被证明在没有这些压力的情况下也表达了对SD的反应[24].在叶状鞭毛中,秋季和冬季对冷胁迫的响应基因也上调[43].在信号通路功能类别中,JUL和SEP之间有129个转录本下调。其中,水杨酸介导的信号显著富集,这可能与应激反应以及诱导植物抗炎素生物合成有关[45].
在此比较中,转录因子功能类别在下调的转录物中也显著富集。其中,ERF亚家族(9个转录本)也被证明显著富集,在AP2-like [46]转录因子家族,大多数与乙烯调控反应有关。在杨树,一些erf样转录本在SD光周期开始时的短暂表达表明乙烯在调控休眠中发挥了作用[24].事实上,杨树在乙烯或与内休眠诱导相关的乙烯感知中,有一个瞬时峰值[5].
从JUL到SEP表达上调的转录本中,只有少数功能类别显著富集。除了前面描述的细胞壁组织、生物发生和碳水化合物代谢相关的功能类别外,核苷酸和核酸代谢、蛋白质代谢相关的功能类别也显著富集。其中,RNA代谢富集和翻译启动可以揭示依赖于存储的准备翻译的mrna转录本的机制的存在,如干被子植物种子中所描述的[47].
内do/生态常态转换(SEP到NOV)(图5B)的特征是参与细胞过程以及初级和次级代谢功能类别的转录本进一步下降,类似于在准休眠/内休眠过渡中观察到的情况。与细胞壁代谢和生物发生相关的功能类别(主要基于纤维素的生物合成、果胶的分解代谢以及果胶和木葡聚糖的修饰)在SEP中仍然相关,并在11月进一步下调。此外,与NOV相比,SEP中下调的碳水化合物代谢相关转录本现在对应低聚糖代谢和葡聚糖分解代谢。年报道了类似的情况葡萄属锐利在内休眠释放所需的冷却期间[34].从SEP到NOV,应激反应的代表性也不足,尤其是与氧化应激相关的类别。氧化应激反应机制在内源性休眠释放前的激活与先前的报道一致,这些报道表明氧化应激影响线粒体功能可参与葡萄内源性休眠释放[36,37].
另一方面,从SEP到NOV的转变以ABA分解代谢的富集为标志,这与ABA在内休眠中的作用以及在内休眠/生态休眠转变中ABA的衰减相一致[5].ABA水平与一些物种的芽休眠有关,并在向生态休眠过渡的整个过程中衰减。无论是在杨树ABA含量在SD处理数周后达到峰值,随后下降[24,43].此外,据报道,在葡萄内休眠释放所需的冷却期间,aba相关的转录本也被下调[34].NOV的芽也显示出丰富的二苯乙烯类生物合成,在葡萄中通常对生物和非生物激发子有反应[48].最后,NOV中烟酸盐和烟酰胺代谢的富集以及核苷酸和氨基酸的转运可能表明某些代谢活动的启动与内do/生态气味转变平行。有趣的是,在JUL和SEP中显著富集的转录因子ERF亚家族也在NOV和SEP中发现。此外,其中5个转录因子在JUL和NOV中普遍存在,这表明在对休眠/内休眠转换之前和内休眠/生态休眠转换之后具有共同的功能。
生态常态/芽裂转变(MAR到APR)(图5C)的特征是参与淀粉和糖分解代谢的特定功能类别或主要与前一时期相关的信号和应激反应的下调。在已知参与应激适应反应(如HSF)的转录因子家族中也观察到类似的表达不足[49], nac [50]及WRKY [51]科,正如在其他物种中所报道的那样[19,43].相比之下,APR的破芽特征是存在JUL中在芽准休眠/内休眠转变前富集的大部分功能类别。这些类别与细胞增殖(染色质组装、微管组织和生物发生、细胞周期调节)和细胞生长(细胞生长和死亡、细胞壁组织和生物发生、光合作用和初级和次级代谢)所需的细胞过程有关。细胞壁组织和生物发生以及碳水化合物代谢类别(单、寡、多糖,更具体地说葡聚糖和1,3-β-葡聚糖分解代谢)的上调,也可能与在胞间连丝胼胝质水解过程中恢复细胞壁性质和细胞通讯有关。应用休眠释放剂后葡萄中1,3-β-葡聚糖酶的诱导也有报道[38].次生代谢类别包括黄酮类化合物生物合成富集(主要是花青素)以及芳香族化合物和莽草酯代谢,可能是黄酮类化合物前体。有趣的是,显著富集的激素信号功能类别是与生长素和水杨酸相关的激素信号功能类别,它们可能在细胞增殖和扩张中起作用[52]以及对生物压力的反应[45].
生殖发育关键调控因子的表达谱
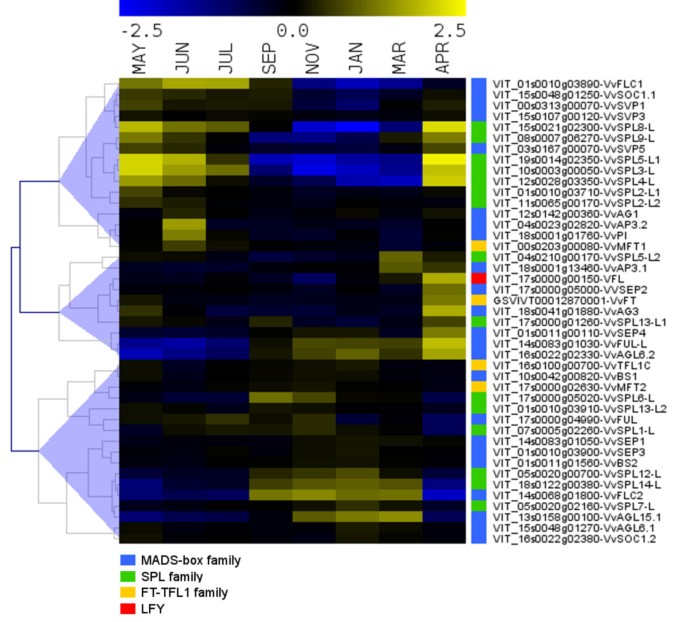
葡萄的开花诱导发生在初夏的潜伏芽中,而花的分生组织分化和花的发育则发生在第二个生长季节[10,30.- - - - - -33].为了鉴定可能参与开花诱导和花发育的基因,我们详细检查了生殖发育关键基因的表达谱,如VFLmikc型MADS-boxSPL和FT-TFL1基因家族。根据这些转录本的芽表达值沿年周期进行分层聚类,如图所示6.与前一节中描述的主要芽转录谱一致,这些转录本的表达分析确定了三个主要的不同簇。第一簇转录本在非休眠芽中上调,在休眠芽中下调。第二簇包含在破芽期间表达水平最高的转录本。第三簇转录本在休眠芽中上调,表达与簇1相反。
簇1显示在花序原基启动和增殖时潜伏芽中表达的转录物。这个簇中的一个特征良好的基因是MADS-box基因VvSOC1.1[39],这种表达模式表明它可能在开花诱导中发挥关键作用SOC1,其拟南芥同系物[53].簇1中的其他MADS-box基因是MADS-box的成员方法(VvFLC1),高级副总裁亚科(VvSVP1,VvSVP3而且VvSVP5) [39].VvFLC1在第一个生长季节表现出高表达,在休眠期间下降,在第二个生长季节再次增加(附加文件)5).三种葡萄藤的表达模式高级副总裁同源物明显不同于观察到的高级副总裁拟南芥[54].它们在开花诱导时表达量高,休眠时表达量降低,在花分生组织形成时表达量再次升高。的表达无明显变化高级副总裁在葡萄藤的芽休眠过程中观察到同源性,这并不能证明它们在这一过程中的作用,正如在其他物种中所报道的那样[18- - - - - -24].集群1也包括在内VvMFT1[31的成员FT-TFL1转录调控因子家族[55,56],在第一季表达量最高。此外,检测该集群内的APETALA3.2,PISTILLATA而且无性生殖的同源性表明,这些参与花器官鉴定的基因可能已经在第一季芽的花序分生组织中表达,为第二生长季发生的花器官鉴定做准备。最后,聚类1包括许多同源的A. thaliana SPL基因(Spl2, spl3, spl4, spl5,SPL8而且SPL9)当考虑到在这个基因家族中观察到的表达模式时,稍后将讨论什么。
簇2转录本在第二个生长季的破芽期表达量最高,可能与花分生组织和花器官分化有关。与发生在破芽阶段的发育过程一致,簇2同时包含了两者VvFT而且VFL,它们在拟南芥中有同源,是花诱导和花分生组织规范所必需的。VvFT在开花诱导期间过度表达,在芽休眠期减少,在第二季再次增加,这与其同源物在杨树及其他木本植物[7,11,13,43].尽管假定的TFL1同族体(VvTFL1A)在Grapegen GeneChip®中不存在,我们之前对该基因家族的分析[31]表明其在休眠时下调,在休眠解除时上调。此表达式模式与已报道的相同TFL1同源染色体在杨树[13].VvSPL13-L而且VvAG3一边是VvFUL-L,VvAGL6.2而且VvSEP4另一方面,其表达模式相似,也可参与花分生组织和花器官发育的过程。
聚类3包括在休眠期间表达最高的转录本。有趣的是,这个集群包括两个MADS-box基因,VvFLC2而且VvAGL15.1,拟南芥的同源基因参与了开花抑制。此外,它还包含几个SPL基因(VvSPL6-L, VvSPL12-L而且VvSPL14-L).其余基因在非休眠期也有一定表达。这两个方法在葡萄藤中发现同源物(VvFLC1而且VvFLC2) [39]在芽中显示相反的表达模式(附加文件5).VvFLC1表现得像PEP1,Arabis alpina FLC同族体。PEP1在冬季表达减少,在寒冷期后生长恢复时表达增加[57].波动方法在这个多年生物种的转录水平将允许一些分生组织进行开花转变,而另一些分生组织保持植物的营养生长。类似的角色VvFLC1在维持营养生长的年轻分生组织,将产生新的潜在芽,可以提出在葡萄藤。相反,VvFLC2,类似于被报道的表达方法类基因枳壳[16]和多叶的spurge [17],它们可能参与调节休眠。类似地,花分生组织起始的抑制因子也被提出AGL15而且AGL18拟南芥[58].有趣的是,他们假定的葡萄藤同源,VvAGL15.1,有相同的表达模式VvFLC2.寻找方法在其他多果植物中具有相反表达模式的同源基因可以帮助阐明它们在这些过程中的作用。此外,两名成员《金融时报》/ TFL1基因家族(VvTFLC1而且VvMFT2) [31]在第3簇中也被发现,这为它们的功能可能与控制葡萄藤的休眠有关打开了可能性。在协议中,高表达的成员《金融时报》/ TFL1家庭(PaFT4)在挪威云杉(挪威云杉L.)与生长停止和花蕾形成有关[59],与观测到的PtFT1基因的杨树[11].的确,比较序列和表达分析《金融时报》/ TFL1在裸子植物和被子植物中发现该基因家族,由此推测该基因家族的原始功能可能与调控生长停滞和/或休眠有关[60].
不同的成员SPL在三个聚类中发现了转录因子家族。已知该转录因子家族参与多种植物发育过程的调控,如植物相变、花和果实发育以及植物结构[61- - - - - -64].16个Arabipdopsis中的10个SPL基因在转录后受到miR156的调控,miR156将内源性的年龄/发育信号整合到营养转变和开花过程中[61,62].这种营养期调节机制在多年生木本植物中也有保留[65].有趣的是,簇1包含同源的转录本Spl3 4 5而且9,都属于mir156 /7靶向SPL拟南芥幼体向成体转变和开花的正向调节因子[63,64,66],并由SOC1[67].集群1也包括两个SPL2和一个SPL8同源染色体。拟南芥SPL2也是miR156靶向的,似乎参与生殖阶段的侧器官发育[68].miR156/7非靶向SPL8基因参与花粉囊发育[69]和男性生育能力所必需的[70].最后,在簇3中发现了该基因家族的几个成员,其表达模式更局限于休眠期(VvSPL1-L, VvSPL6-L, VvSPL7-L, VvSPL12-L, VvSPL14-L和VvSPL13-L2).这些基因的大部分拟南芥对应基因属于miR156/7非靶向SPL亚科(Spl1 7 12 14而且16),由家族中较大的蛋白质组成[70].除了。外,对这些假定的转录调控因子的功能知之甚少SPL14这似乎可以调节植物的结构和营养期的长度。拟南芥突变体SPL14表达,叶柄拉长,叶缘锯齿状,营养相变加快[71],提示该基因可能在植物的相变和开花过程中起负调控作用[72],对其他促进营养相变的SPL蛋白具有拮抗作用。有趣的是,这两个VvSPL14-L而且VvSPL12-L显示了非常相似的表情模式VvFLC2而且VvAGL15.1这也暗示了它们的作用SPL处于休眠状态的基因。很少有人知道的作用SPL类似木本物种的基因。两个基因(SPL例如3.而且6)在休眠期间被检测到杨树[24)与SPL6类递增和SPL3如休眠时减少。此外,SPL-2在葡萄中也发现了同源基因,似乎受到光周期的调控[35].需要进一步的研究来阐明可能的作用SPL处于萌芽休眠状态的基因家族。
在休眠期间,可能还需要其他涉及转录抑制因子的机制来防止花分生组织从花序分生组织过早形成。一年生和多年生生命的建立在开花植物中独立出现了好几次[73],因此,控制花蕾休眠或抑制花分生组织形成的机制很可能在不同的植物科中招募了不同的调控基因。补充实验将需要评估这些转录调节家族成员在这一过程中的生物学功能。
结论
芽发育过程中的转录分析表明,解释所观察到的表达变异的主要成分是由参与活性细胞生长和增殖、休眠调节和应激反应的基因决定的,这表明这些是芽发育过程中最活跃的事件。在7月和9月(前休眠过渡)、9月和11月(内休眠过渡)以及3月和4月(生态休眠/破芽过渡)收集的样本之间检测到主要的转录变化。在这些转换中丰富的功能类别与主成分分析的结果一致。
生殖发育关键调控因子的表达谱被划分为三个主要的转录簇,分别对应于(i)只与开花诱导相关的转录本;(ii)与开花诱导和花分生组织形成相关的转录本;以及(iii)假定处于休眠状态的成绩单.这些结果表明VvFLC2以及其他具有相似表达模式的转录本,比如VvAGL15.1或VvSPL14-L可能在葡萄的芽休眠调节中起作用,而没有证据表明参与VvSVP可以观察到这一过程中的基因。
方法
植物材料
小道消息(葡萄L. culvartempranillo)的芽采自Instituto Madrileño de Investigación y Desarrollo Rural, Agrario y Alimentario (IMIDRA, Alcalá de Henares, Madrid)的一个实验葡萄园。样本连续两年从同一葡萄园的三个重复块中采集。植物和芽的发育阶段按照Baggiolini(1952)的发育系列进行分类[74]和改良的E-L系统[75].在一天的同一时间,从基部的相同茎干位置收集芽。芽样在液氮中冷冻,-80°C保存,然后提取RNA。分析了5月(May)、6月(JUN)、7月(JUL)、9月(SEP)、11月(NOV)、1月(JAN)、3月(MAR)和4月(APR)芽对应的样品。气象数据来自Finca El Encin的一个气象站(IMIDRA, Alcalá de Henares)。
RNA提取
根据Reid等人,2006年从冷冻芽样品中提取总RNA [76].根据制造商的协议,使用RNeasy Mini Kit (QIAGEN)进行RNA纯化。为了去除RNA样品中的DNA痕迹,使用RNase-Free DNase Set (QIAGEN)进行DNase I消化。RNA完整性和数量由安捷伦Bioanalyzer 2100进行评估。微阵列杂交在国家生物技术中心(CNB-CSIC,马德里)基因组学部门进行。报道的实验原始微阵列数据可在植物基因表达数据库(PlexDB)公开获取[77],并标注为“VV36:葡萄芽发育的时间过程”。
微阵列数据处理与分析
使用Affymetrix Grapegen GeneChip®对每个时间点进行3个生物重复,监测芽的转录活性。将原始Affymetrix CEL文件导入Robin软件套件[78,使用RMA方法进行数据归一化。采用Acuity软件进行主成分分析[79(分子设备有限责任公司,CA,美国)。使用分数矩阵来选择最适合第一主成分(PC1)的探针集,选择PC1分数大于7或小于-7的探针集。同样,最适合PC2的探针集是那些组件得分大于3或低于-3的探针集。
在Multi Experiment Viewer中进行差异表达分析[80]使用LIMMA,应用0.01临界值P-value和log2折叠比大于1且小于-1。P值用Benjamini-Hochberg检验进行校正。
为了确定所选探针组中过度代表的生物功能,使用FatiGO进行功能富集分析[81) (P值< 0.05)。功能分类基于定制的GrapeGen GeneChip®的手动注释,基于12X v1葡萄基因组组装,如Grimplet et al., 2012 [82].
根据其功能注释选择生殖发育的关键调控因子[82].表达式值从整个实验归一化数据矩阵中提取(从每个样本和探针集的三次重复中求平均值)。当多个探针组与一个基因转录本匹配时,只有一个被选中。使用MultiExperiment Viewer进行分层聚类[80]基于皮尔逊相关,并使用完全联动选项。
参考文献
- 1.
Horvath DP, Anderson JV, Chao WS, Foley ME:知道什么时候生长:调节芽休眠的信号。植物科学进展,2003,8:534-540。10.1016 / j.tplants.2003.09.013。
- 2.
郎格,岳利,马丁·G,达尼尔·R:内休眠、异态和生态休眠——休眠研究的生理学术语和分类。HortScience。1987, 22: 371-377。
- 3.
Rohde A, Bhalerao RP:多年生植物休眠。植物科学进展,2007,12:217-223。10.1016 / j.tplants.2007.03.012。
- 4.
赵文伟,李志刚,李志刚,李志刚,李志刚。植物芽休眠的信号调控。植物学报,2007,1:49-56。
- 5.
霍瓦特D:常见的机制调节开花和休眠。植物科学学报,2009,27(3):344 - 344。10.1016 / j.plantsci.2009.09.002。
- 6.
杨晓明,王晓明,王晓明:多年生植物芽休眠的一种生存机制。《恶劣环境下的休眠与抵抗》,2010年,柏林,69-90。Lubzens, Esther和Cerda, Joan和Clark, Melody(系列编辑):当前遗传学主题,第21卷。
- 7.
木本植物芽休眠中的光和温度感应和信号。植物分子生物学学报,2010,43(3):344 - 344。10.1007 / s11103 - 010 - 9620 - 9。
- 8.
Jansson S, Douglas CJ:杨树:植物生物学的模型系统。植物学报,2007,38(4):357 - 357。10.1146 / annurev.arplant.58.032806.103956。
- 9.
莫里森J:萌芽发育在葡萄张志军。2001,30(1):1 -3。10.1086/337894。
- 10.
马林斯MG,波束A,威廉姆斯LE:葡萄生物学。剑桥:剑桥大学出版社1992年出版。
- 11.
Böhlenius H,黄T, Charbonnel-Campaa L, Brunner AM, Jansson S, Strauss SH, Nilsson O: CO/FT调控模块控制树木开花时间和季节性生长停止。科学通报,2006,31(4):344 - 344。10.1126 / science.1126038。
- 12.
罗娜娜R,里恩PLH, Kangasjärvi J,范德舒特C:CENL1肋分生组织中的表达影响茎伸长和向休眠的过渡杨树.植物学报,2008,20:59-74。10.1105 / tpc.107.056721。
- 13.
林恩平,李志刚,李志刚,李志刚,李志刚,刘志刚,Kangasjärvi J, van der Schoot C:休眠芽的超诱导作用开花位点t并招募ga诱导的1,3-葡聚糖酶重新打开信号通道并释放休眠杨树.植物学报,2011,23:130-146。10.1105 / tpc.110.081307。
- 14.
Hemming MN, Trevaskis B:太阳照耀时晒干草:MADS-box基因在温度依赖性季节性开花反应中的作用。植物科学学报,2011,30(4):447-453。10.1016 / j.plantsci.2010.12.001。
- 15.
李俊华,刘世杰,朴帅,黄毅,李宗杰,安俊华:作用高级副总裁环境温度对拟南芥开花时间的控制。基因开发,2007,21:397-402。10.1101 / gad.1518407。
- 16.
张杰,李震,梅玲,姚杰,胡超:PtFLC三叶橙的同源物(枳壳trifoliata)受选择性剪接调控,表达水平有季节性波动。植物学报,2009,29(3):344 - 344。10.1007 / s00425 - 008 - 0885 - z。
- 17.
doramaci M, Horvath DP, Chao WS, Foley ME, Christoffers MJ, Anderson JV:低温影响叶重叶花冠芽的休眠状态、开花能力和转录谱。中国生物医学工程学报,2010,29(3):344 - 344。10.1007 / s11103 - 010 - 9621 - 8。
- 18.
Bielenberg DG, Wang Y, Li Z, Zhebentyayeva T, Fan S, Reighard GL, Scorza R, Abbott AG:桃长势基因座的测序与注释(碧桃(l)Batsch)揭示了一组6个MADS-box转录因子作为调节顶芽形成的候选基因。植物基因组学报,2008,4:495-507。10.1007 / s11295 - 007 - 0126 - 9。
- 19.
Mazzitelli L, Hancock RD, Haupt S, Walker PG, Pont SDA, McNicol J, Cardle L, Morris J, Viola R, Brennan R, Hedley PE, Taylor MA:覆盆子休眠释放阶段的协调基因表达(悬钩子属植物idaeusl .)芽。应用物理学报,2007,38(3):357 - 357。10.1093 / jxb / erl266。
- 20.
吴r, Walton EF, Richardson AC, Wood M, Hellens RP, Varkonyi-Gasic E:四种猕猴桃的守恒和散度高级副总裁类似MADS-box基因在猕猴桃花蕾休眠和开花过程中起着不同的作用。应用物理学报,2012,29(3):344 - 344。10.1093 / jxb / err304。
- 21.
山根红,杨春霞,王晓明,王晓明,王志刚,王晓明:基因表达与内源性休眠相关高级副总裁/ AGL24型MADS-box基因在日本杏侧枝营养芽中的表达。中国生物医学工程学报,2008,29(3):344 - 344。
- 22.
王晓明,王晓明,王晓明,王晓明,王晓明,王晓明与休眠相关的疯狂-BOX基因来自叶状散叶。中国生物医学工程学报,2010,29(3):344 - 344。10.1007 / s11103 - 009 - 9596 - 5。
- 23.
李震,张娟,梅玲,邓霞,胡超,姚娟:PtSVP,一个高级副总裁三叶橙的同源物(枳壳trifoliataL. Raf.)在转基因拟南芥和烟草植株中表现出分生组织的季节性周期性,并影响花的发育。中国生物医学工程学报,2010,34(4):329 - 329。10.1007 / s11103 - 010 - 9660 - 1。
- 24.
Ruttink T, Arend M, Morreel K, Storme V, Rombauts S, Fromm J, Bhalerao RP, Boerjan W, Rohde A:杨树根尖芽形成和休眠诱导的分子时间表。植物科学学报,2007,29(3):457 - 457。10.1105 / tpc.107.052811。
- 25.
葡萄花蕾的休眠——事实与推测。德国葡萄酒,1997,3:31-46。10.1111 / j.1755-0238.1997.tb00114.x。
- 26.
Dokoozlian N:低温和持续时间对“Perlette”葡萄扦插的发芽产生相互作用。HortScience。1999, 34: 1054-1056。
- 27.
杨晓东,李志刚,李志刚,等。葡萄科植物形态学与解剖学研究进展。植物发育葡萄属锐利.机械工程学报,1998,26(3):344 - 344。10.1139 / b88 - 037。
- 28.
Pouget R: Considérations générales sur le rhythm végétatif et la dormance des bourgeons de la Vigne。葡萄。1972,11:198-217。
- 29.
杨晓东,李志刚,李志刚,等。葡萄科植物形态学与解剖学研究进展。花的发育葡萄属锐利.中国机械工程学报,1998,26(3):344 - 344。10.1139 / b88 - 188。
- 30.
gerath JM:葡萄花的发育形态学和解剖学。《中国科学》,1993,13:315-337。
- 31.
Carmona MJ, Calonje M, Martínez-Zapater《金融时报》/ TFL1基因家族在葡萄藤。中国生物医学工程学报,2007,29(3):357 - 357。10.1007 / s11103 - 006 - 9113 - z。
- 32.
杨晓明,杨晓明,杨晓明,杨晓明,杨晓明:葡萄生殖发育的分子遗传学分析。应用物理学报,2008,29(2):349 - 349。10.1093 / jxb / ern160。
- 33.
Lebon G, Wojnarowiez G, Holzapfel B, Fontaine F, Vaillant-Gaveau N, Clement C:糖与葡萄开花(葡萄l .)。应用物理学报,2008,29(3):344 - 344。10.1093 / jxb / ern135。
- 34.
Mathiason K, He D, Grimplet J, Venkateswari J, Galbraith DW, Or E, Fennell A:转录分析葡萄属锐利在冷却要求的实现中,基因表达模式与优化的破芽相协调。中国生物医学工程学报,2009,29(3):344 - 344。10.1007 / s10142 - 008 - 0090 - y。
- 35.
Sreekantan L, Mathiason K, Grimplet J, Schlauch K, Dickerson JA, Fennell AY:长、短光周期下葡萄花发育和基因表达差异表明花基因在休眠过渡中的作用。中国生物医学工程学报,2010,29(3):344 - 344。10.1007 / s11103 - 010 - 9611 - x。
- 36.
Halaly T, Pang X, Batikoff T, Crane O, Keren A, Venkateswari J, Ogrodovitch A, Sadka A, Lavee S, Or E:类似的机制可能由其他外部刺激触发,诱导葡萄芽休眠释放。植物学报,2008,28(3):344 - 344。10.1007 / s00425 - 008 - 0720 - 6。
- 37.
Perez FJ, Kuhn N, Ormeno-Nunez J, Rubio S:的表达式VvPHYA而且VvPHYB葡萄叶片和芽的转录本受光周期的调控不同。植物信号行为学学报,2009,4:614-616。10.4161 / psb.4.7.8907。
- 38.
裴西-米勒T,斯科特K, Ablett E, Tingey S, Ching A, Henry R:与葡萄休眠结束相关的基因。中国生物医学工程学报,2003,30(3):344 - 344。10.1007 / s10142 - 003 - 0094 - 6。
- 39.
Díaz-Riquelme J,李维泽,Martínez-Zapater JM, Carmona MJ: MIKC全基因组分析C型MADS-box基因。植物科学学报,2009,29(3):344 - 344。10.1104 / pp.108.131052。
- 40.
Carmona MJ, cuba P, Martínez-Zapater JM:VFL小道消息FLORICAULA /叶正交同源,在分生区表达独立于它们的命运。植物科学学报,2002,29(3):344 - 344。10.1104 / pp.002428。
- 41.
Martínez德托达F: Biología德拉维德。基础知识biológicos葡萄栽培。马德里:世界日报,1991年。
- 42.
Nilsson L, Müller R, Nielsen TH:解剖植物转录组和磷酸盐剥夺的调控反应。中国生物医学工程学报,2010,29(3):344 - 344。10.1111 / j.1399-3054.2010.01356.x。
- 43.
Horvath DP, Chao WS, Suttle JC, Thimmapuram J, Anderson JV:转录组分析发现了叶状突起季节休眠转变的新反应和潜在的调控基因(大戟属植物esulal .)。中国生物医学工程学报,2008,9:536。10.1186 / 1471-2164-9-536。
- 44.
van der Schoot C, Rinne PLH:茎尖分生组织的休眠循环:自组织和自我停止之间的过渡。中国植物科学,2011,18(1):1 - 3。10.1016 / j.plantsci.2010.08.009。
- 45.
李霞,郑霞,闫松,李松:水杨酸(SA)、紫外线辐射(UV-B和UV-C)对收获葡萄果实皮中反式白藜芦醇诱导的影响。中国农业前沿,2008,2:77-81。10.1007 / s11703 - 008 - 0014 - 6。
- 46.
Dietz K, Vogel MO, Viehhauser A: AP2/EREBP转录因子是基因调控网络的一部分,在应激适应和逆行信号传导中整合代谢、激素和环境信号。原生质体,2010,45(3):1 - 4。10.1007 / s00709 - 010 - 0142 - 8。
- 47.
Kimura M, Nambara E:拟南芥种子中mRNA的储存和新合成:环己酰亚胺和控制恶化处理对吸收过程中转录恢复的影响。中国生物医学工程学报,2010,29(3):344 - 344。10.1007 / s11103 - 010 - 9603 - x。
- 48.
巴伐利斯科,李志强,杨建平,Van-Zeller-de-Macedo-Basto-Gonçalves米,维祖里S:葡萄二苯乙烯的生理和分子生物学研究进展。葡萄分子生理学和生物技术。2009,鲁贝拉基斯-安杰拉基斯KA编辑,多德雷赫特,海德堡,伦敦,纽约:施普林格,341-364。
- 49.
薛晓峰,李志刚,李志刚,李志刚,李志刚:植物热胁迫转录因子(Hsf)家族的结构、功能与进化。生物化学学报,2012,27(3):344 - 344。10.1016 / j.bbagrm.2011.10.002。
- 50.
欧森·安,恩斯特·哈,莱乔·李,Skriver K: NAC转录因子的结构差异和功能多样性。植物科学进展,2005,10:79-87。10.1016 / j.tplants.2004.12.010。
- 51.
Rushton PJ, Somssich IE, Ringler P, Shen QJ: WRKY转录因子。植物科学进展,2010,15:247-258。10.1016 / j.tplants.2010.02.006。
- 52.
Perrot-Rechenmann C:细胞对生长素的反应:分裂与扩张。中国生物医学工程学报,2010,2:a001446。10.1101 / cshperspect.a001446。
- 53.
李j,李i:调节和作用SOC1开花途径集成器。应用物理学报,2010,31(2):344 - 344。10.1093 / jxb / erq098。
- 54.
哈特曼U, Höhmann S, Nettesheim K, Wisman E, Saedler H, Huijser P:分子克隆高级副总裁:拟南芥花转化的负调控因子。植物学报,2000,21:351- 351。10.1046 / j.1365 - 313 x.2000.00682.x。
- 55.
刘雪雪,李俊杰,魏格尔D,安俊华:超表达对植物开花加速的影响分区,(ft和tfl1之母).生物化学学报,2004,17:95-101。
- 56.
奚伟,刘超,侯旭,余辉:ft和tfl1之母在拟南芥中通过调节ABA信号的负反馈回路调节种子萌发。中国生物医学工程学报,2010,29(3):344 - 344。10.1105 / tpc.109.073072。
- 57.
王r, Farrona S, Vincent C, Joecker A, Schoof H, Turck F, Alonso-Blanco C, Coupland G, Albani MC:PEP1调节植物多年生开花而阿尔.自然科学进展,2009,29(4):344 - 344。10.1038 / nature07988。
- 58.
Adamczyk BJ, Lehti-Shiu MD, Fernandez DE: MADS域因子AGL15而且AGL18在拟南芥中充当多余的花转换抑制因子。植物学报,2007,30(3):344 - 344。10.1111 / j.1365 - 313 x.2007.03105.x。
- 59.
Gyllenstrand N, Clapham D, Källman T, Lagercrantz U:一种挪威云杉开花位点t同源体在针叶树生长节奏的控制中有牵连。植物科学学报,2007,29(3):344 - 344。10.1104 / pp.107.095802。
- 60.
卡尔格伦A, Gyllenstrand N, Källman T, Sundström JF, Moore D, Lascoux M, Lagercrantz U:进化PEBP植物基因家族:种子植物进化中的功能多样化。植物科学进展,2011,29(3):344 - 344。10.1104 / pp.111.176206。
- 61.
郭安,朱强,顾霞,葛松,杨娟,罗娟:植物特异性SBP-box转录因子家族的全基因组鉴定与进化分析。基因学报,2008,418:1-8。10.1016 / j.gene.2008.03.016。
- 62.
吴刚,Poethig RS: miR156基因对拟南芥茎部发育的调控SPL3.发展,2006,133:3539-3547。10.1242 / dev.02521。
- 63.
吴刚,Park MY, Conway SR, Wang J, Weigel D, Poethig RS:拟南芥miR156和miR172序列调控发育时间。细胞学报,2009,38(3):344 - 344。10.1016 / j.cell.2009.06.031。
- 64.
Amasino R:开花季节和发育时间。植物学报,2010,29(3):344 - 344。10.1111 / j.1365 - 313 x.2010.04148.x。
- 65.
王金文,朴明敏,王丽娟,古勇,陈晓霞,魏格尔D, Poethig RS: MiRNA对树木营养阶段变化的控制。公共科学图书馆,2011,7 (2):e1002012。10.1371 / journal.pgen.1002012。
- 66.
Yamaguchi A, Wu M, Yang L, Wu G, Poethig RS, Wagner D: microrna调控的SBP-Box转录因子SPL3是一种直接上游激活因子FRUITFULL绿叶,而且APETALA1.生物工程学报,2009,17:268-278。10.1016 / j.devcel.2009.06.007。
- 67.
郑俊,朱勇,徐普杰,李俊,Park C:拟南芥SOC1-SPL模块集成光周期和赤霉素信号控制开花时间。植物学报,2012,29(3):349 - 349。10.1111 / j.1365 - 313 x.2011.04813.x。
- 68.
四方M,小山T, Mitsuda N, ohmy - takagi M:拟南芥SBP基因盒SPL10, SPL11而且SPL2在繁殖阶段控制与芽成熟相关的形态变化。植物生理学报,2009,30(4):344 - 344。10.1093 /卡式肺囊虫肺炎/ pcp148。
- 69.
Unte US, Sorensen A, Pesaresi P, Gandikota M, Leister D, Saedler H, Huijser P:SPL8,一个SBP-box基因影响拟南芥花粉囊发育。植物学报,2003,29(3):344 - 344。10.1105 / tpc.010678。
- 70.
邢星,Salinas M, Höhmann S, Berndtgen R, Huijser P: mir156靶向和非靶向SBP-box转录因子协同作用于拟南芥雄性育性。中国生物医学工程学报,2010,26(3):357 - 357。10.1105 / tpc.110.079343。
- 71.
Stone JM, Liang X, Nekl ER, Stiers JJ:拟南芥植物特异性sbp结构域转录因子AtSPL14参与植物发育及对fumonisin B1的敏感性。植物学报,2005,41:744-754。10.1111 / j.1365 - 313 x.2005.02334.x。
- 72.
Usami T, Horiguchi G, Yano S, Tsukaya H:拟南芥的更多和更小的细胞突变体确定了新的作用Squamosa启动子结合蛋白样控制异母细胞形成的基因。科学进展,2009,34(3):344 - 344。10.1242 / dev.028613。
- 73.
Thomas H, Thomas HM, Ougham H:年年性,多年性和细胞死亡。应用物理学报,2000,29(3):379 - 379。10.1093 / jexbot / 51.352.1781。
- 74.
Baggiolini M: Les stades repères每年的发展和利用。罗曼德农业维蒂亚克,1952,8:4 -6。
- 75.
Coombe BG:《葡萄生长阶段》:采用一种识别葡萄生长阶段的系统。奥地利葡萄酒,1995,1:104-110。10.1111 / j.1755-0238.1995.tb00086.x。
- 76.
柯瑞德,李志强,李志强,李志强,李志强。葡萄果实发育过程中RT-PCR内参基因的定量分析。中国生物医学工程学报,2006,26(3):329。10.1186 / 1471-2229-6-27。
- 77.
陈晓明,王晓明,王晓明,王晓明,等。植物病原菌基因表达资源分析。中国生物医学工程学报,2012,40:D1194-201。10.1093 / nar / gkr938。
- 78.
Lohse M, Nunes-Nesi A, Krüger P, Nagel A, Hannemann J, Giorgi FM, Childs L, Osorio S, Walther D, Selbig J, Sreenivasulu N, Stitt M, Fernie AR, Usadel B: Robin:基于r的表达微阵列质量评估和分析的直观向导应用。中国生物医学工程学报,2010,29(3):344 - 344。10.1104 / pp.109.152553。
- 79.
敏度的软件。[http://www.moleculardevices.com/Products/Software/Acuity.html].
- 80.
Saeed AI, Sharov V, White J, Li J, Liang W, Bhagabati N, Braisted J, Klapa M, Currier T, Thiagarajan M, Sturn A, Snuffin M, Rezantsev A, Popov D, Ryltsov A, Kostukovich E, Borisovsky I, Liu Z, Vinsavich A, Trush V, Quackenbush J: TM4:用于微阵列数据管理和分析的免费开源系统。生物技术,2003,34:374-378。
- 81.
Medina I, Carbonell J, Pulido L, Madeira SC, Goetz S, Conesa A, Tárraga J, Pascual-Montano A, Nogales-Cadenas R, Santoyo J, García F, Marbà M, Montaner D, Dopazo J: Babelomics:一个具有高级功能分析的转录组学、蛋白质组学和基因组数据的综合平台。中国生物医学工程学报,2010,38:W210-W213。10.1093 / nar / gkq388。
- 82.
Grimplet J, Van Hemert J, Carbonell-Bejerano P, Diaz-Riquelme J, Fennell A, Pezzotti M, Martinez-Zapater JM:葡萄全基因组预测的比较分析,预测基因序列的功能注释和分类。BMC研究笔记。2012, 5: 213。10.1186 / 1756-0500-5-213。
确认
本研究由BIO2008-03892项目和J.D.-R博士预科奖学金资助。来自西班牙科学与创新部(MICINN)。JG得到了CSIC estate agency JAE-Doc项目的支持,该项目由欧洲社会基金共同资助。作者要感谢Félix Cabello和Instituto Madrileño de Investigación y Desarrollo Rural, Agrario y Alimentario (IMIDRA, Alcalá de Henares, Madrid)为我们提供El Encin的葡萄种植试验田和Javier Ibañez (ICVV-CSIC),他们为我们提供了来自Finca El Encin站的气象数据。我们也非常感谢Diego Lijavetzky关于实验方法的讨论,以及Pablo Carbonell-Bejerano和Rafael Torres-Pérez他们生成功能注释文件的工作,以及Marisela Velez编辑手稿。我们要感谢CNB-CSIC的基因组服务提供的微阵列杂交。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们没有竞争利益。
作者的贡献
JDR和MJC进行样品收集和RNA提取。JDR和JG进行转录组分析。澳门赛马会起草了手稿。MJC和JMZ构思了这项研究,参与了设计和协调。所有的作者都参与了最终手稿的开发,并阅读并批准了它。
电子辅助材料
12870 _2012_1155_moesm1_esm.xls
附加文件1:包含所有GrapeGen基因芯片的RMA规范化表达式值的表®与12X V1版本葡萄参考基因组中的基因及其注释的对应关系。该文件还包括前三个主组件中每个探测集的组件得分。(xls 13mb)
12870 _2012_1155_moesm2_esm.xls
附加文件2:包含分析样本中PC1成分评分(阳性和阴性值)选择的探针集的RMA归一化表达式值的表。(xl409kb)
12870 _2012_1155_moesm3_esm.xls
附加文件3:包含分析样本中PC2成分评分(阳性和阴性值)选择的探针集的RMA归一化表达式值的表。(xl667kb)
功能类别在PC2成分评分(阳性和阴性值)选择的聚类中显著富集。
附加文件4:在正簇中丰富的类别用绿色表示,而在负簇中丰富的类别用粉红色表示。对数的绝对值10改变了P-值用于柱状图,表示统计意义,仅类别为P-values < 0.05。(pdf 22kb)
两条葡萄藤的表达模式
附加文件5:方法同源染色体。显示了每个时间点的平均表达式值。(pdf 19kb)
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
Díaz-Riquelme, J., Grimplet, J., Martínez-Zapater, J.M.et al。葡萄芽发育过程中的转录组变异(葡萄l .)。BMC植物生物学12日,181(2012)。https://doi.org/10.1186/1471-2229-12-181
收到了:
接受:
发表:
关键字
- 小道消息
- 萌芽发展
- 休眠
- 开花
- 花的发育
- 转录组