- 研究文章gydF4y2Ba
- 开放访问gydF4y2Ba
- 发表:gydF4y2Ba
在丛枝菌根共生期间,两个推定的水疗法基因差异表达gydF4y2BaLotus对虾gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba12.gydF4y2Ba文章编号:gydF4y2Ba186.gydF4y2Ba(gydF4y2Ba2012gydF4y2Ba)gydF4y2Ba
抽象的gydF4y2Ba
背景gydF4y2Ba
丛枝菌根(AM)是一种广泛存在的共生体,为植物提供了巨大的优势,改善其营养状况,使真菌完成其生命周期。然而,导致AM共生发展的分子机制尚未完全破译。在这里,我们重点研究了两个假定的水通道蛋白基因,gydF4y2BaLjNIP1gydF4y2Ba和gydF4y2BaLjXIP1gydF4y2Ba,这导致在对菌根根部进行的转录组分析中上调gydF4y2BaLotus对虾gydF4y2Ba.gydF4y2Ba
结果gydF4y2Ba
系统发育分析表明,这两个推定的水电素属于不同的功能性系列:尼斯和XIPP。转录组实验表明它们的表达与其营养状况的独立性,也与菌根和根瘤菌相互作用密切相关。进一步的转录量化揭示了其中一个人的表达之间的良好相关性,gydF4y2BaLjNIP1gydF4y2Ba, 和gydF4y2BaLjPT4gydF4y2Ba磷酸盐转运体,被认为是菌根功能的标记基因。通过使用激光显微解剖,我们证明了两个基因中的一个,gydF4y2BaLjNIP1gydF4y2Ba,专门表达含仲裁的细胞。Ljnip1同意其作为水素的推定作用,在酵母原生质体中表达时能够转移水。共焦分析证明EGFP-LJNIP1在其内源启动子下积聚在丛丛细胞的内膜系统中。gydF4y2Ba
结论gydF4y2Ba
综上所述,两种菌根诱导水通道蛋白的功能和表达特异性不同gydF4y2BaL. japonicus.gydF4y2Ba.其中,LjNIP1可以作为丛枝菌根不同发育阶段状态的新分子标记。与此同时,gydF4y2BaLjXIP1gydF4y2Ba结果表明,这是第一个在共生过程中被转录调控的XIP家族水通道蛋白。gydF4y2Ba
背景gydF4y2Ba
知识有所增加的事实是,植物不作为自己作为个人行动,而是作为一个由细菌,真菌和其他微生物填充的巨大阶段的演员[gydF4y2Ba1gydF4y2Ba- - - - - -gydF4y2Ba3.gydF4y2Ba].丛枝菌根(AM)真菌代表复杂根植物微生物组中最重要的组分之一,因为它们以约80%的血管植物存在。它们提供磷酸盐,氮气,矿物盐和水的植物,并保证在局部和全身水平的生物和非生物胁迫下更广泛地保护。另一方面,植物允许真菌进入光合碳化合物[gydF4y2Ba4gydF4y2Ba].gydF4y2Ba
部分已知的化学对话指导这种密切的关系:植物滴水酮引发孢子发芽菌丝菌丝的生长和分支,而真菌信号,包括脂肪寡糖,刺激根生长和分支[gydF4y2Ba5gydF4y2Ba].后者被一种尚不清楚的受体识别,该受体引起一个保存良好的信号级联并诱导CagydF4y2Ba2+gydF4y2Ba细胞核内的振动,以与涉及的rhizobium-豆科植物共生的机制类似的方式[gydF4y2Ba6gydF4y2Ba].一旦它们穿透了表皮,AM菌丝迅速发展成植物皮质细胞,并形成一种被称为枝形的树形结构,这是营养交换的功能部位。其形成是非同步过程,其寿命假设持续不超过10天[gydF4y2Ba7gydF4y2Ba].仲裁容纳过程需要大量重塑皮质细胞:所有薄枝条枝包围由围绕围绕骨膜(PAM)包裹的,它不仅完全围绕仲裁,而且紧密地跟随每个分支的表面,模制仲裁本身。PAM开发标志着共生界面的外观,狭窄的细胞内隔室允许AM真菌在植物细胞内生长而不破坏其完整性。细胞生物学调查最近证明PAM生物发生需要内质网,高尔基装置,转球糖网络和分泌囊泡的增殖[gydF4y2Ba8gydF4y2Ba],同时由于偏振分泌过程而发生特定PAM蛋白,例如MTPT4,而是发生偏振分泌过程[gydF4y2Ba9gydF4y2Ba].gydF4y2Ba
所有这些戏剧事件都是由受调节的大量基因指出的,不仅在整个菌根根部(例如[gydF4y2Ba10.gydF4y2Ba- - - - - -gydF4y2Ba13.gydF4y2Ba]),但更具体地在丛丛细胞中[gydF4y2Ba14.gydF4y2Ba- - - - - -gydF4y2Ba16.gydF4y2Ba].在这个框架中,Hogekamp和他的同事已经证明了两种上调最多的膜转运基因gydF4y2BaMedicago truncatulagydF4y2Ba托管Am arbuscules的细胞是水蛋白。这种特定的基因调节还通过不同菌根植物中的各种其他报告证实了[gydF4y2Ba14.gydF4y2Ba,gydF4y2Ba17gydF4y2Ba- - - - - -gydF4y2Ba19.gydF4y2Ba].gydF4y2Ba
众所周知,水通道蛋白(AQPs)能够通过各种生物的膜运输水以及其他小溶质(如氨、尿素、硼),涉及水通道蛋白基因的遗传缺陷与几种人类疾病有关[gydF4y2Ba20.gydF4y2Ba].植物AQPs存在于各种组织中,不仅在运输中发挥作用,还在细胞分化、细胞增大、叶片功能、营养物质运输和金属毒性中发挥作用[gydF4y2Ba21.gydF4y2Ba- - - - - -gydF4y2Ba23.gydF4y2Ba].新资料库现已建立,可透过比较序列及结构,查询可能的功能[gydF4y2Ba21.gydF4y2Ba].gydF4y2Ba
AQPs是一组形成孔的完整的小膜蛋白。其选择性的分子基础主要取决于孔内的两个过滤器:第一个是由保守的双“NPA”过滤器(天冬酰胺、脯氨酸和丙氨酸残基)形成的,而第二个是由收缩区域形成的,也被称为ar/R(芳香/精氨酸)过滤器[gydF4y2Ba22.gydF4y2Ba].看来,构成AR / R选择性过滤器的四个残基的性质控制孔的底物特异性[gydF4y2Ba23.gydF4y2Ba]并且被认为是有用的用于预测蛋白质的功能[gydF4y2Ba24.gydF4y2Ba].在序列比较的基础上,Dicots和单焦点的AQP可以分为五个保守的亚组,其中一些亚组似乎与特定的亚细胞本地始终联系起来,因此它们的名称:血浆膜内在蛋白(PIPS),调色剂固有蛋白质(提示),Nodulin 26样内在蛋白质(咬合),小和基本内在蛋白(啜饮)和x内在蛋白质(XIPS)[gydF4y2Ba25.gydF4y2Ba,gydF4y2Ba26.gydF4y2Ba].植物中的咬合表达的总体水平低于其他AQP的表达,因为它们通常与专用器官和细胞相关,并且参与宿主和细菌Symbion之间代谢物的交换[gydF4y2Ba27.gydF4y2Ba].在目前已表征的NIPs中,AtNIP2;1专门在根的内质网中积累,而AtNIP5;1是质膜MIP,主要在根伸长区表达[gydF4y2Ba28.gydF4y2Ba- - - - - -gydF4y2Ba30.gydF4y2Ba].相反,XIP蛋白只被部分描述,但似乎它们可能具有不同的表达模式和功能特征。gydF4y2Ba
虽然已经证明了肌肉粒子对植物根的液压性能至关重要,但它们增强了宿主植物对水赤字的耐受性[gydF4y2Ba31.gydF4y2Ba], AQPs在AM共生中的作用尚不清楚,并在争论中[gydF4y2Ba32.gydF4y2Ba].目前尚不清楚am植物的有益水状况是否通过调节根支座蛋白或由于增强的水流来增强。gydF4y2Ba
最终目的是阐明该基因家族的潜在作用,该基因家族似乎是高度am响应的,我们的研究重点是两个AQPs,发现在中上调gydF4y2Ba莲花gydF4y2Ba菌根的根(gydF4y2Ba14.gydF4y2Ba],属于NIP和XIP类。借助于不同实验方法的组合(表达模式,通过各种营养素和共生状态,通过共聚焦显微镜通过共聚焦显微镜与异源测定和GFP-蛋白质定位的功能表征),我们证明了这一点两种AQP是基因上和功能性多样化,但它们都是又响应。gydF4y2BaLjXIP1gydF4y2Ba只在菌根中过度表达,而gydF4y2BaLjNIP1gydF4y2Ba也gydF4y2Ba根瘤菌gydF4y2Ba响应。LJNIP1仅存在于am根中,更精确地在丛丛中,其中蛋白质与复合体内膜系统相关。与系统源性相似的蛋白质不同[gydF4y2Ba33.gydF4y2Ba],Ljnip1参与水,但显然不是氨,运输。这些结果开启了关于AM-enciplive AQP的功能作用及其与Arbuscules的关系的新问题,作为主要的真菌定植结构。gydF4y2Ba
结果gydF4y2Ba
LjNIP1和LjXIP1基因分离及系统发育分析gydF4y2Ba
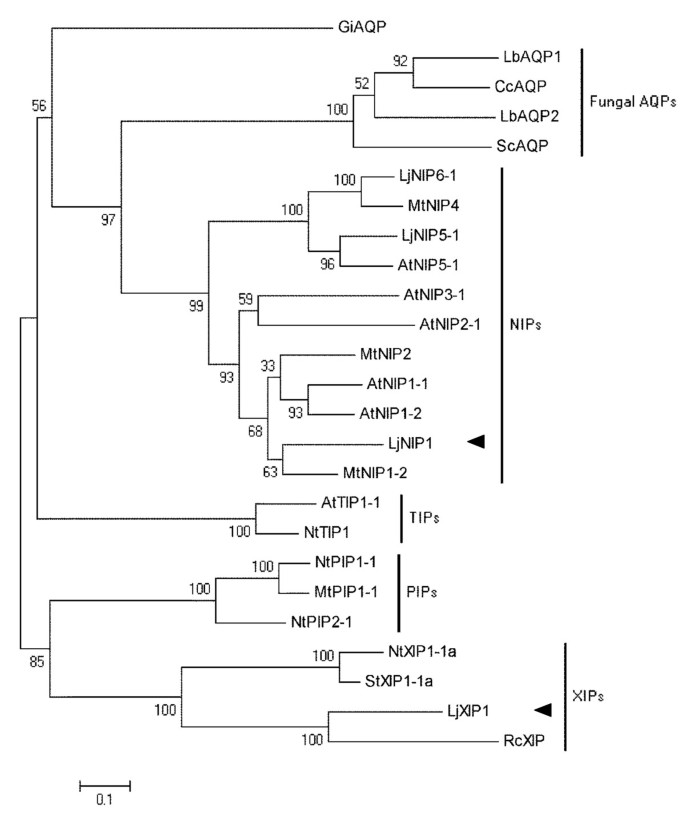
798-BP全长cDNAgydF4y2BaLjNIP1gydF4y2Ba基因(EMBL登录号HE860041)和900-BP全长cDNAgydF4y2BaLjXIP1gydF4y2Ba基因(EMBL登录号HE860042)gydF4y2Ba”gydF4y2Ba和3gydF4y2Ba”gydF4y2BaRACE,分别编码265和299氨基酸长肽。LjNIP1有两个保守的NPA过滤器,而LjXIP1显示一个非典型氨基末端NPA(附加文件gydF4y2Ba1gydF4y2Ba).如果跨膜预测软件(gydF4y2Bahttp://bioinformatics.biol.uoa.gr/tmrpres2d/gydF4y2Ba),两种水通道蛋白可能都有6个完整的跨膜结构域,从而确定了该家族的标准结构(附加文件gydF4y2Ba2gydF4y2Ba).系统发育分析(图gydF4y2Ba1gydF4y2Ba)将它们分成两个不同的功能亚科。LjNIP1与MtNIP1-2(以前称为MtNIP1)同源性最高,Uehlein已经部分描述了MtNIP1gydF4y2Baet al。gydF4y2Ba[gydF4y2Ba33.gydF4y2Ba,而LjXIP1与属于XIP家族的不同蛋白质具有显著的相似性,XIP家族是最近发现的一个功能未知的家族[gydF4y2Ba25.gydF4y2Ba,gydF4y2Ba34.gydF4y2Ba].gydF4y2Ba
植物和Symbiont真菌水电素的系统发育分析。gydF4y2Ba利用mega5,0软件生成水通道蛋白植物和真菌序列的无根系统发生树,使用Muscle进行比对,并使用邻域连接法构建系统发生(gydF4y2Bahttp://www.megasoftware.net/gydF4y2Ba).使用1000重复执行引导测试。黑色箭头标志着这项研究中调查的两种蛋白质。植物种类的缩写:在,gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba;Lj,gydF4y2BaLotus对虾gydF4y2Ba;公吨,gydF4y2BaMedicago truncatulagydF4y2Ba;元,gydF4y2Ba尼科尼亚塔哈瓦姆gydF4y2Ba;rc,gydF4y2Ba萝藦;gydF4y2Ba英石,gydF4y2Ba茄属植物tuberosum;gydF4y2Ba和真菌种类:Lb,gydF4y2BaLaccaria bicolor.gydF4y2Ba;Cc,gydF4y2BaCoprinopsis灰质gydF4y2Ba;SC,gydF4y2Ba裂褶菌属公社gydF4y2Ba;胃肠道,gydF4y2BaGlomus mortraradice.gydF4y2Ba.使用的AQP的GenBank登录号如下:GIAQP [257219859];LBAQP1 [170095169];ccaqp [169862326];LBAQP2 [170107189] SCAQP [302686158] LJNIP6-1 [162568625];mtnip4 [47531135];ntxip1-1a [309385599];ljnip5-1 [162568623];atnip5-1 [126352290];atnip3-1 [259016288]; AtNIP2-1 [32363364]; MtNIP2 [44887593]; AtNIP1-1 [32363362]; AtNIP1-2 [32363340]; MtNIP1-2 [355482834]; AtTIP1-1 [135860]; NtTIP1 [162809290]; NtPIP1-1 [17017255]; MtPIP1-1 [357492595]; NtPIP2-1 [17017257]; NtXIP1-1a [309385599]; StXIP1-1a [309385603]; RcXIP [255586851].
am sysfiens和ljnip1和ljxip1表达的细胞模式gydF4y2Ba
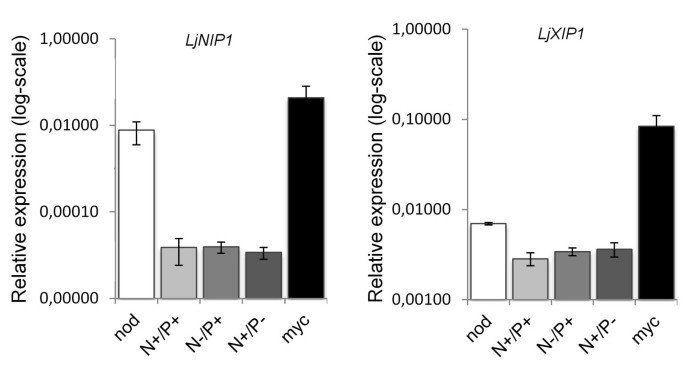
在以前的微阵列研究中[gydF4y2Ba14.gydF4y2Ba,序列标识为gydF4y2BaLjNIP1gydF4y2Ba和gydF4y2BaLjXIP1gydF4y2Ba其log2值分别为3.80和3.08,是菌根化后上调最多的基因之一。为了验证这种上调的特异性,我们将其与高氮磷利用率和低氮磷利用率的根瘤和对照进行了比较,研究了它们的表达模式。菌根和对照根是在28天取样的,这个时间点被认为是微阵列实验中丛枝最多的时间点[gydF4y2Ba14.gydF4y2Ba].在35 dpi下对照和编组根部进行采样。在每个接种的根部中计数32至36个结节。gydF4y2Ba
定量RT-PCR证实,在菌根根中达到了最高表达水平。gydF4y2BaLjNIP1gydF4y2Ba结节也高度诱导表达(图gydF4y2Ba2gydF4y2Ba),而gydF4y2BaLjXIP1gydF4y2Ba表达仅被轻微诱导。保持不同氮磷水平的未接种植株的基因表达不被激活。gydF4y2Ba
相对表达gydF4y2BaLjNIP1gydF4y2Ba和gydF4y2BaLjXIP1。gydF4y2Ba的相对表达gydF4y2BaLjNIP1gydF4y2Ba和gydF4y2BaLjXIP1gydF4y2Ba,通过QRT-PCR评估,在gydF4y2BaL. japonicus.gydF4y2Ba菌根形成28天后,结瘤35天后。cgydF4y2BatgydF4y2Ba样品的值归功于C.gydF4y2BatgydF4y2Ba家务基因的价值gydF4y2BaUBQ10gydF4y2Ba.每个条件的数据都作为平均值呈现,并从三个生物学和三种技术复制中获得。-n =10μm的knogydF4y2Ba3.gydF4y2Ba;+N = 4毫米KNOgydF4y2Ba3.gydF4y2Ba;-p = 20 μm PogydF4y2Ba4gydF4y2Ba3-gydF4y2Ba;+ p = 500 μm PogydF4y2Ba4gydF4y2Ba3-gydF4y2Ba正如Guether所说gydF4y2Baet al。gydF4y2Ba[gydF4y2Ba58.gydF4y2Ba].条形图表示标准差。gydF4y2Ba
这些结果表明,两个推定的水蛋白的表达取决于根系Symbiont的存在,但可能没有显着影响菌根或菌根的改进的N和P状态。另外,表达了gydF4y2BaLjNIP1gydF4y2Ba和gydF4y2BaLjXIP1gydF4y2Ba与共生微生物的身份或特定的植物-微生物相互作用有关。gydF4y2Ba
特异性的表达gydF4y2BaLotus水通道蛋白gydF4y2Ba
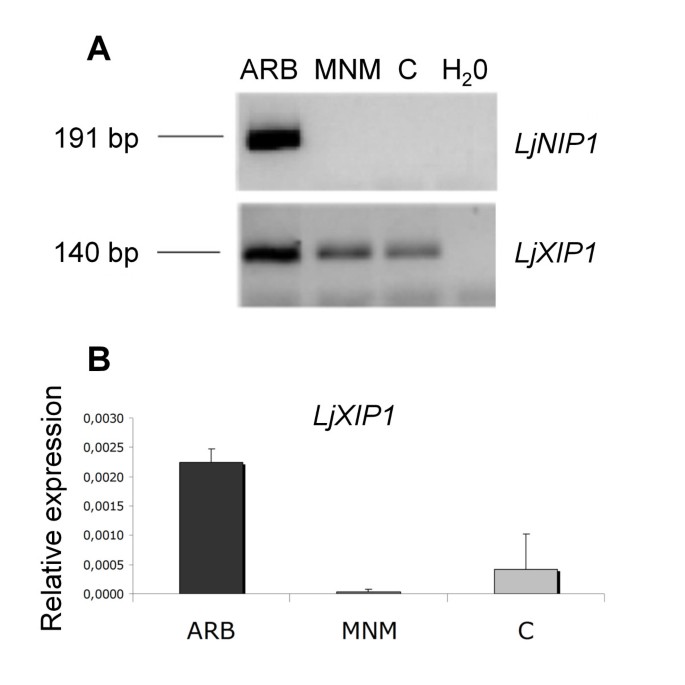
激光微生物切除方法用于定位转录物累积部位。由于植物与真菌之间发生的营养交换的关键结构已经证明是仲裁[gydF4y2Ba4gydF4y2Ba,皮质细胞被选为第一靶点。通过激光显微解剖系统收集三种类型的细胞:丛枝细胞(ARB),来自菌根根的非定殖皮层细胞(MNM)和来自非菌根根的皮层细胞(C)gydF4y2BaLjNIP1gydF4y2Ba和gydF4y2BaLjXIP1gydF4y2Ba使用,预期大小的碎片存在不同的表达模式:gydF4y2BaLjNIP1gydF4y2Ba结果是特异性表达在含丛枝的细胞,而gydF4y2BaLjXIP1gydF4y2Ba分析的三种细胞类型中存在转录物(图gydF4y2Ba3.gydF4y2BaA).为了更好地研究这一结果,进一步进行相对量化gydF4y2BaLjXIP1gydF4y2Ba通过从微小细胞提取的RNA上的一步QRT-PCR进行转录物(图gydF4y2Ba3.gydF4y2Bab)。这种方法显示,与分析的其他细胞类型相比,基因在丛枝细胞中过表达,从而确认含仲核细胞内可能的额外或增强的作用。可以指出该结果的有效性,通过在定量前未扩增RNA,并且在每种细胞类型中保留了RNA的确切量。gydF4y2Ba
激光显微解剖细胞的RT-PCR和qRT-PCR。gydF4y2Ba(gydF4y2Ba一个gydF4y2Ba) RT-PCR分析gydF4y2BaLjNIP1gydF4y2Ba和gydF4y2BaLjXIP1gydF4y2BaLMD样本:gydF4y2BaLjNIP1gydF4y2Ba扩增片段仅在ARB细胞中检测到,而gydF4y2BaLjXIP1gydF4y2Ba在非定殖的菌根皮层细胞(MNM)和非菌根皮层细胞(C)中也检测到片段(gydF4y2BaBgydF4y2Ba的相对表达gydF4y2BaLjXIP1gydF4y2Ba在LMD样本中采用一步qRT-PCR检测。以丛枝细胞最高。数值是两个生物样品和两个技术重复的平均值,条形代表标准差。gydF4y2Ba
LjNIP1gydF4y2Ba殖民时期的表达gydF4y2Ba
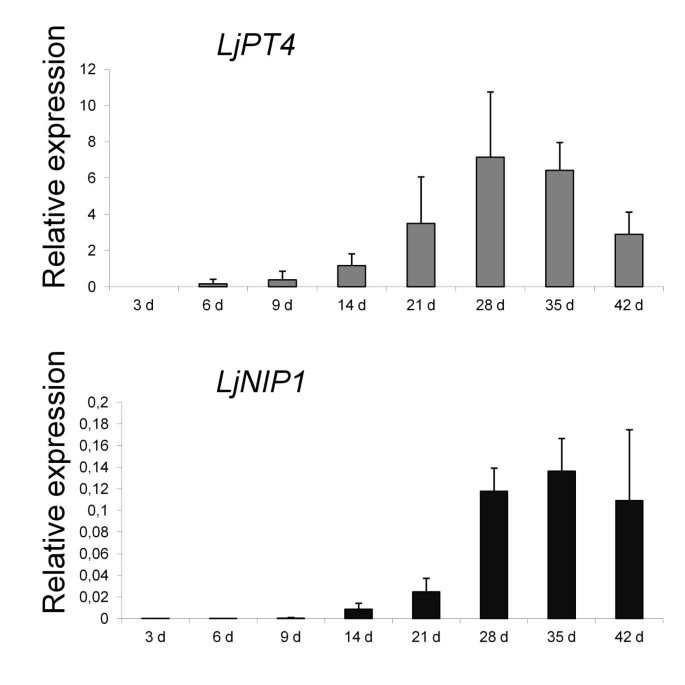
自gydF4y2BaLjNIP1gydF4y2Ba表达导致与仲裁的存在更紧密,我们在时间课程实验期间跟随基因表达。比较与gydF4y2BaLjPT4gydF4y2Ba表达水平也被用于收集信息之间的关系gydF4y2BaLjNIP1gydF4y2Ba表达和仲裁开发。gydF4y2BaLjPT4gydF4y2Ba是同源的吗gydF4y2BaMtPT4gydF4y2Ba,被认为是活跃的丛枝细胞的标志gydF4y2BaMedicago.gydF4y2Ba,由于其表达式反映了ArbUScule状态,即,当仲裁折叠时,其表达式减少[gydF4y2Ba35.gydF4y2Ba].数字gydF4y2Ba4gydF4y2Ba表明,gydF4y2BaLjNIP1gydF4y2Ba表达式模式主要是模拟gydF4y2BaLjPT4gydF4y2Ba动力学。直到28dpi,这两个基因的表达水平都在增加,但有趣的是,在接种后35和42天,表达水平有重要的差异:gydF4y2BaLjPT4gydF4y2Ba表达开始减少,可能是由于仲裁的形成和崩溃的异步过程gydF4y2BaLjNIP1gydF4y2Ba表达在两个时间点之间没有任何显著差异,并在整个实验过程中保持高水平。这使得我们可以推测这种蛋白质的作用,它独立于丛枝结构,在丛枝结构完全发挥功能和衰老过程中都有表达。gydF4y2Ba
时间过程gydF4y2BaLjNIP1gydF4y2Ba和gydF4y2Baljpt4。gydF4y2Ba相对表达gydF4y2BaLjPT4gydF4y2Ba和gydF4y2BaLjNIP1gydF4y2Ba在接种后不同时间点,采用qRT-PCR方法测定定殖时间。将样本的Ct值归一化,如图所示gydF4y2Ba2gydF4y2Ba.这些值是三个生物重复的平均值,条形代表标准差。gydF4y2Ba
铵和尿素吸收缺陷酵母突变体的异源互补gydF4y2Ba
因为高度的相似性gydF4y2BaLjNIP1gydF4y2Ba和gydF4y2BaMtNIP1-2gydF4y2Ba[gydF4y2Ba33.gydF4y2Ba我们测试了这两种装置的能力gydF4y2Ba莲花gydF4y2Ba水素到运输铵。酵母 (gydF4y2Ba酿酒酵母酿酒酵母gydF4y2Ba)菌株31019b,其内源三种铵态氮转运体(Mep1、Mep2和Mep3)均有缺陷,因此无法在含<5 mM铵态氮源的培养基上生长[gydF4y2Ba33.gydF4y2Ba),使用。将该菌株转化酵母载体pDR199gydF4y2BaLjNIP1gydF4y2Ba和gydF4y2BaLjXIP1gydF4y2Ba在构成酵母PMA1启动子的控制下。为了将转化后的酵母与已描述的植物铵转运体和氨通道进行比较,我们还将该酵母菌株与含有NH编码序列的pDR199表达载体进行了转化gydF4y2Ba4gydF4y2Ba+gydF4y2Ba转运体gydF4y2BaATAMT1; 2gydF4y2Ba[gydF4y2Ba36.gydF4y2Ba] 和gydF4y2BaK10gydF4y2Ba,一种除尿素外还能转运氨的水通道蛋白突变体[gydF4y2Ba37.gydF4y2Ba].突变gydF4y2BaK10gydF4y2Ba来自于水选择性的gydF4y2BaAtPIP2; 1gydF4y2Ba并在选择性过滤器中发生突变,具有典型的AtNIP1s ar/R区域。考虑到树木周围空间的酸性条件[gydF4y2Ba38.gydF4y2Ba在酵母氮基(YNB)培养基上分析了不同pH条件下酵母的生长情况。如图所示gydF4y2Ba5gydF4y2Ba首先,LjNIP1或LjXIP1在含1mm铵的最低培养基上不能恢复酵母的生长。正如预期的那样,表达AtAMT1;2的酵母在任何pH条件下都能生长良好,而表达K10的酵母在ph7,25条件下都能产生良好的互补。我们对酵母菌菌株YNVW1进行了同样的实验,该菌株的尿素转运体存在缺陷,因此无法在含<5 mM尿素作为唯一N源的培养基上生长[gydF4y2Ba39.gydF4y2Ba].如图所示gydF4y2Ba5gydF4y2BaB,酵母的生长都不能恢复gydF4y2BaLjNIP1gydF4y2Ba或通过gydF4y2BaLjXIP1gydF4y2Ba在含有1mm尿素的最小培养基上作为鞋底源,而是仅通过阳性对照K10。gydF4y2Ba
LJNIP1可以运输水gydF4y2Ba
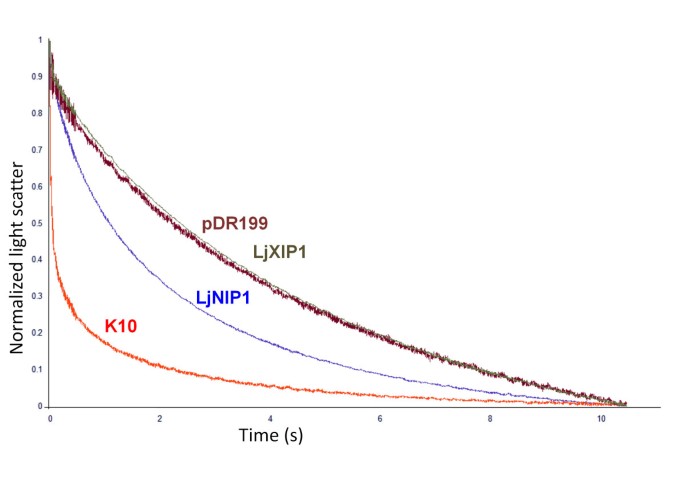
为了更好地描述gydF4y2BaLjNIP1gydF4y2Ba和gydF4y2BaLjXIP1gydF4y2Ba功能,各自的蛋白质在酵母原生质体中表达,并通过停止流动分光光度计检测细胞,以评估其水运输能力[gydF4y2Ba40gydF4y2Ba].这个仪器可以在一个快速混合装置中测量随时间变化的散射光差,这与原生质体获取水的能力有关。如前所述,对K10的分析起到了内部控制的作用。实验表明,LjNIP1增加了细胞膜的水渗透性,而LjXIP1水通道蛋白并没有增加高渗透条件下酵母细胞的水运输速率(图)gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
这些结果导致结论,LJNIP1可以参与水运输,而不是氮溶质转运。然而,LJXIP1在所有测定中都是非功能性的。这是否反映了差的定位进入质膜,选择性或缺乏开放刺激仍然是一个开放的问题。gydF4y2Ba
LjNIP1在烟草叶表皮细胞中的亚细胞定位gydF4y2Ba
一个混合的gydF4y2BaLjNIP1gydF4y2Ba-gydF4y2BaeGFPgydF4y2Ba构建并放置在CaMV 35S启动子下游,以了解LjNIP1在植物细胞中的亚细胞定位。对烟草叶片表皮细胞进行瞬时表达分析。对照细胞中表达游离eGFP的荧光均匀地延伸到细胞内,包括整个细胞核和细胞壁(图)gydF4y2Ba7gydF4y2BaA -gydF4y2Ba7gydF4y2BaC)。gydF4y2Ba7gydF4y2BaD (-gydF4y2Ba7gydF4y2Baf)显示表达Ljnip1-EGFP蛋白的烟草细胞叶:在围绕细胞核的核包封中发现光荧光信号,内质网区域的典型信号和内膜系统。gydF4y2Ba
中p35S-eGFP-LjNIP1瞬时表达gydF4y2Ba尼科尼亚塔哈瓦姆gydF4y2Ba叶表皮细胞。gydF4y2Ba一个gydF4y2Ba-gydF4y2BaCgydF4y2Ba.Free-eGFP荧光均匀地存在于表皮细胞内,并首先积聚在质膜和细胞核内(n),而红色叶绿素自身荧光仅限于叶绿体。gydF4y2BaDgydF4y2Ba.由于eGFP-LjNIP1的表达,一个淡绿色的信号从核膜(ne)开始在内膜系统(ms)中积累。一个微弱的信号也与质膜有关。gydF4y2BaEgydF4y2Ba.D中显示的同一叶片的叶绿素荧光。gydF4y2BaFgydF4y2Ba.D和e的叠加图像= 25 μm。gydF4y2Ba
EGFP-LJNIP1积聚在内质网和内膜系统中gydF4y2Ba莲花gydF4y2Ba菌根根gydF4y2Ba
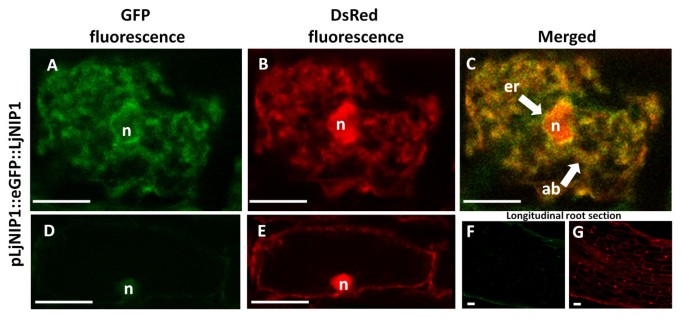
为了验证上述烟叶上上述实验的LJNIP1蛋白的细胞内定位,我们产生了gydF4y2Ba莲花gydF4y2Ba在控制下表达EGFP-LJNIP1融合蛋白的转基因根gydF4y2BaLjNIP1gydF4y2Ba内源性启动子。gydF4y2Ba莲花gydF4y2Ba根被转化为gydF4y2Ba农杆菌属rhizogenesgydF4y2Ba携带质粒。用10-20接种根部gydF4y2Ba胃肠道。玛格丽塔gydF4y2Ba35-42 dpi后观察到孢子和至少10个独立的转化根系。在泛素启动子的控制下,通过DsRed蛋白的表达鉴定转化后的根。GFP信号仅在有丛枝的细胞中被检测到(图gydF4y2Ba8gydF4y2BaA -gydF4y2Ba8gydF4y2BaC),并且在细胞核周围的膜中信号明显,这通常与内质网一致,以及在内质膜中,也可能包括液泡液泡质体。然而,即使荧光信号不能准确地跟踪所有树枝,也不能排除来自树枝周围膜的可能信号。在未定殖根的表皮和皮层组织中未观察到GFP荧光,这在高倍镜下也得到了证实,细胞核位于皮层细胞的外围位置(图)gydF4y2Ba8gydF4y2BaD -gydF4y2Ba8gydF4y2BaG)。gydF4y2Ba
菌根菌根Ljnip1的亚细胞定位。gydF4y2Ba共聚焦显微镜图像显示gydF4y2BaPljnip-EGFP-LJNIP1gydF4y2Ba表达gydF4y2BaL. japonicus.gydF4y2Ba根与殖民gydF4y2Ba胃肠道。玛格丽塔gydF4y2Ba.gydF4y2Bapubi10-dsred.gydF4y2Ba在转化的根中广泛表达,细胞核突出(n)。gydF4y2Ba一个gydF4y2Ba-gydF4y2BaCgydF4y2BapLjNIP1-eGFP-LjNIP1存在于整个细胞腔内,以非连续的方式与真菌丛枝分枝(ab)表面相关联。它也聚集在细胞核外,导致与内细胞膜系统和内质网(er)相关。gydF4y2BaDgydF4y2Ba-gydF4y2BaEgydF4y2Ba:菌根植物的非定殖皮层细胞;核(n)处于典型的周围位置;缺席的情况下gydF4y2BaLjNIP1gydF4y2Ba在没有任何GFP信号的情况下,也可以从没有检测到GFP信号的非定殖根的纵切面上看到(gydF4y2BaFgydF4y2Ba)和DsRed普遍表达(gydF4y2BaGgydF4y2Ba).柱= 25 μm。gydF4y2Ba
讨论gydF4y2Ba
当AM真菌在其宿主的根上定植时,通常会报道显著的细胞重组以及转录组谱的重要变化[gydF4y2Ba41.gydF4y2Ba].这些细胞和分子变化在丛丛细胞中特别令人印象深刻,这被认为是在共生的核心。由于水蛋白 - 允许通过细胞膜通过细胞膜通过的水通道蛋白质在菌根根中据报道据报道,我们表征了两个gydF4y2Ba莲花gydF4y2Ba基因,gydF4y2BaLjXIP1gydF4y2Ba和gydF4y2BaLjNIP1gydF4y2Ba,这导致在微阵列实验期间受到调节[gydF4y2Ba14.gydF4y2Ba].结果表明,这两个基因编码的水通道蛋白在基因和功能上都是不同的,尽管它们在AM共生过程中都过表达。gydF4y2Ba
菌根诱导的LjXIP1和LjNIP1属于植物水通道蛋白的两个不同家族,它们含有不同的ar/R收缩区域gydF4y2Ba
NIP蛋白家族的名字来源于原始类型nodulin26,最初是在被根状菌定殖的大豆中发现的[gydF4y2Ba42.gydF4y2Ba].据报道,结节蛋白26的作用是介导水通过两个共生体之间的界面。这组完整的膜蛋白是植物独有的,可追溯到原始陆生植物的第一个发育阶段,表明在它们的进化过程中起着稳定的作用[gydF4y2Ba24.gydF4y2Ba].nips广泛分布在豆科植物和非豆科植物中,9和13个NIP基因被编码gydF4y2Ba拟南芥gydF4y2Ba和水稻基因组分别[gydF4y2Ba43.gydF4y2Ba].在植物水通道蛋白中,属于该亚家族的蛋白质具有无与伦比的功能特征[gydF4y2Ba28.gydF4y2Ba].根据nip的选择性滤波器结构,将其分为三组。gydF4y2BaLjNIP1gydF4y2Ba属于I类,与同源的有很大的相似性gydF4y2BaMedicago.gydF4y2Ba基因,导致在菌根中过表达,并能转移铵或氨[gydF4y2Ba33.gydF4y2Ba].gydF4y2Ba
XIP蛋白的功能,在细胞水平,尚未阐明,但他们的一些特征已经被描述:在2011年,Bienert和同事[gydF4y2Ba34.gydF4y2Ba)表明,gydF4y2Ba茄科gydF4y2BaXIPs能够转移几种不带电的溶质,如尿素、甘油和硼酸,但结果是不透水。他们还推测了XIPs和NIPs之间可能的功能重叠,因为它们在底物光谱和选择性孔上的相似性。相反,来自杨树的XIPs具有广泛而多样的表达模式和不同的调水能力[gydF4y2Ba44.gydF4y2Ba].LjXIP1与来自gydF4y2Ba里纳斯市政府gydF4y2Ba.gydF4y2Ba
形成Ar / R收缩区域的四个氨基酸对水素底物选择性至关重要。就LJNIP1而言,选择性过滤器由色氨酸,异氨酸,丙氨酸和精氨酸组成。这些残留物形成宽,相当疏水的孔,是典型的I型液体蛋白质,其特征能够转移水[gydF4y2Ba24.gydF4y2Ba,与我们的功能分析一致(图gydF4y2Ba6gydF4y2Ba).另一方面,Ljxip1的Ar / R选择性孔隙是不寻常的,因为它由苯基,精氨酸和两种缬氨酸(芳香族,疏水和两个小残留物)组成(附加文件gydF4y2Ba1gydF4y2Ba),因此很难推测任何可能的化合物亲缘关系。然而,它确实与属于III类的典型NIP蛋白有一些相似之处[gydF4y2Ba43.gydF4y2Ba],并直观地与其他XIP蛋白[gydF4y2Ba34.gydF4y2Ba].gydF4y2Ba
最近有报道称外生菌根真菌的水通道蛋白可能在与植物的相互作用中发挥作用[gydF4y2Ba45.gydF4y2Ba].正如预期的那样,迄今为止,与植物水通道蛋白相比,共生真菌中的水通道蛋白属于一个遥远的分支(图)gydF4y2Ba1gydF4y2Ba),这证明了一个不同的进化故事。gydF4y2Ba
结论,序列分析清楚地表明,LJNIP1和LJXIP1属于两种不同的植物水质蛋白,并且收缩区域的氨基酰基组成预测不同的基质,如我们的功能实验所确认的(见下文)。gydF4y2Ba
Mycorrhiza-inducedgydF4y2BaLjNIP1gydF4y2Ba是棘轮的特异性的细胞,并靶向内膜系统gydF4y2Ba
由于在结节共生期间已经检测到水蛋白蛋白[gydF4y2Ba46.gydF4y2Ba,我们想知道是否gydF4y2BaLjXIP1gydF4y2Ba和gydF4y2BaLjNIP1gydF4y2Ba也是gydF4y2Ba根瘤菌gydF4y2Ba以及它们的表达是否取决于P和N的可用性。无论是gydF4y2BaLjXIP1gydF4y2Ba也没有gydF4y2BaLjNIP1gydF4y2Ba表达水平导致受土壤营养浓度的影响,但有趣的是,它们在与微生物的相互作用期间过表达:gydF4y2BaLjXIP1gydF4y2Ba结果是由AM真菌诱导的,而gydF4y2BaLjNIP1gydF4y2Ba也受根瘤菌的调控。这清楚地表明,这两种水通道蛋白的表达与共生微生物的身份有关。转录本的定位和相对定量,通过激光显微解剖实验gydF4y2BaL. japonicus.gydF4y2Ba菌根已经证明了这一点gydF4y2BaLjXIP1gydF4y2Ba在不同类型的根细胞中表达,在丛枝细胞中表达水平较高,在非定殖的皮层细胞中表达水平也较高。gydF4y2BaLjNIP1gydF4y2Ba而只在含丛枝的细胞中表达,这就提出了这样一个问题:在含拟杆菌的细胞中,这种紧密的细胞类型依赖性是否也能维持?gydF4y2Ba
观察采用激光显微解剖方法的实验[gydF4y2Ba15.gydF4y2Ba,gydF4y2Ba16.gydF4y2Ba,可以得出结论,与水通道蛋白表达模式相关的数据是非常一致的,无论植物-真菌之间的关联,这表明它们可以被认为是AM共生的良好的新指标,在情况下gydF4y2Baljnip1,gydF4y2Ba根系统共生。gydF4y2Ba
目前的知识表明,AM-encooctive的磷酸盐转运蛋白是AM功能的优秀标记[gydF4y2Ba47.gydF4y2Ba].因此,我们执行了agydF4y2BaLjPT4gydF4y2Ba表达时间过程[gydF4y2Ba14.gydF4y2Ba,并检测到与gydF4y2BaLjNIP1gydF4y2Ba直到35 dpi。有趣的是,在此之后,相关模式消失了,水通道蛋白基因的表达仍然保持高水平gydF4y2BaLjPT4gydF4y2Ba开始减少。这表明在我们的实验条件下,丛枝开始坍塌的时刻[gydF4y2Ba14.gydF4y2Ba].事实上,尚未举报菌根特异性磷酸盐转运蛋白在倒塌的仲裁中表达[gydF4y2Ba48.gydF4y2Ba].gydF4y2Ba
瞬态表达gydF4y2BaLjNIP1gydF4y2Ba的绿色荧光蛋白gydF4y2Ba烟草gydF4y2Ba表皮细胞和菌根gydF4y2Ba莲花gydF4y2Ba根,在内膜上有一个定位。与核相关的蛋白质无疑是膜,一个典型的特征,但它似乎也分散在其他endomembranes可以起诉的ER(如高尔基体)或液泡膜,在殖民地遍布周围细胞arbuscule分支(gydF4y2Ba49.gydF4y2Ba]及-如透射电子显微镜下所示[gydF4y2Ba50.gydF4y2Ba] - 可以在某些点粘附到围式膜(图gydF4y2Ba9gydF4y2Ba).相应的水通道蛋白,gydF4y2Baatnip2; 1gydF4y2Ba,已经被提出参与根伸长区细胞的活性伸长,其中几种细胞器和细胞壁成分通过内质网积极合成[gydF4y2Ba51.gydF4y2Ba:同样高的生理和形态活性对于菌根细胞发生的巨大变化是必要的。gydF4y2Ba
总之,我们建议LJNIP1不公共定位在围式膜中,如其他蛋白质营养吸收的蛋白质[gydF4y2Ba52.gydF4y2Ba]但可以与其他细胞膜相关,例如调色剂,ER或ER相关膜。gydF4y2Ba
LjNIP1和LjXIP1不能输送氨和尿素,但LjNIP1可以输送水gydF4y2Ba
基于LjNIP1和MtNIP1-2序列相似性高,能转移铵,但不能转移水[gydF4y2Ba33.gydF4y2Ba[我们验证了LJNIP1是否具有相同的特征,但得到了相反的结果。事实上,当Ljnip1透过水时,如停止流动实验所示,它不能有效地在酵母互补测定中有效地转移铵或尿素。另一方面,Ljxip1,与来自同一家族的任何溶律蛋白质一样,不能转移水[gydF4y2Ba34.gydF4y2Ba或其他溶质。gydF4y2Ba
考虑到这一点,这些结果为各种各样的猜测铺平了道路gydF4y2BaLjNIP1gydF4y2Ba导致高度表达于21个DPI(后接种后)。事实上,与先前的描述不同,在中央液泡由于真菌的存在而被描述为片段化[gydF4y2Ba53.gydF4y2Ba[现在已知在电子显微镜和共焦观察的基础上,调色剂介于围本膜膜,一方面导致丛枝开发期间调节剂的表面增加,另一方面,在另一方面两个细胞膜之间的亲密相互作用[gydF4y2Ba50.gydF4y2Ba,gydF4y2Ba53.gydF4y2Ba- - - - - -gydF4y2Ba55.gydF4y2Ba)(图gydF4y2Ba9gydF4y2Ba).我们推测LJNIP1通过内膜系统内的水通道涉及植物细胞Turgor的维持,或者直接参与从真菌的水中的植物,这是目前较差的机制[gydF4y2Ba56.gydF4y2Ba].这种作用是当枝形分支有效时至关重要,以及当它们塌陷和较高量的水进入液泡以保持正确的Turgor。由于在殖民化的皮质细胞中发生了一个重要的膜生物发生在真菌的殖民化之前和之后[gydF4y2Ba8gydF4y2Ba], LjNIP1可以介导水在不同细胞器膜内外的通道。综上所述,我们可以假设LjNIP1在不同的丛枝细胞膜系统中起着水通道的作用。gydF4y2Ba
结论gydF4y2Ba
我们的研究结果表明,两个与水素相关的基因属于两个遥远的家庭,并对根系统词组不同,显示非重叠表达模式。潜在的作用gydF4y2BaLjXIP1gydF4y2Ba仍然默默无闻gydF4y2Ba,gydF4y2Ba尽管它只对AM真菌定植有反应,而对固氮根瘤菌没有反应,这使它成为进一步研究的好候选。的arbuscule-specificgydF4y2BaLjNIP1gydF4y2Ba相反,已被证明是整个仲裁生命周期的一个新的Am Symbiosis标志。由于AM殖民化的不同步性质,gydF4y2BaLjNIP1gydF4y2Ba似乎是一个比gydF4y2BaLjPT4gydF4y2Ba,因为它涵盖了更广泛的丛枝植物发展步骤。功能实验明确表明,LjNIP1不转运氨,但可以转运水gydF4y2BaMedicago.gydF4y2Ba同源(gydF4y2Ba33.gydF4y2Ba].这些功能的基础上的结果,膜定位和表达时间,人们很容易认为可能涉及蛋白质,直接或间接地在细胞膨规定,在促进细胞适应殖民渗透压力,和/或在实际转移的水从真菌植物。gydF4y2Ba
方法gydF4y2Ba
植物材料、生长条件及接种方法gydF4y2Ba
Gigaspora玛格丽塔gydF4y2Ba贝克尔和霍尔(沉积在银行的欧洲Glomales为BEG 34)作为真菌接种物。的gydF4y2BaLotus对虾gydF4y2Ba通过K.RaRSEN(GIFU;野生型)的菌根化方法(regel)已经详细描述了[gydF4y2Ba14.gydF4y2Ba].gydF4y2Ba莲花gydF4y2Ba在蛭石和B & D营养液[gydF4y2Ba57.gydF4y2Ba],含有10μm或4毫米的KNOgydF4y2Ba3.gydF4y2Ba,分别使用。接种了一部分N-饥饿的植物gydF4y2BaMesorhizobium洛蒂gydF4y2Ba菌株NZP2235。将来自二维液体培养物(5mL)的细菌细胞离心,洗涤,悬浮在50ml蒸馏水中,随后倒入植物盆中[gydF4y2Ba58.gydF4y2Ba,gydF4y2Ba59.gydF4y2Ba].接种真菌28 d后,在立体显微镜下观察,从菌根中切取样品,选择有真菌菌丝的根。对三个独立实验的根段进行了分析。在不同时间点采集至少3个生物重复,进行时间历程实验。gydF4y2Ba
RNA分离、cDNA合成及RT-PCRgydF4y2Ba
RNA的分离、cDNA的合成以及定量RT-PCR (qRT-PCR)方法已经有了详细的描述[gydF4y2Ba14.gydF4y2Ba].在QRT-PCR之前,基因特异性引物gydF4y2BaLjNIP1gydF4y2Ba和gydF4y2BaLjXIP1gydF4y2Ba对基因组DNA和cDNA进行检测以进行扩增。由于从菌根中提取的RNA包含植物和真菌的RNA,因此通过PCR扩增分析引物对的特异性gydF4y2Ba胃肠道。玛格丽塔gydF4y2Ba基因组DNA。在真菌DNA上没有得到扩增产物。寡核苷酸序列gydF4y2BaLjNIP1gydF4y2Ba和gydF4y2BaLjXIP1gydF4y2Ba如下:gydF4y2BaLjNIP1gydF4y2Ba前底漆,5gydF4y2Ba”gydF4y2Ba-AttggGTCTACATTGCT-3gydF4y2Ba”gydF4y2Ba;gydF4y2BaLjNIP1gydF4y2Ba反向引物5gydF4y2Ba”gydF4y2Ba-CTTGTCTGTGTATCTGAGGA - 3gydF4y2Ba”gydF4y2Ba.gydF4y2BaLjXIP1gydF4y2Ba前底漆,5gydF4y2Ba”gydF4y2Ba- ttgtgtccataActgtgacc-3gydF4y2Ba”gydF4y2Ba;gydF4y2BaLjXIP1gydF4y2Ba反向引物5gydF4y2Ba”gydF4y2Ba- AATGTCCATTCCACACTGAG - 3gydF4y2Ba”gydF4y2Ba.gydF4y2Ba
5运动中3的运动中gydF4y2Ba
5gydF4y2Ba”gydF4y2Ba- 3.gydF4y2Ba”gydF4y2Ba- 使用智能族cDNA扩增试剂盒(Clontech),用上述从腐殖根提取的上述总RNA进行的。使用的基因特异性引物序列与QRT-PCR中使用的基因特异性引物序列相同。PCR根据CLONTECH协议使用优点2 PCR酶系统和95℃的35个循环,30s,60℃,30s,72℃持续2分钟,并且在72℃下最终延伸10分钟。将种族产品进行电泳,克隆在PCRII(Topo Cloning Kit; Invitrogen)中,并通过DNA测序分析。gydF4y2Ba
酵母转化质粒的构建gydF4y2Ba
编码区gydF4y2BaLjNIP1gydF4y2Ba利用优势2 PCR酶系统(CLONTECH)和以下寡核苷酸(包括XmaI/XhoI限制性内切位点)进行PCR扩增(798 bp),然后利用这些寡核苷酸进行亚克隆:正向引物,5gydF4y2Ba”gydF4y2Ba-tatcccgggatggctaacaattcagcttc-3gydF4y2Ba”gydF4y2Ba;反向引物5gydF4y2Ba”gydF4y2Ba-tatctcgagggtaactttttcatttgc-3gydF4y2Ba”gydF4y2Ba.我们使用以下寡核苷酸来分离gydF4y2BaLjXIP1gydF4y2Ba编码区(900 bp):正向引物gydF4y2Ba”gydF4y2Ba——TATCCCGGGATGAATTCTTTTAACTCTCAGGTG-3gydF4y2Ba”gydF4y2Ba;反向引物5gydF4y2Ba”gydF4y2Ba——TATCTCGAGTCAAGAAGCTTGAGGCAAC-3gydF4y2Ba”gydF4y2Ba.PCR产物克隆到pCRII载体(TOPO克隆试剂盒;Invitrogen),并通过全长测序进行验证。的开放式阅读框架gydF4y2BaLjNIP1gydF4y2Ba亚克隆到酵母表达载体pDR199 (gydF4y2Ba酿酒酵母酿酒酵母gydF4y2Ba) 表达。以下AQP被用作酵母表达实验的对照:ATAMT1; 2 [gydF4y2Ba36.gydF4y2Ba]和K10,突变形式的Atpip1; 2,atnip1-arnip4的典型Ar / r选择性过滤器,能够运输任何种类的化合物[gydF4y2Ba37.gydF4y2Ba].gydF4y2Ba
在酵母中表达gydF4y2Ba
将含有各自开放阅读框的质粒转染到ura- amt缺陷酵母株31019b中;ΔΔΔmep1; 2、3 (gydF4y2Ba60.gydF4y2Ba]和尿素-;YNVW1;Δdur3;Δura3 [gydF4y2Ba39.gydF4y2Ba].缺氮培养基为不含氨基酸的YNB和硫酸铵(Difco),添加3% Glc和3 mM nhhgydF4y2Ba4gydF4y2BaCl是唯一的N源。没有添加缓冲区。在非选择性条件下,不同结构体的表达不影响酵母的生长。gydF4y2Ba
酵母原生质体制备gydF4y2Ba
酵母原生质体根据协议制备[gydF4y2Ba61.gydF4y2Ba],如前所述[gydF4y2Ba62.gydF4y2Ba].在旋转振荡器上在液体SD-URA或SGAL-URA上生长培养物18小时(250rpm,30℃)。来自10ml等分试样的细胞纺下来(500× ggydF4y2Ba, 5分钟),3毫升resuspended平衡缓冲(50毫米磷酸钾在pH值为7.2,包含40毫米β巯基乙醇)和平衡在30°C旋转瓶15分钟。6毫升消化缓冲区(50毫米磷酸钾在pH值为7.2,40毫米β巯基乙醇,2.4山梨糖醇,50毫克/毫升牛血清白蛋白,添加0.1-1 mg酶解酶20 T)。将混合物在旋转振动筛上旋涡并在30℃下孵育45分钟。采用离心(1000 × 10)方法收获原生质体gydF4y2BaggydF4y2Ba5分钟)重新悬浮在孵育缓冲液中(1.8M山梨糖醇,50mM NaCl,5mM CaClgydF4y2Ba2gydF4y2Ba,10 mm tris与hcl培养至pH8),并在使用直至使用冰。gydF4y2Ba
Stopped-flow光谱法gydF4y2Ba
在停止流动分光光度计(SFM 300, BioLogic)中,通过436 nm的90°光散射检测了酵母原生质体的体积变化,这是由跨膜水运输产生的。酵母原生质体在培养缓冲液(1.8 M山梨醇,50 mM NaCl, 5 mM CaCl)中平衡gydF4y2Ba2gydF4y2Ba通过将平衡的原生质体悬浮液与具有相同离子组合物(1.2M山梨糖醇)的相同的测试溶液混合,通过将平衡的原生质体悬浮液混合而开始10mM Tris / HCl,pH8.0)和水运输。这导致向外指向的渗透梯度诱导水吸收和体积的增加,这从而降低了散射光的强度的降低。gydF4y2Ba
渗透性测量gydF4y2Ba
通过停止的流量分光光度法测量完整酵母原生质体的水渗透率[gydF4y2Ba61.gydF4y2Ba].将原生质体暴露于300 MOSMOL向外指向渗透梯度以诱导肿胀。考虑到停止的流量分光光度计(SFM-300,Bio-Logic SA,Claix,法国)中的降低散射光强度来测量体积变化。使用伯滨(生物逻辑SAS)软件将单一指数函数拟合到肿胀动力学的初始100ms的单指数函数来实现水导率的定量。在至少五个独立转化的克隆的独立实验中至少五个独立转化的克隆进行曲线,平均每种测量为20(N≥100)。gydF4y2Ba
激光显微解剖gydF4y2Ba
菌根和非菌根根段在新鲜制备的无水乙醇:冰乙酸(3:1)中4℃过夜固定石蜡包埋[gydF4y2Ba63.gydF4y2Ba].Leica作为激光微生物系统(Leica Microsystems)用于将细胞与预先作品中所述分离出来自制备的组织切片[gydF4y2Ba14.gydF4y2Ba,gydF4y2Ba63.gydF4y2Ba].收集后,加入PicoPure试剂盒(Arcturus Engineering)的RNA提取缓冲液,42°C孵育30分钟,800 g离心2分钟,−80°C保存。然后,在接下来的RNA提取步骤中,将每个细胞类型群体的约1500个细胞聚集在单个管中,最终体积为50 μL。gydF4y2Ba
RNA提取,RT-PCR和QRT-PCR在微散射样品上gydF4y2Ba
RNA提取是按照稍微修改过的PicoPure试剂盒协议(Arcturus Engineering)进行的,如其他工作所述[gydF4y2Ba63.gydF4y2Ba].使用NanoDrop 1000分光光度计进行RNA定量。RT-PCR实验使用一步RT-PCR试剂盒(Qiagen),对多个样本提取的RNA进行RT-PCR实验。所进行的反应详列于[gydF4y2Ba14.gydF4y2Ba].用特异性引物进行扩增反应gydF4y2BaLjNIP1, LjXIP1gydF4y2Ba还有管家基因gydF4y2BaLjEF1agydF4y2Ba[gydF4y2Ba14.gydF4y2Ba];退火温度分别为65°C和60°C。RT-PCR实验在至少三种独立的生物学和技术复制上进行。使用一步QRT-PCR试剂盒(BiORAD)用于微小细胞上的QRT-PCR实验。根据手册的指示并使用上述相同的引物和退火温度,在两种生物学和两种技术复制上进行反应。在每个孔中,最终体积为20μl,由12,5μl2xsyber绿色,0.5μl底漆10μm(正向和反向),0.5μl逆转录酶和RNase游离水组成。gydF4y2Ba
烟草gydF4y2Ba叶表皮细胞转化及共聚焦分析gydF4y2Ba
引入CaMV启动子的35S启动子下c端GFP融合表达的pK7FWG2,0gydF4y2Ba农杆菌肿瘤术gydF4y2BaGV3101,gydF4y2Ba尼科尼亚塔哈瓦姆gydF4y2Ba然后根据Batoko和同事发表的协议对树叶进行农业渗透[gydF4y2Ba64.gydF4y2Ba].使用尼康PCM2000(BiORAD)激光扫描共焦成像系统进行共聚焦显微镜分析。GFP检测的激发为488nm,检测在515和530nm之间。叶绿素检测的激发为488nm,检测超过570nm。使用Corel Photo-Paint软件(Corel Corporation,Dallas,TX,USA)处理从共聚焦显微镜获取的图像。gydF4y2Ba
菌根菌根的亚细胞定位gydF4y2Ba
的gydF4y2BaLjNIP1gydF4y2Ba使用以下引物从cDNA中扩增编码区域:gydF4y2BaLjNIPgydF4y2Ba-attB-forward /反向。将扩增片段插入pDONR221 (Invitrogen)中,然后使用Gateway系统(Invitrogen)重组,在二元载体pK7WGF2中进行亚细胞定位[gydF4y2Ba65.gydF4y2Ba].红色荧光标记DsRED在构成物的控制下插入gydF4y2Ba拟南芥gydF4y2BaUbiquitin10启动子(PgydF4y2BaUbq10gydF4y2Ba)[gydF4y2Ba66.gydF4y2Ba].一个gydF4y2BaLjNIPgydF4y2Ba利用引物p . pcr从基因组DNA中扩增出1200 bp的启动子片段gydF4y2BaLjNIPgydF4y2Ba- 附庸/反向包含SACI和SPEI位点。启动子片段用于替代包含的PK7WGF2,0中的CAMV 35s启动子gydF4y2BaLjNIP1gydF4y2Ba编码区。gydF4y2Ba
的gydF4y2BapLjNIP1gydF4y2Ba-gydF4y2BaeGFPgydF4y2Ba-gydF4y2BaLjNIP1gydF4y2Ba构造用于稳定变换gydF4y2BaL. japonicus.gydF4y2Ba根通过gydF4y2Ba农杆菌属rhizogenesgydF4y2Ba.根段显示DsRED荧光,定植于gydF4y2Ba胃肠道。玛格丽塔gydF4y2Ba,被切除并包含在8%的琼脂糖中。将所得琼脂糖块切成薄片(200μm),使用vibraatome将切片置于载玻片上。使用具有长距离40倍水浸物镜(HCX APO 0.80)的Leica TCS-SP2共聚焦显微镜观察每个部分(HCX APO 0.80)。用蓝色氩离子激光(488nm)激发GFP,并在500至545nm之间收集发射的荧光。DSRED在488纳米剧中兴奋,并在600-700纳米上成像。在这些成像条件下,GFP发射窗口部分地捕获塌陷的菌丝的绿色自体荧光。从最少10个独立变换的根线收集数据。gydF4y2Ba
参考文献gydF4y2Ba
- 1。gydF4y2Ba
Bonfante P,ANCA I-A:植物,菌根真菌和细菌:互动网络。Annu Rev Microbiol。2009,63:363-383。gydF4y2Ba
- 2。gydF4y2Ba
陈志强,王志强,王志强。植物内生真菌与微生物群落的关系。植物病理学杂志。2011,49:291-315。gydF4y2Ba
- 3.gydF4y2Ba
Berendsen RL, Kalkhove SIC, Lugones LG, Wösten HAB, Bakker PAHM:双孢蘑菇菌球中Lecanicillium fungicola的萌发。环境微生物学报,2012,4:227-233。gydF4y2Ba
- 4.gydF4y2Ba
丛枝菌根真菌在植物营养和生长中的作用。真菌病。2012,104:1-13。gydF4y2Ba
- 5。gydF4y2Ba
Maillet F, Poinsot V, Andre O, Puech-Pages V, Haouy A, Gueunier M, Cromer L, Giraudet D, Formey D, Niebel A, Martinez EA, Driguez H, Becard G, Denarie J:丛枝菌根真菌脂壳寡糖共生信号。自然科学。2011,469:58-63。gydF4y2Ba
- 6。gydF4y2Ba
在黑暗中测定日期:根如何响应真菌信号建立丛枝菌根共生。植物营养与肥料学报。2011,14(4):451-457。gydF4y2Ba
- 7。gydF4y2Ba
Alexander T,Toth R,Meier R,Weber HC:参考草丛中的碎褐色骨折菌根,洋葱,豆类和番茄中仲裁开发和退化的动态。可以j bot。1989,67:2505-2513。gydF4y2Ba
- 8。gydF4y2Ba
Tenre A,Ivanov S,Fendrych M,Faccio A,žžrskýv,Bisseling T,Bonfante P:多种外毒性标记在丛枝菌疹中积聚在Perifngal膜生物的位点。植物细胞生理。2012,53:244-255。gydF4y2Ba
- 9。gydF4y2Ba
Pumplin N,Zhang X,Noar Rd,Harrison MJ:由分泌分泌的瞬时重新定位介导的分泌分泌物特异性磷酸盐转运蛋白的极性定位。《美国国家科学院学报》上。2012,109:E665-E672。gydF4y2Ba
- 10。gydF4y2Ba
HOHNJEC N,Vieweg MF,PühlerA,Becker A,Küsterh:用两种不同的Glomus真菌接种的Medicago Truncatula Roots的转录概况重叠,提供了在丛枝菌根期间激活的遗传程序中的见解。植物理性。2005,137:1283-1301。gydF4y2Ba
- 11.gydF4y2Ba
Güimil S, Chang H-S, Zhu T, Sesma A, Osbourn A, Roux C, Ioannidis V, Oakeley EJ, Docquier M, Descombes P, Briggs SP, Paszkowski U:水稻对微生物定植反应的古老模式。《美国国家科学院学报》上。2005年,102:8066 - 8070。gydF4y2Ba
- 12.gydF4y2Ba
Liu J, Maldonado-Mendoza I, Lopez-Meyer M,张F, Town CD, Harrison MJ:丛枝菌根共生伴随着局部和系统的基因表达改变和抗病性的提高。植物学报,2007,50:529-544。gydF4y2Ba
- 13。gydF4y2Ba
Fiorilli V,Catoni M,Miozzi L,Novero M,Accotto GP,Lanfranco L:由丛林菌根真菌的番茄植物中的全局和细胞型基因表达谱。新植物。2009,184:975-987。gydF4y2Ba
- 14。gydF4y2Ba
王志强,王志强,王志强,等:丛枝菌根共生过程中调控网络、转运、细胞壁和膜生物发生的全基因组重编码。新植物学报,2009,32(2):457 - 462。gydF4y2Ba
- 15.gydF4y2Ba
Hogekamp C, Arndt D, Pereira P, Becker JD, Hohnjec N, Küster植物营养与肥料学报,2011,29(4):429 - 434。gydF4y2Ba
- 16。gydF4y2Ba
Gaude N,Bortfeld S,Duensing N,Lohse M,Krajinski F:粘菌根的仲裁和非殖民化皮质细胞经历广泛而特异性的重新编程,在丛枝腐败的发育中。工厂J. 2012,69:510-528。gydF4y2Ba
- 17。gydF4y2Ba
Sanchez L, Weidmann S, Brechenmacher L, Batoux M, Van Tuinen D, Lemanceau P, Gianinazzi S, Gianinazzi- pearson V:在荧光假单胞菌定殖、菌根发育和结瘤反应中截形苜蓿根的常见基因表达。新植绿醇。2004,2004:855-863。gydF4y2Ba
- 18。gydF4y2Ba
Küsterh,何Hohnjec N,Krajinski F,El Yahyaoui F,Manthey K,Gouzy J,Dondrup M,Meyer F,Kalinowski J,Brechenmacher L,Van Tuinen D,Gianinazzi-Pearson V,PühlerA,Gamas P,Becker A:施工并验证CDNA的MT6K-RIT宏观和微阵列,以探索模型Medicago Truncatula的根内核糖。j biotechnol。2004,108:95-113。gydF4y2Ba
- 19。gydF4y2Ba
Gutjahr C,Banba M,Croset V,AN K,Miyao A,G,Hirochika H,Imaizumi-Anrakuh H,Paszkowski U:丛生菌疹的特异性信号在水稻中超越共同的共生信号传导路径。植物细胞。2008,20:2989-3005。gydF4y2Ba
- 20.gydF4y2Ba
水通道蛋白水通道与人类疾病的分子机制。FEBS Lett. 2003, 555: 72-78。gydF4y2Ba
- 21.gydF4y2Ba
植物中的水通道蛋白。Acta physica sinica . 2006, 32(6): 643 - 648。gydF4y2Ba
- 22.gydF4y2Ba
Forrest KL,Bhave M:植物主要内在蛋白质(MIPS):一种复杂的基因家族,具有对植物表型的主要影响。Funct综合基因组学。2007,7:263-289。gydF4y2Ba
- 23.gydF4y2Ba
植物水通道蛋白:具有多种综合功能的膜通道。植物学报,2008,59:595-624。gydF4y2Ba
- 24.gydF4y2Ba
Gupta AB, Verma RK, Agarwal V, Vajpai M, Bansal V, Sankararamakrishnan R: MIPModDB:主要固有蛋白超家族的中心资源。核酸学报。2012,40(4):362- 369。gydF4y2Ba
- 25.gydF4y2Ba
植物水通道蛋白活性的调节。中国生物医学工程学报。gydF4y2Ba
- 26。gydF4y2Ba
MA JF,Yamaji N:植物中硅的功能和运输。细胞mol寿命。2008,65:3049-3057。gydF4y2Ba
- 27。gydF4y2Ba
刘q,王h,张z,吴j,冯y,zhu z:植物中Nod26样内蛋白的功能和表达的发散。BMC基因组学。2009,10:313。gydF4y2Ba
- 28。gydF4y2Ba
在藓类小Physcomitrella patens中,水通道蛋白基因家族的意外复杂性。BMC Plant Biol. 2008, 8: 45。gydF4y2Ba
- 29。gydF4y2Ba
Gomes D, Agasse A, Thiébaud P, Delrot S, Gerós H, Chaumont F:水通道蛋白是生物体内高度分化的多功能水和溶质转运蛋白。Acta photonica sinica, 2009, 40(4): 453 - 457。gydF4y2Ba
- 30。gydF4y2Ba
Kruse e,uehlein n,kaldenhoff r:水素。基因组Biol。2006,7:206。gydF4y2Ba
- 31。gydF4y2Ba
刘志强,李志强。2010,中国农业大学学报(自然科学版)。17gydF4y2Ba
- 32。gydF4y2Ba
BárzanaG,Aroca R,Paz Ja,Chaumont F,Martinez-Ballesta MC,Carvajal M,Ruiz-lozano JM:丛生菌根共生在含水量和干旱胁迫条件下的宿主植物根系中的相对吻合水流量增加。Ann Bot。2012,109:1009-1017。gydF4y2Ba
- 33。gydF4y2Ba
uehlein n,fileschi k,Eckert M,Bienert GP,Bertl A,Kaldenhoff R:丛枝菌根共生和植物水上蛋白表达。植物化学。2007,68:122-129。gydF4y2Ba
- 34。gydF4y2Ba
Bienert GP, Bienert MD, Jahn TP, Boutry M, Chaumont F:茄科XIPs是质膜水通道蛋白,促进许多不带电荷底物的运输。植物学报,2011,66:306-317。gydF4y2Ba
- 35。gydF4y2Ba
Javot H, Penmetsa RV, Terzaghi N, Cook DR, Harrison MJ:截茎苜蓿磷酸盐转运体对丛枝菌根共生不可缺少。美国国家科学院学报。2007年,104:1720 - 1725。gydF4y2Ba
- 36。gydF4y2Ba
Neuhäuserb,Dynowski M,Mayer M,Ludewig U:通过羧基尾部的AMT单体之间的必要交叉谈论NH4 +运输。植物理性。2007,143:1651-1659。gydF4y2Ba
- 37。gydF4y2Ba
植物水通道蛋白选择性:运输分析、计算机模拟和生理学的结合。中国生物医学工程学报。2009,31(4):491 - 497。gydF4y2Ba
- 38。gydF4y2Ba
泡状-丛枝菌根真菌的丛枝菌根真菌栖息在植物根的酸性隔间里。植物学报。2000,211:299-304。gydF4y2Ba
- 39。gydF4y2Ba
Liu L-H,Ludewig U,Gassert B,Frommer WB,VonWirénn:通过氮气调节的溶胶蛋白质在拟南芥内蛋白质的尿素运输。植物理性。2003,133:1220-1228。gydF4y2Ba
- 40。gydF4y2Ba
Otto B,Uehlein N,SDorra S,Fischer M,Ayaz M,Belastegui-Macadam X,Heckwolf M,Lachnit M,Pede N,Priem N,Reinhard A,Siegfart S,Urban M,Kaldenhoff R:Aquaporin Tellame Conteform改变功能烟草水疗法。J Biol Chem。2010,285:31253-31260。gydF4y2Ba
- 41.gydF4y2Ba
菌根共生植物与真菌相互作用的机制。国家自然科学基金,2010,1:48。gydF4y2Ba
- 42.gydF4y2Ba
nodulin -26,一种类周菌膜结节蛋白独立于类周菌室的发育而表达。acta physica sinica, 2017, 36(5): 593 - 598。gydF4y2Ba
- 43.gydF4y2Ba
刘Q,Zhu Z:NIP III亚组蛋白的功能分歧涉及改变的选择性约束和阳性选择。BMC植物BIOL。2010,10:256。gydF4y2Ba
- 44.gydF4y2Ba
Lopez D,Bronner G,Brunel N,Auguin D,Bourgerie S,Brignolas F,Carpin S,陀螺仪 - Roux C,Maurel C,Fumanal B,Martin F,Sakr S,标签P,Julien JL,Goussets-Dupont A,voupsseJS:进入杨树XIP水蛋白的见解:进化膨胀,蛋白质功能和环境监管。J Exp Bot。2012,63:2217-2230。gydF4y2Ba
- 45.gydF4y2Ba
王志强,王志强,王志强,等。双色蜡蘑水通道蛋白基因的克隆及功能研究。植物营养学报,2011,30(4):427 - 434。gydF4y2Ba
- 46.gydF4y2Ba
黄志刚,王志刚:荷花结瘤中水通道蛋白的选择性和多功能。植物营养学报。2000,21(4):441 - 448。gydF4y2Ba
- 47.gydF4y2Ba
Harrison MJ,Dewbre Gr,Liu J:来自Medicago Truncatula的磷酸盐转运蛋白,参与通过丛枝菌根真菌释放的磷酸盐。在线植物细胞。2002,14:2413-2429。gydF4y2Ba
- 48.gydF4y2Ba
王志强,王志强,王志强,等。水稻丛枝菌根中荧光磷酸盐转运体对丛枝膜动力学的影响。植物营养与肥料学报。2010,31(4):441 - 446。gydF4y2Ba
- 49.gydF4y2Ba
活细胞成像揭示了在丛枝菌根共生过程中截茎苜蓿根周围的膜域和细胞器位置。植物营养与肥料学报。2009,31(4):489 - 494。gydF4y2Ba
- 50.gydF4y2Ba
菌根中植物与真菌的相互作用。《生命科学百科全书》,2010,英国:John Wiley & Sons, Ltd。gydF4y2Ba
- 51.gydF4y2Ba
Mizutani M, Watanabe S, Nakagawa T, Maeshima M:在拟南芥中,水通道蛋白NIP2;1主要定位于ER膜,表现为根特异性积累。植物营养与肥料学报。2006,27(4):457 - 461。gydF4y2Ba
- 52.gydF4y2Ba
Kobae Y,Tamura Y,Takai S,Banba M,Hata S:在大豆中丛生菌根诱导氨铁转运蛋白的局部表达。植物细胞生理。2010年,51:1411-1415。gydF4y2Ba
- 53。gydF4y2Ba
Bonfante P, Perotto S: Tansley Review第82期。新植绿醇,1995,130:3-21。gydF4y2Ba
- 54。gydF4y2Ba
Gianinazzi-Pearson V:植物细胞对丛枝菌根真菌的反应:到达共生的根。acta botanica sinica(云南植物学报). 1996,8:1871-1883。gydF4y2Ba
- 55。gydF4y2Ba
哈里森·MJ:丛枝菌根共生的分子和细胞方面。植物营养与肥料学报,1999,30(5):591 - 598。gydF4y2Ba
- 56。gydF4y2Ba
林志强,王志强,王志强:植物外生菌根与水分关系的研究进展。微生物学进展。2011,21:71-90。gydF4y2Ba
- 57。gydF4y2Ba
蛇豆中血红蛋白合成的控制。中国生物化学学报,2011,32(4):457 - 461。gydF4y2Ba
- 58。gydF4y2Ba
引用本文:王志强,王志强,王志强,等。丛枝菌根真菌释放氮素的研究进展。植物营养与肥料学报。2009,30(4):457 - 461。gydF4y2Ba
- 59。gydF4y2Ba
李志强,李志强,李志强,等。菌根诱导植物氨基酸转运载体ljlht1.2的研究进展。土壤学报,2011,32(4):457 - 461。gydF4y2Ba
- 60.gydF4y2Ba
Marini Am,Soussi-Boudekou S,Vissers S,Andre B:酿酒酵母酿酒酵母的一家铵转运蛋白。Mol细胞Biol。1997,17:4282-4293。gydF4y2Ba
- 61。gydF4y2Ba
关键词:水通道蛋白TIP2;2; nh3 -孔;FEBS Lett. 2007, 581: 5413-5417。gydF4y2Ba
- 62。gydF4y2Ba
Bertl A,Slayman Cl,Gradmann D:从酿酒酵母的血浆膜的向外整流k +通道中的门控和电导。J Membr Biol。1993,132:183-199。gydF4y2Ba
- 63。gydF4y2Ba
Balestrini R, Gómez-Ariza J, Lanfranco L, Bonfante P:激光显微解剖揭示了五种植物和一种真菌磷酸盐转运基因的转录本同时存在于树枝状细胞中。植物营养与肥料学报,2007,20(4):489 - 494。gydF4y2Ba
- 64。gydF4y2Ba
Yoo S-D,Cho Y-H,Sheen J:Arabidopsis Mesophyll Protoplss:一种用于瞬态基因表达分析的通用细胞系统。NAT协议。2007,2:1565-1572。gydF4y2Ba
- 65.gydF4y2Ba
Karimi M,InzéD,Depicker A:农杆菌介导的植物转化的网关载体。趋势植物SCI。2002,7:193-195。gydF4y2Ba
- 66.gydF4y2Ba
Limpens E, Mirabella R, Fedorova E, Franken C, Franssen H, Bisseling T, Geurts R:豆科植物根瘤中类似细胞器固定n2的共生体的形成受DMI2控制。美国国家科学院学报。2005年,102:10375 - 10380。gydF4y2Ba
致谢gydF4y2Ba
作者谨此感谢Andrea Perre为他的专家帮助与共聚焦显微镜,到Valentina Fiorilli,用于在Microrodsed Cells上分享QRT-PCR设置,以获得Marco Incarbone,以便他对稿件的批判性阅读和迈克拉Locati进行绘画丛丛的细胞。区域项目Cipe2007提供财政支持,融合技术 - 生物组织。博士学位给MG的奖学金由Torino / Compagnia di San Paolo大学资助。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
通讯作者gydF4y2Ba
附加信息gydF4y2Ba
相互竞争的利益gydF4y2Ba
提交人声明他们没有竞争利益。gydF4y2Ba
作者的贡献gydF4y2Ba
MAG进行了实验并起草了稿件。RB有助于LMD实验。VV帮助质粒结构,gydF4y2Ba莲花gydF4y2Ba转换和时间过程分析。MiG参与了工作的设计,并进行了第一次qRT-PCR。DS和UL进行了功能互补分析和停止流动实验。AC对烟草叶片细胞进行转化。PB协调项目,撰写稿件。所有作者阅读并批准了最终的手稿。gydF4y2Ba
电子补充材料gydF4y2Ba
12870 _2012_1167_moesm1_esm.pdfgydF4y2Ba
附加文件1:LJNIP1和LJXIP1的氨基兴奋序列对齐。LJNIP1和LJXIP1的序列对准与爆炸的最近蛋白质的序列对齐。使用Clustalw软件进行比较氨基酸序列。两个'NPA图案'浅灰色。形成选择性过滤器的四个残基(R1-R4)以深灰色阴影。(PDF 119 KB)gydF4y2Ba
12870 _2012_1167_moesm2_esm.pdfgydF4y2Ba
附加文件2:LJNIP1和LJXIP1中的跨膜螺旋预测。TMRPRES2D WEB工具(http://bioinformatics.biol.uoa.gr/tmrpres2d/)允许我们确认推定的6个跨膜域,这是水上素类的典型。(PDF 290 KB)gydF4y2Ba
作者的原始提交的图像文件gydF4y2Ba
权利和权限gydF4y2Ba
开放访问gydF4y2Ba本文在“生物资源”中央有限公司的许可下公布了这是一个开放式访问条款,分配根据创意公约归因许可证的条款(gydF4y2Bahttps://creativecommons.org/licenses/by/2.0gydF4y2Ba),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
Giovannetti,M.,Balestrini,R.,Volpe,V。gydF4y2Baet al。gydF4y2Ba在丛枝菌根共生期间,两个推定的水疗法基因差异表达gydF4y2BaLotus对虾gydF4y2Ba.gydF4y2BaBMC植物BIOL.gydF4y2Ba12,gydF4y2Ba186(2012)。https://doi.org/10.1186/1471-2229-12-186gydF4y2Ba
已收到gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
迪伊gydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/1471-2229-12-186gydF4y2Ba
关键字gydF4y2Ba
- Arbusculated细胞gydF4y2Ba
- 豆类gydF4y2Ba
- 水素蛋白gydF4y2Ba
- 共生gydF4y2Ba
- XIPgydF4y2Ba
- 掐gydF4y2Ba
- 菌根真菌gydF4y2Ba
- Lotus对虾gydF4y2Ba