抽象的
背景
氮是植物生长发育的主要限制性养分。在可能限制NO的因素中3.-在还原同化过程中,铁作为酶的金属辅助因子可能发挥重要作用。关于策略I植物缺铁情况下氮代谢的变化,目前所知甚少。这项工作的目的是研究黄瓜(Cucumis sativusL.)植物在铁缺乏率下生长时改变它们的氮代谢。
结果
研究了缺铁黄瓜根和叶片中参与硝酸盐还原同化和铵态氮同化底物生成的酶的活性。缺铁条件下,根和叶水平上只有硝酸还原酶(EC 1.7.1.1)活性降低,而谷氨酰胺合成酶(EC 6.3.1.2)和谷氨酸合成酶(EC 1.4.1.14)活性升高。因此,除根硝酸还原酶增加外,其他酶的转录分析均表现出相同的行为。缺铁根中氨基酸含量显著降低,而缺铁叶中氨基酸含量显著升高。缺铁植物木质部液中氨基酸含量增加。
结论
本研究的数据为植物对缺铁的响应提供了新的见解,表明这种营养失调不同程度地影响了根和叶的氮代谢。事实上,在缺铁的情况下,根的反应更有效,通过提供代谢物(如铁)来维持整个植物。AA.(如有机酸)。
背景
氮(N)是植物中最重要的无机营养物质之一,是蛋白质、核苷酸、叶绿素和许多其他代谢物和细胞成分的主要成分[1].此外,硝酸盐(没有3.-)是一种有氧土壤中最丰富的阴离子营养素,通过在根表皮和皮质细胞的血浆膜上从土壤溶液中占用土壤溶液,涉及诱导型高亲和力运输系统[2那3.].氮通常是植物生长和发育的限制因素。在理解确定N利用效率的机制和识别改进目标方面,有敏锐的兴趣和相当大的农艺效益。
在限制NO的因素中3.-铁(Fe)作为还原同化途径的酶的金属辅助因子[硝酸还原酶(NR)、亚硝酸盐还原酶(NiR)和谷氨酸合酶(GOGAT)]起着至关重要的作用,这些酶都需要铁作为铁血红素基团或铁- s簇][1].已经表明,Fe缺陷在根部水平上诱导各种反应,从而增加了根际中离子的可用性。策略I植物(双子叶族和非综素单胶质单像)能够通过增加响应土壤中的Fe短缺:(i)根组织的Fe降低能力[Fe3+- 水合还原酶(EC 1.16.1.7](FC-R),(ii)酸化是流离星溶解度的酸化[P型H.+-ATPase(EC 3.6.3.6)]和(III)脱胚层根细胞的摄取活性(铁调节转运蛋白1 [IRT1])[4.-6.].铁摄取机制由一个复杂的系统紧密调控,该系统涉及几个基本的螺旋-环-螺旋(bHLH)转录因子,其中FIT/FER (FER- like Iron缺铁诱导转录因子)和PYE (POPEYE)起着核心作用[7.在其中引用。
然而,关于缺铁情况下氮代谢变化的信息尚不完整[8.-11].来自微阵列数据,一些信息可用于FE缺乏依赖性与N新陈代谢相关的基因表达拟南芥[12-14].Fe缺乏对NO的影响3.-上涨已记录。事实上,没有减少3.-在缺铁的黄瓜植株中观察到吸收[15].Wang等[16]发现缺铁条件下,番茄根系诱导了硝酸盐转运体LeNRT1.2的表达,而不是LeNRT2.1的表达。可能都没有3.-同化和铁的获取可以竞争减少等价物;因此,NO有一个局限性3.-吸收有利于铁的还原吸收机制[17或者,或者,自从没有3.-还原是通过含铁酶(NR和NiR)进行的,缺铁可改变胞质NO3.-浓度导致其吸收机制的限制。
在代谢水平上,缺铁引起几个主要与碳(C)代谢有关的变化[18-20.].C和N代谢强烈相互关联。许多研究表明,细胞监测C和N代谢物,并协同作用以协调基因表达,从而确定适合营养和代谢状态的转录物谱[21-23].C/N相互作用发生在能源使用和生产的背景下,涉及不同亚细胞室之间的合作[24-30.].没有3.-同化需要向NR和NiR同时提供还原剂。然而,植物中NR活性是否直接受到NADH水平的限制仍是一个悬而未决的问题[31.].Kaiser等人[32.那33.研究表明,在菠菜叶片中,较低的光合活性可能通过降低还原剂的可用性以及通过翻译后失活而限制NR活性。没有3.-减少和线粒体电子传输可以在某些条件下彼此进行竞争。除了没有3.-C/N相互作用中可能受氧化还原调节的第二个过程是有机酸的形成。有机化合物如2-氧戊二酸酯(2-OG)在氨基酸生物合成中作为氨基基团的碳骨架受体,其生产需要通过呼吸途径氧化[25那34.-36.].近年来,我们对线粒体代谢在氨同化碳骨架生产中的重要性的理解有了相当大的进展[37.].由于氨基酸的合成涉及硝酸盐的还原和碳的氧化,氧化还原状态可能是两个过程结合的一个重要因素。在缺铁情况下,线粒体呼吸链受损[38.[C / N新陈代谢经历强烈的修改。本文的目的是在Fe缺乏下提供对N新陈代谢的新见解。本研究中收集的数据显示,Fe缺陷对根部和叶片中的N代谢具有差异影响,特别是在整个植物水平上作用的这种营养约束的特殊适应机制。
结果
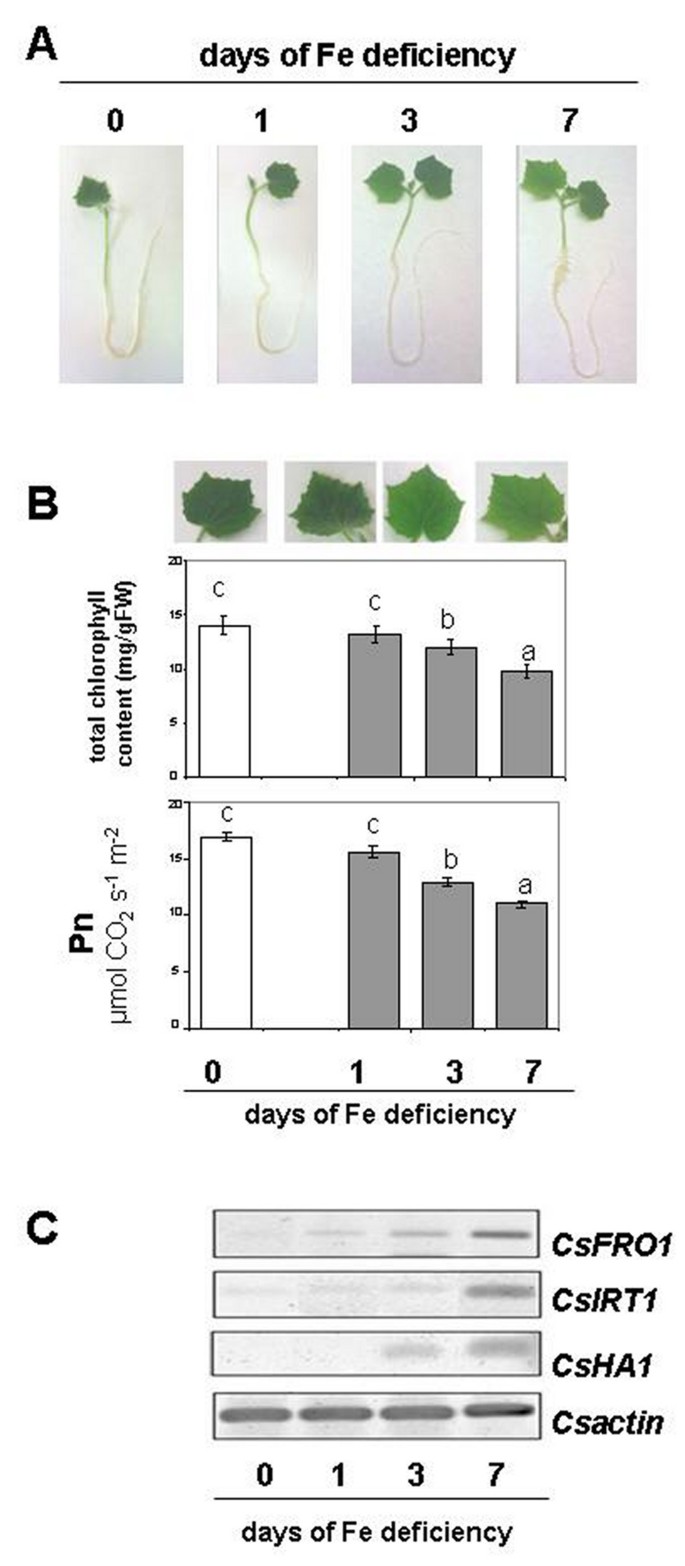
在这项工作中,在根和叶水平上研究了响应Fe缺乏的N代谢的变化。我们已经重新检查了在Fe,在此期间在Fe,在此期间在此期间生长的黄瓜植物中的Fe饥饿的反应,并且在此期间被剥夺了微量营养素。数字1显示了在这些条件下生长的植物之间的差异(图1)、叶绿素浓度、净光合速率(Pn)和策略I基因的表达。在这些条件下,在饥饿3 d后,叶片已经表现出明显的褪绿症状,叶绿素含量和Pn含量都随之下降(图)1 b).为了保证Fe缺陷的工厂在与Fe缺乏病症方面发出明显的反应,在根级进行了对策略I基因表达的初步时间课程实验(图1 c).的表达CsFRO1那CSHA1和CsIRT1与文献中报道的数据一致[39.那40].
缺铁对NR活性及基因表达的影响
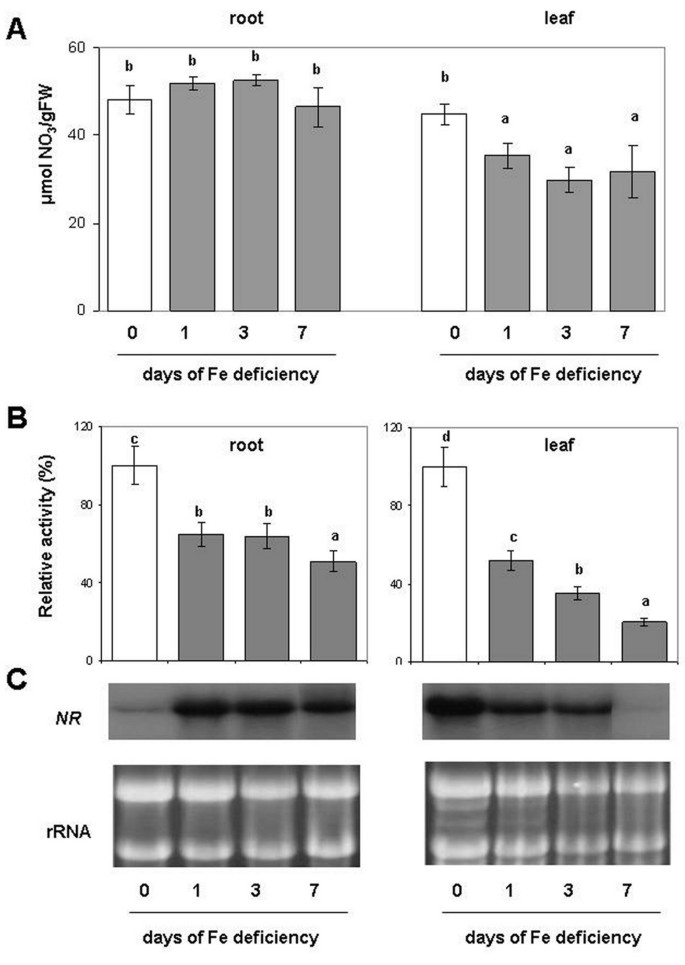
数字2A显示NO的浓度3.-无论是根还是叶。在缺铁诱导后的所有天数内,根的含量没有显著差异,而叶片的含量则下降了(- 35%)。NR活性,是NO中的第一个酶3.-在缺铁胁迫下(-Fe胁迫第1、3、7 d),根和叶水平均显著降低。然而,在缺铁叶片中,NR活性在7 d后比根系下降到−80%更明显,这表明缺铁对叶片NR活性的影响大于对根系(图)2B.和额外的文件1).相反,在缺铁的情况下,NR转录本在根系中增加,而在叶片中表达量明显下降(图)2C).在Fe去除后,转录水平的这些变化已经明显1 d。
(a)硝酸盐浓度,(b)酶活性和(c)NR北印迹分析。在Fe缺乏治疗进展过程中,对植物的根和叶片进行测定和北印迹。在提取铁后0、1、3、7天取样。与Fe足够植物(柱0d)表示,该活性表达为Fe缺陷样本(柱1,3,7d)的相对活性的百分比(%)。对照的活性(0 d)为5.6和9.8 nmol nadh mg-1防敏-1分别用于根和叶(完整活动数据在附加文件中报告1).数据为平均值±SE (n = 4)。在有显著差异(P<0.05)的情况下,不同字母的值有统计学差异。
缺铁对ICDH活性及基因表达的影响
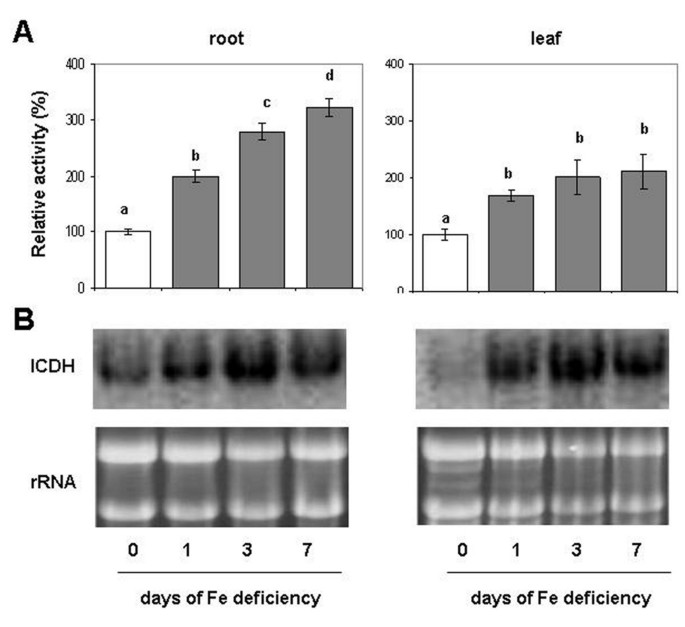
数字3A显示缺铁植物根和叶中ICDH(胞质亚型)活性的时间进程。数字3A(附加文件1)表明,在根和叶片中的Fe缺乏治疗期间ICDH活性增加。特别是,在7天的Fe饥饿后,其增加在根中较大,达到2倍,而在叶片中,这种增加约为100%。Northern印迹分析显示出一种过度表达ICDH.在Fe缺乏的进展过程中,在根和叶中的转录物。特别地,在叶片的一天之后ICDH的表达比根在根中,而在3和7 D中,两种组织中的增加的带强度相似(图3B.).
Fe缺乏的GS / Gogat循环
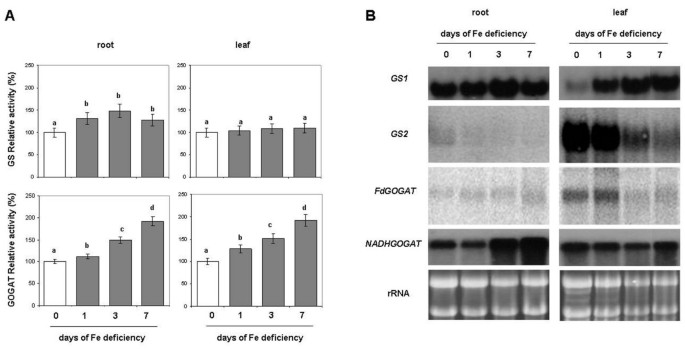
一……就……3.-由NR和NIR减少,NH4.+通过GS/GOGAT循环遵循N同化途径。数字4A和额外的文件1(上图)显示缺铁对GS活性的影响。在缺铁条件下,根系的这一活性增加了30%左右,而在叶片水平上没有显著差异。分别在胞质(GS1)和质体(GS2)上进行基因表达分析。如图所示4B.(上图),GS1在根中表达较多,而GS2在叶中优先表达。与酶活性增加一致的是,在缺铁的情况下,GS1转录本在根水平上过度表达(特别是在第3天之后),在第1、3和7天在叶片中过度表达(图)4B.).GS2转录产物在根中几乎未被检测到,而在叶中则随时间的延长而减少(图)4B.).
(A)酶活性和(B) GS和GOGAT的Northern Blot分析。在Fe缺乏治疗进展过程中,对植物的根和叶片进行测定和北印迹。在提取铁后0、1、3、7天取样。酶和酶活性测量单位的含义如图所示2.GS的对照(0d)活性为259和520 nmol nadh mg-1防敏-1,分别为根和叶。GS1,根同种型;GS2,叶子同种型。GOGAT的对照活性分别为140和112 nmol NADH mg-1防敏-1,分别为根和叶。Fd-GOGAT, ferredoxin-dependent同种型;NADH-GOGAT, nadh依赖的亚型(完整的活性数据在附加文件中报告1).数据为平均值±SE (n = 4)。在有显著差异(P<0.05)的情况下,不同字母的值有统计学差异。
在缺铁期间,根和叶的GOGAT活性均升高,在第7天达到最大值(+90%)(图)4A和额外的文件1较低的面板)。对fd依赖和NAD(P) h依赖的GOGAT亚型进行Northern blot分析。Fd-GOGAT在叶片中表达量最多,而NADH-GOGAT在根和叶片中表达量相近。在根水平上,只有NAD(P)H-GOGAT转录本清晰地被检测到,在缺铁3 d后,其表达量已经增加,相应的,其活性也大幅增加。在叶片中均检测到两种亚型转录本,但NAD(P)H-GOGAT的表达无显著差异,而Fd-GOGAT的表达随时间的延长而减少。最后的观察结果与酶解法检测的GOGAT活性的增加形成对比(图)4B.、较低的面板)。然而,众所周知,酶活性和转录本丰度之间可能没有直接的相关性。
缺铁植物的氨基酸浓度
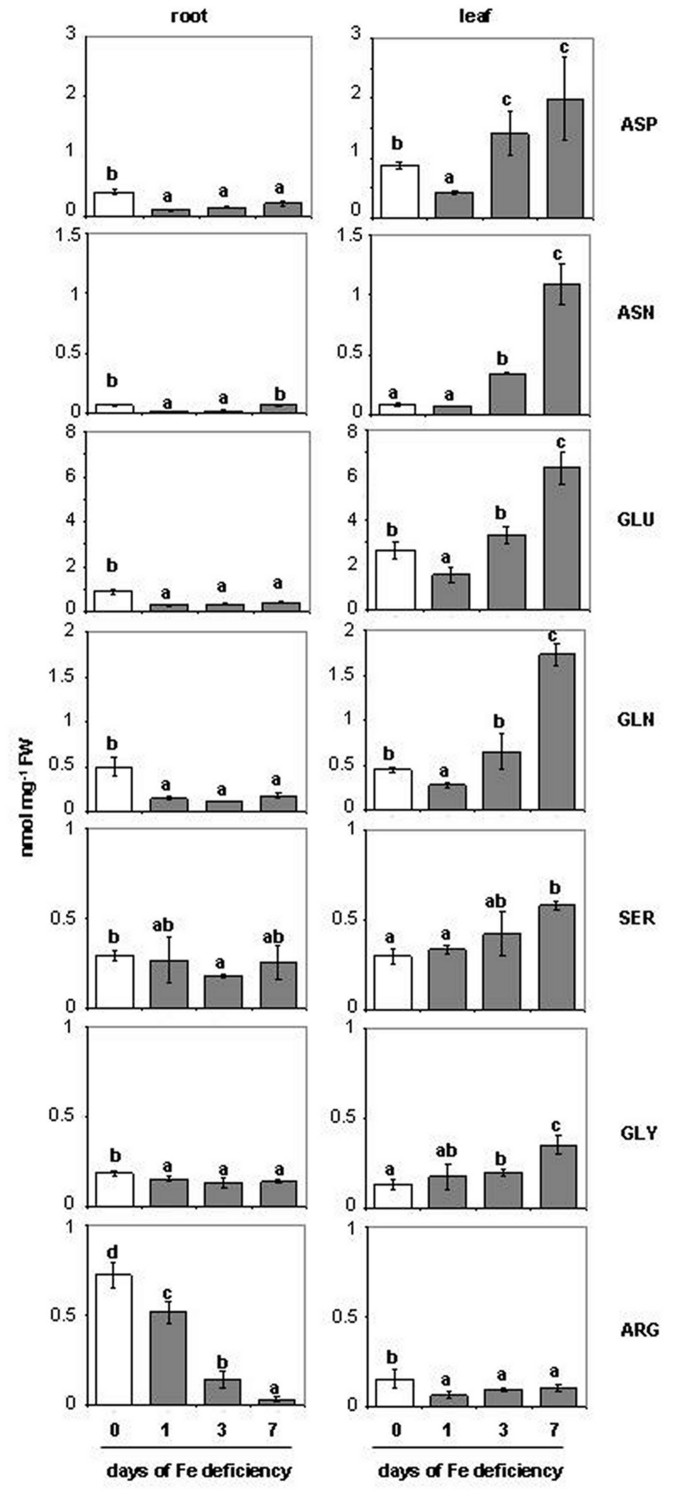
数字5.和额外的文件2报告氨基酸(AA.)在缺铁过程中,植物根和叶中铁含量的变化。的分析AA.选择与糖酵解和克雷布循环密切相关,如谷氨酸(Glu),谷氨酰胺(GlN),天冬氨酸(ASP),天冬酰胺(Asn),精氨酸(Arg),甘氨酸(Gly)和丝氨酸(Ser)。一般来说,可以注意到AA.随着缺铁进程的推进,缺铁根的浓度降低,而缺铁叶的浓度增加,除精氨酸外(见图)5.).
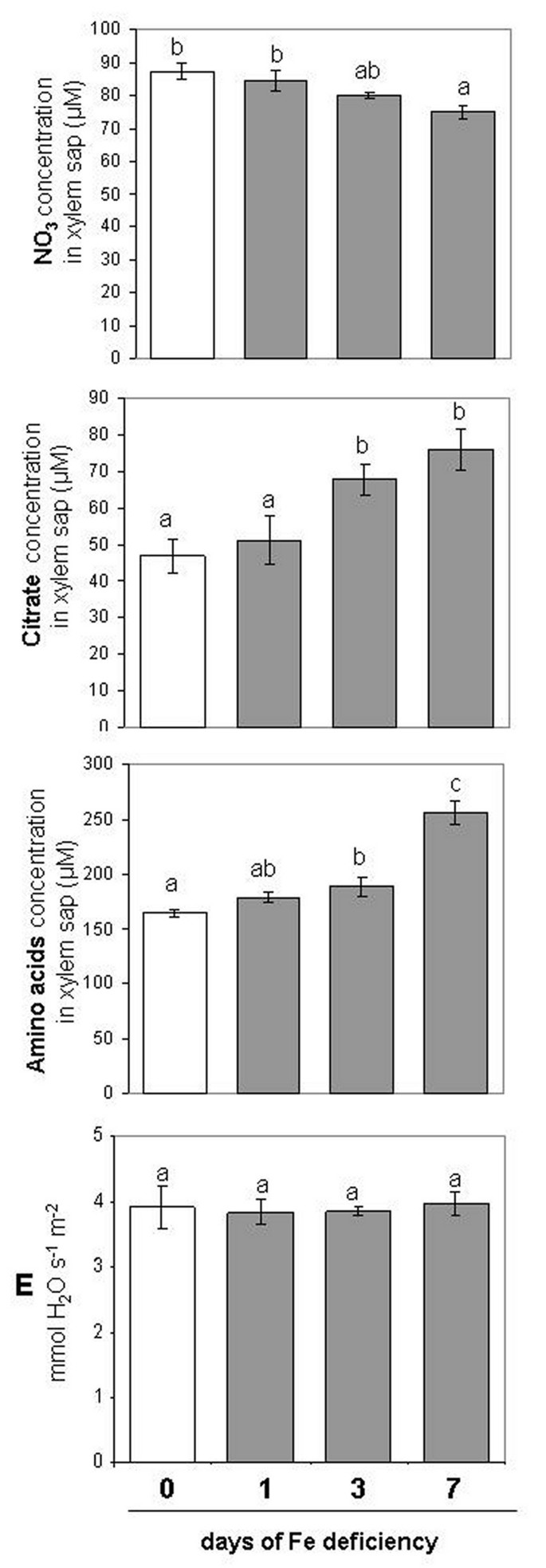
桌子1所有的报告AA.确定0 d和7 d之间的差异。特别地,ASP显示出Fe缺陷的根(-49%)减少,而在Fe缺陷叶(+ 125%)中增加。与对照相比,叶片浓度在叶子水平下不同于7天的叶片,而且与对照相比,含量约为13倍,虽然它没有显示出根部的任何差异(图5.).Glu和Gln的变化非常相似,但在缺铁组织中,与根和叶的Glu(分别为- 52%和+138%)相比,根的Gln减少更多(- 64%),叶的Gln增加更多(3倍)。同样,随着缺铁条件的进行,根中丝氨酸和甘氨酸的浓度降低,叶中丝氨酸和甘氨酸的浓度升高。然而,根中Ser含量仅在第3天显著下降(−38%),而根中甘氨酸含量在缺铁7天后下降约25%。同时,叶片Ser和Gly含量均增加(分别为+94%和+160%)。有趣的是,只有Arg在第7天在根(- 96%)和叶(- 35%)中的浓度显著下降。不同的AA.根和叶之间的浓度促使我们测量它们通过木质部的转运。如图所示6.总量的浓度AA.在Xylem SAP中,在Fe缺乏的根中增加,7D Fe缺乏后它达到了最大水平(+ 50%)。与此同时,在D 7(+ 50%)的木质SAP中也增加了柠檬酸盐浓度,确认了Abadía和同事所获得的数据[41.].相反,在d 7浓度的浓度3.-在木质中略微减少(-14%)。从木质SAP收集的数据被认为是硝酸盐,柠檬酸盐的量增加AA.,由于蒸腾(e)率在Fe缺乏的表达期间没有改变(图6.).
ALT和AST在FE缺陷下的活动
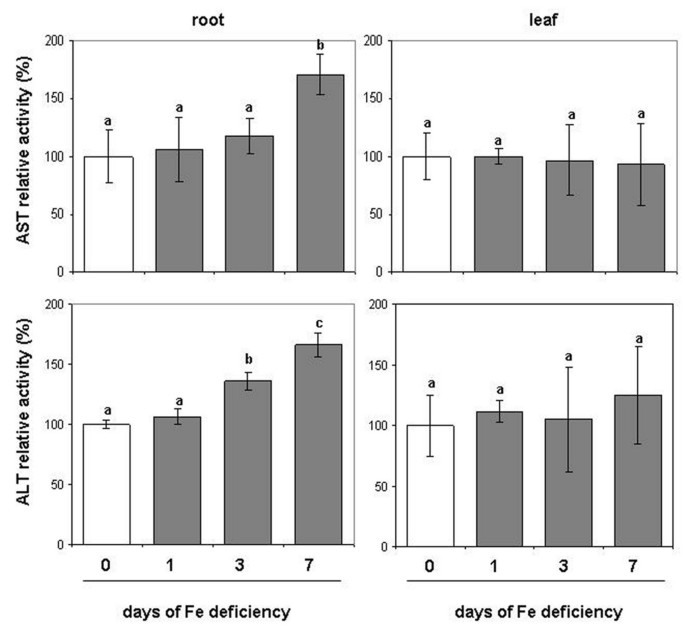
我们已经分析了两种酶的活性,这两种酶被认为与循环利用有关AA.即谷丙转氨酶(ALT)和天冬氨酸转氨酶(AST)。AST和ICDH也被认为是2-OG合成的主要候选化合物之一[35.].如图所示7.(附加文件1),在Fe缺乏的进展过程中,这两种酶的活性仅在根中增加,而叶子没有显着变化。
讨论
有良好的记录,Fe缺陷强烈影响植物C代谢改变所有代谢途径直接或间接相关的所有代谢途径[18那38.那42.].氮同化代表了与C代谢相关的最重要的途径之一,但其在Fe缺乏下调节的机制仍然是不公知的。在C和N代谢之间的连接点中,两个似乎很重要。首先是Pepc活动,第二个是ICDH活动。通过Pepc催化的掺入酮酸酸草酸酸(OAA)的包层反应对TCA循环中间体的补充更可能是必不可少的,这是用于生物合成目的的TCA循环中间体,从而实现净C骨架合成[25].细胞溶质ICDH使用异柠檬酸酯形成2-OG,与OAA一起被认为是N-同化的基本基材和AA.生物合成(37.].与此一致的是,我们之前已经证明,线粒体二三羧酸载体(DTC)在缺铁情况下增加,表明细胞质和线粒体之间的有机酸交换增加[38.].此外,与氧化戊糖磷酸途径活性一起,ICDH活性产生还原力(即NADPH),对在这种条件下发生的大多数代谢变化都有用。在这项工作中,胞质ICDH活性增加(图)3A)和ICDH转录本表达(图3B.)在缺铁根中观察到。此外,PEPC的活性、转录量和数量已经被证明在缺铁的黄瓜根中增加[43.那44.].此外,这些结果表明,OAA和2-OG的产量增加,从而增加了GS/GOGAT循环所需的底物,也增加了C骨架的产量AA.GS/GOGAT循环活性下游生物合成。
在这项工作中,我们确定了GS和Gogat的活性和基因表达在根和叶水平。根据Fe缺乏,GS活性在根中增加,同时它没有显示出叶子的任何重大差异(图4A).我们实验室对缺铁黄瓜根进行的蛋白质组学研究也支持GS1活性的增加[9.].因此,至少在缺铁3 d后,GS1活性的增加与其相对转录本的表达量的轻微增加相匹配(图)4A).有趣的是,在叶水平时,与对照(D 0)相比,特异性同种型GS2的表达降低,而根同种型GS1也在叶子水平上过度表达。对于叶子,可以假设GS2转录物的表达的降低可以部分通过GS1的表达的增加来补偿。如果表达的转录物的量完全考虑,则不会发现总表达模式的变化(图4B.).关于Gogat活性它在FE缺乏期间,在根系和叶中增加了(图4A).GOGAT活性的增加是由其相对转录本的过表达支持的,仅在根中,nadh依赖的亚型表达明显增加。在叶片中可以看到fd依赖亚型的表达减少(图)4B.),而nadh依赖亚型的表达没有变化。
如果缺铁一方面影响根和叶的GS/GOGAT循环,另一方面影响上游NO3.-在相同条件下,两种组织的还原(NR介导的)均减少(图)2).然而,NR活性在根中的影响小于叶子。值得注意的是,在叶片中的同时,NR活性和其相对转录物都强烈地减少,特别是在Fe缺乏诱导的7 d后。在根部发生相反的情况:活动减少了约50%,而转录物在Fe缺乏7 d后上调(图2B.和C)。有趣的是,随着缺铁处理的进行,根系中NR蛋白浓度的条带强度略有增加(补充文件)3.).这些结果表明,缺铁的根细胞在努力保持NO3.-铁的缺乏降低了NR活性的效率。这种反应似乎是有道理的:在调节NR基因表达的代谢因子中,NO3.-和AA.专注是非常重要的。没有3.-正调控NR的表达,相反,AA.对其表达负面调节[45.].叶片水平上NR表达量的显著下降可能与NO表达量的下降有关3.-浓度和增加AA.浓度。相反,在根层次上是正确的,在那里NO3.-浓度没有变化,而AA.大幅下降(见图)2A和5.).此外,根和叶之间的NR活性行为的差异也可以依赖于阿尔卡拉拉拉等人建议的福兰司蛋白(Fe-S蛋白)的可用性。[8.和铁的分异作用。事实上,叶绿体已经被证明含有叶子中总铁的80%以上[46.].这可能表明了细胞溶溶胶和叶绿体之间的Fe分配的一种层次,这将极大地惩罚细胞溶质Fe依赖性酶的活性(即NR),但不是诸如Gogat的基质中的活性。在Fe缺乏的条件下,这意味着(i)维持优先的光合电子传输链(含有几种Fe原子),(ii)减少使用还原剂的竞争,因此(iii)增加了能力修复和减少有限公司2在光合速率减少的情况下[47.),也在这项工作中观察到(图1 b).此外,低光合活性可能通过降低还原剂的可用性而限制NR活性[48.].减少硝酸盐的任务似乎应该维持在根中,根的NR活性比叶高,还原剂的产量也更高[19那49.那50.].
综上所述,缺铁根对NO的还原作用显著3.-降低,GS/GOGAT循环和氨同化增加AA.浓度很大程度上降低了。在缺铁叶片中,NO3.-降低幅度明显减小,GS/GOGAT周期略有增加AA.浓度强烈增加。
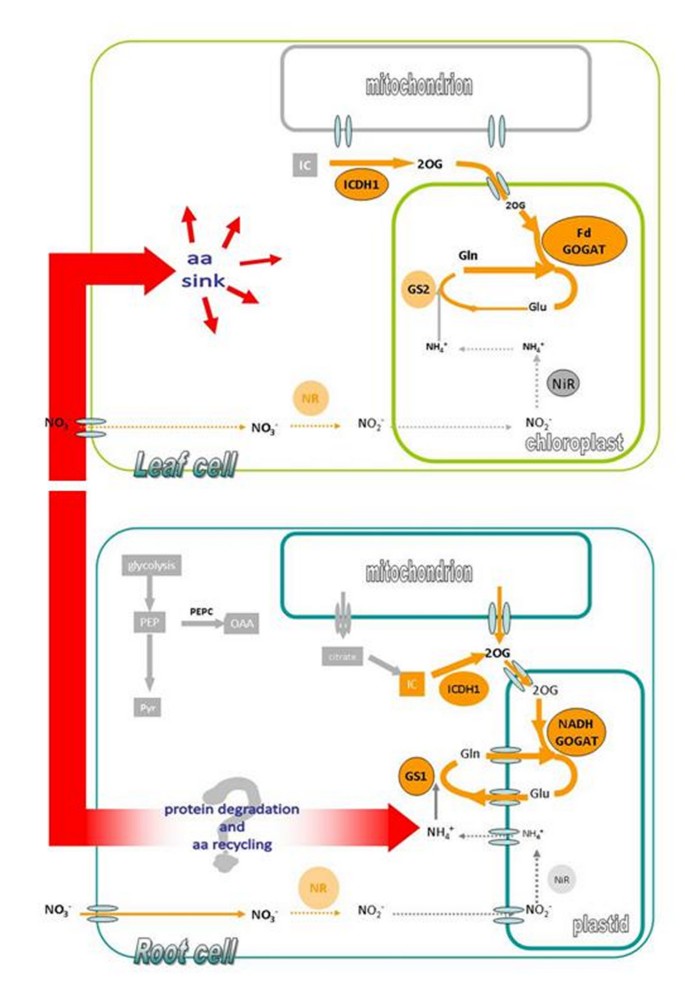
总体下降AA.在缺铁根中观察到的铁含量可能是由不同因素引起的:(i)主要利用AA.在蛋白质合成中,(ii)它们向叶片转运的增加和(iii)降解和/或循环AA..支持第一种假说的直接证据已经在缺铁的黄瓜根中找到[51.].关于第二个假设,总数增加AA.在Fe缺乏的进展期间观察到Xylem SAP中的浓度(这项工作,图6.).考虑到确定的蒸腾率(e)在这一进展期间没有改变(图6.和[52.),这就意味着AA.在缺铁条件下,木质部液中叶绿素含量随浓度的降低而增加AA.在根。关于最后一个假设,它仍然投机,只能通过间接证据支持。在这项工作中,发现两种酶的活动涉及回收AA.,AST和ALT,根部增加而不是叶子(图7.).这些数据也得到了在黄瓜上进行的蛋白质组学研究的支持[9.),Medicago Truncatula.[11其中发现ALT和AST的浓度分别在Fe缺乏内增加。此外,在黄瓜根中鉴定了C-N水解酶家族蛋白质,其浓度在Fe缺陷下增加了[9.].这家酶系列参与N代谢并催化来自C骨架(氨基酸和蛋白)的氨基的切割[53.].因此,释放的氨基可以在GS/GOGAT循环中被重新同化为新的AA..在唐尼尼等。[9.一个有趣的假设,尽管是推测性的,提出了:一些蛋白质(如肌动蛋白、微管蛋白和球蛋白)可能被用作来源AA.,碳骨架和n - nhh4.+在缺铁。我们可以假设,在这种情况下,一部分新同化的N可能来自已经存在的蛋白质,这些蛋白质是为了植物的生存而牺牲的。另一方面,植物似乎具有一种受调节的蛋白质降解机制[54.在其中的引用中,在应力反应和衰老期间特别活跃,导致细胞蛋白的连续转换。因此,AA.在根中释放的氮,部分可以运输到叶片,以保持氮代谢功能(图8.).实际上,叶片对N同化过程(NR + GS/GOGAT)的影响大于根系,因此叶片对N同化过程(NR + GS/GOGAT)的影响大于根系AA.浓度显然主要取决于它们从根部的转移。
结论
由此可见,铁缺乏通过限制NR活性和提高GS/GOGAT显著影响根和叶氮代谢。但在缺铁条件下,根与叶表现出明显的差异AA.根中含量降低,叶中含量增加,这可能与NR基因表达相反。事实上,NR在根和叶中分别表现为过表达和过表达。此外,不同的AA.在缺铁植物中的分布可能是由于根通过木质部向叶的主要转运(连同其他代谢物)。因此,在缺铁情况下,根似乎通过提供代谢物来更有效地维持整个植物。AA.(如有机酸)。代谢途径特征的示意图如图所示8..
方法
植物生长条件
黄瓜种子(CucumiS.巨大成功L. cv Marketmore ' 76, F.lli Ingegnoli, Milano)表面消毒后播种在Agriperlite中,用0.1 mM CaSO浇灌4.,使在26℃下在黑暗中发芽3d,然后用0.1mm FE(III)-edTA转移到完全营养溶液中。日益增长的条件是rabotti和zocchi报道的[55.].在营养液中生长的30株7日龄植株,去除子叶后,转移到10 L不含铁的相同营养液中。采样时间分别在诱导缺铁后0、1、3和7天以及光周期开始后4小时。为清晰起见,之前在铁存在下生长7天,然后转移到无铁溶液中的植物在全文中称为0。
在试验的第7天,采用便携式光合系统(CIRAS-2, PP system, USA)对叶片进行气体交换测量,以表征光合性能和气体交换测量。对铁充足和缺铁植株进行充分展开、完整叶片的测定。网络有限公司2评估同化率和蒸腾浓度为330μmolco2,环境相对湿度,室内温度28°C,光子通量密度1500 μmol m-2S.-1.仪器是根据制造商的指导方针稳定的。
RNA分离,northern blot和半定量RT-PCR分析
根据Vigani等人从根和叶组织中提取RNA。[56].用于扩增本工作中考虑的基因的基因特异性引物在附加文件中有报道4..对第一链cDNA进行PCRTaqDNA聚合酶(Promega)和通过测序验证的扩增片段的同一性。使用砂浆和杵在液氮中粉碎Fe缺陷和对照组织,并使用Trizol试剂(Invitrogen)提取总RNA。每套道的30微克总RNA通过电泳分离5 V cm2在1.3%(W / V)琼脂糖凝胶中,含有6%(v / v)甲醛,通过毛细管印迹在20×SSC中转移到杂膜-N1尼龙膜(Amersham Bioscience)中,然后通过UV交联固定。印迹与a杂交32.p标记的cDNA探针用于研究中考虑的所有基因的整个编码序列。根据尼龙膜生产厂家的说明书进行预杂交和杂交。在室温下用23个SSC在0.1% (w/v) SDS中洗涤10分钟,在65℃下用13个SSC在0.1% (w/v) SDS中洗涤20分钟,然后在65℃下用0.13个SSC在0.1% (w/v) SDS中洗涤10分钟。
这项工作中考虑的基因探针是在一次在Silico.使用以下数据库提供的信息进行的分析:
布兰达,http://www.brenda-enzymes.org;
NCBI,http://www.ncbi.nlm.nih.gov/;
TAIR,http://www.arabidopsis.org.
我们使用扩增引物获得的PCR产物片段作为cDNA探针,如附加文件所述4..
通过对瓜类基因组数据库CuGenDB (http://www.icugi.org/cgi-bin/ICuGI/tool/blast.cgi),所获得的探针序列显示了对瓜类基因的百分比同一性值,如附加文件所述4..关于GS2探针,在CuGenDB中没有具体的信息,但在GenBank中NCBI与GS2序列的同源性为98%Cucumis梅洛(加入N。AY773090)。
根据Donnini等人进行黄瓜植物中的半定量RT-PCR分析及策略I基因分析。[9.].
酶测定
如前所述提取酶[49.].nadph依赖性异柠檬酸脱氢酶(ICDH) (EC 1.1.1.42)的测定依据López-Millán等[42.].NR (EC 1.7.1.1)分析根据[57].GS (EC 6.3.1.2)检测根据[58].NADH-GOGAT (EC 1.4.1.14)活性根据[59].丙氨酸氨基转移酶(EC 2.6.1.2) (ALT)活性测定使用试剂盒(Cayman Chemical Company),按照厂家说明书进行,天门冬氨酸氨基转移酶(EC 2.6.1.1) (AST)活性测定参照[60].
免疫印迹分析
Western blot分析依据Vigani等人[38.].NR抗体由Kaiser博士提供。采用TBS-T缓冲液(Tris Buffered Saline, 0.1% Tween-20)稀释一抗,室温孵育2 h。用TBS-T缓冲液冲洗后,硝化纤维素膜与1:10000稀释的二抗(碱性磷酸酶偶联抗兔IgG, Sigma)在室温下孵育2 h。在TBS-T (Tris Buffered Saline, 0.1%吐温-20)中冲洗后,过滤器在5-溴-4-氯-3-吲哚基磷酸盐和硝基蓝四唑(FAST BCIP/NBT, Sigma)中孵育进行检测反应。
氨基酸分析
氨基酸 (AA.)对0、1、3、7 d的植株进行分析。叶和根分别收获。免费的AA.在4°C下从新鲜组织中提取,首先用80%乙醇过夜,然后用60%乙醇处理1 h,最后用蒸馏水处理24 h。每个样品的上清混合,alibid并保持在−20°C。免费的AA.采用高效液相色谱法测定,Muller和Touraine [61].
木质部汁液的收集与分析
切茎后1 h和光照期开始后4 h收集木质部汁液。在采集的任何时间,植物的木质部总体积没有任何显著差异(数据未显示)。硝酸盐浓度的测定依据[62].柠檬酸盐浓度根据[49.].全部的AA.根据[63].
蛋白质的测定
通过使用Bradford的使用染料结合方法测定总蛋白质浓度[64,以γ -球蛋白为标准。
统计分析
所有统计分析均使用Sigma-Stat®3.1进行。平均数与学生的比较T.所有病例的P≤0.05水平的检验。
缩写
- AA.:
-
氨基酸
- ALT:
-
丙氨酸转氨酶
- 参数:
-
精氨酸
- Asn:
-
天冬酰胺
- Asp:
-
天冬氨酸盐
- AST:
-
天冬氨酸amonitransferase
- G-3-P-DH:
-
甘油醛3-磷酸脱氢酶
- Glc-6P-DH:
-
葡萄糖6磷酸脱氢酶
- Gln:
-
谷氨酰胺
- Glu:
-
谷氨酸
- gly:
-
甘氨酸
- g:
-
谷氨酰胺合成酶
- Gogat:
-
谷氨酸合酶
- ICDH:
-
异柠檬酸脱氢酶
- PEPC:
-
磷enol.丙酮酸羧化酶
- 爵士:
-
丝氨酸。
参考文献
- 1.
高等植物的矿物质营养。1995,伦敦:学术出版社,1995。
- 2.
植物中硝酸盐转运体的结构、功能和调控。生物化学学报。2000,1465:219-235。10.1016 / s0005 - 2736(00) 00140 - 1。
- 3.
王小荣,王小荣,王志强,等:硝酸盐转运与信号转导。中国生物医学工程学报。2007,32(6):457 - 461。10.1093 / jxb / erm066。
- 4.
Curie C,Briat JF:植物中的铁运输和信号传导。Ann Rev植物Biol。2003,54:183-206。10.1146 / annurev.arplant.54.031902.135018。
- 5。
Kim SA,Guerinot ML:采矿铁:植物中的铁摄取和运输。费用。2007,581:2273-2280。10.1016 / J.Febslet.2007.04.043。
- 6.
AbadíaJ,Vázquezs,Rellán-Álvarezr,埃尔·杰曼堡,阿巴迪亚A,Álvarez-FernándezA,López-MillánAF:朝着知识的铁氯仑矫正。植物理性生物化学。2011,49:471-482。10.1016 / J.Plaphy.2011.01.026。
- 7.
Ivanov R,Brumbarova T,Bauer P:拟合苛刻的现实:在双子叶植物中的铁缺乏响应的调节。莫尔植物。2012,5:27-42。10.1093 / MP / SSR065。
- 8.
铁还蛋白水平对缺铁柠檬叶硝酸还原酶活性的影响。植物营养学报,1986,9:1405-1413。10.1080 / 01904168609363537。
- 9.
Donnini S, Prinsi B, Negri AS, Vigani G, Espen L, Zocchi G:黄瓜(Cucumis sativus L.)根系缺铁反应的蛋白质组学特征。植物营养与肥料学报。2010,27(6):723。10.1186 / 1471-2229-10-268。
- 10.
Rellán-Álvarez R, El-Jendoubi H, Wohlgemuth G, Abadía A, Fiehn O, Abadía J, Álvarez-Fernández A:策略I植物木质部汁液和叶片提取物对缺铁和补铁的响应。植物科学学报,2011,32(2):1-18。
- 11.
Rodríguez-Celma J, Lattanzio G, Grusak MA, Abadía A, Abadía J, López-Millán中国石油大学学报(自然科学版),2011,30(4):457 - 461。10.1021 / pr2000623。
- 12.
Colangelo EP,GueLinot ML:铁缺乏反应需要必要的基本螺旋环 - 螺旋蛋白FIT1。植物细胞。2004,16:3400-3412。10.1105 / TPC.104.024315。
- 13。
拟南芥bHLH转录因子POPEYE调控拟南芥根对缺铁的反应。acta botanica sinica(云南植物研究),2010,22(4):489 - 494。10.1105 / tpc.110.074096。
- 14。
Meiser J, Lingam S, Bauer P:铁和一氧化氮影响铁缺乏bHLH转录因子FIT的翻译后调控。植物营养与肥料学报。2011,31(4):489 - 494。10.1104 / pp.111.183285。
- 15.
王志强,王志强,王志强,等。不同铁供应水平对黄瓜根酶活性的影响。植物生态学报,2001,31(4):457 - 461。
- 16.
王玉华,王玉华,吕志强:番茄根系硝酸盐诱导基因的研究。阵列分析揭示了可能在氮营养中发挥作用的新基因。植物生理学报。2001,27(4):445 - 459。10.1104 / pp.127.1.345。
- 17.
王志强,王志强,王志强,等。黄瓜铁营养与硝态氮的短期相互作用。植物营养与肥料学报。2007,34:402-408。10.1071 / FP07022。
- 18.
铁胁迫下双子叶植物的代谢变化。植物的铁营养与根际微生物。编辑:Barton LL, Abadía J. 2006, Dordrecht,荷兰:施普林格,359-370。
- 19.
Vigani G,ZOCCHI G:线粒体在I植物策略中FE缺乏根系的命运和作用。植物迹象表现。2009,4:375-379。10.4161 / PSB.4.5.8344。
- 20.
Vigani G:发现线粒体在植物缺铁引起的代谢反应中的作用。植物营养与肥料学报,2012,29(6):751 - 756。10.1016 / j.jplph.2011.09.008。
- 21.
Wang R, Guegler K, LaBrie ST, Crawford NM:拟南芥营养反应基因组分析揭示了硝酸盐诱导的不同表达模式和新的代谢和潜在调控基因。植物学报。2000,12:1491- 1409。
- 22.
拟南芥根和芽对硝酸盐的响应研究揭示了1000多个快速响应的基因和与葡萄糖、海藻糖-6-磷酸、铁和硫酸盐代谢的新联系。植物生理学报。2003,32(4):536 - 542。10.1104 / pp.103.021253。
- 23.
Palenchar PM,Kouranov A,Lejay LV,Coruzzi GM:基因组的碳和氮气调节的基因组表达验证植物中的碳和氮(CN)的股票假设验证。生物生物。2004年,5:R91。10.1186 / GB-2004-5-11-R91。
- 24.
张晓东,张晓东,张晓东:玉米光合、碳分配和蛋白质磷酸化对硝酸盐、亚硝酸盐和铵态氮同化的短期影响。植物学报,1994,19(4):421 - 427。10.1007 / BF01089037。
- 25。
王志强,王志强,王志强:植物氮素同化相关的分子标记和信号。中国生物医学工程学报,2003,21(4):457 - 461。10.1093 / jxb / erg053。
- 26。
Hoefnagel MHN, Atkin OK, Wiskich JT:叶绿体和线粒体在光明和黑暗中的相互依赖关系。生物化学学报,1998,32(4):457 - 461。10.1016 / s0005 - 2728(98) 00126 - 1。
- 27。
Noctor G, Foyer CH:对C3光合作用中ATP: NADPH预算的重新评估:硝酸盐同化及其相关呼吸活动的潜在作用?中国农业科学。1998,49:1895-1908。
- 28.
Gardestrom P,Igamberdiev Au,raghavendra是:线粒体在光线上的函数和碳 - 氮相互作用的重要性。光合氮同化和相关碳与呼吸代谢。由:Foyer Ch,Noctor G. 2002,阿姆斯特丹,荷兰:Kluwer学术出版社,151-172。
- 29.
Raghavendra AS,Padmasree K:线粒体代谢与光合碳同化的有益相互作用。趋势植物SCI。2003,8:546-553。10.1016 / J.Plants.2003.09.015。
- 30.
郭树清,王志强,王志强,等:不同浓度CO2对菜豆光合特性的影响。植物营养学报。2005,23(3):429 - 434。10.1111 / j.1399-3054.2005.00467.x。
- 31.
植物碳氮互作调控的代谢和信号转导机制。植物学报。2010,3:973-996。10.1093 / mp / ssq049。
- 32.
Kaiser WM,Kandlebinder A,Stoimenova M,Glaab J:叶片叶片完整叶片和硝酸盐还原酶活性之间的差异:原位硝酸盐的降低限制了什么?Planta。2000,210:801-807。10.1007 / S004250050682。
- 33.
是什么限制了叶中硝酸盐的减少?光合氮同化和相关碳与呼吸代谢。编辑:Foyer CH, Noctor G. 2002,荷兰阿姆斯特丹:Kluwer学术出版社,63-70。
- 34.
油菜(Brassica napus)悬浮细胞培养中胞质丙酮酸激酶(pyruvate kinase)的纯化和表征:糖酵解与氮同化整合的意义。中国生物化学学报。2000,27(4):497 - 497。10.1046 / j.1432-1327.2000.01494.x。
- 35.
2-氧戊二酸在植物铵态氮同化中的重要性。中国生物医学工程学报,2002,31(4):513 - 514。10.1093 / jexbot / 53.370.905。
- 36.
Araújo WL, nnes - nesi A, Trenkamp S, Bunik VI, Fernie AR:抑制马铃薯块茎中2-氧戊二酸脱氢酶表明该酶对呼吸作用有限制,并证实了其在氮同化中的重要性。植物营养与肥料学报。2008,31(4):489 - 494。10.1104 / pp.108.126219。
- 37。
Foyer CH, Noctor G, Hodges M:呼吸和氮同化:靶向线粒体相关代谢作为提高氮利用效率的手段。中国生物医学工程学报,2011,32(6):691 - 697。10.1093 / jxb / erq453。
- 38。
Vigani G, Maffi D, Zocchi G:铁的有效性影响黄瓜根中线粒体的功能。新植物学报,2009,33(4):513 - 514。10.1111 / j.1469-8137.2008.02747.x。
- 39。
陈志刚,陈志刚,陈志刚,等。拟南芥高亲和根铁吸收系统的局部信号和远距离信号的双重调控。植物生理学报。2003,32(6):796-804。10.1104 / pp.102.016089。
- 40.
Waters BM,Lucena C,Romera FJ,Jester GG,Wynn An,Rojas Cl,Alcantara E,Perez-Vicente R:乙烯参与在H + -ATPase CSHA1基因的调节和新的孤立的替代铁还原酶CSFRO1和铁运输车CSIRT1黄瓜植物中的基因。植物理性生物化学。2007,45:293-301。10.1016 / J.Plaphy.2007.03.011。
- 41.
Abadía J, López-Millán AF, Rombolà A, Abadía A:有机酸与缺铁:综述。植物营养与肥料学报,2002,29(4):457 - 461。10.1023 /: 1016093317898。
- 42.
Lòpez-Millàn AF, Morales F, Andaluz S, Gogorcena Y, Abadìa A, De Las Rivas J, Abadìa J:甜菜根对缺铁的反应。碳同化和氧利用的变化。植物营养与肥料学报。2000,19(4):457 - 461。10.1104 / pp.124.2.885。
- 43.
DE NISI P,ZOCCHI G:在铁缺乏症下黄瓜(CUCUMIS Sativus L.)甲基丙酮酸羧化酶:活性和动力学表征。J Exp Bot。2000,352:1903-1909。
- 44.
王志强,王志强,王志强:劈裂根系技术在黄瓜植株铁吸收研究中的应用。计划生理生化。2012,doi:10.1016/j.p plope .2012.05.022。
- 45.
硝酸还原酶的结构、功能和调节:架起生物化学和生理之间的桥梁。植物营养与肥料学报。1999,20(5):497 - 503。10.1146 / annurev.arplant.50.1.277。
- 46.
Terry N, Low G:叶片叶绿素含量及其与铁在细胞内位置的关系。植物营养学报,1998,5:301-310。10.1080 / 01904168209362959。
- 47.
刘志强,刘志强,刘志强,等。缺铁植物木质部液和外体细胞液中铁和有机酸含量的变化及其对铁补充的响应。植物营养与肥料学报,2010,27(4):427 - 434。10.1016 / j.jplph.2009.09.007。
- 48.
Dutilleul C,Lelarge C,Prioul JL,De Paepe R,Foyer Ch,Noctor G:Lead NAD状态的线粒体驱动的变化对硝酸盐同化的控制和碳和氮代谢的整合发挥了重要影响。植物理性。2005,139:64-78。10.1104 / pp.105.066399。
- 49。
黄瓜(Cucumis sativus L.)根系缺铁生化反应的代谢影响。植物营养与肥料学报。1995,19(4):423 - 427。
- 50.
Espen L,Dell'orto M,De Nisi P,Zocchi G:Fe缺陷下的黄瓜(Cucumis Sativus L.)根系中的代谢反应:31p核磁共振的体内研究。Planta。2000,210:985-992。10.1007 / S0042500507077
- 51.
Pontiggia A,De NISI P,ZOCCHI G:铁缺乏对黄瓜根系RNA和蛋白质合成的影响。J植物Nutr。2003年,26:2177-2186。10.1081 / PLN-120024273。
- 52.
Rombolà AD, Gogorcene Y, Larbi A, Morales F, Baldi E, Marangoni B, Tagliavini M, Abadía J:缺铁对甜菜(Beta vulgaris)植株固碳和叶片元素组成的影响。植物营养与肥料学报。2005,31(4):457 - 461。10.1007 / s11104 - 004 - 2001 - x。
- 53.
碳氮水解酶的一个新家族。中国科学:地球科学,1994,30(3):444 - 446。10.1002 / pro.5560030821。
- 54.
Araújowl,takayuki t,Kimitsune I,Freamie Ar:蛋白质降解 - 用于应激植物的替代呼吸基材。趋势植物SCI。2011,16:489-498。
- 55.
Rabotti G,Zocchi G:血浆膜结合的H + -ATP酶和Fe缺陷黄瓜根的还原酶活性。physiol植物。1994年,90:779-785。10.1111 / J.1399-3054.1994.TB02537.x。
- 56.
Vigani G, Chittò A, De Nisi P, Zocchi G:通过cDNA-AFLP分析,发现了一组在黄瓜缺铁反应中差异表达的新基因(Cucumis巨大)根尖。BIOL植物。2012,56:502-508。10.1007 / S10535-012-0050-1。
- 57.
Long DM,OAKS A:ChyMostatin稳定玉米硝酸盐酶的稳定化。植物理性。1990,93:846-850。10.1104 / pp.93.3.846。
- 58.
Scheible WR, gonzales - fontes A, Lauerer M, Muller-Rober B, Caboche M, Stitt M:硝酸盐是诱导烟草有机酸代谢和抑制淀粉代谢的信号。acta botanica sinica(云南植物研究),2017,29(5):593 - 598。
- 59.
Chen Fl,Cullimore JV:NADH依赖性谷氨酸合成酶的两种同工酶在寻常的LIPSOLUS的根结节中:纯化,性质和活性变化在结节发育过程中。植物理性。1988,88:1411-1417。10.1104 / pp.88.4.1411。
- 60.
Amador E,Wacker W:血清谷氨酸草灭性转氨酶活性。新的测定技术的新修改与分析评估。Clin Chem。1962,8:343。
- 61.
Muller B,Touraine B:No3的抑制 - 各种Phloem-卵形卵泡的摄取在大豆幼苗中。J Exp Bot。1992年,43:617-623。10.1093 / JXB / 43.5.617。
- 62.
Cataldo Da,Haroon M,Schrader LB,Youngs VI:通过盐酸锡硝酸盐的植物组织中硝酸盐的快速比色测定。沟通SCI植物肛门。1975年,6:71-80。10.1080 / 00103627509366547
- 63.
一种用于氨基酸及相关化合物光度测定的修饰茚三酮试剂。中国生物化学杂志。
- 64.
Bradford MM:一种利用蛋白质-染料结合原理的快速和灵敏的定量蛋白质微克量的方法。生物化学学报。1976,72:248-254。10.1016 / 0003 - 2697(76) 90527 - 3。
致谢
我们感谢Frédéric Gaymard和Jean-François Briat的实验室,在那里进行了一些北方杂交实验,并感谢Brigitte Touraine帮助进行氨基酸检测。感谢Kaiser WM博士(Universität Würzburg)赠送NR抗体。我们也感谢Elena Orsini的技术支持,以及Roberto Pilu和Fabio Nocito对底漆设计的有益讨论。感谢中国农业科学院蔬菜花卉研究所发布的瓜类基因组信息。全球之声部分得到“Dote Ricerca”:FSE, region Lombardia的支持。这项工作得到了米兰大学和Università degli Studi di Milano的资助。
作者信息
从属关系
相应的作者
额外的信息
利益争夺
两位作者宣称他们没有相互竞争的利益。
作者的贡献
AB进行了基因表达分析,酶测定,氨基酸分析。GV进行酶测定,Xylem SAP,Western印迹分析,生理参数的测定并写下了稿件的酶测定。GZ参与了工作的战略规划,数据分析和写入最终版本的手稿。所有作者均致力于讨论结果,并参与了稿件的关键修订。所有作者阅读并认可的终稿。
电子补充材料
酶活性以nmol NADPH mg表达
额外的文件1:-1防敏-1.(DOC 36 KB)
12870_2012_1180_moesm3_esm.tiff.
附加文件3:对从黄瓜根提取的可溶性部分进行硝酸还原酶(NR)的蛋白质印迹分析。0,1,3,7是Fe退出后的日子。(TIFF 46 KB)
作者为图像提交的原始文件
以下是与作者的原始提交的图像的链接。
权利和权限
开放获取本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
缺铁影响黄瓜氮素代谢(Cucumis sativusL.)植物。BMC植物BIOL.12,189(2012)。https://doi.org/10.1186/1471-2229-12-189
收到了:
公认:
发表:
关键字
- C / N代谢
- Cucumis sativusl
- 缺铁
- GS / GOGAT周期
- 异柠檬酸脱氢酶
- 硝酸还原酶