摘要
背景
配子和胚胎发育是植物繁殖和结实率的关键,是决定作物产量的重要因素。脯氨酸积累在很大程度上被认为是克服应激条件的一种特殊反应,而最近的研究表明脯氨酸代谢在生殖发育中也有重要作用。游离脯氨酸水平和脯氨酸代谢水平都对花期过渡、花粉和胚胎发育有影响。
结果
在本研究中,我们详细分析了脯氨酸生物合成酶对拟南芥营养发育和繁殖成功的贡献。与以往的报道相比,我们发现吡咯啉-5-羧酸(P5C)合成酶2 (P5CS2)在有性繁殖中并不是必需的p5cs2突变植株在长日照条件下营养发育迟缓,表现出较低的育性。缺乏P5CS1基因的单突变植株没有表现出任何发育缺陷。两种P5CS异构体同时缺失导致花粉不育,但仍能产生可育卵细胞。P5C还原酶(P5CR)的表达对胚胎发育是必不可少的,但令人惊讶的是,花粉或卵细胞的生育却不需要P5C还原酶的表达。后一观察结果可以用P5CR活性的极端稳定性来解释,其半衰期大于3周体外。在内源性P5CR启动子的控制下,表达P5CR- gfp能够恢复纯合子的生长p5cr突变体胚胎。p5cr - gfp荧光分析在足底支持P5CR的细胞质定位。
结论
我们的研究结果表明,潜在的替代途径脯氨酸合成或代际转移脯氨酸不足以克服花粉发育过程中从谷氨酸生物合成脯氨酸的缺陷。通过P5CS2和P5CR合成脯氨酸对拟南芥的营养和生殖发育具有限制作用P5CS1单独不影响非胁迫植物的发育。
背景
植物的繁殖成功在很大程度上取决于能否成功适应频繁变化的环境条件。对各种导致水分可利用性降低的胁迫的最显著的适应性反应之一是脯氨酸氨基酸的积累(见[1,2]查阅最近的评论)。然而,游离脯氨酸含量的变化也发生在非胁迫条件下生长的植物的发育过程中,特别是在生殖器官中。花粉粒是一种天然的耐干性组织,积累了大量的脯氨酸,许多花分泌富含脯氨酸的花蜜[3.].首先,脯氨酸是蛋白质合成的重要代谢物,并以独特的方式促进蛋白质折叠、结构和稳定性。因此,对脯氨酸合成缺陷突变体的详细表型分析可以促进我们对脯氨酸在植物发育中的初级代谢和特定功能的理解。
在植物中,通过吡咯啉-5-羧酸酯(P5C)合成酶(P5CS)和P5C还原酶(P5CR)的连续反应,谷氨酸在细胞质中转化为脯氨酸,并可能在质体中转化为脯氨酸[1].在动物和真菌中,精氨酸或鸟氨酸也可以作为脯氨酸的前体,而在不同亚细胞分隔区中贡献酶的分离可能阻碍了植物中的这种替代代谢途径[4].
在拟南芥以及许多其他植物中,两种P5CS亚型已被鉴定出具有不同的表达模式和在初级代谢和应激防御中的特定功能[5- - - - - -7].P5CS1(At2g39800)转录在应激反应中被强烈诱导p5cs1T-DNA插入突变体是可行的,但表现出游离脯氨酸基本水平降低和花过渡延迟[6,8].此外,p5cs1突变体在应对胁迫时脯氨酸积累明显减少,同时根系生长减少,叶片活性氧含量增加,NADP降低+与NADPH比值[9,10].P5CS1-GFP融合蛋白在胚胎细胞中形成胞质斑点,而在渗透胁迫植物的叶肉细胞中,P5CS1-GFP荧光主要局限在叶绿体中[10].
P5CS2(At3g55610)转录本和P5CS2-GFP荧光主要在分生组织和发育中的组织中检测到[5,10].的P5CS2启动子被确定为CONSTANS的早期靶点,CONSTANS是一种参与花转变的转录激活因子[11].而转录水平P5CS2它们对非生物胁迫没有强烈反应,在植物对无毒的假单胞菌感染(12,13].T-DNA插入突变体P5CS2,一种胚胎致命表型已被报道,可以克服体外脯氨酸饲喂育成种子的培养。然而,纯合子p5cs2突变株在开花前死亡,因此特异作用P5CS2到目前为止还无法分析5,10].同时沉默或共同抑制两个高度相似的P5CS基因导致生长迟缓、开花延迟和顶端优势度降低[8,14].
脯氨酸生物合成的第二步也是最后一步是由拟南芥中单基因At5g14800编码的P5CR催化的。SeedGenes项目确定了T-DNA插入P5CR作为胚胎缺陷突变emb2772[15].对拟南芥细胞培养的抑制剂研究也发现P5CR是一种生长必需的酶[16].P5CR在年轻生长组织中表达最强,且受应激诱导[17].翻译效率和mRNA稳定性被认为是P5CR表达的额外调控步骤[18].P5CR在植物中的亚细胞定位至今还没有得到明确的确定。虽然序列分析预测了细胞质定位,但在豌豆和大豆中观察到P5CR活性与质体的共沉淀[19,20.].尽管脯氨酸在初级代谢和应激耐受中具有重要作用,但尚无P5CR定位的实验数据在活的有机体内都是可用的。
在这项研究中,我们证明了P5CR-GFP融合蛋白仅定位于细胞质中,可以完全补充发育缺陷p5cr突变体。此外,我们报道了P5CR和两个P5CS亚型对拟南芥营养和生殖发育的要求,而以往的报道大多关注于脯氨酸生物合成的单一步骤。与以前的报告相比,合适的培养条件允许我们产生可育纯合子p5cs2变种人,我们观察到了p5cs2但不是p5cs1突变体表现出生长减少和开花时间推迟。不孕不育的p5cs1/p5cs2双突变花粉排除了双纯合子的产生p5cs1/p5cs2即使双突变的雌性配子是可育的突变植物。功能的缺失P5CR基因对雌雄配子的生育能力均无影响,但在推测为纯合子的情况下,胚胎仅发生少数细胞分裂就会流产p5cr突变体种子。配子发育的缺失新创P5CR基因的表达依赖于P5CR蛋白的异常稳定性。
结果
纯合子的p5cs2突变体是可行的,可以产生肥沃的种子
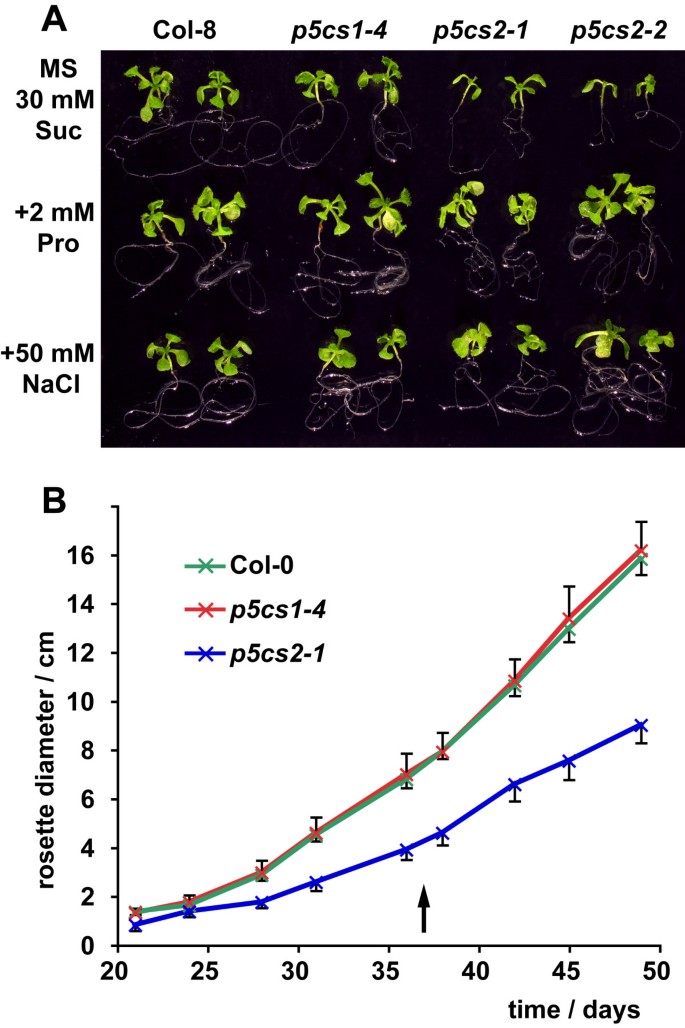
之前的两项研究描述了p5cs2T-DNA插入系为胚胎致死系或有条件胚胎致死系和不可育系。为了消除潜在的继发性突变或生态类型特异性效应,我们回溯了p5cs2-1(GABI452_G01)和p5cs2-2(FLAG_139H07) T-DNA插入线分别3次和5次到Col-8加入。在这两个品系中,分离模式与单T-DNA插入和纯合子种子过早流产相一致(数据未显示)。纯合子的p5cs2然后通过在体外在含有60 mM蔗糖和2 mM脯氨酸的MS板上培养未成熟的突变种子。我们还观察到轻度盐胁迫对杂合子的应用p5cs2-1突变植株允许形成约1%的纯合子和可育种子在活的有机体内.大多数以任一方式获得的纯合子植株表型正常,与野生型植株相比仅表现出生长减少1:图S1A)。在短日照和弱光条件下保存时,最纯合子p5cs2突变株完成了正常的生命周期并产生了可活的种子,这使我们能够分析植物的发育p5cs2与野生型和野生型直接比较的突变植物p5cs1-4突变体植物。
P5CS2表达是正常营养和生殖发育所必需的,而P5CS1表情似乎可有可无的
在无菌培养中生长时,纯合子p5cs2幼苗表现出生长缺陷,可通过外施脯氨酸或施加轻度盐胁迫加以补充(图1A)在矿物质或蔗糖浓度较低的情况下,p5cs2突变苗经常不能建立自养生长1:图印地)。的莲座在土壤中p5cs2-1突变植株的大小只有野生型植株的57%1B),当不施用矿肥时,这种效应更加明显(数据未显示)。
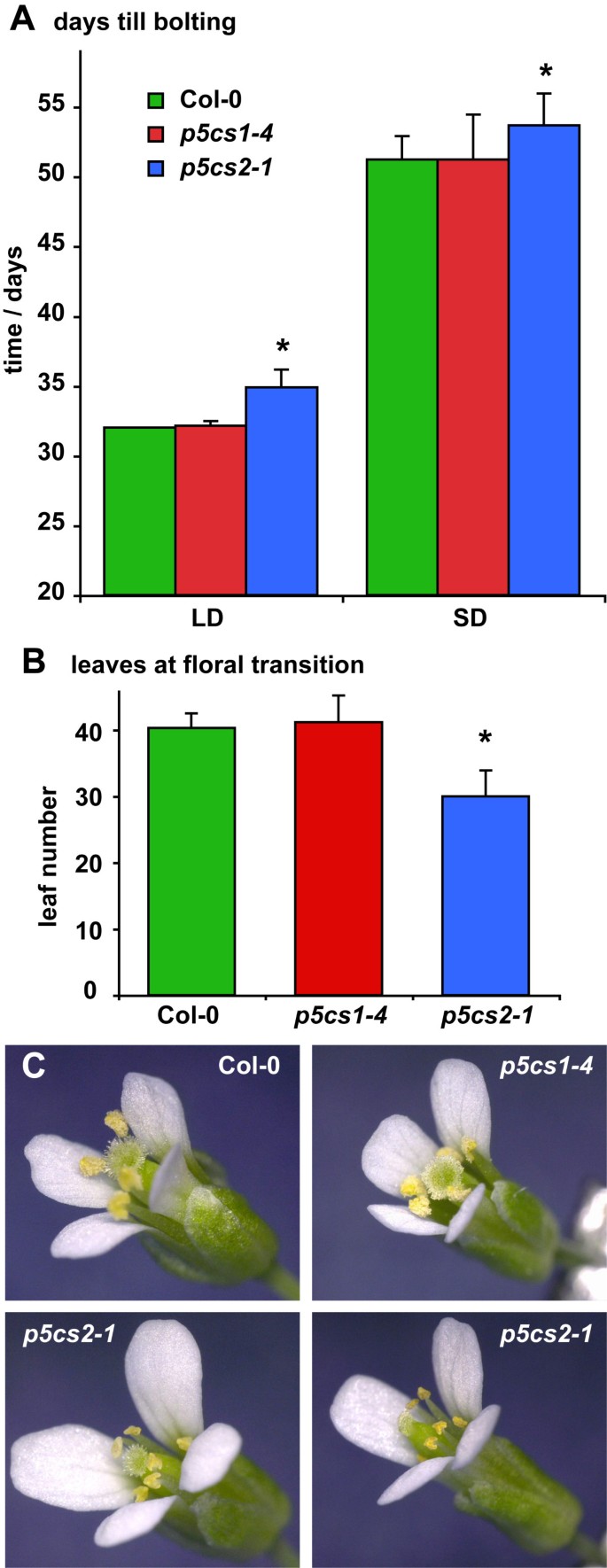
关于花的转变,p5cs2-1在抽苔开始时,植株的初级莲藕叶较少,在短日照和长日照条件下抽苔都推迟了2天以上(图2A、B)。偶尔,p5cs2突变植株形成细长或轻微卷叶,这类植株大多不能产生种子(数据未显示)。在长日照条件下栽培增加了p5cs2突变植株形成异常叶片,减少可育植株的比例。在不育p5cs2花药萎陷,花瓣拉长(图2C).受轻度影响的花的育性可以通过与不同植物的花粉授粉来恢复。在p5cs2有较强表型异常的突变体,也有雌蕊和柱头的畸形,延伸到整个花序的花器官特征和结构的紊乱。这样的花不能通过异花授粉受精(数据未显示)。
另外分析了潜在的影响P5CS1对生长发育的表达,也是敲除突变株p5cs1-4(Salk_063517)回交3次至Col-8,所有实验均纳入纯合子代。与[的观察结果相反5],p5cs1-4在非胁迫栽培条件下,无论光照时间和光照强度如何,突变株在生长、开花时间、花序结构或育性方面均未表现出与野生型的任何偏差1而且2).
P5CS表达是男性生育能力所必需的
在回交,杂合的p5cs2突变植株产生的磺胺嘧啶(p5cs2-1)或BASTA (p5cs2-2)抗性后代(表1).轻度盐胁迫增加了两种植物突变等位基因的传播p5cs2插入线,大概是由归纳法P5CS1表达式。杂合子的互交p5cs2对野生型植物的研究表明,雄性和雌性种系的生殖发育都有轻微的损害1).
为了更深入地了解脯氨酸合成在生殖发育中的作用,我们还跨越了p5cs2的突变行p5cs1-4突变体。令人惊讶的是,频率p5cs2-1突变等位基因在子代中远远低于预期p5cs1-4/p5cs2-1双杂合子植物2和额外的文件2:图S2)。的传播p5cs2-1杂合子植株自交后等位基因从65.0%下降P5CS1野生型背景分别为52.3%和26.7%p5cs1-4分别为杂合子或纯合子背景。得到了相似的结果p5cs2-2突变的等位基因。
我们从未得到纯合子的p5cs2-1另外纯合子或杂合子的植物p5cs1-4突变。相反,纯合子的p5cs1-4另外杂合子的突变体p5cs2等位基因获得频率高,生长发育正常。尝试的在体外从纯合子植物中拯救发育迟缓的胚胎p5cs1-4等位基因和杂合子为p5cs2-1等位基因从不产生双纯合子植株。
确定是否传播p5cs2突变等位基因在雄性或雌性种系中特别受到阻碍,我们在多重植物之间进行了互交p5cs突变的等位基因。的传播p5cs2当母株为纯合子时,通过母株种系的等位基因在44% - 50%之间p5cs1-4等位基因,独立于P5CS1花粉供体的基因型(表2).与之形成鲜明对比的,是传输的p5cs2-1当花粉供体植株为纯合子时,没有观察到雄性种系的等位基因p5cs1-4突变。为p5cs2-2等位基因,我们观察到只有3个幼苗(在289个分析)似乎起源于一个p5cs1-4/p5cs2-2双突变体花粉。
p5cr突变导致胚胎死亡
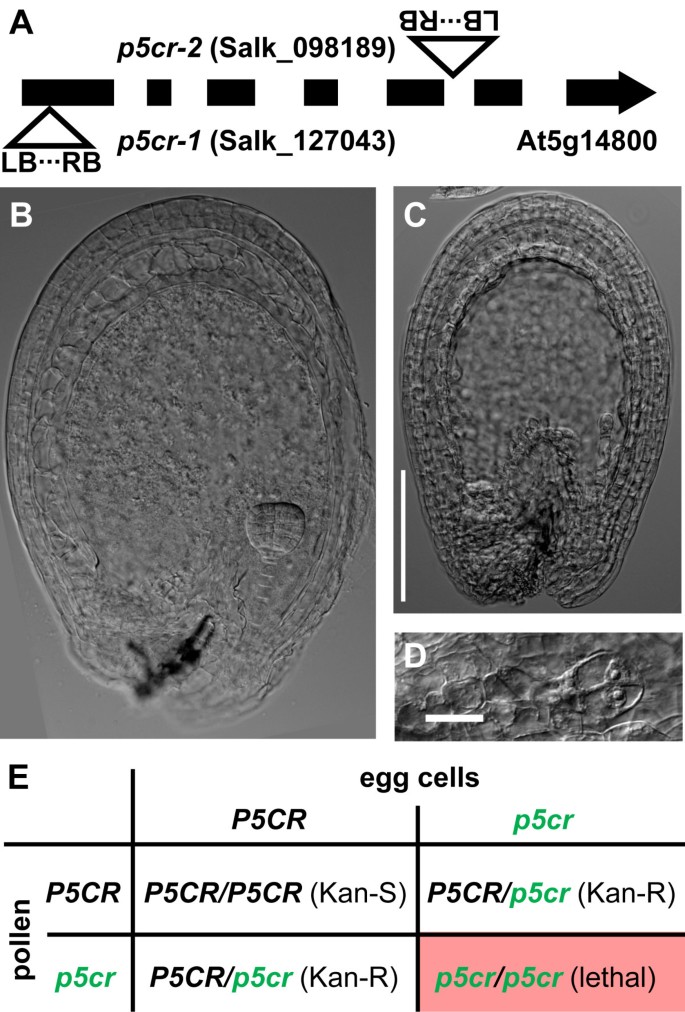
泛函的绝对要求P5CS1或P5CS2男性生育能力的等位基因促使我们对敲除突变体进行分析,以进行脯氨酸生物合成的酶促第二步。在拟南芥中,P5CR由单个拷贝基因编码,我们实验中使用的两条T-DNA插入系(p5cr-1(Salk_127043)和p5cr2[Salk_098189])在SeedGenes数据库中被列为胚胎致死[21].据报道,来自NASC种子中心的一个种子株系(株系号:N16447)来自一个纯合子p5cr-1植物,只有杂合子或野生型植物从这些种子,表明母体植物不是纯合子p5cr突变体(数据未显示)。的p5cr-1突变系最初包含至少一个额外的T-DNA插入,在重复与Col-8野生型杂交时被消除。我们确定了T-DNA插入的确切位置,并证实胚胎致死表型与插入共分离P5CR基因(图3.A和数据未显示)。杂合子的植物的角果p5cr-1或者是p5cr-2等位基因中含有25%的种子,在该等位基因中,胚胎发育最晚在胚原体第二次分裂后停止(图3.罪犯)。自交杂合子的后代p5cr突变植株对卡那霉素抗性的分离率为2:1,这与配子体育性中无缺陷的纯合子胚的合子后致死率一样3.E和表3.).杂合子的互交中p5cr在野生型突变体中,我们观察到46%到50%的抗性后代,但我们无法区分这种偏离期望值(50%)是否由于抗性基因表达不佳或配子发育或生育能力的轻微缺陷(表2)3.).
试图挽救假定的纯合子p5cr通过脯氨酸喂养突变胚胎在体外失败了。在杂合子亲本的角果中促进纯合子种子的胚发育原位通过外部脯氨酸饲喂或通过盐胁迫诱导内部脯氨酸积累均无效。我们的结论是,尽管生育能力正常p5cr突变配子,P5CR表达对胚胎发育至关重要。
P5CS但不是P5CR表达是花粉发育的必要条件
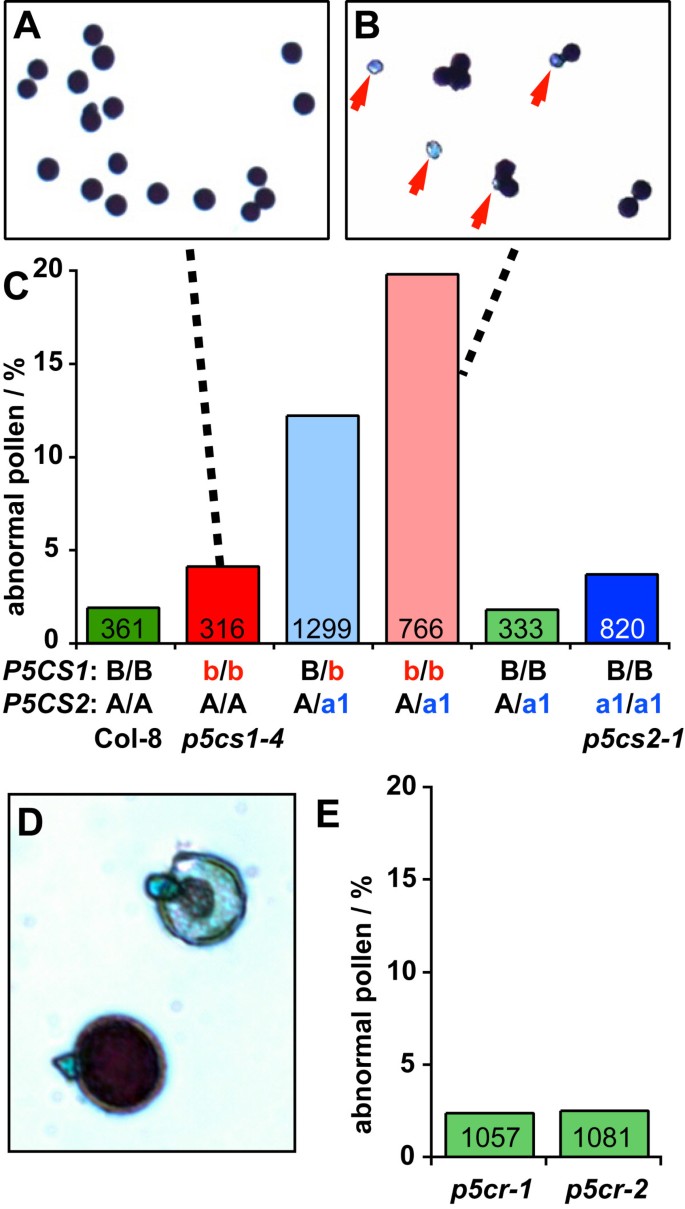
确定原因p5cr突变是通过男性生殖系传播的,而p5cs1 / p5cs2没有双突变,花粉粒收集自开放的花p5cs而且p5cr用Alexander染色法对突变株进行染色(图4).在这一过程中,健康和可育花粉颗粒被染成深紫色,而不育花粉显示较弱或不染。我们在野生型和杂合型中检测到略低于2%的不育花粉粒p5cs2-1植株中,这一数量在纯合子中大约翻倍p5cs2-1或p5cs1-4单突变体。植物杂合突变在两者P5CS异构体产生12.2%的花粉粒更小,几乎没有被Alexander染色。纯合子植株的无染花粉数增加到19.8%p5cs1-4突变和杂合子为p5cs2-1等位基因。得到了相似的结果p5cs2-2突变体植物。相反,花粉来自杂合子p5cr突变株的畸形或未染色花粉没有出现任何增加,这与之前描述的正常育性是一致的p5cr突变体花粉(表3.).
花粉发育不良p5cs但不是p5cr突变体.从2-4株单株的开放花朵中采集花粉,用亚历山大染色法分析花粉活力。柱中的数字表示每个基因型分析的花粉粒总数。一个:一种植物的花粉p5cs1-4单突变体植物,B:一种植物的花粉p5cs1-4突变植株另外杂合子p5cs2-1突变;红色箭头表示不可存活的花粉粒。C:各种植物中大量的非活花粉p5cs变异的基因型。大写字母表示野生型等位基因,小写字母表示突变型等位基因(a1 =p5cs2-1;b =p5cs1-4;Col-8和纯合子p5cs单个突变体被额外标记以增加清晰度)。D:杂合子的正常(左下)和不可活的花粉粒p5cr-1用更高的放大率种植。E:杂合子中无效花粉粒的频率p5cr突变体。
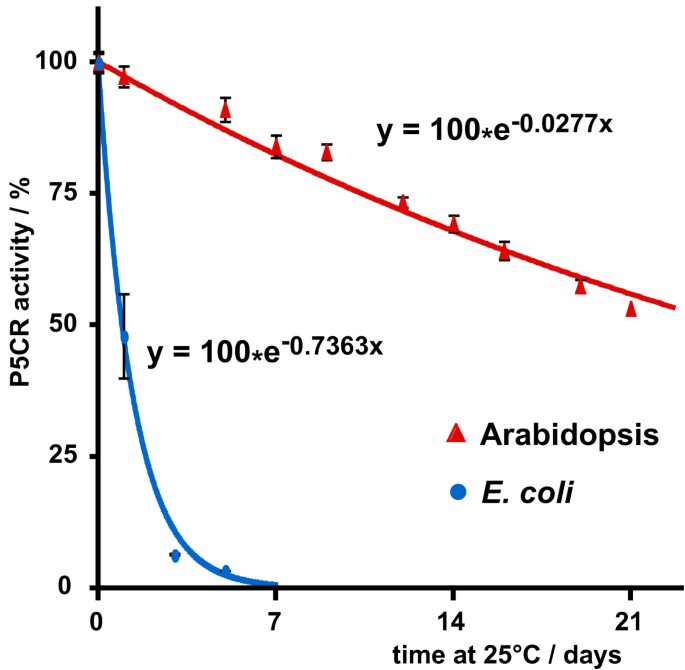
花粉在缺乏育性时P5CR基因表达为保证小麦脯氨酸的供应和生产提供了新的途径p5cr突变体花粉.对公开的微阵列数据的分析表明,只有少量的P5CRmRNA在花粉中积累(数据未显示)。新创如果单倍体小孢子分离前存在于花粉母细胞中的P5CR蛋白在花粉成熟过程中仍然活跃,则从完整的基因拷贝中表达P5CR蛋白可能是不必要的。为了检验这一假设的可能性,拟南芥P5CR在悬浮培养细胞的部分纯化制剂中或在异源表达后的稳定性进行了评估大肠杆菌(图5数据没有显示)。事实上,该酶被发现在25°C保存时高度稳定,估计半衰期约为25天。相比之下,内源性P5CR蛋白来自大肠杆菌(编码proC在相同的实验条件下分离测试的P5CR,在24 h内失去了50%以上的活性。从拟南芥小孢子分离到花药开放的时间约为8天,因此P5CR具有稳定性在活的有机体内足以在减数分裂胞质分裂后完成花粉发育[22].
P5CR-GFP的表达补充了p5crT-DNA插入线,表明P5CR是纯细胞质定位
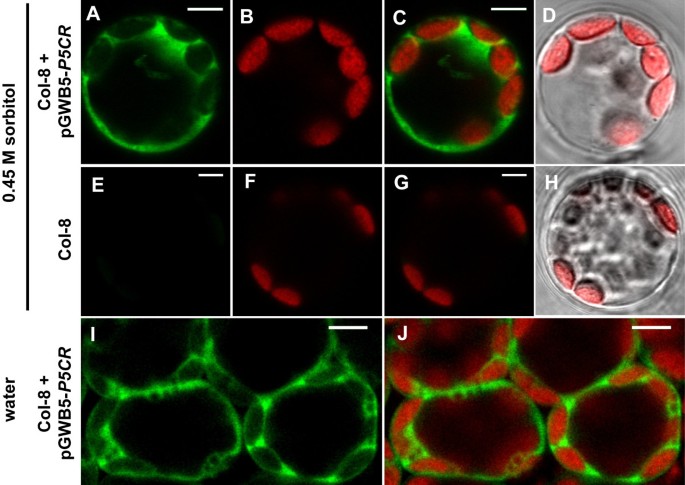
令人惊讶的是,穿越p5cr在花菜花叶病毒(CaMV) 35s启动子的控制下,植物过表达P5CR-GFP融合蛋白的突变体不能产生纯合子的植物P5CR-使插入失效(数据未显示)。这种失败可能是由于CaMV-35S启动子在胚胎组织中的活性较差3.:图S3)。杂合子的转化p5cr变种人的结构中包含原生生物P5CR启动子和基因融合到GFP编码序列允许分离纯合子的植物插入T-DNA使内源性失活P5CR基因(附加文件3.:图S3和附加文件4:图S4)。在原生启动子的控制下,P5CR-GFP在幼嫩、快速生长的组织如嫩叶或根尖中表达最强,在胚胎中也检测到。P5CR-GFP荧光在过表达植物和具有原生启动子结构的植物中的亚细胞分布是相同的,尽管在后者的情况下,成熟组织中的GFP信号与自身荧光信号很难区分。对分离的原生质体和叶肉细胞gfp荧光的分析显示,在低渗透和高渗透条件下,P5CR-GFP在细胞质中均匀分布(图6).
讨论
通过对拟南芥脯氨酸生物合成相关基因突变体的详细分析,我们可以确定脯氨酸发育的关键步骤,这需要相应的酶。与以前的报告一致,P5CS1对生长和繁殖不是必需的[5,10].此外,与Mattioli和同事描述的数据相反,p5cs1-4尽管使用了相同的T-DNA插入系和相似的培养条件,突变体在向繁殖期的过渡中没有表现出任何延迟,花序的形态没有改变。最有可能的是,最初的索尔克T-DNA插入线包含额外的突变,我们通过反复回交消除了这些突变。
在这项研究中,我们首次描述了可活的纯合子的产生p5cs2突变体种子在活的有机体内这使我们能够评估P5CS2对营养和生殖发育的贡献。在无菌培养中,适合抑制的低渗透压条件P5CS1表达频繁阻碍自养生长的建立p5cs2突变苗,而提供脯氨酸或轻度盐胁迫条件,使正常生长。在土壤发育的后期,失活P5CS2由于T-DNA的插入导致了发育迟缓,但并没有阻止成功的繁殖P5CS1基因是存在的。纯合子的育性p5cs2土壤中的突变体,栽培条件是至关重要的,因为植物通常在短日照条件下的营养丰富的土壤中发育良好,而在长日照条件下,它们大多不能产生可行的种子。先前的研究报告纯合子不育或无生存能力p5cs2突变植株是在气候较温暖的地区进行的,因此支持生长条件对生存能力的重要性p5cs2突变体植物(5,10].依赖光的监管P5CS1而且P5CS2早前的一项研究已经证明了这种表达,而且这两种基因都是由光诱导的[12].令人惊讶的是,我们观察到较长的光照时间降低了生育能力p5cs2表明在这些条件下,P5CS1不足以满足生殖发育过程中对脯氨酸的需求。
在花丛中,有一个突出的表达P5CS1-GFP在原生启动子控制下,花粉粒中检出花粉P5CS2-GFP在花药的营养部分表达[10].花开时花药塌陷是长日栽培花中最常见的病变p5cs2突变植物,这表明P5CS2在一定生长条件下,孢子体花药组织的表达对雄性的生育能力起着至关重要的作用。
纯合子的杀伤力p5cs2杂合子亲本植物角果中的突变胚可能是由于纯合子胚生长缓慢,导致营养分配减少,最终导致纯合子胚在杂合子和野生型亲本达到成熟时过早脱水而死亡。在纯合子的角果中p5cs2在突变体中,所有的种子都以相似的速度发育,因此在胚胎发育完全之前不会诱发脱水。有趣的是,盐胁迫对杂合子的应用p5cs2开花期间的突变体允许至少一些纯合子胚胎存活,要么通过诱导或激活P5CS1,要么通过延迟杂合子和野生型胚胎的发育。
相反P5CS,只有一个P5CR该基因存在于拟南芥中。纯合子的早期发育停滞p5cr突变胚胎表明从母体组织向发育中的胚胎的脯氨酸转移有限。这种情况是可能的,因为胚胎完全嵌入胚乳组织中,胚乳组织同样缺乏P5CR表达式。另外,P5CR缺陷胚胎中持续的P5CS活性可能导致毒性浓度P5C的积累。内源性P5C积累的毒性是基于脯氨酸诱导的P5C脱氢酶缺陷突变体的毒性假设的,尽管最近的一项研究没有观察到外用P5C的毒性作用[23- - - - - -25].
救援的纯合子p5cr通过P5CR-GFP融合蛋白的表达对突变体进行调控P5CR启动子证实,P5CR破坏是纯合子致死性的唯一原因p5cr突变体胚胎。细胞质中P5CR-GFP荧光的观察表明,细胞质脯氨酸的合成足以克服发育缺陷p5cr突变体胚胎。P5CS1-GFP和P5CS2-GFP导入到渗透胁迫细胞的质体中,但P5CR-GFP不导入,提出了关于质体在胁迫诱导的脯氨酸积累和P5C细胞内运输中的作用的新问题[10].此外,P5CR的叶绿体定位的植物物种也值得认真的重新检查P5CR基因拷贝数与P5CR蛋白定位[19,20.].
考虑绝对需求P5CR在胚胎发育过程中的表达,是令人困惑的p5cr突变配子的育性没有明显降低。杂合子自交后产生66%杂合子后代p5cr突变植株可能是由于亲本P5CR在mRNA或蛋白质水平上的高度稳定性而实现的。虽然发现几个花粉特异性基因的mrna在花粉发育过程中非常稳定,但微阵列数据不支持花粉的积累P5CR拟南芥花粉转录本[26,27].而悬浮培养细胞中部分纯化的拟南芥P5CR蛋白在25°C条件下的半衰期接近1个月。而拟南芥P5CR则在大肠杆菌具有非常相似的稳定性,酶来自大肠杆菌在相同的条件下,半衰期降低了25倍,尽管我们努力减少蛋白质水解降解使用大肠杆菌Lon和OmpT蛋白酶缺乏的菌株。这种显著的稳定性增强了突变配子中有足够的活性P5CR蛋白在突变和野生型分离后完成花粉发育的可能性P5CR减数分裂细胞质分裂中的等位基因,允许正常的受精率。
与此形成鲜明对比的是,P5CS表达是花粉育性的必要条件p5cs1/p5cs2双突变子房即使用野生型花粉受精,产生可育种子的成功率也降低。不孕不育的p5cs1/p5cs2双突变体花粉阻碍纯合子的形成p5cs1/p5cs2双突变胚胎(附加文件2:图S2)。这些结果表明,亲本P5CS mRNA和蛋白的稳定性不足以满足花粉和子房对脯氨酸的高需求。在具有单一功能的植物的花中,缺陷花粉粒不到50%P5CS等位基因表明,一些双突变体花粉在分析开放花药的花粉时已经完全退化,无法再识别。有报道称,在花中,特别是花粉中诱导脯氨酸的特定转运体,但脯氨酸转运显然不能取代配子中由谷氨酸合成的依赖于p5cs的脯氨酸[1].杀伤力的p5cs1/p5cs2双突变花粉进一步表明,没有其他途径产生P5C,如。从鸟氨酸,是充分活跃的发育花粉,以弥补缺乏P5CS表达式。
结论
通过对基因中插入突变体的细致的生理和遗传特性分析P5CS1,P5CS2而且P5CR我们证明了P5CS和P5CR酶活性都是拟南芥有性繁殖成功的必要条件。显然,无论是潜在的替代途径还是脯氨酸的细胞间运输都不能挽救谷氨酸生物合成脯氨酸的缺陷。无菌的对比p5cs1/p5cs2双突变花粉与正常花粉的育性在无功能的情况下P5CR这种基因可以用P5CR蛋白不寻常的稳定性来解释。P5CR-GFP的胞质定位的观察提出了关于脯氨酸胞内分布以及质体在脯氨酸生物合成中的作用的有趣的新问题。
方法
植物材料和生长条件
拟南芥(拟南芥(l)Heynh。,accessionCol-8)和T-DNA插入系从NASC (GABI452_G01,p5cs2-1;Salk_063517,p5cs1-4;Salk_127043,p5cr-1;Salk_098189,p5cr-2)或从INRA凡尔赛资源中心(FLAG_139H07,p5cs2-2).通过PCR和T-DNA侧翼区测序验证T-DNA的存在和等位基因状态。引物序列在附加文件中给出5S1:表。植物按[24].为了选择转基因植物,培养基中添加50 μg/ml卡那霉素、5 μg/ml磺胺嘧啶或10 μg/ml BASTA (Bayer CropScience, Monheim, Germany)。在光照时间为9 h(短昼)或16 h(长昼)的温室中进行种子生产,昼夜温度为21℃/17℃,光子通量密度为100 ~ 200 μmol*m-2*年代-1.模拟[描述的生长条件5],在光照为(300±30 μmol*m) 16 h的培养箱中培养-2*年代-1),昼夜温度为24°C/20°C。
异养(白色)细胞培养在添加3% (w/v)蔗糖、2倍MS维生素混合物、0.5 mg/l 2,4-二氯苯氧乙酸、0.5 mg/l苄基氨基嘌啶和0.2% (v/v)植物防腐剂混合物(植物细胞技术公司,华盛顿特区,美国)的液体MS培养基中,在昏暗的灯光下持续搅拌(100 rpm)。
P5CR-GFP结构和成像
的开放式阅读框P5CR或者包含1700 bp的5 '上游序列的基因组片段和整个P5CR分别从ORF全长克隆U13409 (ABRC, Columbus, OH, USA)或基因组Col-8 DNA进行PCR扩增。PCR引物序列见附加文件5S1:表。通过定向TOPO克隆(life technologies, Carlsbad, CA, USA),纯化得到的PCR片段并整合到pENTR中。随后,插入物从pENTR转移到pEarleyGate103 (CD3-685, ABRC)、pGWB5或pGWB4 [28通过lr -重组(生命技术)。结果结构的序列显示帧内融合P5CR到绿色荧光蛋白基因。拟南芥植物的花浸转化按[29].进行表观荧光成像,如[24].共聚焦显微镜从表达P5CR-GFP的转基因植物和Col-8中分离原生质体,方法参见[24].原生质体或水渗透的叶片在Zeiss LSM 510 Meta共聚焦显微镜(Zeiss, Oberkochen, Germany)上用40倍油浸透镜观察。用共聚焦显微镜的Meta探测器(GFP: 497-550 nm,叶绿素:657-690 nm)依次捕获GFP和叶绿素荧光信号。在ImageJ和Adobe Photoshop中对图像进行叠加,并调整到相同的亮度和对比度设置。整个花是用VHX 500F数码显微镜(Keyence, Osaka, Japan)拍摄的。
胚胎和花粉分析
为了分析胚胎发育缺陷,在立体显微镜下分离未成熟种子,并在水合物氯醛:水:甘油8:3:1 (w:v:v)的混合物中清除。使用差分干涉对比(Nomarski)光学和黑白数码相机捕捉图像。花粉分离方法为:在300mm冰镇甘露醇中用力摇动开放的花朵,12000 g离心1分钟。活力染色按[30.在50°C下保存16小时。染色花粉的图像是用数码彩色相机在100或400倍放大下捕捉到的。
P5CR纯化和酶促测定
植物和细菌细胞均质于冰浆中,加入1g *(g细胞)-1石英砂或2g *(g细胞)-1分别氧化铝。匀浆重悬在冰冷萃取缓冲液(10 mM Tris-HCl pH 7.4, 0.5 mM二硫苏糖醇,0.5 mM EDTA)中,4℃离心10分钟,10000g。蛋白从上清液中沉淀,加入固体硫酸铵至70%饱和,然后离心成球。蛋白颗粒溶解在极少量提取缓冲液中,通过Bio-Gel P6DG柱(Bio-Rad, Hercules, CA, USA)淡化。样品被加载到用提取缓冲液平衡的DEAE-Sephacel (GE Healthcare, Little Chalfont, UK)柱上。大量洗涤后,蛋白质在萃取缓冲液中随着NaCl浓度的增加而洗脱。
通过NADH的p5c依赖性氧化,测定了P5CR的生理正向反应。实验混合物含有100 mM Tris-HCl缓冲pH 7.4, 0.1 mM MgCl22 mM DL-P5C和0.25 mM NADH,最终体积为1 ml。在预热的混合物中加入限制量的酶(0.05-0.25 nkat),在35°C下测定340 nm吸光度的下降,时间长达10分钟,对照P5C已被省略的空白。活性由初始线性速率确定,假设NADH的消光系数为6220 M-1*厘米-1.DL-P5C是由δ-异丙羟赖氨酸(Sigma-Aldrich, St. Louis, MO, USA)的高过酸氧化合成的,并在Dowex AG50(200-400目的)柱上通过阳离子交换层析纯化。
参考文献
李文华,李文华,李文华。植物发育过程中脯氨酸代谢和转运的研究。氨基酸学报,2010,39(4):949-962。10.1007 / s00726 - 010 - 0525 - 3。
脯氨酸:一种多功能氨基酸。植物动态,2010,15(2):89-97。10.1016 / j.tplants.2009.11.009。
Mattioli R, Costantino P, Trovato M:植物脯氨酸积累:不仅仅是胁迫。植物信号行为学报,2009,4(11):1016-1018。10.4161 / psb.4.11.9797。
Funck D, Stadelhofer B, Koch W:鸟氨酸-δ-氨基转移酶是精氨酸分解代谢所必需的,而不是脯氨酸的生物合成。植物生物学杂志,2008,8:40。10.1186 / 1471-2229-8-40。
Mattioli R, Falasca G, Sabatini S, Altamura MM, Costantino P, Trovato M:脯氨酸生物合成基因P5CS1而且P5CS2扮演重叠的角色拟南芥花的转变,但在胚胎发育中没有。植物工程学报,2009,37(1):1 -8。10.1111 / j.1399-3054.2009.01261.x。
Strizhov N, Abraham E, Okresz L, Blickling S, Zilberstein A, Schell J, Koncz C, Szabados L:两个的微分表达式P5CS拟南芥中控制脯氨酸积累的基因需要ABA,受ABA1、ABI1和AXR2调控。植物学报,1997,12(3):557-569。10.1046 / j.1365 - 313 x.1997.00557.x。
Turchetto-Zolet AC, Margis- pinheiro M, Margis R:植物中脯氨酸合成的关键酶吡咯啉-5-羧酸合成酶的进化。中国生物医学工程学报,2009,29(1):381 - 381。10.1007 / s00438 - 008 - 0396 - 4。
Mattioli R, Marchese D, D'Angeli S, Altamura MM, Costantino P, Trovato M:拟南芥细胞内脯氨酸水平的调控对开花时间和花序结构的影响。植物生物学杂志,2008,26(3):388 - 388。10.1007 / s11103 - 007 - 9269 - 1。
Sharma S, Villamor JG, Verslues PE:组织特异性脯氨酸合成和分解代谢在低水势下生长和氧化还原平衡中的重要作用。植物生理学报,2011,29(1):369 - 369。10.1104 / pp.111.183210。
Szekely G, Abraham E, Cseplo A, Rigo G, Zsigmond L, ciszar J, Ayaydin F, Strizhov N, Jasik J, Schmelzer E,等:复制P5CS拟南芥基因在胁迫调控和脯氨酸生物合成发育控制中发挥着独特的作用。植物生态学报,2008,32(1):1- 8。10.1111 / j.1365 - 313 x.2007.03318.x。
Samach A, Onouchi H, Gold SE, Ditta GS, Schwarz-Sommer Z, Yanofsky MF, Coupland G: CONSTANS靶基因在拟南芥生殖发育中的不同作用。科学通报,2000,29(5):514 - 514。10.1126 / science.288.5471.1613。
Abraham E, Rigo G, Szekely G, Nagy R, Koncz C, Szabados L:油菜素内酯抑制脱落酸和盐胁迫对拟南芥脯氨酸生物合成的光依赖性诱导。植物生物学杂志,2003,31(3):363-372。10.1023 /: 1022043000516。
Fabro G, Kovacs I, Pavet V, Szabados L, Alvarez ME:脯氨酸积累和AtP5CS2拟南芥植物-病原不相容相互作用诱导基因激活。植物生态学报,2004,17(4):343-350。10.1094 / MPMI.2004.17.4.343。
南条T,小林M,吉叶Y, Sanada Y,和田K, Tsukaya H, Kakubari Y, Yamaguchi-Shinozaki K, Shinozaki K:反义转基因中脯氨酸在形态发生和渗透耐性中的生物学功能拟南芥.植物学报,1999,18(2):185-193。10.1046 / j.1365 - 313 x.1999.00438.x。
Meinke D, Muralla R, Sweeney C, Dickerman A:识别重要基因拟南芥.植物动态,2008,13(9):483-491。10.1016 / j.tplants.2008.06.003。
Forlani G, Occhipinti A, Berlicki L, Dziedziola G, Wieczorek A, Kafarski P:为植物P5C还原酶量身定制氨基二膦酸盐结构。农业食品化学,2008,56(9):3193-3199。10.1021 / jf800029t。
华晓娟,Van de Cotte B, Van Montagu M, Verbruggen N:拟南芥吡咯啉-5-羧酸还原酶基因表达的发育调控。植物生理学报,2003,21(4):366 - 366。10.1104 / pp.114.4.1215。
华新军,Van de Cotte B, Van Montagu M, Verbruggen N: 5’非翻译区域At-P5R基因参与转录和转录后调控。植物学报,2001,26(2):157-169。10.1046 / j.1365 - 313 x.2001.01020.x。
Rayapati PJ, Stewart CR, Hack E:吡咯啉-5-羧酸还原酶存在于豌豆(Pisum sativum L.)叶片叶绿体中。植物生理学报,2004,24(2):381 - 381。10.1104 / pp.91.2.581。
邵志平,苗光华,洪志,魏玛。大豆根/根瘤和叶片中δ1-吡罗啉-5-羧酸还原酶亚细胞定位。植物生理学报,2003,21(4):449 - 449。10.1104 / pp.99.4.1642。
种子基因项目。http://seedgenes.org.
Eady C, Lindsey K, Twell D:双细胞和三细胞花粉的花粉启动子的差异激活和保守的营养细胞特异性活性。植物学报,1994,5(4):543- 551。10.1046 / j.1365 - 313 x.1994.5040543.x。
Deuschle K, Funck D, Forlani G, Stransky H, Biehl A, Leister D, van der Graaff E, Kunze R, Frommer WB: δ1-吡咯-5-羧酸脱氢酶在脯氨酸降解中的作用。植物学报,2004,16(12):3413-3425。10.1105 / tpc.104.023622。
芬克D, Eckard S, Müller G:拟南芥两种脯氨酸脱氢酶异构体的非冗余功能。植物生物学杂志,2010,10:70。10.1186 / 1471-2229-10-70。
Miller G, Honig A, Stein H, Suzuki N, Mittler R, Zilberstein A:利用脯氨酸氧化酶的解耦表达分解植物中δ1-吡啶-5-羧酸-脯氨酸循环。中国生物医学工程学报,2009,29(4):369 - 369。10.1074 / jbc.M109.009340。Epub 22009 7月26427。
Ylstra B, McCormick S:花粉发育和BY2细胞mRNA稳定性的分析。植物学报,1999,20(1):101-108。10.1046 / j.1365 - 313 x.1999.00580.x。
追溯:拟南芥eFP浏览器。http://bar.utoronto.ca/efp.
Nakagawa T, Kurose T, Hino T, Tanaka K, Kawamukai M, Niwa Y, Toyooka K, Matsuoka K, Jinbo T, Kimura T:用于实现植物转化融合基因高效构建的一系列网关二进制载体pgwb的开发。中国生物工程学报,2004,23(1):37。10.1263 / jbb.104.34。
Clough SJ,弯曲AF:花浸:一个简化的方法农杆菌属介导的变换拟南芥.植物学报,1998,16(6):735-743。10.1046 / j.1365 - 313 x.1998.00343.x。
Alexander MP:败花粉和未败花粉的差异染色。染色技术,1996,44(3):117-122。
确认
作者要感谢Silvia Kuhn, Roswitha Miller和Mattia Duò对实验室的帮助,以及康斯坦茨大学的园丁对植物的出色照顾。Veit Dörken和康斯坦茨大学生物成像中心在数字成像方面提供了帮助。我们感谢Iwona Adamska, Manuela Perthold和Doris Rentsch对手稿的批判性阅读。Iwona Adamska和康斯坦茨大学为这项研究提供了物质和资金支持。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们没有竞争利益。
作者的贡献
DF设计了这项研究,并执行或监督了大部分实验。GW制作共聚焦图像,LB分析生长和开花时间,GF分离并测定P5CR酶。所有作者都对手稿做出了贡献,并批准了最终版本。
电子辅料
12870 _2012_1119_moesm1_esm.pdf
额外的文件1:图S1。纯合子的发育缺陷p5cs2突变体。答:在短日照条件下栽培的五周植物。B:两周龄苗在含30mm蔗糖的半强度MS培养基上轴生培养。(PDF 9 MB)
12870 _2012_1119_moesm2_esm.pdf
额外的文件2:图S2。遗传图p5cs1/p5cs2双杂合的突变体。一个表明野生型P5CS2等位基因;一个显示p5cs2突变等位基因;B显示野生型P5CS1等位基因;b表示p5cs1突变等位基因;绿色阴影表示T-DNA插入介导的抗除草剂能力p5cs2突变等位基因;粉红色阴影表示不存活的配子或胚;孵化出的粉红色阴影表明,由于花粉不存活,将无法观察到各自的后代。注意粗黑线为杂合子的遗传图p5cs2单突变体,而红线划定的是杂合子的后代p5cs2另外与a纯合的突变体p5cs1突变。(PDF 715 KB)
12870 _2012_1119_moesm3_esm.pdf
额外的文件3:图S3。P5CR-GFP在胚胎中的表达。分离胚胎的荧光和亮场图像以假颜色显示。纯合子的胚胎p5cr-2突变株补充pGWB4-P5CR,包含本地P5C启动子与基因融合绿色荧光蛋白.E-H:由pGWB5-转化的col8野生型植株胚P5CR,表达P5CR的互补融合,绿色荧光蛋白由CaMV-35S启动子控制。I-L: col8野生型植物的胚胎。比例尺= 20 μm。(PDF 5 MB)
12870 _2012_1119_moesm4_esm.pdf
额外的文件4:图S4。P5CR-GFP的亚细胞定位和互补p5cr-1突变体。A-D:纯合子的表观荧光图像p5cr-1表达P5CR-GFP融合蛋白的突变体P5CR启动子。A-C:表皮和海绵薄壁组织细胞;比例尺= 20 μm。GFP荧光。B:绿色荧光蛋白和叶绿素荧光的叠加。C:同一区域的Brightfield图像。D:表达P5CR-GFP的根尖(左)与非转基因根尖的比较,GFP荧光亮场图像叠加,比较尺= 50 μm。E: pGWB4中用于补充的DNA结构的示意图p5cr与野生型相比的突变体P5CR基因。箭头表示用于确定补充突变体基因型的引物的结合位点(见图I)。F-H: pEG103-转化野生型植物表皮和海绵状薄壁组织细胞的表观荧光图像P5CR.注意,这种结构的过表达导致胞质蛋白聚集的形成;比例尺= 20 μm。F: GFP荧光。G:绿色荧光蛋白和叶绿素荧光的叠加。H:同一区域的Brightfield图像。我:PCR-genotyping的p5cr-1pGWB4-突变体补充P5CR.的基因组和转基因拷贝中的引物结合位点见图EP5CR.J: P5CR-GFP过表达的pEG103和pGWB5结构示意图。(PDF 3 MB)
权利和权限
本文由BioMed Central Ltd.授权发布。这是一篇开放获取文章,根据创作共用授权协议(http://creativecommons.org/licenses/by/2.0),它允许在任何媒体上不受限制地使用、分发和复制,只要原著被恰当地引用。
关于这篇文章
引用这篇文章
芬克,D,温特,G,鲍姆加滕,L。et al。拟南芥生殖发育过程中脯氨酸合成的需求。BMC植物杂志12,191(2012)。https://doi.org/10.1186/1471-2229-12-191
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-12-191
关键字
- 脯氨酸代谢
- 配子和胚胎发育
- 酶的稳定性
- 亚细胞定位