- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
低甲基化的种群gydF4y2Ba芸苔属植物拉伯gydF4y2Ba用于正向和反向表观遗传学gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba12gydF4y2Ba文章编号:gydF4y2Ba193gydF4y2Ba(gydF4y2Ba2012gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
附加在真核生物染色体DNA序列上的表观遗传标记在调节基因表达、本体论和对环境的响应方面提供了灵活性和可塑性。调控胞嘧啶的甲基化状态可以产生外等位基因,这些外等位基因已经在一些植物系统的特定位点上被检测和表征,并有可能产生新的和相对稳定的表型。目前还没有系统的尝试去探索和利用等位基因外变异,从而扩大作物改良中可供选择的表型范围。我们开发了一种通过扰动DNA甲基化状态来生成新的外等位基因的方法。氮杂胞苷(5- azac)提供选择性靶向gydF4y2Ba5米gydF4y2BaCG,在植物中与外显子DNA相关。使用5-AzaC的靶向化学干预比甲基转移酶的转基因或突变调节具有优势,允许在基因组中随机生成外等位基因。gydF4y2Ba
结果gydF4y2Ba
我们展示了随机化学诱导的低甲基化的潜力,为作物改良产生新的和有价值的变异。5-AzaC的剂量效应系统分析gydF4y2Bab·拉伯gydF4y2Ba自交随机低甲基化群体的引导生成,用于几个农艺性状的正向筛选。一些性状的剂量反应呈s型,与EMS等化学诱变剂的剂量反应相似。我们证明了一些表现型的跨代遗传。BraRoAZ是一个独特的低甲基化群体,有1000个E2同胞系。与未处理的对照相比,5-Aza c处理的系显示出较低的免疫染色gydF4y2Ba5米gydF4y2BaC和甲基化敏感扩增多态性(MSAP)的差异和多样性。在这些品系之间,种子产量和组成性状的表型变异是一致的,包括种子蛋白质含量增加,含油量减少,芥酸减少,相应的亚油酸和/或棕榈酸增加。每一个5- azac处理的系代表一个独特的低甲基化外等位基因组合。gydF4y2Ba
结论gydF4y2Ba
所开发的方法和种群可用于等位基因外变异的正向和反向筛选以及后续的功能和遗传研究。随机低甲基化群体的产生在广泛的作物植物表观等位基因发现中具有实用价值,并有相当大的潜力作为作物改良的干预策略。gydF4y2Ba
背景gydF4y2Ba
附加在真核生物染色体DNA序列上的表观遗传标记在调节基因表达、本体论和对环境的响应方面具有灵活性和可塑性。这些标记影响染色质结构,包括DNA的胞嘧啶甲基化和组蛋白的修饰。表观等位基因已在几种植物系统的特定位点上被检测到并被表征,这是由于DNA甲基化的特定位点或全球模式的变异或作为组蛋白变体而产生的[gydF4y2Ba1gydF4y2Ba].一些gydF4y2Ba新创gydF4y2Ba外等位基因可以在几代之间赋予新的遗传表现型[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba].越来越多的证据表明,许多作物的农艺性状可能在一定程度上受到稳定遗传的表观遗传修饰的影响[gydF4y2Ba3.gydF4y2Ba- - - - - -gydF4y2Ba5gydF4y2Ba].gydF4y2Ba
在过去的一个世纪里,无意的外等位基因变异选择在多大程度上促进了通过选择性育种实现的作物产量或质量的主要提高,这仍然是一个谜。虽然外等位基因有可能产生新的和相对稳定的表现型[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba6gydF4y2Ba],到目前为止,还没有系统的尝试来探索和利用等位基因外变异,从而扩大可用于作物改良选择的表型范围。利用表观遗传变异的范围被最近的发现证明了DNA甲基化和能量利用效率的选择之间的联系gydF4y2Ba芸苔属植物gydF4y2Ba油料作物(gydF4y2Ba4gydF4y2Ba],以及拟南芥的磷酸盐饥饿反应与组蛋白H2A模式之间的相互作用。Z表观遗传标记[gydF4y2Ba5gydF4y2Ba].H2A。Z被排除在活性转录基因中DNA重甲基化位点[gydF4y2Ba7gydF4y2Ba].组织monoallelicgydF4y2Ba新创gydF4y2BaDNA甲基化gydF4y2BaSP11gydF4y2Ba基因内的gydF4y2Ba芸苔属植物拉伯gydF4y2Ba花粉self-incompatibility轨迹gydF4y2Ba年代gydF4y2Ba已被证明有助于s等位基因之间的优势关系[gydF4y2Ba8gydF4y2Ba].在拟南芥中,由DNA甲基化和组蛋白化学变化介导的印迹状态影响春化和开花时间[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba],胚胎发育[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba和种子大小[gydF4y2Ba11gydF4y2Ba].gydF4y2Ba
DNA甲基化是由一组直接催化甲基化过程或间接影响甲基化状态的基因调控的gydF4y2Ba通过gydF4y2Ba染色质重塑。在哺乳动物和其他后生动物中,这主要是通过gydF4y2BaDNA甲基转移酶1gydF4y2Ba(gydF4y2BaDNMT1gydF4y2Ba)编码负责gydF4y2Ba5米gydF4y2BaC的维护,gydF4y2Ba结构域重新排列甲基化酶1gydF4y2Ba(gydF4y2BaDRM1gydF4y2Ba)编码负责gydF4y2Ba新创gydF4y2BaCG位点的甲基化。植物与动物相比,在DNA甲基化的靶点、分布和传播方面存在差异。拟南芥的gydF4y2BaDNA METHYLTRANFERASE 1gydF4y2Ba(gydF4y2BaMET1gydF4y2Ba)是催化CG环境中胞嘧啶甲基化所必需的,从而导致gydF4y2Ba5米gydF4y2BaCG (gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba],而染色质重塑因子gydF4y2BaDNA甲基化减少1gydF4y2Ba(gydF4y2BaDDM1gydF4y2Ba)是维持CG和CHG位点DNA甲基化所必需的[gydF4y2Ba15gydF4y2Ba].gydF4y2Ba
DNA甲基化的特定模式可以通过有丝分裂和细胞谱系进行传递,也可以通过减数分裂进行传代gydF4y2BaMET1gydF4y2Ba[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba].等位基因外变异的稳定性已在许多植物系统中得到证实,包括gydF4y2Ba芸苔属植物显著gydF4y2Ba[gydF4y2Ba18gydF4y2Ba].在拟南芥中,已建立的epiRILs对花期和株高具有较高的变异和遗传力,并且多个亲本DNA甲基化变异至少可稳定遗传8代[gydF4y2Ba19gydF4y2Ba].随后的表型分析表明,许多适应度性状具有遗传变异[gydF4y2Ba20.gydF4y2Ba].拟南芥DNA甲基化的全基因组分析表明,CG位点往往是编码序列中的靶点[gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba].最近,人们发现这些标记优先与外显子相关[gydF4y2Ba23gydF4y2Ba].gydF4y2Ba
产生新的外等位基因的一种方法是扰乱DNA甲基化状态[gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba].这可能包括基因组中DNA甲基转移酶和其他甲基化调节因子的异位、组织特异性或诱导沉默。在拟南芥中,下调gydF4y2BaMET1gydF4y2Ba结果导致了广泛的异常表型,包括植物身高下降,更小的圆形叶,育性下降和顶端优势降低[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba14gydF4y2Ba].虽然这为胞嘧啶甲基化的作用提供了有价值的见解(gydF4y2Ba5米gydF4y2BaC)在基因功能和发育方面,有弊端gydF4y2Bamet1gydF4y2Ba作物改良背景下的突变体,由于基因组内表观遗传标记的广泛重新模式。然而,与传统的功能基因分析一样,有可能揭示一系列可能支持特定基因或性状的表观遗传调节的变异。通过探索与特定目标基因(逆向表观遗传学)或表型性状(正向表观遗传学)相关的一系列外等位基因,这种方法将变得更加便利。gydF4y2Ba
靶向化学干预,使用去甲基化剂,如5-氮胞苷(5-AzaC),提供了一种替代转基因或突变调制gydF4y2BaMET1gydF4y2Ba.5-AzaC是核苷胞苷的结构类似物,在环结构的第5个位置以氮原子取代碳原子[gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba].它是一种有效的DNA甲基转移酶抑制剂,已被证明可有效逆转肿瘤抑制基因的高甲基化和抑制癌症特异性细胞表型[gydF4y2Ba26gydF4y2Ba,gydF4y2Ba28gydF4y2Ba- - - - - -gydF4y2Ba31gydF4y2Ba].由于5-AzaC干扰MET1,有选择性靶向gydF4y2Ba5米gydF4y2BaCG,在植物中与外显子DNA相关。使用5-AzaC相比直接下调gydF4y2BaMET1gydF4y2Ba包括目标位点的随机低甲基化的可能性,而不是广泛的低甲基化,后者可能掩盖更微妙和有价值的表型,或导致致命的外等位基因。这为筛选特定的外等位基因提供了机会,然后这些外等位基因可以稳定地渗透到野生型背景中。自然产生的外等位基因最近被证明出现在玉米的近等基因系中,并表现出相对稳定的遗传[gydF4y2Ba32gydF4y2Ba].gydF4y2Ba
在许多多倍体起源的作物植物中,通过产生新的外等位基因进行表观遗传干预可能特别容易处理,因为在这些作物植物中有额外的对偶或同源特异基因调控的空间。维持非致死变异的能力从EMS TILLING群体可获得的较高突变负载可见一斑gydF4y2Bab·拉伯gydF4y2Ba[gydF4y2Ba33gydF4y2Ba),gydF4y2Ba显著gydF4y2Ba[gydF4y2Ba34gydF4y2Ba和小麦[gydF4y2Ba35gydF4y2Ba].属内物种gydF4y2Ba芸苔属植物gydF4y2Ba已被驯化为种类繁多的蔬菜、油料、饲料和调味品作物[gydF4y2Ba36gydF4y2Ba],包括萝卜、大白菜、小白菜、青花菜、沙参和萝卜gydF4y2Bab·拉伯gydF4y2Ba(一个基因组,n=10)和卷心菜,花椰菜,西兰花,球芽甘蓝gydF4y2Bab . oleraceagydF4y2Ba(C基因组,n = 9)。A基因组在植物的双二倍体中基本保持完整gydF4y2Ba显著gydF4y2Ba(AC基因组,n=19)产生主要作物油菜、油菜和瑞典菜/芜菁甘蓝和芥菜/褐芥gydF4y2Bab . junceagydF4y2Ba(AB基因组,n = 18)。原因尚不清楚gydF4y2Ba芸苔属植物gydF4y2Ba物种有能力产生如此广泛的形态形式,尽管这被归因于基因复制、基因组间杂合性和表观遗传现象[gydF4y2Ba37gydF4y2Ba- - - - - -gydF4y2Ba39gydF4y2Ba].在全基因组亚硫酸氢盐测序缺乏直接证据的情况下,估计的gydF4y2Ba5米gydF4y2BaC内的甲基化gydF4y2Ba芸苔属植物gydF4y2Ba基于免疫沉淀,估计基因组中有16%的胞嘧啶[gydF4y2Ba40gydF4y2Ba],以及甲基化敏感扩增多态性(MSAP)对16-57%的靶点进行估计[gydF4y2Ba40gydF4y2Ba- - - - - -gydF4y2Ba42gydF4y2Ba].gydF4y2Ba
在这里,我们展示了随机化学诱导的低甲基化的潜力,为作物改良产生新的和有价值的变异。我们系统地优化了5-AzaC的表型剂量响应gydF4y2Bab·拉伯gydF4y2Ba并证明了一些表现型的跨代遗传。然后,我们利用这些信息生成一个随机的低甲基化群体,该群体自交并对包括种子大小和组成在内的许多农艺性状进行特征描述。我们展示了分布的变化gydF4y2Ba5米gydF4y2Ba粗线期染色体的常染色质C, MSAP谱的变化和转录组的改变。所开发的方法和种群可用于等位基因外变异的正向和反向筛选以及后续的功能和遗传研究。gydF4y2Ba
结果gydF4y2Ba
植物表型对5-AzaC低甲基化具有s型剂量响应gydF4y2Ba
在种子吸胀过程中,研究了植物暴露于不同浓度的5-AzaC(水分控制,0.01mM, 0.10mM, 0.50mM, 1.00mM和1.50mM)后的剂量响应,通过检测植物发育过程中的一系列表型性状。gydF4y2Ba
E1种子在浓度达到1.0mM的5-AzaC中浸泡后,萌发率没有显著影响(p>0.05),但在1.5mM的浸泡后萌发率有小幅但显著下降(至98%)(p≤0.05)。在发育的早期阶段,在身高和生长速度方面有明显的总体表型差异(图gydF4y2Ba1gydF4y2Ba).5-AzaC浓度在0.1mM以上时,植株生长明显受阻gydF4y2Ba1gydF4y2Ba:图S1和图gydF4y2Ba1gydF4y2Baa).部分未能长出真叶的幼苗根系发育不良,植株身高显著降低。gydF4y2Ba
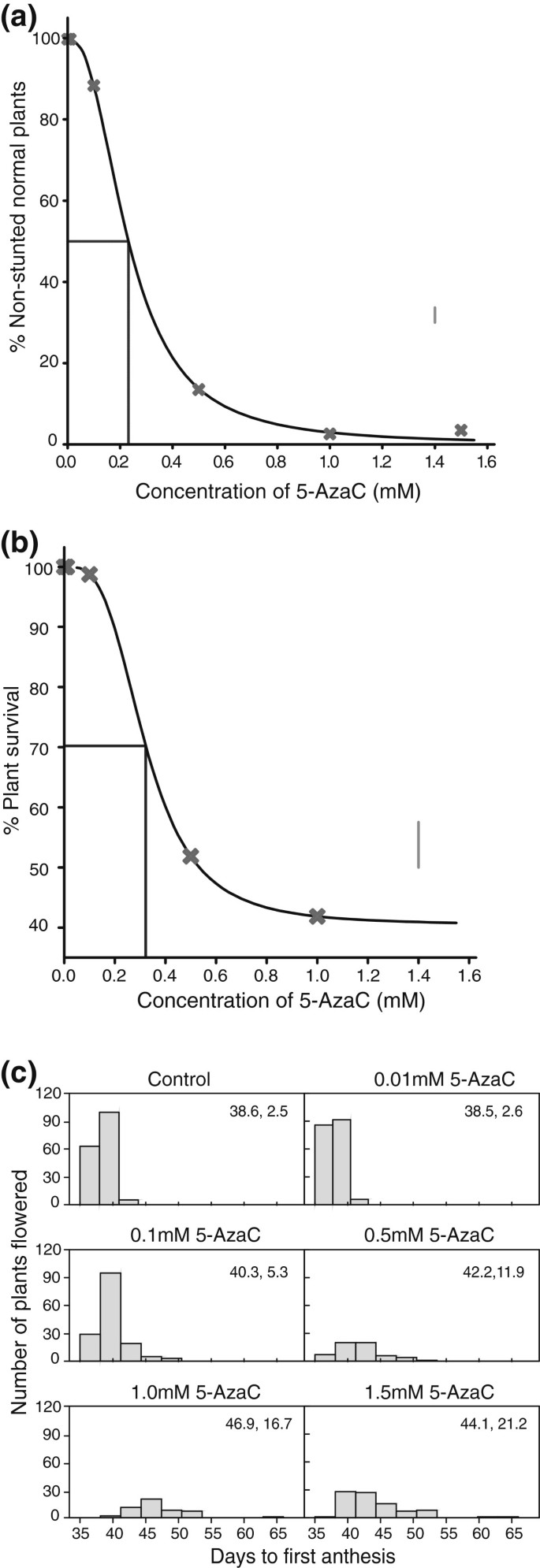
表型的反应gydF4y2Bab·拉伯gydF4y2BaE1代R-o-18至5-AzaC处理gydF4y2Ba.gydF4y2Ba画在曲线上的线表示在正常植物中减少50%的剂量。1.4mM处的垂直线表示LSD(5%)值,用于平均值比较。图中的点(gydF4y2Ba一个gydF4y2Ba)和(gydF4y2BabgydF4y2Ba)表示在每个浓度下四个重复观测的平均值。(gydF4y2Ba一个gydF4y2Ba)播种后20天植株身高剂量响应曲线。画在曲线上的线表示在估计的(显著的,p≤0.05)下渐近线下,使存活率降低50%的总可能降低浓度。1.4mM处的垂直线表示LSD(5%)值,用于平均值比较。(gydF4y2BabgydF4y2Ba)播种后60天的生存曲线。(gydF4y2BacgydF4y2Ba第一次开花前的天的频率分布。平均值和方差显示在每个面板的右上角。gydF4y2Ba
对第一次开花的天数有显著影响(图gydF4y2Ba1gydF4y2Bac和附加文件gydF4y2Ba1gydF4y2Ba:图S2), 0.1毫米及以上(p < 0.05)。总体上,随着5-AzaC浓度的增加,花期天数增加。随着5-AzaC浓度的增加,开花天数的差异也增加。在较高的5-AzaC浓度下,花粉产量降低,花药缺陷发生率增加,尽管所有具有似乎活花粉的植物至少都能结实一些种子。然而,随着5-AzaC浓度的增加,种子的结实率和种子重量总体上有所下降gydF4y2Ba1gydF4y2Ba和额外的文件gydF4y2Ba1gydF4y2Ba:图S3)。gydF4y2Ba
暴露于5-AzaC的影响也延续到子代。E2种子萌发率有轻微但显著的降低(p≤0.05);在1.0 mM - 5-AzaC及以上浓度时下降至92%。在0.5 mM 5-AzaC条件下,与35天开花的对照种子相比,E2组的第一次开花时间缩短了2.8天(p≤0.01)。部分E2植株也表现出叶绿素扇形。gydF4y2Ba
仔细分析两条剂量-反应曲线(图gydF4y2Ba1gydF4y2Ba一个和gydF4y2Ba1gydF4y2Bab,与异常表型和存活率相关)允许选择最佳浓度的5-AzaC来产生低甲基化的群体gydF4y2Bab·拉伯gydF4y2Ba(图gydF4y2Ba1gydF4y2Baa, b)。这两种曲线均不存在显著(p > 0.05)的数据拟合不足。该测试基于对图中数据的共24次观察gydF4y2Ba1gydF4y2Baa(在6种浓度下各有4次重复观测),图中的数据有20次观测gydF4y2Ba1gydF4y2BaB(按5种浓度重复4次)。浓度为0.23 mM时,不超过50%的植物表现出身高和/或生长速度降低的表型(图gydF4y2Ba1gydF4y2Baa).在浓度为0.32 mM 5-AzaC时,约70%的种群有望存活(图gydF4y2Ba1gydF4y2Bab);在估计的(显著的,p≤0.05)下渐近线下,这种浓度使生存率降低了总可能降低的50%。因此,我们采用0.25 mM和0.30mM浓度的5-AzaC来生成BraRoAZ群体。gydF4y2Ba
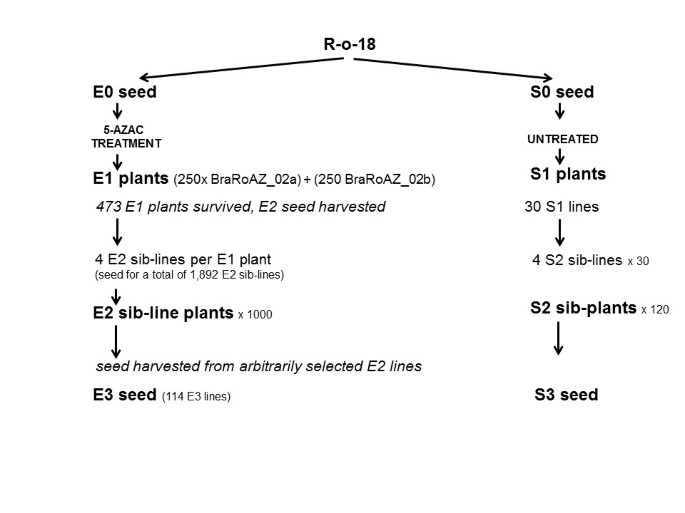
BraRoAZ DNA低甲基化群体(E1 ~ E3)的建立gydF4y2Ba
确定了合适的5-AzaC浓度,可以产生一个由植物组成的群体,这些植物可能是可育的,产生好种子,同时也显示出遗传表型效应,然后我们应用这些浓度建立了低甲基化的E1群体gydF4y2Bab·拉伯gydF4y2Ba行R-o-18 (BraRoAZ)。分别从0.30mM和0.25mM的5-AzaC种子处理中建立了两个亚群体(BraRoAZ_02a和BraRoAZ_02b),每个亚群体包含250株植物(图gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
共收获了1892个E2兄弟系的种子。E1植株与对照(未处理)植株的表型比较(图gydF4y2Ba3.gydF4y2Ba)允许选择1000个E2兄弟系(每个原始处理500个)(图gydF4y2Ba2gydF4y2Ba),以评估E2代。这相当于每处理50株原始E1植株,其中在存活率、开花时间、株高、次生分枝和花形态方面观察到非典型变异(即超出WT对照所见)。gydF4y2Ba
从473个E1系和30个对照(未处理亲本)系中收获E2自交种子。对于每一株E1植物,从初级花序中间的三个独立的角果中收获和独立储存种子。此外,将每株植物剩余的角果种子汇集在一起。每个种子源使用一个种子生成E3代。因此,每个E1植株有4个独特的E2种子(E2兄弟系)(图gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
总体而言,E2植株的形态表型变异水平低于E1植株,但仍高于对照植株。然而,我们确实观察到较低的分裂频率,植株身高降低,叶片变小,花药缺陷,胚胎流产,种子数量和种子大小减少。gydF4y2Ba
接下来,我们从随机选择的114个E2兄弟系(从1000个生长的)中收获自交种子,对应28个原始E1植物,生成E3种群。从一个选定的穗子中收获种子并独立储存,其余种子放在池中。与对照相比,这些植物保持了更高的变异,尽管小于E1。gydF4y2Ba
DNA甲基化模式的变异性gydF4y2Ba
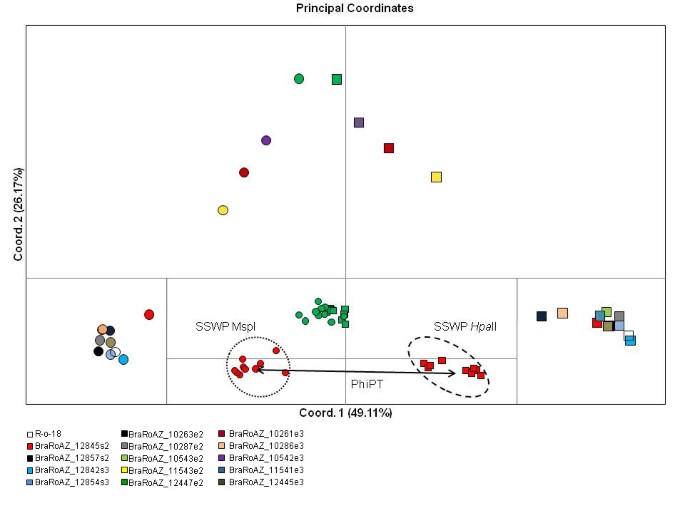
MSAP分析用于评估治疗对整体甲基化谱的影响程度。分析基于S2、E2和E3各5个品系和2个S3品系的10个种子样本。5-AzaC抑制甲基转移酶活性的能力导致了对甲基化敏感性的预期gydF4y2Ba下丘脑-垂体-肾上腺轴的gydF4y2Ba二世和gydF4y2BaMspgydF4y2Ba我在未处理的样本中会出现分歧(因为甲基化会不成比例地影响前一个图谱),但在处理过的样本中会收敛(因为DNA模板缺乏导致差异的甲基化)。正如预期的那样,主坐标分析(PCoA)显示出了显著的差异gydF4y2Ba下丘脑-垂体-肾上腺轴的gydF4y2Ba二世和gydF4y2BaMspgydF4y2Ba所有未处理样本的I型剖面(图gydF4y2Ba4gydF4y2Ba).然而,处理过的品系之间的行为有相当大的差异。来自E2代和E3代的4个处理品系(BraRoAZ_11543e2, BraRoAZ_12447e2, BraRoAZ_10261e3, BraRoAZ_10542e3)与未处理对照相比,酶谱的区分能力显著下降(图gydF4y2Ba4gydF4y2Ba).相反,其余处理系之间保留了很大的差异gydF4y2Ba下丘脑-垂体-肾上腺轴的gydF4y2Ba二世和gydF4y2BaMspgydF4y2BaI型剖面,因此与未处理的控制线难以区分(图gydF4y2Ba4gydF4y2Ba).这些差异的显著性通过AMOVA的PhiPT来估计。在这里,同样的四条线单独产生了足够低的PhiPT值,从而推断出非显著的差异gydF4y2Ba下丘脑-垂体-肾上腺轴的gydF4y2Ba二世和gydF4y2BaMspgydF4y2Ba我的概要文件(0.1642 < P > 0.0006)。所有剩下的行产生gydF4y2Ba下丘脑-垂体-肾上腺轴的gydF4y2Ba二世和gydF4y2BaMspgydF4y2BaI型剖面高度显著差异(P=0.0001)(附加文件gydF4y2Ba2gydF4y2Ba:表S2)。gydF4y2Ba
5-Azac对表观遗传不稳定性的影响gydF4y2Ba.gydF4y2Ba利用引物组合H2/E1和H3/E3对甲基化敏感扩增多态性(MSAP)进行欧氏分析的主坐标分析(PCoA)。植物纹路以颜色标示,如键所示,并以正方形符号(gydF4y2Ba下丘脑-垂体-肾上腺轴的gydF4y2BaII)和圆(gydF4y2BaMspgydF4y2Ba我)。gydF4y2Ba一个gydF4y2Ba)主图,PCoA显示每组的平均表观遗传距离;gydF4y2BabgydF4y2Ba)嵌套图,所有样本在行BraRoAZ_12447e2和BraRoAZ_12845s2中的表观遗传距离。圆内欧几里得空间表示控制线BraRoAZ_12845s2使用的种群内变异(即SSWP)gydF4y2Ba下丘脑-垂体-肾上腺轴的gydF4y2Ba二世(虚线)和gydF4y2BaMspgydF4y2Ba我(虚线)。箭头表示受限制的BraRoAZ_12845e2样本之间的表观遗传距离gydF4y2Ba下丘脑-垂体-肾上腺轴的gydF4y2Ba二或gydF4y2BaMspgydF4y2Ba我(PhiPT)。gydF4y2Ba
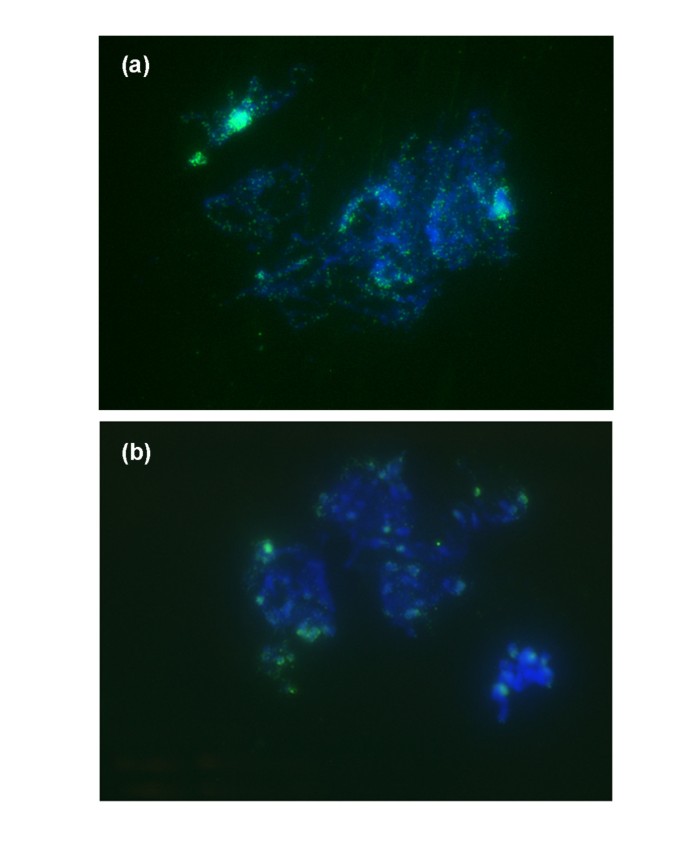
我们评估了空间分布gydF4y2Ba5米gydF4y2Ba在对照S2系和4个BraRoAZ_E2系的减数分裂粗线传播中,通过免疫标记在染色体中表达C。集群的gydF4y2Ba5米gydF4y2BaC信号在对照植株和BraRoAZ_E2植株中均与异色区域共定位,但在BraRoAZ_E2植株的常染色质内显著减少(图gydF4y2Ba5gydF4y2Ba).gydF4y2Ba
低甲基化影响种子大小和其他产量组成部分gydF4y2Ba
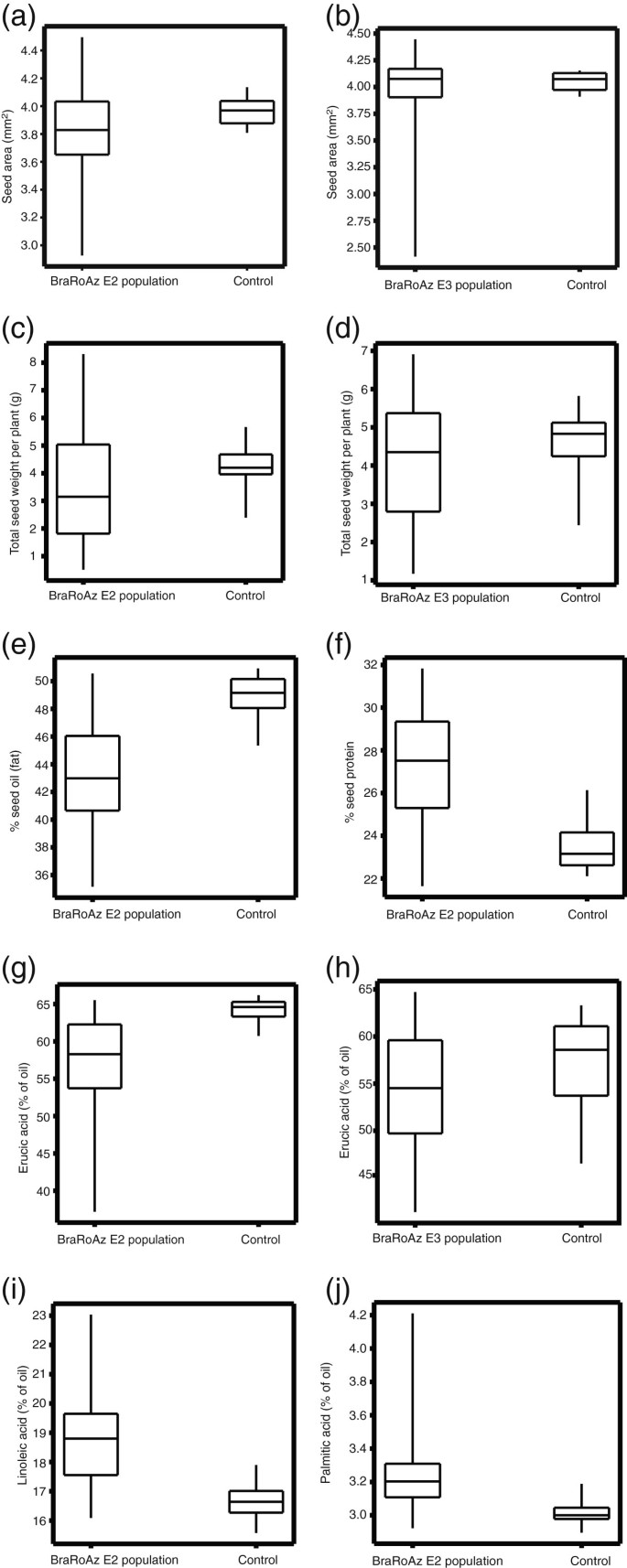
接下来,我们研究了种子形态和组成的重要农艺方面是否因处理而发生了改变。种子大小是由种子在剖面上的面积间接推断出来的。BraRoAZ E2株系种子平均为0.14mmgydF4y2Ba2gydF4y2Ba(SE 0.040)小于S2对照gydF4y2Ba6gydF4y2Ba一个;1 df上Wald统计值= 11.97;p < 0.001)。BraRoAZ E2系的系间变异分量(方差= 0.125)大于对照R-o-18 S2兄弟系(方差= 0.009,与1 df上的一般方差= 40.4相比,变异变化P<0.001)。同样,BraRoAZ E2系种子间的差异(方差= 0.122)大于对照r -o- 18s2兄弟系(方差= 0.083,与1 df上的一般方差= 40.4相比,偏差的变化P<0.001),并且BraRoAZ E2系的一个子系种子大小的变化范围更大。与S3对照相比,BraRoAZ E3系也有更大的种子大小范围gydF4y2Ba5gydF4y2Bab).在亲本系和对照系中,未发现种子大小与每角果种子数之间存在相关性。gydF4y2Ba
BraRoAZ E2和E3居群与对照S2或S3居群的种子大小和组成性状差异的箱线图gydF4y2Ba.gydF4y2Ba一个gydF4y2Ba),gydF4y2BabgydF4y2Ba) E2群体与S2对照和E3群体与S3对照分别记录的种子面积。gydF4y2BacgydF4y2Ba),gydF4y2BadgydF4y2Ba)表示E2和E3居群的单株总种子重。gydF4y2BaegydF4y2Ba)与S2相比,E2记录的总油含量占干重的百分比。gydF4y2BafgydF4y2Ba)与S2相比,E2记录的总蛋白质占干重的百分比。gydF4y2BaggydF4y2Ba),gydF4y2BahgydF4y2Ba)用近红外光谱法测定E2和E3的芥酸占总籽油的百分比。gydF4y2Ba我gydF4y2Ba)亚油酸中E2比S2和增加gydF4y2BajgydF4y2Ba)与S2对照相比,E2中棕榈酸占总油含量的%。gydF4y2Ba
BraRoAZ_E2和BraRoAZ_E3群体的种子产量比相应的S2和S3群体的变化要大得多gydF4y2Ba6gydF4y2Bac, d)。我们分析了100个E2品系的一个子集,发现产量最高的10个品系中有7个品系分枝过多(对着主茎的腋生分枝数量增加),而其余90个品系中有9个品系分枝过多。单株种子产量表现出较强的相关性(rgydF4y2Ba2gydF4y2Ba=0.94),这可能是分枝增加和/或肥力增加的直接结果。然而,观察到的种子大小的变化与种子产量(r= - 0.12)和单株种子数(r= - 0.32)相关性很差。这表明处理对种子大小的影响可能独立于对其他产量组成部分的影响。gydF4y2Ba
种子成分gydF4y2Ba
BraRoAZ E2兄弟系产生的种子总含油量较低(图gydF4y2Ba6gydF4y2Bae;E2=43.1%, S2=48.9%, Wald统计值在1 df上= 5261.3,P<0.001),总蛋白含量较高(图gydF4y2Ba6gydF4y2Baf;E2=27.2%, S2=23.4%, Wald统计值在1 df上= 4475.4,P<0.001)高于S2对照组。对于这两个组分,在BraRoAZ_E3人群中有相似的变异范围。gydF4y2Ba
与对照组相比,BraRoAZ E2人群中个体脂肪酸比例的变化有所增加(图gydF4y2Ba6gydF4y2Bag, l, j)。在BraRoAZ E3人群中,我们观察到类似的,但更明显的变异性,尽管这里,在S3控制线中也观察到增加的传播,可能表明更大的GxE相互作用(图gydF4y2Ba6gydF4y2Ba总的来说,大多数处理品系的棕榈酸(E3=3.24%, S3=3.15%, Wald统计值= 60.2 (1 df)和亚油酸(E3=19.45%, S3=18.82%, Wald统计值= 88.2 (1 df), P<0.001)增加,而芥酸(E3=54.19%, S3=57.56%, Wald统计值= 629.9 (1 df), P<0.001)减少。对单个脂肪酸的线均值之间的成对关系的检查使我们能够推断,低甲基化可能在脂肪酸延伸和/或侧链修饰中有针对性的特定步骤[gydF4y2Ba43gydF4y2Ba].例如,芥酸与亚油酸的负相关(r=−0.88)是一致的[gydF4y2Ba43gydF4y2Ba的上调gydF4y2BaFAD2gydF4y2Ba.此外,棕榈酸与亚油酸呈正相关(r=0.75),与芥酸呈负相关(r=−0.74)。gydF4y2Ba
随机低甲基化和相关的转录变化gydF4y2Bab·拉伯gydF4y2Ba
最后,我们在一个代表性的治疗对象中寻找与5- azac诱导的低甲基化相关的特定转录变化的证据gydF4y2Bab·拉伯gydF4y2Ba线。在这些实验中,来自两个野生型对照系和一个E3系(BraRoAZ_12445e3,根据与S3种子相比种子尺寸缩小的表型选择)的叶子RNA与Affymetrix基因芯片®杂交gydF4y2Ba芸苔属植物gydF4y2BaExon 1.0 ST阵列,基于135k单基因集[gydF4y2Ba44gydF4y2Ba].在转录水平变化的阈值为1.2倍时,10%的基因出现了转录水平变化。在2倍变化的更高阈值下,3.7%的基因转录水平发生变化,BraRoAZ_12445e3植株中有216个基因与R-o-18野生型对照相比表达上调gydF4y2Ba3.gydF4y2Ba:表S3)。初步分析表明,在BraRoAZ植物中,有79个与细胞成分相关的基因被上调。总体而言,BraRoAZ植株中有少量基因显著上调(两倍阈值),而没有基因明显下调。gydF4y2Ba
讨论gydF4y2Ba
我们对5-AzaC诱导的DNA低甲基化效应进行了系统的剂量-反应表征gydF4y2Bab·拉伯gydF4y2Ba.基于这一分析,我们生成了一个独特的1000个E2兄弟系的低甲基化群体,随机分布的还原gydF4y2Ba5米gydF4y2BaCG标志。每一条线都代表了可用于正向和反向遗传筛选的低甲基化外等位基因的独特组合。我们进行了正向筛选,并调查了种子大小和其他产量成分以及种子组成的变化范围。这些外延tilling种群类似于使用传统核苷酸诱变剂如EMS产生的种群[gydF4y2Ba33gydF4y2Ba,gydF4y2Ba45gydF4y2Ba].然而,它们确实提供了独特的机会来探索和利用与表型的微妙的相互作用,可能与外等位基因变异有关。gydF4y2Ba
在采用任何试图通过干扰内源性甲基化控制系统来揭示新的表观遗传变异的治疗方法之前,重要的是首先要证明治疗的有效性并优化其应用。5-AzaC是核苷胞苷的结构类似物[gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba它能抑制DNA甲基转移酶MET1的作用,而MET1在植物中维持外显子甲基化gydF4y2Ba5米gydF4y2BaCG上下文。然而,如果5-AzaC不能接触到目标组织,或者暴露时间不足以引起反应,则有可能无效。相反,过度使用可能导致毒性和/或致命水平的突变或去甲基化[gydF4y2Ba46gydF4y2Ba].因此,重要的是制定适当的策略来评估暴露水平是否足以确保去甲基化的有效性,同时也尽量减少潜在的破坏性影响。我们使用存活率的频率和无显著表型异常来确定5-AzaC的应用水平并不过量。5-AzaC的剂量响应对记录的几个性状呈s型,与EMS等化学诱变剂的剂量响应相似。这表明gydF4y2Bab·拉伯gydF4y2Ba在分生组织细胞发生有丝分裂的3天内,基因组能够耐受低浓度~0.1mM的5-AzaC。在此浓度以上,在~1.0mM 5-AzaC范围内观察到指数反应,在此浓度以上没有明显的额外致死效应。此外,在幼苗的下胚轴和子叶组织中只观察到少量的细胞毒性作用。一般来说,E1植株在所有浓度下都完成了生命周期,并成功结籽。gydF4y2Ba
5-AzaC剂量反应的效力可能不同,取决于不同基因组的二核苷酸组成和结构组织[gydF4y2Ba29gydF4y2Ba].与相同R-o-18基因型的EMS相比[gydF4y2Ba33gydF4y2Ba], 5-AzaC使更多的植株具有正常的视觉表型,尽管对育性的影响是相似的。gydF4y2Ba
接下来重要的是验证5-AzaC治疗显然是通过引起基因组的低甲基化而导致这些效应的。我们用两种方法对此进行了检验。首先,甲基化胞嘧啶的免疫定位显示,在处理(E2)和对照植物粗线染色体的染色质区,FISH信号的分布基本相似,但在处理系中信号明显减少。这与预期的与5-AzaC处理相关的全基因组低甲基化一致,也与之前对小黑麦的观察一致[gydF4y2Ba47gydF4y2Ba].其次,我们比较了等分体生成的MSAP产品图谱之间的差异水平gydF4y2Ba下丘脑-垂体-肾上腺轴的gydF4y2BaII(甲基化敏感)和gydF4y2BaMspgydF4y2BaI.如预期的那样,未经处理的对照系在两种酶产生的图谱之间表现出很大的分歧,主要是因为它们对胞嘧啶甲基化存在的不同敏感性。然而,值得注意的是,在采样的4个处理品系中,这种差异消失了,但在其他品系中保留了。对这一发现最合理的解释是,由5-AzaC处理引发的低甲基化是随机有效的,只在处理的植物的一个子集中明显。这一发现与E2和E3植株中出现表型异常的相似频率是一致的。考虑到5-AzaC疗效的随机性,这种相对简单的方法具有直接和有价值的实用价值,可以早期识别治疗实际影响预期的低甲基化的E1系。这种能力将大大提高任何试图使用这种化学物质产生新的表型变异水平的高通量项目的效率,或以其他方式操纵甲基化状态,用于基因功能的遗传或表观遗传学研究。gydF4y2Ba
在甲基化状态产生了变化之后,下一步重要的是确定处理植物之间相关表型变化的程度。在目前的研究中,与未处理的对照相比,我们确实在E1代中发现了额外的表型变异,正如之前在一系列植物物种中报道的那样[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba].然而,相比之下,gydF4y2Bab . oleraceagydF4y2Ba[gydF4y2Ba50gydF4y2Ba], 5-AzaC的形态表型效应范围减小gydF4y2Bab·拉伯gydF4y2BaR-o-18。这在一定程度上可能是由于其基因组尺寸较小gydF4y2Ba芸苔属植物gydF4y2Ba一个基因组(gydF4y2Ba51gydF4y2Ba]和/或不同的染色质组织,特别是异染色质的相对数量和/或转座元件的分布[gydF4y2Ba52gydF4y2Ba].利用细胞学方法,Braszewska-Zalewska [gydF4y2Ba53gydF4y2Ba]表明gydF4y2Bab·拉伯gydF4y2Ba基因组有明显的DNA甲基化分布,与之相比主要位于异染色质gydF4y2Bab . oleraceagydF4y2Ba.gydF4y2Ba
还有证据表明,在几个具有重要农艺意义的性状中出现了新的变异。例如,开花时间是一个复杂的多基因性状,通过不同信号转导途径的相互作用调节[gydF4y2Ba54gydF4y2Ba- - - - - -gydF4y2Ba56gydF4y2Ba].我们发现,在≥0.1mM的5-AzaC环境下,E1代的开花时间被推迟,这与甲基化在控制开花时间方面起一定作用是一致的gydF4y2Bab·拉伯gydF4y2Ba.的克隆gydF4y2Bab·拉伯gydF4y2Baused (R-o-18)对春化没有反应,与拟南芥生态型Landsberg相同gydF4y2BaerectagydF4y2Ba[gydF4y2Ba57gydF4y2Ba].拟南芥的这种表型被归因于FWA的重新激活,FWA是一种开花抑制因子,在其启动子中构成甲基化,因此在野生型中在生命周期的大多数阶段被抑制。FWA由母体印迹[gydF4y2Ba58gydF4y2Ba]并依赖于DNA甲基化的印迹状态[gydF4y2Ba59gydF4y2Ba,gydF4y2Ba60gydF4y2Ba].然而,我们也观察到在暴露于0.5 mM 5-AzaC的E2植物子集中,开花时间缩短,这一发现与之前的几篇报道一致[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba48gydF4y2Ba,gydF4y2Ba50gydF4y2Ba,gydF4y2Ba61gydF4y2Ba随后在BraRoAZ E2群体中系统筛选0.25 mM 5-AzaC处理的开花时间也表明开花时间缩短。奇怪的是,在某些情况下,E1系E2代早开花表型观察到晚开花,这一现象也在E2和E3居群中发现gydF4y2Bab . oleraceagydF4y2Bavar。gydF4y2BaitalicagydF4y2Ba(王,未公开的数据)。这可能是由于E2代中影响开花途径不同组成部分的等位基因的分离,也可能表明这一重要性状的表观遗传控制中存在高度的冗余和相互依赖性。gydF4y2Ba
如果这种变异能够被固定或至少稳定下来,那么由基因组的随机低甲基化所产生的变异的增加是最有价值的。之前的研究表明,这可以在拟南芥中通过自花授粉实现[gydF4y2Ba19gydF4y2Ba]或单倍体产量加倍(King,未发表)。通过剂量效应分析,我们选择了5-AzaC的最佳浓度用于BraRoAZ群体的生成,其中E2种子从94.5%的E1植株中获得。该人群的建立类似于EMS-TILLING人群,可用于正向和反向表观遗传筛查。正如预期的那样,我们观察到,在相同的R-o-18基因型中,与EMS突变相比,表型范围减少[gydF4y2Ba33gydF4y2Ba].5-AzaC仅靶向甲基化位点的一个子集,而EMS诱导的过渡突变可导致转录物的截断和蛋白质的修饰,并能够靶向基因组的所有区域。gydF4y2Ba
在植物中,DNA甲基化至少有时通过减数分裂直接传递,并通过减数分裂后有丝分裂产生配子体来维持[gydF4y2Ba62gydF4y2Ba,gydF4y2Ba63gydF4y2Ba].在两个独立的实验(剂量反应和BraRoAZ群体)中,我们发现在5-AzaC处理后,某些表型可从E1代遗传到E2代。这些措施包括植株身高的整体降低、种子尺寸变小和花形态的改变。在E2代和E3代中观察到的相对于E1代的变异的明显损失可能是由于许多原因,包括形成配子的特定细胞谱系的再甲基化、野生型等位基因的优势和上位位点的分离。预计E2及其后续世代将具有功能性gydF4y2BaMET1gydF4y2Ba因此,特定CG位点可能发生渐进性的再甲基化。区分新的外等位基因和伴随遗传变异的能力,如可能由转座子的激活引起的,需要更详细的分离和分子分析。gydF4y2Ba
我们观察到的形态变异范围与参与维持DNA甲基化的基因下调所观察到的形态变化范围相当[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba64gydF4y2Ba].我们生成的低甲基化种群的一个关键属性是,只有短暂的5-AzaC暴露,这抑制了MET1的活性,在种子吸胀和分生组织激活期间发生了三天多的少量细胞分裂。相比之下,本构向下调节gydF4y2BaMET1gydF4y2Ba(在突变体中或通过RNAi)影响一系列表型,包括植物身高、叶片、顶端优势、开花和育性[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba65gydF4y2Ba].从EMS突变的初步分析gydF4y2BaBraA.MET1.agydF4y2Ba我们有证据表明它对植物的身高、叶片形状和肥力有影响(数据未显示)。在拟南芥中也观察到类似的异常表型范围gydF4y2Baddm1gydF4y2Ba突变体(gydF4y2Ba64gydF4y2Ba,gydF4y2Ba66gydF4y2Ba].虽然发育异常最初没有报告gydF4y2Bab·拉伯gydF4y2Ba之后RNAi下调gydF4y2BaBraA。DDM1gydF4y2Ba[gydF4y2Ba67gydF4y2Ba],我们在后代中观察到一些形态异常。gydF4y2Ba
BraRoAZ群体的结构为系统筛选等位基因外变异提供了手段。的分布gydF4y2Ba5米gydF4y2Ba在E2和后代中保留的CG标记被认为是随机的,导致相邻基因的外等位基因状态的局部变化。这比本构下调提供了几个优点gydF4y2BaMET1gydF4y2Ba.例如,在gydF4y2Bamet1gydF4y2Ba拟南芥突变体可发生高达90%的胞嘧啶甲基化减少,主要是在CpG二核苷酸中[gydF4y2Ba14gydF4y2Ba].拟南芥野生型与野生型杂交产生的epiRILs的有效性gydF4y2Baddm1gydF4y2Ba突变体为表征靶位点的表观遗传效应提供了另一种策略[gydF4y2Ba19gydF4y2Ba].然而,这种方法在更复杂的基因组中可能并不那么有效gydF4y2Ba芸苔属植物gydF4y2Ba,其中包含多个同源基因区域,以及大量的转座因子。gydF4y2Ba
我们观察到在E2代和E3代种子产量和组成性状的一系列变化。表观遗传过程与种子大小的调节有关,其中DNA甲基化似乎起着关键作用。例如,低甲基化的母体基因组和野生型父本基因组之间的杂交导致种子大小增加,而反向杂交导致种子大小减小[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba68gydF4y2Ba,gydF4y2Ba69gydF4y2Ba].对于一些品系,我们观察到从E2代到E3代的小种子表型遗传。我们能够证明,种子大小的变化在很大程度上独立于种子数量和单株种子产量,这表明有机会选择和重组特定的外等位基因来提高总体产量。gydF4y2Ba
我们发现低甲基化在整个种群(E2和E3)中都有增加种子蛋白质含量的作用,而相应的降低含油量。考虑到我们的原假设是两种成分的野生型均值的随机变化,这表明低甲基化可能导致调节油:蛋白质比例的特定基因的去抑制,要么通过特定的资源分配途径,要么通过与正常种子发育和成熟程序的相互作用。gydF4y2Ba
此外,我们已经证明,低甲基化可以导致种子关键脂肪酸成分比例的大幅调整,并且这些调整通过至少一次减数分裂事件传递。这些影响包括芥酸的减少与亚油酸和/或棕榈酸的增加相对应。这一变异水平与在自然遗传变异和种群隔离调查中观察到的一致gydF4y2Ba芸苔属植物gydF4y2Ba物种(gydF4y2Ba43gydF4y2Ba].通过对公认的脂肪酸合成途径中哪些步骤受到影响的推断,我们可以推测出哪些基因可能由于低甲基化而上调。这可能是由于对特定酶的直接作用,也可能是由于对特定酶的激活剂去抑制的结果。例如,芥酸水平的降低和相应的亚油酸水平的增加是一致的激活gydF4y2BaFAD2gydF4y2Ba[gydF4y2Ba43gydF4y2Ba].棕榈酸的增加伴随着亚油酸的增加可能表明脂肪酸延伸通路中一个基因的早期激活。gydF4y2Ba
E2和E3在群体水平上对种子组成性状的遗传模式不一致。然而,对于体积较大的兄弟种子中相对复杂的性状,这是可以预期的,其中可能有强烈的G×E相互作用,并与一个或多个受影响的基因座分离。此外,在S3对照中观察到的变异比S2更大,这表明在良好控制和可复制的环境中研究等位基因外变异的重要性。的变化gydF4y2Ba5米gydF4y2BaCG标记与调节G×E春化反应的相互作用有关gydF4y2Ba方法gydF4y2Ba而且gydF4y2BaMAF-5gydF4y2Ba[gydF4y2Ba70gydF4y2Ba].DNA甲基化标记也倾向于排除组蛋白H2A。Z (gydF4y2Ba7gydF4y2Ba],似乎在温度感知中起着重要作用[gydF4y2Ba71gydF4y2Ba].与EMS TILLING群体一样,早期世代(外显)突变等位基因的随机分布很可能掩盖了单个位点的表型效应。因此,在进行严格的分离分析和识别相关位点之前,有必要通过至少三代产生回交系(到野生型)。gydF4y2Ba
对单个E3植物叶片组织的初步转录分析没有显示基因表达广泛变化的任何证据,只有少数基因上调,没有基因下调。这与观察到的表型观察和预期的转录去抑制相一致,因为从最初的5- azac处理中会产生修饰的5 mC位点的随机分布。在两个不同条件下的对照生长条件下,纯合子野生型对照之间的转录谱变异比两个sib E3植株之间的差异更大。为了了解影响群体内转录水平的外等位基因变异的分布和模式,需要对株系进行更全面的筛选,这可能需要有针对性的反外等位基因分析。gydF4y2Ba
结论gydF4y2Ba
随机生成低甲基化群体可能有助于在广泛的作物植物中发现表观等位基因,并具有相当大的潜力作为作物改良的干预策略[gydF4y2Ba3.gydF4y2Ba].这将需要制定策略,以确保育种材料或种子繁殖种群中理想的外等位基因的稳定保留和部署,并开发靶向表观遗传修饰的新技术。这些策略需要考虑到再甲基化、G×E相互作用以及初始杂交事件导致的表观基因组重塑等问题[gydF4y2Ba72gydF4y2Ba].我们先前曾建议[gydF4y2Ba3.gydF4y2Ba需要通过渐渗快速分离携带修饰的外等位基因的染色体片段。靶向反向表观遗传筛选还需要对分布的详细知识gydF4y2Ba5米gydF4y2Ba利用高通量亚硫酸氢盐测序技术在作物基因组中的C [gydF4y2Ba21gydF4y2Ba],以及使用高分辨率熔体等技术检测外等位基因的位点特异性标记分析[gydF4y2Ba73gydF4y2Ba].gydF4y2Ba
方法gydF4y2Ba
用5-AzaC处理植物材料和种子gydF4y2Ba
R-o-18系是一种快速循环自亲和自交系gydF4y2Bab·拉伯gydF4y2Bavar。gydF4y2BatrilocularisgydF4y2Ba(Roxb)。Hanelt(黄色沙松),最初来自英国诺维奇的John Innes中心。注册号为GK070302的种子使用去甲基化剂5-氮杂胞苷(Sigma, UK)处理,基本上如King [gydF4y2Ba50gydF4y2Ba].在pH值为6.3的50mm 2-[N-morpholino]乙磺酸(MES)缓冲液中制备15mm 5-AzaC原液。为了建立剂量效应,制备了5种不同浓度(0.01 mM, 0.1 mM, 0.5 mM, 1.0 mM和1.5 mM)。将50颗种子均匀地放置在9cm的培养皿滤纸上,培养皿中加入4.5 ml的5-AzaC溶液(或水,作为对照),放置在密封盘中,在20°C的黑暗中孵育三天。种子被转移到筛子上,用水冲洗至少8次,然后在多细胞种子盘中播种在罗桑配方混合堆肥中。托盘按随机完全块设计(RCBD)排列,每6个处理4个重复,每个重复100株幼苗。除非另有说明,植物生长在一个有补充照明的温室里,每天16小时,提供最低300 μmol/m的光照gydF4y2Ba2gydF4y2Ba/s的光合有效辐射。植物在白天18°C,晚上15°C的标称温度下生长,排气带为2°C。然而,2008年夏季记录的最高温度为32°C,这可能影响了E3种群的发育(见下一节)。幼苗在初盆后14 ~ 17天移栽到9cm的堆肥罐中。为了保证自花授粉,花序在开花前被封闭在微穿孔授粉袋中。gydF4y2Ba
低甲基化群体BraRoAZ的建立gydF4y2Ba
“E”表示“外等位基因”,与“M”表示“突变体”类似。种子和植物世代的命名遵循先前EMS突变群体使用的命名方法[gydF4y2Ba33gydF4y2Ba].因此,E1植物代表那些从吸收了5-AzaC的种子中生长出来的植物。E2是E1之后的一代,以此类推gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
加入GK070302的250组种子分别用从同一批原液5-AzaC中提取的0.25 mM和0.30 mM处理。植株在RCBD中生长,该RCBD包括两个对照组,分别用水或2-[N-morpholino]乙磺酸(MES)缓冲液处理。在生长过程中对植株进行监测和表型性状记录。从所有500种植物中收集叶片材料,冷冻干燥并储存为分子分析的档案材料。从500株E1中每株收获3个穗状体,并分配了单独的登录号(共1500)。将每株剩余角果的种子汇集在一起,分配加入号,并记录每株种子的总重量。gydF4y2Ba
根据观察到的异常E1表型,从两种处理中确定了77个系的子集,以及另外23个野生型外观系。这100个品系用于产生E2代植株,并与6个对照(未处理)品系生长。从每个选择的株系(产生1000株E2植株,每次处理500株)中选择10颗种子播种在花盆中,并任意放置在温室的隔间中。gydF4y2Ba
BraRoAZ_E3种子从所有植物的指定的穗轴上收获,并分配了唯一的登录号,总共1000行。产生E2种子的E1植株生长于2007年10月至2008年3月之间,而产生E3种子的E2植株生长于2008年5月至2008年11月之间。gydF4y2Ba
表型性状的测量gydF4y2Ba
通过计算吸胀后7天发芽种子的数量(通过胚根的出现)来评估发芽情况。播种后20天记录植株高度,9厘米为“发育不良”的阈值,而对照植株最低为11厘米。记录第一次开花的天数(从播种到堆肥的日期起)。移栽后60天记录植株成活率。采收后记录每角果种子数和25粒种子的平均重量。从主花序的指定位置(第6、7和8个角果,从植株顶端开始计数)取角果。记录花粉的存在与否。在培养皿中的湿滤纸上吸吸7天后记录E2种子萌发,每次处理重复4次,每次30粒种子。在E1代和E2代均记录了植株身高、花形态和分枝等形态学特征。gydF4y2Ba
使用Marvin (Selecta Machinefabriek b.v., Enkhuizen, Netherlands)数字种子分析仪确定种子大小,将不超过150颗种子放置在一个小种子盘上。使用Marvin 4.0软件记录种子数和单株种子数据,圆度设置为3。E2线100条,S2水控制线30条。gydF4y2Ba
使用NIRFlex N-500 (BUCHI UK Ltd, Oldham, UK),通过近红外光谱(NIRS)对种子成分进行无损评估,每条生产线大约200-500颗种子,NIRFlex固体瓶附加组件中有一个15 × 45毫米的玻璃瓶。在不同的日子里,每一行都有两个独立的读数。在两天内对样本进行随机排序分析,每个样本扫描32次。S3 MES控制样本被指定为参考标准,并在交替运行中进行分析,以使在不同情况下记录的测量漂移正常化。油和蛋白质百分比以干物质为基础表示,而脂肪酸则以总油含量的%表示。标准脂肪酸甲酯(FAME)分析用于比较和验证特定组分的近红外光谱分配。每瓶提取5粒种子,对1个野生型和3个E2系BraRoAZ_12175e2、BraRoAZ_12175e2和BraRoAZ_12067e2各重复5次,加工前加入七烷酸(100 mg)作为内标[gydF4y2Ba74gydF4y2Ba].gydF4y2Ba
BraRoAz DNA甲基化的MSAP分析gydF4y2Ba
植物材料gydF4y2Ba
十种子从两个S2 (BraRoAZ_12845s2 BraRoAZ_12857s2),两个S3线(BraRoAZ_12842s3 BraRoAZ_12854s3),五E2 (BraRoAZ_10263e2、BraRoAZ_10287e2 BraRoAZ_10543e2, BraRoAZ_11543e2, BraRoAZ_12447e2)和五个E3线(BraRoAZ_10261e3、BraRoAZ_10286e3 BraRoAZ_10542e3, BraRoAZ_11541e3, BraRoAZ_12445e3)在多细胞的种子播种在洛桑处方混合堆肥盘和置于控制之下生长条件(18°C的一天/ 15°C的夜晚,天16小时的长度,300μ摩尔/ mgydF4y2Ba2gydF4y2Ba/s的光合有效辐射)。每个幼苗的第一片真叶子在相同的发育阶段取样,在液态N2中冷冻,在-80°C保存。用Qiagen DNeasy试剂盒提取DNA,在无核酸酶水中稀释至终浓度为10 ng/μl。gydF4y2Ba
MSAP过程gydF4y2Ba
我们使用了MSAP方法的修改,描述为[gydF4y2Ba75gydF4y2Ba]来揭示CG甲基化模式的全球变异性gydF4y2Bab·拉伯gydF4y2Ba样本。对每个个体,50ng DNA消化和连接2小时在37℃使用5UgydF4y2BaEcoRgydF4y2Ba我和1U的gydF4y2BaMspgydF4y2Ba我或gydF4y2Ba下丘脑-垂体-肾上腺轴的gydF4y2BaII (New England Biolabs), 0.45 μMgydF4y2BaEcoRgydF4y2BaI适配器,4.5 μMgydF4y2Ba下丘脑-垂体-肾上腺轴的gydF4y2BaII适配器(参见附加文件gydF4y2Ba2gydF4y2Ba:寡核苷酸序列表S1)和1U T4 DNA连接酶(Sigma)在11 μl总体积的1X T4 DNA连接酶缓冲液(Sigma)中,1 μl 0.5 m NaCl,以1mg/ml BSA添加0.5 μl。酶被加热到75°C 15分钟灭活。在限制和适配器连接之后,接下来是连续两轮PCR扩增。为了进行预选择扩增,0.3 μl上述限制/连接产物孵育在12.5 μl含1X Biomix (Bioline, London, UK)和0.05 μl Preamp的体积中gydF4y2BaEcoRgydF4y2BaI引物和0.25 μl前置放大器gydF4y2BaHpaIIgydF4y2Ba/gydF4y2BaMspgydF4y2BaI(两种引物浓度均为10 uM)(见附加文件)gydF4y2Ba2gydF4y2Ba:表S1引物序列)以1mg/ml的BSA添加0.1 μl。PCR条件为72℃2 min,然后依次为30个循环:94℃30 s, 56℃30 s, 72℃2 min,最后延伸步骤为72℃10 min。选择PCR反应使用0.3 μl的预选择PCR反应产物和与预选择反应相同的试剂,但使用FAM标记的选择性引物(E2/H1或E3/H3;见附加文件gydF4y2Ba2gydF4y2Ba:引物序列表S1)。选择性PCR的循环条件为:94°C 2min, 94°C 30 s, 65°C(每循环降低0.7°C) 30 s, 72°C 2min,循环24次,94°C 30 s, 56°C 30 s, 72°C 2min,最后72°C 10 min。gydF4y2Ba
荧光标记的MSAP产品在纳米无菌水中1:10稀释,1 μl与1 μl ROX/HiDi混合液(50 μl ROX + 1 ml HiDi甲酰胺,Applied Biosystems, USA)混合。样品在95°C下热变性3 - 5分钟,在冰上快速冷却2分钟。样品在ABI PRISM 3100上在3 kV下分离22秒,在15 kV下分离45分钟。gydF4y2Ba
统计分析gydF4y2Ba
形态变异分析gydF4y2Ba
GenStat®(2010年,13岁gydF4y2BathgydF4y2Ba版本,VSN国际有限公司,Hemel Hempstead,英国)统计软件包用于所有分析。方差分析用于分析性状变异,f检验用于确定5-AzaC浓度之间差异的显著性,5%水平下的最小显著性差异(LSD)用于比较均数[gydF4y2Ba76gydF4y2Ba].残差分析表明不需要对数据进行转换。将逻辑曲线修改为从100%(存活植物或正常植物)开始用于模拟剂量响应数据。使用非线性最小二乘回归拟合模型,以估计三个可能的参数(指数率、给予50%存活或正常植物的剂量和下渐近线)[gydF4y2Ba76gydF4y2Ba].使用f检验来评估是否需要一个较低的渐近线,并评估模型的缺乏拟合。限制极大似然(REML, [gydF4y2Ba77gydF4y2Ba](第5.3.3节)分析用于估计同一世代处理系和对照系群体内部和群体之间的变异。用Wald检验评价种子面积种群间的差异([gydF4y2Ba77gydF4y2Ba第6.2节)和使用似然比检验([gydF4y2Ba77gydF4y2Ba), 6.3节)。gydF4y2Ba
表观遗传变异分析gydF4y2Ba
用主坐标分析(PCoA)确定测试样本之间的表观遗传相似性[gydF4y2Ba78gydF4y2Ba]基于GenAlex从引物组合E2/H1和E3/H3中获得的MSAP图谱(v.6.4)。然后我们使用分子方差分析(AMOVA) [gydF4y2Ba79gydF4y2Ba]评价5-AzaC诱导的表观遗传多样性的结构和程度。成对PhiPT [gydF4y2Ba80gydF4y2Ba比较(FgydF4y2Ba圣gydF4y2Ba固定指数,衡量不同群体间的差异连通性/遗传多样性)gydF4y2Ba下丘脑-垂体-肾上腺轴的gydF4y2Ba二或gydF4y2BaMspgydF4y2Ba我被用来推断它们在靶向限制位点内DNA甲基化的总体差异水平(即,限制使用的样品之间的PhiPT值越低gydF4y2Ba下丘脑-垂体-肾上腺轴的gydF4y2Ba二、同样限用gydF4y2BaMspgydF4y2BaI,样本中DNA甲基化水平越低)。随后使用GenAlex (v.6.4)计算AMOVA,以检验种群间PhiPT的显著性[gydF4y2Ba80gydF4y2Ba],在9,999个排列上估计非分化概率(FST=0)。总体SSWP内平方和[gydF4y2Ba80gydF4y2Ba,因此被用来推断系内的表观遗传变异。gydF4y2Ba
细胞学的本地化gydF4y2Ba5米gydF4y2BaC的immune-staininggydF4y2Ba
在18-15℃、日照16小时、相对湿度65 -75%的对照环境条件下,栽培了2个E2系和1个S2水控制系的4株植株。未成熟的花蕾(1.2mm)取样固定,按[gydF4y2Ba42gydF4y2Ba]从减数分裂花粉母细胞中获得粗线期染色体。检测gydF4y2Ba5米gydF4y2BaC按照[gydF4y2Ba47gydF4y2Ba]使用小鼠单克隆抗gydF4y2Ba5米gydF4y2BaC抗体(Calbiochem, UK)。gydF4y2Ba
转录组分析gydF4y2Ba
用Qiagen RNeasy植物试剂盒从E3系BraRoAZ_12445e3(表型与对照无区别,种子小)的3个独立植株的第6叶和R-o-18的2个独立植株中提取总RNA。Affymetrix基因芯片Brassica Exon 1.0 ST阵列的标记和杂交[gydF4y2Ba40gydF4y2Ba,由NASCArrays服务(gydF4y2Bahttp://www.arabidopsis.infogydF4y2Ba).使用genspring v.11.5对结果进行分析,GO分析基本上遵循[gydF4y2Ba44gydF4y2Ba].gydF4y2Ba
BraRoAZ_E2和BraRoAZ_E3种群的种子可从smita.kurup@rothamsted.ac.uk获得。R-o-18基因的重新测序数据可在gydF4y2Bahttp://www.brassica.info/datasets/Brassica_resequencing_data/gydF4y2Ba.gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
Manning K, Tör M, Poole M, Hong Y, Thompson AJ, King GJ, Giovannoni JJ, Seymour GB:编码SBP-box转录因子的基因中自然发生的表观遗传突变会抑制番茄果实成熟。植物学报,2006,38(8):948-952。gydF4y2Ba
- 2.gydF4y2Ba
Kalisz S, Purugganan MD:通过DNA甲基化的外等位基因:植物进化的后果。生态学报,2004,19(6):309-314。gydF4y2Ba
- 3.gydF4y2Ba
King GJ, Amoah S, Kurup S:探索和利用作物表观遗传变异。中国生物医学工程学报,2010,29(6):557 - 557。gydF4y2Ba
- 4.gydF4y2Ba
Hauben M, Haesendonckx B, Standaert E, Van Der Kelen K, Azmi A, Akpo H, Van Breusegem F, Guisez Y, Bots M, Lambert B:能源利用效率的特征是一个表观遗传成分,可以通过人工选择来指导提高产量。中国生物医学工程学报,2009,29(6):369 - 369。gydF4y2Ba
- 5.gydF4y2Ba
Smith AP, Jain A, Deal RB, Nagarajan VK, Poling MD, Raghothama KG, Meagher RB: Histone H2A。Z调节几种类型的磷酸盐饥饿反应基因的表达,但不是作为转录激活因子。植物生理学报,2010,32(1):447。gydF4y2Ba
- 6.gydF4y2Ba
Kim M, Ohr H, Lee JW, Hyun Y, Fischer RL, Choi Y:拟南芥MET1活性时空下调导致全局DNA低甲基化和发育缺陷。细胞生物学杂志,2008,26:611-615。gydF4y2Ba
- 7.gydF4y2Ba
Zilberman D, Coleman-Derr D, Ballinger T, Henikoff S:组蛋白H2A。Z与DNA甲基化是相互拮抗的染色质标记。自然学报,2008,456(7218):125-129。gydF4y2Ba
- 8.gydF4y2Ba
柴叶H, Kakizaki T, Iwano M, Tarutani Y, Watanabe M, Isogai A,高山S: DNA甲基化控制的自交不亲和等位基因的显性关系。植物学报,2006,38(3):297-299。gydF4y2Ba
- 9.gydF4y2Ba
Dennis E, Finnegan E, Bilodeau P, Chaudhury A, Genger R, Helliwell C, Sheldon C, Bagnall D, Peacock W:春化和开花开始。中国生物医学工程学报,1996,27(3):441-448。gydF4y2Ba
- 10.gydF4y2Ba
近藤华,三浦田,和田强,武野强:5氮胞苷对植物开花的诱导作用:光周期诱导开花的稳定性与DNA去甲基化诱导开花效果的关系。植物工程学报,2007,31(3):462-469。gydF4y2Ba
- 11.gydF4y2Ba
王晓燕,王晓燕,王晓燕,等:DNA甲基化对植物胚胎发育的影响。科学通报,2008,3(5):2198。gydF4y2Ba
- 12.gydF4y2Ba
葛瑞林,杨志强,刘志强,等:基因印迹是种子发育过程中重复元素大量去甲基化的基础。科学通报,2009,32(4):347。gydF4y2Ba
- 13.gydF4y2Ba
王晓峰,王晓峰,王晓峰,等。拟南芥中胞嘧啶甲基转移酶的序列同源性分析。核酸学报,1993,21(10):2383。gydF4y2Ba
- 14.gydF4y2Ba
王晓燕,王晓燕,王晓燕:拟南芥DNA甲基化降低导致植株发育异常。中国科学:地球科学,1998,16(3):349。gydF4y2Ba
- 15.gydF4y2Ba
Brzeski J, Jerzmanowski A: DNA甲基化缺陷1 (DDM1)定义了一个新的染色质重构因子家族。中国生物医学工程学报,2003,38(2):378 - 378。gydF4y2Ba
- 16.gydF4y2Ba
Martienssen RA, Colot V:植物和丝状真菌DNA甲基化和表观遗传。科学通报,2001,29(5):559。gydF4y2Ba
- 17.gydF4y2Ba
植物有丝分裂和减数分裂的表观遗传记忆传递。中国生物医学工程学报,2008,19(6):527-536。gydF4y2Ba
- 18.gydF4y2Ba
龙勇,夏伟,李锐,王娟,邵明,冯军,王国杰,孟J:甘蓝型油菜表观遗传QTL定位。中国生物医学工程学报,2011,29(3):359 - 359。gydF4y2Ba
- 19.gydF4y2Ba
Johannes F, Porcher E, Teixeira FK, Saliba-Colombani V, Simon M, Agier N, Bulski A, Albuisson J, Heredia F, Audigier P, Bouchez D, Dillmann C, Guerche P, Hospital F, Colot V:评估跨代表观遗传变异对复杂性状的影响。科学通报,2009,5 (6):e1000530。10.1371 / journal.pgen.1000530。gydF4y2Ba
- 20.gydF4y2Ba
Roux F, Colomé-Tatché M, Edelist C, Wardenaar R, Guerche P, ho -pital F, Colot V, Jansen RC, Johannes F:在自然界中发现的遗传变异的全基因组深度遗传扰动启动模式。遗传学报,2011,38(4):378 - 378。gydF4y2Ba
- 21.gydF4y2Ba
Cokus SJ, Feng S, Zhang X, Chen Z, Merriman B, Haudenschild CD, Pradhan S, Nelson SF, Pellegrini M, Jacobsen SE:拟南芥基因组亚硫酸盐测序揭示DNA甲基化模式。自然学报,2008,42(4):359 - 359。gydF4y2Ba
- 22.gydF4y2Ba
Lister R, O 'Malley RC, Tonti-Filippini J, Gregory BD, Berry CC, Millar AH, Ecker JR:拟南芥表观基因组的高整合单碱基分辨率图谱。中国生物医学工程学报,2008,32(3):533 -536。gydF4y2Ba
- 23.gydF4y2Ba
陈鹏飞,冯硕,陈鹏飞,陈鹏飞,于勇,郭峰,李晓燕,陈鹏飞,等:核小体定位与DNA甲基化的关系。自然学报,2010,42(4):388-392。gydF4y2Ba
- 24.gydF4y2Ba
Bossdorf O, Arcuri D, Richards CL, Pigliucci M: DNA甲基化的实验改变影响拟南芥生态相关性状的表型可塑性。生态学杂志,2010,24:541-553。gydF4y2Ba
- 25.gydF4y2Ba
约翰内斯F, Colomé-Tatché M:通过表观基因组扰动的等基因系定量表观遗传学。遗传学报,2011,38(4):378 - 378。gydF4y2Ba
- 26.gydF4y2Ba
Christman JK: 5-氮胞苷和5-氮胞苷-2 ' -脱氧胞苷作为DNA甲基化抑制剂:机制研究及其对癌症治疗的意义。癌基因研究。2002,21(35):5483-5495。gydF4y2Ba
- 27.gydF4y2Ba
Šorm F,皮斯卡拉A, Čihák A, Veselý J: 5-氮胞苷,一种新型高效的抗癌药物。细胞与生命科学,1994,20(4):202-203。gydF4y2Ba
- 28.gydF4y2Ba
Lyko F, Brown R: DNA甲基转移酶抑制剂与表观遗传癌症疗法的发展。中华人民共和国肿瘤杂志2005,97(20):1498。gydF4y2Ba
- 29.gydF4y2Ba
陈晓燕,陈晓燕,陈晓燕:胞嘧啶类似物对dna -胞嘧啶甲基转移酶的抑制作用。细胞科学,1983,33(1):9。gydF4y2Ba
- 30.gydF4y2Ba
Santi DV, Norment A, Garrett CE: DNA胞嘧啶甲基转移酶与含有5-氮杂胞嘧啶的DNA之间形成共价键。中国科学:地球科学,1998,21(4):369。gydF4y2Ba
- 31.gydF4y2Ba
streemann C, Brueckner B, Musch T, Stopper H, Lyko F: DNA甲基转移酶抑制剂在人癌细胞系中的功能多样性。中华癌症杂志2006,66(5):2794。gydF4y2Ba
- 32.gydF4y2Ba
Eichten SR、Swanson-Wagner RA、Schnable JC、Waters AJ、Hermanson PJ、Liu S、Yeh C-T、Freeling M、Schnable PS、Vaughn MW、施普林格NM:玉米自交系可遗传表观遗传变异。科学通报,2011,7:e1002372。gydF4y2Ba
- 33.gydF4y2Ba
Stephenson P, Baker D, Girin T, Perez A, Amoah S, King GJ, Østergaard L:研究芸苔属基因功能的丰富TILLING资源。植物生物学杂志,2010,10(1):62。gydF4y2Ba
- 34.gydF4y2Ba
王王N, Y,田F,国王GJ,张C,长Y, L,孟J:芸苔属植物的功能基因组学资源显著:EMS诱变处理人口发展和发现FAE1点突变的耕作。植物生态学报,2008,29(4):441 - 441。gydF4y2Ba
- 35.gydF4y2Ba
王晓燕,王晓燕,王晓燕,王晓燕,王晓燕,王晓燕,王晓燕,王晓燕,王晓燕,王晓燕,王晓燕,王晓燕,王晓燕,王晓燕,王晓燕,王晓燕,等。四倍体和六倍体小麦诱导突变的改良TILLING方法。植物生物学杂志,2009,9(1):115。gydF4y2Ba
- 36.gydF4y2Ba
Gómez-Campo C:芸苔属的生物学。1999年,阿姆斯特丹,荷兰:爱思唯尔科学有限公司。gydF4y2Ba
- 37.gydF4y2Ba
Lukens LN, Pires JC, Leon E, Vogelzang R, Oslach L, Osborn T:新合成的甘蓝型异体多倍体群体的序列丢失和胞嘧啶甲基化模式。植物生理学报,2006,30(1):336。gydF4y2Ba
- 38.gydF4y2Ba
Lukens LN, Quijada PA, Udall J, Pires JC, Schranz ME, Osborn TC:古代和现代芸属作物物种的基因组冗余和可塑性。中国生物医学工程学报,2004,32(4):366 - 366。gydF4y2Ba
- 39.gydF4y2Ba
徐艳,钟玲,吴旭,方旭,王娟:新合成的甘蓝型异体多倍体基因表达和胞嘧啶甲基化的快速改变。植物学报,2009,29(3):471- 471。gydF4y2Ba
- 40.gydF4y2Ba
Salmon A、Clotault J、Jenczewski E、Chable V、manzanres - dauleux MJ:芸苔菜表现出高度的DNA甲基化多态性。植物生态学报,2008,32(1):441 - 441。gydF4y2Ba
- 41.gydF4y2Ba
Glyn MCP, Egertová M, Gazdova B, Kovarik A, Bezdek M, Leitch AR: 5-氮杂胞苷对小麦(Triticum aestivum L.)根尖分生细胞核1R染色体短臂缩聚的影响。中国生物医学工程学报,2004,24(4):366 - 366。gydF4y2Ba
- 42.gydF4y2Ba
吕刚,吴旭,陈斌,高刚,徐凯,李鑫:油菜种子萌发过程中DNA甲基化变化的检测。科学通报,2006,51(2):182-190。gydF4y2Ba
- 43.gydF4y2Ba
Barker GC, Larson TR, Graham IA, Lynn JR, King GJ:从芸苔属C基因组的遗传多样性和数量性状位点分析对种子脂肪酸合成和修饰途径的新见解。植物生理学报,2004,24(4):378 - 378。gydF4y2Ba
- 44.gydF4y2Ba
Love CG, Graham NS, Lochlainn SÓ, Bowen HC, May ST, White PJ, Broadley MR, Hammond JP, King GJ:一种用于全转录本基因表达分析的十字花科外显子阵列。科学通报,2010,5 (9):e12812。10.1371 / journal.pone.0012812。gydF4y2Ba
- 45.gydF4y2Ba
Till BJ, Reynolds SH, Greene EA, Codomo CA, Enns LC, Johnson JE, Burtner C, Odden AR, Young K, Taylor NE:高通量TILLING诱导点突变的大规模发现。基因组学报,2003,13(3):524。gydF4y2Ba
- 46.gydF4y2Ba
Haaf T: 5-氮胞苷和5-氮胞苷对染色体结构和功能的影响:甲基化相关细胞过程的意义。中国药理学杂志,1995,65(1):19-46。gydF4y2Ba
- 47.gydF4y2Ba
Castilho A, Neves N, Rufini-Castiglione M, Viegas W, Heslop-Harrison J: 5-氮杂胞苷处理前后小黑麦5-甲基胞嘧啶的分布和基因组组织。中国生物医学工程学报,1999,29(3):369 - 369。gydF4y2Ba
- 48.gydF4y2Ba
Brown JCL, De Decker MM, Fieldes MA: 5-氮杂胞苷诱导的早开花亚麻系DNA甲基化发育特征及其对照的比较分析。植物生态学报,2008,29(3):447 - 447。gydF4y2Ba
- 49.gydF4y2Ba
近藤H,尾崎H,伊藤K,加藤A,竹野K: DNA去甲基试剂5氮胞苷诱导短日生植物开花。紫苏。植物工程学报,2006,26(1):1 - 6。gydF4y2Ba
- 50.gydF4y2Ba
King G: 5-氮杂胞苷在体内处理可调节甘蓝的形态发育。园艺科学杂志(英国)。1995年,70:333 - 342。gydF4y2Ba
- 51.gydF4y2Ba
庄士强,胡耀华,胡耀华,陈志杰,霍德尼特G, Drabek J, Lopez R, Price HJ:十字花科植物基因组大小的进化。生物力学学报,2005,29(1):329。gydF4y2Ba
- 52.gydF4y2Ba
Alix K、Joets J、Ryder CD、Moore J、Barker GC、Bailey JP、King GJ、hesop - harrison JS: CACTA转座子Bot1在芸属植物基因组分化和基因增殖中起着重要作用。植物学报,2008,29(6):369 - 369。gydF4y2Ba
- 53.gydF4y2Ba
王晓燕,王晓燕,王晓燕:芸苔属植物基因组表观遗传染色质修饰。中国生物医学工程学报,2010,38(5):557 - 557。gydF4y2Ba
- 54.gydF4y2Ba
杨晓明,杨晓明,杨晓明,杨晓明:拟南芥花期的遗传调控。植物学报,1998,49(1):345-370。gydF4y2Ba
- 55.gydF4y2Ba
Mouradov A, Cremer F, Coupland G:花期的控制:相互作用途径作为多样性的基础。植物细胞学报,2002,14(1):37 - 38。gydF4y2Ba
- 56.gydF4y2Ba
Putterill J, Laurie R, Macknight R:花期到了:花期的基因控制。生物学报,2004,26(4):363-373。gydF4y2Ba
- 57.gydF4y2Ba
Genger RK, Peacock JW, Dennis ES, Finnegan JE: DNA甲基化降低对拟南芥开花时间的相反影响。植物生态学报,2003,26(3):461-466。gydF4y2Ba
- 58.gydF4y2Ba
julilien PE, Kinoshita T, Ohad N, Berger F:在拟南芥生命周期中,DNA甲基化的维持对亲本印迹至关重要。植物学报,2006,18(6):1360-1372。gydF4y2Ba
- 59.gydF4y2Ba
金志平,王晓燕,王晓燕。爪蟾的二维形态梯度:边界形成与实时转导响应。中国机械工程学报,2006,29(6):369 - 369。gydF4y2Ba
- 60.gydF4y2Ba
Soppe WJ, Jacobsen SE, Alonso-Blanco C, Jackson JP, Kakutani T, Koornneef M, Peeters AJ: fwa突变体的晚开花表型是由同源域基因的功能获得表观遗传等位基因引起的。分子生物学杂志,2000,6(4):791-802。gydF4y2Ba
- 61.gydF4y2Ba
Burn JE, Bagnall DJ, Metzger JD, Dennis ES, Peacock WJ: DNA甲基化、春化和开花启动。中国科学:地球科学,1998,21(1):369 - 369。gydF4y2Ba
- 62.gydF4y2Ba
植物的表观遗传。自然学报,2007,38(4):418-424。gydF4y2Ba
- 63.gydF4y2Ba
王晓燕,王晓燕,王晓燕。植物配子体发生过程中DNA甲基化与表观遗传的关系。中国生物医学工程学报,2006,29(1):359 - 361。gydF4y2Ba
- 64.gydF4y2Ba
Kakutani T, Jeddeloh JA, Flowers SK, Munakata K, Richards EJ:与DNA低甲基化突变相关的发育异常和表观突变。中国科学:地球科学,1998,22(3):369 - 369。gydF4y2Ba
- 65.gydF4y2Ba
Kankel MW、Ramsey DE、Stokes TL、Flowers SK、Haag JR、Jeddeloh JA、Riddle NC、Verbsky ML、Richards EJ:拟南芥MET1胞嘧啶甲基转移酶突变体。中国生物医学工程学报,2003,32(3):369。gydF4y2Ba
- 66.gydF4y2Ba
Kakutani T, Jeddeloh JA, Richards EJ:拟南芥DNA低甲基化突变体的鉴定。核酸学报,1995,23(1):130。gydF4y2Ba
- 67.gydF4y2Ba
Fujimoto R, Sasaki T, Inoue H, Nishio T:油菜ddm1转基因植株中逆转录转座子样序列的低甲基化和转录再激活。植物生物学杂志,2008,26(5):463-473。gydF4y2Ba
- 68.gydF4y2Ba
作者简介:Adams S, Vinkenoog R, Spielman M, Dickinson HG, Scott RJ:拟南芥种子发育的亲本效应需要DNA甲基化。科学通报,2000,27(4):359 - 359。gydF4y2Ba
- 69.gydF4y2Ba
Xiao W, Brown RC, Lemmon BE, Harada JJ, Goldberg RB, Fischer RL:父系和母系基因组的低甲基化对种子大小的调控。植物生理学报,2006,26(3):391。gydF4y2Ba
- 70.gydF4y2Ba
Finnegan EJ, Sheldon CC, Jardinaud F, Peacock WJ, Dennis ES:一组对环境刺激有协调反应的拟南芥基因。植物生物学杂志,2004,14(10):911-916。gydF4y2Ba
- 71.gydF4y2Ba
Kumar SV, Wigge PA: H2A。含z的核小体介导拟南芥的热感反应。中国生物医学工程学报,2010,30(1):376 - 376。gydF4y2Ba
- 72.gydF4y2Ba
杂交功能障碍的表观遗传、转座子和小RNA决定因素。遗传学报,2008,32(1):441 - 441。gydF4y2Ba
- 73.gydF4y2Ba
Wojdacz TK, Dobrovic A:甲基化敏感的高分辨率熔化(MS-HRM):一种用于甲基化敏感和高通量评估的新方法。核酸学报,2007,35 (6):e41。gydF4y2Ba
- 74.gydF4y2Ba
Beaudoin F, Wu X, Li F, Haslam RP, Markham JE, Zheng H, Napier JA, Kunst L:脂肪酸延长酶还原酶候选拟南芥酮酰基辅酶a的功能表征。植物生理学报,2009,30(3):369 - 369。gydF4y2Ba
- 75.gydF4y2Ba
reena - lopez GE, Simpson J, Ruiz-Herrera J:真菌在二态转变过程中通过限制性多态性扩增检测DNA甲基化模式的差异。中国生物医学工程学报,2004,23(6):369 - 369。gydF4y2Ba
- 76.gydF4y2Ba
农业和实验生物学中的统计方法。编辑:Mead R, Curnow RN, Hasted AM。2002年,美国佛罗里达州博卡拉顿:CRC出版社gydF4y2Ba
- 77.gydF4y2Ba
纵向数据的线性混合模型。编辑:Verbeke G, Molenberghs G. 2000,纽约,美国:施普林格gydF4y2Ba
- 78.gydF4y2Ba
多变量分析中隐根法和向量法的距离性质。生物识别技术,2006,38(4):354 - 354。gydF4y2Ba
- 79.gydF4y2Ba
Excoffier L, Smouse PE, Quattro JM:从DNA单倍型的度量距离推断的分子方差分析:在人类线粒体DNA限制数据中的应用。中国生物医学工程学报,2011,32(2):369 - 371。gydF4y2Ba
- 80.gydF4y2Ba
Michalakis Y, Excoffier L:利用特殊参考微卫星位点的等位基因间距离对群体细分的一般估计。遗传学杂志,1996,42:1061-1064。gydF4y2Ba
确认gydF4y2Ba
作者得到了英国生物技术和生物科学研究委员会的支持。SA由BP-BBSRC Dorothy Hodgkin研究生奖学金资助。我们感谢J.S. (Pat) Heslop-Harrison和Trudie Schwarzacher (U. Leicester)对FISH染色体的帮助,感谢F. Beaudoin对F.A.M.E分析的帮助,感谢A. Stoute (BBSRC授权BB/G015716/1)和N. Graham (BBSRC项目BB/G013969/1)对转录组分析的帮助。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
相应的作者gydF4y2Ba
额外的信息gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明他们没有竞争利益。gydF4y2Ba
作者的贡献gydF4y2Ba
SA生成种群并分析种子性状,SK协助进行种群生成、性状测量、MSAP植株生成和文稿起草。CL进行了MSAP分析。SJW和SJP进行统计分析。CH协助人口产生。MW参与了MSAP分析的设计和手稿的起草。GK构思了这项研究,参与了它的设计和协调,并起草了手稿。所有作者阅读并批准了最终稿件。gydF4y2Ba
Stephen Amoah、Smita Kurup对这项工作也做出了同样的贡献。gydF4y2Ba
电子辅料gydF4y2Ba
图S1。gydF4y2Ba
附加文件1:5-AzaC预处理的rapa R-o-18种子生长的剂量响应曲线。分别用0.01mM、0.1mM、0.5mM、1.0mM和1.5mM浓度的5-AzaC处理rapa种子和对照。随着浓度的增加,观察到生长缓慢的梯度。这是通过测量单株植物的高度来量化的gydF4y2Ba1gydF4y2Ba一个)。gydF4y2Ba图S2。gydF4y2Ba5-AzaC处理对油菜开花期的影响。分别用0.01mM、0.1mM、0.5mM、1.0mM和1.5mM浓度的5-AzaC处理种子,并进行水分对照。开花天数,定义为从种子播种到植物第一次开花的天数。图中的数据点表示研究浓度下离开花的平均天数。gydF4y2Ba图S3。gydF4y2Ba5-AzaC处理后E2种子重量的盒图分析。种子是从经过5-AzaC处理的种子中获得的植物。在较低浓度的5-AzaC下,一些E1植物的种子较重,而其他植物的种子较轻。这个盒子代表50%的植物。盒子顶部和底部的晶须分别代表上四分位数和下四分位数。横过方格的水平线表示种子重量的中位数。多克斯(5 MB)gydF4y2Ba
表S1。gydF4y2Ba
附加文件2:用于MSAP分析的引物。在引物编码栏中,选择性核苷酸标记为+XYZ。酶柱表示与每个引物相关的酶切位点。gydF4y2Ba表S2。gydF4y2Ba5-AzaC诱导的表观遗传分子多样性。利用分子方差分析(AMOVA)计算5-AzaC诱导的表观遗传多样性,AMOVA是从使用引物组合H2/E1和H3/E3的甲基化敏感扩增多态性(MSAP)分析中推导出来的。群体按照其PhiPT值排序,PhiPT值表示受HpaII和MspI限制的每个群体之间的表观遗传距离(红色突出显示的群体与原始群体相比,PhiPT明显较低gydF4y2Bab·拉伯gydF4y2BaR-o-18行)。Prob表示有一个更极端的方差分量和PhiPT的概率,比单独的概率观测值。种群内平方和(gydF4y2BaSSWPgydF4y2Ba)通过甲基化敏感限制性内切酶对甲基化敏感扩增多态性(MSAP)的分析反映了群体内的多样性gydF4y2Ba下丘脑-垂体-肾上腺轴的gydF4y2Ba2(多克斯16 KB)gydF4y2Ba
表S3。gydF4y2Ba
附加文件3:与R-o-18对照系相比,芸芥E3系BraRoAZ_12445e3基因被鉴定为上调。叶片RNA与genchip Brassica Exon 1.0 ST阵列杂交[3940]。使用genspring v.11.5对结果进行分析,GO分析基本上遵循Love等人的描述。[gydF4y2Ba40gydF4y2Ba].(XLS 108 KB)gydF4y2Ba
作者提交的图片原始文件gydF4y2Ba
下面是作者提交的原始图片文件的链接。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文由BioMed Central Ltd.授权发布。这是一篇开放获取文章,根据创作共用授权协议(gydF4y2Bahttps://creativecommons.org/licenses/by/2.0gydF4y2Ba),它允许在任何媒体上不受限制地使用、分发和复制,只要原著被恰当地引用。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
阿莫阿,S.,库鲁普,S.,罗德里格斯·洛佩兹,C.M.gydF4y2Baet al。gydF4y2Ba低甲基化的种群gydF4y2Ba芸苔属植物拉伯gydF4y2Ba用于正向和反向表观遗传学。gydF4y2BaBMC植物杂志gydF4y2Ba12,gydF4y2Ba193(2012)。https://doi.org/10.1186/1471-2229-12-193gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/1471-2229-12-193gydF4y2Ba
关键字gydF4y2Ba
- DNA甲基化gydF4y2Ba
- HypomethylationgydF4y2Ba
- 表观遗传学gydF4y2Ba
- 农作物gydF4y2Ba
- 芸苔属植物gydF4y2Ba
- 5-AzacytidinegydF4y2Ba