抽象的
背景
负责基因组DNA消化的降解核酸酶的活性已经在生命的所有领域中观察到。认为植物程序性细胞死亡过程中DNA降解的主要作用是氮、磷和核苷酸碱基等核酸衍生产物的再分配。目前研究的植物降解核酸酶主要属于s1型家族,并在含有核酸的细胞室或细胞器中进行鉴定。然而,关于降解的DNA成分如何从死亡细胞中输出以进一步再利用的解释仍然是开放的。
结果
本文中提出的生物信息和实验数据表明了两个拟南芥称为CAN1和CAN2的葡萄球菌状核酸酶通过N-末端肌细胞织物和棕榈酰化修饰锚定到细胞膜。两种蛋白质在其催化结构域中具有独特的杂合结构,其由葡萄球菌核酸酶样和TRNA合成酶抗ocon结合样基序组成。他们是中立的,加利福尼亚州2+- 依赖核肉显示SSDNA,DSDNA和RNA基材的不同特异性。对微阵列实验和内源性核酸酶活性的研究表明,CAN1基因的表达与不同形式的编程细胞死亡相关,而CAN2基因是组成型表达的。
结论
在这篇论文中,我们提出的证据表明,两种植物葡萄球菌样核酸酶属于一个新的,尚未识别的真核核酸酶类,其特点是独特的质膜定位。这类核酸酶的鉴定表明,植物细胞具有额外的,到目前为止还没有特征的,负责DNA和RNA降解的机制。这些核酸酶的潜在功能与它们独特的细胞内位置进行了讨论。
背景
脱氧核糖核酸酶是一大类酶,具有相当大的结构和功能多样性。在真核细胞中,它们参与一系列细胞功能,包括DNA修复、重组和基因组降解。细胞程序性死亡(PCD)的标志是细胞核DNA的降解,这一过程在动物和植物中都存在。然而,尽管植物和动物PCD在功能上有许多相似之处,但这两个领域中代表的核DNA降解似乎具有根本不同的目的。DNA是动物的免疫原性分子,如果凋亡细胞的DNA未被消化,就会引起炎症反应和自身免疫疾病[1].在植物中,在没有发生这些过程的情况下,DNA的降解以及RNA最有可能参与营养活化,因为核酸是富含氮和磷的富源,属于植物生长的主要限制营养素[2,3.].
植物PCD中涉及的已知降解核酸酶主要属于S1家族,鉴定为与S1核酸酶共享序列相似性米曲霉[4].在衰老和发育PCD期间诱导这个家庭BFN1内切核酸酶的最佳特征成员之一拟南芥[5,6].PCD中核酸酶功能的直接证据已被报道为该家族的另一成员ZEN1,它在木质素发生过程中负责DNA降解[7].此外,已经在接受PCD的各种组织中鉴定了其他S1型核酸酶的表达[8,9].
由于降解核酸酶对宿主细胞的潜在毒性,其表达、活性和细胞定位受到严格控制。在动物中,凋亡DNA降解发生在两种系统中。首先,DNA内切酶水解是通过caspase-activated DNase (CAD)进行的,在非凋亡细胞中,它作为一种与抑制蛋白(DFF45)结合的非活性酶驻留在细胞核中。caspase依赖的凋亡途径释放CAD核酸酶,该酶被特定的染色体蛋白进一步激活[1].此外,线粒体胱天蛋白酶非依赖性核酸内切酶G,似乎也参与凋亡DNA裂解[10.].下一阶段,在死亡细胞被吞噬后,片段DNA被溶酶体DNaseII消化。
已经提出,在植物中,降解核酸酶以及参与PCD的其他水解酶,在成熟细胞的液泡中积聚。然后,在PCD的最终阶段期间,Tonoplast破裂将它们释放到细胞质中,导致细胞内容物的自水解[11.].尽管在管状细胞程序化死亡过程中已经观察到这种机制[12.],船架 - 巴勒姆等等。[13.]报道了与衰老相关的BFN1核酸酶最初沉积在丝状结构中,分布于整个细胞质中,但在衰老晚期细胞中,它定位于破碎的核泡中。值得注意的是,虽然植物细胞PCD中核DNA的内核裂解已经被充分证明,但关于降解DNA组分如何从死亡细胞中输出以进一步再利用的解释仍然是开放的。
降解核酸酶也被一些细菌用来利用外源DNA分子作为营养来源[14.].虽然大多数的这些酶是分泌蛋白,已在各种支原体被鉴定膜相关核酸在本文的上下文中特别有意思。支原体是一种细胞内细菌,其缺乏参与核苷酸的生物合成的酶的。然而,支原体能够获得来自主机核酸核苷酸。已经表明,一些支原体核酸酶可以的,因为它们诱导细胞凋亡的变化,其特征在于宿主染色体的体间断裂能力被认为是致病性的决定因素[15.].此外,其他观察显示,一些支原体膜相关核酸酶是ABC运输系统的组成部分,参与从宿主DNA释放的核苷酸的导入[16.].这些支原体核酸酶通过添加脂质部分的处理用于附着到细胞膜上。氨基酸序列分析表明,已知的支原体膜相关核酸酶具有两种类型的催化域中的一个,即,DNA酶I样中的情况下,基序mnuA核酸酶的M. pulmonis.[17.]或MPH379中的葡萄球菌样SNC结构域[16.]和mg_186 [18.].
葡萄球菌核酸酶(SNc)结构域首次被描述为Nuc热切酶金黄色葡萄球菌,其中这种蛋白被分泌来降解外源核酸。其特征是细菌SNase结构域包含的蛋白质小,热稳定,Ca2+- 依赖核酸酶,消化单链DNA和/或双链DNA [19.].含有葡萄球菌核酸酶结构域的蛋白质也已在生命的其他王国中被鉴定出来。Tudor葡萄球菌核酸酶(TSNs)是这类多功能真核蛋白中特征最好的,它由葡萄球菌核酸酶样结构域串联重复组成[20.].下一组植物蛋白质显示与葡萄球菌核酸酶相似的特征在于单一Snase结构域的存在。在里面拟南芥基因组,这个小家族由两个基因组成,即AT3G56170和AT2G40410。关于这种蛋白质家族的文献非常有限。isono.等等。[21和郭等等。[22的细菌表达蛋白产物拟南芥葡萄球菌的基因,命名为CAN蛋白(钙依赖性核酸酶),显示出DNase活性。而且,顾等等。[23]观察到黄瓜的同源基因表达拟南芥CAN核酸酶,简称CsCaN,是乙烯诱导的,可能参与了雌性黄瓜花发育过程中原始花药特异性DNA的损伤。
在本文中,我们呈现实验证据表明,两种植物葡萄球菌样核酸酶属于一种新的尚未鉴定的真核核酸酶,其特征在于独特的血浆膜定位。尽管它们的序列相似,但这两种酶都显示出不同的催化性质和表达谱,表明它们可能发挥不同的生物学功能。由于其中一种在经历各种类型的PCD的组织中特异性表达,因此我们怀疑它参与植物基因组降解。我们讨论了这些核酸酶与其独特的细胞内位置相关的潜在功能。
结果
CAN核酸酶被预测为n -肉豆蔻酰化和棕榈酰化的具有修饰SNase结构域的蛋白质
对NCBI蛋白数据库进行BLAST搜索发现,植物中有两类蛋白具有与葡萄球菌核酸酶活性位点同源的结构域。其中一个基因包括两个基因,AT5G61780和AT5G07350,包含四个串联重复的葡萄球菌核酸酶样结构域,后面跟着一个tudor和c端SNc结构域。第二类由At3g56170和At2g40410两个基因组成,编码的蛋白分别为CAN1和CAN2。与含有蛋白质的Tudor动机不同,CAN1和CAN2具有单个SNase结构域。对这两个CAN氨基酸序列的详细分析表明,这些蛋白质具有复杂的一级结构,由不同种类的蛋白质保守的不同基序组成。
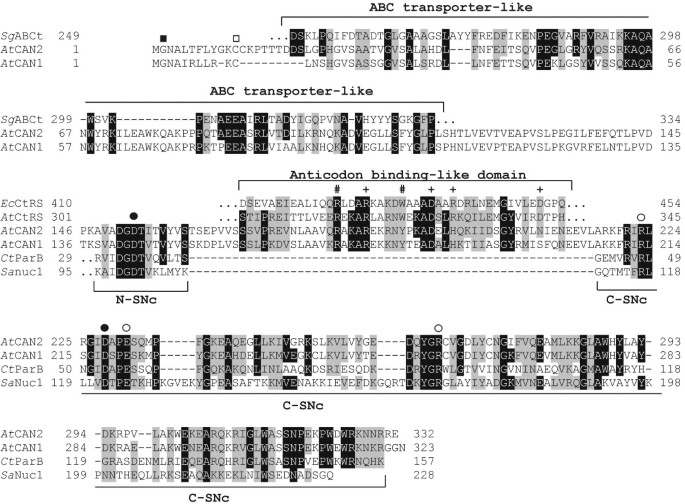
两种罐蛋白质的最有趣特征之一是位于其羧基末端附近的催化结构域的独特结构。该结构域含有所有保守的氨基酸残基,认为在葡萄球菌核酸酶的酶活性(图 1).然而,我们的分析表明,该结构域被一个短序列分割,包括约55个氨基酸,与已知的SNase结构域没有任何同源性。这个插入分离出高度保守的SNc结构域n端部分(N-SNc),包含一个Ca2+从该结构域(C-SNC)的C-末端部分的结合天冬氨酸残基,含有第二个CA.2+结合天门冬氨酸和三个直接参与酶催化的氨基酸残基,即两个精氨酸和一个谷氨酸(图)1).CAN1和CAN2的SNc结构域与细菌parB核酸酶的催化结构域具有最显著的相似性;然而,它们与定义明确的葡萄球菌核酸酶相似[19.]也很重要。氨基酸片段的序列分析除以SNC结构域的两部分,意外地揭示了该区域与一些细菌性胱抑素-TRNA合成酶分享同源性(图 1).我们发现特别有趣的是,这个CAN核酸酶的动机几乎完全符合tRNA合成酶区域负责识别tRNA反密码子环[24].此外,tRNA合成酶中的6个残基中有5个要么直接与反密码子核苷酸相互作用,要么对结合腔的稳定性至关重要,这5个残基在CAN蛋白中是严格或高度保守的。值得注意的是,这种插入在所有植物的CAN同源物中都是保守的,包括进化上古老的植物Physcomitrella和卷柏(数据没有显示)。
的领域组织和序列对齐拟南芥CAN1和CAN2蛋白。的两个氨基酸序列比对拟南芥5种细菌蛋白的CAN核酸酶的保守基序。比对结果包含了CAN1和CAN2蛋白的全长序列,以及部分与CAN1和CAN2序列对应区域相似度最高的细菌蛋白(序列上方和下方的括号)。AtCAN1- CAN1核酸酶A. Thaliana.[TAIR:AT3G56170]。AtCAN2- CAN2核酸酶A. Thaliana.[TAIR: At2g40410]。SGABCt- ABC型转运仪的推定的周质成分Syntrophobotulus glycolicus(NCBI: YP_004267097]。EC.点击率-半胱氨酸- trna合成酶大肠杆菌[基因库:EGW73615]。在点击率-假定的半胱氨酸- trna合成酶Anaerolinea thermophila(NCBI: YP_004174706]。CtParb.- parb样核酸酶Cronobacter turicensis(NCBI: YP_003212717]。SANuc1——thermonuclease金黄色葡萄球菌[基因库:EGS91983]。相同且高度保守的氨基酸分别用黑色和灰色框起来。黑方(■)-假定的n -豆蔻酰基序中的n端甘氨酸。开方形(□)-假定棕榈酰基基的半胱氨酸残基。半胱氨酸- trna合成酶中的加号(+)残基与细菌tRNACys的反密码子环碱基相互作用。井号(#)- - - - - -影响反密码子结合稳定性的残基。黑点(●) -参与钙结合的残基2+离子。开放点(○) - SNase活性位点内的残基。N-SNc和C-SNc- n端和c端分别是推定的SNase催化结构域。
我们还检查了含量核酸酶的潜在翻译后修饰。使用MyRistoylator程序我们确定了两端的N-Terminal MyRistoylation Concensus Polifs拟南芥核酸酶。肉豆蔻酰化蛋白中位于2位的甘氨酸残基,是肉豆蔻酸酯的受体位点[25,也存在于所有其他植物的CAN同源物中。两种CAN核酸酶都已被Boisson分类等等。[26列入437个推定为肉豆蔻酰化的名单拟南芥蛋白质(n -肉豆蔻酰组),以实验和生物信息学相结合的方法确定。肉豆蔻酰化可以影响蛋白质与膜相互作用的能力,但肉豆蔻酰化的存在并不足以使膜稳定附着。人们认为,由肉豆素酰化诱导的蛋白膜锚定,接着是半胱氨酸残基的棕榈酰化[25].CSS-Palm软件的应用,专为Palmitoylation预测设计[27,显示了CAN1和CAN2中豆蔻酰化动机的直接下游存在一个假定的棕榈酰化位点(图1).由于在许多膜蛋白中鉴定了N末端的这种肌中福利福和棕榈酰胺位点的这种布置,这表明CAN蛋白的该区域也可参与膜附着。
位于n端肉豆蔻酰化/棕榈酰化基元与SNc催化结构域之间的CAN蛋白区域与任何确定的结构域都没有相似之处,也没有显示出与任何其他植物或动物蛋白序列的显著同源性。然而,在蛋白质数据库中对该氨基酸序列进行BLAST搜索后发现,它与细菌abc型转运体的某些胞浆周成分具有最高的同源性[28].虽然CAN核酸酶和ABC转运体之间存在低序列相似性,但不能对它们潜在的相似功能得出任何明确的结论,但这可能表明它们假定的系统发育关系。
原生质体中瞬时表达的CAN1和CAN2核酸酶的催化活性各不相同
利用公共数据库中储存的核苷酸序列设计PCR引物,扩增编码这两种基因的全长cdna拟南芥葡萄球菌样核酸酶。本文稍后讨论的微阵列数据表明CAN1表达可以通过包括年龄依赖性衰老的发育和应力提示诱导,并且CAN2基因的活性基本上是本文的。因此,我们使用从早期的衰老叶中纯化的逆转录的mRNA作为两个基因的PCR扩增的模板。将RT-PCR扩增产物克隆到植物表达载体中,使我们允许我们获得重组天然的瞬时表达以及C-末端HA-和荧光蛋白标记的融合蛋白。
关于植物金葡萄球菌的核酸酶的已发表的报告显示了CA2+细菌表达蛋白依赖的活性[21,22].然而,由于植物酶的活性可能会受到各种翻译后修饰的影响,我们决定检测这两个家族成员在短暂过表达拟南芥原生质体。在我们的研究中,我们转化了根细胞培养和叶中亲植物的原生质体,得到了相似的结果。
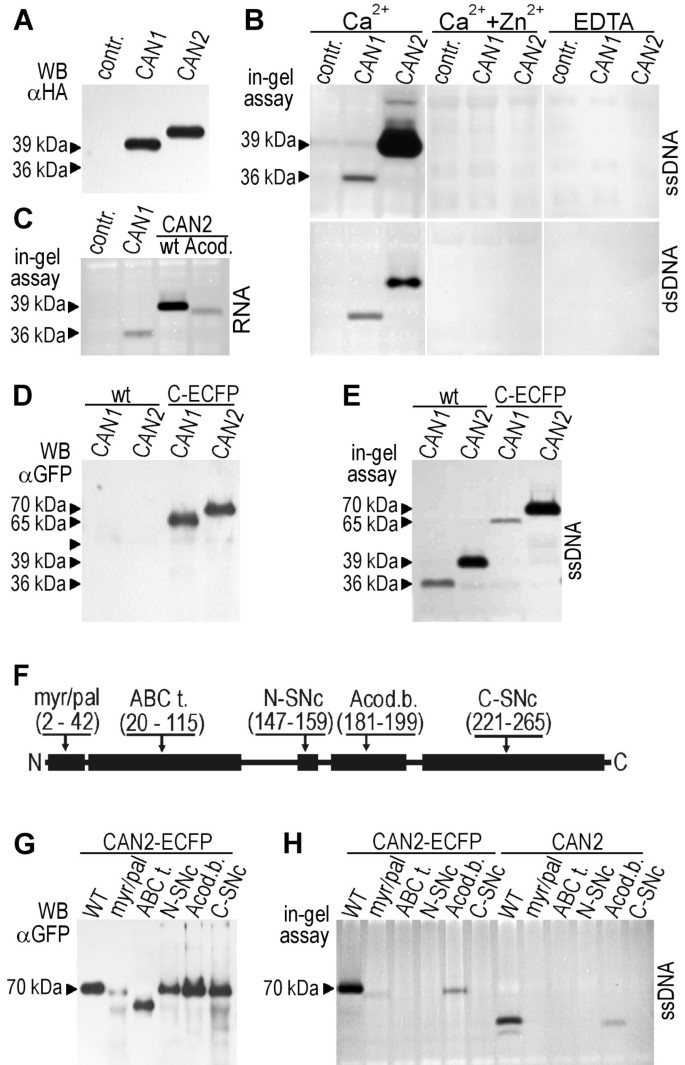
为了评估蛋白质合成的效率,将转化原生质体中提取的蛋白质进行Western blot分析,使用标记在转基因c端ha结构域的抗体。如图所示2首先,这两个转基因都能在原生质体中高效表达拟南芥悬浮细胞。使用Western印迹分析估计的重组CAN1和CAN2蛋白的分子量为约36kDa和39kDa,大致相同,从推导的氨基酸序列中预测:36.1kDa和37.3kDa。
瞬时表达的CAN1和CAN2核酸酶活性检测。用空载体转化的原生质体(PSAT6A-ECFP-N1)转化的蛋白质提取物作为阴性对照(反射。)。(一个HA标记的CAN1和CAN2核酸酶的Western印迹分析与抗HA抗体.如箭头所示,从凝胶电泳推断出分子质量。(B)采用凝胶核酸酶活性法检测CAN1和CAN2 dna酶活性。DNA底物(ssDNA, dsDNA)的类型,离子和EDTA添加到反应缓冲液中,如图所示。(C显示了CAN1野生型、CAN2野生型(wt)及其缺失反密码子结合样域(Acod)突变体的RNase活性。(d)野生型(WT)和ECFP标记(C-ECFP)CAN1和CAN2蛋白质的蛋白质印迹分析,具有抗GFP抗体。(E)采用凝胶核酸酶活性检测野生型(wt)和c -末端ecfp标记(C-ECFP) CAN1和CAN2 DNase活性。(F)缺失CAN2的突变体,缺少本文所描述的保守区域。(Myr/pal.) -豆蔻酰化和棕榈酰化基序。(ABC t.) - ABC转运体样序列。(N-SNc) SNc结构域的n端部分。(C-SNc) SNc域的c端部分。(Acod.b.) -反密码子结合样域。域名缩写下面括号中的数字表示从每个突变体中删除的氨基酸的范围。(G用抗gfp抗体对CAN2突变体进行Western blot分析。上述突变域的缩写(图2F)。(H) CAN2突变体核酸酶活性检测。突变域的缩写如下图所示2F)。
为了鉴定原生质体中过表达的CAN蛋白的dna酶活性,我们使用了凝胶核酸酶活性检测。将这种检测方法与作为底物的单链DNA结合使用,在钙离子的存在下,我们可以检测到与CAN1和CAN2的分子质量相对应的位置上具有明确的溶核活性的条带(图)2B).所有重复实验表明,尽管两种核酸酶的表达效率相当,但CAN2的核酸酶活性产量显著更高。用未变性DNA进行的类似实验表明,两种核酸酶也能消化双链DNA,但在这种情况下,两种核酸酶的活性是相当的。通过对反应条件的调整,我们估计出两种蛋白的最大活性都是在pH 8.0和Ca2+浓度约为5mm,范围为1至10 mm(数据未显示)。此外,我们发现在EDTA存在下,两种核酸酶没有揭示任何活动。用Zn观察到明显的抑制作用2+.此外,我们发现,电泳前在2-巯基乙醇存在下的热变性并没有抑制这两种酶的活性,这表明在它们的天然结构中缺乏功能上重要的二硫化物键。以植物总RNA为底物进行凝胶RNA酶试验(图2c)显示,两种核酸酶也具有降解RNA的能力,表明它们可以定义为糖 - 非特异性核酸酶。这种多种底物特异性表明,可以核酸酶的功能与降解过程有关。
在本研究中,我们还使用了CAN重组核酸酶与ECFP、GFP和RFP融合。由于带有c端或n端荧光标记蛋白的重组蛋白的稳定性可以在翻译后通过蛋白水解处理改变,我们也通过western blot和凝胶内核酸酶活性分析它们。如图所示2D和E,与共电泳的未标记蛋白相比,带有c标记ECFP的两种核酸酶的电泳迁移都有所延迟,这与它们的分子量增加相对应。此外,与未标记的CAN2相比,CAN2- ecfp的核酸酶活性似乎没有改变,明显强于CAN1-ECFP。
生物信息分析显示,除了SNC结构域外,植物还可以核酸酶,还含有一些未知功能的保守域。为了理解其对核渗透性活性的相关性,构建CAN2缺失突变体以除去区域,包括每个结构域的保守残基(图 2F).因为我们打算利用这些结构体来研究CAN2的溶核活性及其细胞位置,所以我们制备了untagged CAN2和cfp tagged CAN2的缺失突变体。尽管在所有重复实验中,转化条件相同,但我们观察到CAN2突变体数量减少,肉豆蔻酰化和棕榈酰化基元缺失,这表明该区域可能参与蛋白质稳定性(图)2G)。未标记的和CFP-稠CAN2的核酸酶活性的分析表明,突变体缺乏N-SNC,C-SNC域和ABC蛋白样基序,是完全无活性(图 2相反,与反密码子结合域相似的氨基酸序列的缺失会减少,但不会消除CAN2 dna酶的活性。这是特别有趣的,因为这个区域位于催化结构域内,但显然对CAN1/2 DNase和RNase的活性不是至关重要的(图)2C)。
CAN1核酸酶的表达在结膜发育和叶片衰老期间诱导,与宿主病原体相互作用相关,而CAN2的表达通常是本构
为了建立这两种CAN核酸酶的基因表达谱,我们分析了基因调查者报道的微阵列实验[29].本数据库收集了作者进行的419个微阵列实验(7137个样本)的结果拟南芥生物学。由于在许多情况下,通过几种研究组独立地分析了相同的基因表达的决定因素,我们认为它们的结果提供了获得有关所选基因表达模式的可验证和客观信息的机会。
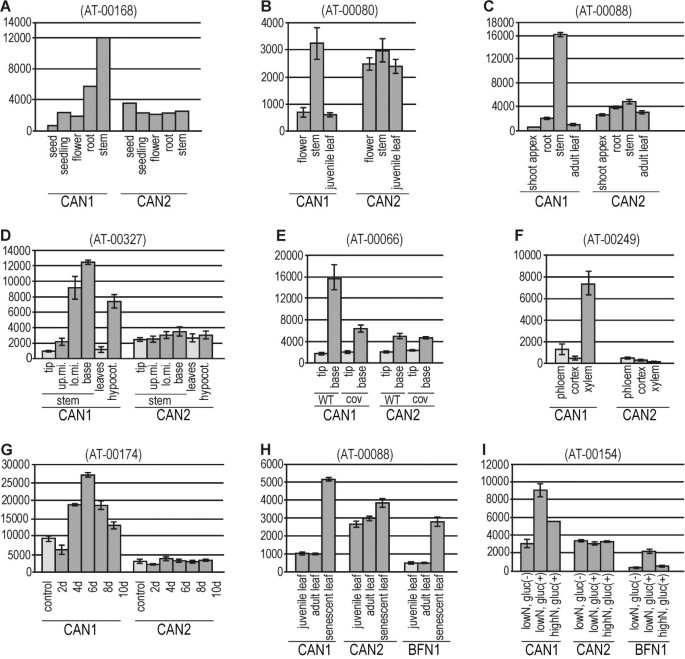
我们通过检测CAN1 [TAIR:At3g56170]和CAN2 [TAIR:At2g40410]基因在不同发育过程中的表达来开始我们的研究。原则上所有的微阵列实验都是进行比较的拟南芥组织特异性转录谱清楚表明CAN1核酸酶优先在茎和根中表达(图)3.得了,附加的文件1).另一方面,CAN1 mRNA在种子、幼苗、嫩叶和花中均有低表达。与CAN1相比,CAN2表达的器官特异性变异性相对较小。其他微阵列分析显示,CAN1在茎的上部转录水平较低,而在茎的下部转录水平显著升高(图)3.D, E).由于茎的这些部分主要是木质部发育的程度不同,这表明CAN1核酸酶可能参与了这个过程。这一假设已经被用于鉴定维管束不同部分(木质部、韧皮部、皮层)发育相关基因的实验所证实3.F),以及被诱导转分化为木质部管状分子的细胞中激活的基因(图3.G)。
基于微阵列的CAN1和CAN2基因的表达分析在不同发育阶段拟南芥。从genevinvestigator数据库中检索微阵列表达数据,并按照方法部分所述进行处理。括号中的数字为genevinvestigator提供的实验ID。在给定的实验中,编码CAN1 [TAIR:At3g56170]和CAN2 [TAIR:At2g40410]蛋白的基因表达量以信号值(y轴)显示。x轴表示如下文所述的治疗条件。浅灰色条——控制,深灰色条——在给定的实验中对处理的反应。(得了)三个例子的实验证明了CAN1基因的主要表达拟南芥干。(d e)两个实验表示CAN1表达对茎生长阶段的依赖性。在x轴上示出的缩写表示杆的部分:(。lo.mi)(尖) - - (up.mi.)阀杆头,茎的上部中间部分, - 降低干的中间部分,(基峰)- 茎基部。(COV) -答:芥浸突变影响血管组织的发展。(做减法)与木质部发育CAN1表达的相关性在根维管束(F)和在诱导的细胞中分化为气管元素(G).缩写(2d-10d)表示培养诱导后的天数。(设定h) CAN1表达水平与年龄依赖性(H)和糖处理诱导衰老的相关性(I)。缩写(low/high N)和(gluc +/−)分别表示培养基中氮和葡萄糖的浓度。衰老相关BFN1核酸酶的表达谱也显示出来。
在幼叶和成熟叶中,CAN1的表达水平较低,但随着叶龄的增加而增加。这种效应在发育性叶片衰老中可以观察到(图)3.H),以及因缺氮而导致衰老的叶片(图3.我)。3.H-I表明,CAN1核酸酶在衰老叶片中的表达模式与编码BFN1核酸酶的AT1G11190基因类似[5,6].两种基因,AT1G11190(BFN1)和AT3G56170(CAN1)也被列入约800个基因的列表中,显示在叶片衰老期间至少3倍的调节,由Buchanan-Wollaston鉴定等等。[30.].
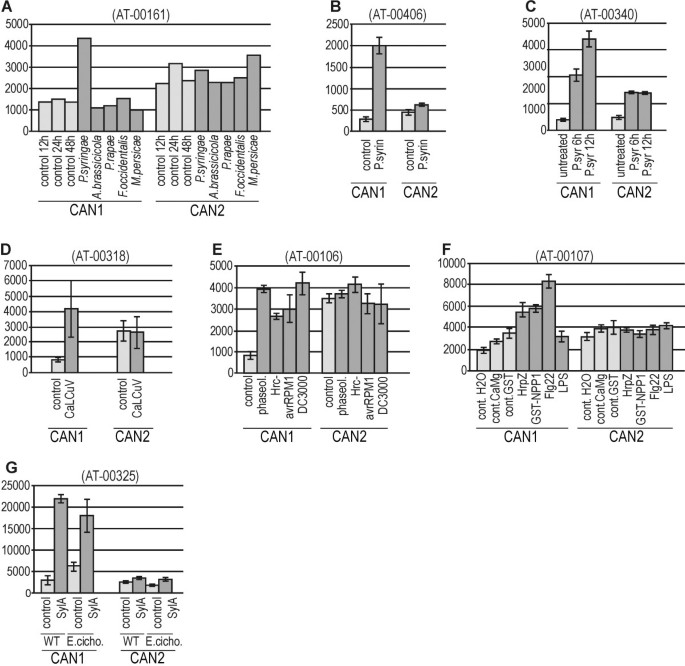
大量的微阵列研究表明,在环境胁迫下,CAN1的表达上调。与发育过程相似,外部刺激显著调节CAN1 (At3g56170)的表达,但对CAN2基因(At2g40410)的表达影响微弱。我们观察到,在所有测试的因素中,那些与发病机制相关的因素对CAN1表达的影响最大。实验分析如图所示4A-D和附加文件2清楚地表明,通过一些细菌和病毒刺激该基因的上调,而真菌,线虫和昆虫不会发挥这种效果。在进行研究各个方面的十个实验中假单胞菌sp。感染,九九揭示了CAN1 mRNA的升高,与该病原体遭到攻击的组织中的对照(图 4得了,附加的文件2).CAN1基因的转录也受到E.coli.(附加文件2, AT-00202)和dsDNA病毒CaLCuV(图4其他实验表明,CAN1的激活并不依赖于毒性假单胞菌菌株(vir / avir)(图 4E)也发生在诱导子治疗后。四项研究鞭毛蛋白对基因表达影响的实验中有三项表明,这种诱导子可以激活CAN1的转录(图)4f,附加文件2).在两个研究毒力因子紫丁香素A影响的实验中观察到CAN1基因的特别强的上调P.Syringae.(图 4G,额外的文件2).
响应于与发病相关的各种刺激的CAN1和CAN2基因基于微阵列的表达分析。从genevinvestigator数据库中检索微阵列表达数据,并按照方法部分所述进行处理。括号中的数字为genevinvestigator提供的实验ID。在给定的实验中,编码CAN1 [TAIR:At3g56170]和CAN2 [TAIR:At2g40410]蛋白的基因表达量以信号值(y轴)显示。x轴表示如下文所述的治疗条件。浅灰色条——控制,深灰色条——在给定的实验中对处理的反应。个别实验的详细参考资料在附加文件中给出2.(一个)微阵列研究显示,CAN1表达在应答细菌感染时被特异性激活。本文介绍了植物对以下微生物和昆虫病原体的反应:叶细菌(两PV。番茄),致病真菌叶(链格孢属brassicicola),组织咀嚼毛毛虫(地区rapae)、以细胞为食的蓟马(Frankliniella occidentalis)及以韧皮为食的蚜虫(myzus persicae.).(罪犯三个实验表明……的效果p .两(B-C)和DNA病毒(卷心菜曲叶病毒- calcuv) (D)对CAN1基因表达的影响。(E)不同的影响p .两CAN1表达的菌株。(F)不同病原菌源诱导子对CAN1基因表达的影响。(HrpZ) - Harpin诱导子,(NPP1) -坏死诱导子疫霉蛋白1 (Flg22) -鞭毛蛋白,(LPS) -脂多糖。(G)CAN1基因在用Syringolin A(Syla)处理的植物中的表达,并用Syringolin A和Syry白粉菌属cichoracearum感染。
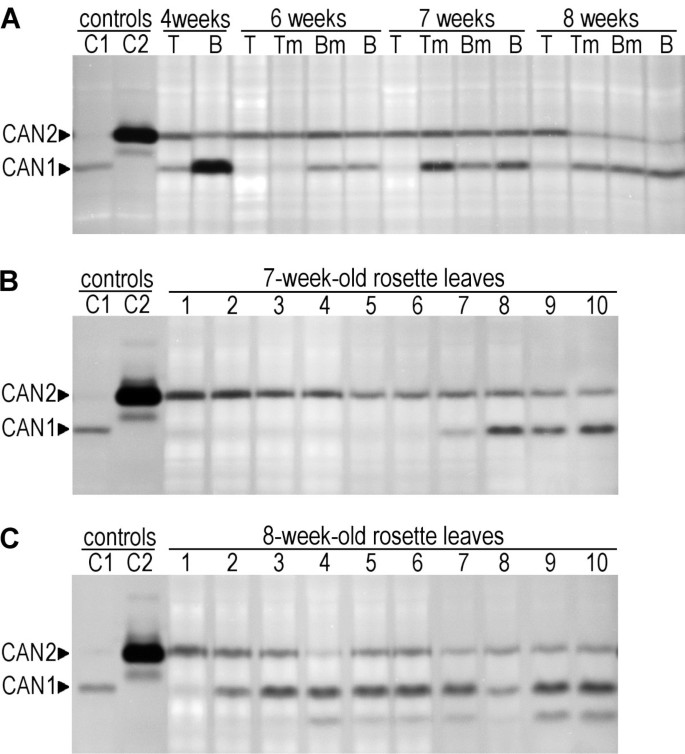
为了验证从微阵列实验获得的数据,我们检查了CAN1和CAN2基因的建议mRNA表达谱对应于任何内源的核溶解活性。我们分析了核酸酶的核酸酶活性曲线。Xylem的发展在杆的下部开始,该区域连续地朝向生长茎的上部移动。根据棕色呈现的方案等等。[31我们分析了从4至8周龄植物中获得的不同部分分离的蛋白质提取物。如图所示5A,凝胶中的核酸酶活性测定显示,由茎制备的样品含有迁移到与用作对照的过度表达的CAN1和CAN2相同位置的核酸次。对应于CAN2的内源性核酸酶的活性基本恒定,其同意从微阵列数据衍生的观察。相反,随着CAN1以相同的方式迁移内源性核酸酶的活性是更可变的,即茎的上部是不可见的或弱的,并且朝向茎底增加。
内源性CAN1和CAN2活性。(一个)茎发育过程中内源CAN1和CAN2活性的变化。对4 ~ 8周龄茎中蛋白质提取物的dna酶活性进行了分析。(T) -茎尖,(Tm) -茎上中部,(Bm) -茎下中部,(B) -茎基。以原生质体中瞬时表达的CAN1 (C1)和CAN2 (C1)核酸酶为阳性对照。(c) 7周龄单叶内源CAN1和CAN2核酸酶活性(B)及8周大(C玫瑰花园。连续的叶子提取物从最小(1)到最旧的(10)叶片的玫瑰花属。CAN1(C1)和CAN2(C1)控制如上所述(图 5一个)。
为了鉴定与衰老相关的核酸酶,我们分析了从7和8周龄植物的单个玫瑰花叶中获得的蛋白质提取物。如图所示 5B和C,与CAN1相对应的内源核酸酶活性在7周龄莲座叶片中首次出现,在8周龄莲座叶片中更为常见。因此,这一结果支持了CAN1核酸酶在年龄依赖性发育中的作用。在7周龄和8周龄的叶片以及年轻植株(数据未显示)的叶片中鉴定出的CAN2核酸酶活性更稳定,这支持了该核酸酶具有结构性表达的假设。
观察到内源性核酸酶活性的假设是指CAN1和CAN2蛋白质源于相应的蛋白质具有完全相同的电泳迁移率,催化要求和对热变性,洗涤剂和2-巯基乙醇的异常抗性的事实。对还原剂的抗性提供了与植物S1型核酸酶区分内源性植物样核苷酸酶的机会,该核酸酶具有二硫键,并且在我们的经验中受到2-甲甲乙烯醇(未示出的数据)抑制。这使我们允许我们得出结论,通过我们的蛋白质活性测定证实的微阵列mRNA表达数据,同时表明CAN1核酸酶的表达与不同形式的PCD相关,例如木质发育或衰老,而CAN2表达通常是组成型。
的CAN1和CAN2核酸酶锚定到质膜,可能是通过N端豆蔻酰化和棕榈酰化
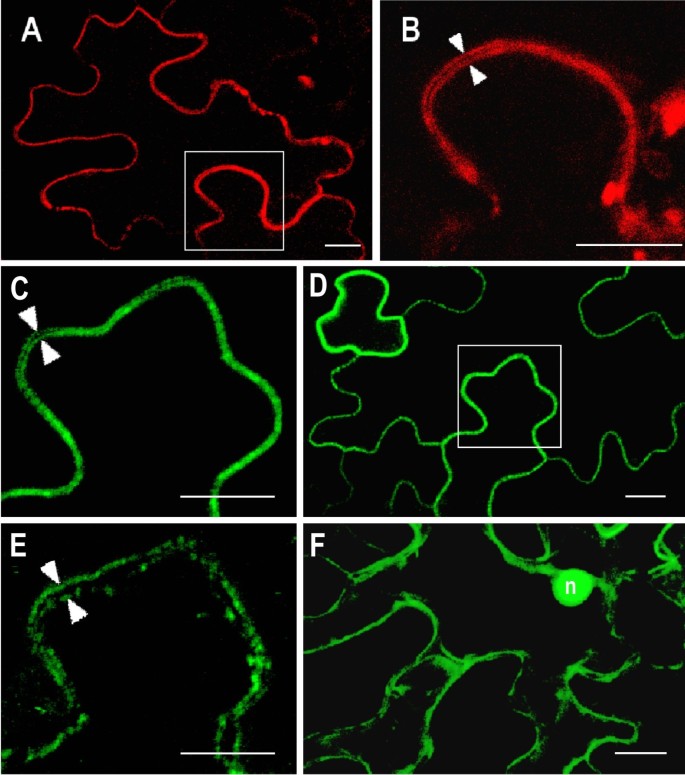
为了确定CAN核酸酶在细胞内的分布,我们暂时表达了翻译融合结构CAN1-ECFP和CAN2-ECFP拟南芥根原生质体。阴性对照使用空载体质粒pSAT4A-ECFP(仅表达ECFP)。如图所示6单独的ECFP作为对照,通常分布于整个细胞质和细胞核。反过来,在原生质体周围可以看到过表达的CAN1和CAN2核酸酶与ECFP融合的荧光环(图)6B, C).我们在转化的叶原生质体中观察到这两种蛋白相同的亚细胞位置(附加文件3.).用相同结构转染的原生质体,但通过荧光显微镜分析显示原生质体表面的荧光一致(附加文件4).这些荧光图像表明这两种核酸酶都与质膜有关。为了确保具有核酸酶活性的蛋白质的这种不寻常的位置不是原生质体制备过程的人工结果,我们还分析了这两种核酸酶在转化植物细胞中的位置农杆菌肿瘤术.如图所示7A和D, CAN1-RFP和CAN2-GFP融合蛋白的荧光沿转化表皮细胞边缘呈锐利的线条。所选区域的放大显示荧光信号形成两条平行线,表示两个相邻细胞的细胞膜(图)7B, C)。此外,如图所示7e,干旱诱导的质子溶液引起荧光信号朝向细胞中心的位移,进一步证明了可以用质膜核酸酶的核酸酶。
对CAN核酸酶氨基酸序列的生物信息学分析未发现明显的跨膜结构域疏水区。为了识别可能与质膜相互作用的片段,我们应用了CAN2核酸酶的缺失突变体(图)2F)用于转染实验。如图所示8B-E、abc样结构域、反密码子结合样结构域和SNc结构域的缺失突变均不影响CAN2的质膜定位。相反,缺失含有豆蔻酰化/棕榈酰化基元的n端片段会显著影响该核酸酶的亚细胞定位(图)8一个)。从CAN1核酸酶中去除MyRistoylation / Palmitylation术语导致相同的效果(图 8F)。由于已知膜靶向所需的N-末端MyRistoylation,并且近端半胱氨酸残基的棕榈酰基织物极大地稳定膜结合,我们得出结论,核酸酶最大可能通过这些后期改性锚定血浆膜。
CAN核酸酶缺失突变体的亚细胞定位。瞬时表达ecfp融合蛋白拟南芥根细胞的原生质体。亮场图像显示在每个面板的左侧部分中,并且相应的共聚焦激光扫描图像位于右侧。图像显示缺乏以下共识序列的ECFP融合蛋白的细胞位置:(一个CAN2突变体缺乏n -豆蔻酰化和棕榈酰化一致序列。(BCAN2突变体缺乏ABC转运体样序列。(C)CAN2突变体缺乏N-SNC结构域。(D缺失反密码子结合样序列的CAN2突变体(E缺失C-SNc结构域的CAN2突变体。(FCAN1突变体缺乏n -豆蔻酰化和棕榈酰化一致序列。突变域的缩写如下图所示2F面板右下角白色刻度条长度为10 μm。
我们考虑到CAN核酸酶可以根据与PCD相关的各种细胞和外源性因子改变其位置。为了验证这种可能性,我们对含有过表达CAN1-ECFP和CAN2-ECFP的原生质体进行以下因素的处理,处理范围在括号内:H2O2(0.1-1mM),热应激(36-55°C),盐胁迫(NaCl 0.1-1M), flg22肽(0.1-1mM),大肠杆菌菌株DH5α(OD 0.01)和A.tumefaciens菌株GV3101(OD 0.01)。此外,我们比较了在原生质体上含量的核酸酶的细胞位置比较从杨(6周龄),成熟(8周龄)和早期衰老(12周龄)玫瑰花叶中制备的原生质体上过度表达。但是,我们没有观察到上述治疗的任何影响亚细胞位置(数据未显示)。此外,我们没有检测原生质体介质中的过表达的蛋白质,表明在测试条件下它们没有从细胞分泌(数据未显示)。这些结果表明,核酸酶可能不会在可能触发PCD或植物防御反应的压力条件下改变其蜂窝定位。
讨论
尽管具有显著的序列相似性,具有SNase结构域的真核蛋白似乎实现了不同的生化和生物学功能。例如,Tudor葡萄球菌核酸酶(Tudor- sn)既具有DNase活性,又具有RNase活性,特异性地与dsRNA底物相互作用并促进其裂解。由于该蛋白是RISC复合物的组成部分,预计它有助于在RNAi中观察到的RNA降解[32].葡萄球菌核酸酶的另一真核同源物parB,在进化过程中获得了一种新的功能,作为氧化还原酶[33].我们试图发现的潜在核酸酶活性拟南芥我们与本文所述研究并行进行的parB-like蛋白[TAIR:AT1G31170]也未显示该蛋白的任何核酸酶活性(数据未显示)。
本文主要研究了属植物的酶的分子活性和生物学功能拟南芥两个成员蛋白质,其特征在于单个Snase结构域的存在。使用原生质体的瞬时表达测定与生化方法一起使我们能够表明CAN1和CAN2表现出类似于细菌鼻腔的钙依赖性的脱氧核酸酶活性。我们发现,尽管存在保守的钙结合和催化氨基酸残基可以在Snase结构域中存在,但它们还含有另外的保守的基序,其显示出对某些细菌TRNA合成酶的抗ocodon结合结构域的强烈同源性。虽然这两个域似乎具有细菌来源,但它们在任何已知的原核蛋白中的这种布置中不会一起发生。推定的RNA结合基质如何影响植物核酸酶的DNase活性仍然未知。然而,由于该基序的缺失降低,但不能消除DNA酶和RNase活性,因此可以推测抗癌剂结合结构域有助于增强CAN核酸酶催化活性。
尽管它们是氨基酸序列相似性,CAN1和CAN2表现出一些显着差异。我们证明,虽然CAN1核酸酶以相当的效率消化单链和双链DNA,但CAN2强烈更喜欢单链DNA作为其基材。此外,编码两个核酸酶的基因表现出根本上不同的表达谱,这可能表明,尽管具有相同的亚细胞分布,但它们在常见的生物过程中不合作。
这两种CAN核酸酶最显著的特征似乎是它们不同寻常的细胞定位。迄今为止所研究的核酸酶是在含有核酸的细胞室中发现的,如细胞核[1]、质体及线粒体[34或者在最终应用之前储存的细胞器中,例如液泡[12.),溶酶体(1]其他细胞内膜囊泡[6].据我们所知,本文描述的CAN酶是唯一与质膜相关的真核核酸酶。考虑到CAN核酸酶在不同位置的潜在功能,质膜核酸酶可能参与了植物细胞对病原菌入侵的防御反应。我们发现CAN1的表达与细菌和病毒感染密切相关,这可能支持这一假设。然而,对CAN1基因表达模式的整体分析表明,其基因的激活也与木质部形成和叶片衰老等与致病反应无关的发育过程有关。因此,CAN1核酸酶似乎不参与病原体的遗传物质降解,除非它具有不止一种功能。同样,目前还不能排除这个家族的第二个成员,组成型表达的CAN2核酸酶参与了一些尚未明确的病原体DNA在细胞表面或核内体处理的机制。
对CAN1表达谱的详细分析表明,它的基因在导致可控细胞死亡的两个发育过程中特异性上调,即木质化和衰老。在细菌和病毒攻击下诱导CAN1表达也可能与细胞死亡有关,因为识别无毒病原体可以触发与耐药性相关的PCD,这是一种超敏反应,也涉及DNA降解。值得注意的是,一些HR诱导烟草脱氧核糖核酸酶[35],尚未鉴定其编码序列,具有与本文所呈现的CAN1和CAN2的催化性质。顾客还提出了可以涉及核酸酶的假设,也可以参与PCD等等。[23,他们观察到黄瓜同源物CsCaN的表达增加与原始花药特异性DNA损伤的相关性。此外,值得注意的是CAN核酸酶高效和非特异性降解DNA和RNA的能力也是PCD相关降解过程的特征。
据认为,某些类型的植物PCD降解过程的主要功能之一,主要在衰老的情况下,是营养物质从死亡细胞重新分配到扩张或下沉组织。由于氮缺乏是限制植物生长的主要营养因素,大多数研究都集中在了解蛋白质释放的还原氮的再利用,特别是从植物中最丰富的蛋白质Rubisco释放的还原氮。现有证据表明,这是一个多阶段的过程,其特征是细胞内或细胞间的区隔化[36].通过塑性和真空内肽酶引发的Rubisco的降解持续到单一氨基酸中,然后将其溶于氨基,最终将其重新归于谷氨酸,谷氨酰胺和天冬氨酸。由于这些氨基酸在较晚的衰老期间增加了这些氨基酸的浓度,因此它们是蛋白质降解的长距离滑移产物的主要形式的主要形式[37].尽管初始蛋白水溶液发生在衰老中间细胞中,但是随后的步骤,由谷氨酸脱氢酶(GDH)或谷氨酰胺合成酶(GS)催化,在与血管束相邻的细胞中发生,例如血管薄壁或伴侣细胞[38].
分解代谢途径负责回收的核酸来源的营养物质比那些有关蛋白质的了解要少得多。核苷酸是细胞内氮的第二主要来源,也是磷的重要储存源。然而,PCD过程中核酸被降解到何种程度,降解产物如何通过韧皮部进行长途运输,目前尚不清楚。核酸降解可能是由s1型酶引起的,如BFN1、Zen1、Ben1等,其表达与不同类型的植物PCD相关。这些核酸酶产生的反应产物的性质尚不清楚,但由于这些酶具有内切酶活性,它们可能产生大小不同的DNA片段。但衰老过程中韧皮部汁液含量的研究未发现任何DNA片段或单个脱氧核苷酸。相反,在韧皮部血管中发现了一些核碱基和磷转运体的明显表达[39,40建议,一些额外的反应必须导致S1型核酸酶衍生的DNA片段和随后的核苷酸分解代谢的进一步降解。此外,假设与氨基酸类似的核苷酸在与血管束相关的细胞中被分解代谢,还应考虑负责来自染色细胞的细胞间转移的一些机制。这是假设的,过程与那些类似的过程,使支原体能够获得核酸前体。由于此处呈现的CAN1核酸酶似乎与PCD及其性质类似于支原体膜核酸酶,因此我们打算验证该酶与DNA降解与染色细胞和细胞之间的降解产物的转移结合的假设。负责进一步的核苷酸分解代谢过程。
目前的知识状态不允许我们清楚地解释在上述过程的哪个阶段可能涉及CAN核酸酶,有关其功能的各种假设需要进一步研究。然而,对一类以质膜定位为特征的新型核酸酶的鉴定表明,植物细胞具有额外的、到目前为止尚未被描述的DNA降解机制。
结论
血浆膜的主要功能之一是提供对细胞生长重要的分子的高度选择性传输。在接受PCD的植物组织中观察到从降解的大分子释放的营养素的强化出口。虽然核酸是富含氮的富核来源,但是磷和核苷酸碱基对于来自染色细胞的DNA和RNA降解产物的出口而言很少。在含有核酸的细胞室或在最终应用之前储存的细胞器中,在PCD中鉴定负责在PCD期间的基因组DNA降解的核酸酶。在这篇论文中,我们提出的证据表明,两种植物葡萄球菌样核酸酶属于一个新的,尚未识别的真核核酸酶类,其特点是独特的质膜定位。该类核酸酶的鉴定表明植物细胞具有额外的额外组织,负责核酸降解的机制。
方法
生物信息分析
cDNA序列编码拟南芥CAN1 [TAIR:At3g56170], CAN2 [TAIR:At2g40410]和细菌蛋白如图所示1[NCBI: YP_004267097, YP_004174706 YP_004267097;GenBank: EGW73615, EGW73615从NCBI (http://www.ncbi.nlm.nih.gov).为了比对氨基酸序列,BLASTP (http://blast.ncbi.nlm.nih.gov/blast.cgi.)及CLUSTALW (http://www.ebi.ac.uk/Tools/clustalw2)的程序。使用在线工具鉴定了保守的蛋白结构域和结构域(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi).
Myristoylator (http://www.expasy.ch/tools/myristoylator/)计划和CSS-Palm软件(http://csspalm.biocuckoo.org/index.php)分别预测N端肉豆蔻酰化位点和棕榈酰化位点。使用TMHMM进行跨膜区域预测(http://www.cbs.dtu.dk/services/TMHMM-2.0), SOSUI (http://bp.nuap.nagoya-u.ac.jp/sosui/sosui_submit.html)和psort程序(http://www.psort.org/).
在基因表达模式的硅分析中,使用了由genevinvestigator提供的公开的微阵列表达数据[29)(https://www.genevestigator.ethz.ch/at).Genevestigator软件的元型谱刺激工具用于估计响应于不同的外部刺激的基因表达水平。单个阵列的信号值是从元型北部工具图中获得的,并转移到Microsoft Excel电子表格,以计算标准误差值并创建图表。
cDNA的克隆与表达
总RNA从30天孤立拟南芥玫瑰花瓣使用TRIzol试剂(Invitrogen)根据制造商的说明。用寡核苷酸(dT)引物和MMLV逆转录酶(Promega)按照随酶提供的协议将mRNA逆转录为单链cDNA。采用巢式PCR扩增CAN1和CAN2蛋白的cDNA。第一轮扩增是使用Primer3程序为两个cdna设计的特异性引物(http://biotools.umassmed.edu/bioapps/primer3_www.cgi).以PCR产物为模板,利用分别在5'和3 '端含有人工SalI和BglII限制性内切酶位点的引物进行第二次PCR反应。用于RT-PCR扩增的引物见表1.通过将两个编码ha标记域的互补寡核苷酸与pSAT6A载体连接,设计了一个表达ha标记融合蛋白的表达载体[41.].将含有终止密码子的CAN1和CAN2蛋白的PCR产物经SalI和BglII酶切酶切后连接到pSAT6A载体上。缺少终止密码子的PCR产物用同一对酶切酶切后分别连接到pSAT6A-HA和pSAT6A-ECFP-N1载体HA结构域或ECFP报告基因5 '端框架内。所得结构通过测序得到证实。
转换拟南芥叶表皮细胞,来自pSITE系列的载体[42.使用过。编码CAN1和CAN2氨基缺乏它们的天然终止密码子,并通过具有attB1和attB2位点的侧翼序列的PCR产物,根据制造商的方案(Invitrogen)克隆到的pDONR供体载体。然后,CAN1和CAN2编码序列通过Gateway重组反应分别转移到pSITE-4NB(RFP)和pSITE-2NB(GFP),。目的地载体转化到农杆菌肿瘤术GV3101通过传统的冻融和熔融法。
SDS-PAGE和Western blot
采用Hoefer Mighty Small II凝胶体系,按照标准方案进行SDS-PAGE分析。采用Biometra Fastblot B43半干转移系统(0.8 mA/cm)将蛋白转移到Amersham Hybond-P PVDV膜上2,1个小时)。将该膜按照制造商的说明书和堵塞洗涤。分别5000,:主抗HA抗体(Santa Cruz Biotechnology公司)和次级抗大鼠HRP-缀合的抗体(Sigma)稀释1:200和1。与GE医疗ECL Plus蛋白质印迹检测系统进行蛋白质的免疫学检测。
瞬时基因表达拟南芥叶和原生质体
原生质体的拟南芥如他所描述的那样制备根部细胞(由教授提供。伊丽莎白jamet)和从叶片蛋白质中提供的。等等。[43.]和yoo等等。[44.),分别。在peg介导转化12小时后,原生质体被制备用于显微分析或收获用于制备蛋白提取物在体外测定。通过蛋白质样品缓冲液中的直接原生质体裂解(30%甘油(v / v),160mM Tris-Cl pH 6.8,6%SDS),补充有5mM EDTA和4%(Vol / Vol)2-巯基乙醇,制备蛋白质提取物。.通过Bradford试剂(Pierce)取出各种提取物的等分试样测量蛋白质浓度。然后将萃取液在-20℃下迅速冷冻。
对于瞬时表达拟南芥叶子,农杆菌菌株携带目的载体在转化缓冲液中稀释(10mM的MES,pH值5.8; 10mM的氯化镁2;0.15mm acetosyringone)到OD6000.05并用注射器施用于4-6周龄植物的叶子的下侧。
凝胶内核酸酶活性测定
dna酶活性的检测如前所述[9]随着以下修改。将堆叠凝胶富含1mM EDTA以除去蛋白质提取物中存在的残余离子。分辨迷胶含有超声物的小腿胸腺DNA(0.008mg / ml)。对于单链DNase活性,在浇注凝胶之前将DNA煮沸5分钟。为了鉴定瞬时表达的核酸酶的活性和内源性核酸酶活性,分别使用1μg和10μg蛋白质提取物。将蛋白质提取物在100℃下在富含2-巯基乙醇的标准样品缓冲液中孵育5分钟。在+ 4℃下进行电泳施加10V / cm。电泳后,将分离凝胶在室温下浸泡两次20%(v / v)异丙醇。随后,将凝胶洗涤两次15分钟,并在含有1%(v / v)Triton X100和20mM Tris-Cl(pH8.0)的复发缓冲液中孵育48小时。为了测试低pH对核酸酶活性的影响,使用25mM乙酸钠(pH5.5)代替Tris-Cl。 Depending on the experiment, the renaturation buffers were supplemented with either 1-10mM CaCl2, 0.2 mM氯化锌2或5mm EDTA。温育后,洗涤凝胶,然后在含有10mM Tris,1mM EDTA和0.01mg / mL乙阳氨酸的冰冷缓冲液中染色,以显示核酸酶的位置。
从蛋白质提取物的制备拟南芥茎和叶
拟南芥植物(哥伦比亚生态型)在无菌土壤盆栽(50ml)中生长(光照16 h,黑暗8 h)。昼夜温度分别设置为22℃和18℃。用MS矿质溶液每天浇灌和施肥。如结果部分所示,选择的器官在生长的各个阶段收获,并直接用于制备蛋白质提取物。植物碎片放入液氮了5分钟。解冻后,0.05 - -0.2毫升样品缓冲(甘油30% (v / v), 160毫米Tris-Cl pH值6.8,6% SDS)补充5毫米EDTA和4%(卷/期)2-mercaptoethanol倒在样品然后动摇(1400 rpm) 5分钟在99°C。最后,在3000×g离心5分钟后,测定蛋白提取物的蛋白浓度,并在−20℃保存。
共聚焦显微镜分析
共聚焦激光扫描显微镜使用尼康A1Rsi倒置共聚焦显微镜。来成像荧光蛋白的融合拟南芥原生质体使用PLAPO100x OI(NA = 1.4)目的。通过457nm氩激光激发ECFP荧光,并使用定制482/35nm带通发射过滤器检测。为了在叶片表皮中可视化蛋白质融合,使用CFI LWD APO 40x Wi(Na = 1.15)目的。使用488nm氩激光激发EGFP荧光,并使用定制525/50nm带通发射过滤器检测。使用561nm氦氖激光激发MRFP荧光,并使用定制595/50nm带通发射过滤器检测。数据被收集为单个光学部分或作为一系列Z堆叠并使用imagej软件进行处理。
缩写
- 能够:
-
钙依赖的核酸酶
- 纤毛运动:
-
程序性细胞死亡
- 西门子数控(南京)有限公司:
-
葡萄球菌核酸酶。
参考文献
- 1。
细胞凋亡过程中染色体DNA的降解。细胞死亡不同。2003,10:108-16。10.1038 / sj.cdd.4401161。
- 2.
《衰老与死亡的定义》。中国生物医学工程学报,2003,21(4):457 - 461。10.1093 / jxb / erg133。
- 3.
郭颖,蔡志强,甘树华:拟南芥叶片衰老的转录组。acta botanica sinica(云南植物学报),2004,27(5):521-549。10.1111 / j.1365-3040.2003.01158.x。
- 4.
BEN1和ZEN1 cdna编码与植物细胞程序性死亡相关的s1型dna酶。2 .中华人民共和国农业部。1998,429:134-8。10.1016 / s0014 - 5793(98) 00563 - 8。
- 5。
Pérez-Amador MA, Abler ML, De Rocher EJ, Thompson DM, van Hoof A, LeBrasseur ND, Lers A, Green PJ:拟南芥叶片和茎衰老过程中诱导的BFN1双功能核酸酶的鉴定。植物生理学报。2000,22(4):489 - 494。10.1104 / pp.122.1.169。
- 6。
Farage-Barhom S, Burd S, songo L, Perl-Treves R, Lers A: BFN1核酸酶基因启动子在衰老、脱落和程序性细胞死亡相关过程中的表达分析。中国生物医学工程学报,2008,29(5):457 - 461。10.1093 / jxb / ern176。
- 7。
ITO J,Fukuda H:ZEN1是气管元素的细胞死亡期间核DNA降解的关键酶。植物细胞。2002,14:3201-11。10.1105 / TPC.006411。
- 8.
Panavas T, Pikula A, Reid PD, Rubinstein B, Walker EL:从黄花菜花瓣中鉴定衰老相关基因。植物生态学报,1999,19(4):489 - 494。10.1023 /: 1006146230602。
- 9.
Leśniewicz K, Pieńkowska J, Poręba E:花椰菜幼苗发育的核酸酶特性。植物营养与肥料学报,2010,27(4):591 - 598。10.1016 / j.jplph.2010.03.011。
- 10.
Li Ly,Luo X,Wang X:内切核酸酶G是一种从线粒体释放时的凋亡DNase。自然。2001,412:95-9。10.1038 / 35083620。
- 11.
Hara-Nishimura I,Hatsugai N:液泡在植物细胞死亡中的作用。细胞死亡有所不同。2011,18:1298-1304。10.1038 / CDD.2011.70。
- 12.
Obara K, Kuriyama H, Fukuda H:百日草细胞程序性死亡过程中液泡破裂引发的活跃和快速核降解的直接证据。植物生理学报。2001,25(6):615- 626。10.1104 / pp.125.2.615。
- 13.
码码-Barhom S,Burd S,Sonego L,Mett A,Belausov E,Gidoni D,Lers A:拟南芥的定位衰老和细胞死亡相关的BFN1核酸酶:从ER到碎片核。莫尔植物。2011,4:1062-73。10.1093 / MP / SSR045。
- 14。
Mulcahy H, Charron-Mazenod L, Lewenza S:铜绿假单胞菌产生一种细胞外脱氧核糖核酸酶,这是利用DNA作为营养来源所必需的。环境微生物学杂志。2010,12:1621-9。
- 15.
Paddenberg R,韦伯A,沃尔夫S,Mannherz HG:支原体核酸酶能够诱导在培养的细胞间DNA降解具有真核细胞凋亡核酸酶的许多特征。细胞死亡有所不同。1998年,5:517-28。10.1038 / sj.cdd.4400380。
- 16。
猪肺炎支原体mhp379是暴露在细胞表面的一种Ca2+ -依赖的糖非特异性外切酶。中国微生物学杂志,2007,29(4):434 - 434。10.1128 / JB.01835-06。
- 17。
肺支原体膜核酸酶mnuA基因的克隆及其在大肠杆菌中的表达分析中国微生物学杂志,1999,19(4):457 - 461。
- 18。
Li L,Krishnan M,Baseman JB,Kannan TR:Ca2 +依赖性,膜相关核酸核糖酶的分子克隆,表达和表征。J细菌。2010,192:4876-84。10.1128 / jb.00401-10。
- 19.
唐建军,周瑞,史晓霞,康敏,王慧,陈华:金黄色葡萄球菌中两种耐高温核酸酶的同时存在及其突变和体外表达的证据。微生物学杂志,2008,34(4):427 - 434。10.1111 / j.1574-6968.2008.01194.x。
- 20.
Sundström JF, Vaculova A, Smertenko AP, Savenkov EI, Golovko A, Minina E, Tiwari BS, Rodriguez-Nieto S, Zamyatnin AA, Välineva T, Saarikettu J, Frilander MJ, Suarez MF, Zavialov A, Ståhl U, Hussey PJ, Silvennoinen O, Sundberg E, Zhivotovsky B, Bozhkov PV:都铎葡萄球菌核酸酶是程序性细胞死亡降解体中进化保守的组成部分。细胞生物学杂志。2009,11:1347-54。10.1038 / ncb1979。
- 21.
ISONO K,SATOH K,Kobayashi H:编码新型CA2 +依赖性核酸酶的cDNA的分子克隆类似于葡萄球菌核酸核酸酶。Biochim Biophys Acta。2000,1491:267-72。10.1016 / s0167-4781(00)00007-5。
- 22.
郭凯,刘树华,张晓霞:拟南芥钙依赖核酸酶的克隆、表达和分子生物学特性。中国生物医学工程学报。2012,32(4):457 - 461。10.1016 / j.pep.2012.03.007。
- 23。
顾海涛,王东辉,李霞,何春霞,徐振华,白南春:一种乙烯诱导的钙依赖核酸酶在黄瓜花发育中的表达差异。植物营养学报,2011,32(4):591 - 598。10.1111 / j.1469-8137.2011.03825.x。
- 24。
张春梅,侯玉梅,张春梅:半胱氨酸- trna合成酶对RNA的形状选择性识别。中国生物医学工程学报。2004,11:1134-41。10.1038 / nsmb849。
- 25.
Aicart拉莫斯C,瓦莱罗RA,罗德里格斯·克雷斯波我:蛋白质棕榈酰化和亚细胞贩卖。Biochim Biophys Acta。2011年,1808:2981-94。10.1016 / j.bbamem.2011.07.009。
- 26。
瓦松B,Giglione C,Meinnel T:意外的蛋白质家族包括细胞防御组分在高等真核生物的N- myristoylome功能。J Biol Chem。2003,278:43418-29。10.1074 / jbc.M307321200。
- 27。
Ren J,Wen L,Gao X,Jin C,Xue Y,Yao X:CSS-Palm 20:Palmitoylation网站预测的更新软件。蛋白质ENG DES SEL。2008,21:639-44。10.1093 /蛋白/ GZN039。
- 28。
李世杰,Böhm A,李志刚,李志刚:古生菌结合蛋白依赖转运的基本原理。微生物趋势,2007,15:389-97。10.1016 / j.tim.2007.08.002。
- 29。
齐默尔曼P,赫希 - 霍夫曼男,亨尼格L,Gruissem宽:GENEVESTIGATOR拟南芥微阵列数据库和分析工具箱。植物理性。2004年,136:2621年至2632年。10.1104 / pp.104.046367。
- 30.
Buchanan-Wollaston V,Page T,Harrison E,Breeze E,Lim Po,Nam Hg,Lin JF,Wu Sh,Swidzinski J,Ishizaki K,Leaver CJ:比较转录组分析显示出发展和发射之间的基因表达和信号通路的显着差异。拟南芥中的黑暗/饥饿诱导的衰老。工厂J. 2005,42:567-85。10.1111 / J.1365-313x.2005.02399.x。
- 31.
Brown DM, Zeef LA, Ellis J, Goodacre R, Turner SR:利用表达谱和反向遗传学鉴定拟南芥中涉及次级细胞壁形成的新基因。acta botanica sinica(云南植物研究),2017,34(5):531 - 534。10.1105 / tpc.105.031542。
- 32.
Caudy AA, Ketting RF, Hammond SM, Denli AM, Bathoorn AM, Tops BB, Silva JM, Myers MM, Hannon GJ, Plasterk RH: RNAi效应复合物中的微球菌核酸酶同源物。自然科学进展。2003,25(4):417 - 418。10.1038 / nature01956。
- 33.
Basu Mk,Koonin EV:来自细菌染色体分区蛋白Parb的真核半胱氨酸亚磺酸还原酶的演变。细胞周期。2005,4:947-52。10.4161 / cc.4.7.1786。
- 34.
dppd1外切酶介导的组织特异性细胞器DNA降解。植物学报,2011,32(6):1391-1393。10.4161 / psb.6.9.16595。
- 35。
一种烟草超敏反应细胞死亡诱导的内切酶活性的鉴定、鉴定和纯化。acta botanica sinica(云南植物学报),1995,7:1951-62。
- 36。
大麦和小麦的叶片衰老和养分恢复。植物生物(Stuttg)。2008,10(增刊1):37-49。
- 37.
C3植物叶中管束鞘细胞的作用。中国生物医学工程学报,2008,29(5):457 - 461。
- 38。
Tercé-Laforgue T, Dubois F, Ferrario-Méry S, de Crecenzo MA, Sangwan R, Hirel B:外源提供氨或光呼吸释放氨时,烟草的谷氨酸脱氢酶主要在韧皮部伴生细胞的胞质中诱导。植物营养与肥料学报。2004,31(4):489 - 494。10.1104 / pp.104.047548。
- 39。
Möhlmann T, Bernard C, Hach S, Ekkehard Neuhaus H:核苷运输和相关代谢。植物生态学报。2010,12:26-34。
- 40.
乙烯调控矮牵牛花花冠衰老过程中磷的再活化和磷酸转运蛋白PhPT1的表达。中国海洋大学学报(自然科学版)。10.1093 / jxb / erp092。
- 41.
引用本文:李俊,田文华,田文华,李俊。pSAT载体的构建及其在植物自荧光蛋白标记和表达中的应用。植物营养与肥料学报。2005,27(6):593 - 598。10.1007 / s11103 - 005 - 0340 - 5。
- 42.
植物自荧光蛋白的稳定整合或瞬时表达的PSITE载体:探索烟草病毒与烟草病毒的相互作用。植物营养与肥料学报,2007,20(4):429 - 434。10.1094 / mpmi - 20 - 7 - 0740。
- 43.
他P,Shan L,Sheen J:使用原生质体来研究先天免疫反应。方法Mol Biol。2007,354:1-9。
- 44.
刘志强,赵永华,王志强:拟南芥叶肉原生质体的瞬时基因表达分析。Nat protocol . 2007, 2: 1565-72。10.1038 / nprot.2007.199。
承认
我们要感谢伊丽莎白Jamet来自CNRS-Université为我们提供拟南芥以及Angelika Chudzik和Agnieszka Błasińska寻求技术援助。这项工作由波兰国家科学中心资助:NN301 034740到KL, NN303 813140到EP, NN303 813540到MS。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称,他们没有竞争的利益。
作者的贡献
KL对研究的概念和设计做出了实质性的贡献,完成了所有的分子生物学实验,并起草了手稿。EP对研究的概念、数据的解释做出了贡献,并参与了手稿的起草。MS:进行所有的显微分析。NW和SS有助于植物蛋白提取物的制备和评价。PW:参与了整体学习的协调。所有作者阅读并批准了最终的手稿。
电子辅料
微阵列实验提取自genevinvestigator网站,正在检查
额外的文件1:拟南芥发育基因表达。(PDF 16 KB)
从Genevistigator网站提取的微阵列实验,检查表达
额外的文件2:拟南芥Thaliana基因对各种病原体感染和诱导子治疗的反应。(PDF 23 KB)
作者的原始提交的图像文件
下面是作者提交的原始图片文件的链接。
权利和权限
本文由BioMed Central Ltd授权发表。这是一篇基于知识共享署名许可协议(http://creativeCommons.org/licenses/by/2.0.)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
Leśniewicz, K., Poręba, E., s。等等。植物膜结合的葡萄球菌样DNase作为一种新型的真核核酸酶类别。BMC植物BIOL.12,195(2012)。https://doi.org/10.1186/1471-2229-12-195
收到了:
接受:
发表:
关键词
- Staphylococcal-like核酸酶
- 程序性细胞死亡
- 血浆膜蛋白
- 衰老
- 肉豆蔻/棕榈酰化主题
- ABC转运蛋白
- tRNA合成酶