摘要
背景
NPR1.是一种拟南芥对水杨酸感知所需的。这种感知触发了防御反应,并对茉莉酸盐的感知进行了负面调节。令人惊讶的是,茉莉酸甲酯的施用也诱导抗性,并且NPR1.也怀疑是相关的。自等位基因系列以来npr1最近描述了这些等位基因的行为是响应茉鲸甲酸甲酯的。
结果
不同品种对茉莉酸甲酯的反应NPR1s.等位基因和NPR1.通过病原体的生长测量副葡萄球菌突变体。我们还测试了一些NPR1的亚细胞定位,以及可以在酵母中测量的蛋白质 - 蛋白质相互作用。蛋白质的定位npr1等位基因不影响对茉莉酸甲酯的反应。事实上,NPR1.不是必需的。以冗余方式需要的基因是烦恼.这烦恼假字的NPR1.,它们与TGA家族的转录因子相互作用。
结论
一些npr1等位基因在这种反应中具有表型可能是因为它们影响了BOP和TGA之间的相互作用,并且这两个蛋白质的蛋白质负责在野生型植物中甲基己酸酯诱导的抗性。
背景
植物通过各种各样的机制不断地保护自己免受病原菌的侵害。其中一些是预先存在的(或不可诱导的),另一些是在对病原体攻击的反应中产生的。水杨酸(SA,由[1])是一种对诱导诱导响应至关重要的植物激素拟南芥(拟南芥)的生物营养病原体假单胞菌spp[2].当察觉到病原体时,水杨酸就会产生并积累,形成适当的防御。这种SA信号不仅发生在攻击发生的地方,因为防御也在不同于接种的叶子上增强。这被称为系统性获得性抗性(SAR, [3.])。SA与其他激素有复杂的串音,与生长素、乙烯(ET)和茉莉酸酯(JA)总体呈负的串音。4.])。在JA的情况下,已经显示出活性形式在足底是JA-Ile(由[5.]),而在实验室中被外源性用作茉莉酸甲酯(MeJA)。
发病相关基因的非表达1(NPR1.)是SA感知所需的主要基因[6.].有五个奎曲NPR1.在拟南芥[7.],刀片上的叶片1(BOP1.) 和BOP2.在发展中具有重要作用[8.],NPR3.和NPR4.在防守中有一个角色[9.],可能是通过SA感知[10],没有特定的功能NPR2.已经描述了,除了SA感知中的次要角色[11].还有其他与信号转导的基因相似,如家庭TGA.产品与NPR1相互作用的转录因子[12]但是他们是以冗余的方式所必需的。
NPR1.被描述为在防御中具有多于一个角色,因为它在诱导的全身性抵抗(ISR,[13])。ISR被定义为通过在根中接种的非致病生物在叶子处触发的电阻,而SAR需要SA信号,ISR需要MEJA和ET信号传导。与SA一样,Meja和Et触发拟南芥对一些生物植物的抗性的外源性应用,如假单胞菌[14].已经提出了这一点NPR1.与Meja的抗性能力相关([13]以后缩写为RIM),虽然RIM它不一定相当于ISR。虽然的作用NPR1.在SA感知中发生在核中[15]但它在边缘的功能不明确理解。已经描述了在SA和JA信号之间的串扰中NPR1至关重要的细胞骨功能[16].此外,拟南芥对病原体感染的转录组分析表明,这种胞质功能也参与了ja依赖防御的调节[17].这npr1 -据报道,3个突变体,其产生截短的细胞质局部的NPR1蛋白,没有核定位信号,仅在SA依赖性基因表达中受到影响,而不是在JA和ET依赖性基因中受到影响。相比之下,npr1 -1突变体,在关键区域发生突变,影响SA、JA和et依赖基因的表达[17].最近的研究支持这种胞质NPR1功能作为ja依赖防御反应的调节器([18-20.])。
BOP1.首先是由沿叶柄的异位叶片的突变表型鉴定,以及花中的一些改变[8.].第一个被识别的等位基因是显性阴性的,因为T-DNA插入BOP1.没有再现异位叶片的表型[21].一次BOP1.被识别为帕拉洛NPR1.[22,它被证明是另一种模拟,BOP2.,功能冗余BOP1.[21].双突变体bop1 bop2繁殖了异位叶片的所有发育表型,但接种后为野生型假单胞菌[21],它也是SA感知的野生类型[23].
自收集以来npr1最近可用的等位基因[11,我们测试了这个角色的假设NPR1.在RIM中是胞质的。在这项工作中,我们证明了这一点NPR1.在野生型条件下对RIM没有作用,因为负责RIM的基因是BOP1.和BOP2.,有一个重要的部分TGA..因此,植物防御也需要两种正常发育所需的两种基因。
结果
npr1在边缘的角色
NPR1.已经表征了观察对其描述的大量等位基因的响应[24].NPR1.也被描述为边缘至关重要,但等位基因之间存在差异npr11,npr13有不同的RIM ([20.那25])。npr11,npr1-3对Meja有关的表型差异。因此,SA-JA拮抗剂不存在npr1-1,但它处于活跃状态npr1-3 [16].其他差异是基因表达,而npr1-1在SA、JA和ET依赖基因中受影响PTO.接种,npr1-3只受到SA依赖基因的影响[17].这些不同的表型已经归因于缺乏核定性npr1-3,由于截短的细胞溶质蛋白质是调制JA依赖性的防御反应的功能性[19].
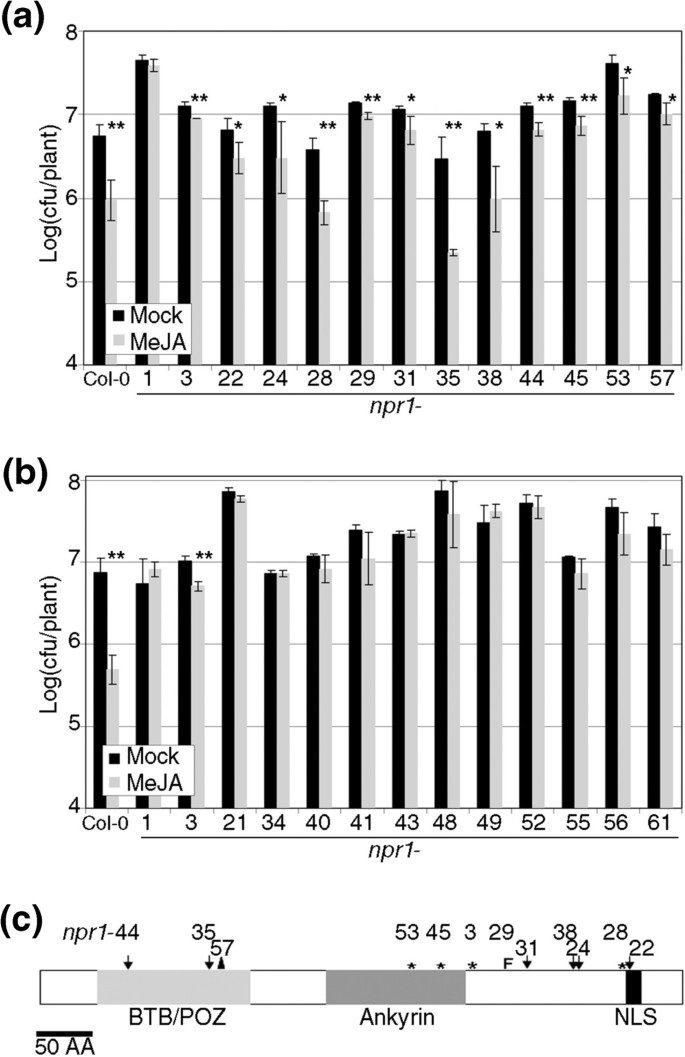
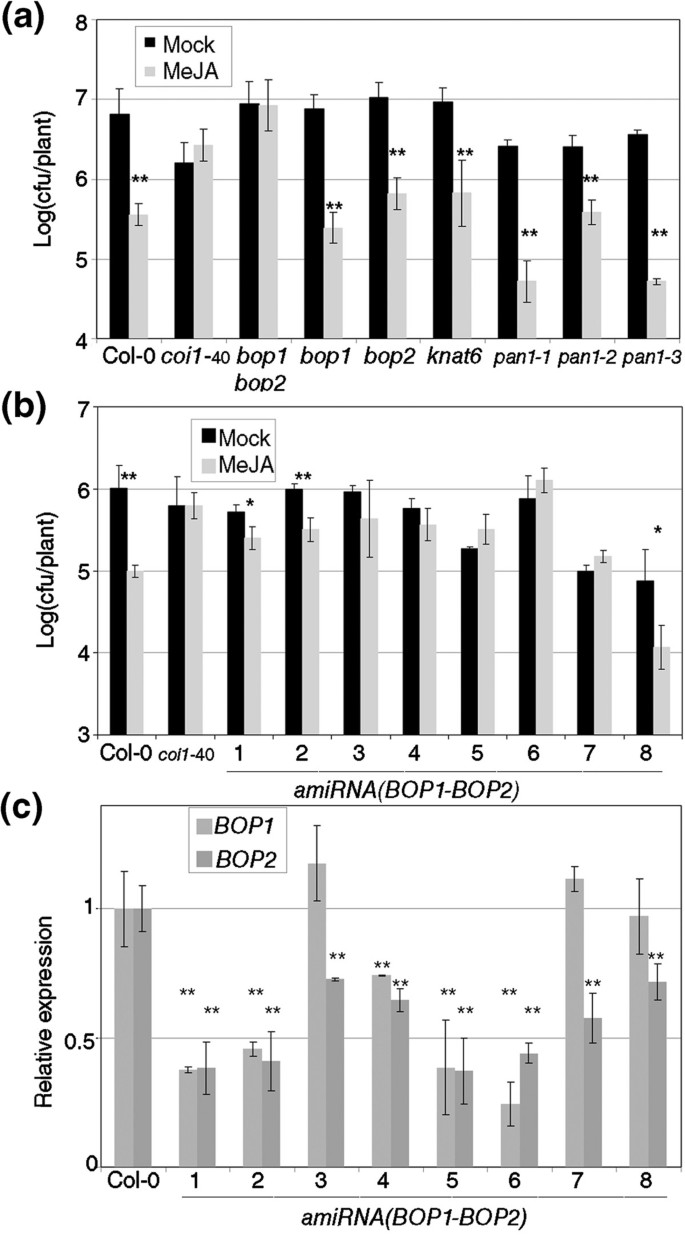
以确定。的确切作用NPR1.在轮辋中,并判断细胞溶质与核定位的作用,我们测试了43岁的等位基因系列npr1等位基因,定义为他们无法感知SA [11].这npr1等位基因在RIM中产生了混合表型(图1),并且在测试的43个等位基因中,11个具有重要的边缘(RIM +,图1A),意思是成长PTO.MeJA处理显著低于模拟处理(学生单尾试验,P<0.05)。其余的等位基因没有反应(RIM-, 32个中的11个如图所示1b).这两类等位基因没有任何明显的特征,在每一类中停止突变和点突变的比例相同。事实上,在检测的RIM+等位基因中,6个点突变沿着蛋白质广泛分布(图)1C,npr1-3作为参考包含。
npr1等位基因对MeJA的反应不同。四十三npr1用100μM甲基己酸酯(MEJA)处理等位基因,0.1%DMSO和0.02%SILWET L-77或模拟处理。一天后,丁香假单胞菌。番茄DC3000(PTO.)被接种,并在对数标度后三天进行生长。对于每种基因型和治疗,采集具有5种植物的三个样品。条形图平均±SD和npr11,npr1-3作为对MejA的负面和正响应的控制。(一种)npr1显示MEJA诱导的阻力的等位基因。(b)npr1不显示MEJA引起的阻力的等位基因。(C)的示意图表示npr1在NPR1的结构上显示MeJA诱导抗性的等位基因。BTB / POZ代表B.road-Complex,T.ramtrack和B.ric-a-brac蛋白质,宝x病毒和Z.丙烯手指蛋白。用于Ankyrin的Ankyrin重复主题(其中4个)和NLS用于核定位信号。箭头表示点突变,星号终止密码子,字母“f”架构,以及三角形内部删除。该数字表示等位基因数量。在所有图中,实验重复至少三次,结果。一个星号表示P <0.05和两个星号差异意味着P <0.01(学生对一条尾部的测试)。
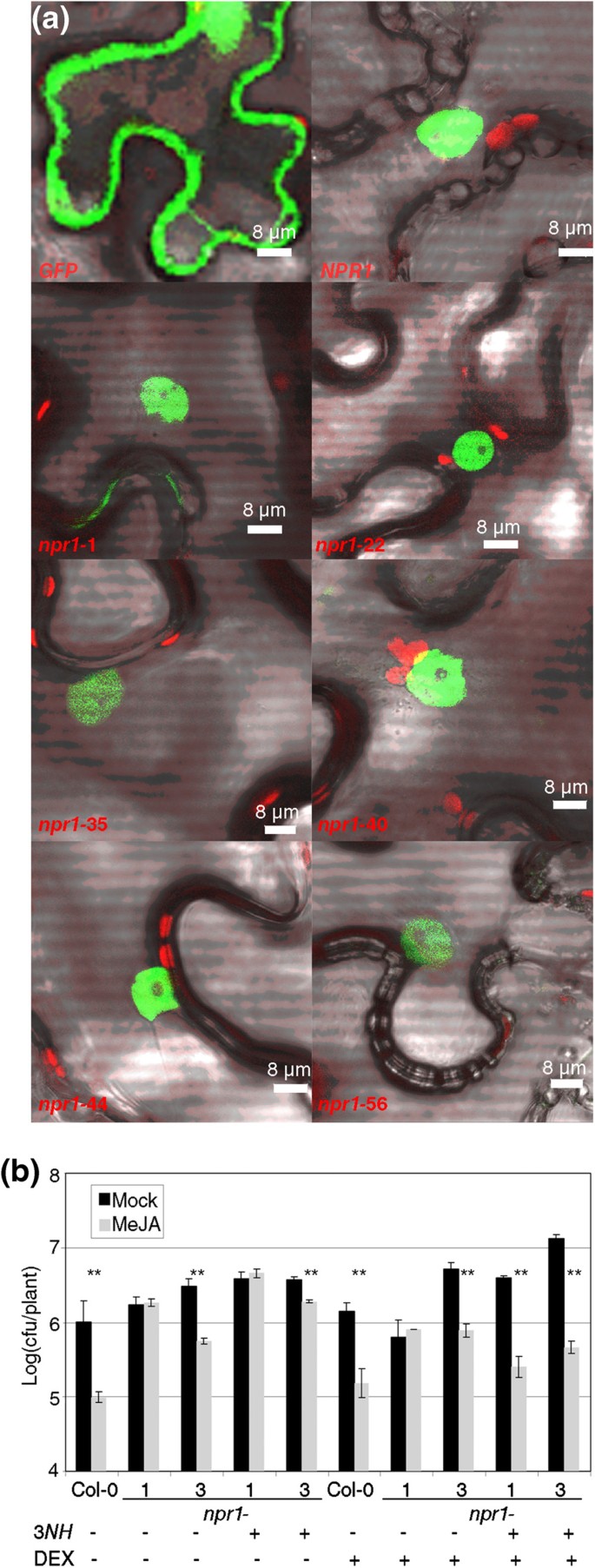
这些等位基因可以以某种方式影响细胞内蛋白质的定位,即使突变不在NLS中。要检查这种可能性,三个边缘+等位基因的CDNA(npr1-22,-35和-44,附加文件1),以及三个RIM-等位基因(npr1-1,-40和-56,附加文件1在点突变中选择,与野生类型一起克隆NPR1..然后,这七个CDNA瞬时表达n benthamiana在35s启动子和GFP标志物的控制下。在细胞核中和细胞质中可检测到游离GFP。但是当野生类型和六个等位等位基因时npr1在相同的条件下表达,主要在细胞核中检测到GFP,两类等位基因之间没有差异(图2一种)。
的核局部化npr1等位基因与MEJA引起的阻力不相关。(一种)瞬态表达绿色荧光蛋白那NPR1:GFP,和六个npr1等位基因(来自图中的三个1a和三个来自数字1b)。农杆菌肿瘤术在叶片的叶片中渗入含有启动子35下的提及基因尼古利亚娜·宾夕法尼亚州并且四天后用共聚焦显微镜检测表达。(b)NPR1的细胞质锚固不补充npr1 -1在对Meja的回应中。植物与转基因35SCAMVP:NPR1:HBD(缩写为3NH.) 在npr11或npr1-3背景及其对照用地塞米松(DEX)或模拟溶液处理,然后用MeJA或模拟溶液处理。一天后,PTO.被接种和测量如图所示1.一个星号表示P <0.05和两个星号差异意味着P <0.01(学生对一条尾部的测试)。
作为一种互补的方法,我们利用了过度表达NPR1的转基因系,该转基因系融合到大鼠糖皮质激素受体(HBD)的类固醇激素结合域,转基因植物被称为NPR1-HBD, [15])。NPR1-HBD仅在模拟条件下留在细胞溶胶中,并且应该在轮辋中具有功能性。原始线路在一个npr1-3背景(RIM +),因此转基因转移到npr1-1背景(RIM-)检查互补。BTH和含有糖皮质激素地塞米松(DEX)的治疗表明NPR1-HBD是功能性的(附加文件1)。NPR1-HBD,即使在35s启动子的控制下,也没有补充缺乏轮辋npr1-1(图2b).右美托咪定后,NPR1-HBD移至细胞核npr1-1互补的边缘表型。注意,在一个中存在细胞溶质NPR1-HBDnpr1-3背景不增强轮辋npr1-3单独。
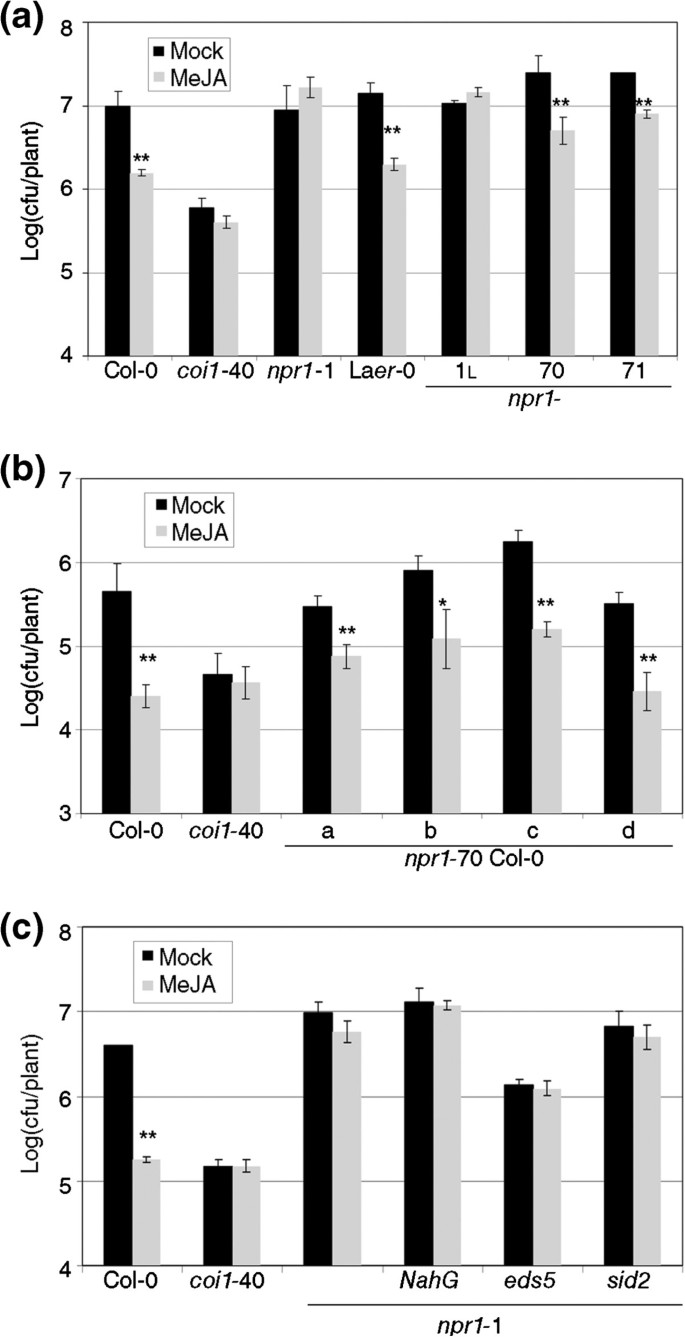
这npr1等位基因RIM +或RIM-没有分享任何明显的特征,因此难以为野生型基因分配精确的作用。辨别基因作用的临界遗传资源是零等位基因。因此,两个无效等位基因的响应npr1对RIM的测量(图3.一个)。npr1-70年和npr1-71是在洛杉矶呃-0背景,所以是一个渐渗npr11在洛杉矶呃-0用作对照[11].这两个无效等位基因在野生类型等实验中响应RIM。npr1-70在Col-0中漫长地又像野生型一样回应,从而排除了任何生态型效果(图3.b)。自直接作用NPR1.由于上述结果,我们纳入了一个独立的RIM控制,coi1-40(参见方法)。
NPR1.不是由MeJA引发的抗性所必需的。(一种)两个零点npr1等位基因(npr1-70年和npr1-71,洛杉矶呃-0 background),加上它们的对照被MEJA引起的电阻,如图所示1.coi1-40被引入为Meja触发的抗性负控制。npr1-1L.是npr1-1在Laer-0中渐渗[11].(b)Introgressed行npr1-70在col0中表现出与原株相同的表型npr1-70。(C)一些效果npr1由MEJA触发的阻力等位基因不是由于过量水杨酸。双突变体npr11NahG那eds5,Sid2.测试了他们对Meja的反应的抵抗力。一个星号表示P <0.05和两个星号差异意味着P <0.01(学生对一条尾部的测试)。
NPR1在此响应中的作用可能是间接的。因此,一种情景将加强SA和Meja之间的负面串扰。npr1等位基因在感染时产生更多SAPTO.[26似乎无法代谢它[27].rim-等位基因 - 在SA感知方面 - 可能已经留下了SA和MEJA之间的负面串扰,并且过量的SA压制了对Meja的反应超出了野生类型的水平。因此,RIM +等位基因在SA感知和SA-MEJA串扰方面都会有缺陷,这是一个解释,也与无效等位基因的行为一致。
为了验证这个假设,双突变体之间npr11,NahG(一种能降解SA的转基因植物,[28]),eds5(SA转运中的突变体,[29)),Sid2.(SA生物合成中的突变体,[30.),并为RIM进行了测试。npr1-1即使SA的水平低,也没有回应Meja(图3.c),因此不支持对负串扰增强的假设。
BOP1.和BOP2.他们在轮辋中的角色
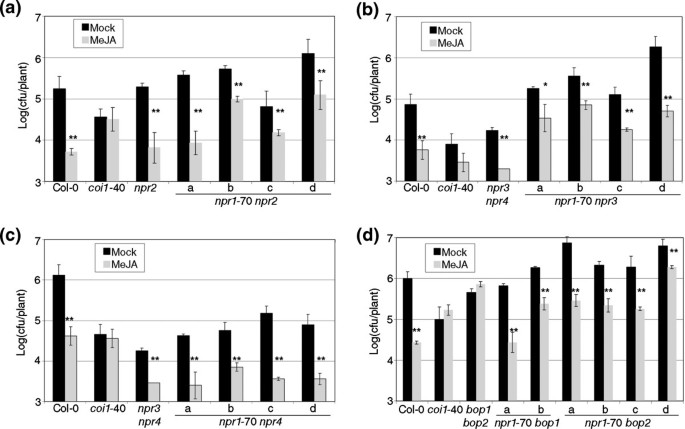
零等位基因的实验表明NPR1.对RIM来说不是必须的。也许NPR1.和其他基因将冗余负责轮辋,而零npr1等位基因将有一个边缘+表型,一些npr1等位基因可能是RIM-通过与其他蛋白质(s)负作用。这些互动最有可能的候选者是NPR1.因为它们的蛋白质具有相同的整体结构。还有五个附加的谬误NPR1.在拟南芥基因组中[7.,我们分析了双突变体npr1-70与不同的谬误(图4.)。没有证据NPR1.在RIM扮演着多余的角色。NPR2.在边缘中没有发挥重要作用(图4.a)双重的情况也是如此NPR3 NPR4.(数字4.B,C和[7.])。引人注目的是,双bop1 bop2[21]是RIM-(图4.d)。
一个角色NPR1.MeJA引发的阻力的谬误。双突变体npr1-70年,NPR1.如图所示,测试了ParaLogs及其相应的对照,以进行MEJA触发的电阻1.(一种)双突变体npr2.(b)npr3.(C)npr4.(d)BOP1.和BOP2..在每种情况下测试了四条独立的线条,除了BOP1.,在那里只得到了两个。一个星号表示P <0.05和两个星号差异意味着P <0.01(学生对一条尾部的测试)。
单BOP1.和BOP2.也对RIM进行了测试,结果显示为野生型(图5.一种)。BOP1和BOP2部分地通过KNAT6的转录调节和与PAN的物理相互作用(TGA8,[31[]),但T-DNA插入预测会破坏KNAT6或PAN活性,但对RIM没有影响(图)5.a).排除其他突变的可能性BOP1.和BOP2.我们正在制作这种rim-表型,我们构建了一个人为microRNA(amirna.,[32])耗尽水平BOP1.和BOP2.同时。八种独立的纯合转基因系amirna.(BOP1.-BOP2.分析了轮辋(图5.b)。八条线中的五分之一是RIM-,其余三个响应于野生型控制少。两种基因的水平在八条线中部分耗尽(图5.c);其中5个株系的这两种基因都显著减少,而且所有株系都如此BOP2.显着减少。这些线都没有具有特征的叶片叶片宏观表型,甚至没有作为细微的表型BOP1.一个人。
只有两者的减少BOP1.和BOP2.表达影响MeJA引发的抗性。(一种)双bop1 bop2,单个突变体,t - dna插入KNAT6.和PAN1并且,它们的对照被MEJA诱导的抗性测试,如图所示1.KNAT6.和PAN1基因是相互作用的吗BOP1.和BOP2..(b)减少BOP1.和BOP2.表达部分验证双重bop1 bop2.八个独立的人造微RNA的转基因系,旨在降低水平BOP1.和BOP2.(amirna.(BOP1-BOP2.)进行测试,如图所示1.线路未显示任何宏观叶片叶片表型。(C)从(b)中所述的线的3周龄植物中提取RNA,并为BOP1.和BOP2.通过RT-QPCR测量。表达水平被标准化为三种参考基因,并在模拟中的COL-0的水平。星号标志着每条线的表达水平与COL-0之间的差异的重要性;一个星号表示P <0.05和两个星号差异意味着P <0.01(学生对一条尾部的测试)。
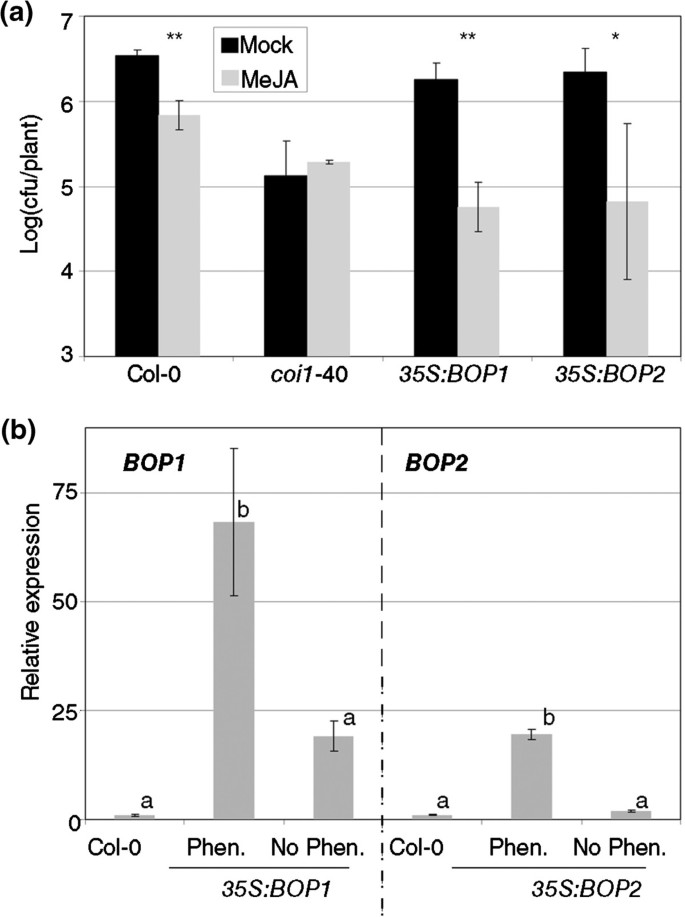
以前的实验表明BOP1.和BOP2.在边缘冗余行动(图4.d).因此,增加它们中的任何一个的数量都应该对RIM产生影响,特别是由于正常水平的BOP1.和BOP2.是相当低的(额外的文件1,[21])。过度表达线BOP1.和BOP2.描述 [33分析了轮辋。35秒:BOP1有一个比col-0更强的边缘,35秒:BOP2.在MeJA处理过的植物中有很强的变异(图6.一种)。在实验时,每种人口都看起来均匀,但当这些植物生长以设置种子时,可以在每个转基因系中观察到两种表型。大约一半的植物显示出野生型表型,另一半再现了描述的矮化植物[33].来自两条线和两种表型的种子再现了两种表型。看来这是一个沉默的问题,因为RNA从其提到的表型分类的植物中被广泛分散在转基因表达中(图6.b)。
过度表达BOP1.或BOP2.对MeJA产生更多的响应。(一种)35秒:BOP1和35秒:BOP2.行(33,并按照图中所示对其控件进行了测试1.一个星号表示P <0.05和两个星号差异意味着P <0.01(学生对一条尾部的测试)。(b)沉默过度表达线。35秒:BOP1和35秒:BOP2.系在抽薹时表现为具有特征表型(Phen.) [33]或野生型(没有pen。)。然后,从几种植物中提取RNA和如图所示的那样定量的转基因的水平5.C。在图的左侧,相对表达BOP1.并且,在右边,相对表达BOP2..使用相同字母的手段没有显着差异(Fisher的LSD测试,P <0.05)。测试对每个基因分别进行。
bop1 bop2RIM的特异性
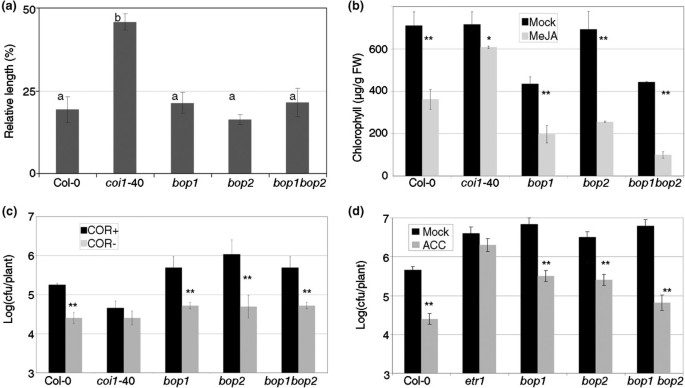
这bop1 bop2双突变体缺乏RIM响应,但这种MeJA信号传导的失败可能发生在信号转导的不同点。例如,缺陷可能针对影响所有MeJA响应的一般信号组件(例如。COI1,[34])或途径的专门部分,影响Meja响应的子集(例如jin1,[35])。什么时候bop1 bop2植物在含有Meja的平板上生长,根部的生长与野生型对照相似(图7.一种)。其他表型bop1 bop2在Meja板中生长的植物与野生型对照(类胡萝卜素生产,航拍大小,胎儿数量,滴形体数量等;数据未显示)。Meja的另一个效果是脱离叶片中衰老的增加,以叶绿素生产测量[36].bop1 bop2响应为这个特定系统中的野生类型(图7.b)。冠状胺是几个毒力因子假单胞菌与JA-ILE的结构和功能相似(茉莉酸的功能形式)分离在足底,[5.]),因此是一个突变体PTO.缺乏冠状素[37在Col-0中少于野生类型而越来越少PTO..bop1 bop2野生型也有反应吗PTO.有和没有coronatine(图7.c)。接种Plectospharella cucumerina,一种在MeJA突变体中比在野生型植物中引起更多疾病的真菌[38],没有引起任何疾病bop1 bop2比在Col-0(数据未显示)。如果bop1 bop2不是Meja信号传导突变体,但特别是在轮辋中,它可能在ISR所需的其他信令中有缺陷;等。不是;当喷洒1mm的1米氨基环丙烷-1-羧酸(ACC,ANET前体)时bop1 bop2,触发的阻力类似于野生型控制中触发的电阻(图7.d)。ETR1.(乙烯反应1,[39]包括作为乙烯诱导的抗性的阴性控制。
双bop1 bop2在MEJA引起的阻力中受到特别影响。(一种)主根长度。bop1 bop2他们的控件与约翰逊的媒体的板材生长[58]有或没有50微米Meja。在10天的时候,在条件下测量根的长度,其比例(由Meja处理除以模拟处理)表示为百分比。使用相同字母的手段没有显着差异(Fisher的LSD测试,P <0.05)。(b)MeJA诱导衰老。将上述基因型在土壤中培养,将6周龄植株的成熟叶片切割并漂浮在水中,添加或不添加100 μM MeJA。在4 d的黑暗条件下,用三组叶片测定叶绿素含量(μg/g鲜重)C。1 g。(C)冠状嘌呤作为一种毒性因子。冠状菌(PTO., COR+)或无冠状位(PTO(CFA.-),接种了核,它们的成长如图所示1.(d)乙烯诱导的抗性。用1mM 1-氨基环丙烷-1-羧酸(ACC)或模拟处理处理植物,然后PTO.被接种并如图所示1.ETR1.是对乙烯诱导的抗性的阴性控制。一个星号表示P <0.05和两个星号差异意味着P <0.01(学生对一条尾部的测试)。
NPR1和BOPS互动
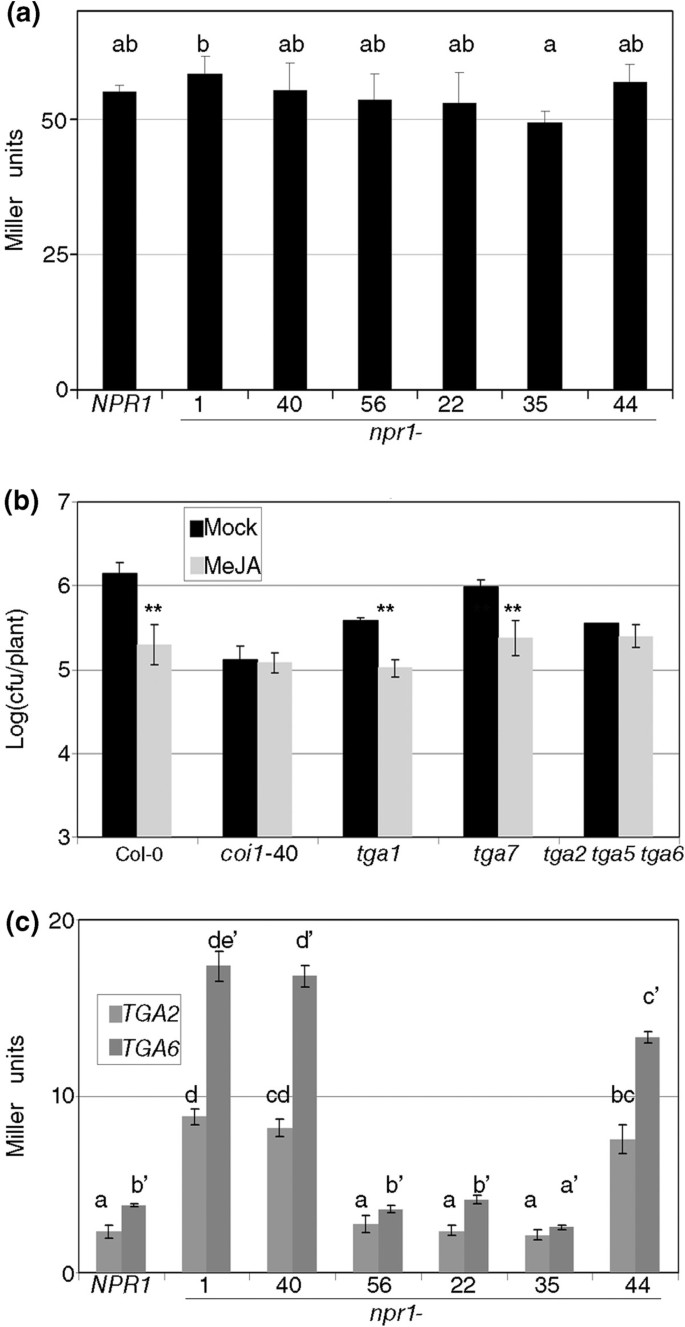
一旦明确地,RIM需要两个BOP基因,我们测试了模型npr1边缘等位基因可以直接或间接对BOP活性产生显着的负面影响。首先测试NPR1是否在BOP蛋白之间的相互作用中具有效果,我们使用了酵母双杂化测定。如报道所示,BOP1和BOP2彼此相互作用[40].接下来,我们介绍含有WT的第三种质粒NPR1.或各种突变体npr1等位基因在图中呈现2一种。如果是效果npr1在RIM上,NPR1和两个bop直接相互作用,在RIM表型中出现分歧的等位基因干扰BOP1和BOP2相互作用的能力也会出现分歧。这两类npr1等位基因没有明显的行为(图8.A,前三个npr1等位基因是RIM-,最后三个是RIM+),因此显性的负面影响似乎不是直接的。
TGA家族在MeJA诱导的抗性中起重要作用。(一种)BOP1和BOP2在酵母两种混合系统存在下的相互作用npr1等位基因在第三种质粒中克隆。NPR1被称为控制,接下来的三个等位基因没有响应MEJA的防御,并且其余三个响应野生类型。以米勒单元测量相互作用[55].(b)零几个等位基因TGA.等位基因分析如图所示1.tga2 5 6代表三倍TGA2 TGA5 TGA6.一个星号表示P <0.05和两个星号差异意味着P <0.01(学生对一条尾部的测试)。(C)在酵母双杂交系统中BOP1与TGA2、TGA6的相互作用是相同的npr1(a)的等位基因。相同字母的平均值差异不显著(Fisher’s LSD检验,P<0.05)。
所有NPR1副歌曲都在不同的程度上与TGA系列的成员进行互动[7.那21].因此,TGA是作为第三组分的合理候选者,它们与边缘等位基因的相互作用将间接地影响BOP1和BOP2的功能。作为一种对照,单突变体TGA1和TGA7.产生了一个重要的RIM(图8.B),但当三具体TGA.在同一时间被淘汰出局(一个斑点的三倍npr1SA反应突变,[41]),没有边缘(图8.b)。
我们推断这三个TGA(TGA2,5和6)中的一个或几个可能具有与横梁影响的功能相互作用,这可能受到边缘等位基因的影响。测试这个假设BOP1.和每个提到的TGA.在酵母双混合系统中引入了npr1上述等位基因在第三质粒中。TGA2和TGA6与BOP1相互作用,具体取决于存在的NPR1蛋白质(图8.c).三个RIM-等位基因中有两个相互作用增强,而三个RIM+等位基因中有两个没有干扰。TGA5-BOP1的相互作用不受npr1蛋白的影响(数据未显示)。通过BOP2的重复实验,得出了相似的结果(数据未显示)。综上所述,BOPs和TGA2, TGA5和TGA6是RIM所需要的,BOPs与这些(和其他)TGAs相互作用,NPR1可能调节相互作用的亲和性或稳定性。
讨论
RIM不需要NPR1
NPR1.是SAR和SA感知的重要基因[6.].npr1-1是应用最广泛的等位基因,在RIM中也受损[13].我们推测以来npr1-3是rim的野生类型([20.那25]),据报道,在某些表型之间的差异npr11,npr1-3是由于缺乏NLSnpr13 ([17那19]),对于轮辋也是如此。但是,我们在这里展示了等位基因的核定位没有差异。这一结论由多行证据支持。一,是npr1带RIM +的等位基因在结构上不是类似的npr1-3,因为并非所有这些都受到NLS的影响(图1C)。甚至在NLS中具有点突变的等位基因(npr1-22,附加文件1)应部分位于细胞核内[15].第二,三个边缘和三个边缘+等位基因在瞬时表达时,它们的核定位或稳定性没有差异n benthamiana(数字2一个,附加文件1)。虽然这些蛋白质不再具有功能性,但它们通过在核中定位来响应野生型背景的信号。第三,当功能性NPR1锚固在细胞质中时,RIM-表型中没有互补npr1-1背景(图2b),也没有RIM表型的增加npr1-3背景。实际上,DEX的应用在两个背景中触发了增加的轮辋(下面讨论)。
但是,最重要的是,RIM不需要NPR1,因为nullnpr1等位基因是RIM +,无论背景如何(图3.a,b)。我们也丢弃了NPR1.可能会以冗余的方式成为RIM的一部分(图4.)。
一个有趣的替代角色NPR1.会对SA和MeJA之间的交叉影响。NPR1.已被描述为SA和MEJA之间的负面规则的关键点。因此,RIM +等位基因在SA感知和Sa-Meja串扰中可能有缺陷,而且只有在SA感知中的边缘都会有缺陷,但不在Sa-Meja串扰中。接种PTO.触发SA的水平,并且在此情况下npr1等位基因,比在野生类型中有更多的sa [42].虽然这一假设将解释零等位基因的表型,但在图中的实验之后被拒绝3.C,其中RIM - 等位基因中SA水平严重降低对表型没有任何影响。
BOP1.和BOP2.在RIM是多余的
冗余功能BOP1.和BOP2.是正常发展所必需的。先前的研究表明,双突变体在植物结构上有许多缺陷,包括叶片形态的改变[43],花卉图案的变化[21],射击转换为鲜花的缺陷[44[丧失花香器官脱落[45].对基底防御进行了双突变体[21[SA感知(附加文件1)但发现了野生类型的差异。我们在这里展示两种基因也被拒绝防御Meja触发的病原体。有趣的是,虽然需要显着的BOP活动损失以发挥发展变化[21在BOP基因部分沉默的植物中,RIM被消除(图)5.公元前)。因此,轮辋所需的基因表达水平高于正常发育所需的基因表达水平。兼容这个想法,烦恼植物中的表达是高度本地化的,仅限于幼体原序,叶片叶柄和侧向器官界限,这可能对BoP转录物丰富的Meja敏感性相对较小的变化进行全身反应。NPR1和BOPS都定位在细胞质和细胞核中,也可以与TGA系列Bzip转录因子的成员相互作用,尽管具有不同的亲和力(例如,[12])。在发育过程中,BOP1和BOP2与TGA8/PERIANTHIA (PAN)形成核复合物,调节花中萼片和花瓣的数量,并可能促进花分生组织命运[21].考虑到平底锅功能丧失没有复制RIM-表型(图5.可能是其他基因TGA.,参与此表型,如SA感知所示[23].考虑到BOPs在KNOX (Knotted1-like homeobox)基因的转录调控中既有正的作用,也有负的作用KNAT6.[46,我们也测试了RIM是否受到KNAT6.函数丧失,但再次,没有观察到差异(图5.一种)。这可能反映与其他knox基因的冗余,或更有可能,其沿RIM的BOP调节与KNAT6无关。
是否bop1 bop2重新承认或不是轮辋的所有表型 -npr1等位基因(例如ISR,[13];Verticilium电阻,18];电阻引起的Piriformospora籼稻,[47];等)仍有待评估。我们检查了对MeJA反应的特异性中有相似的表型以及bop1 bop2其余的MeJA表型均为野生型(图7.)。但有很大的差异,自从npr1-3影响基础防御和SA感知bop1 bop2是两种表型的野生型[21].关于等,对ISR相关的另一个激素,已经提出了这种激素的应用可以使SA和MEJA之间的串扰独立于NPR1 [19].它似乎是诱导抗性的合理性,因为Meja诱导的抗性和其他蛋白质-PAPLAPS NPR1副病剂,但不是乐趣(图7.d) - 也可能受到一些等位基因的影响npr1.
一些npr1等位基因干扰了BOPS-TGAS互动
RIM -npr1等位基因是发现的大多数等位基因(32 RIM-vs. 11 RIM +)。这种情况如何兼容空缺的事实npr1RIM +等位基因?一个可能的解释是在筛选中使用的选择。由于选择是为了完全丧失SA感知,可能RIM+的大多数等位基因都具有部分SA感知的表型,即为空等位基因。那么,我们的预测就是有很多随机的等位基因npr1将是RIM +和部分接受SA。我们以前表明,对于SA感知,存在遗传相互作用npr1等位基因和NPR1.Paralogs [11].这里报道的工作也指出了遗传互动,这在npr1一方面的等位基因烦恼在另一。因此,边缘等位基因是一种斑点bop1 bop2防御突变体,但不是发育中的突变体。这种区别是发育和防御中表型阈值不同的结果(图)5.公元前)。
机械地,表达的水平烦恼相比之下NPR1.(附加文件1),因此具有BOP的直接或间接的负干扰将有利于化学计量的。一旦接种病原体,SA的水平将升高,并且在野生型植物NPR1中作为信号传导过程的一部分降级[48].在一个npr1背景技术不会传输该信令,也许NPR1蛋白质能够在RIM中干扰更长时间。这将解释一种行为NPR1-HBD在npr11 (v 2 b);NPR1-HBD在细胞质中没有补充npr1-1在RIM表型中,但当使用DEX时,表型有互补。很可能,当没有DEX存在时,npr -1会以某种方式干扰防喷器的功能。DEX存在时,NPR1-HBD在细胞核内的存在会触发NPR1-HBD和npr1-1的降解。如果npr1-1降级,防喷器将正常工作。
没有证据表明在酵母中存在直接的相互作用,因为NPR1或该蛋白的突变版本的存在并没有以与表型一致的方式干扰BOP1和BOP2之间的相互作用(图)8.一种)。第一替代方案是,在不影响BOP之间的相互作用的情况下,将发生边缘等位基因的干扰。第二种替代方案是边缘等位基因会干扰通常与乐谱相互作用的其他蛋白质。在这两种情况下都有一系列蛋白质与NPR1和BOPS相互作用,转录因子TGA [49],同样具有功能冗余(图8.b)。三个边缘中的两个增强或稳定了BOPS-TGA的相互作用,而三个边缘+等位基因中的两个没有(图8.C和数据未显示)。很明显,NPR1突变的蛋白质对BOPS-TGA相互作用具有不受预处理的影响,但酵母实验没有产生关于NPR1蛋白在边缘中的作用的绝对答案。我们推测这一点在足底,所有的RIM-等位基因增强了bop和TGAs之间的相互作用,使TGAs滴出,从而使它们无法完成触发防御的功能。另一方面,RIM+等位基因(包括空等位基因)和NPR1不会以任何方式影响相互作用。由于在酵母试验中,三分之二的等位基因以两种方式工作,可能有一种因子存在于植物中,而不是酵母中,或者可能有十个因子TGA.[49),NPR1.表达3到18倍之间BOP1.+BOP2.(附加文件1)可以解释这种差异。如果这个假设是正确的,它将明确地解释npr1在RIM中的作用。
结论
总而言之,我们已经表明,在野生型条件下,烦恼和TGA.(但不NPR1.)是由茉莉酸甲酯触发的阻力所必需的PTO..我们认为npr1边缘等位基因是由诸如BOPS和TGA之间的干扰引起的。
方法
植物生长和接种
拟南芥(L.)Heynh。如上所述播种和生长[23在21°C, 150 μmol m-2S.-1,和19°C的16小时晚上。在人造日开始后30分钟开始治疗,接种和取样以确保再现性。使用以下基因型:npr11,npr1-3 [27];npr2那npr1-20到npr1-71,以及组合npr1-70及其他基因型[11];35 scamvp: NPR1HBD[15];Sid2.[30.];eds5[29];NahG[28];npr3和npr4[7.];BOP1.3和BOP2.-1 [21];coi1-40(Dobón,Wulff,Canet和Tornero,待在其他地方出版);康德6,Pan1.-1pan1 -3.TGA1,TGA7.[50];35秒:BOP1和35秒:BOP2.[33];ETR1.-3 [39];TGA2 TGA5 TGA6[41].丁香假单胞菌。番茄DC3000 (PTO.)的生长、接种和测量方法[51].简而言之,通过喷雾接种14天的植物PTO.在od.600= 0.10.10.101010SILWET L-77(克罗姆普顿欧洲有限公司,英国埃夫萨姆)。三天后,量化每株菌落形成单位(CFU)的量,并以对数标度表示。当指示时,一个菌株PTO.缺乏冠状嘌呤(PTO(CFA.-),[37])。对于所有实验,进行至少三种独立的治疗方法(在不同日期上播种并治疗三套植物)。
表达在足底在酵母中
NPR1.在PDONR222或PDONR221(Invitrogen,Barcelona,Spain)中克隆了六个等位基因,然后转移到PMDC43 [52]为了表达在足底与GFP和pARC352 [53]在酵母中表达。相似地,bop1,bop2,tga2,tga5,和TGA6.,被克隆,然后转移到PDEST22和PDEST32(Invitrogen)中以表达酵母。如上所述完成酵母N-杂化分析[54]并如描述的那样量化相互作用[55].n benthamiana叶组织在渗透后4天在盖玻片下安装在水中农杆菌肿瘤术包含结构。所有成像均使用莱卡TCS SL共聚焦激光扫描显微镜(西班牙巴塞罗那莱卡),使用HCX PL APO CS 40X/1.25油靶研究荧光标记蛋白的亚细胞定位。绿色荧光蛋白在488 nm的Ar激光激发下可见,并通过500 ~ 530 nm的带通滤波器检测其发射。所使用的引物包括在附加文件中1.除非另有说明,底漆和化学产品均购自SIGMA (St. Louis, MO, USA)。为了建造amiRNA (BOP1-BOP2),对质粒pRS300进行修饰[32,克隆于pGW14 [56]如所述转化植物[57].
化学处理
测量效果PTO.在病原体接种前一天喷雾,在0.1%DMSO和0.02%SILWET L-77(Crompton Europe Ltd)中的0.1%DMSO和0.02%Silwet L-77(Crompton Europe欧洲有限公司)的生长[25].在EtOH中20mM的水溶液在水中稀释的2μm施加地塞米松。用0.02%SILWET L-77在水中以1mM喷雾1-氨基环丙烷-1-羧酸(ACC)。
体外增长
为了体外在约翰逊的培养基中种植植物[58]以1毫米KH2宝4..当指示时,用50 μM MeJA补充板。使用ImageJ软件测量根的长度[59].MeJA诱导衰老的测量方法如下[36].
RT-QPCR.
3周龄的RNA总数(图5.c)或6周龄植物(图6.b)使用Trizol (Invitrogen)提取,按照制造商的说明。使用RevertAid™First Strand cDNA Synthesis Kit (Fermentas, Madrid, Spain)合成cDNA,并使用LuminoCt Sybr Green qPCR Ready Mix (SIGMA)在7000 RT-PCR Systems机器(Applied Biosystems, Madrid, Spain)中进行定量PCR。每个测量都做了三个生物重复。取3个内参基因(At3G18780、At1G49240、At5G60390)的几何平均值,如[60[归一化,是COL-0的值等于一个。使用的引物列表在附加文件中提供1.
参考文献
- 1.
Vlot AC, Dempsey DMA, Klessig DF:水杨酸,一种抗疾病的多面激素。植物病理学杂志。2009,47(1):177-206。10.1146 / annurev.phyto.050908.135202。
- 2.
何春华:拟南芥与丁香假单胞菌的相互作用。《拟南芥丛书》,2002,Rockville: American Society of Plant biology, 10.1199/tab.0111。http://www.aspb.org/publications/arabidopesis/.
- 3.
Ross AF:植物中局部病毒感染诱导的系统性获得性。病毒学。1961,14:340-358。10.1016 / 0042-6822(61)90319-1。
- 4.
控制激素信号是植物和病原体对生长和生存的挑战。植物生态学报。2008,11(4):420-427。10.1016 / j.pbi.2008.05.002。
- 5.
浏览J:jasMonate通过集合:防御激素的受体和目标。Annu Rev植物Biol。2009,60(1):183-205。10.1146 / annurev.arplant.043008.092007
- 6.
Dong X:NPR1,所有的事情都考虑。CurrOp植物BIOL。2004,7(5):547-552。10.1016 / J.PBI.2004.07.005。
- 7.
张y,cheng yt,qu n,zhao q,bi d,li x:两个NPR1副歌曲的拟南芥防御反应的负调节。工厂J.2006,48(5):647-656。10.1111 / J.1365-313x.2006.02903.x。
- 8.
Ha CM, Kim GT, Kim BC, Jun JH, Soh MS, Ueno Y, Machida Y, Tsukaya H, Nam HG:叶片- on - peole 1基因通过调节拟南芥分生组织活性来控制叶片模式的形成。发展。2003,130(1):161-172。10.1242 / dev.00196。
- 9.
Liu G, Holub EB, Alonso JM, Ecker JR, Fobert PR:一个拟南芥npr1样基因,NPR4是抗病必需的。植物学报,2005,41(2):304-318。
- 10.
Fu ZQ, Yan S, Saleh A, Wang W, Ruble J, Oka N, Mohan R, Spoel SH, Tada Y, Zheng N, et al .: NPR3和NPR4是植物水杨酸免疫信号的受体。自然科学学报。2012,486(7402):228-232。
- 11.
拟南芥npr1等位基因的结构-功能分析揭示了其parogs在水杨酸感知中的作用。植物学报。2010,33:191 -192。10.1111 / j.1365-3040.2010.02194.x。
- 12.
张颖,范伟,董晓霞:NPR1与亮氨酸拉链蛋白转录因子的相互作用及其与水杨酸诱导所需序列的结合。中国科学(d辑:地球科学),1998,16(4):523- 528。10.1073 / pnas.96.11.6523。
- 13.
Pieters CM,Van Wees SC,Van Pelt Ja,Knoester M,Laan R,Gerrits H,Weisbeek PJ,Van Loon LC:控制拟南芥诱导的全身性能的新型信号通路。植物细胞。1998,10(9):1571-1580。
- 14.
Ton J, De Vos M, roben C, Buchala A, Metraux JP, Van Loon LC, Pieterse CM:拟南芥疾病易感突变体的特性,影响系统诱导抗性。植物学报,2002,29(1):11-21。10.1046 / j.1365 - 313 x.2002.01190.x。
- 15.
Kinkema M,风扇W,Dong X:PR基因表达的激活需要NPR1的核定位。植物细胞。2000,12(12):2339-2350。
- 16.
Spoel Sh,Koornneef A,Claessens Sm,Korzelius JP,Van Pelt Ja,Mueller MJ,Buchala Aj,Metroaux JP,Brown R,Kazan K等:NPR1通过A通过A调制水杨酸和茉莉依赖防御路径之间的串扰。细胞溶溶胶中的新功能。植物细胞。2003,15(3):760-770。10.1105 / TPC.009159。
- 17.
陈伟,张海涛,张海涛,朱涛,张海涛:水杨酸和茉莉酸信号转导网络的拓扑结构。植物学报,2003,34(2):217-228。10.1046 / j.1365 - 313 x.2003.01717.x。
- 18.
Johansson A,STAAL J,Dixelius C:拟南芥 - verticillium Longisporumstem的早期反应依赖于通过细胞溶质NPR1和RFO1的NDR1,Ja和Et相关信号。Mol植物微生物相互作用。2006,19(9):958-969。10.1094 / mpmi-19-0958。
- 19.
Leon-Reyes A,Spoel Sh,De Lange Es,Abe H,Kobayashi M,Tsuda S,Millenaar FF,Welschen Ra,Ritritema T,Pieters CM:乙烯调节非转化素相关基因1在水杨酸盐之间的交叉谈论中的非简称相关基因的作用jasMonate信号传导。植物理性。2009,149(4):1797-1809。10.1104 / pp.108.133926。
- 20。
Ramired V,Van der Ent S,Garcia-Andrade J,CoeoO A,Pietersecm,Vera P:OCP3是NPR1介导的茉莉酸依赖性诱导拟南芥的重要调节剂。BMC植物BIOL。2010,10:199.101186 / 1471-2229-10-199。
- 21。
李晓东,张永强,李晓东,等:拟南芥叶片与花叶形态的关系。植物学报,2005,17(5):1434-1448。10.1105 / tpc.104.030536。
- 22。
Ha CM, Jun JH, Nam HG, Fletcher JC: BLADE-ON-PETIOLE1编码拟南芥叶片形态发生所需的BTB/POZ结构域蛋白。植物生理学报。2004,45(10):1361-1370。10.1093 /卡式肺囊虫肺炎/ pch201。
- 23。
张志强,张志强,张志强,等。拟南芥对水杨酸的抗性和生物量:一种新的水杨酸感知模型。植物生态学报,2010,27(6):751 - 756。10.1111 / j.1467-7652.2009.00468.x。
- 24。
Cao H,Bowling Sa,Gordon As,Dong X:拟南芥突变体的表征是无响应的系统性获得性抗性的诱导者。植物细胞。1994,6(11):1583-1592。
- 25。
DobónA,Canet JV,Perales L,Tornero P:拟南芥中水杨酸感知的定量遗传分析。Planta。2011,234:671-684。10.1007 / s00425-011-1436-6。
- 26。
张X,陈某,MOU Z:NPR1的核定位是用于调节水杨酸盐耐受性,同种型合酶1表达和拟南芥的水杨酸盐积累所必需的。J植物理性。2010,167(2):144-148。10.1016 / J.Jplph.2009.08.002。
- 27。
曹洪涛,董晓东:拟南芥NPR1基因编码一种含有锚蛋白重复序列的新蛋白。acta photonica sinica, 2012, 40(3): 372 - 372。10.1016 / s0092 - 8674(00) 81858 - 9。
- 28。
Lawton K,Weymann K,Friedrich L,Vernooj B,Uknes S,Ryals J:拟南芥的系统获得性抗性需要水杨酸但不是乙烯。Mol植物微生物相互作用。1995,8(6):863-870。10.1094 / mpmi-8-0863。
- 29。
Nawrath C, Heck S, Parinthawong N, Metraux JP: EDS5是拟南芥中水杨酸依赖的抗病信号通路的重要组成部分,是MATE转运蛋白家族的成员。植物学报。2002,14(1):275-286。10.1105 / tpc.010376。
- 30.
Wildermuth MC,Dewdney J,Wug,Ausubel FM:需要等抚合酶来合成植物防御的水杨酸。自然。2001,414(6863):562-565。10.1038 / 35107108。
- 31.
Khan M,Xu M,Murmu J,Tabb P,Liu Y,Story K,McKim SM,Douglas CJ,Hepworth SR:Blade-On-Petiole1和2与Brevipedicellus和Pennywise的拮抗相互作用,并对拟南芥花序架构进行调节。植物理性。2011,158(2):946-960。
- 32.
Schwab R,Ossowski S,Riester M,Warthmann N,Weigel D:通过拟南芥中的人造小罗式沉默的高度特异性基因。植物细胞。2006,18(5):1121-1133。10.1105 / TPC.105.039834。
- 33.
Norberg M, Holmlund M, Nilsson O:叶片上的叶柄基因冗余地控制侧器官的生长和发育。发展。2005,132(9):2203-2213。10.1242 / dev.01815。
- 34.
COI1:茉莉酸调控的拟南芥抗病和育性所需基因。科学进展。1998,28(4):591 - 594。10.1126 / science.280.5366.1091。
- 35.
Dombrecht B,Xue GP,Sprague Sj,Kirkegaard Ja,Ross JJ,Reid JB,Fitt GP,Sewelam N,Schenk PM,Myc2差异调节拟南芥中不同的jasmon依赖功能。植物细胞。2007,19(7):2225-2245。10.1105 / TPC.106.048017。
- 36.
何玉华,何玉华,何玉华。茉莉酸在拟南芥叶片衰老过程中的作用。植物营养与肥料学报。2002,28(3):427 - 434。10.1104 / pp.010843。
- 37.
Mittal S,Davis Kr:Phytotoxin冠状苷的作用在拟南芥Syringae PV的拟南芥感染中的作用。番茄。Mol植物微生物相互作用。1995,8(1):165-171。10.1094 / mpmi-8-0165。
- 38.
B: β -氨基丁酸诱导的对坏死营养病原体的抗性是基于aba依赖的胼胝质的引物。植物学报,2004,38(1):119-130。10.1111 / j.1365 - 313 x.2004.02028.x。
- 39.
张志强,张志强,张志强,等:拟南芥乙烯响应基因ETR1与双组分调控因子的相似性。中国科学:地球科学。10.1126 / science.8211181。
- 40。
Jun JH, Ha CM, Fletcher JC:拟南芥叶柄上的BLADE-ON-PETIOLE1通过直接激活非对称LEAVES2来协调器官决定和轴向极性。植物学报。2010,22(1):62-76。10.1105 / tpc.109.070763。
- 41。
张Y,Tessaro MJ,Lassner M,Li X:拟南芥转录因子TGA2,TGA5和TGA6的敲除分析揭示了它们在系统获得的阻力中的冗余和基本作用。植物细胞。2003,15(11):2647-2653。10.1105 / TPC.014894。
- 42。
Delaney TP,Friedrich L,Ryals Ja:拟南芥信号转导突变体在化学和生物学诱导的疾病抗性中缺陷。Proc Natl Acad SCI U S A. 1995,92(14):6602-6606。10.1073 / pnas.92.14.6602。
- 43。
HA CM,Jun JH,NAM HG,Fletcher JC:叶片 - 叶片1和2通过调节LOB结构域和adaxial-轴向极性基因来控制拟南芥横向器官命运。植物细胞。2007,19(6):1809-1825。10.1105 / TPC.107.051938。
- 44。
徐M,Hu T,McKim Sm,Murmu J,Haughn GW,Hepworth SR:拟南芥叶片叶片1和2促进以前未定义的靶向Apetala1和静脉静脉的途径的花卉营销命运和测定。工厂J.2010,63(6):974-989。10.1111 / J.1365-313x.2010.04299.x。
- 45。
McKim Sm,Stenvik Ge,Butenko Ma,Kristiansen W,Cho Sk,Hepworth SR,Aalen RB,Haughn GW:叶片叶片基因对于拟南芥脱落区形成至关重要。发展。2008,135(8):1537-1546。10.1242 / dev.012807。
- 46。
王志强,王志强,王志强:拟南芥YABBY和KNOX家族转录因子调控叶片形态发生的机制。中国生物医学工程学报。2010,31(1):101 - 105。10.1534 / genetics.110.118703。
- 47。
Stein E,Molitor A,Kogel Kh,Waller F:由菌根菌耳状锥虫赋予拟南芥的全身性抗性,需要JasmOx酸信号和NPR1的细胞质功能。植物细胞生理。2008,49(11):1747-1751。10.1093 / PCP / PCN147。
- 48。
许志强,陈志强,陈志强,董晓东:蛋白酶体介导的转录辅助激活因子NPR1的转换在植物免疫调控中的双重作用。生物技术学报。2009,37(5):836 - 841。10.1016 / j.cell.2009.03.038。
- 49。
Jakoby M,Weisshaar B,Droge-Laser W,Vicente-Carbajosa J,Tiedemann J,Kroj T,Parcy F:拟南芥的Bzip转录因子。趋势植物SCI。2002,7(3):106-111。10.1016 / s1360-1385(01)02223-3。
- 50。
Alonso JM,Stepanova An,Leisse TJ,Kim CJ,陈H,Shinn P,Stevenson DK,Zimmerman J,Barajas P,Cheuk R等:拟南芥的基因组插入诱变。科学。2003,301(5633):653-657。10.1126 / Science.1086391。
- 51。
Tornero P,Dangl JL:量化拟南芥植物疗法细菌生长的高通量方法。工厂J.2001,28(4):475-481。
- 52。
柯蒂斯MD,Grossniklaus U:一种Gateway克隆传染媒介,用于Planta中基因的高通量功能分析。植物理性。2003,133(2):462-469。10.1104 / pp.103.027979。
- 53。
Ciannamea S,Kaufmann K,Frau M,Tonaco Ia,Petersen K,Nielsen KK,Angenent GC,Immink RG:疯子箱转录因子的蛋白质相互作用在Lolium Perenne开花。J Exp Bot。2006,57(13):3419-3431。10.1093 / JXB / ERL144。
- 54。
Vidal M,羊氏P:酵母前进和反向'N'-混合系统。核酸RES。1999年,27(4):919-929。10.1093 / nar / 27.4.919。
- 55.
米勒JH:分子遗传学的实验。1972年,纽约冷泉港:冷泉港实验室。
- 56.
Nakagawa T,Kureose T,Hino T,Tanaka K,Kawamukai M,Niwa Y,Toyooka K,Matsuoka K,Jinbo T,Kimura T:开发网关二进制矢量系列,用于实现植物改造的高效融合基因的高效施工.J Biosci Bioeng。2007,104(1):34-41。10.1263 / JBB.104.34。
- 57.
Clough SJ,弯曲AF:花卉浸:农杆菌介导的拟南芥转化的简化方法。工厂J.998,16(6):735-743。10.1046 / J.1365-313x.1998.00343.x。
- 58.
约翰逊厘米,斯图尔·科特,博克特,卡尔顿AB:不同植物种类的比较氯要求。植物土壤。1957,8:337-353。10.1007 / bf01666323。
- 59.
Abramoff MD, Magalhaes PJ, Ram SJ: Image Processing with ImageJ。生物光子学杂志。2004,11(7):36-42。
- 60。
Vandesompele J,De Preter K,Pattyn F,Poppe B,Van Roy N,De Paepe A,Speleman F:通过多个内部对照基因的几何平均准确正常化实时定量RT-PCR数据。基因组Biol。2002,3(7):Research0034
致谢
这项工作得到了西班牙的“Ministerio deCongondíay竞争”(Mineco)(Mineco)(Mineco)(Grant Bio201018896到Pt,Jae-CSIC奖学金和AD)和“Generalit瓦伦西亚纳”和“Generalit at Valenciana”(Grant Acomp /2012/105至pt)。谢谢邓连博士NPR1.和欧维·尼尔森博士烦恼超表达。我们感谢博士的意见和慷慨帮助。维森特·拉米雷斯,巴勃罗·维拉,雪莱·海普沃斯。
作者信息
隶属关系
相应的作者
附加信息
利益争夺
作者声明他们没有任何竞争利益。
作者的贡献
JVC, AD和JF进行了实验,分析了数据并对论文进行了修改。PT设计了研究,分析了数据并撰写了论文。所有作者阅读并批准了最终的手稿。
电子辅料
图S1。
附加文件1:克隆的本地化npr1文中提到的等位基因。图S2。DEX治疗NPR1HBD对BTH更敏感。图S3。NPR1副病虫病的表达水平。图S4。响应bop1 bop2到sa和bth。表S1。使用的引物列表。(PDF 103 KB)
作者为图像提交的原始文件
以下是与作者的原始提交的图像的链接。
权利和权限
开放获取本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
蔡志强,刘志强,刘志强。等等。这叶片叶片拟南芥基因是茉莉酸甲酯诱导抗性的关键基因。BMC植物杂志12,199(2012)。https://doi.org/10.1186/1471-2229-12-199
收到了:
公认:
发表:
关键词
- 甲基jasmonate
- 水杨酸
- 拟南芥
- NPR1.
- 烦恼
- 防御