摘要
背景
最近的报告表明维生素B1(硫胺素)参与植物适应某些类型的非生物和生物胁迫的过程,主要是氧化应激。大多数基因编码的酶参与硫胺素的生物合成拟南芥已被确认。在本研究中,我们检测了拟南芥幼苗对氧化、盐度和渗透胁迫的早期(感知)和晚期(适应)反应中硫胺素生物合成基因、硫胺素二磷酸依赖酶编码基因的表达以及硫胺素化合物的水平。本文还探讨了植物激素在调节硫胺素对胁迫反应的贡献中的可能作用。
结果
拟南芥硫胺二磷酸生物合成途径相关基因的表达,包括THI1,THIC,TH1而且TPK,在NaCl或山梨醇处理的幼苗中分析48 h。这些基因在胁迫响应早期(2 ~ 6 h)显著上调。这些基因转录水平的变化进一步被发现与幼苗中硫胺及其二磷酸酯含量的增加有关,以及与需要硫胺二磷酸作为辅助因子的酶基因表达的增强有关,主要是α-酮戊二酸脱氢酶、丙酮酸脱氢酶和转酮二酸酶。对于已知参与植物胁迫反应的植物激素,包括水杨酸、茉莉酸和脱落酸,研究发现只有脱落酸显著影响硫胺生物合成基因的表达、硫胺二磷酸水平以及编码依赖硫胺二磷酸的主要酶的基因的表达。利用脱落酸产生缺陷的拟南芥突变体,我们证明了这种植物激素在调节脱落酸的过程中是重要的THI1而且THIC盐胁迫下的基因表达,但渗透胁迫反应的调控机制更为复杂。
结论
根据已获得的结果和先前报道的数据,提出了植物非生物胁迫敏感和适应过程中硫胺素化合物和硫胺素二磷酸依赖酶的生物合成的一般模型。这些数据还提示脱落酸在应力敏感阶段可能的调节作用。
背景
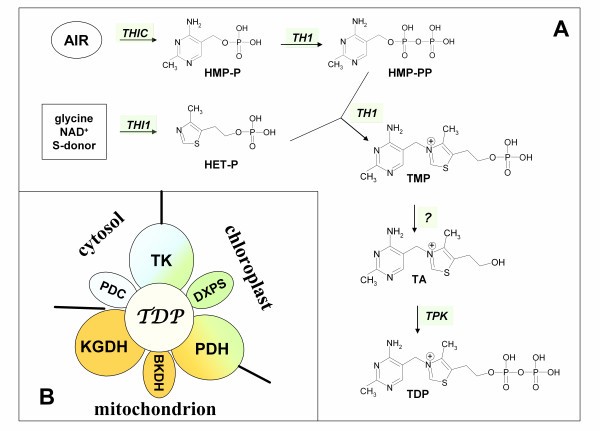
维生素B1(硫胺素)是所有生物体正常运作所必需的,因为它在碳水化合物分解代谢、NADPH和ATP合成以及核酸的形成中发挥重要作用。硫胺素的生物活性形式是它的二磷酸类似物(TDP),作为许多关键酶的辅助因子(图1包括丙酮酸脱羧酶(PDC)、丙酮酸脱氢酶(PDH)、α-酮戊二酸脱氢酶(KGDH)、支链α-酮酸脱氢酶(BKDH)、转酮酸酶(TK)、乙酰乳酸合酶(AHAS)和1-脱氧-D-木酮糖-5-磷酸合酶[1].植物可以合成TDP新创从简单的前体到具有细菌和酵母所利用系统特征的生物合成途径[2- - - - - -5].在这方面,TDP生物合成的早期阶段包括两条平行的途径。一种是类似于在细菌中发现的机制,从5-氨基咪唑核糖核苷酸(AIR)引导到硫胺素的嘧啶部分(4-氨基-2-甲基-5-羟甲基嘧啶单磷酸,HMP-P),并且只参与一种酶,一种酶的产物THIC被鉴定的基因拟南芥[6].在第二种平行途径中,硫胺的噻唑部分(4-甲基-5-(2-羟乙基)-磷酸噻唑,HET-P)由甘氨酸,NAD合成+以及硫供体蛋白,其方式与酵母中利用的系统相似[7].参与HET-P形成的主要酶是由THI1基因,现在已经在拟南芥和玉米[8,9].
植物中硫胺素生物合成的示意图(A)和主要硫胺素二磷酸结合酶的亚细胞定位(B).所示的拟南芥基因编码催化生物合成反应的酶。5-氨基咪唑核糖核苷酸;HET-P, 4-甲基-5-(2-羟乙基)噻唑磷酸盐;HMP-P/HMP-PP, 4-氨基-2-甲基-5-羟甲基嘧啶单磷酸/二磷酸;助教,硫胺素;TMP,单磷酸硫胺素;TDP,二磷酸硫胺;丙酮酸脱羧酶;PDH,丙酮酸脱氢酶; KGDH, α-ketoglutarate dehydrogenase; BKDH, branched-chain α-ketoacid dehydrogenase; TK, transketolase; DXPS, 1-deoxy-D-xylulose-5-phosphate合成酶。
进一步的两个硫胺素生物合成步骤包括HMP-P磷酸化到4-氨基-2-甲基-5-羟甲基嘧啶二磷酸(HMP-PP)和HMP-PP与HET-P缩合形成单磷酸硫胺素(TMP)。这两个反应是由一种蛋白质催化的TH1拟南芥基因[10]或THI3基因z梅斯[11],因此是一种同时具有HMP-P激酶和TMP合酶活性的双功能酶。TMP至今没有任何公认的生理功能,但构成了硫胺素资源或进一步合成TDP的过渡阶段。在后一种情况下,需要一种未磷酸化形式的硫胺素。如前所述z梅斯[12], TMP被一种相对非特异性的磷酸酶去磷酸化,该磷酸酶也可以使用TDP作为底物。上述所有步骤都在叶绿体中进行[13],但硫胺素转化为TDP的过程发生在细胞质中,并由硫胺素焦磷酸激酶催化,由蛋白编码TPK基因(14].为了实现其生物学功能,TDP必须被转运到叶绿体或线粒体,但所需的转运体尚未被确定。植物中硫胺素的生物合成途径是通过tdp依赖的核糖开关机制精确调控的THIC基因在古代植物类群中也有THI1基因水平[15].
已有充分的文献证明,在植物对持久性非生物胁迫条件(如盐渍和洪水)的适应反应中,硫胺素的生物合成被激活[16]、寒冷、炎热和干旱[17,18],以及氧化应激[19,20.].然而,还没有确定在相应应激反应(感知)的早期阶段,硫胺素的生物合成和激活是如何对上述刺激做出反应的。在我们目前的研究中,我们进一步描述了硫胺素生物合成上调在植物对氧化、渗透和盐胁迫的早期反应中的作用。在实验中,我们分析了所有硫胺生物合成基因以及TK、KGDH、PDH、PDC和DXPS等tdp依赖酶基因在拟南芥幼苗中的表达水平变化。我们还首次表明,脱落酸(ABA)而不是水杨酸(SA)参与了植物对非生物胁迫反应中硫胺素生物合成的上调。
结果
拟南芥幼苗对氧化、盐和渗透胁迫的早期反应中硫胺素生物合成基因的表达增加
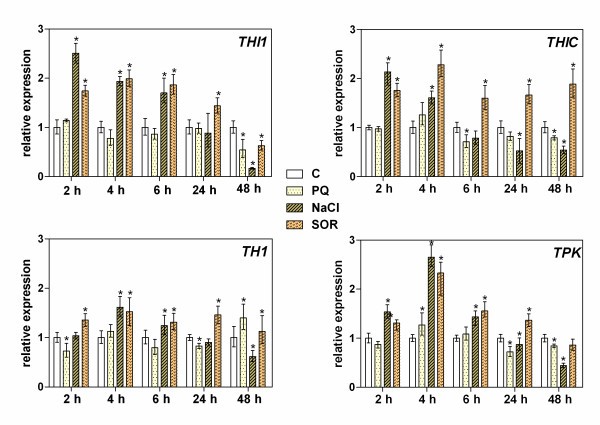
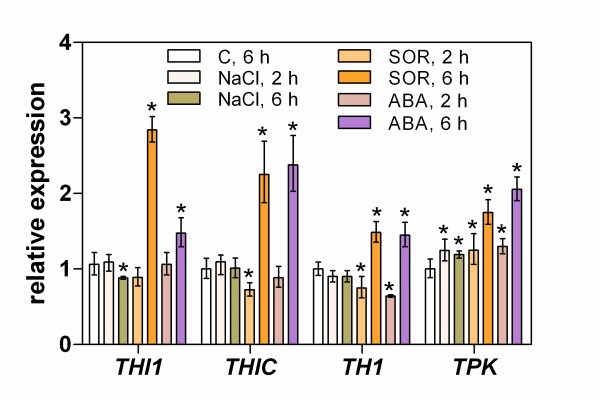
参与硫胺素生物合成的四个主要基因的表达答:芥对氧化(0.25 μM百草枯;PQ),盐(200 mM NaCl)和渗透(200 mM山梨醇;or)压力条件。这些测试评估了负责硫胺素嘧啶和噻唑部分生物合成的基因(THIC而且THI1), HET-P与HMP-PP耦合形成TMP (TH1),以及硫胺素对TDP的活化(TPK).拟南芥幼苗对环境变化的快速传感反应(2小时内)(图2)通过参与硫胺素生物合成早期步骤的两个基因的表达增加来观察,THI1而且THIC(分别增加2.9倍和2.2倍)高浓度盐或SOR的存在,但没有PQ。在应力持续时间较长(达48 h)的情况下,较高的表达THIC但在持续高盐条件下,其表达量显著下降。应力诱导的表达变化THI1表现出类似的时间依赖性,显著的例外是48小时的渗透胁迫,在这段时间内,该基因的表达下降THIC基因。的表达式TH1这些应力条件也会改变其时间剖面,与THIC相似,但增加不超过1.5倍。最高的差异表达反应(1.5- 3.0倍)TPK在培养基上施加胁迫刺激(SOR或NaCl) 2 ~ 4 h后,观察其基因表达。
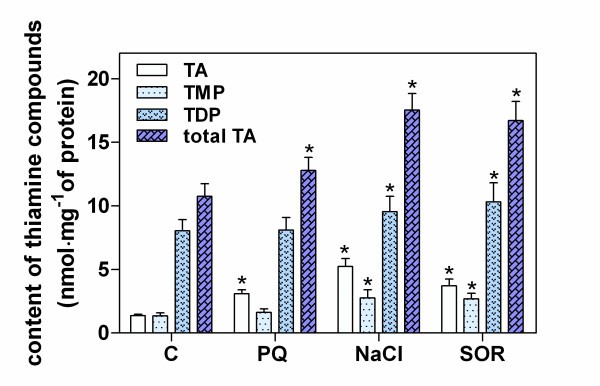
对胁迫条件下生长48 h的拟南芥幼苗进行补充实验,研究叶片中硫胺素总含量的变化(图3.).研究发现,在胁迫条件下,幼苗的总硫胺素水平,即硫胺素、TMP和TDP含量之和增加了160-170%。在所有试验条件下,TDP均优于其他硫胺素化合物,但在植物适应胁迫反应过程中,TDP含量仅增加了120 ~ 130%。因此,观察到的总硫胺素水平的增加主要是由于TMP和游离硫胺素的大幅增加(与未受胁迫的植物相比,增加了200-380%)。
tdp依赖酶对氧化、盐和渗透胁迫的早期反应
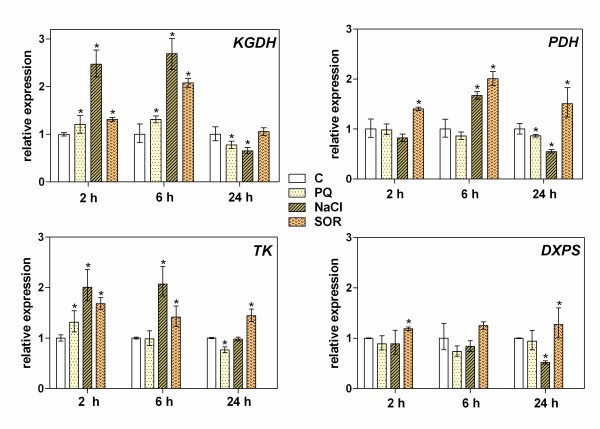
为了将胁迫诱导的植物硫胺素生物合成相关基因的表达增加与植物在不同胁迫条件下对TDP的实际需求联系起来,我们分析了几个编码TDP依赖酶的基因(KGDH、PDH、TK和DXPS)的表达水平,这些酶在细胞代谢中起着关键作用。在这些实验中,KGDH似乎对环境变化最为敏感。在这种酶的情况下,暴露于应激条件后2小时(盐)或6小时(SOR)观察到2 - 3倍的表达增加(图4).在较长的时间尺度(24小时),该表达迅速恢复到基础水平。在盐胁迫下,TK基因也以类似的时间依赖性上调(约2倍),但在SOR存在的情况下,这种表达上调延长了24小时。PDH基因也被发现参与盐和SOR胁迫感知。然而,在两种胁迫条件下,6 h后这些基因的表达量增加最多(约2倍)。相比之下,在盐或SOR处理6小时后,DXPS基因表达仅略有增加(1.2倍),并且这些水平在24小时内保持不变。
植物激素在应激早期反应中参与硫胺素生物合成的上调
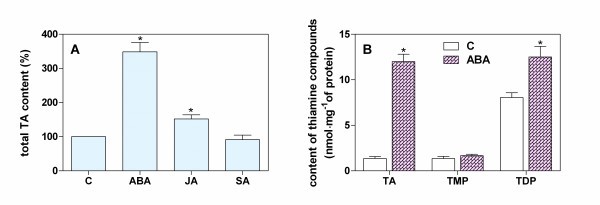
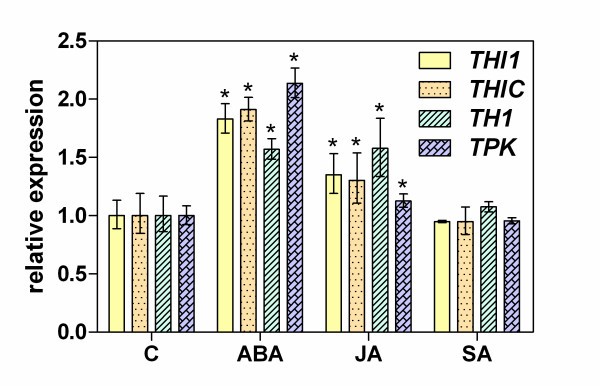
拟南芥幼苗在添加植物生长调节剂(包括ABA、茉莉酸(JA)和SA)的标准培养基上生长48 h,硫胺池对照分析结果如图所示5.ABA显著提高了总硫胺素含量(360%),JA显著降低了总硫胺素含量(140%),SA未超过对照水平。TMP,产生新创在ABA的影响下,被发现主要积聚在游离硫胺素池中(比对照增加8.8倍),可能是由于非特异性磷酸酶的激活。然而,TDP水平基本保持不变,仅观察到1.5倍的增长(图5 b).这些结果通过添加ABA 6小时后硫胺素生物合成基因转录水平的测定得到进一步证实6).值得注意的是,在含有aba的培养基中生长的幼苗中,所有分析基因的表达量都增加了2- 2.2倍THI1,THIC而且TPK基因和略低(1.5倍)的上调被观察到TH1基因。相比之下,在相同的时间尺度上,SA在培养基中的存在并不影响硫胺素的生物合成过程,只是略微增加了硫胺素的表达(1.2- 1.5倍)THI1,THIC而且TH1,但不是TPK在培养基中添加JA后观察到。
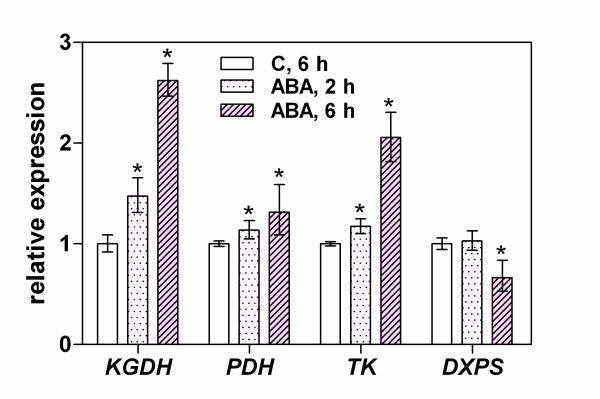
在培养基中添加ABA对tdp依赖酶转录的影响分析(图7)显示KGDH和TK(表达量分别增加2.6倍和2.0倍)是可能受ABA调控的酶。然而,我们在本实验中没有观察到ABA对PDH表达有显著影响。
为了进一步证实ABA参与了水分胁迫感知过程中硫胺素生物合成的上调,一个ABA生物合成缺陷突变体(aba1)进行分析。硫胺素生物合成基因的表达aba1用SOR处理的突变体植株表现出与野生型植株相似的模式(图8),唯一值得注意的区别是突变植物的反应较慢(6 h vs .野生植物的2 h)。相比之下,在盐处理下THI1而且THIC该突变株的基因未受显著影响TH1而且TPK表情显示为野生型模式。
讨论
由于它们的生长和发育受到环境波动的影响,植物需要对这些变化做出快速反应,以维持内部稳态。因此,植物进化出了许多敏感机制,能够快速感知环境线索,促进生长变化,以适应和生存。21,22].由于胁迫对植物的碳固定和整体能量状态有影响,以前对这一领域的遗传、蛋白质组学和代谢研究大多涉及糖酵解、三羧酸循环、磷酸戊糖途径和光合作用的变化[23- - - - - -25].然而,这些早期的报告所提供的数据是在非常不同的生长或应力条件下获得的,也是在非常不同的时间尺度上获得的,并使用了不同的测量参数。这使得以有意义的方式比较来自不同实验室的结果变得困难。
在我们目前的研究中,我们首次评估了植物对胁迫的早期反应阶段(“胁迫感知”),而不是长期适应,我们比较了(i)硫胺素/TDP生物合成途径相关基因的表达水平;(ii)编码最重要的需要tdp的酶的基因表达水平;(iii) PQ、NaCl和SOR等非生物胁迫源处理的拟南芥幼苗中硫胺素及其磷酸酯含量。在处理的头几个小时内,向植物生长介质中施用NaCl或SOR会被植物感知为一般的水分胁迫,而不是特定于盐或SOR的效应[26].人们普遍认为,应力产生的损伤涉及最重要的途径,因此显然需要上调主要的生物合成过程,包括TDP的生物合成。事实上,我们在本实验中观察到,在施用两种水胁迫剂后2小时,所有tdp -生物合成基因的表达都已经增加(图2).有趣的是,这些基因在盐胁迫下的表达下降了几天,这表明离子广泛渗透到植物组织中[26可能会产生新的刺激和适应过程。然而,在我们的SOR应激实验中,大多数早期观察到的变化,特别是那些涉及THIC基因,在很长一段时间内保持不变。这可能表明在这些条件下控制植物生长的是激素信号机制,而不是水分可利用性[27].令人惊讶的是,在几个小时的时间尺度内,我们没有观察到PQ对TDP生物合成基因表达的任何显著影响,这与早期一项关于PQ产生的持久氧化应激的研究结果相反[20.].
我们在植物胁迫反应的初始阶段观察到基因表达的增加,这可能表明:(i)翻译蛋白在不利条件下容易受损,因此需要增加转录来维持适当的硫胺素细胞水平;(ii)依赖tdp的酶被破坏,与它们的再合成平行,对它们的辅因子的新要求出现;和/或(iii)生产硫胺素对于克服压力的后果或制定新的适应策略是必要的。我们对逆境植物中硫胺素及其磷酸盐类似物的分析(图3.)表明,观察到的硫胺素生物合成基因表达变化与编码酶活性相关。在拟南芥对水分胁迫的早期反应(感知)中,硫胺素和TDP含量的增加与最近报道的相似变化是一致的Z.梅斯幼苗受长期渗透、氧化和盐度胁迫[19].这表明,在植物的胁迫感知和适应过程中,硫胺素的生物合成受到严格的调控。此外,这种调节似乎并不特定于这种胁迫类型,可能受益于先前在植物中发现的两种不同的机制。第一种可能的调控发生在遗传水平,并可应用于THIC基因启动子,因为它含有tdp依赖的核糖开关[15].另一个调节过程可以在蛋白质水平上运行,正如在一项研究中所证明的那样Z.梅斯,其中TMP合酶活性被增加的HMP-PP供应所强烈抑制,HMP-PP是通过同一蛋白质THI3的激酶结构域的活性产生的[11].
为了验证胁迫条件对植物组织中硫胺素化合物库的影响来自于TDP依赖的主要分解代谢途径对TDP需求的增加这一假设,我们分析了几个编码TDP依赖酶的基因表达的胁迫依赖性变化(图2)4).乙酰辅酶a的线粒体生成和三羧酸循环被认为是植物氧化应激的第一个传感器[23,28,29].我们目前的分析确定KGDH和PDH是应力扰动的主要来源。然而,这两种线粒体tdp依赖酶的表达上调不仅可能是由于线粒体电位恢复、呼吸控制、氮代谢或谷氨酸信号通路需求的增加[30.]但也反映了KGDH副反应导致活性氧产生导致代谢失衡的应激信号反应的激活[29].
TK酶在叶绿体卡尔文-本森循环(CBC)中起作用,参与碳固定[31],其活性是蔗糖生产和光合作用的限制因素[32].由于TK也在戊糖磷酸途径中起作用,因此它在NADPH的生成中也很重要,与各种氧化剂清除系统合作[23,33- - - - - -35].早期报道的拟南芥TK转录本的增加与在拟南芥中观察到的TK活性的变化一致Z.梅斯在盐和氧化应激下[19并支持了这种酶参与植物胁迫保护的假设。DXPS是另一种依赖tdp的酶,它参与了强抗氧化剂类胡萝卜素的产生[36,37].类胡萝卜素合成途径的激活已在渗透、盐和干旱胁迫下被观察到[38- - - - - -40].然而,在我们目前的研究中,在24小时的胁迫处理中,dxps编码基因的表达没有明显的变化,这可能是因为它的调控发生在转录后水平[41].
植物激素在植物广泛的胁迫适应过程中具有良好的特征和重要的作用[42,43]促使我们寻找在盐胁迫和渗透胁迫感知期间以及后期适应阶段激活硫胺素生物合成和tdp依赖代谢过程的候选调节因子。我们对SA的关注是基于之前关于白菜活化的报道THIJ类基因产物通过sa依赖信号通路参与HMP磷酸化[44]以及SA参与了硫胺诱导的植物对病原体攻击的抗性[45].然而,我们用外源SA处理拟南芥植株,并没有引起任何可观察到的与硫胺素生物合成有关的基因表达的变化(图5而且6).
JA与对坏死性病原体和食草性昆虫的防御有关[46]但它也参与了盐胁迫依赖性基因调控[47].在本研究中,在生长培养基中添加JA使拟南芥幼苗中硫胺素含量略有增加,主要是由于激活了硫胺素生物合成基因TH1(数据5而且6).虽然JA调控硫胺素生物合成的机制还需要进一步分析,但值得注意的是,在该研究中发现了一个顺式作用元件T/GBOXATPIN2 (AACGTG)TH1启动子区[48]负责激活该基因,在受伤时对JA作出反应[49].
ABA调控植物中近10%的蛋白质编码基因[50]并且通常参与在盐和渗透胁迫条件下的转录调节过程[51- - - - - -54].的上调THI1,THIC,TH1而且TPK在本研究中,我们观察到外源ABA影响下拟南芥幼苗总硫胺素水平增加3.5倍,这为ABA参与应激条件下硫胺素生物合成提供了第一个证据(图5,6).这些发现也可以根据先前的分析来解释THI1而且THIC启动子显示aba响应元件(ABRE)的存在THI1启动子(16的假定应力相关元素THIC启动子,包括ABRE和干旱响应元件[20.].在网上分析TPK启动子已经鉴定出一种脱水和aba诱导的表达元件MYBATRD22 (CTAACCA)TH1启动子为ABRE - ABRELATERD1 (ACGTG)元件。
我们目前对在含aba培养基上生长的tdp依赖酶的表达进行了分析,结果显示KGDH-和tk -编码基因的转录本积累,但对PDH基因转录本没有显著影响。这些数据与我们之前观察到的ABA含量和TK活性增加相一致Z.梅斯NaCl和聚乙二醇处理的幼苗[19].综上所述,这些数据与ABA与植物线粒体功能之间联系的既定假设一致[55- - - - - -57].
虽然外源ABA的应用经常被用来模拟植物的水分胁迫反应[58],一般认为这些类型的反应包括依赖aba的过程和不依赖aba的过程[59].为了进一步验证ABA在植物对盐或SOR产生的水分胁迫的早期反应(感知)中负责硫胺素生物合成的假设,一株突变拟南芥(aba1)在我们目前的实验中使用了。这种突变体在玉米黄质环氧化酶的产生中存在缺陷,这种酶催化环氧类胡萝卜素前体生成的两个早期步骤,作为ABA生物合成途径的一部分[60].在分析中,aba1对盐胁迫和渗透胁迫表现出不同的反应。在盐胁迫下,钙含量降低THI1而且THIC表达水平aba1通过对突变株的观察,证实了ABA对这些硫胺素生物合成步骤的调控作用。的表达式TH1而且TPK被发现与野生型植物保持一致。相比之下,在SOR存在的情况下,硫胺素生物合成基因的激活与野生型植物没有明显不同,这表明在这些条件下,硫胺素生物合成的一些额外的,例如转录后的调节过程,尽管细节仍有待澄清。
我们目前的研究结果表明ABA对硫胺生物合成中起作用的两个第一个基因的转录调节有贡献(THI1而且THIC)在盐胁迫和渗透胁迫下的拟南芥幼苗中,特别是在胁迫反应的早期阶段(即胁迫感知)。然而,其他尚未识别的内源介质也一定参与其中,ABA的相对重要性在较长的时间尺度上(即在植物对胁迫的适应过程中)变得不那么显著。此外,TH1而且TPK基因似乎受ABA以外的内源性因素调控,但当生长介质中存在ABA时,也受ABA调控。
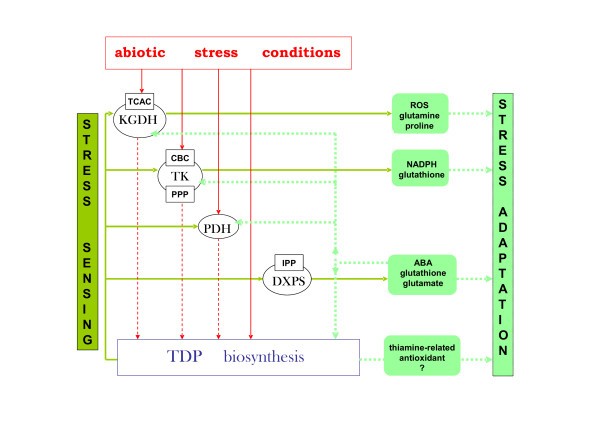
基于本研究中获得的数据以及先前报道的结果,可以假设硫胺素生物合成和tdp依赖的代谢途径在非生物应激感应和适应中的作用(图9).简单地说,植物环境中出现的非生物应激源开始使主要代谢途径失活,其中的关键酶可以作为胁迫传感中心(即KGDH, TK)。对这些因素快速再激活的迫切要求产生了启动进一步适应阶段的次要过程或刺激。TDP生物合成过程的激活导致硫胺素/TDP过量生产,从而支持诸如NADPH生产或类胡萝卜素生物合成等防御反应。TDP的产生和TDP依赖酶的后续活性受ABA控制,但不是这些过程的唯一调节器。然而,硫胺素化合物本身也可以作为抗氧化剂的重要来源[61,62]或在碳饥饿条件下的细菌中发挥应激警报功能[63].
结论
我们在这里首次证明了TDP生物合成过程在拟南芥对盐和渗透胁迫反应的早期(感知)阶段被迅速激活。产生的TDP被合并到同时上调的TDP依赖酶中,如KGDH, PDH, TK,所有这些酶都参与了植物应对胁迫条件的主要代谢途径。ABA似乎参与了编码硫胺素和TDP生物合成中的酶的基因的激活,以及TDP依赖的KGDH和TK基因。我们提出了一个硫胺素在植物胁迫感知和适应过程中的贡献的工作模型。
材料与方法
植物材料、生长条件和胁迫处理
的种子拟南芥ecotype Columbia (Lehle, Round Rock, TX, USA)用于检测硫胺素生物合成和激活过程的所有基因表达分析。aba缺失突变体的种子aba1 (CS21)取自拟南芥生物资源中心(ABRC, Columbus, OH, USA)。使用背景生态型Landsberg erecta的野生型拟南芥进行对比分析。
拟南芥种子(100 mg)经0.5%吐温-20处理5 min, 70%乙醇处理5 min, 15%漂白剂处理7 min。将水洗后的种子在4℃下分层3 d,然后在添加1%蔗糖但去硫胺的Murashige和Skoog (MS)琼脂板上生长,在22℃、100 μmol m的恒光强条件下,光照12 h /暗12 h循环-2年代-1.9天大的幼苗移栽在含0.2 μM PQ、200 mM NaCl、200 mM SOR、100 μM ABA、100 μM JA和200 μM SA的MS培养基上生长2-48 h。所有试验均设3 ~ 5个重复,每个处理20株。
RNA分离和实时定量PCR
使用Trizol试剂(Invitrogen, Carlsbad, CA, USA)和无rnase - DNase I (Promega, Madison, WI, USA)从液氮破坏的幼苗叶片中分离总rna。使用PureLink RNA Mini Kit (Invitrogen)进行进一步纯化。RNA浓度使用NanoDrop ND-1000分光光度计(NanoDrop Technologies, Inc., Wilmington, DE, USA)测定,RNA的完整性在1% (w/v)琼脂糖凝胶上评估。按照制造商推荐的方法,使用Invitrogen SuperScript III逆转录酶从1 μg总RNA中生成cdna。定量RT-PCR采用Rotor-Gene 6000系统(Corbett Life Science, USA)和SYBR Green JumpStart Taq Ready Mix,按照制造商说明书(Sigma, St. Louis, MO, USA)进行。基因特异性引物对,列于表1使用Primer Express 3.0软件(Applied Biosystems, Bedford, MA, USA)进行设计。熔点曲线分析验证了反应的特异性。每个基因的相对mRNA水平通过ΔΔC计算T并以EF-1基因作为内控进行归一化。定量RT-PCR分析使用每个cDNA样本至少3个重复。
硫胺素及其磷酸盐类似物的高效液相色谱分析
拟南芥幼苗中硫胺素及其磷酸盐类似物的测定采用先前描述的方法[19].简单地说,通过12% TCA处理冷冻的拟南芥幼苗,在4°C下处理5分钟,制备植物提取物。蛋白球去除,乙醚处理TCA后,采用反相高效液相色谱法(RP-HPLC)分析上清液,柱后用90 μM铁氰酸钠(III)在0.56 M NaOH中氧化,荧光检测所形成的硫代色素和硫代色素磷酸盐[64].RP-HPLC分离采用梯度洗脱(0-90%B, 16 min),其中溶剂A含有15 mM柠檬酸铵(pH 4.2),溶剂B由0.1 M甲酸和55 mM二乙胺组成。应用的HPLC设备包括岛津(日本京都)LC-9A型HPLC泵,带有岛津FCV-AL比例阀,Knauer(德国Bad Homburg) A0263型手动注射器,Merck药筒LiChrosphere 100RP-18柱(250 × 3.4 mm),岛津RF-535型荧光监测仪(激发为365 nm,发射为430 nm)和岛津Class-VP软件(版本4),用于泵的控制、数据采集和分析。
参考文献
- 1.
刘志刚,李志刚,刘志刚:硫胺依赖酶的结构、机制及催化二元性研究。中国生物医学工程学报,2007,29(4):344 - 344。10.1007 / s00018 - 007 - 6423 - 5。
- 2.
杨志强,李志强,李志强:硫胺素生物合成的结构和生物化学基础。中国生物工程学报,2009,29(3):344 - 344。10.1146 / annurev.biochem.78.072407.102340。
- 3.
Kowalska E, Kozik A:酵母中参与硫胺和硫胺二磷酸生物合成的基因和酶。细胞生物学杂志,2008,13:271-282。10.2478 / s11658 - 007 - 0055 - 5。
- 4.
植物中的硫胺素:代谢和功能方面。植物化学学报,2010,29(3):344 - 344。10.1016 / j.phytochem.2010.06.022。
- 5.
Rapala-Kozik M:维生素B1(硫胺素):参与主要代谢途径的酶的辅助因子和环境压力保护剂。中国机械工程学报,2011,29(3):344 - 344。
- 6.
Raschke M, Burkle L, Muller N, Nunes-Nesi A, Fernie AR, Arigoni D, Amrhein N, Fitzpatrick TB:植物中维生素B1的生物合成需要必需的铁硫簇蛋白(THIC)。美国国家科学研究院。2007, 104: 1967 -19642。10.1073 / pnas.0709597104。
- 7.
Chatterjee A, Schroeder FC, Jurgenson CT, Ealick SE, Begley TP:真核生物中硫胺-噻唑的生物合成:噻唑互变体中间体的鉴定。中国生物医学工程学报,2008,29(3):344 - 344。
- 8.
Machado CR, de Oliveira RL, Boiteux S, Praekelt UM, Meacock PA, menk CF: Thi1,硫胺生物合成基因拟南芥,补充了DNA修复中的细菌缺陷。植物化学学报,1996,31:585-593。10.1007 / BF00042231。
- 9.
黄志刚,李志刚,李志刚,李志刚。高等植物质体硫胺素生物合成途径及其发育调控的研究进展。植物化学学报,2004,26(4):489 - 497。10.1007 / BF00041170。
- 10.
Ajjawi I, Tsegaye Y, Shintani D:植物遗传、分子和生化基础的测定拟南芥硫铵营养缺陷型th1.中国生物医学工程学报,2007,29(4):344 - 344。10.1016 / j.abb.2006.11.011。
- 11.
Rapala-Kozik M, Olczak M, Ostrowska K, Starosta A, Kozik A的分子表征thi3参与硫胺素生物合成的基因玉米:具有4-氨基-5-羟甲基-2-甲基嘧啶(磷酸)激酶和硫胺单磷酸合酶活性的重组双功能蛋白的cDNA序列及其酶学和结构性质。中国生物工程学报,2007,27(3):344 - 344。10.1042 / BJ20070677。
- 12.
Rapala-Kozik M, Golda A, Kujda M:植物组织中控制硫胺二磷酸池的酶。纯化硫胺焦磷酸激酶和硫胺-磷酸磷酸酶的性质玉米幼苗。植物化学学报,2009,27(3):344 - 344。10.1016 / j.plaphy.2008.12.015。
- 13.
朱利亚德,李志刚,杜志刚:植物叶绿体中硫胺素(维生素B1)噻唑部分的生物合成。美国国家科学院。1991, 88: 2042-2045。10.1073 / pnas.88.6.2042。
- 14.
Ajjawi I, Rodriguez Milla MA, Cushman J, Shintani DK:拟南芥硫胺素辅因子活化需要硫胺焦磷酸激酶。中国生物医学工程学报,2007,29(3):344 - 344。10.1007 / s11103 - 007 - 9205 - 4。
- 15.
Bocobza S, Aharoni A:打开植物核糖开关的灯。植物科学进展,2008,13:526-533。10.1016 / j.tplants.2008.07.004。
- 16.
Ribeiro DT, Farias LP, de Almeida JD, Kashiwabara PM, Ribeiro AF, Silva-Filho MC, Menck CF, Van Sluys MA:该1启动子区域的功能表征拟南芥.应用物理学报,2005,26(3):379 - 379。10.1093 / jxb / eri168。
- 17.
Ferreira S, Hjerno K, Larsen M, Wingsle G, Larsen P, Fey S, Roepstorff P, Salome Pais M:蛋白质组分析胡杨.在热应激下。王志强,2006,30(1):59 - 61。10.1093 / aob / mcl106。
- 18.
王ce, Li Y, Labbe A, Guevara D, Nuin P, Whitty B, Diaz C, Golding GB, Gray GR, Weretilnyk EA, Griffith M, Moffatt BA:拟南芥近缘植物Thellungiella非生物胁迫与激素反应的转录分析植物科学学报,2006,30(4):344 - 344。10.1104 / pp.105.070508。
- 19.
李志强,李志强,李志强,等。硫胺代谢的调控玉米非生物胁迫条件下的幼苗。应用物理学报,2008,39(4):344 - 344。10.1093 / jxb / ern253。
- 20.
Tunc-Ozdemir M, Miller G, Song L, Kim J, Sodek A, Koussevitzky S, Misra AN, Mittler R, Shintani D:硫胺增强拟南芥抗氧化胁迫能力。植物学报,2009,29(4):531 - 531。10.1104 / pp.109.140046。
- 21.
谭艳芳,陈志伟,陈志伟,陈志伟,陈志伟:非生物胁迫诱导拟南芥叶绿体、线粒体和过氧化物酶体蛋白质组的变化。蛋白质组学杂志,2009,32(3):367-378。10.1016 / j.jprot.2008.11.006。
- 22.
Baena-Gonzalez E:压力下基因表达调节中的能量信号。植物学报,2010,3:300-313。10.1093 / mp / ssp113。
- 23.
Baxter CJ, Redestig H, Schauer N, Repsilber D, Patil KR, Nielsen J, Selbig J, Liu J, Fernie AR, Sweetlove LJ:异养拟南芥细胞对氧化应激的代谢反应。植物科学学报,2007,29(3):344 - 344。
- 24.
Williams TC, Poolman MG, Howden AJ, Schwarzlander M, Fell DA, Ratcliffe RG, Sweetlove LJ:一种基因组尺度代谢模型能准确预测胁迫条件下中枢碳代谢通量。植物营养学报,2010,34(3):344 - 344。10.1104 / pp.110.158535。
- 25.
Obata T, Matthes A, Koszior S, Lehmann M, Araújo WL, Bock R, Sweetlove LJ, Fernie AR:拟南芥短期氧化胁迫下线粒体蛋白复合物与代谢调控的关系。植物化学学报,2011,27(3):344 - 344。10.1016 / j.phytochem.2010.11.003。
- 26.
Munns R:盐和水胁迫的比较生理学。植物学报,2002,26(3):357 - 357。10.1046 / j.0016-8025.2001.00808.x。
- 27.
郭军,郭俊杰,王晓明,杨晓明,杨晓明,杨晓明。植物水分分布与叶片膨大的关系。应用物理学报,2000,29(4):344 - 344。10.1093 / jexbot / 51.350.1495。
- 28.
Sweetlove LJ, Heazlewood JL, Herald V, Holtzapffel R, Day DA, Leaver CJ, Millar AH:氧化应激对拟南芥线粒体的影响。植物学报,2002,32:891-904。10.1046 / j.1365 - 313 x.2002.01474.x。
- 29.
Taylor NL, Day DA, Millar AH:植物线粒体应激诱导氧化损伤的靶点及其对细胞碳氮代谢的影响。中华实验物理学报,2004,55:1-10。
- 30.
Bunik VI, Fernie AR:由2-羟戊二酸脱氢酶反应施加的代谢控制:能量产生和氮同化之间交叉的跨界比较。中国生物工程学报,2009,29(4):344 - 344。10.1042 / BJ20090722。
- 31.
Raines CA:卡尔文循环的重访。光子学报,2003,27(2):344 - 344。10.1023 /: 1022421515027。
- 32.
Henkes S, Sonnewald U, Badur R, Flachmann R, Stitt M:反义烟草转化体质体转酮醇酶活性的小幅降低对光合作用和苯丙类代谢有显著影响。植物学报,2001,13:535-551。
- 33.
李志刚,李志刚,李志刚。植物氧化应激与抗氧化系统的关系。中国生物医学工程学报,2002,32(3):344 - 344。
- 34.
Couée I, Sulmon C, Gouesbet G, El Amrani A:可溶性糖在植物活性氧平衡中的作用及其对氧化应激的响应。应用物理学报,2006,37(4):449-459。10.1093 / jxb / erj027。
- 35.
Valderrama R, Corpas FJ, Carreras A, Gómez-Rodríguez MV, Chaki M, Pedrajas JR, Fernández-Ocaña A, Del Río LA, Barroso JB:脱氢酶介导的NADPH循环是橄榄植物对抗盐诱导氧化应激的关键抗氧化系统。植物细胞环境学报,2006,29:1449-1459。10.1111 / j.1365-3040.2006.01530.x。
- 36.
李志刚,李志刚,李志刚,李志刚。植物类异戊二烯生物合成的限制性酶。中国生物医学工程学报,2001,26(3):344 - 344。10.1074 / jbc.M100854200。
- 37.
Lois LM, Rodriguez-Concepcion M, Gallego F, Campos N, Boronat A:番茄果实发育过程中的类胡萝卜素生物合成:1-脱氧-d -木酮糖5-磷酸合酶的调节作用。植物学报,2000,26(3):344 - 344。10.1046 / j.1365 - 313 x.2000.00764.x。
- 38.
patami I, Kanellis AK:植物萜类合成基因的应激与发育反应岩蔷薇creticus无性系种群。creticus。植物细胞学报,2010,29:629-641。10.1007 / s00299 - 010 - 0849 - 1。
- 39.
Meier S, Tzfadia O, Vallabhaneni R, Gehring C, Wurtzel ET:拟南芥发育和渗透胁迫响应过程中类胡萝卜素、叶绿素和质体类异戊二烯生物合成基因的转录分析。中国生物医学工程学报,2011,29(3):377。
- 40.
朱建军:植物盐与干旱胁迫信号转导。植物学报,2002,29(3):357 - 357。10.1146 / annurev.arplant.53.091401.143329。
- 41.
Cordoba E, Porta H, Arroyo A, San Román C, Medina L, Rodríguez-Concepción M, León P:玉米1-脱氧-d -木酮糖5-磷酸合成酶3个基因的功能特征。应用物理学报,2011,29(2):344 - 344。10.1093 / jxb / erq393。
- 42.
桑特纳A,埃斯特尔M:植物激素信号的最新进展和新趋势。自然科学学报,2009,39(4):344 - 344。10.1038 / nature08122。
- 43.
黄志刚,李志刚:植物激素平衡与非生物胁迫耐受性。植物学报,2011,14:290-295。10.1016 / j.pbi.2011.02.001。
- 44.
吴佳杰,朴玉生,李佳佳,郑玉杰,赵天杰:大白菜thiJ-like基因的分子特征。中华生物化学杂志,2004,37:343-350。10.5483 / BMBRep.2004.37.3.343。
- 45.
安叶平,金松,李永华:维生素B1是植物抗病的激活剂。植物科学学报,2004,29(3):344 - 344。10.1104 / pp.104.058693。
- 46.
Bari R, Jones JD:植物激素在植物防御反应中的作用。中国生物医学工程学报,2009,29(4):344 - 344。10.1007 / s11103 - 008 - 9435 - 0。
- 47.
Walia H, Wilson C, Wahid A, Condamine P, Cui X, Close TJ:大麦在盐胁迫下的表达分析。中国生物医学工程学报,2006,30(6):344 - 344。10.1007 / s10142 - 005 - 0013 - 0。
- 48.
黄志刚,黄志刚,黄志刚:植物顺式作用调控DNA元件(PLACE)数据库:1999。中国生物医学工程学报,1999,27(4):457 - 457。10.1093 / nar / 27.1.297。
- 49.
Vandepoele K, Quimbaya M, Casneuf T, De Veylder L, Van De Peer Y:利用顺式调控元件和共表达网络研究拟南芥的转录控制。植物科学学报,2009,30(4):344 - 344。
- 50.
李志刚,李志刚,李志刚:不同植物激素对转录过程的调控是通过非重叠的转录反应实现的。电子学报,2006,26(3):344 - 344。10.1016 / j.cell.2006.05.050。
- 51.
Arbona V, Argamasilla R, Gómez-Cadenas A:常见和不同的生理,激素和代谢反应拟南芥而且Thellungiella halophila对水和盐胁迫。中国植物学报,2010,27(3):344 - 344。
- 52.
Divi UK, Rahman T, Krishna P:油菜素类固醇介导的胁迫耐受性与脱落酸、乙烯和水杨酸途径相互作用。中国生物医学工程学报,2010,30(4):344 - 344。
- 53.
Cutler SR, Rodriguez PL, Finkelstein RR, Abrams SR:脱落酸:核心信号网络的出现。植物学报,2010,29(3):344 - 344。10.1146 / annurev - arplant - 042809 - 112122。
- 54.
Fujita Y, Fujita M, Shinozaki K, Yamaguchi-Shinozaki K: aba介导的植物渗透胁迫应答的转录调控。植物工程学报,2011,29(4):357 - 357。10.1007 / s10265 - 011 - 0412 - 3。
- 55.
Prasad TK, Anderson MD, Stewart CR:驯化、过氧化氢和脱落酸保护玉米幼苗线粒体免受不可逆冷害。中国农业科学,2004,27(4):457 - 457。
- 56.
王晓明,王晓明,王晓明,等:拟南芥线粒体载体蛋白的基因组学分析。植物科学进展,2003,31(4):443-453。10.1104 / pp.009985。
- 57.
Kharenko OA, Boyd J, Nelson KM, Abrams SR, Loewen MC:脱落酸与线粒体腺嘌呤核苷酸易位子相互作用的鉴定与表征。中国生物工程学报,2011,37(3):344 - 344。10.1042 / BJ20101898。
- 58.
巴特尔斯D,酸E:高等植物对脱水的分子反应。植物对非生物胁迫的反应。编辑:Heribert H, Shinozaki K.施普林格,柏林;2004:13-37。
- 59.
杨晓明,杨晓明,杨晓明:干旱和寒冷胁迫对植物基因表达的调控网络。中国植物学报,2003,6:410-417。10.1016 / s1369 - 5266 (03) 00092 - x。
- 60.
Barrero JM, Piqueras P, González-Guzmán M, Serrano R, Rodríguez PL, Ponce MR, Micol JL:对拟南芥ABA1基因的突变分析表明ABA参与了营养发育。应用物理学报,2005,29(4):344 - 344。10.1093 / jxb / eri206。
- 61.
胡明明,陈玉凯,林艳芳:一些B族维生素及类维生素化合物的抗氧化和促氧化活性。化学与生物工程学报,1995,27(3):344 - 344。10.1016 / 0009 - 2797(95) 03608 - 8。
- 62.
Lukienko PI, Mel'nichenko NG, Zverinskii IV, Zabrodskaya SV:硫胺素的抗氧化性能。中华生物医学杂志,2000,30(3):344 - 344。
- 63.
Bettendorff L, Wins P:生物化学中的硫胺二磷酸:硫胺代谢的新方面,特别是作为辅因子的三磷酸衍生物。清华大学学报(自然科学版),2009,29(4):344 - 344。10.1111 / j.1742-4658.2009.07019.x。
- 64.
李宝林,王海燕,王国荣:梯度洗脱高效液相色谱法测定硫胺素及其磷酸酯类。中华医学杂志,2001,29(3):344 - 344。10.1016 / 0378 - 4347 (91) 80311 - y。
确认
作者感谢Andrzej Kozik教授对手稿的有益讨论和批判性阅读。这项工作得到了波兰科学和高等教育部的部分支持。NN303 320937到M. R-K)和雅盖隆大学(法定基金No.;DS15 / WBBiB)。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
MRK设计和协调了研究,参与了HPLC和分子生物学实验并撰写了手稿;NW进行分子生物学实验;MK参与硫胺素化合物HPLC分析;AKB参与分子生物学研究和植物繁殖。所有作者都阅读并批准了最终的手稿。
权利和权限
本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用属性许可协议(http://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
Rapala-Kozik, M., Wolak, N.;et al。硫胺素(维生素B1)生物合成拟南芥在盐胁迫和渗透胁迫条件下,幼苗在胁迫反应的早期阶段是由脱落酸介导的。BMC植物生物学12日,2(2012)。https://doi.org/10.1186/1471-2229-12-2
收到了:
接受:
发表:
关键字
- 水杨酸
- 硫胺素
- 茉莉酸
- 拟南芥幼苗
- 硫色素