抽象的
背景
植物microRNA(miRNA)在对环境压力的转录反应中发挥关键作用。然而,MiRNA在对昆虫草食病的反应中的作用尚未彻底探索。为了识别草食病响应的miRNA,我们在生态模型植物中识别了保守的miRNA烟草attenuata则它们与食草动物的相互作用已经在实验室和野外研究中得到了很好的描述。
结果
我们鉴定了来自36个家族的59个mirna,其中两个是内源性的反式- miRNAs靶向的作用小干扰rna (tasiRNA)。我们描述了前体和成熟mirna对来自专业食草动物的模拟攻击的响应manduca sexta.采用荧光定量PCR分析,并用ir-重获缺失茉莉酸盐生物合成的RNAi转化子,以鉴定茉莉酸盐依赖和非依赖的miRNA调控。miRNAs和tasiRNAs的表达分析显示,miRNAs和tasiRNAs的表达受机械创伤或创伤加口腔分泌物的特异性调控M.Sexta.幼虫,这些小RNA被累积在茉莉依赖或依赖性的举止中。此外,cDNA微阵列分析表明,相应的靶基因的表达模式与miRNA和TASIRNA的积累相关。
结论
我们表明,一组mirnas和tasirnas策划了涉及的目标基因的表达n attenuata则对食草动物攻击的反应。
背景
一组非编码小rna (smRNAs)在转录调节中发挥着重要作用,通过与它们的靶序列结合,导致靶的转录降解、转录或翻译抑制[1- - - - - -5].SMRNA分为两种主要类:MicroRNA(miRNA)和小干扰RNA(SIRNA)。将miRNA的初级转录物加工成MiRNA的前体,其形成次级茎和环结构,其由核糖核酸酶Dicer样1(DCL1)加工成MiRNA / miRNA *双链体,随后掺入RNA诱导的沉默复合物中(RISC)[5- - - - - -7].sirna进一步被分为反式表演sirnas(tasirnas),染色质相关独联体根据他们的生物生物组成,代理sirnas和自然反义sirnas [8- - - - - -10].tasiRNA的生物发生是由miRNAs调控的,miRNAs直接切割初级tasiRNA (TAS.)编码tasiRNAs的转录本,导致由RNA依赖的RNA聚合酶(RdRs)合成第二链RNA。双链rna被DCL4切丁生成tasiRNAs拟南芥[9- - - - - -11].
植物miRNA和SIRNA参与了几个发育过程[12]:胚胎发生(13,器官极性[14,叶片形成[15],根籍发展[11,16,植物激素信号[17,18]和开花时间[19].植物防御信号也受MiRNA响应不同的非生物应激[20.,21]包括热,冷,干旱[22,23]和UV-B辐射[24].例如,答:芥在磷酸盐饥饿期间诱导的MiR399(Ath-MiR399)靶向泛素缀合的E2酶,其中磷酸盐从土壤中摄取[25].在干旱胁迫下,Ath-miR159调控MYB33和MYB101在种子萌发过程中激活脱落酸反应的转录因子[26].Ath-mir398调节Cu / Zn-超氧化物歧化酶基因,其解毒超氧化物自由基[27].最近的一项研究报道,烟草叶片和根部的机械损伤会诱导几种mirna [28].
植物的microrna也参与生物间的相互作用。Ath-miR393由鞭毛蛋白衍生的PAMP肽22诱导,以F-box蛋白和运输抑制剂反应1为靶点,在抗菌反应中起关键作用[29].ATH-MIR160,ATH-MIR167和ATH-MIR825响应感染太平洋标准时间DC3000 hrcC [20.),而答:芥和烟草受TyMVP69病毒感染的植物积累了高水平的miR156,miR160和miR164 [30.,31].植物mirna也参与了与细菌的有益相互作用:miR482、miR1512和miR1515在根瘤菌侵染中发挥作用大豆有节,Bridyrhizobium japonicum[32].然而,植物mirna在昆虫食草动物反应中的作用尚不清楚。
野生烟草烟草attenuata则其食草动物群落已成为植物 - 食草动物相互作用研究的生态模型系统。在昆虫食草动物攻击期间,n attenuata则快速诱导茉莉酸介导的防御反应,重新配置初级和次级代谢[33,34].茉莉酸类包括茉莉酸(JA)及其衍生物和缀合物;茉莉酸盐,特别是活性激素茉莉酰异亮氨酸(JA-Ile)调节对咀嚼性食草动物的大多数防御[35].脂肪酸氨基酸缀合物(FACS)在专业食草动物幼虫的口腔分泌(OS)中,manduca sexta.,触发jasmonate介导的直接和间接防御n attenuata则,如尼古丁的积累、蛋白酶抑制剂的产生、二萜苷的生物合成和绿叶挥发物的释放[36- - - - - -38].在温室和野外研究中,茉莉酸生物合成或信号传导受损的转基因植物显示出对草食的敏感性增加[35,39- - - - - -41].
OS-Elicitation显着改变了SMRNA人口n attenuata则[42],以及smRNA途径的两个主要组成部分,RdRs和DCL蛋白,在生物和非生物胁迫应答中发挥作用[42- - - - - -45].沉默的N.Attenuata RDR1.,DCL3,DCL4导致防御反应受损M.Sexta.食草性(42,44,45].沉默NaRdR1或nadcl4.损害茉莉酸(JA)积累,共同沉默nadcl3.和nadcl4.减少JA水平,表明RDR1 / DCL4介导的SMRNA是对昆虫草食病的反应的关键调节因素。
为了加深我们对smrna在植物-昆虫相互作用中的作用的理解,我们鉴定了初级miRNA (米尔)成绩单和TAS.的转录组数据库中编码tasiRNAs的转录本n attenuata则[46[计算上分析的次级茎和环结构米尔记录。为了了解茉莉酸盐在调控miRNA中的作用,我们检测了茉莉酸盐缺失的miRNA的积累丙二烯氧化环化酶(重获) RNAi线。AOC蛋白为JA生物合成提供前体[47].mirna和tasirna及其推测的靶基因的表达分析为植物smrna在植物对草食反应中的关键作用提供了证据。
结果与讨论
鉴定保守的miRNA及其前体n attenuata则
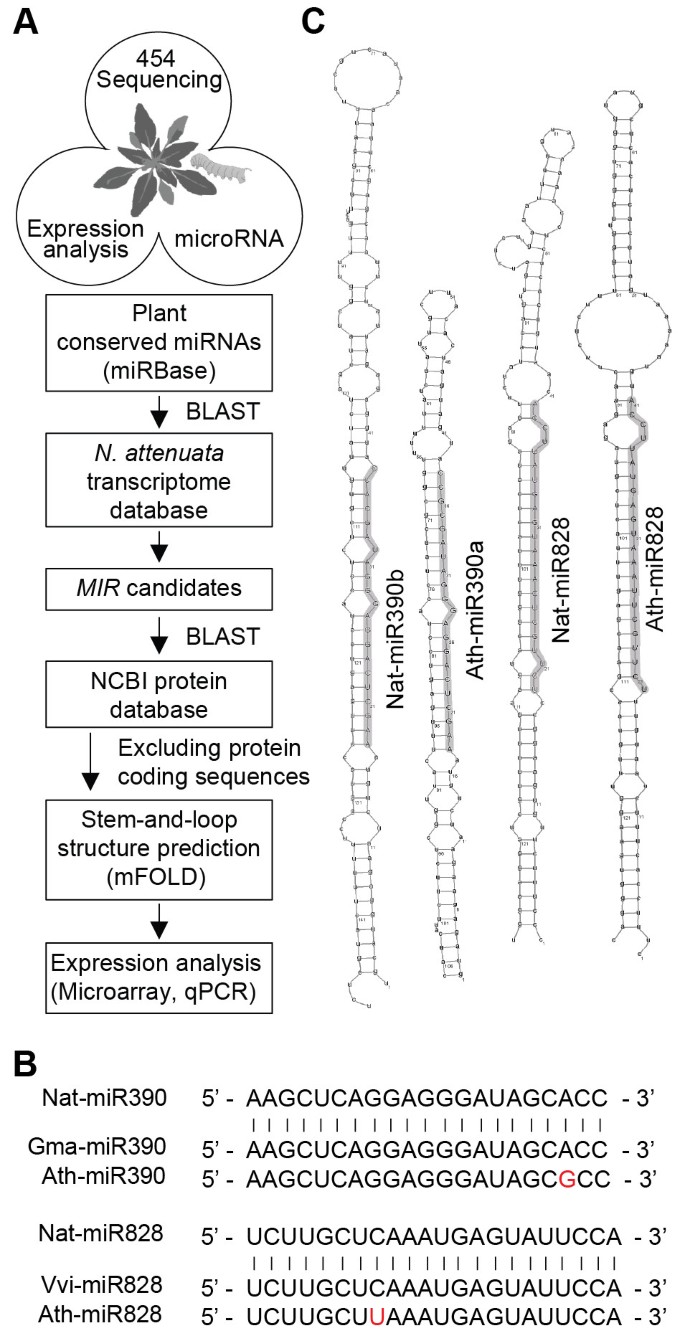
以鉴定保守的miRNAsn attenuata则,我们使用了一个454-转录组数据库n attenuata则对MiRBase的保守植物MiRNA进行爆炸搜索(http://www.mirbase.org)(数据1A和1B).这项研究确定了分布在36个家庭中的59个潜在mirna(表1).我们利用BLASTX算法对NCBI蛋白质数据库来检查MIRNA的推定初级转录物是非编码的。基于Web的MFOLD软件(http://mfold.rna.albany.edu/)用于预测次生茎环结构。在鉴定的mirna前体中,52个具有茎环结构(图)1C和附加文件1),其最小自由能(MFE)为ΔG =−97.5千卡摩尔-1至−33.3千卡mol-1(表1),平均MFE为−62.1千卡mol-1.这一平均MFE可与答:芥(-59.5 kcal mol-1),高于红藻Porphyra yezoensis.(−41.7千卡摩尔-1)低于单子叶米饭(-71.0 kcal mol-1)和小麦(−72.4千卡摩尔-1)[22,48].只有七个预测的miRNA-前体转录物没有形成茎和环结构或不稳定(表 1).我们确定了几个n attenuata则(NAT)MiRNA系列(NAT-MIR403,NAT-MIR478,NAT-MIR1128,NAT-MIR1133,NAT-MIR1446,NAT-MIR1863,NAT-MIR2911和NAT-MIR2911和NAT-MIR5281)N. Tabaccum.[28,49].其中Nat-miR478、Nat-miR482、Nat-miR1128、Nat-miR1133、Nat-miR1446、Nat-miR1863和nat - mir5281不在答:芥但与其他植物种类的同源物相近(见表)1).
接下来,我们设计了探测n attenuata则RNA墨水上的miRNA(附加文件2).我们使用从莲座叶中提取的40μg的总RNA进行Northern印迹杂交以检测所选择的miRNA。MiRNA的累积变化(附加文件3.).与Nat-MiR157,Nat-MiR393,NAT-MiR396和Nat-MiR828的NaT-MiR159,NAT-MiR171,NAT-MiR172和NAT-MiR319的积累高。为了进一步分析前体和成熟的miRNA丰度,我们使用具有特定底漆的实时定量PCR(QPCR)(附加文件4和5).
tsirna的鉴定n attenuata则
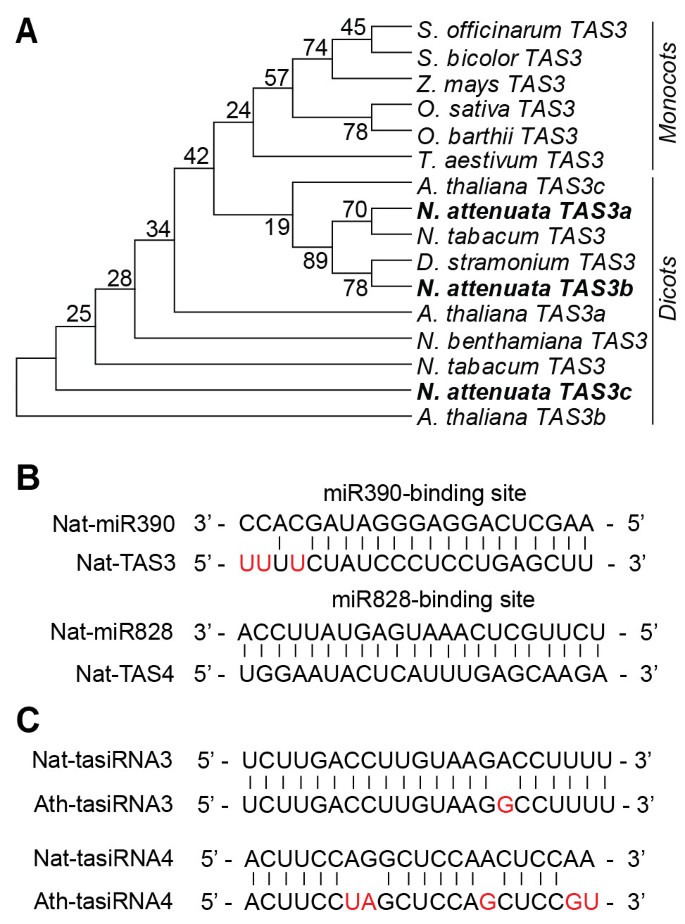
内源性tasiRNAs的四个家族(TAS1.,TAS2.,TAS3.,TAS4.)确定答:芥是由mirna调控的[9,50].我们发现三个TAS3.成绩单和一个TAS4.记录在n attenuata则(数字 2),并构建了不同植物物种的系统发育树,以研究不同植物物种的进化关系TAS3.在双子叶植物和单子叶植物中表达的[50,51].毫不奇怪,Natas3.成员被分组在二象的植物物种的成员中(图 2一种)。
因为TAS3.和TAS4.转录本分别包含miR390和miR828的结合位点[9,11,52我们炸了Nat-miR390和Nat-miR828TAS.转录物(图 2B),并比较n attenuata则Tasirnas与那些人答:芥(数字 2C).序列分析表明miRNA和tasiRNA序列的结合位点高度保守n attenuata则和答:芥.
伤口和OS诱导的miRNA
接下来,我们研究了花期WT植株叶片中mirna及其靶基因的丰度在损伤和稀释后的变化M.Sexta.OS(W + OS)或水至伤口(W + W,作为W + OS的对照)与没有治疗(控制)(图 3.和4).W+OS处理忠实地模拟了由M.Sexta.喂养(36,38]但具有允许精确控制的诱导时间的明显优势(与散发性质相反M.Sexta.幼虫的摄食行为),因此大大增加了转录分析的重现性。
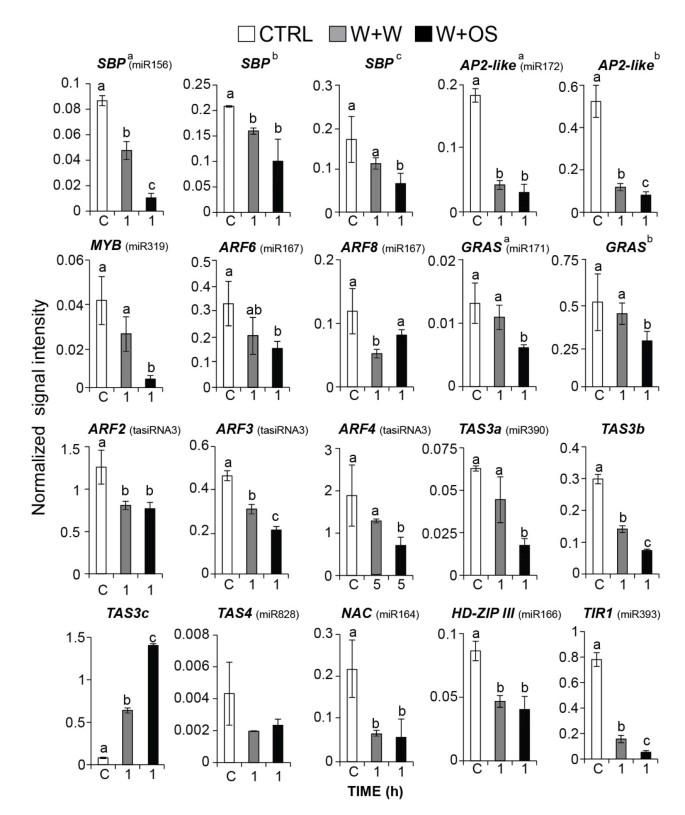
靶基因的miRNA和tasirnas的表达。W+W和W+OS处理后mirna和tasirna靶基因的标准化转录丰度均值(±SE)水平。未经处理的植物作为对照(CTRL, C)。微阵列数据中的信号强度使用75百分位值和log2转换归一化。字母表示显著差异(P< 0.05)。有关目标基因的识别,请参阅附加文件9.
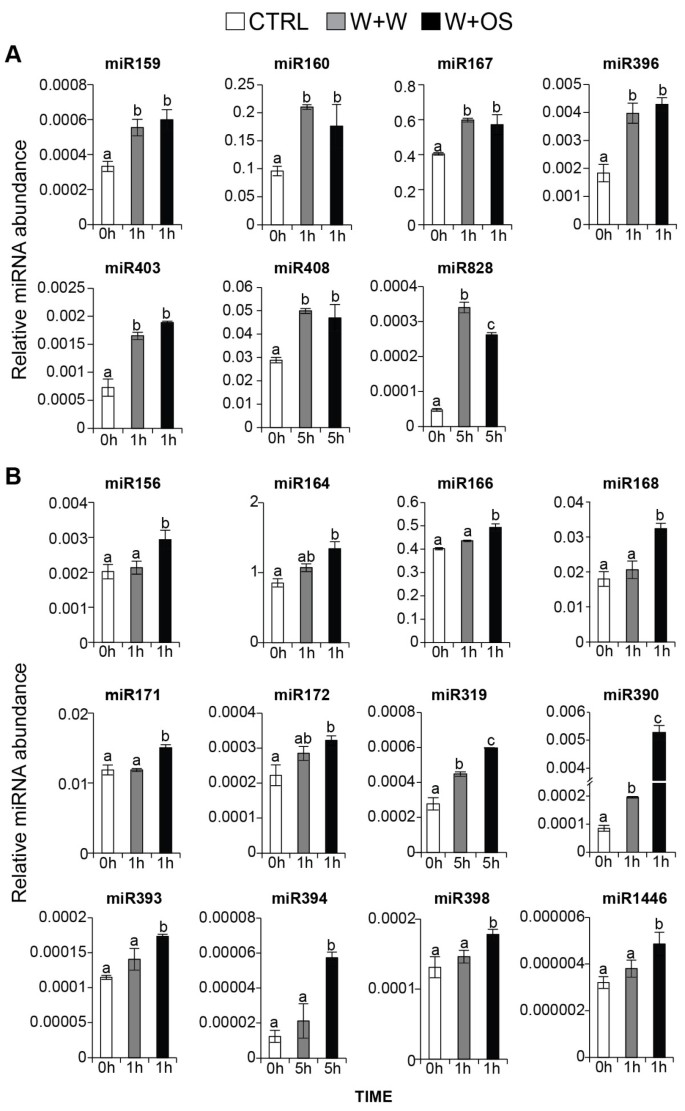
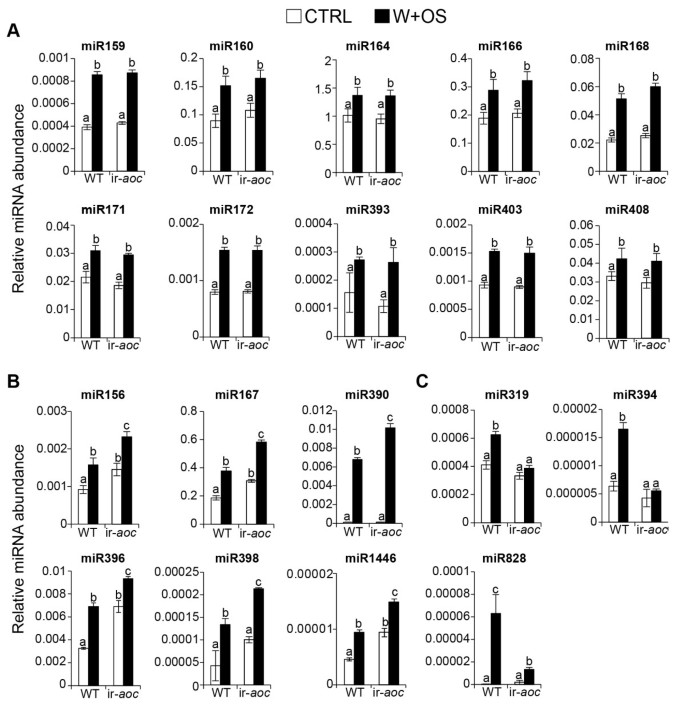
在W+W和W+OS处理后,成熟的Nat-miR159、Nat-miR160、Nat-miR167、Nat-miR396、Nat-miR403、Nat-miR408和Nat-miR828的丰度均增加,其丰度没有差异(图)3.一种)。我们分类了这些miRNA伤口诱导的miRNA。十二个保守的MiRNA系列(NAT-MIR156,NAT-MIR164,NAT-MIR166,NAT-MIR168,NAT-MIR171,NAT-MIR172,NAT-MIR319,NAT-MIR390,NAT-MIR393,NAT-MIR394,NAT-MIR398和与对照和W + W处理的叶子相比,在W + OS处理的叶片中,NAT-MIR1446)显着增加(图 3.b),这些被归类为OS诱导的miRNA。
很好地确定了MiRNA和Tasirnas通过完美或不完美的互补性与其目标MRNA结合[5].这种互补性允许鉴定数据库中的miRNA目标。我们使用BLASTN算法对内部转晶数据库的MiRNA序列爆炸,默认参数允许1-4个不匹配。我们确定了111个潜在目标,介绍了Tasirnas的目标(附加文件6).
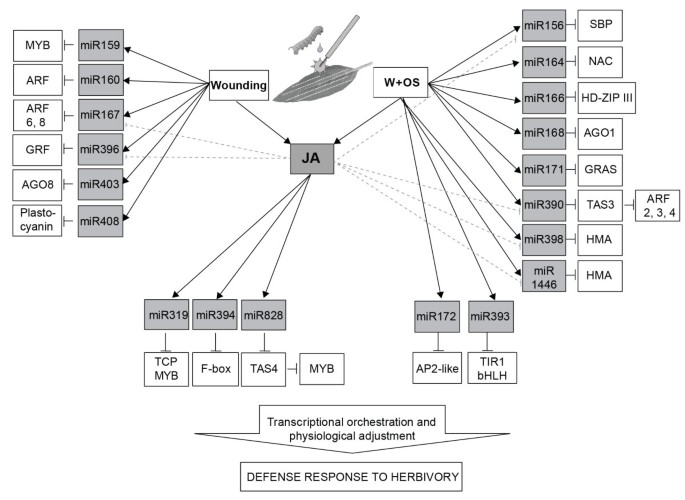
已知Ath-miR164负调控参与年龄依赖性衰老的ORE1/NAC2转录因子[53] ore1 / NaC2中的突变延迟了旧叶片的叶绿素损失答:芥[53].我们发现含有NAT-MIR164结合位点的NAC转录因子n attenuata则(数字 4).在W+W和W+OS诱导的叶片中,NAC转录本显著减少(图)4),这与os诱导后Nat-miR164水平升高相关(图3.B).这个结果可能解释了原因M.Sexta.攻击延迟衰老n attenuata则[54].
此外,ARF6和ARF8被伤口诱导的NAT-miR167的推定靶标,它们的转录物随NAT-MIR167的积累而同时降低(图 4).OS诱导NAT-MIR171,GRAS结构域转录因子的潜在靶标在OS引发植物中下调(图 4).几个OS诱导NAT-MIR156目标的转录物被注释为SQUAMOSA在W + OS处理后,启动子结合蛋白(Sbps)显着下调。在W + OS处理的叶子中大量NAT-MIR172显着增加(图 3.b)始终如一地,其推定靶标的转录物AP2样蛋白质在W + W和W + OS处理的叶子中显着下调(图 4).
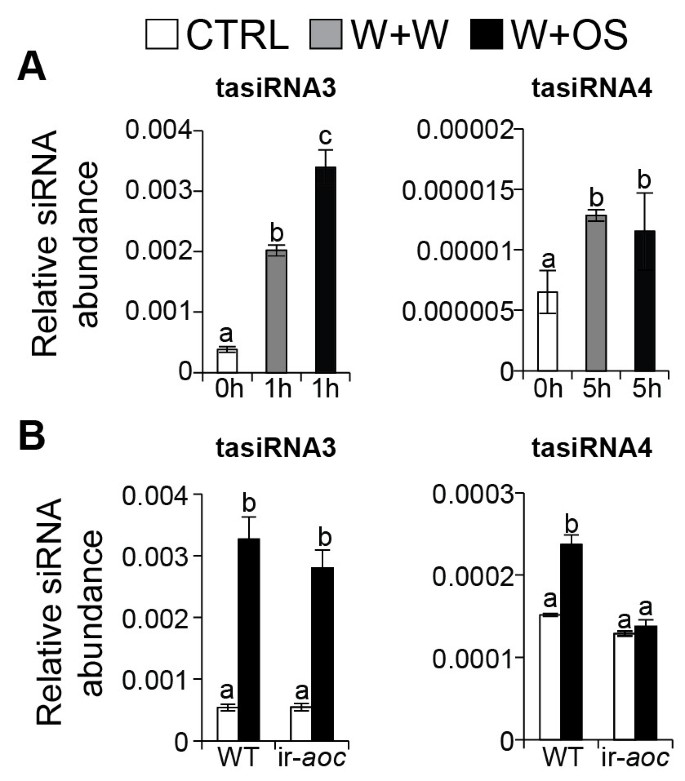
W + OS处理后MiRNA转录物最显着的变化对于NAT-MiR390,与对照叶片相比显示75倍,与W + W处理的叶片相比增加了30倍(图 3.b)。Ath-mir390切割TAS.RdR6/DCL4复合物介导的tasiRNA3的产生[11,52].TasiRNA3控制疾病响应因子(ARFS)2,3和4的转录,其调节叶片形态和侧根生长答:芥[11,16,52].过度的TAS3.导致侧根数量增加,敲除突变体侧根生长受损[11].W+OS处理后,成熟Nat-tasiRNA3丰度增加(图)5A)和Nat-tasiRNA3以独立于ja的方式被调节(图5b)。TasiRNA3的靶标,转录物同源答:芥ARF2,3.和4W + OS elicitation后显着减少(图 4),提示Nat-miR390可以影响根的结构,从而调节根中合成的尼古丁的产生,或者通过增加根中矿物质的吸收或糖的储存来促进草食动物的耐受性。我们之前的研究表明,沉默nadcl4.,进而减少tasiRNA3的积累,显著损害根的生长和烟碱的积累n attenuata则[45].我们通过QPCR分析验证了微阵列数据(附加文件7),结果显示类似的表达式模式(附加文件8).
塔斯兰国家响应OS-elicitation的积累。(一个)与对照(CTRL)和W+W处理相比,os诱导的na - mir390靶点tasiRNA3的丰度显著增加。tasiRNA4的丰度受创伤诱导的Nat-miR828调控,在创伤后显著增加。(B)分别在OS-Elicitation之后在1小时和5小时内累积JA-Indushy TasiRNA3和JA依赖性TasiRNA4。对于每种样品,一片叶子在32天老植物的玫瑰果上被伤害加上专家食草动物的幼虫分泌物治疗M.Sexta.(W+OS),处理1 h或5 h后收获。未经处理的植物作为对照。显示的是三个重复的平均值(±SE)水平。字母表示显著差异(P< 0.05)。
JA依赖mirnas
茉莉酸盐在向草药反应中介导对草药的关键作用是很好的,并且发现与W + W治疗相比,在W + OS处理的叶片中茉莉族水平显着增加的茉莉酸盐水平(附加文件9)[37].沉默的naaoc.降低W+OS处理叶片中JA积累量90-100%9),已知可以抑制ja介导防御的产生[47].通过对该基因型的os诱导,我们可以了解哪些mirna受茉莉酸盐的调控。
在W +之后增加了10个miRNA(NAT-MIR159,NAT-MIR160,NAT-MIR164,NAT-MIR171,NAT-MIR172,NAT-MIR393,NAT-MIR403,NAT-MIR393,NAT-MIR172,NAT-MIR393,NAT-MIR172,NAT-MIR393,NAT-MIR172)W和W +操作系统治疗,但WT和IR之间没有区别重获植物(图6A).我们认为这些mirna是ja独立的mirna。对照和W+OS诱导的ir叶片中Nat-miR156、Nat-miR167、Nat-miR390、Nat-miR396、Nat-miR398和Nat-miR1446的丰度均显著升高重获(图6B),表明茉莉酸盐或ja信号对这些miRNAs的水平有负面影响,无论如何处理。na - mir390丰度在ir-中较高重获只有在W + OS治疗后(图 6b)。虽然在wt(图 3.b),它们在IR-中未受W + OS治疗诱导重获植物(图6C).我们认为这些是os诱导的ja依赖的mirna。伤口诱导型Nat-miR828在W+W和W+OS处理下均被诱导(图)3.A),但它们的水平在诱发ja缺陷的ir-中没有显著的诱导重获植物与WT的比较(图6C)。
MiR319的一个主要目标答:芥是TCP(Teosintebranceed / Cyperoidea / PCF)转录因子,积极调节茉莉酸盐生物合成[18].TCP4蛋白可以结合启动子Ligoxygenase2.(LOX2.)答:芥[18].我们还不知道答:芥tcps in.n attenuata则,但NAT-MIR319诱导的时序与L + OS引起的JA积累和诱导相似NaLOX3,这是功能性同源物A. Thaliana Lox2.[40,55].W+OS处理可放大创面诱导的JA积累(附文件)9)[36,38],并对Nat-miR319做同样的处理(图3.b)。这表明NAT-MIR319可以在茉莉酸盐生物合成的微调调节中发挥作用[18在食草性)。
NAT-MIR828和NAT-TASIRNA4在WT(图)中的W + W和W + OS治疗增加(图 3.A),但不是在ir-重获植物(数据5和6C).在ir-中Nat-miR828水平显著下降重获与WT及其主要转录本进行比较(图6C和附加文件10).mir828的一个目标是一个TAS4.编码由RDR6 / DCL4蛋白处理的TasiRNA4的转录物[9,56].TasiRNA4针对几种调节苯丙烷化生物合成的MYB转录因子[9,56].几种苯丙类防御代谢产物在n attenuata则在食草动物和沉默期间DCL4改变W+ os诱导的叶片中二咖啡酰亚精胺和咖啡酰腐胺的积累[45].一种茉莉酸诱导的MYB转录因子NaMYB8,参与植物防御食草性和苯丙素生物合成[57,58].虽然在我们目前的cDNA文库中没有找到包含Nat-tasiRNA4结合位点的MYB转录因子,但miR828和tasiRNA4的序列保存在答:芥和n attenuata则将指导鉴定调节次级代谢产量的目标。
单一诱导对mirna及其靶标积累的时间效应
为了研究mirna对昆虫食草性的反应动力学,我们在处理1 h和5 h后测量了mirna及其靶标的积累。除miR166和miR390外,大多数os诱导的mirna在os诱导后1 h内大量增加,并持续增加到5 h11).miRNA390在诱导1 h时升高,但在诱导5 h后再次下降11).通过伤害诱导OS诱导的MIRNA,但伤害后的增加(miR164,miR166,miR172,miR319和miR398)或较慢(miR168,miR390和miR393),而不是OS引发。有趣的是,在OS引发后1小时,大多数miRNA和TasiRNA靶基因在OS-ELICITION之后减少,但恢复到对照水平(SBPA,ARF2,ARF3,TAS3A,TAS3B,HD-ZIPIII,TIR1)或甚至增加到大于之前的水平诱导(MYB,ARF6,ARF8),表明调节剂成熟miRNA与其靶基因之间的复杂关系。
初级和成熟miRNA转录本积累的比较
我们检查了积累米尔使用先前报道的微阵列数据的转录本[46](附加文件12)通过QPCR确认这些响应(附加文件10).的积累mir156.,MIR159.,MIR164.,mir166.,mir167.,mir168,MiR172.,mir393.,mir396.,mir398.,mir403.,MIR1446与他们成熟的miRNA的丰富无关。转录水平的变化mir160.,mir171.,MIR319,mir390.,MIR408.,mir828.反映了其成熟mirna的转录本积累。一般来说,两者之间的关系较弱米尔已经报道了成熟的miRNA积累[59].我们的数据也表明了处理米尔转录比转录更重要米尔植物性miRNA调控基因。
结论
为了建立植物与昆虫相互作用中mirna的功能数据库,我们研究了植物中mirna的积累及其靶标n attenuata则在OS-Elicitation之后。我们将W + OS诱导的miRNA和TASIRNA分为四组:JA依赖性或依赖性伤口诱导型和OS诱导的miRNA或TASIRNA(图 7).Herbivore-attackedn attenuata则植物诱导防御代谢产物并调节其生理机能以耐受昆虫的攻击。本研究表明,W+OS诱导作为一种模拟草食动物攻击的严格手段,可以迅速改变参与开花时间、根形态、衰老、激素调节和代谢产物合成的mirna的表达。在未来的工作中,我们将实验表征这些W+OS调控的ja依赖和ja独立mirna的功能及其靶标。
方法
植物材料和生长条件
WT和JA缺陷的IR-重获第30次近亲生成的RNAi线n attenuata则(Torrey Ex。Watson)(最初在美国西南部,美国)用于实验。种子在补充有维生素B5的MS基础培养基上发芽(GB5,Duchefa,http://www.duchefa.com).为了处理,莲座+1节点(最小膨胀叶)的叶片用织物图案轮伤,以及20 ul milliq水(w + w)或20μlM.Sexta.OS(用无菌水稀释5X) (W+OS)。未处理植物的相同位置的叶子作为对照。在Master Suns-U PIA Agro 400-W钠光补充光照16/8 h(长日)(26-28°C)的温室中种植植株。
鉴定miRNA和前体,以及MiRNA靶的预测
为了鉴定保守miRNA和tasiRNA,我们对miRBase (http://www.mirbase.org) 反对n attenuata则在House 454-Transriptome数据库中使用默认搜索参数,允许1或2个不匹配(图 1A).选择20到24个nt序列对抗最多4个核苷酸错配的非编码转录本,作为候选者来检查预测的miRNA二级结构。公共的基于网络的mFOLD服务器(http://mfold.rna.albany.edu/)用于使用默认参数,折叠温度(37℃)和离子条件(1M NaCl)预测辅助茎和环结构,具有最小自由能(MFE)形成(表 1).使用rnashapes另外描述了预测的miRNA-前体(http://bibiserv.techfak.uni-bielefeld.de/rapidshapes.)[60来创建茎和循环结构(附加文件1).为了TAS3.识别我们使用以下内容TAS3.直接同源:Saccharum OfficinArum.(EU327139),高粱二色的(EU327137),玉米(EU327127,EU293143),选用barthii(GQ420228),Triticum aestivum.(EU327134),A. Thaliana Tas3a.(AT3G17185),TAS3b(AT5G49615),TAS3c(At5g57735),烟草(FJ804751 FJ804743),烟草benthamiana(FJ804742),达尔氏藻藻(FJ804744)。一棵连接邻居的树是为TAS3.使用MEGA4进行组评估和1000个引导复制的转录本[61].
RNA提取和RNA印迹杂交
按照Molnar et al.(2007)的方法进行RNA印迹杂交[62].提取的总RNA经DNase I (Fermentas;http://www.fermentas.com.)。采用苯酚-氯仿萃取法去除酶,乙醇沉淀法分离总RNA。采用BIORAD Mini-Protean 3 Cell体系(http://www.bio-rad.com).40 μg总RNA用等量的2倍凝胶装载染料变性(Fermentas, http:/http://www.fermentas.de)在65℃下5分钟。将变性的RNA样品加载到Prerun 15%变性聚丙烯酰胺凝胶中,在50 V.A Zr小RNATM梯子(Zymo Research,http://www.zymorearch.com.)也装载。凝胶在150 V下运行,直到加载染料中的溴酚蓝到达凝胶的底部。接下来,凝胶中含有小RNA的部分(在溴酚蓝和二甲苯氰醇之间)被剪下来,并涂抹在尼龙膜上(Nytran Supercharge;http://www.whatman.com),通过毛细管湿转移过夜。将转移的RNA用1200 μJ紫外光(UV Stratalinker 2400, Stratagene;http://www.stratagene.com.).用5-10 mL的ULTRAhyb-Oligo杂交缓冲液(http://www.ambion.com.),在40°C下保存至少30分钟。额外的文件2)使用标记为32P与U4多核苷酸激酶(Fermentas;http://www.fermentas.com.).将反应混合物在37℃温育1小时。根据制造商的说明书(GE Healthcare,Cypers)使用MicroSpin G-25列分离未掺入的核苷酸。http://www.gelifesciences.com).标记探针与杂交液混合,在40℃下杂交至膜上过夜。用洗涤液(2xSSC, 0.1% SDS)在40℃下洗涤10分钟,用塑料保鲜膜包裹,磷暴露-成像板。
实时定量PCR (qPCR)和cDNA芯片
1 μg总RNA使用SuperScript®II逆转录酶按照制造商的协议进行逆转录(Invitrogen;http://www.invitrogen.com.).使用基因特异性引物使用SYBR绿色进行二十μgcDNA与SYBR绿色进行定量实时PCR(附加文件4和10)设计米尔和目标基因。伸长率因子(NaEF)作为参考管家基因进行分析。
为了将miRNA和TasiRNA的逆转录成cDNA,我们使用了MISCRICRY逆转录套件(QIAGEN;http://www.qiagen.com).取总RNA 10 μg进行qPCR(附加文件)5)用MISCRICTS SYBR Green PCR套件(QIAGEN;http://www.qiagen.com)来量化mirna和tasirna。所有qPCR数据采用2ΔΔCt计算方法进行分析[63].
我们使用cDNA微阵列NCBI GEO数据库(平台GPL13527,登录号GSE30287) [46].对于数据分析,原始数据被归一化到第75个百分位数并进行对数转换。比较大于2倍的变化采用Fisher 's PLSD检验后进行方差分析。
植物激素分析
如前所述,JA和JA- ile从叶子组织中共提取[64].来自对照和处理植物的一百至150毫克的薄层组织用于植物激素萃取,用1ml乙酸乙酯加入200 ng d2-ja和40 ng13C6-ja-ile作为内部标准。在varian 1200L Triple-Quadreapol-MS上分析十五μl上清液,用Prontosil柱(C18;5μm,50×2mm)。
统计分析
使用STATVIEW软件使用STATVIEW软件计算数据的单向分析ANOVA(通过最低标准偏差(LSD)比较)算法(SAS Institute Inc.,Cary,NC,USA)进行比较。
参考
- 1.
吴L,周H,张Q,张j,ni f,刘c,qi y:DNA甲基化由microRNA途径介导。Mol细胞。2010,38(3):465-475。10.1016 / j.molcel.2010.03.008。
- 2.
RNA干扰:甲基化之谜。自然资源学报。2005,33(4):472-473。10.1038 / 433472。
- 3.
Chellappan P, Xia J, Zhou X, Gao S, Zhang X, Coutino G, Vazquez F, Zhang W, Jin H: miRNA位点的sirna介导靶基因的DNA甲基化。中国生物医学工程学报,2010,38(20):6883-6894。10.1093 / nar / gkq590。
- 4.
Khraiwesh B,Arif Ma,Seumel Gi,Ossowski S,Weigel d,Reski R,Frank W:MicroRNA的基因表达转录控制。细胞。2010,140(1):111-122。10.1016 / J.Cell.2009.12.023。
- 5.
Bartel DP: microrna:基因组学、生物起源、机制和功能。acta photonica sinica, 2011, 40(3): 441 - 446。10.1016 / s0092 - 8674(04) 00045 - 5。
- 6.
Henderson IR,Zhang X,Lu C,Johnson L,Meyers BC,Green PJ,Jacobsen SE:将拟南芥拟南芥Dicer功能解剖到小RNA处理,基因沉默和DNA甲基化图案中。NAT Genet。2006,38(6):721-725。10.1038 / NG1804。
- 7。
Kurihara Y,Watanabe Y:拟南芥微RNA生物发生,通过Dicer样1蛋白质功能。美国国家科学院学报。2004,101(34):12753-12758。10.1073 / pnas.0403115101。
- 8。
植物小rna在生物胁迫反应中的作用。植物生态学报。2009,60:485-510。10.1146 / annurev.arplant.043008.092111。
- 9。
拟南芥(Arabidopsis thaliana) microrna的研究进展基因工程学报,2006,20(24):3407-3425。10.1101 / gad.1476406。
- 10.
谢Z,艾伦e,wilken a,carringtonjc:Dicer样4功能在丙族的小干扰RNA生物发生和拟南芥植物相变。美国国家科学院学报。2005,102(36):12984-12989。10.1073 / pnas.0506426102。
- 11.
Marin E, Jouannet V, Herz A, Lokerse AS, Weijers D, Vaucheret H, Nussaume L, Crespi MD, Maizel A: miR390,拟南芥的TAS3 tasiRNAs和它们的生长素响应因子靶标定义了一个定量调控侧根生长的自动调控网络。植物学报。2010,22(4):1104-1117。10.1105 / tpc.109.072553。
- 12.
陈XM:小RNA及其在植物开发中的作用。Annu Rev Cell Dev Bi。2009,25:21-44。10.1146 / annurev.cellbio.042308.113417。
- 13.
microrna调控拟南芥胚胎成熟的时间。植物营养与肥料学报。2011,32(4):441 - 446。10.1104 / pp.110.171355。
- 14.
Kidner CA, Martienssen RA:空间受限的microRNA通过ARGONAUTE1引导叶片极性。自然。2004,428(6978):81-84。10.1038 / nature02366。
- 15.
吴晓霞,王志刚,王志刚,王志刚:微rna对水稻叶片形态发生的调控作用。自然科学学报。2003,32(6):591 - 598。10.1038 / nature01958。
- 16.
Yang JH, Yang J, Yang J, Kim SH, Kim SK, Lee WS:生长素对拟南芥侧根发育的调控。中国生物医学工程学报,2010,38(4):1382-1391。10.1093 / nar / gkp1128。
- 17.
刘Q,陈YQ:洞察植物发展机制:植物途径与植物激素反应的相互作用。Biochem Biophys Res Communce。2009,384(1):1-5。10.1016 / J.BBRC.2009.04.028。
- 18。
Schommer C,Palatnik JF,Aggarwal P,Chetelat A,Cubas P,Farmer EE,Nath U,Weigel D:MiR319目标控制茉莉酸盐生物合成和衰老。Plos Biol。2008,6(9):E230-10.1371 / journal.pbio.0060230。
- 19。
acta optica sinica (acta optica sinica), 2010, 31(4): 537 - 541。植物学报。2003,15(11):2730-2741。10.1105 / tpc.016238。
- 20.
朱建平,朱建军:mirna和sirna在植物生物和非生物胁迫响应中的作用。生物化学学报。2012,1819(2):137-148。10.1016 / j.bbagrm.2011.05.001。
- 21.
Kulcheski FR, de Oliveira LF, Molina LG, Almerao MP, Rodrigues FA, Marcolino J, Barbosa JF, Stolf-Moreira R, Nepomuceno AL, Marcelino-Guimaraes FC,等:参与非生物和生物胁迫的新型大豆microrna的鉴定。基因组学杂志。2011,12:307-10.1186/1471-2164-12-307。
- 22.
关键词:小麦,白粉病,热胁迫,小分子分子,微rna植物生态学报。2010,30(6):591 - 598。
- 23.
周玲,刘玉玲,刘志,孔东,段敏,罗玲:水稻干旱响应microrna的全基因组鉴定与分析。生物医学工程学报,2010,31(5):457 - 461。10.1093 / jxb / erq237。
- 24.
周X,王G,张W:拟南芥抗核心浓度响应MicroRNA基因。MOL SYST BIOL。2007,3:103-
- 25.
Chiou Tj,Aung K,Lin Si,Wu cc,Chiang Sf,Su Cl:MicroRNA在拟南芥中调节磷酸盐稳态。植物细胞。2006,18(2):412-421。10.1105 / TPC.105.038943。
- 26.
在拟南芥种子萌发过程中,miR159的ABA诱导控制两个MYB因子的转录水平。植物学报,2007,49(4):592-606。10.1111 / j.1365 - 313 x.2006.02980.x。
- 27.
植物microrna及其靶点的计算鉴定,包括胁迫诱导的miRNA。acta photonica sinica, 2004, 40(6): 489 - 494。10.1016 / j.molcel.2004.05.027。
- 28.
唐松,王勇,李志,桂艳,肖波,谢军,朱庆华,范丽:烟草(nictiana tabacum)伤顶反应小rna的鉴定。植物学报。2012,32(1):1- 4。
- 29.
张伟,高森,周旭,Chellappan P, Chen Z, Zhang X, Fromuth N, Coutino G, Coffey M, Jin H:细菌应答microrna通过调节植物激素网络调控植物天然免疫。acta botanica sinica(云南植物学报),2011,32(1):1 - 5。
- 30.
Navarro L,Jay F,Nomura K,He Sy,Voinnet O:细菌效应蛋白抑制MicroRNA途径。科学。2008,321(5891):964-967。10.1126 / Science.1159505。
- 31.
Kasschau KD,谢Z,艾伦e,llave c,查普曼Ej,Krizan Ka,Carrington JC:P1 / HC-Pro,RNA沉默的病毒抑制器,干扰了拟南芥开发和MiRNA功能。DEV细胞。2003,4(2):205-217。10.1016 / s1534-5807(03)00025-x。
- 32.
Li H, Deng Y, Wu T, Subramanian S, Yu O: miR482, miR1512和miR1515的错误表达增加了大豆结瘤。植物营养与肥料学报。2010,29(4):527 - 534。10.1104 / pp.110.156950。
- 33.
Schwachtje J,Baldwin It:为什么草食攻击重新配置初级新陈代谢?植物理性。2008,146(3):845-851。10.1104 / pp.107.112490。
- 34.
Kessler A,Baldwin It:草食病诱导的植物疫苗接种。第I部分。植物防御的康策与野生烟草尼古塔纳·塔比塔的健身后果。工厂J. 2004,38(4):639-649。10.1111 / J.1365-313x.2004.02076.x。
- 35.
康JH,Wang L,Giri A,Baldwin It:沉默的苏氨酸脱氨酶和Jar4在尼古利亚纳睾丸损害茉莉酸 - 异亮氨酸介导的防治抗ManducaSexta。植物细胞。2006,18(11):3303-3320。10.1105 / TPC.106.041103。
- 36.
Halitschke R,Schittko U,Pohnert G,Boland W,Baldwin IT:专业草食病曼丘菌(Lepidoptera,Sphingidae)和其天然宿主尼古拉睾丸之间的分子相互作用。III。脂肪酸 - 氨基酸缀合物在草食物口腔分泌物中是必需的,并且足以用于食草草特异性植物反应。植物理性。2001,125(2):711-717。10.1104 / pp.125.2.711。
- 37.
BONAVENTURE G,Vandoorn A,Baldwin IT:食草动物相关的Elicitors:FAC信号和新陈代谢。趋势植物SCI。2011,16(6):294-299。10.1016 / j.tplants.2011.01.006。
- 38.
草食性和毛虫反刍物会增加樟子叶烟草中茉莉酸的伤害,但不会增加尼古丁的伤害。植物学报。1997,203(4):430-435。10.1007 / s004250050210。
- 39.
通过沉默过氧化氢裂解酶和氧化烯合成酶揭示烟草中底物和防御信号的串扰。植物学报,2004,40(1):35-46。10.1111 / j.1365 - 313 x.2004.02185.x。
- 40。
Kallenbach M,Alagna F,Baldwin It,Bonaventure G:尼古纳睾丸SIPK,WIPK,NPR1和脂肪酸 - 氨基酸缀合物通过影响途径中的早期酶促步骤来参与茉莉酸生物合成的诱导。植物理性。2010,152(1):96-106。10.1104 / pp.109.149013。
- 41。
NaCOI1介导了草食动物诱导的烟草抗性,揭示了草食动物运动在规避防御中的作用。植物学报,2007,51(1):79-91。10.1111 / j.1365 - 313 x.2007.03119.x。
- 42。
草食对烟草小rna转录组和植物激素信号转导的影响。美国国家科学院学报。2008, 105(12): 4559-4564。10.1073 / pnas.0711363105。
- 43.
Liu Y Y, Gao Q, Wu B, Ai T, Guo X: NgRDR1, RNA依赖RNA聚合酶,参与生物和非生物胁迫。植物生理与生物化学。2009,47(5):359-368。10.1016 / j.plaphy.2008.12.017。
- 44.
Pandey SP, Baldwin IT: RNA-directed RNA polymerase 1 (RdR1)介导了自然界中烟草对草食动物攻击的抗性。植物学报,2007,50(1):40-53。10.1111 / j.1365 - 313 x.2007.03030.x。
- 45.
关键词:烟草,DICER-like蛋白,植物-草食动物相互作用acta botanica sinica(云南植物学报),2012,54(3):189-206。10.1111 / j.1744-7909.2012.01104.x。
- 46.
Kim SG,Yon F,Gaurle E,Gulti J,Baldwin It:在原生烟草中的食草动物攻击过程中代谢物的组织特异性昼夜节律及其调节,Nicotiana Attenuata。Plos一个。2011,6(10):E26214-10.1371 / journal.pone.0026214。
- 47.
叶蝉以茉莉酸盐依赖的方式攻击野生烟草植株,并在自然种群中鉴定茉莉酸盐突变体。美国国家科学院学报。acta photonica sinica, 2012, 109(24): 1548-1557。10.1073 / pnas.1200363109。
- 48.
梁超,张旭,邹军,徐东,苏飞,叶宁:条斑紫菜miRNA的高通量测序和生物信息学分析。公共科学图书馆。2010,5 (5):e10698-10.1371/journal. pon.0010698。
- 49.
谢芳,张志强,张志强:烟草microrna及其靶基因的鉴定与表达分析。植物学报。2010,232(6):1289-1308。10.1007 / s00425 - 010 - 1255 - 1。
- 50。
Allen E,谢Z,Gustafson Am,Carrington JC:MicroRNA-在植物中的转发siRNA生物发生过程中定向相位。细胞。2005,121(2):207-221。10.1016 / J.Cell.2005.04.004。
- 51。
沈东,王胜,陈辉,朱庆华,何立伟,范丽娟:mir390引导的反式作用siRNA基因(TAS3)在草科植物中的系统发育。acta botanica sinica(云南植物研究),2009,28(1):1 - 5。
- 52。
Adenot X, Elmayan T, Lauressergues D, Boutet S, Bouche N, Gasciolli V, Vaucheret H: drb4依赖的TAS3反式sirna通过AGO7控制叶片形态。中国生物医学工程学报,2006,16(9):927-932。10.1016 / j.cub.2006.03.035。
- 53。
Kim JH, Woo HR, Kim J, Lim PO, Lee IC, Choi SH, Hwang D, Nam HG:拟南芥中涉及miR164的年龄依赖性细胞死亡的三叉前导调控。中国科学:地球科学。10.1126 / science.1166386。
- 54.
Schwachtje J,Minchin Pe,Jahnke S,Van Dongen JT,Schittko U,Baldwin IT:SNF1相关的激酶让植物通过分配碳来耐受食草。美国国家科学院学报。2006,103(34):12935-12940。10.1073 / PNAS.0602316103。
- 55.
反义LOX表达通过降低防御反应和抑制烟草生长相关转录重组提高草食动物的表现。植物学报,2003,36(6):794-807。10.1046 / j.1365 - 313 x.2003.01921.x。
- 56.
Luo QJ, Mittal A, Jia F, Rock CD:拟南芥对糖的响应中涉及PAP1和TAS4的自调节反馈环。植物学报,2012,40(1):116 - 119。10.1007 / s11103 - 011 - 9778 - 9。
- 57.
Kaur H, Heinzel N, Schottner M, Baldwin IT, Galis I: R2R3-NaMYB8调节苯丙酸-多胺结合物的积累,这是烟草对昆虫食草动物的局部和系统防御的关键。植物营养与肥料学报。2010,29(3):441 - 446。10.1104 / pp.109.151738。
- 58.
Onkokesung N,Gaurle E,Kotkar H,Kaur H,Baldwin It,Galis I:MyB8通过激活三种新的羟基氨基酰氨基 - 辅酶A:多胺转移酶在Nicotiana Attenuata中进行控制。植物理性。2012,158(1):389-407。10.1104 / pp.111.187229。
- 59.
Schwab R,Voinnet O:miRNA处理颠倒了。Embo J. 2009,28(23):3633-3634。10.1038 / emboj.2009.334。
- 60.
Steffen P, Voss B, Rehmsmeier M, Reeder J, Giegerich R:基于抽象形状的整合RNA分析包。生物信息学。2006,22(4):500-503。10.1093 /生物信息学/ btk010。
- 61.
Tamura K,Dudley J,Nei M,Kumar S:Mega4:分子进化遗传学分析(Mega)软件版本4.0。mol Biol Evol。2007,24(8):1596-1599。10.1093 / molbev / msm092。
- 62。
Molnar A, Schwach F, Studholme DJ, Thuenemann EC, Baulcombe DC: miRNAs控制莱茵衣藻单细胞藻类的基因表达。自然科学学报。2007,44(4):591 - 598。10.1038 / nature05903。
- 63。
bbubner B, Gase K, Baldwin IT:双重差异是实时PCR测定转基因植物拷贝数的检测限。生物技术学报。2004,4:14-10.1186/1472-6750-4-14。
- 64。
独立沉默两名JAR家族成员会降低胰蛋白酶蛋白酶抑制剂的水平,但不会降低尼古丁的水平。植物学报。2007,226(1):159-167。10.1007 / s00425 - 007 - 0477 - 3。
致谢
我们感谢TamaraKrügel博士和园艺员工为成长和维护植物,Meredith C. Schuman博士进行语言编辑,以及最大的普朗克资助社会。
作者信息
从属关系
相应的作者
附加信息
相互竞争的利益
作者声明他们没有竞争利益.
作者的贡献
TAB进行了实验工作并对数据进行了分析。TAB, ITB, SGK参与了研究的设计。ITB和SGK构思了这项研究并编辑了手稿。TAB起草了手稿。所有作者阅读并批准了最终的手稿。
电子补充材料
中鉴定的mirna的茎环结构
额外的文件1:N.Attenuata。(TIFF 198 KB)
玫瑰花叶中几个miRNA的累积
额外的文件3:N.attenuata则.进行RNA印迹杂交,以检查MIRNA在玫瑰花叶中的累积N.attenuata则.溴化乙锭染色rRNA显示为负荷对照。(TIFF 95 KB)
MiRNA靶基因的转录物丰度。
附加文件8:W+W和W+OS处理后miRNA靶点的丰度。对每个样本,32日龄的WT植株莲座上的一片叶子不处理(对照)或用伤加水(W+W)或伤加OS (W+OS)处理,并在处理1小时或5小时后收获。显示的是平均(±SE)水平的三个重复每行。字母表示显著差异(P< 0.05)。(TIFF 755 KB)
12870 _2012_1133_moesm9_esm.tiff
附加文件9:诱导后ir-aoc植物中的JA和JA- ile水平受损。在W+W和W+OS处理下,茉莉酸(JA)和茉莉酰异亮氨酸(JA- ile)的积累量增加,而在ir-aoc处理下,茉莉酸和茉莉酰异亮氨酸(JA- ile)的积累量显著降低。对于每个样本,对32日龄植株莲座上的一片叶子进行处理,并在处理1小时或5小时后收获。未经处理的植物作为对照。星号表示Fisher ' s PLSD检验方差分析后的显著差异(***,P < 0.001)。(TIFF 900 KB)
显示W + W和W + OS在野生型和IR的叶片中的原发性miRNA转录物累积的QPCR数据
额外的文件10:AOC。以32日龄植株莲座叶片为材料,分别用伤加水(W+W)或伤加OS (W+OS)处理,处理1 h或5 h后采收。未经处理的植物作为对照(CTRL)。显示的是三个重复的平均值(±SE)水平。字母表示显著差异(P< 0.05)。(TIFF 1 MB)
MiRNA的时间课程表达及其在W + W和W + OS处理的叶片中的目标。(一种)
附加文件11:qPCR数据显示成熟mirna的丰度。(B)显示MiRNA目标累积的微阵列数据。对每个样本,32日龄的WT植株莲座上的一片叶子不处理(对照)或用伤加水(W+W)或伤加OS (W+OS)处理,并在处理1小时或5小时后收获。显示的是平均(±SE)水平的三个重复每行。小写字母(W + OS)和斜体字母(W + W)表示显着差异(P< 0.05)。(TIFF 6 MB)
微阵列数据显示,在W+W和W+OS处理的黄叶中,初级mirna的积累
额外的文件12:n attenuata则.W+W和W+OS处理后mirna和tasirna靶基因的标准化转录丰度均值(±SE)水平。未经处理的植物作为对照(CTRL)。微阵列数据中的信号强度使用75th百分位数和log2变换。字母表示显著差异(P< 0.05)。(TIFF 1 MB)
作者为图像提交的原始文件
权利和权限
开放获取本文在“生物资源”中央有限公司的许可下公布了这是一个开放式访问条款,分配根据创意公约归因许可证的条款(https://creativecommons.org/licenses/by/2.0.),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
Bozorov,T.A.,Baldwin,即。&Kim,SG。MiRNA在草卵期鉴定和分析揭示了茉满面依赖性和依赖性的积累模式烟草attenuata则.BMC植物杂志12,209(2012)。https://doi.org/10.1186/1471-2229-12-209
收到了:
接受:
发表:
关键字
- Anti-herbivore国防
- Jasmonate
- manduca sexta.
- microrna的
- 烟草attenuata则
- TasiRNA