摘要
背景
同源域转录因子在后生动物发育中起着关键作用。有缘(BLR),是一种转录因子,参与了不同的发育过程拟南芥作用于维管分化、叶根分化、花和果的发育。BLR在分生组织维持中也有多余的作用。细胞壁重塑是这些过程的基础BLR最近被证明能调节果胶甲基酯酶5 (pme5),一种细胞壁修饰酶,控制叶根结构。我们进一步探讨了的作用BLR在植物发育中通过分析表型和基因表达在一系列植物中过度表达BLR,生成组合突变体blr,brevipedicellus(英国石油公司),是KNOX1转录因子家族之前已经被证明与之相互作用blr,和同源域转录因子revoluta(牧师),用于阀杆的径向图案。
结果
过表达BLR的植株表现出广泛的表型。一些细胞大小有缺陷,并表现出主要影响细胞壁发育的基因调控不当。其他表型更为极端的品系未能产生侧器官,这与BLR抑制茎尖转录一致。细胞壁动力学也受到影响blr突变植物,以及BLR在此之前已被证明与英国石油公司.我们发现当英国石油公司而且blr与牧师,观察到一组不同于的缺陷bp blr行。在这些三突变体中,木质部发育受到最显著的影响,导致几乎完全缺乏血管和次生增厚的木质部薄壁组织。
结论
我们的数据支持一个角色BLR在茎尖的顺序上,与英国石油公司而且牧师,在决定血管系统的组成和组织中起作用的微阵列分析有力地表明,显着的血管表型bp转速三突变体和植物过表达BLR野生型植物中BLR的目标基因决定了发育中的脉管系统的细胞大小和结构。
背景
有缘(BLR),亦称为VAAMANA,小精明,拉尔森而且REPLUMLESS,的成员吗贝尔同源域转录因子家族及其在不同发育过程中的作用拟南芥[1- - - - - -5].BLR被独立鉴定为花同源基因的抑制因子无性生殖的(AG)) [5],作为果实发育所需的因素,以规范果实的规格[1]而作为正常的叶序排列模式所必需的基因[2,4].BELL转录因子可增强玉米KNOTTED1的DNA结合[6],是联合国的创始成员KNOX1基因家族[7),而BLR随后被证明与KNOX1同源域转录因子BREVIPEDICELLUS(英国石油公司) [3.].BLR和KNOX1蛋白异二聚体[3.]和,在烟草在表皮细胞瞬态分析中,BLR与KNOX1蛋白结合后转移到细胞核[2].这一事件很可能在真核生物发育的早期进化,因为它是绿藻单倍体-二倍体转变所必需的衣藻[8].
虽然表达模式BLR而且KNOX1重叠,它们不完全相同3.),blr而且knox1突变体表现出独特的表型,这表明BLR功能不太可能局限于单独与KNOX1蛋白作用。然而,相似之处是显而易见的,比如两人都身材矮小blr而且英国石油公司植物(2- - - - - -4和…的能力blr而且英国石油公司增强…的弱等位基因拍摄meristemless(扫描隧道显微镜) [2,4),一个KNOX1茎尖分生组织维持所需基因[9,10],指向一个冗余的角色BLR而且英国石油公司在干细胞命运建立中[2- - - - - -4].遗传相互作用的报告blr而且英国石油公司然而,突变体一直与矮个子表型相冲突bp blr双突变被多种解释为加性[4],协同的[3.],或novel -因为在单个突变体中观察到花序伸长,而在双[2].之间的表型差异blr而且英国石油公司突变体不太可能是由家族成员之间的冗余产生的,因为家族内部有多个敲除线KNOX1而且贝尔家族表现出不同的表型。例如,当观察到营养性向生殖性转变缺陷时blr突变体与突变体结合poundfoolish(pnf)的基因BLR最相似的是拟南芥[11],而不是在多重中观察到的knox1突变体(12,13].同样,多个knox1变种人不像blr植物作为一个角色英国石油公司是对KNAT2而且KNAT6[12].BLR那么函数是否可能既依赖于又独立于KNOX1.
一个KNOX1的独立函数BLR可能包括对叶状结构的控制,因为在knox1突变体。正常的层状分化需要正确的细胞分裂模式[14,15]而这又依赖于严格调控的细胞壁重塑事件[16]由机械约束所驱动[17].原基的生长伴随着细胞壁中果胶多糖的去甲基酯化,以及通过改变蛋白的表达水平来扰乱分生组织中果胶的甲基酯化状态果胶甲基酯酶已被证明会改变叶序排列模式[18].PME5被证明是负调控的BLR在分生组织中,这种相互作用对于维持叶状结构至关重要,因为器官起始的不正确定位blr突变体被抑制在blr pme5双突变体。之间的关系BLR而且PME5似乎是特定于上下文的BLR促进PME5节点间表达[19].
的功能英国石油公司而且BLR血管发育重叠。通常在拟南芥茎、维管束呈放射状排列,木质部位于茎的中心,韧皮部位于茎的外侧,木质部、维管分生组织(原形成层)和韧皮部沿茎的中外侧轴分布[20.].木质部的特点是存在用于水运输的大血管和较小的木质部纤维,两者都有次级细胞壁,相邻的原形成层形成一个分裂细胞的弧线。在茎内,维管组织代表了一个发育序列,最近形成的组织在顶部,最古老的组织在底部[20.].一个连续的维管环已描述blr系中,表型增强bp blr双突变体[3.]由于未发育的维管束的出现[3.含有细胞,以前只观察到出现在覆盖在一些维管束上的小而孤立的条带中英国石油公司植物(21,22].
在这里,我们利用转基因植物过表达BLR作为一种工具,以确定推定下游目标的转录因子。除前面所述的目标外BLR,PME5[19],我们的微阵列分析已经确定了许多编码细胞壁相关蛋白的其他基因的调控错误BLR过表达。细胞壁代谢缺陷可影响细胞大小[23因此我们进行了检查blr突变的维管组织,其中细胞大小缺陷先前已被描述[3.].我们发现了一种基因相互作用blr,英国石油公司而且revoluta(牧师),一种HD-ZipIII家族的同源域转录因子,先前已被证明可以指定茎中的近轴特征和径向模式[24]和木质部分化[25].我们的研究结果进一步支持了[19除了调节茎尖的基因外,BLR通过控制细胞外基质在发育中发挥更广泛的作用。
结果与讨论
表达的有缘减少器官大小
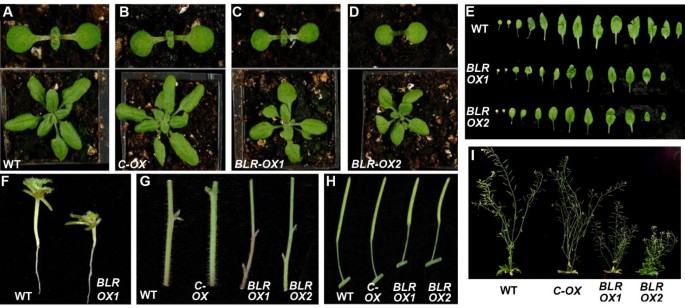
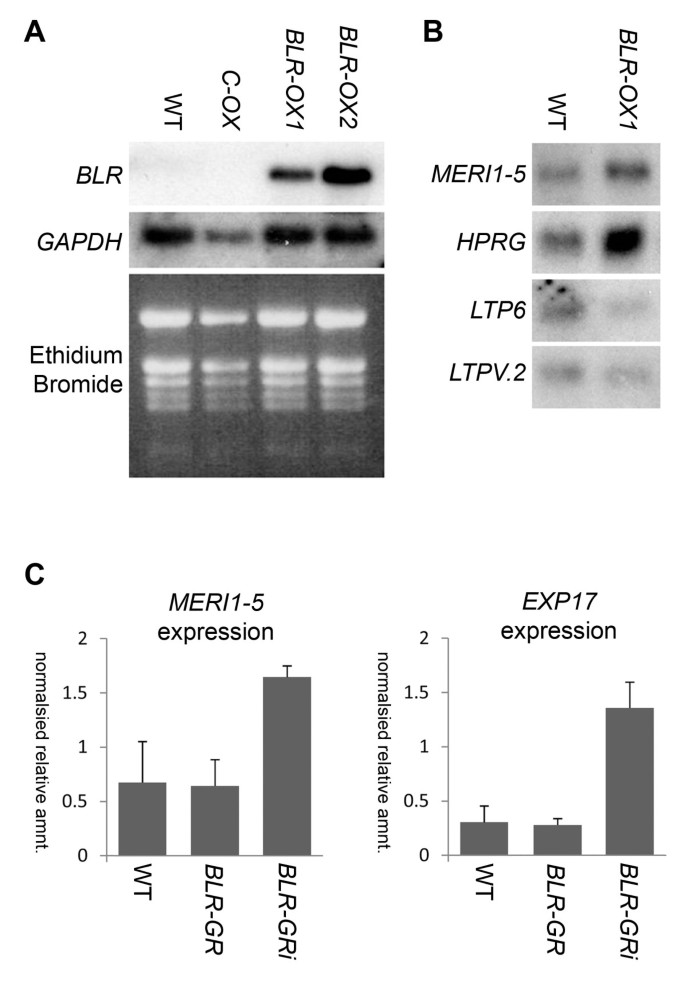
过表达研究已在功能分析中提供了信息KNOX1[26- - - - - -28].使用类似的策略,BLR利用cDNA进行生成35 s:: BLR从中构造BLR过表达(BLR-OX)获得转基因株系。植株下胚轴短,莲座丛叶小,茎生叶窄,角果短(图11 f,1 h).BLR-OX植物的茎也比野生型更短,更细,腋毛分枝更多(图1克,1我).Northern blot分析显示8个系呈增高BLR水平;BLR其中两条线的转录水平,BLR-OX1而且BLR-OX2,如图所示2.
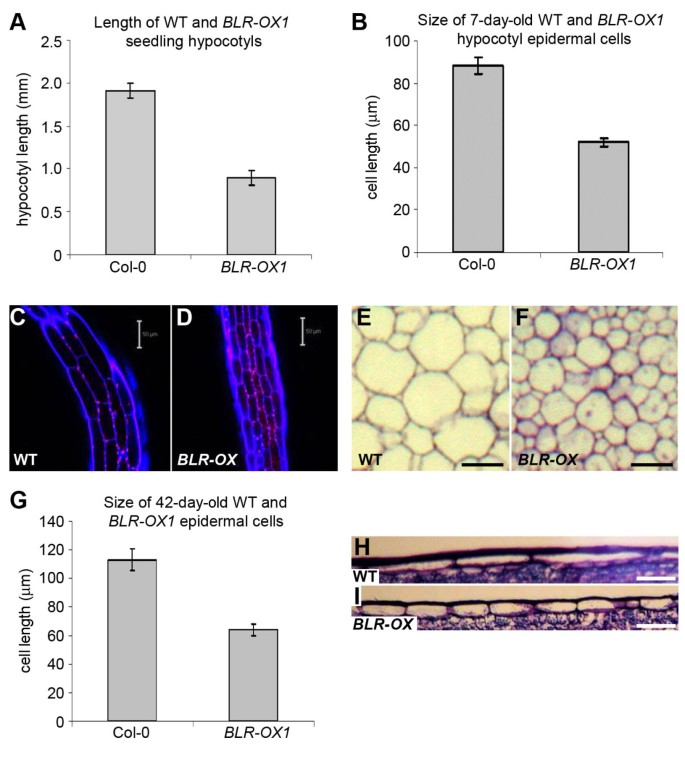
器官BLR-OX品系比野生型小,因此研究了7天的表皮下胚轴细胞大小和数量的差异BLR-OX和野生型植物(图3- d)。BLR-OX表皮细胞明显短于对照组(图3 b);在花序茎表皮的纵向切片上也观察到类似的减少(图3 g-I)和髓实质横切面(图3 e- f)。因此,细胞大小的减小很可能导致器官的尺寸更小BLR-OX植物。其他组织学特征,包括维管束组织与野生型难以区分。
表达变化BLR-OX植物
探索转录的变化BLR-OX表型,下胚轴转录本BLR-OX对照植物在1.01阶段进行微阵列分析[29发展。使用“微阵列显著性分析”策略[30.], 3109个基因表现出一致的表达变化和可接受的位点置信度,其中2957个基因具有合适的q值(<0.1%)。927个基因显示>表达改变1.5倍(附加文件1:表S1)。有三种证据指向反映基因表达变化的微阵列数据在足底;首先,BLR上调了3.6倍BLR-OX与Col-0相比(表1).第二,表达PME5,之前被证明是由BLR减少了2.3倍(表1)第三,100个显示最大折叠变化的基因中的70个启动子携带预测BLR共识DNA结合位点(表1).相比之下,与BLR一样,ATHB2的DNA结合序列具有9个碱基对一致序列,只出现在100个启动子区域中的9个。的表达式对数组数据进行了验证MERI-5(At4g30270;4.3倍的增长BLR-OX),这是一种木葡聚糖内转葡萄糖酶,可以水解糖基键,HPRG(At5g65660;增加1.6倍),富含羟脯氨酸的质膜定位糖蛋白,以及LPT6(At3g08770;减少1.9倍)和LTPV.2(At3g53980;通过northern blot,两者都编码了内膜定位的脂质结合/转运蛋白(图2 b).在所有实例中,表达式都反映了数组数据。
为了更好地理解转录差异的意义BLR-OX与对照植物相比,进行了基因个体发生(GO)分析。引人注目的是,唯一显著的变化被证明是细胞壁相关基因的表达,从对照组的1.3%富集到组的6.8%BLR-OX行(表1)指出BLR在调节细胞壁代谢或组织方面的作用。细胞大小的变化有规律地伴随着细胞壁相关基因的表达变化,GO分析因此汇集了功能获得表型(图1,3.)和数组数据(表1).脂质转移蛋白[31]和过氧化物酶[32]使细胞壁松动,诱导细胞扩张;因此,表达减少了6倍LTP过氧化物表达减少了2.5倍BLR-OX植物(表1),与观察到的细胞尺寸减小相一致BLR-OX行。PME5,哪个是负调控的BLR(2.3倍下调BLR-OX),改变细胞壁的胶凝特性[33],而其他表达改变的基因则被同源性暗示在细胞扩张中起作用。例如,thaumatin家族成员(下调2.8倍)具有潜在的内do-β-1,3葡聚糖酶活性[34].
极端的BLR功能获得植物缺乏器官启动
有组织的叶状结构,缺乏blr突变体(2- - - - - -4]需要在器官发生过程中精确的细胞扩张和分裂[15],这些过程依赖于密切调控细胞壁的形成和扩张[16,18].因此,我们预计在BLR-OX细胞壁代谢改变引起的器官起始性中断,可以加强细胞系BLR-OX上述分析的系仅表现出相对较小的表达增加(3.6倍)。此外,在某些情况下,BLR定位在细胞质中,其核定位依赖于相互作用的伙伴[2,35].因此产生的植物表达了激素诱导的BLR以a的形式BLR-GR熔合由35 s CaMV该启动子将导致BLR以类固醇诱导的方式进行核定位,显示相互作用伙伴的独立性。证实细胞壁修饰酶的表达随之发生变化BLR-GR诱导与观察到的结果一致BLR-OX对株系、植物进行地塞米松(dex)诱导72小时,因为该系统中直接转录靶点的最大活性已被证明发生在64至128小时之间[36].dex归纳后,两者的表达式MERI-5而且EXP17升高(图2摄氏度),例如BLR-OX行(表1)提供了进一步的证据BLR细胞外基质的调节。
当BLR-GR种子在10 μm dex上萌发,14 d后仅见子叶4),这表明细胞核中BLR的高水平会导致极其有限的生长。这一观察结果可能解释了BLR表达BLR-OX因为较高表达水平的植株可能在T1代中无法恢复。在无类固醇的条件下,幼苗发芽3天,随后转移到10 μm dex (BLR- - - - - -GR我),产生的叶片膨胀严重减少(图4 b- e)。21天后不再出现可见叶片,顶点增大(图4 f),表明在没有器官启动的情况下,生长仍在继续。通过这些放大切片切割BLR- - - - - -GR我顶端显示缺乏侧器官原基或任何其他明显分化的细胞类型(图4 g-H),表明高水平的核BLR导致各向异性生长。
器官发育正常拟南芥需要相互作用BLR镇压PME5在茎尖分生组织中[19],在器官原基形成过程中失去这种抑制[4].的损失PME5抑制已经被提出,以允许其他细胞壁修饰成分访问细胞壁。我们的结果支持这个假设,在我们的BLR-GR我植物,BLR会继续消极监管吗PME5随着器官启动的抑制,我们观察到。
器官的形成既需要细胞分裂的正确模式,也需要细胞分裂的正确模式[14,15]和严格调控的细胞壁重塑[16,18].细胞顶端分裂的组织已被证明依赖于机械压力[17],它们很可能受到细胞壁的影响[37].目前关于器官顶端起始阶段细胞壁重塑的模型认为,细胞壁组分的断裂和退火是由与微管的连接控制的,可能是通过调节纤维素-微纤维的长度[38].治疗拟南芥含有米扎林的顶端,可以解聚微管并阻止有序分裂,当与生长素信号中断结合时,会导致球根状顶端和外侧器官起始的丧失[39].细胞壁在细胞间化学和机械信号的传递中起着核心作用,据报道,向日葵顶端发育线索的定位对机械干预很敏感[17].我们的数据表明BLR调节编码细胞壁相关蛋白的基因表达,我们观察到植物强烈过表达BLR-GR我融合产生的球茎尖不能形成侧部器官,这与密切调控的细胞壁发育对茎尖侧部器官有序形成至关重要的观点是一致的。
牧师增强了bp blr表型
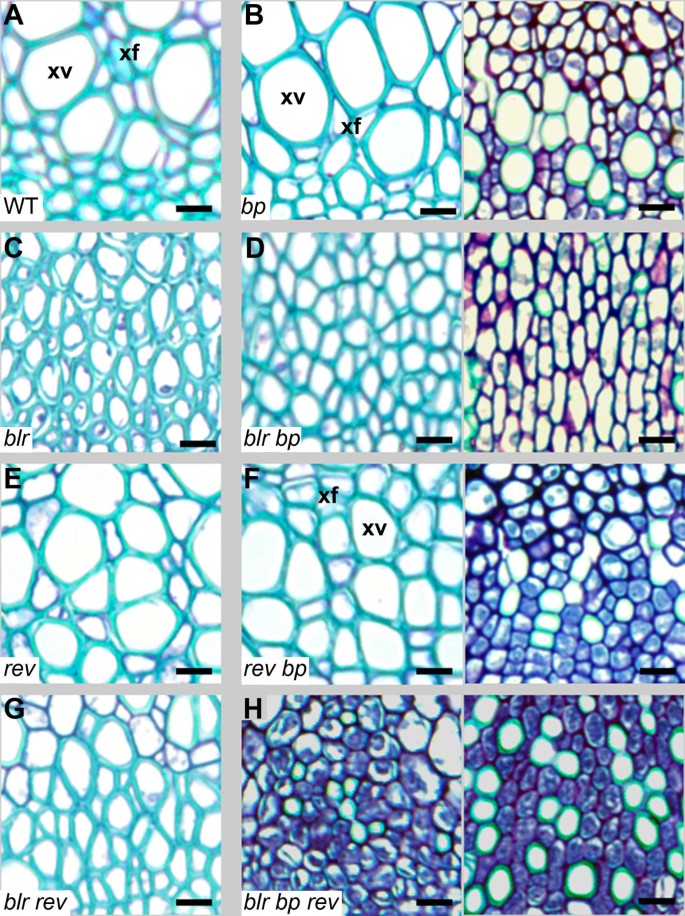
阵列实验确定了参与细胞扩张的基因在细胞中被错误调控BLR-OX植物。参与细胞扩张的基因表达变化也是异位的一个特征knox1(扫描隧道显微镜)在杨树茎维管组织中的表达[40],以及几个假定的BLR所指明的目标BLR-OX数组是相互调节的英国石油公司突变体(41)(表1).英国石油公司当分化缺陷的表皮细胞、皮层细胞和维管细胞存在于英国石油公司突变茎[22,42,43].此外,英国石油公司负调控木质素的生物合成[41,是一种细胞壁聚合物,存在于具有次生壁的细胞中,包括维管组织的次生壁。尽管进行了详尽的分析,blr野生型下胚轴被证明无法区分(未显示);然而,我们在花序茎的维管组织中看到了明显的差异BLR表示为[4].功能丧失blr表型在这一区域已被描述[3.]在茎顶部(第三和第四角果之间)相对新形成的维管组织中。在这里blr发现突变体形成一个连续的维管组织环,而bp blr双突变体表现为增强blr表型为连续维管环中的细胞不能分化,包含小而浓密的染色细胞,其中野生型植物中形成了具有次生细胞壁的木质部细胞[3.].
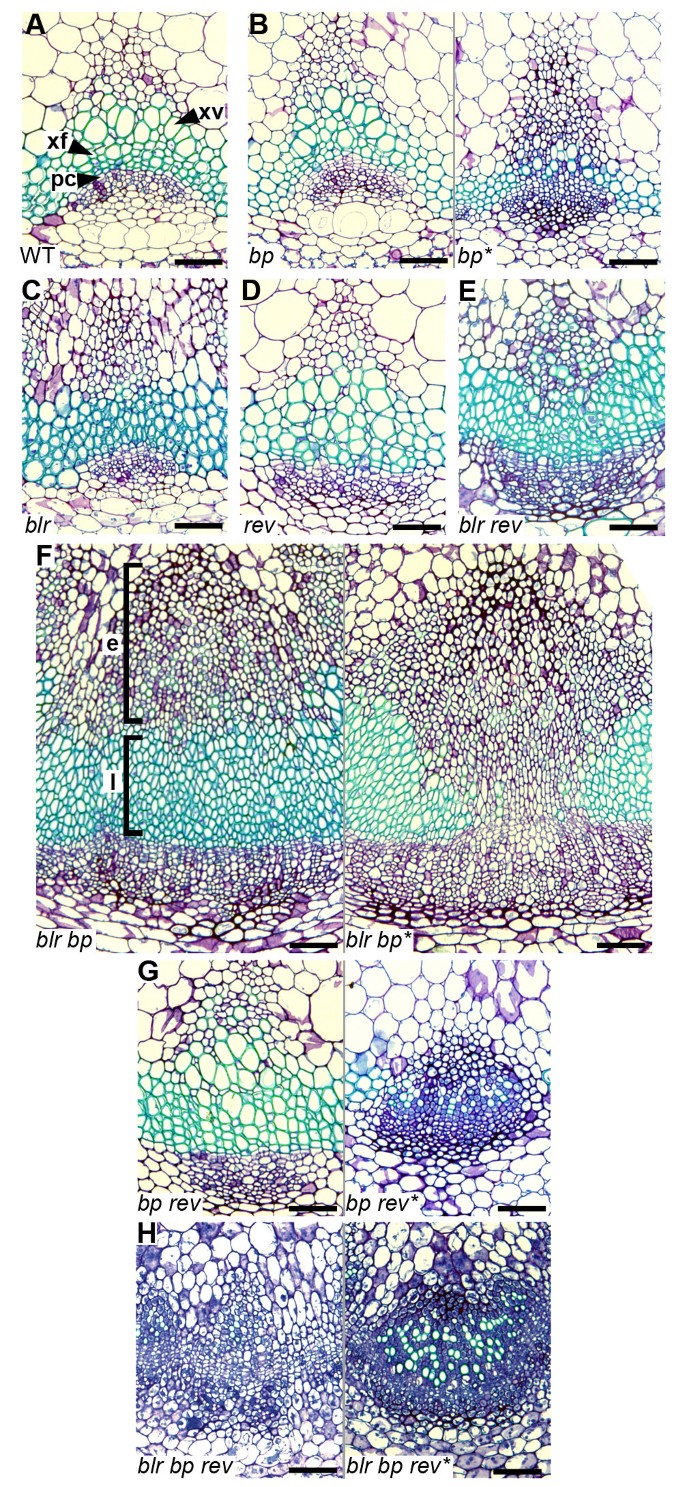
我们分析了发育后期的维管组织,靠近主花序茎上的第一个茎生叶。blr维管束的形态与野生型不同,野生型的原形成层细胞弧度较浅blr(图5C)。blr表型最强的突变体也有维管束,缺乏大的木质部血管,显然只包含木质部纤维,这表明要么是血管规格的失败,要么是血管细胞大小的缺陷(图6C).分化缺陷细胞的“条纹”覆盖在一些维管束上英国石油公司突变体产生了两种不同的血管形态(图5 b,6 b);在条纹内,木质部分化发生了改变blr突变体,木质部缺乏大血管,但与之相反blr突变体,许多较小的细胞没有产生次级细胞壁[22,42)(图6 b).在分化缺陷条纹以外的区域,血管模式与野生型难以区分(图5 b).
血管组织blr,英国石油公司而且牧师突变体的组合。邻近第一个茎生叶的花序茎维管组织的甲苯胺蓝染色切片。(一个野生型维管束,箭头指向木质部导管(xv)、木质部纤维(xf)和维管分生组织(原形成层;个人电脑)。(B)英国石油公司突变体与野生型没有区别,除了分化缺陷条纹(英国石油公司*),原形成层细胞弧线变平,木质部血管缺失或缩小,许多细胞小且染色深,表明它们缺乏次生壁(野生型木质部为绿色;一个).blr(C),blr牧师(E)原形成层圆弧变平,木质部血管缺失的维管组织。(D)牧师.(F大血管扩张blr英国石油公司.在发育早期的维管组织中(方括号;E)所有的细胞都很小,很多都没有次级壁。相比之下,后来的衍生组织(方括号;L)含有分化的xyary纤维,但没有血管,除了茎的分化缺陷区域(blr英国石油公司*),很少有次级壁细胞。(G)英国石油公司牧师双突变体是无法区分的牧师然而,在茎的大多数区域,在分化缺陷区域(英国石油公司牧师*)细胞比中观察到的小英国石油公司*。(H)位于bp转速花序茎非常小,在绝大多数情况下,次生壁缺失。鳞片为50 μm。
blr,英国石油公司而且牧师突变体木质部。木质部从维管束在花序茎。(一个野生型木质部,具导管(xv)和木质纤维(xf)。(B)英国石油公司突变型木质部与野生型木质部难以区分(左侧;LHS),除分化缺陷组织外(右侧;RHS),其中血管缺失或体积缩小,许多细胞缺乏次级壁(野生型木质部为绿色;一个).(C)极端blr木质部血管缺失的表型。(D)blr英国石油公司木质部在后来的衍生组织中(见图5 f),含有木质素纤维,但没有血管(LHS)。在茎的分化缺陷区(RHS)很少有二次壁细胞。(E)牧师木质部,与野生型相似。(F)英国石油公司牧师木质部就像木质部牧师(LHS)除分化缺陷区(RHS)的细胞比观察到的细胞小英国石油公司.(G)牧师blr木质部。(H)最bp转速木质部缺乏次生壁。鳞片为10 μm。
bp blr维管组织被描述为使人联想到存在分化缺陷的区域英国石油公司突变体(3.].在bp blr如Smith所描述的分化缺陷条带外的小的深色染色细胞et al。[3.],向茎的中心方向观察(图5 f)表明这些细胞来源于血管发育的早期。然而,发育后期产生的木质部细胞(最接近原形成层)发生了显著的分化bp blr双突变体,因为次级细胞壁存在,但与极端blr在突变体中,所有的木质部细胞都能联想到木质部纤维(图6 d).相反,我们观察到很少的木质部细胞有次生壁bp blr分化缺陷组织内的维管束与英国石油公司即使在发育的晚期也会发生突变(图5 f,6 d).因此,与其他报告一致[3.],blr增强了英国石油公司在维管组织的背景下,这种相互作用在成熟时尤其明显bp blr茎分化缺陷区域内的维管组织(图5- c,5 f,6- d)。我们对那个分析进行了推理英国石油公司而且blr在木质部身份改变的背景下的突变组合可能揭示出多余的功能英国石油公司而且blr.牧师与茎的径向图案有关[24]并且先前已被证明是束间纤维发育所必需的[25,44],用于木质部分化和维持木质部细胞数量[25].的作用牧师在木质部可能是部分冗余的表型出现增强牧师的phb/ +或牧师phv突变体(45].更进一步地在枝尖处,如英国石油公司[13),blr[2],牧师增强弱等位基因的表型扫描隧道显微镜[46暗示牧师可能有重叠的功能BLR.因此,我们检查了花序茎维管组织英国石油公司,blr而且牧师组合突变体。在牧师维管束、木质部组织与野生型相似,有血管和薄壁组织,但原形成层弧度较浅blr植物(图5 d),这种表型也发生在英国石油公司牧师变异的维管组织,分化缺陷组织外(图5克).在分化缺陷组织内,木质部细胞大体类似英国石油公司单个突变体除了相对较少的产生次生壁的细胞外,与其他突变体相比都极小英国石油公司(图6 f).blr牧师而且blr维管束是相似的,但引人注目的是,木质部的维管束bp转速三突变体由小而深染的木质部细胞组成,无论这些细胞束是否位于分化缺陷细胞的条纹内(图5 h,6克).在极端情况下,维管束中未见有次生壁的细胞(图5 h).
遗传相互作用BLR,牧师而且英国石油公司在茎的变化取决于组织类型。维管束之间的维管束细胞分裂是次生生长(径向扩张)的标志之一。英国石油公司而且BLR压抑这个过程bp blr突变体有一个连续的维管组织环[3.].然而,牧师似乎是血管组织大量增加所必需的bp blr因为Bp BLR转速线显示血管组织减少bp blr(图5 f, H).这一观察支持的作用牧师(相比之下英国石油公司而且BLR)促进次生生长,这一功能以前曾被认为是其杨树的同源植物[47].BLR,牧师而且英国石油公司在调节木质部分化中没有相反的作用。在双突变体和三突变体组合中,具有次生壁的木质部细胞的存在减少(图6)暗示BLR,牧师而且英国石油公司在这个过程中一起行动。因此,BLR,牧师而且英国石油公司交互依赖于上下文。
虽然主要缺陷是在BLR-OX是否有一种细胞大小减小,类似于在血管组织中观察到的blr突变组合,细胞大小和特定细胞壁修饰基因表达之间的关系并不总是直接的[48- - - - - -53].例如,E2Ff转录因子的过表达导致细胞大小减小,同时伴随膨胀素表达的减少(EXP3 7而且9),一种udp -葡萄糖-葡萄糖转移酶(UGT),MERI-5[52)(上调4.6折BLR-OX).然而,过度的表达MERI-5据其他地方报道,促进性早熟[54].BLR因此,细胞外基质的控制可能同样复杂。BLR-OX植物的细胞比野生的小,但是blr突变体,当与英国石油公司而且牧师也会导致维管组织细胞变小。
结论
控制细胞扩张对正常植物发育至关重要。我们的研究结果表明BLR控制细胞扩张和分化在血管发育过程中也涉及英国石油公司而且牧师转录因子。植物过表达的芯片分析BLR表明BLR针对许多参与细胞壁调节的基因。由于细胞壁的动态控制对细胞扩张至关重要,我们认为植物的显着表型是过度表达和过表达BLR可能是由于这个过程的中断。
密切调控的细胞壁动力学也是茎尖器官起始的正常模式所必需的,这一过程先前已被证明是由BLR镇压PME5[19].我们的实验BLR-GR提示进一步的转录靶点BLR也可能在这个过程中发挥重要作用。
方法
BLR超表达
全身的BLR将cDNA克隆到pGEM-T Easy (Promega)中,亚克隆为生态RI片段进入pART7 [55]并测序以鉴定质粒BLR在方向的意义上。结果CaMV35S::BLR::口服避孕药-终结者盒式磁带随后从pART7中使用不I和亚克隆到pMLBART。结果BLR-OX引入二元向量拟南芥(Col-0)使用标准方法[56].对于steroid-inducibleBLR扩增出两个PCR产物,其中一个含有BLRcDNA和第二个含有糖皮质激素受体(GR)。GR正向引物(AAAAAGCAGGCTTAATGACCACACTCAACATG)含有部分attB1位点,而反向引物(GCTCCACCTCCACCTCCATACTCATGG)含有一个Ala-Gly连接子和部分5 '位点BLR序列。同样,远期BLR引物(GGAGGTGGAGGTGGAGCATGGCTGATGCAT)含有Ala-Gly连接子,反向引物(AGAAAGCTGGGTTCAACCTACAAAATCATG)含有attB2位点。将两种PCR产物以等摩尔浓度混合,并作为模板与attB1和attB2引物进行重叠PCR,得到aBLR-GR帧内融合,克隆到pDONR Zeo,测序,利用Gateway技术亚克隆到pEarleyGate100。如上所述,生成了抗basta的Col-0转基因株系拟南芥在未诱导时具有野生型表型但对10 μ m地塞米松有反应的转化子被用于后续分析。
基因表达分析
在微阵列实验中,从Col-0和BLR-OX植物使用RNeasy植物迷你工具包(Qiagen)。在使用3DNA阵列900从2 μg总RNA合成cDNA之前,在2100 BioAnalyzer (Agilent, CA, USA)上检查RNA完整性TM试剂盒(Genisphere Inc.,哈特菲尔德,PA,美国),含有树枝状分子的rt -引物[57捕获序列。标记的cdna杂交16小时至拟南芥Atv3.3.2。用操作子打印的z数组拟南芥版本3 Array-Ready Oligo Set (Galbraith, USA)使用Slidebooster (Advalytix, Brunnthal, Germany),功率设置为27,脉冲设置为7:3。将载玻片分别在2× SSC、0.2% SDS (10 min, 55℃)、2× SSC (10 min,室温)和0.2× SSC (10 min,室温)中洗涤。荧光标记的Genisphere 3DNA树状大分子含有约850个Cy3或Cy5染料,与阵列杂交4小时。在如上所述的一系列清洗之后,使用ScanArray Express HT Microarray Scanner (Perkin Elmer)扫描阵列。
在校准以获得最佳动态范围内的扫描后,使用BlueFuse 3.1版(BlueGnome, Cambridge, UK)进行图像分析和斑点特征量化。在进一步分析之前,确认每张幻灯片的数据基本上是线性的和全局中值归一化的。当生物重复的综合置信值<0.005时,斑点被排除。微阵列数据在Cy5和Cy3通道中进行中位归一化。进一步分析了所有三个重复中表达方向相同的斑点。
归一化Cy5/Cy3日志2比率(三个值为每个基因BLR-OX(3条为Col-0)进行显著性分析[30.]使用TIGR多实验查看器(TMEV V3.0.3)。将imputer设置为10-nearest neighbour imputer,排列数为100。显著性分析中的delta值进行了调整,使显著性基因的估计错误发现率(FDR)为0%。表达倍数变化被设定为1.5作为潜在生物学重要性变化的阈值。这里描述的微阵列数据已提交给MIAMExpress (http://www.ebi.ac.uk/arrayexpress/experiments/E-MEXP-852).GO注释分析使用http://www.arabidopsis.org/tools/bulk/go/index.jsp.
对于主要转化子的北方印迹分析,从叶片组织中提取2微克总RNA,在1.2%甲醛琼脂糖凝胶上进行电泳,随后将其吸附在hybondnx膜上,并与全长的琼脂糖混合32pdctp标记的cDNA探针。RNA也通过溴化乙锭染色和滤镜混合可见GAPDH作为加载控件。微阵列靶标在6-7日龄幼苗的RNA上进行验证。引物用于扩增3”UTR和毗邻的外显子用于特定探针,它们是32PdCTP-labelled。
qRT-PCR分析使用SYBR Green JumpStart Taq ReadyMix (Sigma)和ABI Prism 7000机器(Applied Biosystems),采用标准SYBR绿色检测程序。每次实验结束时都要画出熔解曲线,以确保只形成单一产物。基因表达用比较阈值循环(Ct)方法确定。每个靶标的平均扩增效率采用LinReg [58],样本归一化为18 s rRNA(未显示)和ACT2(如图所示)。结果与对照组相似。样品在生物三份的技术三份上进行测量。
植物材料,生长条件和成像
植物在20°C的长时间条件下生长。突变体,blr(van-1) [2],rev-6[46),而bp-1[22,42],之前已经描述过。植物的数字图像分析接穗的形象(Scion Corporation, Maryland, USA)用于下胚轴测量。用于组织分析BLR-OX而且BLR-GR,植物被固定,蜡嵌入和切片使用标准的方法。6 - 10微米的切片用甲苯胺蓝染色用于光学显微镜。下胚轴表皮细胞用10 μg ml染色−1碘化丙啶(Molecular Probes Europe BV,荷兰)在黑暗中放置10分钟,然后转移到水中。用Zeiss (Welwyn, UK) CLSM 510共聚焦显微镜观察幼苗。
甲苯胺蓝染色树脂切片用于显示花序茎的横维管束切片取自5周龄植株。切片取自第一片茎生叶上方,并按[59].
作者的信息
Anuj M Bhatt和Hugh G Dickinson联合最后的作者。
参考文献
罗德华,王晓明,王晓明,等:拟南芥果实中REPLUMLESS同源结构域蛋白的研究进展。动物学报,2003,13(18):1630-1635。10.1016 / j.cub.2003.08.027。
Bhatt AM, Etchells JP, Canales C, Lagodienko A, Dickinson H: VAAMANA-a - bel1样同源结构域蛋白与KNOX蛋白BP和STM相互作用并调控拟南芥花序茎生长基因工程学报,2004,28(3):344 - 344。
Smith HMS, Hake S:两种同源盒基因BREVIPEDICELLUS和PENNYWISE的相互作用,调节拟南芥花序的节间模式。植物细胞学报,2003,15(8):1717-1727。10.1105 / tpc.012856。
Byrne ME, Groover AT, Fontana JR, Martienssen RA:拟南芥同源盒基因BELLRINGER决定了叶序分布模式和干细胞命运。发展,2003,130(17):3941-3950。10.1242 / dev.00620。
鲍晓霞,刘震,李文杰,刘震:BELLRINGER对花和花序分生组织AGAMOUS的抑制作用。植物细胞学报,2004,16(6):1478-1489。10.1105 / tpc.021147。
Smith HMS, Boschke I, Hake S:植物同源结构域蛋白选择性相互作用介导高dna结合亲和力。美国国家科学研究院。2002, 99(14): 9579-9584。10.1073 / pnas.092271599。
Vollbrecht E, Veit B, Sinha N, Hake S:发育基因knot -1是玉米同源盒基因家族的成员。自然科学学报,1997,35(4):344 - 344。10.1038 / 350241 a0。
李建华,林海华,周松,Goodenough U:同源蛋白异二聚体的早期性起源与植物KNOX/BELL家族的进化。光子学报,2008,33(5):829-840。10.1016 / j.cell.2008.04.028。
Barton MK, Poethig RS:拟南芥茎尖分生组织的形成:野生型和茎尖无分生突变体的发育分析。发展。1993,119(3):823-831。
Long JA, Moan EI, Medford JI, Barton MK:拟南芥STM基因编码的同源结构域蛋白KNOTTED类成员。自然科学学报,1996,27(6):344 - 344。10.1038 / 379066 a0。
Smith HMS, Campbell BC, Hake S:响应花诱导信号的能力需要同源盒基因。动物学报,2004,14(9):812-817。10.1016 / j.cub.2004.04.032。
Ragni L, Belles-Boix E, Gunl M, Pautot V:拟南芥花序中KNAT6和KNAT2与短花梗和PENNYWISE的相互作用。植物学报,2008,20(4):888-900。10.1105 / tpc.108.058230。
Byrne ME, Simorowski J, Martienssen RA:不对称LEAVES1揭示了拟南芥knox基因冗余。发展,2002,129(8):1957-1965。
Reddy GV, Heisler MG, Ehrhardt DW, Meyerowitz EM:拟南芥茎尖定向细胞分裂与形态发生的实时谱系分析中国科学进展。2004,31(4):344 - 344。10.1242 / dev.01261。
Hamant O, Heisler MG, Jonsson H, Krupinski P, Uyttewaal M, Bokov P, Corson F, Sahlin P, Boudaoud A, Meyerowitz EM,等:拟南芥机械信号的发育模式。科学通报,2008,29(4):344 - 344。10.1126 / science.1165594。
王志刚,王志刚,王志刚,王志刚。细胞壁蛋白扩张蛋白对叶片原基的诱导作用。科学通报,1997,27(4):344 - 344。10.1126 / science.276.5317.1415。
杨晓明,李志刚,李志刚:向日葵结构模式表达的转导分析。中国生物医学工程学报,1993,5(12):1725-1738。
Peaucelle A, Louvet R, Johansen JN, Höfte H, Laufs P, Pelloux J, Mouille G:拟南芥果胶甲基酯化状态对分叶性的控制。动物学报,2008,18(24):1943-1948。10.1016 / j.cub.2008.10.065。
Peaucelle A, Louvet R, Johansen JN, Salsac F, Morin H, Fournet F, Belcram K, Gillet F, Höfte H, Laufs P,等:转录因子BELLRINGER通过调节拟南芥中一种胶质甲基酯酶的表达来调节分叶性。发展,2011,138(21):4733-4741。10.1242 / dev.072496。
《血管发育:漫长而曲折的道路》。植物学报,2006,9(1):48-54。10.1016 / j.pbi.2005.11.008。
Cartwright HN, Humphries JA, Smith LG: PAN1:一种促进玉米非对称细胞分裂极化的受体样蛋白。科学通报,2009,29(4):344 - 344。10.1126 / science.1161686。
Douglas SJ, Chuck G, Dengler RE, perelecanda L, Riggs CD: KNAT1和ERECTA调控拟南芥花序结构。植物细胞学报,2002,14(3):547-558。10.1105 / tpc.010391。
植物细胞扩张-细胞壁机械特性的调控。植物化学学报,2004,26(3):366 - 366。10.1146 / annurev.arplant.35.1.585。
Emery JF, Floyd SK, Alvarez J, Eshed Y, Hawker NP, Izhaki A, Baum SF, Bowman JL:拟南芥HD-ZIP和KANADI III类基因的径向模式。动物学报,2003,13(20):1768-1774。10.1016 / j.cub.2003.09.035。
钟蓉,叶志华:拟南芥束间纤维分化调控基因IFL1编码同源结构域亮氨酸拉链蛋白。植物生理学报,1999,11(11):2139-2152。
Frugis G, Giannino D, Mele G, Nicolodi C, Chiappetta A, Bitonti MB, Innocenti AM, Dewitte W, Van Onckelen H, Mariotti D:莴苣中KNAT1的过表达使叶片的决定生长转变为与异戊烯基型细胞分裂素积累相关的笋状不确定生长。植物学报,2001,26(4):379 - 379。10.1104 / pp.126.4.1370。
李志刚,李志刚,李志刚,李志刚。拟南芥幼苗knox基因表达调控机制的研究。发展,2000,127(24):5523-5532。
Lincoln C, Long J, Yamaguchi J, Serikawa K, Hake S:拟南芥中一种knotted1样同源盒基因在营养分生组织中表达,并在转基因植物中过度表达后显著改变叶片形态。植物生理学报,2004,27(3):379 - 379。
Boyes DC, Zayed AM, Ascenzi R, McCaskill AJ, Hoffman NE, Davis KR, Gorlach J:基于生长阶段的拟南芥表型分析:植物高通量功能基因组学模型。植物学报,2001,13(7):1499-1510。
杜晓峰,朱国强,王晓明,王晓明:微阵列对电离辐射响应的显著性分析。美国国家科学研究院。2001, 98(9): 5116-5121。10.1073 / pnas.091062498。
倪文杰,李志刚,王志刚,王志刚,王志刚。烟草脂质转移蛋白对烟草细胞壁延长的影响。植物细胞学报,2005,17(7):2009-2019。10.1105 / tpc.105.032094。
帕萨迪F, Penel C, Dunand C:执行悖论:植物过氧化物酶如何修饰细胞壁。植物科学进展,2004,9(11):534-540。10.1016 / j.tplants.2004.09.002。
Imoto K, Yokoyama R, Nishitani K:拟南芥细胞壁修饰相关基因的综合方法。植物分子生物学,2005,58(2):177-192。10.1007 / s11103 - 005 - 5344 - 7。
Grenier J, Potvin C, Trudel J, Asselin A:一些thaumatin样蛋白水解聚合β-1,3-葡聚糖。植物学报,1999,19(4):473-480。10.1046 / j.1365 - 313 x.1999.00551.x。
Cole M, Nolte C, Werr W:转录因子SHOOT MERISTEMLESS的核导入依赖于与BLH蛋白的异二聚,BLH蛋白在拟南芥茎尖分生组织的离散子域表达。中国生物医学工程学报,2006,34(4):1281-1292。10.1093 / nar / gkl016。
Craft J, Samalova M, Baroux C, Townley H, Martinez A, Jepson I, Tsiantis M, Moore I:拟南芥糖皮质激素依赖性转基因表达的新pOp/LhG4载体。植物学报,2005,41(6):899-918。10.1111 / j.1365 - 313 x.2005.02342.x。
植物细胞壁中膜张力和结构方向。中国生物医学工程学报,2003,27(1):1 - 6。10.1002 / jcp.1030100110。
Wasteneys GO:理解植物细胞中微管作用的进展。植物学报,2004,7(6):651-660。10.1016 / j.pbi.2004.09.008。
柯森。F, Hamant O, Bohn S, Traas J, Boudaoud A, Couder Y:通过各向同性生长将植物组织转变为活细胞泡沫。美国国家科学研究院。2009, 106(21): 8453-8458。10.1073 / pnas.0812493106。
胡杨同源盒基因ARBORKNOX1的研究进展:杨树茎尖分生组织与维管形成层的重叠调控机制。植物分子生物学,2006,61(6):917-932。10.1007 / s11103 - 006 - 0059 - y。
Mele G, Ori N, Sato Y, Hake S: BREVIPEDICELLUS的knotted1样同源盒子基因通过调节代谢途径调控细胞分化。基因开发,2003,17(17):2088-2093。10.1101 / gad.1120003。
Venglat SP, Dumonceaux T, Rozwadowski K, Parnell L, Babic V, Keller W, Martienssen R, Selvaraj G, Datla R:同源箱基因BREVIPEDICELLUS是拟南芥花序结构的关键调控因子。美国国家科学研究院。2002, 99(7): 4730-4735。10.1073 / pnas.072626099。
Douglas SJ, Riggs CD:拟南芥花梗发育:维管定位的贡献及短花梗和勃起基因的作用。中国生物医学工程学报,2005,26(2):451- 453。10.1016 / j.ydbio.2005.06.011。
钟锐,叶志华,叶志华:拟南芥突变体束间纤维分化的中断。植物科学学报,1997,9(12):2159-2170。
Prigge MJ, Otsuga D, Alonso JM, Ecker JR, Drews GN, Clark SE: III类同源结构域-亮氨酸拉链基因家族成员在拟南芥发育中具有重叠、拮抗和独特的作用。植物细胞学报,2005,17(1):61-76。10.1105 / tpc.104.026161。
Otsuga D, DeGuzman B, Prigge MJ, Drews GN, Clark SE: REVOLUTA调节分生组织横向启动。植物学报,2001,25(3):344 - 344。10.1046 / j.1365 - 313 x.2001.00959.x。
罗伟雄,杜J,三浦E,杨3类HD ZIP, popREVOLUTA,影响木本茎形成层启动和模式。中国生物医学工程学报,2011,27(3):344 - 344。10.1104 / pp.110.167007。
郭晓明,王晓明,王晓明,王晓明,王晓明。油菜素内酯在植物发育过程中的作用。植物学报,1996,9(5):771 - 773。10.1046 / j.1365 - 313 x.1996.9050701.x。
Mizukami Y, Fischer RL:植物器官大小控制:AINTEGUMENTA在器官发生过程中调节生长和细胞数量。美国国家科学研究院。2000, 97(2): 942-947。10.1073 / pnas.97.2.942。
Kim G-T, Shoda K, Tsuge T, Cho K-H, Uchimiya H, Yokoyama R, Nishitani K, Tsukaya H:拟南芥的ANGUSTIFOLIA基因,一种植物CtBP基因,调节叶细胞扩张、叶细胞皮层微管排列和参与细胞壁形成的基因表达。环境科学学报,2002,21(6):1267-1279。10.1093 / emboj / 21.6.1267。
Vlieghe K, Vuylsteke M, Florquin K, Rombauts S, Maes S, Ormenese S, Van Hummelen P, Van de Peer Y, Inze D, de Veylder L:过表达e2fa - dpa植物的微阵列分析揭示了DNA复制和氮同化之间的互传遗传网络。中国生物医学工程学报,2003,26(3):344 - 344。10.1242 / jcs.00715。
Ramirez-Parra E, Lopez-Matas MA, Frundt C, Gutierrez C:非典型性E2F转录因子在拟南芥细胞生长和分化调控中的作用。植物学报,2004,16(9):2350-2363。10.1105 / tpc.104.023978。
Matsui K, Hiratsu K, Koyama T, Tanaka H, Ohme-Takagi M:一种嵌合AtMYB23抑制因子诱导拟南芥毛状根、叶茎伸长和抑制种皮粘液沉积植物生理学报,2005,46(1):147-155。10.1093 /卡式肺囊虫肺炎/ pci005。
Verica JA, Medford JI:修饰的MERI5表达改变了转基因拟南芥的细胞扩张。中国植物科学,1997,25(2):379 - 379。10.1016 / s0168 - 9452 (97) 00068 - x。
Gleave AP:一种多功能的二元载体系统,具有T-DNA组织结构,有利于将克隆DNA有效整合到植物基因组中。植物分子生物学,1992,20(6):1203-1207。10.1007 / BF00028910。
Clough SJ, Bent AF:花浸法:农杆菌介导的拟南芥转化的简化方法。植物学报,1998,16(6):735- 738。10.1046 / j.1365 - 313 x.1998.00343.x。
Stears RL, Getts RC, Gullans SR:使用树突分子技术的高密度微阵列的一种新颖、灵敏的检测系统。中国生物医学工程学报,2000,3(2):93-99。
Hardstedt M, Finnegan CP, Kirchhof N, Hyland KA, Wijkstrom M, Murtaugh MP, Hering BJ:非人类灵长类动物接受猪胰岛移植后趋化因子信使RNA的上调。异种移植,2005,12(4):293-302。10.1111 / j.1399-3089.2005.00228.x。
Pinon V, Etchells JP, Rossignol P, Collier SA, Arroyo JM, Martienssen RA, Byrne ME:三种特殊影响叶片模式的背载基因编码核糖体蛋白。发展,2008,135(7):1315-1324。10.1242 / dev.016469。
确认
我们感谢安德烈·拉戈迪安科的预选BLR-OXIan Moore提供共聚焦显微镜辅助,John Baker提供摄影,Jo Dowding提供技术帮助。种子来自NASC,微阵列材料由亚利桑那大学提供。本研究得到了英国科学技术委员会(授予BB/G18339)的支持。微阵列设施是在EPA头孢菌素信托基金(NS)的财政支持下建立的。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
实验由AMB和HGD设计。JPE、LM、WZJ、HP、NC、NS和AMB进行了实验。JPE, AMB和HGD撰写了手稿。所有作者都阅读并批准了最终的手稿。
J Peter Etchells和Lucy Moore对这项工作做出了同样的贡献。
电子辅助材料
12870 _2012_1177_moesm1_esm.pdf
附加文件1:BLR-OX基因在3个重复中表达方向相同,平均>1.5倍变化,按位点置信度排序。(pdf 117kb)
权利和权限
本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用属性许可协议(http://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
埃切尔斯,j.p.,摩尔,L.,姜伟哲et al。一个角色有缘细胞壁发育是由功能丧失表型支持的。BMC植物生物学12,212(2012)。https://doi.org/10.1186/1471-2229-12-212
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-12-212
关键字
- 维管组织
- 维管束
- 苗端
- 次生壁
- 次级细胞壁