摘要
背景
的内无外(伊诺)基因,该基因编码yabby型转录因子,指定并促进拟南芥胚珠外被的生长。伊诺该基因的表达仅限于胚珠外被发育的背面细胞层,并受胚珠内部多个区域的调控伊诺启动子,包括POS9,这是一种阳性元件,当以四倍复制存在时,在正常情况下可以产生低水平表达伊诺模式。
结果
大脑不同区域之间的活动显著冗余伊诺演示了启动子。对于特定的调控元件,多聚化或加入花椰菜花叶病毒35S通用增强子能够激活报告基因结构的表达,否则它们本身就无法表达。一个新的启动子元件POS6被定义,并被证明包含足够的正调控信息来再现胚珠中内源性的表达模式,但其他启动子区域需要完全抑制胚珠外的表达。的长篇伊诺发起人,但不是任何的伊诺启动子缺失测试,能够作为一个增强子阻断绝缘子,以防止35S增强子的异位激活表达。的启动子区域之间的序列守恒拟南芥,芸苔属植物oleracea和芸苔属植物拉伯与POS6和POS9区域的功能定义密切一致,并且与定义的伊诺最小的启动子。的B.oleracea伊诺启动子足以在拟南芥中促进与拟南芥启动子相似的报告基因表达模式和水平。
结论
至少有两个独立的区域伊诺启动子包含足够的调控信息来指导具体的模式而不是水平伊诺基因的表达。这些调控区域以部分冗余的方式促进胚珠内特定模式的表达,抑制胚珠外的表达。这种模式的建立需要多种正负监管要素之间的合作与竞争。
背景
某些发育过程需要特定的基因表达时空模式,并且可能依赖于转录调控的正负因素的作用。序列特异性DNA结合转录因子以组合方式作用于DNA中的多个结合位点,以实现不同的转录输出[1].这种类型的组合控制是真核生物转录调控的主要机制,并负责差异基因表达[2,3.].例如,抹刀(SPT)基因在拟南芥的多个组织中特异性表达SPT启动子包括多个组织特异性增强子和沉默子,并且在密切相关的物种中显示出与同源基因启动子保守的几个区域[4].的假定启动子区域丝状的花(费尔), YABBY基因家族成员,也被表征并显示包括消极和积极作用区域,这些区域共同导致它在初级外侧器官的背侧区域表达[5].内无外(伊诺)是拟南芥中另一种在胚珠外被中表达的YABBY基因[6,7].了解多个调控区域的组合作用,以产生高度特异性的模式伊诺我们在拟南芥中研究了该基因的启动子区域。
的伊诺基因促进胚珠雌蕊基侧的外被的形成和生长,产生两性(反折)形状[7- - - - - -10].伊诺在胚珠的起始部位和胚珠外被发育的背面表达[6,7,11,12].超人(吃晚饭)的作用是限制胚珠外被毛向雌蕊基部的生长吃晚饭突变体显示胚珠雌蕊尖侧的外被过度增殖,导致胚珠更垂直。10].的维持和上调,而不是启动伊诺表达需要有活性的INO蛋白,而SUP抑制了INO的自我调节作用[11,13].
报告基因和互补分析已经在INO编码序列上游发现了一个2.3 kb的区域,该区域包含了足够的调控信息伊诺表达式,称为P-INO [11].以ß-glucuronidase (GUS)酶活性为报告因子的缺失实验在P-INO中定义了一个295 bp的正调控元件POS9 [12].而POS9的单个拷贝没有产生可检测的表达,当该元件与5”(称为POSX)或3”(称为POSY) P-INO侧翼区,或至少3个额外的POS9拷贝,再现了INO的野生型表达模式。这表明在P-INO中存在额外的,至少部分冗余的正调控元件[12].本研究未发现具有负调控活性的元素。
校长等人。[12研究表明,POS9包含的信息足以产生正常的表达模式,也有助于表达的定量水平。区域也显示了冗余的定量信息”和3”但这些区域是否也包含多余的位置信息,从这些先前的研究中尚不清楚。我们现在利用报告基因的方法来测试这些信息的存在。我们还利用花椰菜花叶病毒35S转录启动子的增强子区域,观察这种通用增强子是否可以替代在胚珠中提供定量表达的P-INO区域。对其他芸苔科成员序列保守性的评估使我们能够将重点放在启动子最保守的区域上。在这些研究中,我们发现P-INO不同区域的定量和位置活性都存在冗余,并进一步发现P-INO元件负调控活性的证据。试图在启动子中识别特定的功能序列基序是不成功的。
结果
进一步剖析伊诺不同的启动子结构对GUS报告基因复制全长启动子表达模式的能力进行了评估。伊诺先前已经描述了P-INO::GUS转化子胚珠中GUS染色所显示的表达模式(图2)1模拟)[11,12].GUS活性首次在2-III期(根据Schneitz等人的说法)的外被原基中检测到。14]),它仍然局限于外被,并通过该结构的发育一直持续到第3- 1阶段之后。目前的报告基因分析最初是使用早期研究中使用的底物浓度进行的[11],但对一些启动子构建物的染色也进行了评估。
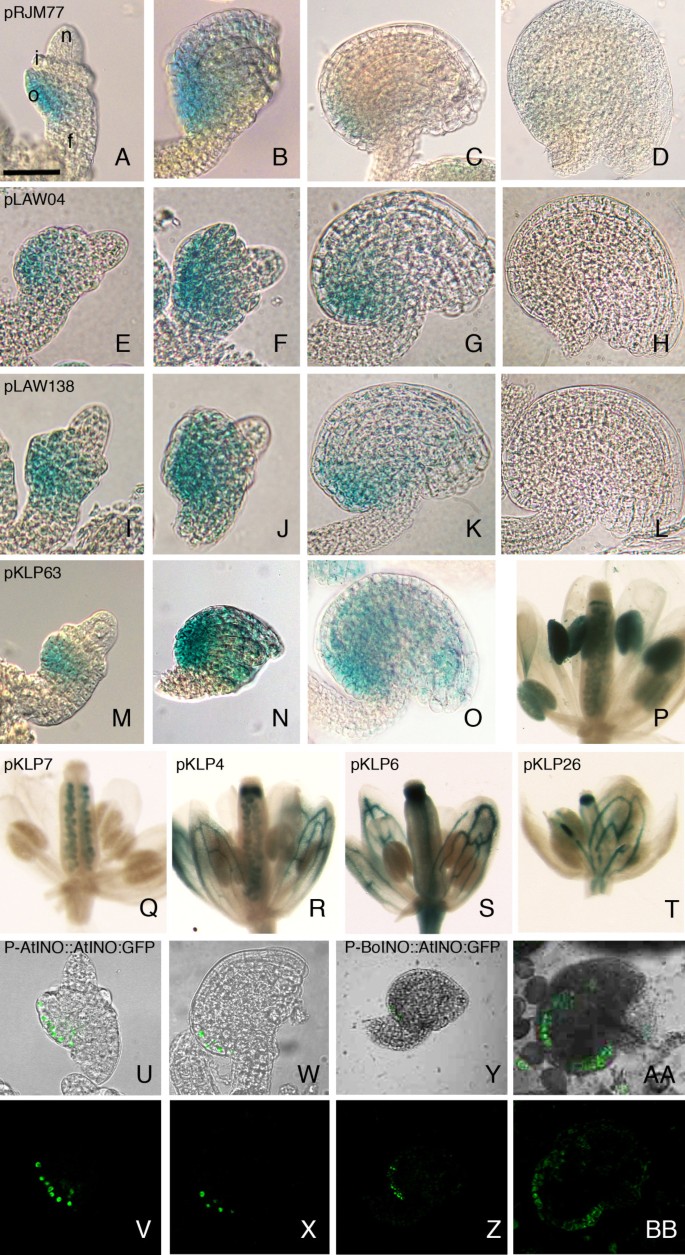
P-INO启动子在野生型植物中的表达模式迪拜国际资本(一个O)和含有pRJM77 (P-INO::GUS)的植物的胚珠和花的光镜图像(一个D), pLAW04 (POSX 3'delPOSY to−756::GUS) (EH), pLAW138 (POSX 5'delPOSY to−868::GUS) (我l), pKLP63 (4XPOS6::GUS) (米P), pKLP7 (35Senh:P-INO::GUS) (问), pKLP4 (35Senh:POSXPOSY::GUS) (R), pKLP6 (35Senh:POSX::GUS) (年代)和pKLP26 (35Senh::35SMP::GUS) (T),测定GUS活性。面板(我l)染色GUS活性,使用相对于面板(一个H和米T),以检测与全长启动子相似的强度和模式的GUS活性。胚珠发育阶段:2-III期(A、I、M);2-IV (E);2-v (f, j, u);3-i (b, n, w);3-iii (c, g, k, y);4-III (D, H, L, O, AA)(根据Schneitz等的分级。[14])。P-AtINO::AtINO:GFP结构的共聚焦显微镜[11] (U-X)和P-BoINO::AtINO:GFP (Y-BB)。(U, W, Y和AA)表示DIC图像覆盖了来自GFP的绿色共聚焦信号,或者(V, X, Z和BB)单独显示GFP荧光。比例尺(F): 15μm, (A, B, E, I, J, m, U, V) 25μm (G, N, W, X) 30μm, (C K O) 40μm (D、H、L, Y, Z) 50μm (P, Q, R、S、T、AA、BB) 700μm。f,细绳;O,外皮;1、内被;n,珠心。
芸苔科植物中INO启动子的保护
显著的保护模式伊诺在少数其他被子植物种中也观察到表达伊诺同源物已被研究过[15- - - - - -17].为了帮助鉴定P-INO的重要区域,我们研究了启动子区域的守恒和发散伊诺直接同源的芸苔属植物oleracea和芸苔属植物拉伯(它有两个同源的伊诺基因),芸苔科成员,胚珠形态与拟南芥相似。
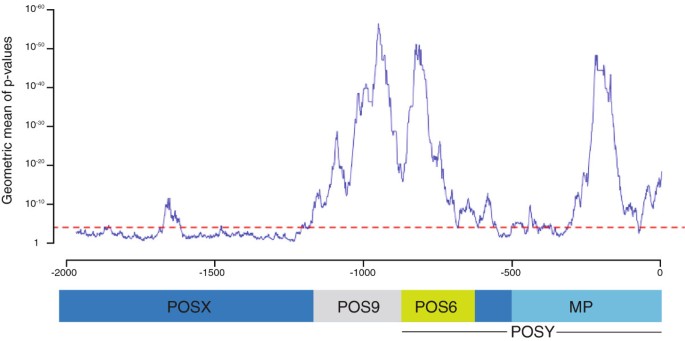
采用三种基于对齐的方法比较5”的侧翼区域AtINO,BoINO这两个BrINO基因鉴定在假定的保存概况中伊诺启动子。这些剖面确定了沿青藏高原的几个扩展保护区域伊诺启动子。ear (Evolutionary Analysis of Regulatory Sequences)鉴定出三个最显著的保守区域[18]方法,并由cluster和FSA(快速序列比对)程序中的一种或两种程序确认[18- - - - - -20.)(图2)。比对还揭示了多个较高相似性的短区域(附加文件)1)。一个54 bp的区域从- 1711位延伸到- 1657位,具有74%的同源性,是位于先前鉴定的POS9正调控元件上游的唯一高度相似的元件。在POS9区域中,-1158至- 1090和- 1066至- 898两个区域具有高度的相似性,每个区域的相似性为84%。另外一个区域,从−869到−774,具有85%的同源性,重叠POS9元件的3 '端和额外的下游序列。−317 ~−173的最后一段具有77%的序列同一性。这些价值观与这四家公司37%的整体认同形成了对比伊诺经检验的发起人(食品标准局方法,[20.])。
多物种保护概况伊诺启动子。伊诺启动子的拟南芥,芸苔属植物oleracea和芸苔属植物拉伯利用ear工具使用60 bp窗口对正射影进行比较[18].虚线表示显著性阈值(P=0.0001)。下面的图表显示了在拟南芥中通过缺失分析确定的功能调控域的位置伊诺启动子。MP,最小启动子。
芸苔属植物拟南芥的INO启动子活性
测试的转录活性B.oleracea伊诺利用拟南芥启动子(P-BoINO)和At的编码序列构建了P-BoINO伊诺ß-葡糖苷酸酶和绿色荧光蛋白(GFP)。
一个报告结构,P-BoINO::AtINO:GFP,包含2.4 kb的5”的侧翼序列BoINO包括高度保守的序列,转化为拟南芥。转基因植株在胚珠发育的雌蕊基侧外被外层显示GFP荧光,与P-AtINO::AtINO:GFP的结果相一致(图2)1U-BB)。P-BoINO::GUS结构的表达得到了类似的结果(数据未显示)。
GFP和GUS数据表明,当存在正常内源性P-AtINO时,P-BoINO可以定性地促进类似P-AtINO的表达模式伊诺基因。的伊诺基因已被证明在自我调节回路中通过自身启动子放大表达[11].为了测试P-BoINO是否也能参与自调节环,我们测试了P-BoINO::AtINO转基因的能力伊诺1突变。6个纯合子中的5个伊诺1用P-BoINO::AtINO构建体转化的植物显示出雌性生殖力的恢复,并产生与野生型相似的胚珠(数据未显示),表明该构建体进行了互补。
缺失分析描绘了一个复杂的近端启动子元件,具有正作用区和负作用区
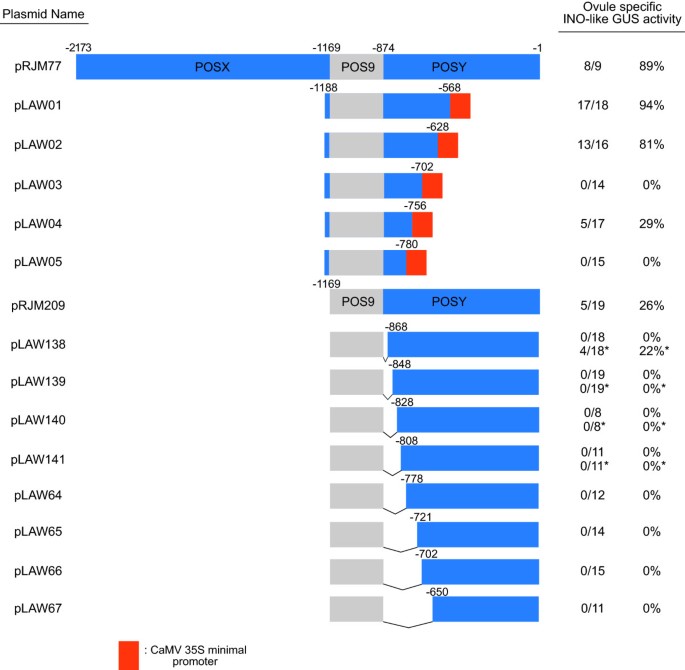
先前的研究表明,POS9元件只有在与额外的POS9拷贝或与p - ino5区域结合时才能复制内源性表达模式”或者P-INO - 3的区域”POS9 [12].这表明在5个国家中存在其他积极因素”-和3”-区域,这些区域分别被命名为POSX和POSY [12].在POSY区域存在重要的功能信息,进一步表明该区域的序列保守芸苔属植物物种(图2,附加数字1)。
为了确定POSY元件的功能区域,将PCR和寡核苷酸介导的诱变相结合[21]生成5个POSY 3”-末端和8个POSY 5”-末端缺失,在已经缺乏POSX的质粒中。花椰菜花叶病毒(CaMV) 35S启动子的最小启动子元件,先前在这些类型的分析中显示在转录起始中起作用[12],用于补偿缺失结构中转录启动所需的内源性最小元件的去除。GUS活性在每个构建体的至少10个主转化体中进行检测。
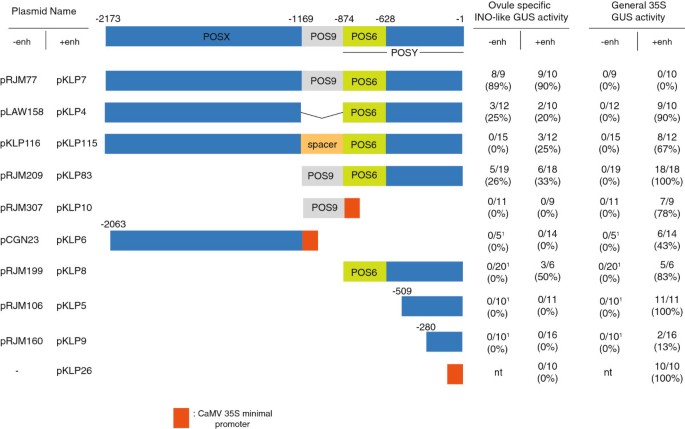
从POSY的3 '端删除到- 628位(pLAW02)并不影响报告基因的活性,因为16个转化子中有13个在胚珠中显示GUS染色,其模式与全长启动子产生的模式(野生型表达模式)相当(图2)3.)。虽然在- 702 (pLAW03)位置上缺失了GUS活性,但在- 756 (pLAW04)位置上额外移除54 bp,在17个测试的转化子中有5个恢复了野生型GUS表达模式(图2)1情况)。这表明在- 756和- 702之间的54 bp区域存在负调控元件。进一步删除- 780位点(pLAW05)导致在15个测试的转化子中都无法产生可检测到的GUS活性,这表明在- 780和- 756之间的区域存在重要的正调控信息。
POS9与截断型POSY组合的胚珠表达。整体示意图伊诺启动子和POSY缺失结构如图所示。图中的位置表示假定值上游的碱基对的数目伊诺翻译起始密码子。橙色框代表CaMV 35S启动子的60 bp最小启动子元件。胚珠特定伊诺-like GUS活性表示显示全长P-INO显示的外皮特异性GUS染色模式的独立植株数量相对于评估的转化子总数,以及从这些值计算的百分比。的频率伊诺类似于pRJM77的表达先前被描述[12],与本文报道的重复实验结果相似。*使用50X -gluc底物浓度时的结果。
在我们的标准条件下,仅从POSY区域的5 '端删除6 bp (pLAW138,删除至- 868)导致染色丢失,并且该区域的所有其他5 ' -缺失(POS95'POSYdel::GUS构建体)也是如此(图5)3.)。缺失最少的转基因系pLAW138(缺失至−868)、pLAW139(缺失至−848)、pLAW140(缺失至−828)和pLAW141(缺失至−808)也使用增加10倍的组织化学底物浓度进行检测,但未显示出任何可见的GUS活性(图2)3.数据没有显示)。当底物升高到50X时,18个pLAW138突变体中有4个检测到GUS野生型染色模式,但在含有任何较大缺失的系中未见染色(图2)1I-L和3),因为即使在极端情况下只有6个bp的缺失”这些观察结果表明,在POSX缺失的情况下,POSY的5 '端存在序列信息,这与正确的表达水平有关。综上所述,这些P-INO缺失结构的分析确定了POSY区域内246 bp的元件,我们现在将其命名为POS6,因为它位于INO起始密码子上游约600 bp的位置。POS9的下游核苷酸被认为是POS6的5 '端,而其3 '端位于假定的INO翻译起始密码子上游628bp。POS6的边界与基因的启动子区有显著的保护关系伊诺直接同源的芸苔属植物物种(图2)。
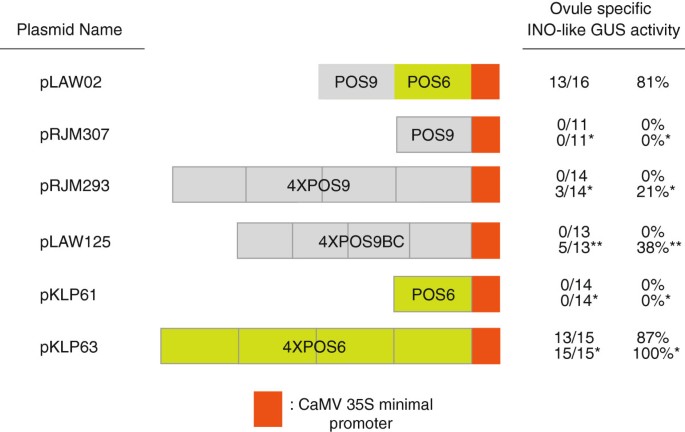
P-INO正调控元件冗余
当与最小启动子区域一起包含时,POS9和POS6 (pLAW02)的组合足以复制整个P-INO的表达。相比之下,即使底物浓度升高,单独的POS9和单独的POS6也不能从最小启动子中产生可检测的表达(图2)4)。然而,先前的报告分析显示POS9元素足以复制伊诺当出现在四个或更多串联拷贝时的表达模式(但表达水平较低)[12)(图4)。进一步解剖POS9,发现至少存在三个不同的子元件,POS9A, POS9B和POS9C [12].POS9A被认为至少含有一个转录增强子,因为它的去除(在POSY存在的情况下)只影响GUS的早期表达水平[12].为了进一步表征POS9元件,与35S最小启动子(pLAW125,图)一起构建了POS9的178 bp亚片段的四聚体,该片段仅包含POS9BC4)。在标准条件下,13个4XPOS9BC::GUS转化子均未检测到GUS活性。然而,当使用50X浓度的底物时,13个转化子中有5个在野生型中表现出GUS染色伊诺模式。这些结果表明,POS9BC中包含足以复制P-INO表达模式的调控信息,但POS9A区域的序列对转录水平有积极影响。
POS9和POS6区域的多个拷贝可以复制P-INO功能。图中显示了POS9(−1187 ~−874)和POS6(−873 ~−628)启动子区结构。橙色框代表CaMV 35S启动子的60 bp最小启动子元件。胚珠特异性ino样GUS活性表示显示全长P-INO显示的外皮特异性GUS染色模式的植物数量相对于评估的转化子总数,以及从这些值计算的百分比。* X-gluc底物浓度升高8倍时得到的结果。**当X-gluc底物浓度升高5倍时得到的结果。pRJM307和pRJM293表达模式的频率先前已被描述[12],并在实验中重复了类似的结果。
当P-INO与POS9结合时,其两侧的POSX和POSY区域也参与胚珠中的表达。为了测试这两个区域一起是否足以促进GUS的适当表达模式,我们制备了一个POSXPOSY::GUS构建体,删除POS9 (pLAW158)。12个变形者中有3个具有这种结构伊诺样胚珠特异性表达(图25)。为了测试这些区域是否能够在其原生空间关系中产生相同的效果,我们准备了一个额外的结构,在POSX和POSY之间引入一个与POS9大小和相对GC含量相同的间隔区域。POSXspacerPOSY::GUS未显示报告基因的表达,因为在胚珠中染色的15个转化子中没有一个(图2)5)。这表明这些元素中的一个或两个的活性与POS9的活性相似,但当靠近第二个阳性元素时,这种活性最有效。
CaMV 35S增强子对P-INO缺失构建体活性的影响。图表显示了整个伊诺启动子和启动子缺失结构,其中第一个质粒名称表示原始结构,第二个质粒名称表示相同的结构,但在极端处添加了35S增强子”-结构的结尾。pRJM77是具有整个P-INO [12].橙色框表示花椰菜花叶病毒(CaMV) 35S启动子的60 bp最小启动子元件。胚珠特异性ino样GUS活性表示具有外皮特异性GUS染色模式的植物数量相对于所评估的转化子总数(以及基于这些值的表达百分比),而一般35S GUS活性表示在花中观察到的具有35S模式GUS活性的植物数量相对于所评估的转化子总数。给出了不加(−enh)和加(+enh) 35S增强子的结构的结果。pRJM77、pRJM209和pRJM307的表达模式频率已被先前描述[12],并且与本文报道的重复实验中得到的结果相似。1pCGN23、pRJM199、pRJM106和pRJM160的表达谱频率为先前报道[12].Nt,未测试。
而POS6的单拷贝(与最小启动子结合)不足以产生可检测的胚珠表达([12]和图4),该区域在4XPOS6::GUS构建体(pKLP63)中的4个拷贝足以复制伊诺在标准染色条件下,15个转化子中有13个在胚珠中的表达模式,所有的转化子在较高的底物浓度下都显示胚珠染色(图2)1M-O和4)。此外,在标准条件下,15个转化体中有2个在花药中显示了报告基因的额外表达,在较高的底物浓度下,15个转化体中有14个显示了这种染色(图2)1便士)。这种特异的异位表达模式在1XPOS6::GUS和2XPOS6::GUS转化子中也以较低的频率观察到,这表明花药表达是由POS6元件诱导的,而不是POS6元件四聚化的产物4数据没有显示)。在4XPOS9::GUS或POS9POS6::GUS转化子中未检测到胚珠外染色。因此,POS6区域包含激活报告基因转录的正调控信息伊诺在胚珠和植物的其他组织中也有类似的图案。这些数据表明伊诺启动子包含多个正调控元件,足以形成适当的模式伊诺表达,但这些元素单独不足以诱导表达到可检测的水平。此外,POS6区域内的元件可以促进胚珠外组织的表达,但这种活性被POS9和POSX中包含的序列抑制。
CaMV 35S通用增强子的活性与P-INO区域融合
CaMV 35S启动子的一般增强子[22]进一步评价P-INO不同区域的功能。35S通用增强子有望促进多种植物结构中的基因表达[23].我们用一个对照构建体plklp26证实了这种活性,它将35S增强子融合到35S最小启动子和GUS编码区。所有10个被评估的转化体在胚珠(但没有P-INO产生的模式)和植物的其他部分显示GUS活性(图2)1 t和5)。
对于某些基因,仅最小启动子就包含了足够的组织特异性调控信息[24].来测试这是否适用于伊诺为了鉴定最小启动子,我们将35S增强子融合到P-INO的近端区域。先前报道5”位置- 509 (pRJM106)和- 280 (pRJM160)的缺失不能产生任何报告基因表达[12].将35S增强子添加到- 509 bp缺失的P-INO (pKLP5)中,11个转化子都没有在胚珠中表达,但所有11个转化子都在植物的非胚珠区域表达(图5)5)。这表明该区域包含足够的信息作为最小启动子,但没有证据表明包含组织特异性表达的信息。将35S增强子添加到−280 bp的P-INO缺失(pKLP9)中,16个转化子中的任何一个在胚珠中都没有表达,并且在16个转化子中只有两个显示非胚珠表达,这表明该区域可能不包含足够的信息来充当有效的最小启动子(图2)5)。
P-INO的POSX、POS9和POS6/POSY区含有促进外被底层表达的调控元件,但单独使用这些元件不足以促进表达。只有当它们与第二个P-INO元件组合时才会出现表达([12]和图5)。为了测试第二个元件的作用是否只是简单的增强子活性,我们评估了CaMV 35S启动子的能力[22]来代替第二个P-INO区域。将35S增强子分别添加到这些区域(分别为pKLP6、pKLP10和pKLP8),几乎所有植物的POSY(6个中的5个)和POS9(9个中的7个)以及近一半植物的POSX(14个中的6个)在胚珠外表达(图2)1)。相比之下,只有在POSY中添加35S增强子时才观察到ino样表达,其中6个转化子中有3个表现出这种模式(图2)5)。因此,胚珠中POSX和POS9的表达可能需要额外的组织特异性阳性元件,而一般增强子的激活无法激活这些区域的表达。
一些P-INO元件的成对组合以正确的空间模式产生表达,但其表达水平(或频率)低于完整的P-INO启动子。我们测试了添加35S增强剂对P-INO元件成对组合的影响。将增强子添加到POS9POSY或POSXPOSY组合(分别为pKLP83和pKLP4)中,不会导致胚珠中可检测到的ino样表达频率发生显著变化,并始终导致胚珠外的表达(图2)1 r和5)。
35S增强子也被融合到全长P-INO (pKLP7)上,并且它没有改变胚珠中的染色模式,因为10个转化子中有9个显示出P-INO伊诺类似的表达方式。然而,与35S增强子对所有其他P-INO元件组合的影响相反,pKLP7的所有10个转化子在胚珠外都没有表达(图2)1问和5)。这表示完整的长度伊诺启动子可以抑制35S增强子在胚珠外区域的活性。由于这是迄今为止测试的最长的启动子片段,因此35S增强子在胚珠外产生表达的失败可能是由于与最小启动子的距离。然而,当我们在一个片段上测试35S增强子时,POS9被POSX和POSY之间长度和G/C含量相似的间隔物取代(pKLP115, 35S:POSXspacerPOSY::GUS),它显示出与POSXPOSY结构相似的活性,12个转化子中有3个染色在胚珠区域,7个转化子中有5个染色在非胚珠区域(图5)5)。因此,完整的P-INO似乎具有独特的活性,可以抑制胚珠外的激活,并且没有P-INO的亚区或更小的亚区组合能够复制这种活性。
P-INO POS9区特定序列基序突变
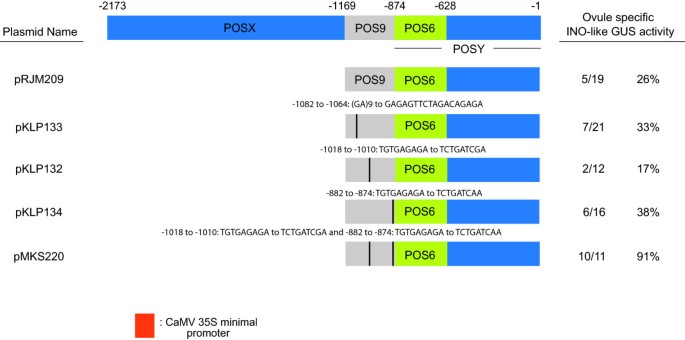
前(12],目前的研究结果表明,POS9A亚区正调控报告基因的表达水平,而POS9B和POS9C亚区是在胚珠内产生报告基因表达所必需的。碱性五半胱氨酸(BPC)蛋白结合GA重复序列或可能富含嘌呤的序列,以及POS9区域内多个GA重复序列的存在,表明BPC蛋白可能结合影响P-INO表达[12,25].此外,BPC基因家族已被证明以部分冗余的方式促进胚珠外被的生长[26].因此,(GA)的具体贡献9研究了POS9A亚元件内的重复序列,使用定点诱变来改变(GA)。9在−1064位置重复到GAGAGTTCTAGACAGAGA。(GA)的诱变作用9在含有改变后的POS9与POS6 (pKLP133)结合的载体中,repeat没有改变总体模式或表达水平,因为21个转化子中有7个显示出GUS报告基因的正确模式和表达水平(图2)6)。这与用这种表达模式观察到的pRJM209 (POS9POSY::GUS)的19个转化子中的5个相似,具有不变的POS9区域。该区域的遗传重复序列是保守的,尽管在遗传重复序列的数量上有一定的变化芸苔属植物检查的物种(附加文件1)。
POS9突变对启动子活性的影响。整体示意图伊诺显示了启动子、启动子删除和四个位点定向诱变结构。图中的位置表示INO的假定翻译起始密码子上游的碱基对数量。胚珠特定伊诺-like GUS活性表示显示全长P-INO显示的外皮特异性GUS染色模式的独立植株数量相对于评估的转化子总数,以及从这些值计算的百分比。的频率伊诺pRJM209的类似表达先前被描述[12],与本文报道的重复实验结果相似。
一个独特的单体TGTGAGAGA存在于POS9B和POS9C中,其缺失似乎会影响启动子的功能[12].利用定点诱变研究了该元件的可能作用。在含有POS9POSY (pRJM209)的构建体中,POS9C中的TGTGAGAGA元件突变为TCTGATCAA (pKLP134),但这一变化并未改变报告基因的活性,因为16个转化体中有6个在胚珠中显示GUS染色,呈inos样模式(图2)6),而在未突变的质粒中,这一比例为19分之5。POS9B中的TGTGAGAGA元件突变为TCTGATCGA,由此产生的pKLP132也没有丧失活性,因为12个突变体中有2个在胚珠中显示GUS染色,呈ino样模式(图2)6)。当这两个突变在pMKS220中组合成一个构建体时,我们观察到ino样表达的频率高于其他测试构建体,因为11个转化体中有10个在胚珠中显示GUS染色(图2)6)。因此,这个基序不是表达所必需的,但不能排除抑制表达的活动。这个基序是保守的B.oleracea其中一个B.拉伯伊诺启动子序列。
讨论
的严格的空间和时间限制伊诺基因只表达到外被膜的一层[7,11]为研究发育基因调控所必需的启动子元件提供了一个示范模型。以前的工作表明,多个独立的区域伊诺启动子以部分冗余的方式起作用,并定义了一个元件(POS9)的极限,该元件包含驱动特定表达的足够信息[12].在此,我们描述了具有类似POS9性质的第二个元件,表明在不同物种中序列的保守性集中在这两个元件上,并表明正负活性都有助于建立POS9伊诺域表达式。
POS9的亚区重建启动子活性,但无法确定必要的序列基序
先前鉴定的P-INO的POS9元件包含足以指导特定模式的调控元件伊诺表达式,当与自身的额外副本或与POSX或POSY组合时[12].研究表明,POS9A亚区可以提高报告基因的表达水平,但与报告基因表达所必需的更关键的POS9B和POS9C区域相比,其保守性较差。我们目前的研究发现,四聚化的POS9BC区域以与四聚化的全长POS9相似的模式和水平激活了报告基因的表达,这进一步证明了POS9A区域并不是提供特定表达模式所必需的,而是可能作为表达增强子发挥作用。BPC蛋白先前在酵母杂交实验中被鉴定为结合P-INO的POS9区域,并优先结合GA重复序列或富含嘌呤的序列[12,25].我们假设(GA)9位于POS9A和POS9B之间的重复序列可能代表BPC蛋白的结合位点,并可能促进包括a (GA)在内的POS9A亚区表达的增强。6重复。(GA)的特异性诱变9在POS9POSY::GUS结构中重复的基因对报告基因的活性没有影响,这表明(GA)9repeat对POS9A活性的增强没有贡献。在邻近的POS9A或POS9BC亚区存在的其他GA重复序列和富含嘌呤的序列可能仍然允许BPC与dna结合伊诺启动子,因此,只有一个这样的元件的诱变可能不足以改变报告基因的活性水平。因此,GA的作用重复在调节伊诺表达仍然不清楚。
先前的分析表明,报告基因的正常表达需要POS9B和POS9C亚区[12],并在这两个亚区发现了一个独特的单体序列TGTGAGAGA。然而,我们的结果表明,在我们的分析中,这种独特的序列并不需要维持报告基因表达的模式或水平。事实上,这两个序列的去除导致相关结构家族中表达频率最高,表明该序列基序可能在负调控中起作用。POS9区与基因序列高度保守芸苔属植物POS9A分区域的保护水平最低。因此,控制表达特异性的调控元件似乎比增强元件更高度保守。的区域存在高度的序列整体守恒芸苔属植物与POS9B/C对应的序列阻止了正确模式所需的特定调控元件的识别伊诺基因的表达。在POS9区域的- 957位,我们注意到存在一个假定的结合位点AINTEGUMENTA(蚂蚁),一种维持细胞生长所需的转录因子伊诺表达式[12].GCACTAGTCTCAACTC序列与Nole-Wilson和Krizek [j]鉴定的GCAC(G/ a)N(T/ a)TCCC(a /G)ANG(T/C)的ANT共识序列匹配良好。27].然而,在酵母1杂交试验中,ANT蛋白没有与POS9区域结合[12].一个假定的ANT结合位点也存在于YABBY基因的启动子中费尔和YABBY3与抑制基因表达的Kruppel蛋白结合位点相邻[28].然而,我们没有观察到类似的Kruppel结合位点序列伊诺启动子。
P-INO的功能冗余元件
先前的研究表明,POSX或POSY可以添加到POS9中来重建伊诺表达模式[12].我们现在发现POSX和POSY的组合也可以重建这种模式,这表明POS9不是组织特异性信息的唯一位点。此外,我们发现POSY的一个246 bp的亚区(POS6)与POS9相邻,当四聚体化时,也包含足够的调控信息,以促进报告基因的正确表达模式。因此,两个区域的伊诺启动子包含足以促进特定模式的调控序列伊诺在胚珠中表达,两者都需要额外的序列来产生正常水平的表达。在POS6区域内,缺失分析表明,在- 702和- 756位点之间存在一个沉默或负调控元件,因为从POS6的3 '端移除74 bp会消除GUS活性,但当另外删除54 bp时,这种活性会恢复,这表明恢复的报告基因活性可能是由抑制子结合的序列缺失的结果。在分析费尔拟南芥、Watanabe和Okada叶片背面表达的YABBY基因启动子[5]发现了一个顺式调控元件,该元件抑制叶片正面报告基因的表达,从而给出了特定的背面表达模式。然而,我们在…的POS6区域发现了假定的抑制域伊诺启动子消除胚珠中所有的表达,并且不仅仅负责表达的极性。在含有多个POS6区域的构建体中,花药中的异位表达,而当POS6与其他P-INO区域存在时,则没有异位表达,这表明花药的表达受到POS6侧的P-INO序列的抑制。因此,正调控元件和负调控元件都存在于POS6和P-INO的其他部分,包括POS9和POSX,这些元件的组合建立了胚珠特异性表达模式。
POS9和POS6都需要多个拷贝或添加另一个元件才能从其包含的组织特异性调控信息中显著表达。对于POS6,添加一般增强子活性似乎足以促进胚珠表达,因为添加35S增强子导致胚珠表达符合预期模式。此外,POS6元件的多片段足以促进报告基因在胚珠中的表达,其水平类似于全长启动子或POS9POS6元件的共同表达。这与POS9和所有超过一个元素的测试组合形成对比,其中35S增强子对胚珠表达没有影响。此外,POS9元件的多个拷贝并不能重建正常的表达水平,因为检测报告活性需要提高底物浓度。这表明激活POSY基因表达的位置特异性元件足以促进胚珠内的表达,但需要额外的非特异性增强元件来激活报告基因表达到可检测的水平,而POSX和POS9需要额外的位置特异性增强子来促进表达。
当35S通用增强元件与其他区域结合时,促进非胚珠表达的能力伊诺启动子受到全长P-INO的抑制,但不受任何不完整的子区域组合的抑制,即使在引入间隔序列以维持总序列长度时也是如此。这样,才算圆满伊诺启动子可作为35S通用增强子的增强子阻断绝缘子。在植物中描述的具有增强子阻断活性的序列的例子相对较少(参见[29])。抑制活性分布在所有三个确定的P-INO亚区。这表明,高特异性表达模式伊诺部分是由于主动抑制胚珠外的表达。POSY区域似乎包含较少的抑制活性,因为当存在多个POS6拷贝时,我们观察到特定的花药表达。此外,与其他P-INO区相比,POSY区对35S一般增强子的响应更大。
的伊诺最小启动子区
除了POS6调控元件外,POSY区域还包括另一个功能域伊诺最小启动子区域。我们发现包含- 509到+1碱基对的区域可以有效地支持35S增强子驱动的表达,但从- 280开始的较短区域则不能。这伊诺最小启动子似乎没有组织特异性活性,因为当最小启动子片段与35S增强子融合时,我们没有观察到在胚珠中的表达,而是报告基因的表达模式更类似于35S增强子与35S最小启动子的活性。我们注意到伊诺最小启动子相对于CaMV 35S等其他特征明确的最小启动子(60 bp, [22])和核酮糖二磷酸羧化酶基因(33 bp, [24])。
的序列守恒伊诺启动子元素
同源物的启动子区分析伊诺在B.oleracea和B.拉伯结果表明,POS9、POS6和最小启动子区具有高度的序列保守性十字花科.我们注意到POS9和POS6交界附近区域的序列相似度有所下降,但这两个元件交界的序列高度保守,这与我们的分析一致,表明该边界的缺失显著破坏了这两个元件的活性。与POS9B和C区域相比,POS9A区域的相似度也较低,这与POS9A的活性较低一致。在序列的POSX区域的一个额外的小区域的序列相似性伊诺从−1711到−1657的启动子,在芸苔属植物物种。这可能是POSX元素的一个重要组成部分,但我们还没有研究这个区域对伊诺表达式。的伊诺来自近亲物种的启动子序列,番木瓜和葡萄,也进行了检查,未观察到序列守恒(数据未显示)。此外,伊诺启动子序列与之密切相关拟南芥lyrata被比作一个.芥而且整个启动子长度上的序列相似性使我们无法区分启动子中序列保守可能指示功能活性的区域(数据未显示)。的伊诺启动子的B.oleracea结果表明,P-BoINO::AtINO:GFP在拟南芥外被基部的外层表达,因此含有足以促进AtINO样模式表达的所有调控信息。利用该启动子的构建体也充分补充了伊诺1突变表型,从而证明了在外被的雌蕊基侧特异性表达和AtINO蛋白在P-INO启动子驱动下上调和维持表达的自我调节作用所必需的调控元件[11都是守恒的B.oleracea伊诺启动子。
在P-INO的3 '端- 317和- 173之间的区域也显示出高度的序列保守性,我们的分析表明该区域可能是dna的必要部分伊诺基本表达的最小启动子区域。该区域的一部分将在不能有效发挥作用的最短启动子片段(缺失至- 280)中被删除,但包含在与35S增强子一起发挥作用的较长片段(缺失至- 509)中。
结论
我们发现胚珠产生的特异性表达伊诺位于胚珠外被雌蕊基侧最外层细胞层的启动子是位置特异性增强子和一般增强子共同作用的结果,促进胚珠表达,抑制序列阻止胚珠外表达。这两种类型的序列都存在于我们定义的所有三个元素中。因为只有至少两个元素(可以是相同的元素)的组合才能产生显著的表达,所以证明了积极的活动。分布的负活性表明,这三种元素都需要阻断35S增强子驱动的一般表达,POSX和POS9能够阻断POSY驱动的异位花药表达。此外,在POSY的缺失分析中发现了一个负活性区域。POSY在两个方面不同于其他元素;它是唯一被35S增强子促进的元件,并且在阻断胚珠外表达方面似乎具有较弱的活性。尽管三个鉴定区域之间的功能相似,但没有确定共同的序列基序。有可能在元件中存在具有冗余活动的不同序列,或者,共同元件可能具有足够的变量以防止识别。对功能区位置的进一步细化,以及对与调控元件结合的因子的研究,或对这些区域中DNA或染色质的修饰的研究,可能会使这些可能性得到解决。
方法
植物材料
拟南芥兰茨贝格erecta(Ler)植物如前所述在长日照条件下生长[30.].植物通过花浸法转化[31],用6 × 10喷淋的方法选择变压器-3%草铵除草剂。
启动子报告基因的构建
pRJM77、pRJM209、pRJM307、pRJM293、pCGN23、pRJM199、pRJM106、pRJM160和pCGN09等构建体此前已被报道[11,12].
的POSY元素的5 '端删除伊诺启动子是通过寡核苷酸诱变产生的[21]有关pRJM209 [12]生成8个启动子片段。引物过去”IIDEL1,过去”IIDEL2,过去”IIDEL3,过去”IIDEL4, POS45”DEL1, POS45”DEL2, POS45”DEL3和POS45”本研究中使用的DEL4引物序列列于附加文件2)生成启动子片段,随后克隆到pRJM137的HindIII/NcoI位点(P-INO::GUS,在这些克隆中替换了P-INO;[12])分别创建pLAW138、pLAW139、pLAW140、pLAW141、pLAW64、pLAW65、pLAW66和pLAW67。
从3”的POSY元素的末端伊诺用pRJM137对启动子片段进行PCR扩增产生启动子[12]作为模板,带正向引物”POS8和反向引物POS43”DEL1, POS43”Del2, pos43 ' del3, pos43”DEL4和POS43”DEL5。将这些片段克隆到带35S最小启动子和GUS编码区的HindII/BamHI位点pMON999中,分别得到pLAW01、pLAW02、pLAW03、pLAW04和pLAW05。
类的POS9BC元素伊诺启动子是从pLMK134 [12]使用引物NEWPOS8for和NEWPOS8rev克隆到pLITMUS28(新英格兰生物实验室)中,生成pLAW117。通过将pLAW117的BglII/BamHI片段重复连接到BamHI消化的pLAW117中,形成pLAW120,如前面描述的POS9元件[12].将4XPOS9BC元件与pLAW105的35S最小启动子和pCGN43的GUS编码区结合,插入到pMON999中[11]作为一个PstI/StuI片段,与诺帕碱合成酶多腺苷化区相邻。
采用PCR技术对稻瘟病菌的POS9序列进行定点诱变伊诺使用pRJM209 [12作为模板。(GA)突变9利用引物GA9-5构建POS9A区域序列”和GA9-3”.利用引物POS9Bfor和POS9Brev, POS9TOPfor和POS9BOTTOMrev分别在POS9B和POS9C区域的保守序列上产生突变。将这些PCR产物连接到pRJM209的HindIII/NcoI位点,分别得到pKLP133、pKLP132和pKLP134。为了在POS9B和POS9C的保守序列上产生突变,将POS9TOPfor和POS9BOTTOMrev引物与POS9B突变的pKLP132模板一起使用。
的POS9序列的删除伊诺启动子是通过寡核苷酸介导的诱变产生的[21在pRJM77上使用POS9DEL引物来创建pLAW156。将pLAW156的HindIII/NcoI片段克隆到pRJM77中,得到pLAW158。
一个序列,作为POSX和POSY区域之间的间隔,代替POS9伊诺启动子用引物BglIIspacer5聚合酶链反应生成”和BglIIspacer3”在ROC3以pCG23为模板克隆拟南芥基因32]并插入pCR4-TOPO (Invitrogen)中,生成pKLP114。然后将pKLP114的BglII片段转移到pLAW158和pKLP4中,分别生成pKLP116和pKLP115。
的POS6元素伊诺利用引物POS6Bgl和POS6BamHI从pLAW158中扩增出启动子,并将其克隆到pBluescript KS的BglII和BamHI位点上,pBluescript KS在EcoRI和BamHI位点之间添加了一个BglII位点,从而产生了pKLP57。pRJM293的BamHI/SacI片段(包括35SMP::GUS组合,[12将pKLP60的BglII/SacI片段克隆到pRJM293中,构建pKLP61。将pKLP57的BglII/BamHI片段多次克隆到pKLP61的BglII位点,生成pKLP63,得到POS6元件的四聚体。
35S增强子序列[22]用引物35S-5扩增”Hind和35S-3”SalHind并克隆到pUC118的HindIII位点,生成pKLP2。随后将pKLP2的HindIII片段克隆到pRJM77、pLAW158、pRJM209、pRJM307、pCGN23、pRJM199、pRJM106、pRJM160和pCGN09的HindIII位点([12],见上文),分别创建pKLP7、pKLP4、pKLP83、pKLP10、pKLP6、pKLP8、pKLP5、pKLP9和pKLP26。在这些克隆中,35S增强子的正确方向被一个不对称的MspI位点的消化所证实。
一段B.oleracea伊诺(BoINO)基因从B.oleracea利用基于拟南芥序列(B-INO1、B-INO2和B-INO3)的引物。利用BoINO片段序列设计引物(B-INO4和B-INO5),用于鉴定含有该基因的细菌人工染色体(BAC)克隆B.oleracea图书馆(加州大学戴维斯分校卡洛斯·基罗斯的礼物)。该BAC的BglII/HindIII片段包括所有5个”将BoINO基因的-侧翼区域亚克隆到pLITMUS28中的这些相同位点上,以创建pRB9(该克隆的插入物利用部分的序列已存入GenBank [GenBank:JX682714])。整个启动子5”用引物PB-INO1和PB-INO2扩增-侧翼区(从紧邻基因到起始密码子),分别加入HindIII和BamHI位点,并将这些位点插入到pBluescript KS+中,形成pRB26。这个5”-flanking片段与AtINO cDNA结合到pMON999中,形成pLAW181 (P-BoINO::AtINO)。5”-侧翼片段还与一个去除了停止密码子的INO cDNA和eGFP编码区结合[33]创建pRB29 (P-BoINO::AtINO:GFP)。
所有启动子构建体都以NotI片段的形式穿梭到pMLBART中[34]二值向量和pMLBART导数分别转移到任意一个农杆菌属菌株ASE [35]或GV3101::pMP90 [36].
显微镜
组织化学染色检测GUS活性,并使用差示干涉对比(DIC)光学显微镜观察,如前所述观察到GFP荧光[11].
序列分析
的油菜基因序列为Bra024599和Bra012373,通过对芸苔属遗传和基因组数据库的序列相似性检索得到[37].拟南芥与芸苔属植物伊诺启动子采用EARS、FSA和ClustalW [18- - - - - -20.].
参考文献
Blackwood EM, Kadonaga JT:继续前进:增强剂作用的当前观点。科学通报,1998,28(3):61-63。
植物转录调控:组合调控的重要性。植物生理学报,1998,18(4):1107 - 1107。10.1104 / pp.118.4.1111。
Riechmann JL:转录调控:基因组学综述。拟南芥书(TAB)。电子图书。2002,美国植物生物学家学会,46-http://www.aspb.org/publications/arabidopsis/.
grozmann M, Bylstra Y, Lampugnani ER, Smyth DR .:拟南芥心皮发育、幼苗萌发和侧枝器官生长相关bHLH基因SPATULA的组织特异性表达调控。实验学报,2010,61(5):1495-1508。10.1093 / jxb / erq015。
Watanabe K, Okada K:两个离散顺式元件控制拟南芥丝状花基因的背面特异性表达。植物学报,2003,15(11):2592-2602。10.1105 / tpc.015214。
Balasubramanian S, Schneitz K:喷嘴对拟南芥胚珠发育过程中近端-远端模式形成、细胞增殖和早期孢子发生的调控。发展,2000,27(19):4227-4238。
杨建军,杨建军,杨建军,杨建军。拟南芥胚珠发育过程中胚轴与胚轴的相互作用。中国生物医学工程学报,2009,30(3):391 - 391。10.1101 / gad.13.23.3160。
王晓明,王晓明,王晓明,王晓明。拟南芥胚珠发育调控基因的研究进展。遗传学报,2009,35(4):1104 - 1104。
李建军,李建军,李建军,等。拟南芥胚珠发育的遗传分析。发展,1997,24(7):1367-1376。
Gaiser JC, Robinson-Beers K, Gasser CS:拟南芥超人基因介导胚珠外被不对称生长。植物学报,1995,7(3):333-345。
Meister RJ, Kotow LM, Gasser CS: SUPERMAN减弱INNER - NO - OUTER自调节以维持拟南芥胚珠外被极性发育。发展,2002,129(18):4281-4289。
Meister RJ, Williams LA, monwfp MM, Gallagher TL, Kraft EA, Nelson CG, Gasser CS:拟南芥INNER NO OUTER启动子区正调控元件的定义和相互作用。植物学报,2004,37(3):426-438。
Meister RJ, Oldenhof H, Bowman JL, Gasser CS: YABBY蛋白在生殖发育中的差异表达。植物生理学报,2005,37(2):651-662。10.1104 / pp.104.055368。
施奈尔兹K, Hulskamp M, Pruitt RE:拟南芥野生型胚珠发育的光镜研究。植物学报,1995,7(5):731-749。10.1046 / j.1365 - 313 x.1995.07050731.x。
王晓明,王晓明,王晓明,等。无核果实在植物胚珠发育中的应用。美国科学进展,2011,108(13):5461-5465。10.1073 / pnas.1014514108。
杨建军,李建军,李建军,等。凤仙花属植物的分化机制。植物学报,2005,17(6):1674-1684。10.1105 / tpc.104.029207。
杨建军,李建军,李建军,李建军,李建军。植物YABBY基因的克隆与表达。植物学报,2011,37(1):26-36。10.1111 / j.1365 - 313 x.2011.04570.x。
王晓明,王晓明,王晓明,等。植物基因调控序列的进化分析。植物学报,2010,32(1):559 - 561。
Thompson JD, Gibson TJ, Plewniak F, Jeanmougin F, Higgins DG: CLUSTAL*X窗口界面:质量分析工具辅助下的多序列比对灵活策略。核酸学报,1997,25(24):4876-4882。10.1093 / nar / 25.24.4876。
张建军,刘建军,刘建军,张建军,张建军,张建军,张建军。计算机工程学报,2009,35 (5):11000392 - 11371 /journal.pcbi.1000392。
Kunkel TA:快速有效的位点特异性诱变,无需表型选择。美国国家科学促进会。中国生物医学工程学报,2009,32(2):488-492。10.1073 / pnas.82.2.488。
陈建军,陈建军,陈建军,等。植物CaMV 35S启动子序列的克隆与分析。科学通报,2007,35(6):379 - 379。10.1126 / science.236.4806.1299。
花椰菜花叶病毒35S启动子:植物转录的组合调控。科学,1990,25:959-966。10.1126 / science.250.4983.959。
Morelli G, Nagy F, Fraley RT, Rogers SG, Chua n h:豌豆核酮糖1,5-二磷酸羧化酶亚基编码基因的短保守序列参与光诱导。自然,1985,315(6016):200-204。10.1038 / 315200 a0。
Kooiker M, Airoldi CA, Losa A, Manzotti PS, Finzi L, Kater M, Colombo L:拟南芥基因SEEDSTICK调控区构象变化的GA结合蛋白- BASIC PENTACYSTEINE1。植物细胞,2005,17(3):722-729。10.1105 / tpc.104.030130。
mongode MM, Simon MK, Meister RJ, roigi - villanova I, Kooiker M, Colombo L, Fletcher j, Gasser CS:拟南芥中基本五半胱氨酸基因的重叠和拮抗活性对发育过程的影响。植物学报,2011,36(6):1020-1031。10.1111 / j.1365 - 313 x.2011.04562.x。
none - wilson S, Krizek BA:拟南芥花发育蛋白AINTEGUMENTA的DNA结合特性。核酸学报,2000,28(21):4076-4082。10.1093 / nar / 28.21.4076。
Nole-Wilson S, Krizek BA: AINTEGUMENTA与YABBY基因联合影响器官极性和调节侧身器官生长。植物生理学报,2006,41(3):977-987。10.1104 / pp.106.076604。
宋志强,刘志强,刘志强。转基因植物增强子-启动子干扰及其预防。植物学报,2011,30(5):723-731。10.1007 / s00299 - 010 - 0977 - 7。
McAbee JM, Hill TA, Skinner DJ, Izhaki A, Hauser BA, Meister RJ, Venugopala Reddy G, Meyerowitz EM, Bowman JL, Gasser CS:拟南芥胚珠珠被分离和生长的极性决定基因。植物学报,2006,46(3):522-531。10.1111 / j.1365 - 313 x.2006.02717.x。
郭文杰,李文杰,李文杰,等。农杆菌介导的拟南芥转化方法的研究进展。植物学报,1998,16(6):735-743。10.1046 / j.1365 - 313 x.1998.00343.x。
周晓明,Gasser CS:拟南芥亲环蛋白基因家族的研究。以及已知亲环蛋白的系统发育分析。植物学报,1997,35(6):873-892。10.1023 /: 1005930024796。
Schumacher K, Vafeados D, McCarthy M, Sze H, Wilkins T, Chory J:拟南芥液泡H(+)- atp酶在植物生长发育中的核心作用。基因工程学报,2009,35(4):359 - 369。10.1101 / gad.13.24.3259。
Gleave AP:具有T-DNA组织结构的多功能二元载体系统,有助于将克隆DNA有效整合到植物基因组中。植物化学学报,1992,20(6):1107 - 1107。10.1007 / BF00028910。
李建军,李建军,李建军,李建军,李建军,李建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军。生物/技术。1985, 3(7): 629-635。10.1038 / nbt0785 - 629。
王志强,王志强,王志强,等。一种新型农杆菌双载体中TL-DNA基因5的表达调控。中华生物医学工程学报,2003,19(3):383-396。10.1007 / BF00331014。
程峰,刘松,吴军,方林,孙松,刘波,李鹏,华伟,王旭:BRAD,芸苔属植物遗传与基因组数据库。植物生态学报,2011,31(1):369 - 369。
致谢
我们感谢迪奥·凯利和莫娜·蒙德罗德的有益讨论和黛布拉·斯金纳对手稿的评论。这项工作得到了美国国家科学基金会(IOS-0920618)对CSG的资助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们没有竞争利益。
作者的贡献
所有作者都参与了研究的设计;MS, LW, KP和RB进行实验。MS, LW和CG完成了大部分稿件的撰写,并由其他作者进一步编辑。所有作者都阅读并批准了最终的手稿。
电子补充资料
12870 _2012_1188_moesm1_esm.doc
附加文件1:利用FSA程序对拟南芥(AtINO)、甘蓝(BoINO)和油菜(BrINO1和BrINO2)同源物的INO启动子保守区域进行比对[20.].(doc 32kb)
权利和权限
开放获取本文由BioMed Central Ltd.授权发表。这是一篇开放获取的文章,在知识共享署名许可(https://creativecommons.org/licenses/by/2.0),允许在任何媒体上不受限制地使用、分发和复制,前提是正确引用原创作品。
关于本文
引用本文
西蒙,m.k.,威廉姆斯,洛杉矶,布雷迪-帕瑟里尼,K。et al。正向和负向调控元件参与组织特异性表达内无外是拟南芥中yabby型转录因子基因。BMC Plant Biol12,214(2012)。https://doi.org/10.1186/1471-2229-12-214
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-12-214
关键字
- 启动子
- 增强器
- 胚珠
- 芸苔属植物
- 工厂的发展