摘要
背景
低温对植物生长影响很大,许多基因的表达都是由低温胁迫诱导的。虽然在冷信号通路中的许多基因已经在拟南芥,关于苹果中感冒应激响应的转录因子很少。
结果
在这里,我们展示了苹果BHLH(基本螺旋环 - 螺旋)基因MdCIbHLH1(诱使bHLH1),编码类似ice的蛋白质,在冷应激反应中明显受到诱导。MdCIbHLH1蛋白特异性结合MYC识别序列ATCBF3启动子,MdCIbHLH1过表达增强了转基因植物的耐寒性拟南芥.此外,MdcibhlH1蛋白结合于启动子MdCBF2并通过上调表达促进了转基因苹果植株的耐冷性MdCBF2通过CBF (c -重复结合因子)途径。我们的研究结果表明MdCIbHLH1在不同物种的耐受性中发挥作用。例如,异位MdCIbHLH1表达在转基因烟草中赋予增强的冷却耐受性。最后,我们观察到冷诱导苹果中MdcibhlH1蛋白的降解,并且这种降解可能是通过普发化和雄性的介导的。
结论
基于这些发现,MdCIbHLH1编码一个转录因子,对苹果的耐冷反应很重要。
背景
苹果 (Malus×Divelsa.)是世界上最重要的水果作物之一,在一些商业苹果种植区,低温是影响苹果产量的主要环境因素之一。苹果树在冬季需要足够的冷却来恢复正常的生长,并在春天长出果芽。1].然而,当生长已经恢复时,早春的严寒和晚春的霜冻可能会损害苹果树[2,3.].因此,提高苹果的耐冷性可显著提高苹果产量和经济效益。
植物对低温的反应表现在生理、分子和生化水平上[4].在分子水平上,低温诱导了一组特定的基因和蛋白质,介导植物对低温胁迫的耐受性。在应对低温时,这些基因和它们的产物参与保护细胞免受压力诱导的损伤([5,6])。
ICE1-CBF-COR冷响应通路是触发人体冷耐受反应的主要冷信号模块之一拟南芥([7- - - - - -9])。拟南芥和(寒冷调节)基因编码蛋白质,帮助防止冰冻压力[10].许多这些的启动子天哪基因包含C-repeat/脱水反应元件(CRT/DRE)的副本([11])。一个包含AP2结构域的转录激活因子家族,被称为CBF (CRT结合因子)[12,13或DREB (DRE结合)蛋白[14,15],与CRT / DRE元素结合并激活转录。编码CBF转录因子的基因也被冷,以及三个CBF基因在拟南芥已发现编码DREB1B / CBF1,DREB1A / CBF3和DREB1C / CBF2参与冷适应途径[16- - - - - -18].过度表达DREB1A / CBF3和DREB1B / CBF1基因在拟南芥增加转基因植物的耐寒性[19].在转基因烟草,番茄和水稻表达中也观察到增强的耐寒性CBF基因(20.- - - - - -22].在苹果,过度表达MBDREB1.转录因子基因增加植物对非生物胁迫的耐受性[23].另外,异源过表达Prunus Persica与对照M.26相比,苹果CBF1基因抗冻性增强[24].
bHLH转录因子广泛参与高等植物对各种非生物胁迫的响应,包括冷胁迫(AtICE1,[9]),干旱(atmyb2.,[25])和高盐度(AtNIG1,[26])。ICE1 (CBF3 Expression1的诱导子)是一种类似myc的基本螺旋-环-螺旋转录因子,可激活CBF3和天哪基因对低温的反应拟南芥[9].ICE1与MYC识别结合独联体-Elements(Canntg)在启动子CBF3基因,触发CBF家族成员的表达,进而增强CBF调控的表达[9,27].占主导地位的突变ICE1.阻断CBF3冷诱导,降低下游基因表达[9].表达的ICE1.与增强的耐寒性有关拟南芥,黄瓜和米[28,29].ICE1蛋白的降解强烈影响CBF3/DREB1A和CBF1/DREB1B编码基因的表达,以及耐寒反应[9].在拟南芥,在低温驯化过程中,ICE1的降解是通过26S蛋白酶体途径的多聚泛素化介导的[30.].参与冷驯化的ICE1蛋白也被SUMO偶联/去偶联修饰[31].
在这项研究中,bHLH基因MdCIbHLH1(诱使bHLH1)的克隆根据其在冷胁迫下的差异表达。由。编码的蛋白质的特殊结合MdCIbHLH1致……的发起人CBF用EMSA (Electrophoresis Mobility Shift Analysis)和ChIP-PCR (Chromatin immunoprecipitation)对基因进行验证。随后,MdCIbHLH1变成了拟南芥以苹果、烟草等为研究对象,分析其在冷反应中的作用。这项研究的结果表明MdCIbHLH1基因可用于改善苹果和其他作物物种的耐寒性。
结果
基因克隆、序列分析及MdCIbHLH1亚细胞定位
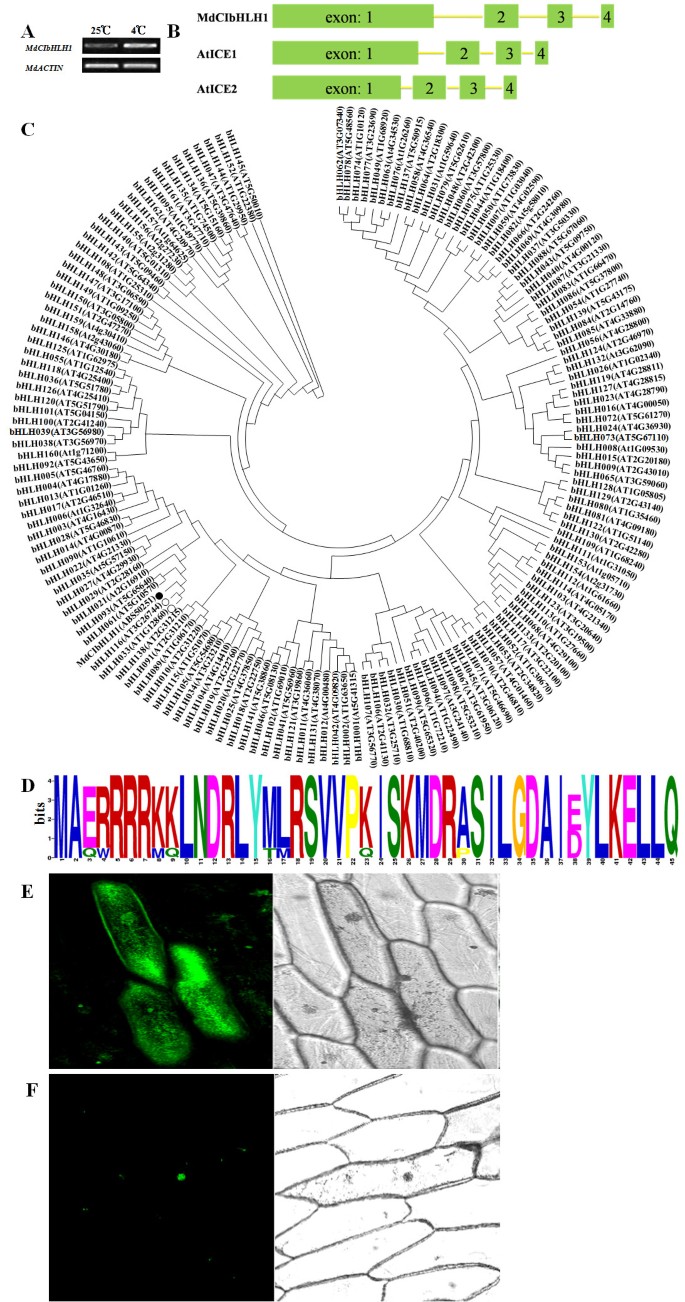
在公开可用的apple GenBank (http://www.ncbi.nlm.nih.gov),有大量的est表现出高度的相似性拟南芥bHLH TF(转录因子)从BLAST中搜索。利用半定量RT-PCR进行差异表达分析,鉴定苹果中与冷诱导相关的bHLH EST,并利用该方法分离出差异表达EST(图)1).随后,在est基础上,利用RACE技术克隆了全长cDNA在网上克隆。此后,基因被称为MdCIbHLH1(诱使bHLH1;Genbank登录号ABS50521)。
MdCIbHLH1基因表达、序列分析及亚细胞定位.(A)半定量RT-PCR分析MdCIbHLH1在25°C和4°C。苹果组织培养处理4 hmdcibhlh1,atice1和AtICE2.(C)含有MdCIbHLH1和bHLH蛋白的系统发育树拟南芥.实心圆代表MdcibhlH1,而空循环代表拟南芥ICE1和ICE2 bHLH转录因子。(D) bHLH结构域在MdCIbHLH1和其他bHLH转录因子(AtICE1: AT3G26744;AtICE2: AT1G12860;CbICE1: AAS79350;GmICE1: ACJ39211;OsICE1: NP_001045272;PtICE1: ABF48720;PsICE2: ADK91821;GmICE4: ACJ39214;PsICE1: ABF48720; ThICE1: BAJ34291; GmICE2: ACJ39212; GmICE3: ACJ39213) proteins. The bit score indicates the information content for each position in the sequence. (E) Three onion epidermal cells producing GFP alone. (F) An onion epidermal cell producing the MdCIbHLH1-GFP fusion protein.
序列分析表明,该基因的开放阅读框(ORF)中存在3个内含子MdCIbHLH1以及长度为1113 bp、230 bp、169 bp和84 bp的四个外显子1 b).的MdCIbHLH1ORF全长1596 bp,编码531个氨基酸残基,分子量为57.4 kD。
利用MEGA 4.0程序构建bHLH蛋白系统发育树。为了这个分析,一切拟南芥bHLH蛋白和MdCIbHLH1蛋白纳入并比对。MdCIbHLH1蛋白与atbhlh16 (AtICE1)和AtbHLH033 (AtICE2)聚在同一分支内(图2)1 c).此外,基因组比较显示mdcibhlh1,atice1和AtICE2基因所有含有四个外显子,表明类似的基因组组成(图1 b).
预测的MdCIbHLH1蛋白包含一个保守的bHLH结构域和一个核定位信号http://www.bioinfo.tsinghua.edu.cn/SubLoc/.MdCIbHLH1的bHLH结构域与其他植物ICE蛋白的bHLH结构域高度相似(图)1 d).
推测的MdCIbHLH1细胞核定位信号足以将GFP融合蛋白导向细胞核。通过引入MdCIbHLH1之间的翻译融合来研究MdCIbHLH1的亚细胞定位MdCIbHLH1和GFP.进入洋葱表皮细胞使用农杆菌属介导的转换。细胞表达MdCIbHLH1:绿色荧光蛋白融合基因仅在细胞核内显示GFP荧光(图)1 f),细胞表达GFP.单独显示GFP荧光贯穿整个细胞(图1 e).这一结果提示MdCIbHLH1蛋白亚细胞定位于细胞核。
表达式MdCIbHLH1在不同的组织和对冷压力的反应
MdCIbHLH1采用半定量RT-PCR分析不同组织的转录水平。结果表明MdCIbHLH1在春梢、休眠芽、花芽、花、幼叶、成熟叶、幼果、果皮和愈伤组织中均有不同水平的转录本组成(图)2).确定是否MdCIbHLH1通过冷应激诱导,通过在暴露于4℃的苹果组织培养物中通过半定量RT-PCR分析其表达以进行不同的时间。结果表明MdCIbHLH1在4°C的低温处理下,阳性诱导表达(图2 b).
在拟南芥, AtCBFs是在冷信号通路中作用于AtICE1下游的关键成分([9])。在苹果基因组中,有五个CBF基因:MdCBF1(U77378),MdCBF2(AF074601),MdCBF3(AF074602),MdCBF4(nm_124578)和MdCBF5(nm_101131)。系统发育分析表明,五种MDCBF在其他植物物种中的CBF高,包括葡萄,杨树,番茄,拟南芥和大米(图2摄氏度).有趣的是,这五种表情MdCBFs在4°C低温处理下MdCIbHLH1(图2 b),这表明MdCIbHLH1可以作为上游的MdCBFs.
MdCIbHLH1调节ATCBFS.通过与他们的启动子结合拟南芥
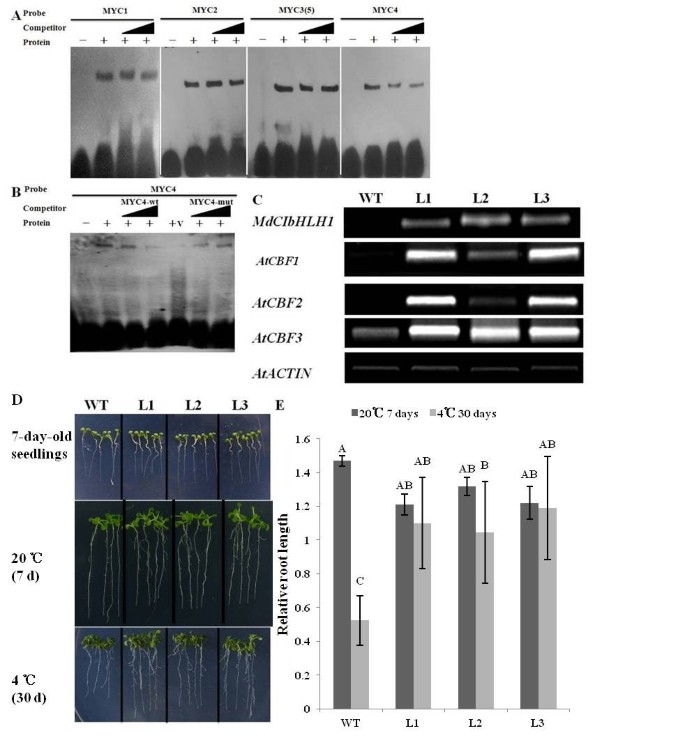
MdCIbHLH1与AtICE1和AtICE2的相似性表明其功能可能与AtICE蛋白相似。为了检测MdCIbHLH1蛋白是否像AtICE1一样与与冷信号相关的MYC识别位点结合,我们进行了EMSA研究,以评估MdCIbHLH1与四个CANNTG基元MYC1、MYC2、MYC3(5)和MYC4的dna结合能力ATCBF3推动者[9].观察到MYC4的条带发生了位移(图3).当加入到反应中100倍和400倍过量的未标记的竞争对手DNA探针时,减少了换档带的存在(图3).相反,与野生型竞争者相比,突变竞争者对MdCIbHLH1和MYC4片段之间的结合影响较小(图)3 b).因此,过量的非标记探针干扰了标记MYC4启动子片段的特异性结合。非特异性竞争者没有这种作用,表明MdCIbHLH1蛋白特异性地结合在MYC4识别位点ATCBF3启动子。
MdCIbHLH1与ATCBF3促进剂和增加耐冷性拟南芥.(a)MdcibhlH1蛋白与标记的MyC1,MyC2,MyC3(5)和MyC4 DNA片段之间的相互作用。(b)与MyC4 DNA片段结合的MdcibhlH1。每个实验中使用的标记探针在每个面板的顶部表示。三角形表示(a)和(b)中用于竞争分析的较多的未标记寡核苷酸的量,对应于每种探针的100倍和400倍。wt,探针完整元素;mut,探针突变元素;v,GS115中表达的空载体的蛋白质产物。(c)转录水平Mdcibhlh1,ATCBF1,ATCBF2和ATCBF3在转基因拟南芥控制条件。从野生型和转基因苗中分离得到RNA。的AtACTIN基因被用作载荷对照。wt,野生型;L1,L2和L3,转基因拟南芥线条。(d)冷却WT,L1,L2和L3幼苗的耐受性。(e)暴露于冷却的WT,L1,L2和L3幼苗的相对根长度。通过Duncan's Multiple Range检验,大写字母表示的值分别不显著,p < 0.01。
MdCIbHLH1与MYC1、MYC2和MYC3探针之间的反应也观察到带移(5)(图)3).然而,未标记的野生型MYC1、MYC2和MYC3(5)竞争者的加入并没有消除这种结合(图5)3),表明MdCIbHLH1与MYC1、MYC2和MYC3的结合(5)不如与MYC4的结合特异性强。这不是AtICE1的情况,它具体地结合了所有四个识别位点[9].
为了进一步描述函数的性质MdCIbHLH1基因,一种包含MdCIbHLH1的推动下CaMV 35 s启动子被基因转化为拟南芥.利用L1、L2和L3三个纯合子转基因株系进行进一步研究。半定量RT-PCR显示MdCIbHLH1三线的转录物比在WT(野生型)控制中。另外,表达了ATCBFS.与对照相比,在3种转基因系中显着增加(图3 c).利用转基因苗进行抗寒性试验。在冷却处理后测量根的相对长度。结果表明,在20℃下,MdCIbHLH1异位表达抑制了转基因植株的根生长Arabidiopsis苗(图3 d e).相反,在4℃下,L1,L2和L3转基因幼苗的相对根长度分别为1.1,1.04和1.19,而WT对照为0.52(图3 d e).因此,异源表达MdCIbHLH1在转基因中授予增强的冷耐受性拟南芥幼苗。
Mdcibhlh1通过苹果中的CBF途径调节耐寒耐受性
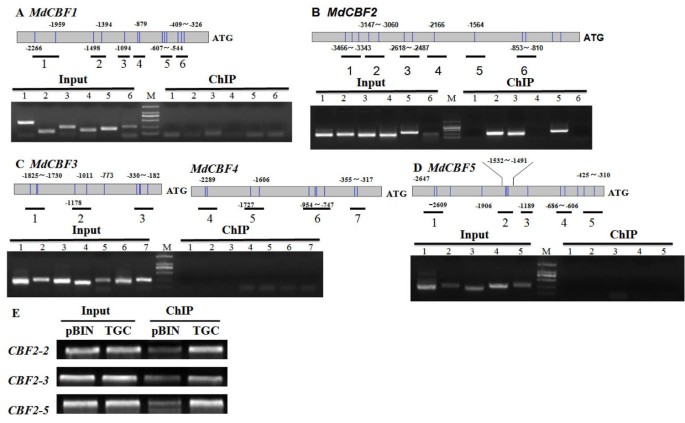
EMSA用于验证MDCIBHLH1对MYC序列的特定结合ATCBF3启动子。五人组的发起人MdCBFs也包含MYC识别位点,通过ChIP-PCR检测MdCIbHLH1蛋白是否与5个启动子结合CBF在苹果的基因。一个mdcibhlh1-gfp.聚变结构由CaMV 35 s使用促进剂被引入苹果组织培养物和愈伤组织农杆菌属介导的转换。使用GFP抗体进行ChIP检测。以空载体转化的转基因愈伤组织ChIP产物作为非特异性对照。在分离交联染色质后,用PCR分析免疫沉淀DNA(图4模拟).结果表明,MdCIbHLH1特异性结合于MdCBF2启动子在三个区域(图4 b).然而,它未能绑定到测试的区域MDCBF1,MDCBF3,MDCBF4和MdCBF5启动子。MdCIbHLH1与MdCBF2在转基因苹果愈伤组织中也观察到了启动子(图)4 e).
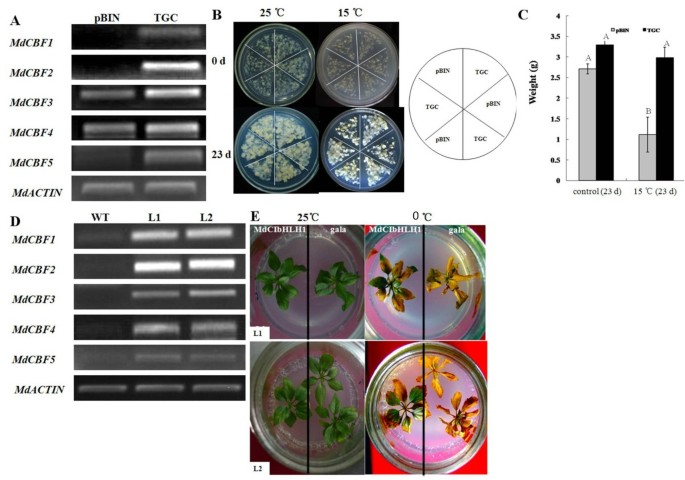
的功能表征MdCIbHLH1在苹果愈伤组织中,表达的转基因愈伤组织线MdCIbHLH1基因称为TGC(转基因愈伤组织)系,以及含有空载体的转基因愈伤组织系pBIN被称为pBIN控件。半定量RT-PCR显示较高的转录水平MdCIbHLH1在TGC线中比在pBIN控制中,表明MdCIbHLH1基因在TGC系中过表达。另外,表达了MDCBF1,MDCBF2,MDCBF3,MDCBF4和MdCBF5与pBIN对照相比,TGC线上调(图5),进一步表明MdCIbHLH1在上游的函数MdCBFs并通过直接与MdCBF2启动子。这些结果表明MdCIbHLH1过度表达在TGC线路中赋予增强的冷却耐受性(图5 c).
抗逆性试验MdCIbHLH1在转基因苹果.(A)半定量RT-PCR分析MDCIBHLH1,MDCBF1,MDCBF2,MDCBF3,MDCBF4和MdCBF5在转基因苹果愈伤组织中含有空载体(pBIN)或MdCIbHLH1基因(TGC)。模板起始量的差异使用归一化处理MdACTIN表达式。(B)转基因愈伤组织在胁迫条件下的照片。上面的面板代表应力分析前的老茧。下面的面板显示了在15°C下生长了23天的老茧。右边的这个周期是一个板上愈伤组织分布的草图。(C)经过应力处理的愈伤组织的重量增量,如(B)所示。误差棒表示三个独立实验的标准误差。(D)半定量RT-PCR分析Mdcibhlh1,mdcibhlh1,mdcbf1,mdcbf2,mdcbf3,mdcbf4和MdCBF5在转基因和非转基因苹果组织培养苗。将模板起始量的差异归一化为MdACTIN表达式。(E)将WT、L1和L2苹果组培苗在0°C下培养7天,然后在正常生长条件下再生长7天。WT,野生型;L1和L2,转基因苹果系。通过Duncan's Multiple Range检验,大写字母表示的值分别不显著,p < 0.01。
在转基因苹果组织培养中,对MdCIbHLH1的功能进行了表征。半定量RT-PCR显示高转录水平MdCIbHLH1在2个转基因株系L1和L2中,表明MdCIbHLH1基因在这些转基因株系中过表达。此外,MdCIbHLH1的表达被发现上调MDCBF1,MDCBF2,MDCBF3,MDCBF4和MdCBF5(图5 d),进一步证实MdCIbHLH1工程的上游MdCBFs.wt和MdCIbHLH1在MS培养基上生长的转基因素暴露于0℃温度7天。在7天的回收后,WT控制几乎已经死亡,而2种转基因系仍然存在(图5 e).MdCIbHLH1因此,过表达提高了转基因苹果系的抗寒性。
过度表达MdCIbHLH1在烟草
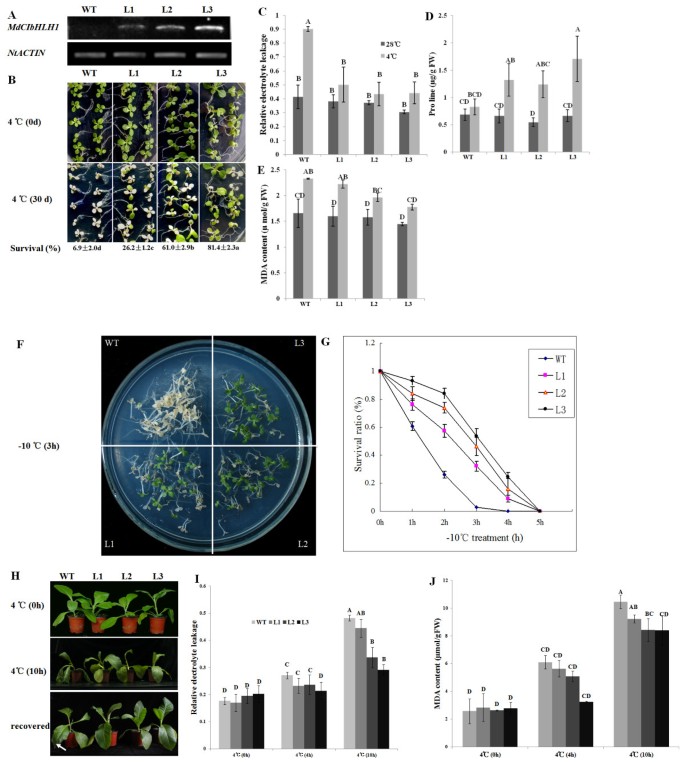
检查…的功能MdCIbHLH1在另一种作物中,转基因烟草植物异体表达MdCIbHLH1基因。半定量RT-PCR结果表明MdCIbHLH1基因在转基因烟草株系L1、L2和L3中以不同水平异源表达(图3)6).使用15天龄幼苗来检查对寒冷的压力的耐受性。在将幼苗保持在4℃下30天后,确定其存活率。结果表明,L1,L2和L3幼苗的存活率分别为26.2±1.2%,61±2.9%和81.4±2.3%,而WT对照为6.9±2%(图6 b).此外,与野生型相比,3个转基因品系产生更多的保护性脯氨酸,但表现出更少的损伤,这从低温条件下MDA含量和电解质泄漏量的降低可以看出(图)6汉英).不齐的MdCIbHLH1因此,表达赋予转基因烟草植物的增强的冷却耐受性。还用于评估凝固耐受性的十五天幼苗。结果表明异位表达MdCIbHLH1显著提高了L1、L2和L3幼苗的抗冻性(图3)6做减法).3个转基因株系的成活率与表达量呈正相关MdCIbHLH1,表明其增强的耐受性来源于异位表达MdCIbHLH1.
积累MdCIbHLH1以及MdCIbHLH1烟草的耐冷性.(A)转录水平MdCIbHLH1在转基因烟草。的ntactin.基因被用作载荷对照。wt,野生型;L1,L2和L3,转基因烟草线。(b)冷却WT,L1,L2和L3幼苗的耐受性。(C-E)相对电解质泄漏(C),WT,L1,L2和L3幼苗的脯氨酸(D)和MDA含量(e)暴露于冷却。(f)冻结WT,L1,L2和L3幼苗的耐受性。(g)暴露于冷冻处理的WT,L1,L2和L3幼苗的存活率。(h)WT,L1,L2和L3成人烟草植物的冷却耐受性。箭头表示坏死的叶片余量。(I-J)接受处理的烟草植物中的相对电解质泄漏(I)和MDA含量(J)。 Values indicated by the capital letters are not significant atp< 0.01,根据邓肯多重范围测试。
成体植物也被用来评估低温胁迫的耐受性。结果表明,与WT相比,L1、L2和L3植株表现出更强的抗寒性(图3)6小时).在4°C处理后10小时,WT植物开始枯萎,而转基因植物在外观上接近正常。在正常条件下2小时恢复后,WT植物在叶子边缘显示坏死,而三种转基因系列完全恢复(图6小时).此外,转基因植物产生的MDA比野生型植物少得多,因此其膜系统受到的伤害也更小,这可以从低温胁迫下相对于野生型植物的电解质泄漏减少中看出(图)6 i j).
连同,这些数据表明了MdCIbHLH1与各种植物的耐冷性有关。
MdCIbHLH1蛋白通过泛素化和sumo化修饰
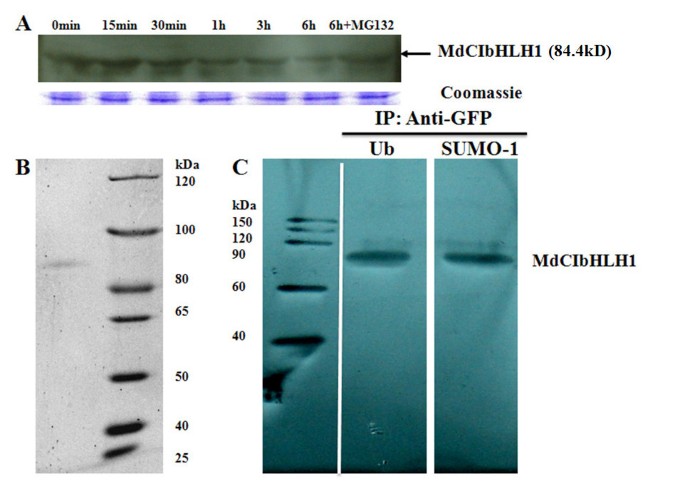
为测定MdCIbHLH1-GFP融合蛋白在冷胁迫下的稳定性,采用转基因苹果愈伤组织进行免疫印迹。结果显示,MdCIbHLH1蛋白在冷胁迫6 h后逐渐降解到非常低的水平。然而,26S蛋白酶体特异性蛋白酶抑制剂MG132显著抑制了冷诱导蛋白的降解(图)7一个),提示泛素化相关蛋白酶体参与了这一过程。因此,除了冷诱导的转录外,低温还可能通过在翻译后水平上调节MdCIbHLH1的蛋白质丰度来影响其活性。
有报道称,AtICE1蛋白在低温下通过泛素-蛋白酶体途径降解[30.].此外,泛素化作用可作为泛素拮抗剂[31].为了确定通过泛素化或SuMoylation修饰MdcibhlH1蛋白,使用TGC线中的抗GFP抗体免疫沉淀MdcibhlH1-GFP蛋白(图7 b).用抗泛素抗体和抗sumo抗体分别检测沉淀蛋白,以确定泛素化和sumo化修饰的发生。两种抗体均检测到阳性信号(图)7 c),提示MdCIbHLH1蛋白的泛素化和sumoylation发生在TGC愈伤组织的体内。
讨论
在这项研究中MdCIbHLH1该基因是从苹果中分离出来的,基于其对冷处理反应的差异表达。它编码bHLH TF。bHLH转录因子代表了一个包含保守bHLH结构域的蛋白质家族,bHLH结构域是一种参与DNA结合的基序[32].bHLH蛋白通过启动子区域的序列特异性相互作用调节下游基因[32].MdCIbHLH1基因结构和氨基酸序列高度相似拟南芥ICE1及ICE2 [9,33,表明它可能是ICE蛋白在苹果中的同源物。这与事实相符MdCIbHLH1通过冷胁迫诱导ICE1和ICE2的表达拟南芥[9,33].然而,MdCIbHLH1被发现有比序列更长AtICE1和AtICE2与苹果相比,苹果的基因组更大拟南芥.
在拟南芥,ICE1通过与促进剂中存在的Myc识别位点结合来直接起坐CBF的上游CBF基因,这种结合随后引发了cbf /羧酸调节子(9,27].在拟南芥, AtICE1和AtICE2可分别直接调控AtCBF3和AtCBF1 [9,33].在本研究中,发现MdCIbHLH1蛋白结合到MYC识别位点ATCBF3和MdCBF2利用EMSA和ChIP-PCR进一步证实其功能与ICE蛋白相似。然而,MdCIbHLH1特异性结合到MYC的启动子中四个假定的识别位点中的一个ATCBF3,而AtICE1与所有4个MYC位点结合。然而,在apple中,MdCIbHLH1只与MdCBF2启动子。根据具体结合,观察到表达的最大增加MdCBF2,但表达的其他4MdCBF基因也增强了。这可以通过MDCIBHLH1和犬的不完全保护来解释,或者启动子的其他识别位点的存在MdCBF基因。此外,MDCBF2可以调节其他表达MdCBF基因,就像AtCBFs拟南芥[17].
CBF冷响应途径是一个重要的低温基因网络,有助于耐冷([7- - - - - -9])。DREB1B / CBF1 DREB1A / CBF3和DREB1C / CBF2被冷诱导拟南芥.过度表达DREB1A / CBF3和DREB1B / CBF1基因增加了转基因植物的耐寒性拟南芥、油菜籽、烟草、蕃茄及稻米[20.- - - - - -22].此外,编码CBF/DREB转录激活子的基因也与苹果耐冷性的增强相关[23,24].
占主导地位的突变ICE1.挡冷感应CBF3规管及削弱冷冻及冷藏容忍度[9].相比之下,ICE1.过表达不仅增加了野生型植物的耐寒性拟南芥而且还在其他植物,如黄瓜和米[28,29].在拟南芥,最近鉴定的阳性调节剂,ICE2,其是BHLH转录因子,参与通过冷适应依赖性途径冻结的反应[33].在这项研究中,MdCIbHLH1过表达导致表达升高CBF基因增强对冷胁迫的耐受性。这些数据表明MdCIbHLH1作为CBF途径中的信号转导组分,与Apple的耐冷耐受相关,就像这种情况一样冰基因在拟南芥[9].
在拟南芥,寒冷通过蛋白酶体途径诱导AtICE1蛋白水解[30.].已经表明,ATECE1的泛素由HOS1在体外和体内介导[30.].此外,ATSIZ1介导的SUMO缀合/ ATICE1的欺诈是低温耐受性所需的关键过程[31].与Atice1不同,Atice2不参与泛素依赖性蛋白质[33].本研究结果表明,MdCIbHLH1蛋白在低温条件下被降解,MdCIbHLH1通过泛素化和sumoylation途径被修饰。然而,MdCIbHLH1蛋白没有与AtHOS1或AtSIZ1相互作用(数据未显示)。我们的结果表明,MdCIbHLH1蛋白的降解依赖于苹果中其他泛素和SUMO E3连接酶的存在。
CBF途径也在树中运行[34].众所周知,在生长已经恢复时发生早春冷害和晚春霜冻可能通过直接冷害或间接影响授粉和坐果效率而对苹果作物造成损害[2,3.].的表达MdCIbHLH1是由冷敷引起的,这表明MdCIbHLH1基因可能参与了苹果组织的抗寒保护。
结论
在这项研究中,我们孤立苹果BHLH(基本螺旋环 - 螺旋)基因MdCIbHLH1(诱使bHLH1).响应于冷应激明显诱导其表达。它编码了冰蛋白质。通过冷处理诱导MdcibhlH1蛋白的降解,潜在的是普发化和苹果中的尤利化的介导。此外,EMSA和CHIP-PCR核实MDCIBH11蛋白特异性地与MYC识别序列的启动子ATCBF3和MdCBF2基因。结果,异位表达MdCIbHLH1增强转基因植物的耐寒性拟南芥通过上调烟草和苹果幼苗或植物的表达cbf基因通过CBF(C重复结合因子)途径。因此,MDCIBHLH1以不同植物物种的CBF依赖性方式在耐寒耐受。反映其在耐寒性中的作用,MdcibhlH1可以是用于克服冷应激并在寒冷的温度条件下提高苹果作物生产率的适当基因。
方法
植物材料
苹果(苹果属国内简历。在25±1°C、16小时的光周期下进行基因克隆和基因转化。‘Orin’苹果愈伤组织在25±1℃暗培养,用于遗传转化。拟南芥(生态型‘Columbia 0’)在20±1°C、16 h光周期下生长,用于遗传转化。烟草(烟草tobaccuml‘NC89’)在25±1°C、12 h光周期下生长,用于遗传转化。取‘Royal Gala’的离体组织培养物,冷藏(4±1℃)后进行表达分析。
半定量RT-PCR检测基因表达
从苹果中提取了总RNA拟南芥根据制造商的说明,分别使用RNAPLANT Plus试剂(天根)和Trizol试剂(Invitrogen,USA)的样品。根据制造商的说明,使用Primescript第1链CDNA合成试剂盒(Takara,Japan)合成第一链cDNA。
PCR反应混合物含有200 ng cDNA,每10 mM引物1 μl, 10× Taq DNA聚合酶缓冲液2.5 μl2+(20 mM)、2 μl脱氧核糖核酸(dNTP) (2.5 mM)和0.25 μl 5 U/μl transstaq DNA聚合酶(Trans, China),反应体积为25 μl。半定量RT-PCR反应周期为25 ~ 30个。MdACTIN用于标准化cDNA装载。以下引物用于PCR反应:MdcibhlH1S:5'-Atggacgacggggaggac-3',Mdcibhlhla:5'-ggaggaggaagagtccac-3';mdcbf1s:5'-cggtgtttcgggggggtgtaag-3';MDCBF1A:5'-AAGTGCCCAGCCAAATCC-3';mdcbf2s:5'-atccgacggccgcagatggca-3';MDCBF2A:5'-CCAACCGGCTGCGCGGAA-3';mdcbf3s:5'-aagcggcgatgatgagaa-3';mdcbf3a:5'-cgtcatcgttgctttcat-3';mdcbf4s:5'-gtcatttgcatccagcac-3';mdcbf4a:5'-ttgtcctcctcactcc-3'; MdCBF5S: 5'-GGAAGCAGCAGAACAGTTT-3'; MdCBF5A: 5'-CACGACATCATCGGCATTG-3';MdACTIN使用先前报道的引物进行扩增[35].
MdCIbHLH1的亚细胞定位
的全长编码区域MdCIbHLH1被融合到了n-末端GFP.在基因的控制下CaMV 35 s启动子。瞬态表达式35 s:: MdCIbHLH1: GFP融合结构和GFP.将对照载体导入洋葱表皮细胞农杆菌属-介导遗传转化法。转化细胞在MS培养基上黑暗培养16-24小时,使用激光共聚焦显微镜(Zeiss LSM510,德国)观察。
电泳迁移率位移法
用于放大的引物MdCIbHLH1ORF分别为MdCIbHLH1-zS, 5'-GCGAATTCATGGACGACAGGGAGGAC-3'和MdCIbHLH1-zA, 5'-GCGCGGCCGCCATCATGCCATGGAACCCG-3',分别含有EcoRI和NotI酶切位点。将扩增的片段插入表达载体中ppiczαa.(Invitrogen公司,美国)用EcoRI和NotI消化。表达载体经BstXI酶切后转化至酵母株GS115。MdCIbHLH1蛋白按照厂家说明书制备。EMSA是根据制造商的说明(Thermo, USA)进行的。双链寡核苷酸MYC1 (CATTTTACAATTGCTTCGCT), MYC2 (CTCTGGACACATGGCAGATC), MYC3(5) (accccaccattttgttaatgc)和MYC4 (ACAATTACAACTGCATGCTT) [9]被用作EMSAS的探针和竞争对手。Myc4-mut(Acaattaacacgtcatgctt)用作突变的竞争对手。
ChIP-PCR化验
芯片分析使用染色质免疫沉淀分析试剂盒(Millipore,美国)和修改版本的制造商说明书进行。通过在培养基中直接加入甲醛至终浓度为1%交联蛋白质和DNA,在培养基中加入终浓度为0.125 M的2 M甘氨酸10 min后停止反应。抗体结合复合物用蛋白A-Sepharose珠沉淀。将免疫沉淀复合物中的DNA片段在65°C下反向交联5小时后释放。纯化的免疫沉淀DNA首先通过PCR分析,并通过凝胶电泳显示。常规PCR所用引物见附加文件1S1:表。PCR条件如下:95℃孵育5 min,激活聚合酶;35次放大循环,在95°C for 20 s, 60°C for 15 s和72°C for 20 s;最后在72°C下拉伸10分钟。结果用与输入DNA的比值表示。
遗传转化MdCIbHLH1
用来扩增的引物MdCIbHLH1cDNA分别为MdCIbHLH1-fS, 5'- ggatggacgacagggga -3'和MdCIbHLH1-fA, 5'-TGCAATCTACATCATGCCATGG-3'。随后,PCR产物克隆到PMD18-T.向量(豆类、日本)。MdCIbHLH1double-digested了Xba我和萨尔然后把它绑在PBI121在矢量的控制下CaMV 35 s启动子。二元结构35 s:: MdCIbHLH1被引入根癌土壤杆菌gv3101,和拟南芥用[36].
A. Tumefaciens.菌株LBA4404含有35 s:: MdCIbHLH1: GFP或35S :: GFP.用二元结构转化苹果愈伤组织。'Orin'苹果的愈伤组织被浸没农杆菌属悬浮培养10 min。愈伤组织在MS 1.5 mg l培养基中共培养-12,4- d和0.4毫克l-1ba25±1°C,在黑暗中保存2天。共培养后,将愈伤组织转移到含1.5 mg l的MS筛选培养基上-12,4- d 0.4毫克l-1ba,100 mg l-1卡那霉素250毫克-1氨基甲霉素。在15天间隔中转移4次愈伤会议以获得转基因愈伤组织。相同的二元构建体用于苹果转换。
苹果叶片被从潜水后4周从体外生长的枝条切除。浸入叶条农杆菌属悬浮培养物10分钟,然后在25±1℃下转移到MS培养基中,在黑暗中在25±1℃下进行2天。随后将叶片转移到含有0.15mg L的MS培养基中-1NAA, 5毫克l-16-BA, 10mg l-1卡那霉素250毫克-1氨基苄西林的再生和筛选。不定芽再生后,转移到含0.5 mg l的MS培养基上-16-BA, 0.1 mg l-1NAA, 10mg l-1卡那霉素250毫克-1氨基甲霉素用于传递。小植物用于进一步调查。
生长旺盛的烟草幼叶切成约1厘米× 1厘米的条状。浸入叶条农杆菌属悬浮培养物10分钟,然后在25±1℃下转移到MS培养基中,在黑暗中在25±1℃下进行2天。随后,将叶片条转移到含有0.2mg L的MS培养基中-1NAA, 3mg l-16-BA, 100mg l-1卡那霉素250毫克-1氨基苄西林的再生和筛选。不定芽再生后,转移到含1.5 mg l的MS培养基上-1NAA 150mg l-1卡那霉素250毫克-1羧苄青霉素加油。生根苗移栽土壤。自花授粉后,利用纯合子转基因株系进行进一步研究。
转基因植物的耐受性分析
用于生长测量拟南芥在4±1℃,光照强度为100-150 μmol m的条件下,维持7日龄幼苗-2证券交易委员会-130天,而在20±1°C相同条件下7天为对照。处理板垂直放置,幼苗处于直立位置。每个处理3个重复。用直尺测量根的相对长度。相对根长计算为根长伸长/原始根长。
Fifteen-day-old TGC (35 s:: MdCIbHLH1: GFP)及pBIN (35S :: GFP.)愈伤组织(0.5 g)进行冷胁迫处理。冷处理:15°C黑暗孵育。对照愈伤组织转移到MS培养基中,在黑暗中再生长23天。体重增量是在这段时间之后测量的。
苹果芽组织培养物在MS营养培养基(含3%蔗糖和0.8%琼脂)上继代培养4周,并检测其耐冷性。在150 μmol m的光照下,在0±1℃下培养7天-2证券交易委员会-1.使培养物在正常条件下恢复7天。
烟草幼苗在含3%蔗糖和0.8%琼脂的MS营养培养基上萌发15 d,测定其耐冷性和耐冻性。低温胁迫是在4±1℃、100 ~ 150 μmol m光照条件下进行的-2证券交易委员会-1.30 d后用目测法测定幼苗成活率。耐冻性试验:将幼苗在4±1°C冷驯化3天,然后在-10°C黑暗冷冻1 ~ 5小时。冷冻后的幼苗在4°C下解冻过夜,恢复到正常状态。3 d后目测成活率。
在盆栽土壤中生长的成年烟草植物也用于评估耐寒耐受性。在16-H Photopheriod下在15±1℃下冷敷48小时,然后在黑暗中暴露在4℃下10小时。经历冷冻处理的植物在正常条件下恢复2小时。
在冷冻试验中,测定了脯氨酸和丙二醛(丙二醛)的含量以及电解质的相对渗漏量,如前所述[37].
蛋白质印迹分析及泛素化和泛素化
western blot分析,将TGC愈伤组织置于15°C黑暗中培养。每个样品共研磨2 g愈伤组织材料,在缓冲液中包含20 mM Tris (pH 7.4)、100 mM NaCl、0.5% Nonidet P-40、0.5 mM EDTA、0.5 mM PMSF和0.5%蛋白酶抑制剂混合物(Sigma,德国)。如前所述,使用抗gfp抗体的蛋白凝胶印迹法测定MdCIbHLH1蛋白水平[38].
对于泛素化和SuMoylation测定,在黑暗中用50μMMg132蛋白酶体抑制剂预处理15日历史的愈伤组织。如上所述提取总蛋白质。使用Pierce Classic蛋白A IP套件(Thermo,USA)和抗GFP(Beyotime,中国)免疫沉淀蛋白质复合物。将所得蛋白质用SDS-PAGE分离并呈上PVDF膜(Roche,USA)。凝胶印迹用抗UB(Sigma,德国)和抗Sumo1(Cell Signaling Technology,USA)抗体探测,并根据制造商的说明使用ECL Plus套件(跨国公司)通过化学发光可视化。
统计分析
这些数据是以三次重复的平均值表示的。采用SAS (Statistical Analysis System)软件(SAS Corporation, Cory, NC, USA)进行分析。
参考文献
- 1.
Cesaraccio C,Spano D,Snyderc RL,Duce P:冷却和强制模型预测作物和森林种类的芽爆。农业森林迈托罗尔。2004,126:1-13。10.1016 / J.AGROMONET.2004.03.002。
- 2.
Farajzadeh M, Rahimi M, Kamalib GA, Mavrommatisc T:模拟伊朗苹果树的萌芽时间和霜冻风险。地球科学进展,2017,36(4):531 - 534。
- 3.
vistal ck:寒冷季节期间的第一和最后一次出现低温。Mon天气修改1971,99:650-652。10.1175 / 1520-0493(1971)099 <0650:Falool> 2.3.co; 2。
- 4.
Agarwal M,Hao Y,Kapoor A,Dong Ch,Fujii H,Zheng X,Zhu JK:R2R3型MYB转录因子参与CBF基因的冷调控和获得的冷冻耐受性。J Biol Chem。2006,281:3766-37645。10.1074 / JBC.M605895200。
- 5.
Thomashow MF:植物冷适应,冷冻耐受基因和监管机制。Annu Rev植物植物植物Mol Biol。1999年,50:571-599。10.1146 / annurev.arplant.50.1.571。
- 6.
关键词:干旱胁迫,低温胁迫,基因表达,调控网络植物营养与肥料学报。2003,6:441 - 446。10.1016 / s1369 - 5266 (03) 00092 - x。
- 7.
Shinozaki K,Yamaguchi-Shinozaki K:对脱水和低温的分子反应:两个应力信号通路之间的差异和串扰。CurrOp植物BIOL。2000,3:217-223。
- 8.
Thomashow MF:那么植物冷驯化领域有什么新发现吗?很多!植物营养与肥料学报。2001,25(4):489 - 493。10.1104 / pp.125.1.89。
- 9.
Chinnusamy V,Ohta M,Kanrar S,Lee B,Hong X,Agarwal M,朱记:ICE1:一种冷诱导的转录组和冷冻耐受性的调节器拟南芥.陈志强。2003,17:1043-1054。10.1101 / gad.1077503。
- 10.
Steponkus PL, Uemura M, Joseph RA, Gilmour SJ, Thomashow MF:动作模式COR15.抗冻性基因拟南芥.美国国家科学院学报。1998年,95:14570 - 14575。10.1073 / pnas.95.24.14570。
- 11.
joglo KR, Kleff S, Amundsen KL, Zhang X, Haake V, Zhang JZ, Deits T, Thomashow MF:组件拟南芥C-repeat/脱水反应元件结合因子冷反应通路在芸苔栗鸟和其他植物物种。植物生理学报。2001,27(4):491 - 497。10.1104 / pp.010548。
- 12.
Gilmour SJ, Zarka DG, Stockinger EJ, Salazar MP, Houghton JM, Thomashow MF:低温调节拟南芥AP2转录激活剂的CBF系列作为冷诱导的早期步骤有限公司基因表达。工厂J. 1998,16:433-442。10.1046 / J.1365-313x.1998.00310.x。
- 13.
Stockinger EJ, Gilmour SJ, Thomashow MF:拟南芥CBF编码一个包含AP2结构域的转录激活子,该激活子与C-repeat/DRE结合,C-repeat/DRE是一种顺式DNA调节元件,在应对低温和缺水时刺激转录。中国科学(d辑):地球科学(英文版)。10.1073 / pnas.94.3.1035。
- 14.
Shinozaki K:两个转录因子DREB1和DREB2分别在干旱和低温响应基因表达中分离出两条信号转导通路,其中DREB1和DREB2具有一个EREBP/AP2 DNA结合域拟南芥.植物学报。1998,10:1391-1406。
- 15.
Shinwari ZK, Nakashima K, Miura S, Kasuga M, Seki M, Yamaguchi-Shinozaki K, Shinozaki K: An拟南芥编码DRE/CRT结合蛋白的基因家族参与低温响应基因表达。生物化学学报。1998,32(5):591 - 598。10.1006 / bbrc.1998.9267。
- 16.
Gilmour SJ, Fowler SG, thomas MF:拟南芥转录激活子CBF1、CBF2和CBF3具有匹配的功能活性。植物学报。2004,54(4):457 - 461。
- 17.
Novillo F, Alonso JM, Ecker JR, Salinas J: CBF2/DREB1C是一个负调控因子CBF1 / DREB1和CBF3 / DREB1在表达和耐受性方面起着中心作用拟南芥.美国国家科学院学报。2004年,101:3985 - 3990。10.1073 / pnas.0303029101。
- 18.
Van Buskirk Ha,Thomashow MF:拟南芥调节冷适应的转录因子。植物营养学报。2006,27(6):751 - 756。10.1111 / j.1399-3054.2006.00625.x。
- 19.
Maruyama K, Sakuma Y, Kasuga M, Ito Y, Seki M, Goda H, Shimada Y, Yoshida S, Shinozaki K, Yamaguchi-Shinozaki K:冷诱导下游基因的鉴定拟南芥DREB1A/CBF3转录因子使用两个微阵列系统。植物学报,2004,38:982-993。10.1111 / j.1365 - 313 x.2004.02100.x。
- 20。
Gilmour Sj,Sebolt Am,Salazar MP,everardJD,Thomashow MF:过度表达拟南芥CBF3转录激活物模拟与冷驯化相关的多种生化变化。植物生理学报。2000,34(4):591 - 598。10.1104 / pp.124.4.1854。
- 21。
谢长廷T,李J, Charng Y,陈M:番茄植物ectopically表达拟南芥CBF1显示出增强的水缺损压力抗性。植物理性。2002,130:618-626。10.1104 / pp.006783。
- 22。
Ito Y, Katsura K, Maruyama K, Taji T, Kobayashi M, Seki M, Shinozaki K, Yamaguchi-Shinozaki K:水稻DREB1/ cbf型转录因子参与转基因水稻冷响应基因表达的功能分析。植物营养与肥料学报。2006,27(4):441 - 446。
- 23。
杨文,刘XD,志克XJ,吴卡,李捷,歌曲LL,刘奇,王毅,王FW,张c,刘y,zong jm,li hy:dwarf苹果mbdreb1增强植物耐受低温,干旱,通过ABA依赖性和无关的途径和盐胁迫。Planta。2011,233:219-229。10.1007 / S00425-010-1279-6。
- 24。
Wisniewski M, Norelli J, Bassett C, Artlip T, Macarisin D:一种新型桃子的异位表达(Prunus Persica)苹果CBF转录因子(马鲁斯×国内)导致短时间的休眠,增强抗寒性。植物学报。2011,33:971-983。10.1007 / s00425 - 011 - 1358 - 3。
- 25.
Abe H,Uraao T,Ito T,Seki M,Shinozaki K,Yamaguchi-Shinozaki K:拟南芥AtMYC2 (bHLH)和AtMYB2 (MYB)在脱落酸信号转导中起转录激活作用。acta botanica sinica, 2017, 36(5): 643 - 648。10.1105 / tpc.006130。
- 26.
植物盐胁迫信号传导中钙结合转录因子的功能分析。中国生物化学学报,2006,30(5):591 - 598。10.1016 / j.febslet.2006.08.050。
- 27.
李波峰,韩德胜,朱克俭:《中国日报》拟南芥冷响应转录组及其对ICE1的调节。植物细胞。2005,17:3155-3175。10.1105 / TPC.105.035568。
- 28.
刘丽,段丽,张娟,张智,米国,任慧:黄瓜Cucumis巨大成功过表达低温诱导的转录组调节因子ICE1.改变了植物的形态特征,提高了植物的耐冷性。中国海洋科学,2010,29(4):429 - 434。10.1016 / j.scienta.2009.11.018。
- 29.
向冬,胡欣,张颖,尹凯:转基因水稻ICE1基因的过表达提高了水稻的耐寒性。水稻科学。2008,15:173-178。10.1016 / s1672 - 6308(08) 60039 - 6。
- 30.
Dong CH, Agarwal M, Zhang Y, Xie Q, Zhu JK: HOS1是一个介导ICE1泛素化和降解的RING E3连接酶。美国国家科学院学报。2006年,103:8281 - 8286。10.1073 / pnas.0602874103。
- 31.
Miura K, Jin JB, Lee J, Yoo CY, Stirm V, Miura T, Ashworth EN, Bressan RA, Yun DJ, Hasegawa PM: siz1介导的ICE1对照的sumo化CBF3 / DREB1表达和抗冻性拟南芥.acta botanica sinica(云南植物研究),2007,19(4):593 - 598。10.1105 / tpc.106.048397。
- 32.
retero- paulet L, Galstyan A, roeg - villanova I, Martínez-García JF, Bilbao-Castro JR, Robertson DL: bHLH家族转录因子的全基因组分类和进化分析拟南芥,杨树,水稻,苔藓和藻类。植物营养与肥料学报。2010,31(4):591 - 598。10.1104 / pp.110.153593。
- 33.
Fursova OV, Pogorelko GV, Tarasov VA:识别冰2是一种与冷适应有关的基因,它决定了植物的耐寒性拟南芥.基因。2009,429:98-103。10.1016 / j.gene.2008.10.016。
- 34.
李春梅,李春梅,李春梅,等:低温胁迫对白桦C-重复结合因子控制基因表达的影响。植物营养与肥料学报。2004,31(4):489 - 498。10.1104 / pp.104.047258。
- 35.
Espley RV, Hellens RP, Putterill J, Stevenson DE, Kutty-Amma S, Allan AC:苹果果实的红色着色是由于MYB转录因子MdMYB10的活性。植物学报,2007,49:414-427。10.1111 / j.1365 - 313 x.2006.02964.x。
- 36.
Clough SJ,弯曲AF:花浸:一个简化的方法农杆菌属介导的变换拟南芥.植物学报1998,16:735-743。10.1046 / j.1365 - 313 x.1998.00343.x。
- 37.
水稻幼苗对盐胁迫的抗氧化反应。植物科学进展,2019,39(4):531 - 534。10.1016 / s0168 - 9452(98) 00025 - 9。
- 38.
Oh E, Yamaguchi S, Kamiya Y, Bae G, Chung WI, Choi G:光通过赤霉素激活PIL5蛋白的降解促进种子萌发拟南芥.植物学报,2006,47:124-139。10.1111 / j.1365 - 313 x.2006.02773.x。
确认
作者感谢日本国家果树科学研究所(National Institute of Fruit Tree Science, Japan)的Moriguchi博士(Takaya Moriguchi)发明了“Orin”苹果愈伤组织。国家自然科学基金项目(no . 30971969);国家高技术研究发展计划项目(no . 2011AA100204);长江学者和高校创新团队资助项目(no . IRT1155)。关键词:岩石力学,数值模拟,数值模拟
作者信息
隶属关系
相应的作者
附加信息
作者的贡献
YJH和XMF设计了研究并撰写了文章。XMF、QZ、LLZ、YQ进行基因克隆和功能鉴定。XBX和HFL参与了EMSA和基因表达分析。YXY和CXY帮助进行数据分析和稿件准备。所有作者阅读并批准了最终的手稿。
作者为图像提交的原始文件
权利和权限
开放获取本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
冯,XM。,Zhao, Q., Zhao, LL.et al。冷诱导的基本螺旋环 - 螺旋转录因子基因MdCIbHLH1在苹果中编码一种类似ice的蛋白质。BMC植物杂志12,22(2012)。https://doi.org/10.1186/1471-2229-12-22
收到了:
接受:
发表:
关键字
- 冷应激
- 电泳迁移率位移法
- 耐寒性
- 冻结公差
- bHLH域