摘要
背景
MicroRNAs是一类小的非编码rna,通过结合靶mRNA调节基因表达,从而导致切割或翻译抑制。NAC蛋白包括NAM、ATAF和CUC,是植物特异性转录因子家族,在植物发育和胁迫调控中发挥着不同的作用。据报道,miR164具有负调控作用母表达,进而影响侧根的发育拟南芥;然而,关于玉米NAC家族和miR164参与侧根发育的研究还很少。
结果
我们收集了175个具有NAC结构域的玉米转录本。其中,7个ZmNACs可能是miR164调控的目标。我们分离了一个基因,叫做TC258020(指定ZmNAC1)来自玉米自交系87-1和宗3。ZmNAC1在根中表达量较高,丰度高于87-1(1.8倍),而侧根较少。的表达水平有显著的相关性ZmNAC1和重组自交系群体的侧根密度。转基因拟南芥的过表达ZmNAC1与野生型相比,侧根增加。这些发现表明ZmNAC1在侧根发育中起重要作用。等位基因表达试验表明,跨调节元件是主要的介质ZmNAC1miR164在87-1和Zong3中有差异表达,进一步分析表明,miR164是一种引导内源性卵裂的反式元件ZmNAC1信使rna。87-1中成熟miR164和miR164前体的表达量均高于Zong3,而与ZmNAC1.此外,等位基因分析表明,顺式调节元件最有可能受到影响Zm-miR164b的表达模式。β-葡糖苷酸酶(GUS)检测结果表明Zm-miR164b87-1启动子GUS活性高于宗3。此外,我们在RIL群体中检测了miR164b的表达,结果表明miR164b在含有87-1启动子的RIL中表达量高于含有Zong3启动子的RIL。
结论
我们的研究结果指出了一种可能的途径miR164b启动子活性导致成熟miR164负调控的不同表达模式ZmNAC1在87-1和Zong3中表达,从而导致侧根表型显著不同。
背景
南汽编码植物特异转录因子的基因影响一系列不同的发育过程。NAC家族蛋白包含一个公认的序列,称为NAC结构域(牵牛花NAM和拟南芥ATAF1, ATAF2, CUC2) [1,2],位于n端区域,但它们的c端序列在长度和氨基酸序列上都有分歧[3.].NAC蛋白构成了一个大家族,共鉴定出109和140种预测蛋白拟南芥和大米,分别[4,5].NAC家族的成员似乎在植物发育过程中扮演着不同的角色。例如,不结盟运动源自petunia [1),CUC2的拟南芥[2)(第一个报道南汽基因)参与茎尖分生组织(SAM)的发育。相比之下,拟南芥南汽基因CUC3已报道有助于子叶边界和芽分生组织的建立[6].另一个拟南芥南汽基因被称为午睡(NAC-LIKE,被AP3/PI激活)被表征为两个MADS盒基因的靶点,APETAL3而且PISTILLATA,控制雄蕊和花瓣的细胞分裂和细胞扩张[7].AtNAC1已被描述为生长素信号通路中的一种中介,激活编码与侧根起始规范有关的分子的基因[8].此外,NAC蛋白还涉及防御和非生物应激反应。一些ATAF亚家族基因,包括StNAC来自番茄和AtAF1-2从拟南芥,已被证明是由病原体引起的攻击和伤害[9].最近,一些南汽基因比如BnNAC从芸苔属植物[10),AtNAC072(RD26),AtNAC019而且AtNAC055从拟南芥[11),而SNAC1[12),SNAC2[13]被发现与植物对各种环境胁迫的反应有关,包括干旱、盐度和/或低温。
MicroRNAs (miRNAs)是一类小的非编码rna,通过引导靶mRNA切割或翻译抑制来调节基因表达[14- - - - - -16].在拟南芥miR164可以靶向5种NAC结构域编码的mrna,包括NAC1, CUC1, CUC2, At5g07680,而且At5g61430信使rna (17].母能够传递促进侧根出现的生长素信号,miR164引导母信使rna,然后是一种裂解机制母mRNA下调生长素信号[8,18].其他研究小组独立报告了mir164介导的调控CUC1[17),CUC2[19,20.],这与分生组织的发育和空气器官的分离有关。
侧根(LR)的发育过程在开花植物和裸子植物中得到了广泛的研究,侧根(LR)开始于主根(PR)的一个特化细胞层(称为中柱鞘)[21,22].在拟南芥和大多数其他双子叶一样,LRs仅由覆盖在发育中的木质部组织上的中柱鞘细胞形成(木质部极点中柱鞘)。在其他物种中,特别是谷物如玉米、水稻和小麦,LRs专门产生于韧皮部极中柱鞘,另有来自内胚层的贡献[23,24].在拟南芥,大量证据表明生长素在侧根发育中起着关键作用。侧根起始始于生长素诱导的IAA14降解。此步骤允许激活ARF7而且ARF19转录因子,然后激活的表达小黑裙/美国手语基因。LBD/ASL蛋白反过来激活细胞周期基因和细胞模式基因,允许形成新的侧根原基(LRP) [25,26].此外,生长素激活转录母,它上调了两个下游生长素反应基因的表达,包括菲律宾而且AIR3刺激LR启动[8].NAC1的转录后和翻译后调控也被报道如下:miR164表达在晚期生长素反应中的作用被旨在清除母mRNA,这将减弱生长素信号,抑制侧根发育[18].一种名为SINAT5的环指泛素E3连接酶促进NAC1的泛素化及其随后的降解,以减弱生长素反应[27].
在本研究中,一个mir164靶向的NAC结构域基因被指定ZmNAC1是从玉米中分离出来的。有人证明ZmNAC1超表达在拟南芥导致侧根数量增加。进一步研究表明,miR164是负调控反式作用因子之一ZmNAC1,导致了不同ZmNAC1自交系87-1和宗3之间的表达差异显著,导致这两个自交系的侧根表型差异显著。此外,我们的分析还表明,玉米的启动子存在变异pri-miR164b在87-1和Zong3中可能是显性顺式元素影响的表达pri-miR164b,导致成熟miR164表达的差异。
结果
玉米中mir164调控的NAC基因的鉴定
在TBLASTN搜索的查询中,使用保守的NAC结构域序列鉴定了玉米中的假定NAC蛋白。利用预测的玉米全长cDNA (PlantGDB)氨基酸序列进行分析。在本研究中,共获得175个推测的玉米NAC蛋白,其中105个来自玉米拟南芥用于构建多遗传树。这些NAC蛋白根据其预测的NAC结构域氨基酸序列可分为3个组和14个亚组(附加文件)1)。据报道,miR164可指导5种靶nac -域转录因子mrna的调控拟南芥[17].以获得假定的mirna调控南汽我们在175个玉米基因中寻找成熟miR164的反向互补位点ZmNACs.玉米miR164序列在http://www.mirbase.org/.七个ZmNAC的基因,TC258020,Zm390255026,Zm029753,Zm020717,Zm020987,Zm4253255028而且Zm017452,被发现是推测的miR164靶基因(附加文件2),并在补充图1(附加文件1)。在这些基因中,其中三个基因对应的氨基酸序列,Zm020987,TC258020而且Zm017452,显示出高度的同源性拟南芥NAC1蛋白(附加文件1)。
推测的mir164调控的表达ZmNAC基因
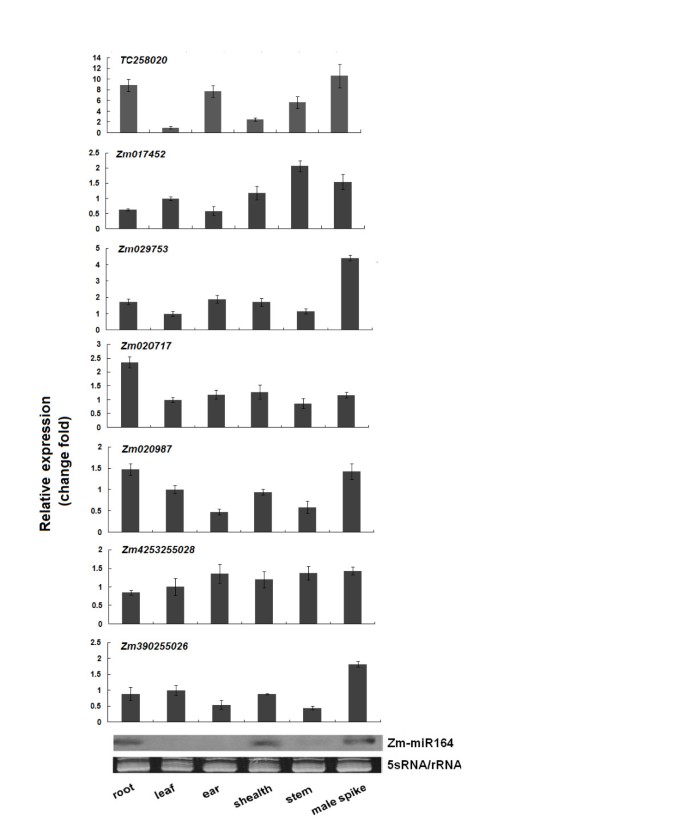
利用玉米根、叶、叶鞘、雄穗、穗和茎6个组织,对含有miR164互补位点的7个NAC基因(tc258020、Zm017452、Zm029753、Zm020717、Zm020987、Zm4253255028和Zm390255026)进行实时PCR检测。由于这些基因在NAC区域表现出高度的序列保守性,因此针对c端区域设计了特异性PCR引物。结果表明,TC258020而且Zm020717根中的表达水平高于其他分析组织,而Zm020987而且Zm390255026在耳和茎中的表达水平低于其他分析组织(图1)。Zm029753而且Zm4253255028在所有器官和发育阶段累积(图1)。最近有人提出miR164可以引导NAC mrna的分裂拟南芥[18].玉米miRNA164的RNA凝胶印迹显示,miR164在根、叶鞘和雄穗中的表达水平高于其他器官(图1)。这种表达模式与miR164的表达模式相似拟南芥,与其他组织相比,miR164在其根和花序中积累得更多[18].miR164在根中较高的表达提示miR164可能靶向根中的NAC基因。
的ZmNAC1玉米根系基因及其表达
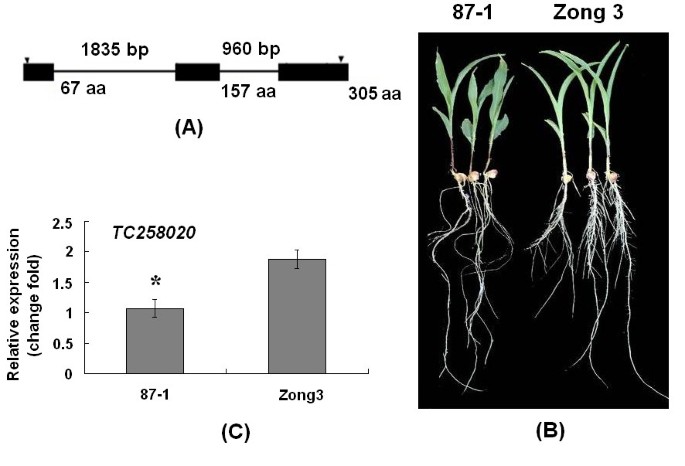
在拟南芥, miR164指导母影响侧根发育的mRNA裂解[18].我们首先试图确定假定的mir164靶点南汽玉米中可能与侧根发育有关的基因。在7个miR164候选靶基因中,TC258020编码305个氨基酸的蛋白质,与拟南芥母,所以我们给这个基因命名ZmNAC1.全长1657 bp的cDNAZmNAC1采用快速扩增cDNA末端(RACE)方法获得。n端残基包含了NAC家族的5个保守同源片段。不同的c端与其他已知蛋白无同源性。我们的分析在氨基酸121和138之间检测到一个假定的二部核定位信号序列(NLS)3.)。根据已发表的玉米基因组序列,ZmNAC1位于第5号染色体上,在其编码区有两个内含子(图2)。
拟南芥母已被证明在侧根发育中起重要作用。确定…假定的生物学功能ZmNAC1在玉米根系发育中,利用自交系87-1和宗3以及一组RIL(由宗3/87-1杂交衍生的重组自交系),在该群体中,无论是两个自交系还是RIL,侧根密度均存在显著差异。87-1和Zong3的侧根密度分别为4.13和6.822 bp < 0.01),在ril中观察到侧根密度有较大幅度的变化(从2.3到12.6)(附加文件4)。
积累ZmNAC1利用实时荧光定量PCR技术测定了自交系宗3、87-1的根系转录本及其RILsZmNAC1与87-1相比,Zong3的表达量高1.8倍(P < 0.05)2摄氏度),在不同RIL系间表达量不同,最高比宗3高1.41倍,比87-1低3.04倍(附加文件5)。确定RIL群体中侧根表型是否与ZmNAC1表达水平,侧根密度与表达水平的相关系数ZmNAC1计算了。这些结果表明,相关系数值达到0.41 (P < 0.01),表明存在差异ZmNAC1表达对侧根表型的贡献为16.8%。基于这些结果,我们认为ZmNAC1在玉米侧根发育中起重要作用,导致自交系宗3与87-1的侧根数差异。
过度的ZmNAC1在拟南芥正向调节侧根发育
以进一步证实的生物学功能ZmNAC1,我们产生了转基因拟南芥植物过度表达ZmNAC1基因。转基因植物35 s: ZmNAC1具有比野生型更早和更侧根的表型。萌发后9天,幼苗生长发育良好35 s: ZmNAC1转基因株系(不包括野生型幼苗)产生侧根。在发芽后11天,我们测量了每厘米主根的侧根数35 s: ZmNAC1结果表明,过表达系和野生型的侧根密度分别为2.45±0.27和0.92±0.18,两者差异极显著(n=18, P < 0.01;t以及)(图3.)。然而,野生型和转基因植物地上部分的生长在表型上没有差异。
ZmNAC1玉米杂交种与亲本间的等位基因表达
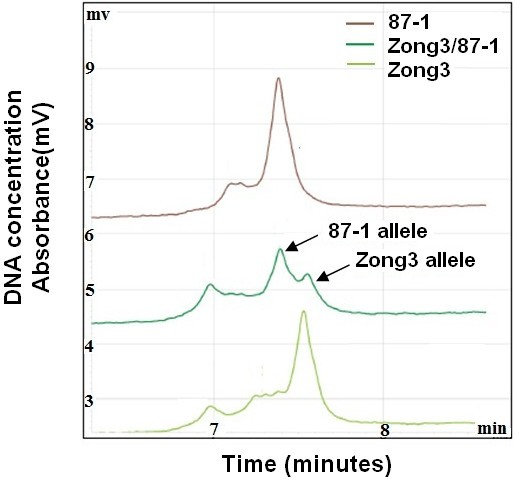
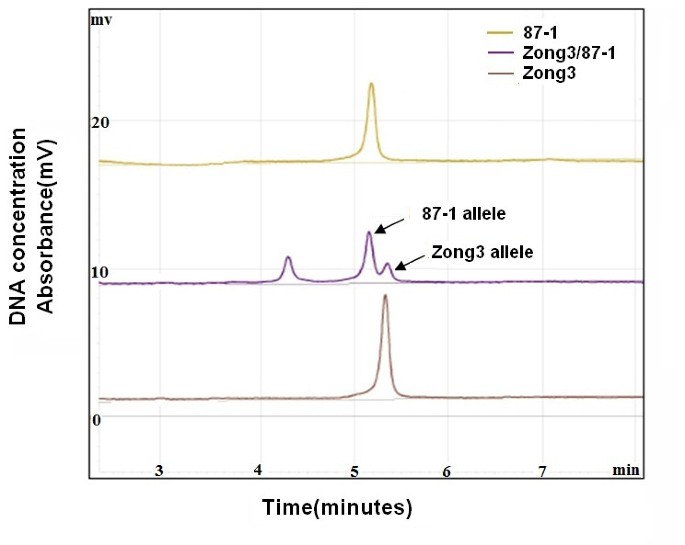
基因调控涉及许多分子间的相互作用。一般来说,顺式监管要素和跨式监管要素都可以发挥重要作用。以确定是否表达ZmNAC1是由顺式、反式或两种机制调控,我们比较了ZmNAC1在宗3、87-1及其杂交体(宗3 /87-1)中,该系统被用于检测等位基因特异性表达。在杂交宗3 /87-1中,对来自宗3母本和87-1父本的两个等位基因进行了比较,发现遗传背景和环境因素对宗3 /87-1的影响相同。与87-1的等位基因相比,宗3的等位基因在5'UTR区域有4 bp的插入,可以区分两个自交系及其杂交种的等位基因;因此,利用等位基因特异性RT-PCR分析检测了这两个自交系和杂交种的亲本转录本积累情况4)。
利用WAVE dHPLC系统进行RT-PCR和等位基因特异性cDNA定量分析。的亲本等位基因ZmNAC1对基因进行了克隆和测序,发现5个基因中等位基因多态性少4个bp”UTR比Zong3有87-1的区域。然后使用为包含4 bp Indel区域的等位基因之间的保守区域设计的引物进行RT-PCR。RT-PCR产物采用WAVE dHPLC系统进行分离和定量。与较早洗脱的87-1等位基因相对应的较短DNA片段相比,与Zong3等位基因相对应的较长DNA片段具有较高的亲和力,因此从WAVE柱中洗脱所需的时间更长。x轴表示DNA片段被洗脱的时间,单位为分钟。y轴表示用于测量DNA浓度或表达水平的紫外线吸收量。该分析量化等位基因特异性转录作为一个相对比率,不测量绝对转录水平。
不同类型的调控分歧可以通过实验检测等位基因特异性基因表达在两个亲本和杂交种。当等位基因在亲本植株和杂交种中的表达差异达到相同程度时,则可以推断出顺式作用的遗传差异[28,29].当等位基因在亲本种中的表达差异大于杂交种时,则可以推断反式作用遗传差异。利用WAVE dHPLC系统计算P-ratio,即两个亲本系中等位基因表达的比例,以及H-ratio,即杂种中来自两个亲本的等位基因的比例。然后,我们检查了是否有两个ZmNAC1等位基因表现为(1)亲本间差异表达(p比≠1),(2)杂交种间差异表达(h比≠1),或(3)亲本间等位基因表达比例与杂交种间差异(p比≠h比)。我们的分析显示H-Ratio为1.15±0.06(与1.0无显著差异)(表1),表明87-1与Zong3等位基因在顺式调控元件上无差异。P-Ratio (87-1/Zong3)为0.58±0.01,与1.0有显著性差异(P < 0.05),与H Ratio不相等(P比≠H比)(表1)1),显示只有跨规管要素有变化。这些发现表明,跨调控元件是基因差异表达的主要中介ZmNAC1在两宗3和87-1之间。
miR164作为反式作用因子调控ZmNAC1
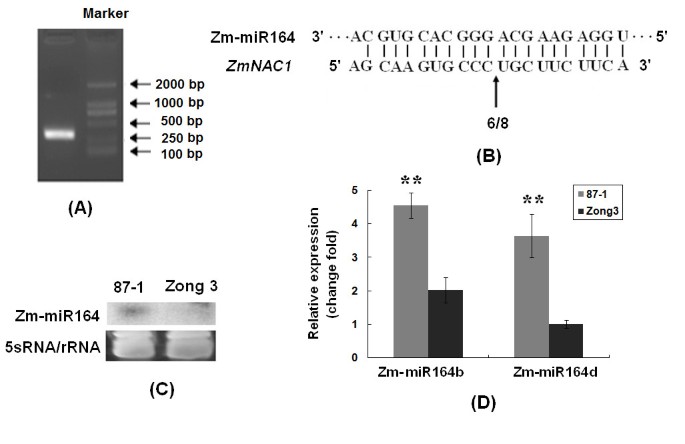
我们评估了玉米miR164是否是反式作用因子,可以指导蛋白的切割ZmNAC1,并证明miR164可以直接表达ZmNAC1mRNA裂解,通过使用修饰的RNA连接酶介导的5' cDNA末端快速扩增(5'-RACE)协议。与miR164互补位点中心对应的5'末端RNA序列始终被检测到是miRNA加工的产物。对8个独立克隆的测序分析得到了相同的结果,并将切割片段的5'端定位在核苷酸991ZmNAC1信使rna。该核苷酸位置位于miR164/的中间南汽mRNA互补区,表明ZmNAC1mRNA是体内miR164的切割靶点(图5和B)。
微分表达式Zm-miR164在87-1至宗代之间。一个.miR164的裂解位点ZmNAC1RNA连接酶介导5检测mRNA表达”竞赛。所得琼脂糖凝胶显示了我们克隆和测序的嵌套PCR产物,预计产物长度约为300 bp。B.对应于裂解位点的5 ' RACE无性系的频率(箭头所示)以分数表示,分母为与目标信息匹配的无性系的数量。C.的RNA凝胶印迹分析Zm-miR16410 μg低分子量RNA,该RNA是从两个独立自交系的8天大根系样品中制备的。使用5S rRNA样本作为加载对照(底部凝胶)。D.表达分析miR164b而且miR164d实时定量逆转录聚合酶链反应(RT-PCR)。采用8天大的根苗样品进行RNA提取。
然后,我们研究了成熟miR164的表达,以确定miR164是否可以作为反式作用的调节因子ZmNAC1,在87-1和Zong3之间也有差异表达。Northern blot分析显示,成熟miR164在87-1中表达水平高于Zong3(图5度),与ZmNAC1两个自交系的表达模式。
在玉米中,MiR164可能从8个位点转录,特别是从miR164a到miR164h。来自这些基因座的成熟miR164在3'端有一到两个核苷酸的差异。我们设计了特异性引物对8种前体进行扩增,只有miR164b和miR164d在根中表达量高于其他组织。由于RNA凝胶印迹中使用的寡核苷酸探针不能区分这八种转录本,我们使用基因特异性RT-PCR来分析pri-miR164的表达。结果显示,pri-miR164b(primary miRNA)和pri-miR164d87-1表达水平分别比宗3高2.4倍和3.6倍(P < 0.01)5 d),提示miR164前体的高表达可能导致87-1中成熟miR164的高表达。
ZmmiR164b玉米杂交种与亲本间的等位基因表达
采用WAVE高效液相色谱(HPLC)系统,测定了两种基因的差异表达ZmmiR164前体由顺式或反式作用机制调节。首先,全长cDNAmiR164b而且miR164d通过5'RACE得到前体,后续序列分析表明,该基因的单转录起始位点为pri-miR164b而且pri-miR164d分别在成熟miR164起始位点上游105和126个核苷酸。以全长cDNA为基础,对宗3和87-1的等位基因进行扩增和测序。的ZmmiR164b与87-1等位基因相比,宗3等位基因插入8 bp;该插入对pre-miR164次级结构的形成没有影响(附加文件)6)。用HPLC法测定亲本间(P值)和杂交种间(H值)的等位基因转录比(图6),结果表明,P比(87-1/Zong3)和H比(87-1/Zong3)分别可达2.39±0.03和2.26±0.45(表1)2)。P比= H比≠1的模式说明在不同的表达模式中均存在一个顺式元素pri-miR164b两个自交系的转录本。因此,启动子之间的序列差异ZmmiR164b的差异表达可能与宗3和87-1的差异表达有关ZmmiR164b.为ZmmiR164d,两个自交系的两个等位基因仅在一个核苷酸上存在差异,因此我们无法用WAVE dHPLC系统检测到等位基因的表达。
RT-PCR及等位基因特异性cDNA定量分析ZmmiR164b与WAVE dHPLC系统。ZmmiR164b与87-1相比,宗3的等位基因有8-bp的插入。然后使用为包含8 bp Indel区域的等位基因之间的保守区域设计的引物进行RT-PCR。RT-PCR产物采用WAVE dHPLC系统进行分离和定量。与较早洗脱的87-1等位基因相对应的较短DNA片段相比,与Zong3等位基因相对应的较长DNA片段具有较高的亲和力,因此从WAVE柱中洗脱所需的时间更长。x轴表示DNA片段被洗脱的时间,单位为分钟。y轴表示用于测量DNA浓度或表达水平的紫外线吸收量。该分析量化等位基因特异性转录作为一个相对比率,不测量绝对转录水平。
的倡导者Zm-miR164b自交系87-1表现出较高的活性
为了提供miR164前体顺式调控的证据,我们分离了miR164前体上游2.6 kb的区域miR164b并从自交系87-1和宗3中鉴定了启动子的活性。序列分析表明,这两个系的启动子具有71.07%的核苷酸同源性miR164b.根据序列多态性,设计特异性引物对两个自交系的启动子进行区分。
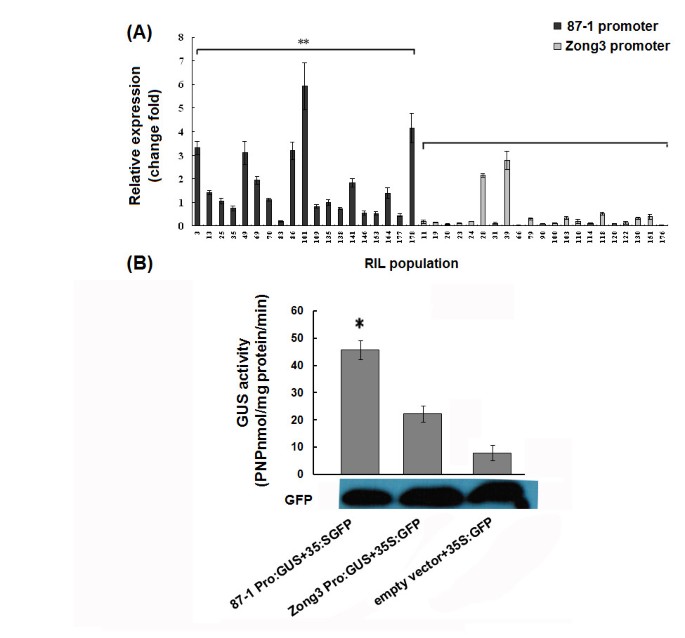
首先,我们测试了是否ZmmiR164b在含有87-1启动子的RIL植株中,转录水平高于含有Zong3启动子的RIL植株。在宗3、87-1及其40个RILs中检测到启动子多态性,其中19个系与87-1启动子相同,21个系与宗3启动子相同。我们进一步检测的表达水平ZmmiR164b结果显示,87-1启动子的RILs的表达量较高,平均为Zong3启动子的4.37倍(P < 0.01)(图7一个)。这些发现有力地表明,miR164启动子的顺式元件是导致基因表达差异的主要因素pri-miR164,可以说,其他因素也可能参与到调控中pri-miR164表达式.
分析pri-miR164b启动子活动。一个.表达分析Zm-miR164bRIL人群中。颜色较深的是与87-1含有相同启动子的RIL系,颜色较浅的是与Zong3含有相同启动子的RIL系。**表示含有87-1启动子的RIL植株与含有Zong3启动子的RIL植株之间存在显著差异。B.GUS活性(nmol PNP/mg蛋白/min)受不同启动子驱动。GUS的活动是由Zm-miR164b87-1和Zong3启动子在烟叶组织中的表达为对硝基酚(PNP) n摩尔mg-1蛋白质分-1.GUS活性的平均值和实验的标准差来自三个独立的烟叶提取物测定。GUS活性差异相对于空向量值的显著性,由学生确定t-测试分析在这里用星号表示(∗P < 0.05)。
为了进一步调查是否ZmmiR164b87-1的启动子具有更高的活性在体外我们设计了一个启动子:GUS报告子,包括87p-ZmmiR164b: GUS(的发起人miR164b从87-1)和宗3p -ZmmiR164b: GUS(的发起人miR164b从Zong3)。用含有这些结构的农杆菌浸润烟叶,用分光光度法分析GUS活性表达。我们还用GFP载体对烟叶进行了转化,以标准化转化效率。我们的结果显示,87-1启动子驱动的GUS活性显著高于Zong3启动子和背景驱动的GUS活性(图7 b),这强烈提示pri-miR164导致了的多样性pri-mir164这可能是导致87-1和Zong3成熟miR164表达差异的原因。此外,表达水平之间的相关系数ZmmiR164b也计算了RILs之间的侧根数,但没有观察到显著的相关性(附加文件7)。
讨论
ZmNAC1在侧根发育中起重要作用
我们进行了分离和表征ZmNAC1该基因是NAC结构域基因家族的成员,也是第一个参与玉米侧根发育的NAC基因。我们证明了ZmNAC1具有与同源基因高度相似的氨基酸,母,在拟南芥据报道,它在侧根发育中也起着重要作用。与它家族的其他成员相比,ZmNAC1根中表达量高于其他组织。此外,ZmNAC1在自交系宗3根部的表达量高于自交系87-1,且自交系宗3的侧根数量高于自交系87-1。由宗3/87-1杂交获得的RIL群体在侧根数和株数上存在显著差异ZmNAC1表达式。各基因表达水平之间存在显著相关性(相关系数值为0.41,P < 0.01)ZmNAC1和RILs的侧根数表型,说明了这一点ZmNAC1对玉米侧根发育有重要作用。过度的ZmNAC1在拟南芥导致侧根数量高于野生型,而在转基因植株中没有检测到其他显著的表型变化。然而,一旦侧根在转基因植物中开始生长,根的发育就不会发生进一步的改变。这些结果表明ZmNAC1特别涉及控制侧根起始。过度表达的转基因植物的表型ZmNAC1与母主要作用于根的,只影响侧根的发育。
尽管如此,我们不能排除……的可能性ZmNAC1在其他发展途径中发挥作用。ZmNAC1穗、茎和雄穗的表达量也高于叶片,因此我们推测ZmNAC1也可能与耳朵和雄性尖刺的分支发育有关。
miR164-mediatedZmNAC1体内mRNA裂解
植物miRNAs已被牵涉到各种发育过程的控制,包括叶片发育[30.- - - - - -32],花卉发育[33]及侧根发育[18].在拟南芥, miR164被预测靶向5个NAC-domain转录本:NAC1, CUC1, CUC2, At5g07680而且At5g61430[17].在这些目标中,CUC1而且CUC2有助于胚胎和花的发育母在侧根发育中起重要作用。在这里,我们提供了miR164指导的证据ZmNAC1在11th这种切割在玉米和玉米之间是保守的拟南芥.此外,ZmmiR164在自交系87-1中表达量高于宗3,而在自交系87-1中表达量与宗3相反ZmNAC1表明miR164负调控ZmNAC1.这些发现证实了这种保守的miRNA可以在进化过程中以保守的途径调节靶基因。
miR164作为反式作用因子导致了ZmNAC1在87-1至宗代之间
等位基因变异分析的结果ZmNAC1在87-1、宗3和杂交宗3/87-1中,反式作用因子,而不是顺式元素,最有可能是导致基因表达差异的主要因素ZmNAC1在87-1至宗代之间。我们进一步分离并比较了1 kbZmNAC1自交系87-1与宗3之间的启动子序列,除1个SNP外无序列差异(附加文件8)。基于ZmNAC1我们认为miR164是调控转录后反式作用因子之一ZmNAC1表达式。的表达水平之间无显著的负相关ZmmiR164b而且ZmNAC1在RIL人群中,提示ZmNAC1也受其他基因调控,如在拟南芥.例如,Xie报道了F-box蛋白TIR1可能参与了泛素介导的调节蛋白的蛋白水解,这些调节蛋白是生长素反应所必需的,并且可以诱导母通过生长素信号[8].
进一步的研究表明,成熟miR164和前体pri-miR164b87-1基因比宗3基因表达量高,ZmmiR164b从87-1显示出较高的体内活性和在体外这可能导致87-1中miR164的表达水平高于Zong3。据报道拟南芥miR164负向调控侧根发育,表明miR164水平的变化与侧根发育呈严格的负相关关系母信使rna水平。miRNA生物发生缺陷的突变植物表现出较高水平的母mRNA和更多的侧根。miRNA164条件过表达减少母mRNA和侧根数。基于我们的研究结果,有可能通过改变miR164通路来改善玉米的根系发育。
拟南芥母已被证明是生长素诱导的侧根起始的转录激活因子。这项研究表明ZmNAC1在玉米侧根的发育中也起着重要的作用ZmNAC1转录后水平的表达由miR164调控。总的来说,我们的数据表明,87-1玉米(侧根比Zong3少)的影响miR164b启动子的活性高于Zong3,导致成熟miR164表达水平升高,进而下调ZmNAC1转录后水平的表达。这一途径可能与87-1中较小的侧根数有关。相比之下,pri-miR164b成熟miR164在自交系宗3玉米中表达量低于87-1玉米,导致miR164在自交系宗3玉米中表达量较高ZmNAC1,因此有助于增加侧根的数量。值得注意的是,在表达水平之间没有检测到显著的负相关ZmmiR164b和侧根数,揭示了RIL群体的复杂性ZmmiR164及其对玉米侧根发育的调控作用。
结论
拟南芥母是生长素诱导侧根起始的转录激活因子。我们的研究表明玉米同源体,ZmNAC1在玉米侧根发育中也起重要作用。我们的研究通过表明ZmNAC1玉米miRNA164在转录后水平调控其表达。总的来说,我们的数据表明,miR164b启动子在自交系87-1玉米中比在宗3玉米中表现出更高的活性,导致成熟miR164的表达更高,而成熟miR164表达下调ZmNAC1转录后水平的表达。这一途径可能导致87-1的侧根数少于宗3。
方法
植物材料和生长条件
玉米(玉米L)自交系87-1和宗3,杂交系宗3/87-1,以及杂种宗3/87-1衍生的40个重组自交系(RIL)。为了进行侧根数量的表型分析,种子在培养皿中蒸馏水浸泡12小时,在室温下萌发。然后将种子放在潮湿的纸巾层之间,在30°C下放置24小时,然后移植到花盆中。种子在蛭石中栽培,不加肥料,在相对湿度为40-60%、昼夜温度为26/24℃的生长室中生长,光周期为16小时/8小时。每种基因型种植8个个体,收集其中一半用于基因表达分析(其余用于侧根密度调查)。所有根样均于发芽后8天上午8:00 - 9:00采集,根样采集时小心用水清洗,不造成任何损伤。手工统计主根侧根数,将侧根数除以主根长度,计算侧根密度参数[34].对侧根进行了3次生物重复,进行基因表达和表型分析。在组织表达谱分析中,采集V3期的根、叶、鞘、V12期的穗和V9期的茎进行real-time PCR和Northern blot分析。
的拟南芥采用Col-0生态型进行转化。在Murashige和Skoog (MS)培养基上4℃春化3 d后萌发。用于转化的植物在持续光照(150 mE/m)下生长2在温室中,温度为22°C。
基因表达分析
对于Northern blot杂交,根据制造商的说明使用Trizol (Invitrogen, Carlsbad, CA, USA)分离总RNA。用0.5 M NaCl和10% PEG 8000沉淀富集低分子量RNA。每通道加载10 μg低分子量RNA,在变性15%的聚丙烯酰胺凝胶上分解,电泳转移到Hybond-N+膜(Amersham生物科学,白金汉郡,英国)。膜用uv交联,在80°C下烘烤2小时。利用T4多核苷酸激酶对miR164互补的DNA寡核苷酸进行末端标记γ-32P-ATP (TaKaRa,大连,中国)。膜预杂交超过8小时,然后在38°C下使用Church缓冲液杂交过夜。印迹在50℃下清洗三次(2 × SSC + 1% SDS清洗两次,1 × SSC + 0.5% SDS清洗一次)。将膜短暂风干,然后在−80°C下暴露于x射线薄膜进行放射自显影。
对于实时PCR分析,总RNA根据制造商说明使用Trizol (Invitrogen, USA)分离,并使用无rnase - DNase I (Promega, Madison, USA)处理。从每个样品中提取2 μg总RNA,在含50 mM Tris-HCl (pH 8.3)、75 mM KCl、3 mM MgCl的20 μL反应中合成第一链cDNA2, 10 mM DTT, 50 μM dNTPs, 200 U M-MLV逆转录酶(Promega, Madison, USA)和50 pmol T15寡核苷酸。37°C逆转录60 min, 95°C变性5 min。根据EST序列设计7个推测miR164靶点的基因特异性RT-qPCR引物。用引物5'- tggcattgtcaacaactg -3'和5'-TCATTAGGTGGTCGGTGAGG-3'扩增250 bp β-actin基因片段作为阳性对照。在体积为20 μL、引物为10 pmol、Tris-HCl (pH8.5) 10 mmol/L、KCl 50 mmol/L、MgCl 2 mmol/L的条件下进行PCR反应2、0.4 μL DMSO、200 mmol/L dNTPs、1u Taq DNA聚合酶(TaKaRa,大连)和0.5 μL SYBR GREEN I.采用以下PCR扩增方案:95°C (3 min)和40个扩增周期(95°C (30 s)、55°C (30 s)和72°C (1 min),使用Opticon PTC200系统(MJ Research, Waltham, MA, USA)。所有反应重复三次,不包括模板和逆转录对照。定量结果根据基线以周期阈值(CT)值表示,调整为0.04。比较CT法(PE Applied Biosystems, Foster City, CA, USA)用于定量与肌动蛋白比较的基因表达。简而言之,每三次CT值取平均值。计算特定基因的CT平均值与β-actin的CT平均值之差为ΔCT样本= CT基因- ctβ肌动蛋白.在最终结果中,样本的相对表达量由2确定——ΔCt方法。使用Student 's检验统计学显著性t-test (P < 0.05)。
mirna引导切割位点的定位
按照制造商的说明使用GeneRacer Kit (Invitrogen USA)进行RACE检测。从87-1幼苗根部提取总RNA,纯化Poly(A)mRNA,并连接到rcm - race 5' race RNA Oligo接头(5'-CGACUGGAGCACGAGGACACUGACAUGGACUGAAGGAGUAGAAA-3')上。将oligo (dT) (15-mer)引物与逆转录酶进行cDNA合成,并将得到的cDNA与5' RACE引物5'-CGACTGGAGCACGAGGACACTGA-3'一起进行第一轮嵌套PCRZmNAC1基因特异性引物5 ' -ACCCAAGCCTCTTGTAGCACTCATC-3'。第二轮采用5' RACE嵌套引物5'-GGACACTGACATGGACTGAAGGAGAT-3'和基因特异性嵌套引物5'-GTCGAGGCATTTCGATCCGCATC-3'进行嵌套PCR。将凝胶纯化的PCR产物克隆到pGEM-T Easy Vector (Promega)中进行测序。
转基因植物的转化载体及构建
对于转基因来说拟南芥植物,构建在二进制向量pcambisuperper1300中。对于质粒super-p:ZmNAC1,正向引物(5'-GC .TCTAGACGCAGAAGTTGACCACGTAC-3')(下划线序列为XbaI位点)和反向引物(5'-GGGGTACC设计ATCCATCCTGTTATCGTCGAG-3'(下划线序列为KpnI位点),引入XbaI和KpnI位点,利用Zong3根cDNA样本扩增出1463 bp的cDNAZmNAC1.该构建物被转化为农杆菌GV3101。六个拟南芥植物经农杆菌介导的花浸法转化[35].转基因植株在含湿霉素b的1/2 MS培养基(Gibco BRL, Grand Island, NY, USA)上选择,T3代用于进一步实验。
农杆菌介导瞬时表达试验和GUS活性测定
来自自交系87-1和Zong3的miR164b启动子被连接到Gateway pDONR 211Vector (Invitrogen USA),然后根据制造商的说明构建miR164b-87-1启动子::GUS和miR164b-Zong3启动子::GUS。两个不同方向的引物(5'-CAAAAAAGCAGGCTGTGATTGACGACAACATGAACAAATC-3 ', 5 ' -ACAAGAAAGCTGGGTCGCAATTCTCGAATTCACCTTC-3 ';(下划线序列为attB1和attB2位点)用于扩增87-1和Zong3的启动子序列。含有启动子:GUS构建物的农杆菌GV3101在酵母浸膏蛋白胨培养基(10 g酵母浸膏、10 g Bacto蛋白胨、5 g NaCl和15 g琼脂/l)上培养,并添加利福平(60 μg/mL)、卡那霉素(50 μg/mL)和大光霉素(100μg/mL)。农杆菌在28°C下培养,6000 g离心15分钟收获,重新悬浮在渗透介质(10 mM MgCl2和含有150 mM乙酰丁香酮的10 mM MES)在室温下2小时诱导T-DNA转移功能[36],然后调整到OD600为0.8。用无针注射器将农杆菌悬浮液渗入烟叶背面后[37],在26°C的潮湿室中保存48 h,用于GUS活性分析。
这些烟叶中的GUS活性的测定方法如Jefferson [38].烟草叶组织均质于1 ml提取缓冲液(50 mM NaH2阿宝4, pH 7.0, 10 mM EDTA, 0.1% Triton X-100, 0.1% (w/v)月桂基肌氨酸钠,10 mM β-巯基乙醇,6 mM l -抗坏血酸)。在12000 rpm(4°C)下离心10分钟后,将上清液转移到新鲜的微管中。分光光度反应在1ml体积下进行,提取缓冲液为1mm PNPG(对硝基苯-β- d -葡萄糖苷),并添加蛋白提取物上清液。GUS活性归一化为各粗提物中蛋白质的浓度,用对硝基酚min/mg蛋白的nmol表示。根据Bradford方法,以牛血清白蛋白为标准定量样品提取物中的总蛋白[39].GUS测量至少重复三次。
采用WAVE dHPLC系统进行RT-PCR分析
根据制造商的说明,使用Trizol (Invitrogen, Carlsbad, CA, USA)分离总RNA。我们使用基因特异性引物(5'-CAGCTCCACACCTGTACGT-3'和5'-CCATGCTCAGCGACTTGATG-3')ZmNAC1, 5'-ACGTGCATTACCATCCAATGC-3', 5'-CTGCATGACGAGGTATGTACG-3'ZmmiR164b),利用RT-PCR从各自交系中获取相应的cDNA。然后对PCR产物进行测序,以鉴定自交系87-1和Zong3之间的等位基因特异性序列多态性,这将允许在WAVE dHPLC系统(Transgenomic, Omaha, NE)上分离两个亲本等位基因。基因特异性引物被设计用于扩增等位基因之间保守的区域和包含序列多态性的区域,以最小化任一等位基因的扩增偏好,并优化扩增子用于WAVE分析。β-肌动蛋白基因片段扩增26次,作为阳性对照。每个RNA样本进行3次PCR重复。RT-PCR产物然后用WAVE dHPLC系统分离和定量,并根据制造商的说明进行详细的WAVE dHPLC分析[40].
参考文献
Souer E, van Houwelingen A, Kloos D, Mol J, Koes R:矮牵牛的No Apical Meristem基因在胚和花的模式形成中是必需的,在分生组织和原基边界表达。细胞科学,1996,85:159-170。10.1016 / s0092 - 8674(00) 81093 - 4。
Aida M, Ishida T, Fukaki H, Fujisawa H, Tasaka M:拟南芥器官分离相关基因:杯状子叶突变体分析。植物科学学报,1997,19(4):344 - 344。10.1105 / tpc.9.6.841。
Ooka H, Satoh K, Doi K, Nagata T, Otomo Y, Murakami K, Matsubara K, Osato N, Kawai J, Carninci P, Hayashizaki Y, Suzuki K, Kojima K, Takahara Y, Yamamoto K, Kikuchi S:水稻和拟南芥NAC家族基因的综合分析。DNA决议2003,10:239-247。10.1093 / dnares / 10.6.239。
Riechmann JL, Heard J, Martin G, Reuber L, Jiang CZ, Keddie J, Adam L, Pineda O, Ratcliffe OJ, Samaha RR, Creelman R, Pilgrim M, Broun P, Zhang JZ, Ghandehari D, Sherman BK, Yu GL:拟南芥转录因子:真核生物全基因组比较分析。科学通报,2000,29(3):349 - 349。10.1126 / science.290.5499.2105。
方勇,游娟,谢坤,谢伟,熊龙:水稻NAC转录因子家族组织特异性或胁迫响应基因的系统序列分析与鉴定。中国生物医学工程学报,2008,29(3):344 - 344。10.1007 / s00438 - 008 - 0385 - 7。
Vroemen CW, Mordhorst AP, Albrecht C, Kwaaitaal MACJ, de Vries SC:拟南芥中CUP-SHAPED COTYLEDON3基因是边界和芽分生组织形成所必需的。植物学报,2003,29(3):344 - 344。10.1105 / tpc.012203。
Sablowski RW, Meyerowitz EM: APICAL MERISTEM的同源物是花同源基因APETALA3/PISTILLATA的直接靶标。细胞科学,1998,32(3):344 - 344。10.1016 / s0092 - 8674(00) 80902 - 2。
谢强,蔡新华,孙晓明,李志强,李志强。拟南芥NAC1基因在TIR1基因下游的生长素信号转导与侧根发育的关系。基因工程学报,2000,30(4):344 - 344。10.1101 / gad.852200。
Collinge M, Boller T:马铃薯两个基因Stprx2和StNAC的差异诱导对疫霉菌感染和损伤的反应。植物化学学报,2001,46:521-529。10.1023 /: 1010639225091。
Hegedus D, Yu M, Baldwin D, Gruber M, Sharpe A, Parkin I, Whitwill S, Lydiate D:甘蓝型油菜NAC域转录激活子在生物和非生物胁迫下的分子表征。中国生物医学工程学报,2003,23(3):383-397。
Tran LS, Nakashima K, Sakuma Y, Simpson SD, Fujita Y, Maruyama K, Fujita M, Seki M, Shinozaki K, Yamaguchi-Shinozaki K:拟南芥干旱诱导NAC转录因子的分离与功能分析。植物科学学报,2004,16:481- 498。10.1105 / tpc.104.022699。
胡华,戴敏,姚娟,肖斌,李霞,张强,熊玲:过表达一个NAM、ATAF和CUC (NAC)转录因子增强水稻抗旱性和耐盐性。自然科学进展,2006,29(4):457 - 457。10.1073 / pnas.0604882103。
胡华,游俊,方勇,朱晓霞,祁忠,熊林:水稻耐寒耐盐转录因子基因SNAC2的鉴定。中国生物医学工程学报,2008,29(3):344 - 344。10.1007 / s11103 - 008 - 9309 - 5。
巴特尔DP: MicroRNAs:基因组学,生物发生,机制和功能。电子学报,2004,34(1):1- 7。10.1016 / s0092 - 8674(04) 00045 - 5。
谢振霞,李志强,李志强,李志强:拟南芥miRNA介导的稻草人样mRNA的分离。科学通报,2002,29(3):344 - 344。10.1126 / science.1076311。
Schwab R, Palatnik JF, Riester M, Schommer C, Schmid M, Weigel D: microrna对植物转录组的特异性影响。生物工程学报,2005,8:517-527。10.1016 / j.devcel.2005.01.018。
Mallory AC, Dugas DV, Bartel DP, Bartel B: MicroRNA对nac结构域靶点的调控是相邻胚胎、营养和花器官正确形成和分离所必需的。动物学报,2004,14:1035-1046。10.1016 / j.cub.2004.06.022。
郭海生,谢强,费建峰:MicroRNA在拟南芥侧根发育过程中调控转录因子NAC1 mRNA的切割下调生长素信号。植物科学学报,2005,27(3):366 - 366。10.1105 / tpc.105.030841。
刘志刚,刘志刚,刘志刚,刘志刚,等:拟南芥分生组织中CUC基因的MicroRNA调控对边界大小的影响。科学进展,2004,31(4):439 - 439。10.1242 / dev.01320。
Baker CC, Sieber P, Wellmer F, Meyerowitz EM:早期额外花瓣1突变揭示了microRNA miR164c在调节拟南芥花瓣数量中的作用。中国生物医学工程,2005,15:303-315。10.1016 / j.cub.2005.02.017。
杜布罗夫斯基JG,罗斯特TL:中柱鞘。生命科学百科全书。编辑:罗伯茨KR. 2005,约翰威利父子有限公司,奇切斯特,英国。
Parizot B, Laplaze L, Ricaud L, Boucheron-Dubuisson E, Bayle V, Bonke M, De Smet I, Poethig SR, Helariutta Y, Haseloff J, Chriqui D, Beeckman T, Nussaume L:拟南芥根维管束的双弓对称围绕中柱胞,并反映在远侧根起始。植物科学学报,2008,29(4):344 - 344。
De Smet I, Vanneste S, Inze D, Beeckman T:侧根起始或新分生组织的诞生。中国生物医学工程学报,2006,30(4):344 - 344。10.1007 / s11103 - 005 - 4547 - 2。
霍赫霍丁格F,齐默尔曼R:根系发育的保守和多样性机制。植物学报,2008,11:70-74。10.1016 / j.pbi.2007.10.002。
深崎H, Nakao Y, Okushima Y, Theologis A, Tasaka M:稳定的孤根/IAA14的组织特异性表达改变拟南芥侧根发育。植物学报,2005,44:382-395。10.1111 / j.1365 - 313 x.2005.02537.x。
Okushima Y, Fukaki H, Onoda M, Theologis A, Tasaka M: ARF7和ARF19通过直接激活LBD/ASL基因调控拟南芥侧根形成植物科学学报,2007,29(3):344 - 344。10.1105 / tpc.106.047761。
谢强,郭海生,郭海生,蔡新华,郭海生,郭海生,郭海生,方s, Weissman AM: SINAT5通过促进NAC1泛素相关降解来减弱生长素信号。自然科学,2002,29(4):344 - 344。10.1038 / nature00998。
闫红,袁伟,王晓明,王晓明,王晓明,王晓明。人类基因表达的等位基因变异。科学通报,2002,27(3):344 - 344。
维特科普PJ,海尔姆BK,克拉克AG:顺式和反式基因调控的进化变化。自然科学,2004,30(4):344 - 344。10.1038 / nature02698。
吴晓东,吴晓东,杨晓明,杨晓明,杨晓明,杨晓明。微rna对叶片形态发生的调控作用。自然科学,2003,29(4):357 - 357。10.1038 / nature01958。
Kidner CA, Martienssen RA:空间受限microRNA通过ARGONAUTE1指导叶片极性。自然科学学报,2004,27(3):344 - 344。10.1038 / nature02366。
Mallory AC, Reinhart BJ, Jones-Rhoades M, Tang G, Zamore PD, Barton MK, Bartel DP:水稻叶片发育中的MicroRNA控制:配对对水稻叶片发育的重要性。中国生物工程学报,2004,23:356- 364。10.1038 / sj.emboj.7600340。
陈欣:拟南芥花发育中作为APETALA2翻译抑制因子的microRNA。科学通报,2004,30(3):344 - 344。10.1126 / science.1088060。
De Smet I, Philip JW, Bengough AG, Lionel D, Parizot B, Casimiro I, Heidstra R, Laskowski M, Lepetit M, Hochholdinger F, Draye X, Zhang H, Broadley MR, Benjamin P’,Hammond JP, Fukaki H, Mooney S, Lynch JP, Nacry P, Schurr U, laple L, Benfey P, Beeckman T, Bennetta M:分析侧根发育:如何前进。植物学报,2012,24:15-20。10.1105 / tpc.111.094292。
Clough SJ, Bent AF:花浸法:农杆菌介导的拟南芥转化的简化方法。植物学报,1998,26(3):344 - 344。10.1046 / j.1365 - 313 x.1998.00343.x。
Hellens RP, Edwards EA, Leyland NR, Bean S, Mullineaux PM: pGreen:农杆菌介导植物转化的一种多功能灵活的二元Ti载体。植物化学学报,2000,42:819-832。10.1023 /: 1006496308160。
金百思,金玉春,申克辉,金俊华:辣椒抗菌斑超敏基因的近等基因系。植物病理学杂志,2007,29(3):344 - 344。10.5423 / PPJ.2007.23.3.155。
Jefferson RA, Kavanagh TA, Bevan MW: GUS融合:hglucouronidase作为一种敏感和多功能的高等植物基因融合标记。杨晓明,2004,30(1):1- 7。
Bradford MM:一种利用蛋白质-染料结合原理定量微量蛋白质的快速灵敏方法。中国生物化学杂志,2003,27(3):344 - 344。10.1016 / 0003 - 2697(76) 90527 - 3。
郭敏,马鲁佩,杨晓霞,胡忠:杂交玉米胚乳中异慢性等位基因变异及其印迹基因。植物学报,2003,36:30-44。10.1046 / j.1365 - 313 x.2003.01852.x。
致谢
国家基础研究计划项目(2012CB910900)、国家863计划项目(2012AA10A309)和国家自然科学基金项目(30930058、30600392、30871529)资助。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
主要实验由李菁和郭光辉进行,并由他们起草手稿,他们对本研究做出了同样的贡献。郭伟伟、郭刚刚和童丹在转基因工作、RIL分析和Northern blot分析方面给予了第一作者很大的帮助。倪忠富对数据进行了分析。Yao Yingyin和Sun Qixin设计了研究并完成了手稿。所有作者都阅读并批准了最终的手稿。
李静、郭光辉对这项工作也有同样的贡献。
电子辅助材料
12870 _2012_1201_moesm1_esm.pdf
附加文件1:175玉米NAC和105拟南芥南汽的蛋白质。采用CLUSTAL X程序和邻居连接法构建NAC蛋白的无根系统发育树。在该图中,105个拟南芥NAC蛋白和175个玉米NAC蛋白被分为三大类,用蓝线分隔。红色弧线代表14个亚群,粉色圆点表示玉米中假定的miR164靶基因。105个拟南芥NAC蛋白的序列来自文献[3.].(pdf 337kb)
12870 _2012_1201_moesm2_esm.pdf
附加文件2:假定的zmacs作为假定的miR164靶基因。该图显示了成熟miR164和7个zmacs的反向互补位点。(pdf 115kb)
12870 _2012_1201_moesm3_esm.pdf
附加文件3:的全长cDNAZmNAC1。该图显示了cDNA的全长ZmNAC1,其中NAC域的高度保守区域被框化;红框表示在氨基酸121和138之间的(NLS)核定位信号。(pdf 125kb)
12870 _2012_1201_moesm4_esm.pdf
附加文件4:图中显示了RILs之间侧根密度的变化。在种子萌发后8d对40株RILs进行侧根密度调查,每个基因型4株。主根中的侧根数手工计数,并除以主根的总长度作为侧根密度的参数(De Smet et al. 2012)。对40个RILs的侧根密度进行方差分析。(pdf 137kb)
12870 _2012_1201_moesm5_esm.pdf
附加文件5:表达水平ZmNAC1瑞来斯。的表达式ZmNAC1在种子萌发后8天,每种基因型分别种植8株植物,收集其中一半进行基因表达分析。(pdf 143kb)
12870 _2012_1201_moesm6_esm.pdf
附加文件6:87-1和Zong3中ZmmiR164b的二级结构。该图为mFold软件测定87-1和Zong3中ZmmiR164b的二级结构。良好的发夹结构表明两者都能产生成熟的miR164。(pdf 103kb)
12870 _2012_1201_moesm7_esm.pdf
附加文件7:40个RILs中侧根数与mir164b表达的相关性。从图中可以看出,在40个RILs中,无论是侧根数还是miR164b的表达都存在较大的差异。计算相关系数值,未发现显著相关。(pdf 178kb)
12870 _2012_1201_moesm8_esm.pdf
附加文件8:比较ZmNAC187-1和宗3之间的启动子。从图中可以看出,在的1kb区域内没有太大的变化ZmNAC1两个自交系之间的启动子,除了一个SNP。(pdf 103kb)
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
李,J,郭,G,郭,W。et al。mirna164定向切割ZmNAC1使玉米侧根发育(玉米l .)。BMC植物生物学12,220(2012)。https://doi.org/10.1186/1471-2229-12-220
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-12-220
关键字
- 玉米ZmNAC1
- miR164
- 侧根