摘要
背景
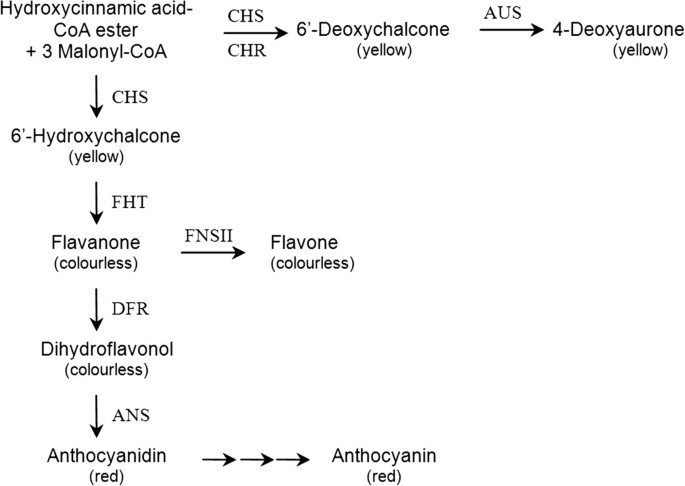
超过20,000个品种的花园大丽花(大丽花摘要Hort。)可提供来自白色,黄色和橙色的花色,每个可想而出的红色和紫色色调。它只有少数种品种是所谓的黑色大丽花,显示出明显的黑色色调。大丽花的花卉颜色是红色花青素,黄色的高氧化物(6'-deoxychalcones和4-脱氧藻酮)和无色黄酮和黄酮醇的结果,这充当了Cupigments。仅当通向花青素的途径不完整时,才会发生白色和黄色。在所有品种中,不受沙棘途径的相同步骤受到影响,但经常观察到缺乏二氢烷醇4-还原酶活性,这似乎基于抑制转录因子DVIVS..本文介绍了迄今为止未知的大丽花黑色分子背景。
结果
黑色品种的花青素积累量较高,但黄酮含量显著降低。在14个品种中,13个品种花色苷途径的酶均有较高的活性,而FNS II活性未被检测到或只有较低的活性。分离FNS II的cDNA克隆和基因组克隆。独立于颜色类型,cDNA克隆的异体表达产生了功能活性酶。FNS II拥有一个不同长度的内含子。定量实时PCR显示FNS II与其他品种相比,黑色品种的表达较低。在转录因子的表达中观察到黑色和红色品种之间的差异静脉注射以及可能的调控基因WDR1,WDR2,MYB1,MYB2,3RMYB和▽或者类黄酮通路的结构基因。尽管FHT表达,黄烷酮3-羟化酶(FHT,同义词F3H)酶活性清楚地存在于黄色和白色品种中。
结论
花青素积累增加,形成黑色开花表型。在大多数黑色品种中,这是由于黄酮积累减少,从而缺乏黄酮作为黄酮形成和花青素途径的共同前体的竞争。低FNS II活性表现为FNS II活性降低FNS II表达式。
背景
大丽(大丽花摘要Hort。)是奥斯特拉科家族的成员,是一个受欢迎的花园花。全球有超过20,000种品种[1].花园大丽花是杂交品种,根据植物的形状和大小及其花序进行分类。从白色和黄色到几乎所有你能想象到的红色、橙色和品红(红色调),有各种各样的花色,但没有蓝色的花色。1].与众多的红色阴影品种相比,只有少数所谓的黑色品种存在(图)1).这些品种经常有富有表现力的名字,如Chat Noir(法语术语黑猫),魔术之夜,阿拉伯之夜和黑杰克。
黑色大丽花品种的例子。一种:简历。业力巧克力,B:简历。Tisa,C:简历。阿拉伯之夜,D:简历。Kenora Macop B.其他品种的照片可以在大丽花目录中找到http://www.dahlie.net/或http://www.dahlienwirth.at/dahliensorten.html.
大丽花花卉颜色仅基于黄酮类化合物和生物化学相关的公园(Chalcones,Aurones)的积累[2- - - - - -4].对大丽花色素的研究始于1956年大丽花物种(2,5].6′-脱氧查尔酮(butein和isquiritigenin的衍生物)和相应的4-脱氧金酮(sulfuretin的衍生物)是黄花颜色的化学基础d .摘要并与橙色和红色形式的花青素(Pelargonidin和Cyanidin的衍生物)混合[6,7].筛选200多个大丽花品种的筛选表明,不同的红色色调基于相同的花青素和花青素浓度的变化,核心结构的修饰模式,也可能是pH的形成不同色调的原因[3.].橙色,玫瑰和淡紫色的品种经常显示出比红色和品种品种的低ocyanin含量较低。在玫瑰和淡紫色的品种的情况下,这似乎主要基于下螯氢酮合酶(CHS)活性[3.].黄色和白色品种不积累花青素由于瓶颈或堵塞花青素途径。虽然没有一般规则,但对于黄色品种,这在黄酮3-羟化酶(FHT,同义词F3H)和二氢黄酮醇4-还原酶(DFR)水平上最常见[3.,最近在一个黄色品种上的基因表达研究证实了这一点DFR,FHT.和答抑制bHLH转录因子引起的表达[8].在大多数白种品种中,相比之下,单独的DFR受到影响[3.],这也反映在7个白色和星型品种的基因表达研究中[9].
除了花青素和6'-deoxychalcones,黄酮和黄酮醇可以在大丽花花中积累[10].尽管本身几乎无色,但它们会影响花色,因为它们与花青素相互作用,从而稳定其结构,对氧化和水解发作敏感[11- - - - - -14].所有测试的品种显示出非常高的黄酮合酶II(FNS II)活性,而黄酮合酶(FLS)活性非常低。因此,假设,黄酮而不是黄酮醇是大麻花中存在的主要分布[3.].
黑色大丽花颜色产生的基础到目前为止还没有被调查过。研究发现,大部分黑色品种的黄酮积累量急剧下降,并伴有低FNS II活性并受到抑制FNS II表达式。由于黄酮的形成与花青素的生物合成竞争常见的中间体,这导致了巨大的花青素浓度建立了黑色品种。
结果与讨论
黑色品种颜料组合物和酶活性
对14个黑色品种的花瓣进行了花青素、黄酮醇和黄酮含量的分析,并与1个白色品种、2个红色品种和2个黄色品种进行了比较。酸性甲醇提取物花色苷含量在7 ~ 32 μmol/g FW(表2)1).因此,黑色品种的含量高于或接近先前报道的红色品种的含量范围[3.].在水解液中,天竺葵苷和花青素均以不同比例存在,而黄色开花cv中未发现花青素。鲁本斯和简历。阿尔瓦的最高或白色开花cv。白色的阿尔瓦。黑色品种的花青素组成不同,花青素的比例在9%之间。黑芭芭拉)和80%(履历。神奇的夜晚)(表1).因此,黑色色调取决于花青素浓度而不是在花青素模式上。水果和鲜花的黑色着色是不频繁的,但在少数情况下已经研究过。在樱桃[11],lisanthus [12],中提琴[13],郁金香[14],罂粟[15),叶麦冬planiscapus[16,甚至在谷物中,如黑米[17].在所有情况下,黑色组织都显示出大量的花青素。
黄色,白色和红色品种提取物包含大量的黄酮(表1和额外的文件1相比之下,这仅在黑色品种中存在低量存在。黄酮醇还存在于白色,黄色和红色的品种中,但仅与黄酮相比,仅在低量的情况下,因此证实黄酮是大丽花花的普遍性的鲜花[3.].与红品种相比,黑色品种的黄酮醇含量增加(表1和额外的文件1).
在所有被测试的所有黑色品种的花瓣的酶制剂中检测到花青素途径的高活性(表2).与此相反,黄色和白色的品种表现出较低或缺乏DFR活性。红色和黑色品种的酶活性无明显差异,但有3个黑色品种(cv.;Chat Noir, Karma Choc和Tisa)的CHS活性高于红色品种,这可能增加了这些品系进入类黄酮通路的通量。然而,14个黑色品种中有13个FNS II活性较低2).使用微粒体制剂证实了这一点,其中富含膜结合酶如F3'H和FNS II。使用来自CV的花瓣的这种制剂。RUBENS,FNS II测定与时间和蛋白质的pH和温度最佳,温度稳定性和线性优化进行了优化。结果总结为在段材料和方法中的花瓣制剂中的FNS II标准酶测定。从黄色CV孵育微粒体制剂。在NADPH存在下具有ERIODICTYOL的RUBENS导致形成单一产品,该产品被鉴定为黄酮叶绿环。在NADPH存在下与Naringenin孵育导致形成三种产物的F3'H和FNS II的齐全活性的艾滋病艾滋病(黄酮),Apigenin(Flavone)和叶黄素(黄酮)。当在标准测定条件下测试黑色品种的微粒体制剂时,当使用ERIODICTYOL作为底物时,不观察到或仅观察到低产物形成(附加文件2),柚皮素经F3'H转化为穗二醇。
FNS II活性的缺乏与黄酮的缺乏有关,并增加了黄酮的可用性,如柚皮素和绒毛膜二醇作为花青素形成的前体。因此,黄酮形成较低有利于花青素分枝,因此在黑色品种中花青素积累量高于平均水平。与黄酮含量下降平行,黄酮醇含量略有上升。剩余的黄酮和黄酮醇可以作为稳定花青素的辅色素,也可以作为分子内的辅色素[18- - - - - -21].事实上,随着花瓣的老化,黑色的颜色会逐渐褪色,旧的花瓣会呈现暗红色而不是黑色(图)1),这一效应在红色品种中没有观察到。与红色品种相比,黑色品种的copigments:花青素的摩尔比急剧下降,可能影响颜色稳定性[21].
大丽花cDNA克隆及其基因组的克隆FNS II
要调查缺乏FNS II活动的原因,我们测试了是否有可能隔离FNS II黑色品种的cDNA克隆。引物(表3.)都是在保护区设计的FNS II在NCBI数据库(登录号:BD270652-BD270670)中,从百合花瓣中分离出cDNA片段。鲁本斯。利用RACE技术获得全尺寸cDNA克隆(GQ479808)。利用特异性引物,获得了黑色品种Chat Noir (GQ489009, GQ489008)和Aurora’s Kiss (GQ489010)的全尺寸cDNA克隆。这表明FNS II至少在一定程度上以黑色品种表达,并且结构基因中的枢转突变导致功能或转录后或翻译后或翻译后调节或过低的表达水平可能是缺乏FNS II活性的原因。
序列高度保守,在氨基酸水平上相似性为97-99%(图)2).从cv的花瓣。鲁本斯和简历。Chat Noir两个等位基因在氨基酸水平上的相似性分别为98%。进一步获得黄色品种Rubens (GQ479809)和Alva’s Supreme (GQ479807)、红色品种Feuerschein (GQ479806)和白色品种white Alva (GQ489011)的cDNA克隆。从序列比较来看,没有根据花色进行区分。
多种氨基酸序列比对FNS II.对比赛进行对齐[38.[并提供从红色栽培Feuerschein(GQ479806),CV中获得的cDNA克隆的比较。白色阿尔瓦(GQ489011),黄色品种Alva的至高无上(GQ479807),CV。Rubens(GQ479808,GQ479809)和黑色品种聊天Noir(GQ489009,GQ489008)和Aurora的吻(GQ489010)。低共识网站以灰色阴影。
此外,相应的基因组克隆FNS II黄色cv。Rubens(登录No JQ731761)和黑色品种阿拉伯夜(登录NO JQ731764),Chat Noir(登录No JQ731765),Karma Choc(登录没有JQ731763)和TISA(登录没有JQ731762)。基因组克隆在同一位置处有一个内含子(在加入中的889中,否JQ731761,Rubens)。然而,内含子长度差异很大(图3.).因此,克隆的大小为2939bp(登录No JQ731761),2704bp(登录No JQ731762),2702(登录No JQ731763),2736bp(登录No JQ731764)和2757bp(登录No JQ731765)。
基因组的多重排列FNS II的核苷酸序列大丽花摘要长的矮。对比赛进行对齐[38.]并提供比较FNS II黄色cv。Rubens (Accession No JQ731761)和黑色品种Arabian Night (Accession No JQ731764)、Chat Noir (Accession No JQ731765)、Karma Choc (Accession No JQ731763)和Tisa (Accession No JQ731762)。一致性较低的网站用黑色字母和灰色阴影显示,其他的用白色字母和灰色阴影显示。内含子所在区域被装箱。
重组酶的功能活性与表征
来调查这些微小的差异是否FNS II所有cDNA克隆均在大肠杆菌中异源表达S. Cerevisiae..假设得到的重组蛋白具有功能活性,并分别催化了柚皮素和绒毛膜二醇中依赖napdh的芹菜素和木犀草素的形成,从而证实了序列上的差异不是关键。重组FNS II的黄色cv。鲁本斯(GQ479808)和黑色cv。Chat Noir (GQ489009)的特征更为详细,从高序列相似性中可以看出,其特征在很大程度上与预期的相同。柚皮素转化的最适pH为6.50,穗二酚为底物的最适pH为7.50。酶在25℃前都是稳定的,最适温度为25 ~ 30℃。反应时间为25 min,蛋白含量可达31 μg (GQ479808)或15 μg (GQ489009)。动力学研究表明K米和V最大限度分别为3.86 μM和22.7 μmol/s*kg和4.2 μM和22.3 μmol/s*kgV最大限度/K米5.9对于柚皮素和5.3分别用于ERIODICTYOL。因此,FNS II显示了两个基材的相对高的特异性。
基因表达研究
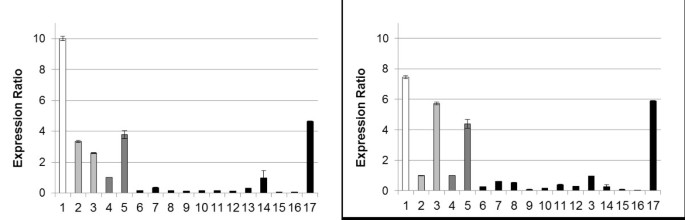
通过定量的实时PCR测量来自类黄酮途径的结构和调节基因的表达,与两个家庭基因相比,肌动蛋白和甘油醛3磷酸脱氢酶(GAPDH).扩增产物的预期大小通过凝胶电泳和熔体曲线分析确定。FNS II在所有品种中表达。然而,黑色品种表现出很低FNS II表达与其他品种相比(图4),但简历除外。黑人芭芭拉,排名第二FNS II表达与测定的相对较高的FNS II活性一致(见表1)2).白色和黄色品种表现较高FNS II表达比红色的简历。在cv中观察到Feuerschein和最高表达量。白色的阿尔瓦(图4).这与在大多数黑色品种中观察到的低FNS II活性密切相关。作为d .摘要是八倍体(2n.=8倍=64.)[22,预计不止一个FNS II副本显示为最近显示的D. VariaBilis Chs.[9].FNS II活动在大多数黑色品种中的下降,这对于大丽花而言是不寻常的[3.,表明存在有效的调控机制,这也可能包括转录后或翻译后过程。
一些研究表明,黄酮途径对花青素积累和花色的影响。非洲菊行不FNSII.表达和FNSII活性没有积聚黄酮,而花青素含量和花色的强度显着增加[23].然而,获得的花青素浓度不足以导致黑色的花朵。反之亦然,改造FNSII.进入紫罗兰导致黄酮的积累,以牺牲花青素的牺牲,显示比野生型花瓣。达芙妮突变体Antirrhinum Majus.缺乏黄酮,开出暗红褐色的花,与红色野生花形成对比[24].
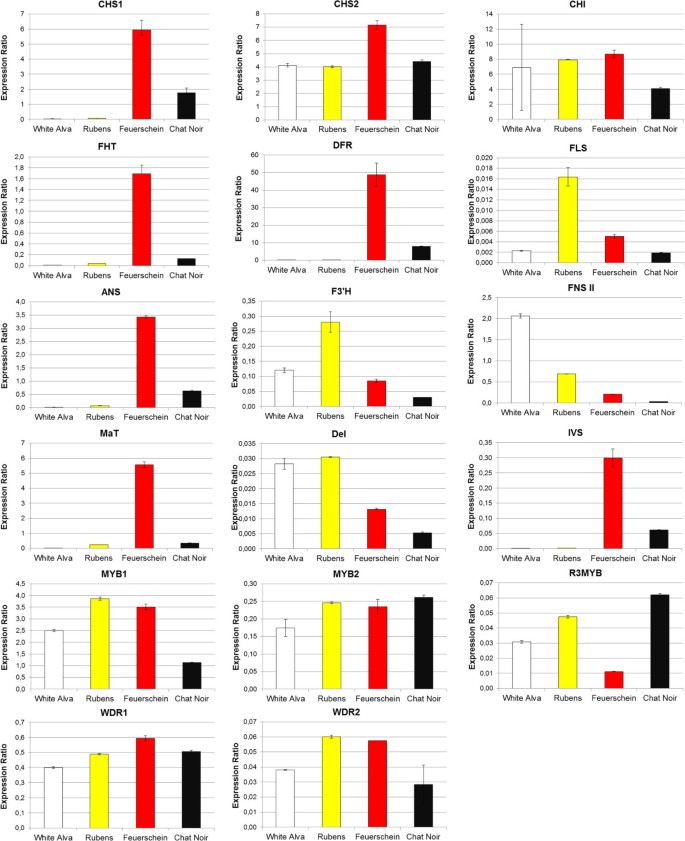
调查转录因素可能的可能参与d .摘要在这一点FNS II抑制,我们确定了7个最近确定的调控基因的表达MYB1,MYB2,R3MYB,WDR1,WDR2和bhlh转录因子▽和静脉注射[8,9,25].类似蛋白质的相互作用导致了调控复合物的形成,该调控复合物控制表皮细胞的细胞身份,包括花青素的形成[26- - - - - -28].14个黑色品种均表现出相似的表达模式3.和4).为了更好的概述和颜色类型之间的比较白色CV中的相对表达式模式。白色alva,黄色的cv。Rubens,红色简历。Feuerschein和黑色简历。聊天中间显示在图中5.转录因子的表达模式遵循红色和黑色品种的相同趋势,并且可以发现任何一般差异可以解释黑色表型,但是一些黑色品种偶尔显示出较低的表达。简历。聊天myb1.或cv。Mythos for.myb2..与颜色有关的唯一区别是被抑制的程度静脉注射如前所报道的在黄色和白色品种中的表达[8].因此,抑制了FNS II表达必须受到其他未知因素的影响。启动子区域的变化不太可能发挥特定作用,因为必须同时影响若干等位基因。
Ohno等人[9]已经证明在大丽花中存在两种不同的查尔酮合酶,每一种都有几个等位基因。CHS 1似乎与花青素的形成有关,因为它的表达模式与FHT,DFR和答由于静脉注射表达并在白色和黄色品种中被抑制。CHS 2.与之相反,是独立于花的颜色表达出来的[9].这也在我们的研究中确认。CHS 1在红色和所有黑色品种中都有表达但在白色和黄色品种中没有,在哪里CHS 2.在所有品种中均有表达(图5,其他文件3.和4).可以推测,两种CHS类型被引入d .摘要由两种不同的野生种类是花园大丽花的母植物[29.,30.].到目前为止同工酶的存在d .摘要只观察到chs。但是,我们的数据表明也不止一个FHT存在基因,因为在黄色CV中测量的FHT酶活性。鲁本斯和白色简历。白色阿尔瓦高于预期FHT在白色和黄色品种中观察到抑制(图5、表2).另外,来自类黄酮途径的其他二氧化基团如FLS,已被证明是接受广泛的基材[31.],可以有助于这些线的观察到的FHT活动。
来自类黄酮途径的结构基因的相对表达在很大程度上是相当的,有时甚至低于红色品种的相对表达。这种基本素地是大多数黑色品种中的花青素形成不是基于诱导的花青素途径,而是仅通过降低的黄酮形成引起的香兰酮中间体的促进助熔剂的结果。只在CV的情况下。黑色芭芭拉,尽管不受无洞的黄酮形成,但存在巨大的花青素形成。另一方面,该品种显示出最高的总表达CHS基因(CHS1.和2)对于所有其他基因也非常高。这可能是对高ocyyanin形成的解释,但我们不能排除进一步的相关因素。表达式malonyl-coenzyme答:花青素-O-malonyltrans-ferase 3-O-glucoside-6”(垫)在黑色品种中差异很大,与花色没有相关性(图5,其他文件3.和4).因此,通过花青素丙二酰化增加花青素稳定性似乎对黑色表型的建立没有作用。有趣的是,malonyltransferase表现出类似的抑制CHS 1, FHT,DFR和答在黄色和白色品种中,表明基因可以用截然不同地涉及红色色素沉着的其他基因进行核心。
结论
在世界范围内持续的大丽花育种已经导致了无数的品种的可用性,其中许多显示红色的色调。然而,大丽花的黑色色调似乎只是偶尔出现。我们首次证明了大丽花对黑色的独特印象是基于大量花青素的积累。在大多数黑色品种中,这似乎是黄酮向花青素通道增加而损害黄酮形成的结果(图)6).这似乎基于低FNS II活动和FNS II其表达不受任何已知的类黄酮途径的转录因子的影响。虽然类黄酮途径为建立白色、黄色、橙色、粉色和红色调提供了很大的可能性,12个品种中有11个品种显示了建立表型的相同的生化和分子背景。的简历。然而,Black Barabara '显示了来自花青素途径的基因的普遍高表达,这可能为尽管黄酮形成量高,但花青素含量高提供了解释。由于苯基丙素途径的改变,更高的底物供应也可能导致花青素形成增强。进一步的调查将需要了解黑色的建立在特殊情况下的履历。黑色的芭芭拉。在大多数黑色大丽花中,对黄酮形成的特异性抑制的分子解释将是特别有趣的。由于大丽花是八倍体植物,且预期存在多个等位基因,因此同时抑制所有FNS II同工酶表明了一种有效的机制,可用于定制黄酮含量的工程植物。
方法
植物材料
大丽花摘要长的矮。简历。阿拉伯之夜,简历。Karma Choc和cv。Tisa来源于Kubelka (Spitz a.d. Donau,奥地利),cv。极光吻,简历。黑杰克,简历。魔法之夜和cv。Negerkopf from Haslhofer (Windischgarsten, Austria), cv。黑芭芭拉来自Aviflora(阿尔斯米尔,荷兰),cv。 Chat Noir, cv. Charles de Gaulle, cv. Kenora Macop B, cv. Rubens, cv. Alva’s Supreme, cv. Feuerschein, cv. Cheerio, cv. White Alva from Dahlien-Kultur Wirth (Vienna, Austria), cv. Meteor, cv. Stefanie Hertel from Paul Panzer (Bad Köstritz, Germany) and cv. Nathal from Dahlien Schwieter (Legden, Germany). According to previous studies [3.],最大瓣长为2.5 cm的开放芽,用于基因表达、酶活性测定和类黄酮含量分析。此外,还对发育完全的花提取物进行了花青素含量的测定。由于菊科植物花序的特殊形状,所有的样品都是不同大小和年龄的花瓣的混合物,存在于各自的花发育阶段。所有样本至少取自10株植物。所有的调查都至少进行了三个生物重复。将植物材料在液氮中冲击冷冻,在−80℃保存。
酶准备
花瓣在砂浆地面0.25 g Polyclar, 0.25 g石英砂和3毫升0.1米三/盐酸(pH值7.25,包含0.4%抗坏血酸钠),然后离心3分钟10000 x g。fn二世和F3'H化验进行使用上层清液或微粒体准备获得根据(32.].其他酶的测定,用凝胶色谱法(Sephadex G25,medium, GE Healthcare)。
化学品
14C]malonyl-CoA购自Amersham International (Freiburg, Germany)p-香豆蔻酰辅酶a (TransMIT, Marburg, Germany),芹菜素,木樨草素,butein,山奈酚,槲皮素,Extrasynthese (Genay,法国)中的3 ',5,7-三羟基-3,4 ' -二甲氧基黄酮。14c]柚皮素,和14C]如上所述合成了ERIODICTYOL [32.].
酶测定
根据[3.].用洛瑞的改性方法进行蛋白质的定量[33.].FNS II的标准含量的最终体积为100 μl 0.046 nmol14C]黄烷酮,20μL微粒体制备,5μL1mmNADPH和75μL0.1MkH2阿宝4含有0.4%Na抗坏血酸(pH6.75)。用70μlEtOAc和10μL乙酸终止反应。将有机相转移至薄层纤维素板(Merck,Darmstadt,德国),并在Caw(氯仿/醋酸/水中:10/9/1)中开发。通过集成峰面积,在Berthold LB 2842 TLC线性分析仪(德国Wildbad)上进行了评估。
色素分析
花青素含量的测定,取0.5 g冲击冷冻花瓣,与2.5 ml 2 M甲醇盐酸混合。悬浮液在19200 × g离心10分钟,用2 M甲醇盐酸调节10 - 140 μl上清液至1000 μl。用DU-65分光光度计(Beckman Instruments)测定在520 nm处的吸收。用市售天竺葵苷氯(Roth,德国)获得的校准曲线计算出天竺葵苷当量的花色苷含量。
对于花青素的酸性水解,将20μl甲醇盐酸提取物与180μl4NHCl混合,并在90℃下温育60分钟。冷却10分钟后,将混合物以10,000×g离心10分钟。将上清液用4N HCl调节至200μl,并使用等分试样用于HPLC分析。对于黄酮和黄酮的酶水解,将20μl甲醇萃取液在40℃下孵育10分钟,10μl溶解在80μl0.1mmcilvaineBuffer,pH 4.0中,溶解在10μl溶液酶(Sigma-Aldrich,奥地利)。通过加入40μl甲醇并进行HPLC分析,停止反应。HPLC分析根据[34.使用Perkin Elmer系列200高效液相色谱系统,配备Perkin Elmer系列200二极管阵列探测器和Total Chrom Navigator,版本6.3.1 (Perkin Elmer Inc)。色谱柱为BDS Hypersil C18高效液相色谱柱,5 μm, 250 × 4.6 mm (Thermo Scientific)。定量方法以3′,5,7-三羟基3,4′-二甲氧基黄酮为内标。
克隆相应的FNS II cDNA克隆及基因组FNS II
mRNA被隔离大丽μMACS mRNA Isolation Kit (Miltenyi Biotec, Bergisch-Gladbach, Germany)。利用RevertAid H Minus MuLV逆转录酶(Fermentas Life Science, St. Leon-Rot, Germany)和oligo(- dT) anchor引物制备cDNA3.).分离的引物FNS II从大丽花被设计使用FNS II该序列在NCBI GenBank (BD270652-BD270670, AF156976, AF188612)中获得。选择编码序列外的引物(FNS1、FNS4,表)3.).将获得的cdna片段分离,连接到载体pCR®2.1-TOPO (Invitrogen, Paisley, UK)中,转化E.coli.(TOP10, Invitrogen Paisley,英国),并由商业供应商(StarSEQ,美因茨,德国)进行测序。利用获得的序列信息设计特异性引物(FNSIIRub-ex,表)3.).使用扩大的高保真PCR系统(Roche,Mannheim,Germany)进行完整开放阅读框的校对放大。对于酵母中的异源表达,将校对cDNA扩增子连接到PYES2.1 / V5-HIS-Topo®载体(Invitrogen,Paisley,UK)中。通过测序分离和证实感测结构。将质粒转化为美国cereviasiae应变发票SC.1执行。重组蛋白的异种表达和制备方法参照[35.].
根据供应商的指示,使用DNeasy植物迷你套件(Qiagen,Hilden,德国)制备基因组DNA。特定引物(Dah.fnsii.lang,表3.)为了扩增基因组FNS II由cDNA序列信息设计。
基因表达研究
表达式FNS II根据供应商的说明,使用StepOnePlus系统和SYBR®Green PCR Master Mix (Applied Biosystems, Darmstadt, Germany)进行qPCR定量。分析采用三元组进行,数据为FNS II针对两种对照基因标准化,肌动蛋白和glyceraldehyd 3 -磷酸脱氢酶(GAPDH).引物来源于[36.]Actin,Chi,CHS1,CHS2,FHT,ANS,FLS,DELILA,MYB1,MYB2,R3MYB,WDR1,WDR2,和静脉注射来自[37.]F3'H.引物对DFR基于NCBI数据库(FJ216425)中公布的序列,其先前使用用于保守的DFR序列的退化引物来源。引物对垫基于NCBI数据库(AF489108)发布的序列。引物对GAPDH基于MRNA序列中的保守区域设计GAPDH在NCBI-Genbank(EU708566,AF162198,GU475487)中发表的不同菊科物种。引物的序列如表所示3..
缩写
- ANS:
-
花青素合成酶
- bHLH:
-
基本螺旋循环螺旋
- CHS:
-
Chalcone合成酶
- 气:
-
Chalcone异构酶
- CY:
-
花青色素
- DFR:
-
二氢烷醇4-还原酶
- Etoac:
-
乙酸乙酯
- F:
-
向前
- F3'H:
-
黄酮类化合物3'-羟化酶
- FHT:
-
黄烷酮3-hydroxylase
- 弗尔斯:
-
黄酮醇合成酶
- FNS II:
-
黄酮合酶2
- GAPDH:
-
甘油醛3磷酸脱氢酶
- 高效液相色谱法:
-
高效液相色谱
- 垫:
-
Malonyl-coenzyme答:花青素-O-malonyltrans-ferase 3-O-glucoside-6”
- NAPDH:
-
烟酰胺腺嘌呤二核苷酸磷酸盐
- 接待员:
-
反向
- 种族:
-
cDNA结束的快速扩增
- 薄层色谱:
-
薄层色谱法
- 沃尔:
-
WD40重复。
参考文献
- 1.
麦克拉伦M:大丽花:历史和物种。大丽花的百科全书;波特兰。编辑由:麦克拉伦M.波特兰,俄勒冈州:木材出版社,2009:161-166。
- 2.
Giannasi de:属的黄酮系统系统大丽花(菊科)。林志刚。中国农业大学学报(自然科学版). 1975,26(2):1-125。
- 3。
大丽花着色的生化基础研究。Nat Prod Comm. 2008, 3: 1259-1266。
- 4.
黄酮类化合物的比较生物化学。伦敦:学术出版社1967年出版。
- 5。
Nordstrom C, Swain T:黄酮类苷大丽花摘要.II。黄色品种的糖苷。拱生物学生生物糖。1956,60(2):329-344。10.1016 / 0003-9861(56)90435-0。
- 6。
Kaufmann H, El Baya A:抗氧化前驱物与fettgebiet第二十六章:anthochlore von大丽花摘要和Cosmos sulphureus..王志强,王志强。2003,(5):1 - 7。10.1002 / lipi.19700720505。
- 7。
王志强,王志强。大丽花丙二酰化查尔酮苷的研究进展。植物化学。1990,29(9):2899-2900。10.1016 / 0031 - 9422 (90) 87101 - y。
- 8。
Hosokawa M,Hoshino A,Kitamura Y,Morita Y,Park Kii,Nakashima A,Deguchi A,Tatsuzawa F,Doi M:BHLH转录因子,DVIVS参与调节大丽花的调节(大丽花摘要).中国生物医学工程学报。2011,32(4):514 - 516。10.1093 / jxb / err216。
- 9。
Ohno S, Hosokawa M, Kojima M, Kitamura Y, Hoshino A, Tatsuzawa F, Doi M, Yazawa S:八倍体大丽中两个不同查尔酮合成酶基因同时转录后沉默导致纯白花。Planta。2011,234(5):945-958。10.1007 / s00425-011-1456-2。
- 10.
Nordström C, Swain T:黄酮类苷大丽花摘要.3来自白色品种的糖苷。中国生物化学学报,2003,23(1):1 - 8。10.1016 / 0003 - 9861(58) 90257 - 1。
- 11.
是什么让樱桃变成红色的?:an investigation into flavonoid pathway regulation in sweet cherry (Prunus avium L.) fruit. Thesis. 2010, Adelaide: The University of Adelaide.
- 12.
Markham K, Bloor SJ, Nicholson R, Rivera R, Shemluck M, Kevan PG, Michener C:野生黑刺李的黑色花颜色及其化学和生态后果。自然科学学报2004,59:625-630。
- 13。
Goto T, Takase S, Kondo T:天然酰化花青素的PMR光谱测定awobanin, shisonin和violanin的立体结构。acta photonica sinica, 2010, 39(4): 441 - 446。10.1016 / s0040 - 4039(01) 94788 - 4。
- 14。
Shibata M,Ishikura n:郁金香花的花青素纸色谱调查。I.日本植物学杂志。1960,17:230-238。
- 15.
哈伯恩·JB:生态生物化学概论。英国伦敦:学术公关1993。
- 16。
Hatier JHB, Gould KS: Ophiopogon planiscapus' Nigrescens'叶子的黑色颜色。叶片光学,色度和内部光梯度。植物功能生物学杂志,2007,34(2):130-138。10.1071 / FP06220。
- 17。
Abdel-Aal ESM,Young JC,Rabalski I:黑色,蓝色,粉红色,紫色和红色谷物的花青素组成。JAgric Food Chem。2006,54(13):4696-4704。10.1021 / JF0606609。
- 18。
Suzuki H, Nakayama T, Yonekura-Sakakibara K, Fukui Y, Nakamura N, Yamaguchi M, Tanaka Y, Kusumi T, Nishino T:大丽花丙二酰辅酶A:花青素3- o -葡萄糖苷-6"- o -丙二酰转移酶的cDNA克隆、异体表达及功能特征。植物营养与肥料学报。2002,13(4):492 - 498。10.1104 / pp.010447。
- 19。
Figueiredo P,Elhabiri M,Toki K,Saito N,Handles O,Brouillard R:花青素络合的新方面。分子内的连翘作为颜色损失的手段?植物化学。1996,41(1):301-308。10.1016 / 0031-9422(95)00530-7。
- 20。
Yamaguchi Ma,Oshida n,Nakayama M,Koshioka M,Yamaguchi Y,Ino I:来自Dahlia Variabilis的花青素3-葡糖苷丙二酰亚丙酯酶。植物化学。1999年,52(1):15-18。10.1016 / S0031-9422(99)00099-0。
- 21.
Malien-Aubert C,摇摆O,Aniot MJ:与酚类组合物相关的商业花青素的提取物的颜色稳定性。内分子间连翘的保护作用。JAgric Food Chem。2001,49(1):170-176。10.1021 / JF000791O。
- 22.
丁海峰,王志强,王志强,等:多倍性与野生和栽培植物的进化大丽花物种。Ann Bot。1998,81(5):647-656。10.1006 / anbo.1998.0614。
- 23.
黄酮和黄酮合成酶。植物营养与肥料学报。2005,22(6):531 - 534。10.1016 / j.phytochem.2005.07.013。
- 24.
罗志强,王志强,王志强,等:转座子诱变对大背草色素沉着的影响。植物学报,1991,1(1):59-69。10.1111 / j.1365 - 313 x.1991.00059.x。
- 25。
黄酮类化合物:生物化学途径调控和进化的彩色模型。植物科学进展,2005,10(5):236-242。10.1016 / j.tplants.2005.03.002。
- 26。
MYB-bHLH-WD40蛋白复合物与细胞多样性的进化。植物科学进展,2005,10(2):63-70。10.1016 / j.tplants.2004.12.011。
- 27。
Dubos C,Stracke R,Grotewold E,Weisshaar B,Martin C,Lepiniec L:MYB转录因子拟南芥.趋势植物SCI。2010,15(10):573-581。10.1016 / J.Plants.2010.06.005。
- 28。
Feller A, Machemer K, Braun EL, Grotewold E: MYB和bHLH植物转录因子的进化和比较分析。植物学报,2011,66(1):94-116。10.1111 / j.1365 - 313 x.2010.04459.x。
- 29。
Hansen HV,Hjerting J:关于染色体数字和生物系统的观察大丽花(菊科,向日葵科),并对其身份进行了说明D. Pinnata.,d . rosea, 和d . coccinea.nord j bot。1996,16(4):445-455。10.1111 / J.1756-1051.1996.TB00256.X。
- 30。
Hansen HV, Hjerting JP:大丽花(asteraceae - coreopsidae)的杂交:基于20种数据的摘要。植物园:哥本哈根大学,2003。
- 31。
Lukacin R, Wellmann F, Britsch L, Martens S, Matern U:柑橘黄酮醇合成酶是一种双功能双加氧酶。植物化学学报。2003,62(3):287-292。10.1016 / s0031 - 9422(02) 00567 - 8。
- 32。
Halbwirth H,Forkmann G,Stich K:Tagetes SP中6位的黄酮醇的A型腺特异性羟基化。通过依赖于细胞色素P450依赖性单氧基酶催化。植物SCI。2004,167(1):129-135。10.1016 / J.Plantsci.2004.03.007。
- 33.
关键词:金黄色葡萄球菌,c55 -异戊二烯醇磷酸激酶,活性中国生物医学工程学报,2003,21(4):513。
- 34.
钱德拉A,林蛙J,李艳:植物补充剂原料中花青素的高效液相色谱-质谱分离、鉴定、定量及方法验证。农业食品化学学报,2001,49(8):3515-3521。10.1021 / jf010389p。
- 35.
Pompon D,Louerat B,Bronine A,Urban P:酵母在优化氧化还原环境中的动物和植物P450s的表达。方法酶。1996年,272:51-64。
- 36.
Ohno S, Hosokawa M, Kojima M, Kitamura Y, Hoshino A, Tatsuzawa F, Doi M, Yazawa S:八倍体大丽中两个不同查尔酮合成酶基因同时转录后沉默导致纯白花。植物学报。2011,34(1):1-14。10.1007 / s00425 - 011 - 1383 - 2。
- 37。
Schlangen K, Miosic S, Halbwirth H:大丽花的等位变异编码类黄酮3'-羟化酶,查尔酮3-羟化酶活性存在功能差异。生物化学学报。2010,34(1):40-45。10.1016 / j.abb.2009.11.015。
- 38。
(2004)遗传变异的分析与可视化。EMBNET新闻。acta photonica sinica, 1999, 4(2): 1-4。
致谢
这项工作得到了奥地利研究基金FWF [Project V18-B03]的支持。RA由Erasmus Mundus奖学金资助。通用汽车和KS想要感谢奥地利汽车公司Innovationsförderung。我们感谢R. Paltram对qPCR研究的宝贵支持。
作者信息
隶属关系
通讯作者
附加信息
相互竞争的利益
提交人声明他们没有竞争利益。
作者的贡献
GM筛选了大麻酶存在的大麻栽培品种,并显示黑色达利亚没有FNS II活性,JT分离出基因组克隆,进行定量实时PCR研究并导致制备稿件。KSL进行了cDNA克隆的分离和表征。SM显示功能活性,其特征在于重组酶,分析了花瓣中的黄酮类化合物的存在,并监督了在植物制剂中表征FNS II活性的RA的工作,并为工作的所有其他部分做出了贡献。克斯特参加了研究的设计和手稿起草。HH构思了这项研究,参加了所有部分的工作并起草了手稿。所有作者阅读并认可的终稿。
电子补充材料
黄酮、黄酮醇和花青素的含量与白cv成比例。
附加文件1:白色Alva(1),黄色cvs。Rubens (2) Alva 's Supreme(3),红色cvs。Feuerschein (4), Cheerio(5),黑色cvs。天方夜谭(6),极光之吻(7),黑杰克(8),黑色(9),戴高乐(10),卡玛乔克(11),魔法之夜(12),流星(13),纳塔尔(14),尼格科夫(15),蒂莎(16),黑芭芭拉(17)。绝对值参见表1.(TIFF 755 KB)
黄酮合成酶II测定在三种黑色品种中。
附加文件2:用溶剂系统CAW(氯仿/醋酸/水:10/9/1)孵育的纤维素上TLC的放射性曲线图[14C]在CV的花瓣存在微粒体制剂中的ERIODICTYOL。黑色barabara(左),cv。聊天黑色(中心)和简历。Stefanie hertel(右)。(TIFF 3 MB)
结构基因与转录因子的相对表达。
附加文件3:与管家基因相比确定表达式肌动蛋白在白色的简历里。白色Alva(1),黄色cvs。Rubens (2) Alva 's Supreme(3),红色cvs。Feuerschein (4), Cheerio(5),黑色cvs。天方夜谭(6),极光之吻(7),黑杰克(8),戴高乐(9),黑色小说(10),卡玛·乔克(11),魔法之夜(12),流星(13),神话(14),尼格柯普夫(15),蒂莎(16),黑芭芭拉(17)。(TIFF 927 KB)
结构基因与转录因子的相对表达。
附加文件4:与管家基因相比确定表达式甘油醛3磷酸脱氢酶(GAPDH)。白色Alva(1),黄色cvs。Rubens (2) Alva 's Supreme(3),红色cvs。Feuerschein (4), Cheerio(5),黑色cvs。天方夜谭(6),极光之吻(7),黑杰克(8),戴高乐(9),黑色小说(10),卡玛·乔克(11),魔法之夜(12),流星(13),神话(14),尼格柯普夫(15),蒂莎(16),黑芭芭拉(17)。(TIFF 340 KB)
作者的原始提交的图像文件
权利和权限
开放获取本文在“生物资源”中央有限公司的许可下公布了这是一个开放式访问条款,分配根据创意公约归因许可证的条款(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
蒂尔,J.,Miosic,S.,Ahmed,R.et al。'Le Rouge et Noir':黄酮形成的下降与黑色大丽花的罕见颜色相关(大丽花摘要如果短)花。BMC植物BIOL.12,225(2012)。https://doi.org/10.1186/1471-2229-12-225
已收到:
接受:
发表:
关键字
- 大丽花摘要长的矮
- Asteraceae.
- 花色
- 黑花
- 黄酮类化合物
- 花青素
- 黄酮
- 黄酮合酶2
- 转录因子