抽象的
背景
磺胺胺家族包括临床上重要的抗微生物化合物,其也显示出植物中的生物活性。虽然有证据表明,磺胺酰胺在细菌和植物中抑制叶酸生物合成,但对这些化合物的完整植物反应网络仍有特征。因此,我们在拟南芥中启动了两种前进的遗传筛,以鉴定表现出对磺硅酰胺化合物的改变敏感性的突变体。这些屏幕基于在化合物磺胺甲恶唑(SMEx)存在下萌发的幼苗生长表型。
结果
我们鉴定了一个对Smex敏感性降低的突变体,随后的定位表明一个编码5-氧脯氨酸酶的基因与此表型有关。一个导致对Smex敏感性增强的突变被定位到一个没有任何功能注释的基因上。
结论
通过我们的正向遗传筛选确定的基因代表了拟南芥对磺胺类化合物响应的新介质,并表明这些响应超出了叶酸生物合成的干扰。
背景
磺胺酰胺化合物占据历史中的突出位置,作为第一种合成分子,临床和兽医实践中的抗菌化学治疗方法[1].自20世纪30年代发现以来,已经合成了数千种磺胺胺衍生物,并且它们的作用机制广泛研究。磺胺胺是结构类似物p-氨基苯甲酸(PABA)竞争性地抑制二氢pteroate合酶(DHPS),该酶催化叶酸生物合成途径的关键步骤[2].DHPS基因中的单碱基对变化可以在细菌中赋予磺胺胺抗性[3.],这使得这些化合物在现代医学中需要更具选择性利用。
植物对磺胺也很敏感。在拟南芥中,有相当多的证据表明,这些化合物抑制双功能叶酸生物合成酶羟甲基蝶呤焦磷酸激酶/二氢蝶呤合成酶(HPPK/DHPS) [4.-7.].在低微量摩尔浓度下,这种抑制与幼苗生长减少相关,而浓度较高致命。拟南芥中磺酰胺 - 不敏感的细菌DHP的过度表达使这些植物对磺胺酰胺相对不敏感[8.].这种不敏感性目前在一些植物转化载体中用作可选标记,包括用于产生GABI-KAT Arabidopsis T-DNA插入收集的那些[9.].尽管磺胺活性在HPPK/DHPS水平上的表征,但对植物对这些化合物的反应缺乏更广泛的了解。拟南芥HPPK/DHPS胞质亚型的叶酸独立活性的证明,为更复杂的反应提供了证据[7.那10.].此外,鉴于叶酸生物合成途径形成单碳代谢的基础[11.“磺胺胺活性可能影响各种重要的下游代谢组分,例如嘌呤,氨基酸和酶辅因子。其他代谢途径对磺胺酰胺敏感性的影响也是未知的。
在这里,我们描述了两种前向遗传筛网,旨在将拟南芥对磺胺酰胺化合物分析。我们使用幼苗生长表型来鉴定具有改变的浓度对化合物磺胺甲恶唑(SMEx)的敏感性。对SMEX敏感性降低的突变体被映射到OXOPROLINASE1基因座,而具有增强的敏感性与SMEX的敏感性映射到未知功能的基因。这些基因座之前,先前并不与磺胺酰胺响应表型相关,因此代表了改变的磺硅酰胺敏感性的新机制。
结果
幼苗生长表型和结构活性分析
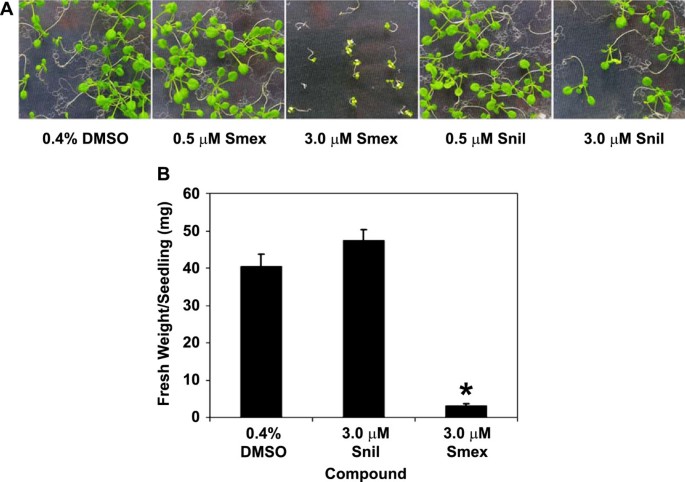
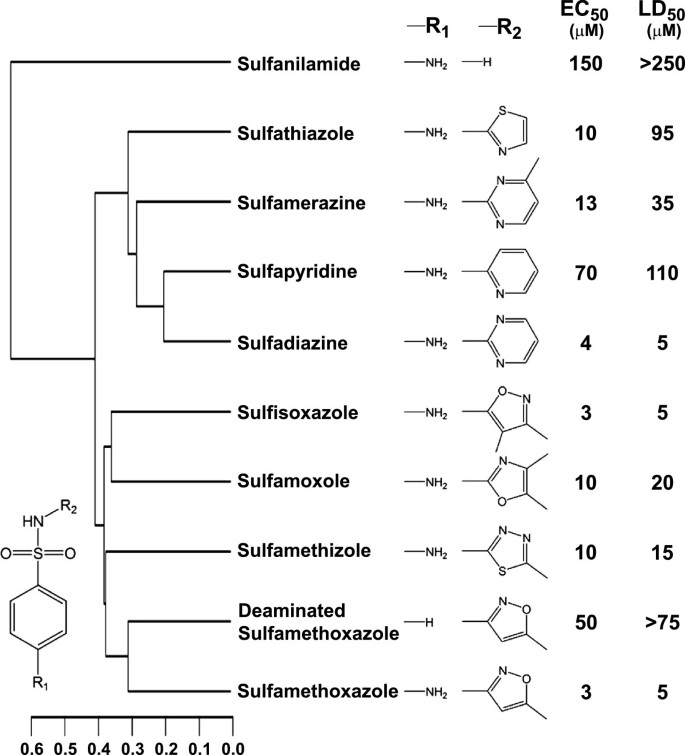
为了从遗传学角度分析拟南芥中磺胺类化合物的活性,我们需要一种适合于高通量调查的表型。通过观察拟南芥(Col-0)种子在固体培养基(0.5X MS, 2.5 mM MES;pH 5.8, 0.8%琼脂)含有3 μM Smex的幼苗发育严重,几乎完全漂白(图)1).我们随后使用幼苗生长表型来确定较大一组磺胺酰胺之间的结构活性关系。当在3μm测试时,磺酰胺核心组本身并没有显着影响幼苗生长(图1).我们还评估了许多额外的磺胺胺化合物(图2),并在幼苗生长试验中发现了广泛的抑制活性,其中Smex是所有测试化合物中最活跃的。我们观察到氨基从磺胺核(位置R1)严重影响了这些测定中的SMEX的活性。有趣的是,磺胺酰胺本身表现出比脱胺的SMEX甚至较低的活性,这表明主要副族(R2)有助于化学活性。然而,很明显,在该R组的组合方面对幼苗生长的影响存在相当大的灵活性。五个和六个构件环结构均赋予相似的活性,并且通常在环内的各种取代和/或在环周围的不同位置存在另外的甲基存在时,通常保留该活性。然而,苏菲吡啶的一个主要例外,尽管只有一种原子与磺胺嗪不同,但仍然存在急剧减少的活性。这两个环结构的化学性质可能是不同的,但它们与活性的关系仍不清楚。我们还注意到了EC之间观察到的差异大小的各种变化50和LD50值。特别地,四种化合物都有EC50大约10微米,但LD50范围从15到95μm。这些观察结果可以反映用于确定EC的漂白剂和致死性表型的不同过程50和LD50值分别。额外的表型变异可以通过幼苗产生这些化学物质的不同速率。最终,每种磺胺胺的对接模型及其目标可以帮助解释这种行为。
幼苗生长测定中各种磺酰胺化合物的结构 - 活性关系。磺胺酰胺核在底部左上角,以及上述每种化合物的特定R组。使用拟南芥(COL-0)种子在含有一系列化学浓度的固体培养基上进行活性测定。在生长10-14天后评估幼苗表型。“EC.50“表示漂白50%幼苗的化学品的有效浓度,并”LD50“表示致死至50%的幼苗的浓度。数据代表两个独立实验的平均值。使用Chemmine在线结构分析工作台生成左侧的树状图(http://bioweb.ucr.edu/ChemMineV2/).
对Smex敏感性降低的突变体
基于Smex在幼苗生长试验中的活性,我们启动了两个正向化学遗传筛选,其中一个是在含有3 μM Smex的培养基上进行甲基磺酸乙酯诱变的拟南芥种子的发芽,以鉴定对Smex敏感性降低的突变体。从大约16000米2经筛选,发现197个疑似RSS突变体,并证实任一突变体对Smex的敏感性降低3.或者4.这一条线的37个。为了量化突变体的不敏感性,在含有一系列SMEX浓度的培养基上播种每根线,揭示九个突变体对SMEX显着敏感而不是野生型。我们的判断意义的标准规定,抑制幼苗生长所需的SMEX的浓度比在野生型幼苗中抑制生长的浓度高至少1.5倍。拟南芥基因组含有两种HPPK / DHPS基因[7.因此,这两种基因的开放阅读框在所有9个突变体中进行了测序,但没有发现任何一个包含突变。9条选定的过饱和度谱线中有8条对抗叶酸化合物甲氨蝶呤也不敏感。唯一的例外,指定为RSS 26-1,表现出最大的Smex敏感性降低,但仍与野生型一样对甲氨蝶呤敏感。该突变体在对水杨酸和除草剂Bialaphos等其他植物毒素的敏感性方面也与野生型植物相似1).
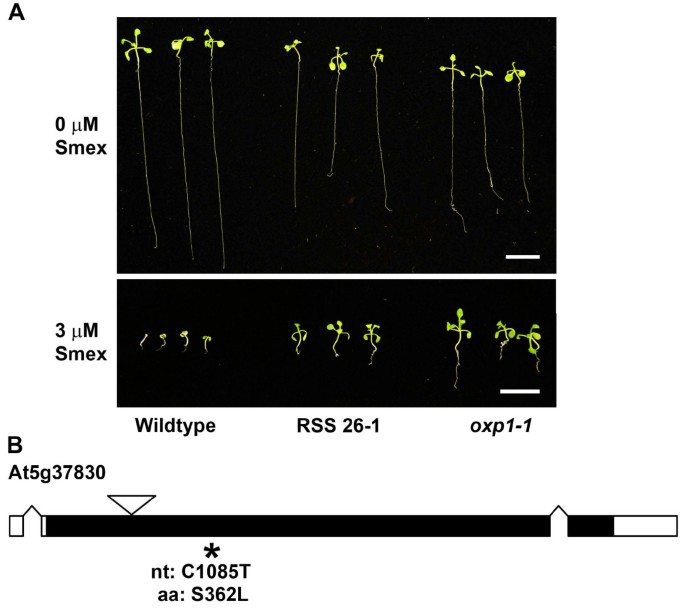
rss26 - 1化学不敏感性的明显特异性表明,这种表型的突变可能为了解独立于叶酸代谢的smex影响的拟南芥通路提供了一些线索。在为定位这种突变做准备时,rss26 - 1 (M4.)被越过陆地山脉erecta.(L.呃).来自f的SMEX不敏感的个体2在含有5 μM Smex的培养基上回收该杂交组合的基因组DNA,并从80个个体的组织中提取基因组DNA。全基因组测序在Illumina基因组分析仪上进行,结果数据使用奥斯汀设计的生物信息学管道进行分析等.[12.]为了鉴定感兴趣的感兴趣突变所在的基因组区域。简而言之,Col-0 / L的频率呃在基因组序列中评估单核苷酸多态性(SNP),并且利益区域由代表原始突变背景的COL-0 SNP的富集来定义。在该地区内,在分析的100%序列中存在的编码序列中或附近的突变被认为是感兴趣的突变。该分析产生了使用T-DNA插入管线评估与RSS表型的相关性的候选基因的简短列表(表2).这些努力确认RSS 26-1从编码氧寄存酶的基因(OXP1;At5g37830[基因库:NM_123142])。一个纯合子oxp1.顶线(OXP1-1)关于SMEX敏感性类似于26-1的RSS 26-1(图3.).
突变体具有增强对SMEX的敏感性
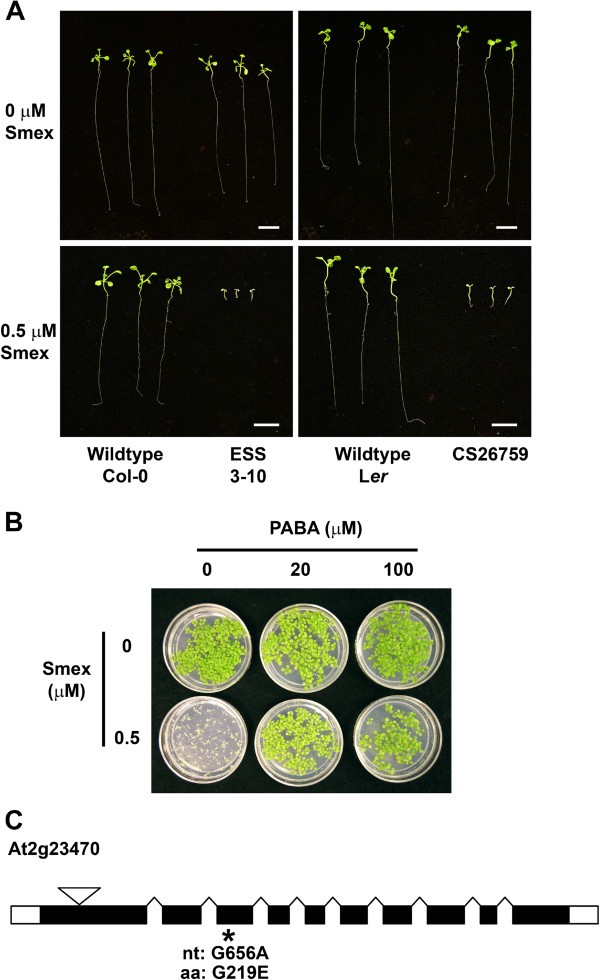
除了筛选对Smex的敏感性降低外,第二项正向遗传筛选侧重于识别对该化合物敏感性增强的突变体。在该筛选中,种子在含有0.5 μM Smex的培养基上萌发,不影响野生型幼苗的生长和外观。大约12000米2对种子进行筛选,538个个体表现出白化和/或发育不良。在含有0.5 μM Smex和0.4% DMSO的培养基上进行二次筛选,3个突变体均表现出Smex特异性表型。结果表明,3个突变体均为隐性等位基因。我们重点研究了“对Smex的敏感性增强”(ESS)突变体3-10,该突变体对Smex的敏感性是野生型拟南芥(Col-0)的近700倍(图)4A).这种表型可以通过添加PABA或二氢叶酸(DHF)部分挽救(图)4B.这表明HPPK/DHPS抑制有助于该突变体的Smex超敏反应。值得注意的是,ESS 3-10的化学过敏并不是一个普遍现象,因为它与野生型在水杨酸、Bialaphos或甲氨蝶呤存在下萌发时没有区别(表)3.).与RSS 26-1一样,为ESS 3-10生成映射群并进行测序en masse..随后的序列分析产生了获得T-DNA敲除线的五种候选基因的列表(表4.).然后进行幼苗生长测定,揭示携带在AT2G23470 [Genbank:NM_127911]内的T-DNA插入的线中的SMEX过敏。基于我们的测序数据,该基因座含有G→核苷酸突变在编码序列的核苷酸656处,导致ESS 3-10中的G219E氨基酸取代。
与“对磺胺甲恶唑(Smex)增强敏感性”突变体相关的表型(ESS 3-10)。(一种)ESS 3-10的幼苗生长表型含有0.5μmSmex的培养基。T-DNA插入管线CS26759(在Landsberg中erecta.背景)显示为比较。秤条表示1厘米。(B.)ESS 3-10对含有两者的培养基的幼苗生长表型p-氨基苯甲酸(PABA)和0.5 μM Smex。这两张照片都是在生长14天后拍摄的。(C) At2g23470基因模型。黑色区域表示开放阅读框架,白色区域表示未翻译区域。本研究绘制的ESS 3-10点突变的位置用星号表示,具体的序列变化在核苷酸(nt)和氨基酸(aa)水平上都显示出来。一个倒三角表示用于确认ESS表型的T-DNA插入(股票CS26759)的近似位置。
讨论
除了化学物质与其直接靶标之间的相互作用外,生物系统中小分子的活性还受到多种因素的影响[13.].磺胺类化合物的抗菌活性归因于对细菌DHPS的抑制。虽然人类缺乏DHPS,但磺胺酰胺可以与碳酸酐酶和血清白蛋白结合,偶尔会产生毒性副作用[14.-16.].在植物中,HPPK/DHPS也记录了与叶酸无关的活动[7.那10.].这些观察,结合广泛的下游代谢途径的DHPS和叶酸生物合成,刺激我们去研究影响植物中磺胺酰胺活性的基因。
为了促进这项调查,我们寻求一种易于批量的表型,以评估拟南芥幼苗对SMEX的敏感性。我们发现,补充有3μmSmex的琼脂培养基上的发芽导致野生型(Col-0)幼苗的显着静止和漂白。该表型有利于将遗传筛网重点用于鉴定拟南芥突变体,其对Smex的改变反应。对SMEX敏感性降低的突变体的筛网产生了许多次数,对SMEX具有显着和定量的敏感性。值得注意的是,虽然可以通过DHPS基因的单个碱基对变化来赋予磺胺酰胺的不敏感性[3.那8.,在HPPK/DHPS序列中未观察到感兴趣的突变。同样值得注意的是,大多数突变体对Smex和甲氨蝶呤(叶酸生物合成的另一抑制剂)的敏感性都较低。这种对植物对两种不同抗叶酸化合物反应的广泛影响可能代表了一种补偿性突变,增加了叶酸生物合成途径的总通量,减少了从周围介质中吸收化学物质,或改变了atp结合盒蛋白的液泡活性,其中一些已知可以运输叶酸和甲氨蝶呤[17.].只有一个突变体对Smex的敏感性降低,相关突变被定位到一个oxoprolinase (OXP1).
在植物中,氧化普罗素酶作为谷胱甘肽回收途径的一部分将5-氧化丙醇(焦戊酰胺酸)转化为谷氨酸酯。从理论上讲,OXP1功能的损失可能导致谷胱甘肽的积累,随着该分子的缀合的增强的消除异恶素的能力[18.].然而,实际上,硫醇的整体组成和浓度似乎不受影响OXP1-1突变体[19.],因此RSS表型可能不是增加SMEX解毒的结果。这一结论也同意我们以前的观察结果,SMEX似乎没有降级或以其他方式结构修改在Planta.(Sean Cutler博士,个人沟通)。OXP1的损失与其他代谢变化有关,包括大量的5-氧寄生载体的积累,并降低(14-30%降低)谷氨酸浓度[19.].有证据表明,5-氧脯氨酸导致动物神经组织中的脂质和蛋白质氧化[20.]但是在植物中发生这种情况的程度是未知的。植物中5氧化载体的生理作用的信息缺乏使得难以假设关于连接之间的连接OXP1和拟南芥中的SMEX活性。
第二个屏幕聚焦在具有增强敏感性对SMEX的突变体的鉴定。从该筛选中回收高度过敏突变体,并将其映射到迄今为止的单声组织轨迹(AT2G23470)。该基因座编码未知函数的蛋白质,其唯一注释涉及与RU共享的序列图案(root你V-B年代确保对紫外线控制生长响应的蛋白质[21.].有趣的是,虽然可以通过用叶酸前体PABA共同处理来拯救SMEX过敏,但相对于野生型,ESS 3-10对甲氨蝶呤的敏感性不会改变。因此,似乎SMEX和ESS 3-10会影响叶酸依赖性和依赖性的反应。
结论
我们已经描述了两个正向遗传筛选,开始调查植物对化学物质磺胺家族的反应。我们鉴定了对化合物Smex敏感性改变的突变体,发现At5g37830位点的突变降低了对Smex的敏感性,而At2g23470位点的突变导致敏感性增强。重要的是,这是第一次证明这两个基因中的任何一个的表现型。虽然At5g37830和At2g23470在介导拟南芥对Smex的响应中的确切作用尚不清楚,但我们的初步数据表明,Smex可以介导拟南芥中多个非重叠表型。
方法
植物材料和细菌菌株
拟南芥(生态型哥伦比亚-0)用于幼苗生长测定。前向遗传筛用乙基甲磺酸乙烯酸酯诱变拟南芥(COL-0)种子(Lehle种子,圆形岩石,TX,USA)进行。对于候选基因分析,下面的基因座和其相关联的T-DNA插入株系进行了检查:At5g37160(SALK_045992C,SALK_129697C),At5g39040(SALK_011884),At5g37830(SALK_078745C),At2g26135(SALK_150146C,SALK_055187),At2g24590(SALK_023090,SALK_032699C,SALK_094266),AT2G25320(Salk_07287C,Salk_007242C),AT2G27790(SAIL_1155_B02,SAIL_1155_E08,SALK_06215C)和AT2G23470(CS26759)。所有线条从拟南芥生物资源中心(ABLC)获得。股票CS26759是在山寨erecta.背景。
将土壤种植植物的种子置于潮湿的土壤(Promix BX,Premier Horticulture Ltd.,Dorval,PQ,加拿大)用20-20-20肥,分层为4°C,然后置于生长室具有九小时的光周期和22°C / 18°C的日/夜温度制度。对于幼苗生长测定,表面灭菌的种子在由0.5倍Murashige和Skoog(MS)基盐(Sigmaaldrich,Oakville,Canada),2.5mm 2-(N-morpholino)乙磺酸(MES)组成的培养基上铺板。pH 5.8(Sigmaaldrich)和0.8%琼脂。在4℃下分层的四天后,在连续光下在22℃下将平板温育。
全基因组测序的基因图谱
为了绘制导致对Smex敏感性改变的突变,将感兴趣的突变体与Landsberg生态型杂交erecta..对于每个突变体,至少100 F2在幼苗萌发试验中,根据Smex敏感性选择植物并转移到土壤中。对于ESS 3-10,在移栽土壤之前,在含1.5%葡萄糖的0.5X MS培养基上挽救发育不良和漂白的幼苗。生长三周后,收集80株植物的组织,使用Gentra Puregene基因组DNA提取试剂盒(QIAGEN Inc., Mississauga, ON, Canada)提取基因组DNA。根据制造商的方案(Pauline Fung和Jianfeng Zhang,多伦多大学基因组进化和功能分析中心(CAGEF),加拿大on,多伦多大学),样品在Illumina基因组分析仪IIx上进行测序。序列组装和分析也在CAGEF (Yunchen Gong和Ryan Austin博士)进行。随后使用基于网络的Next-Gen Mapping应用程序(http://bar.utoronto.ca/ngm.;[12.])。Illumina从每个测序突变种群中获得的原始读取数据存储在Dryad数字知识库中(doi:10.5061 / DRYAD.3SK8).使用含有适当浓度的Smex的0.5×MS琼脂培养基萌发的纯合T-DNA插入管线确认候选者。
缩写
- DHF:
-
二氢酚属
- 井下供电:
-
二氢乙酸盐合成酶
- ess:
-
对磺胺甲恶唑的敏感性增强
- PABA:
-
p- 氨基苯甲酸
- RSS:
-
对磺胺甲恶唑的敏感性降低
- Smex:
-
磺胺甲恶唑。
参考文献
- 1。
van Miert Asjpam:磺胺胺 - 二氨基嘧啶故事。J vet pharmacol actap。1994年,17:309-316。10.1111 / J.1365-2885.1994.TB00251.X。
- 2。
McCullough JL,Maren Th:核心和磺酰胺从大肠杆菌抑制二氢酯合成酶。抗氨基甲虫剂化学其他。1973年,3:665-669。10.1128 / aac.3.665。
- 3.
Guerineau F,Mullineaux P:来自质粒R46的磺酰胺抗性基因的核苷酸序列。核酸RES。1989,17:4370-10.1093 / NAR / 17.11.4370。
- 4.
Prabhu v,Lui H,King J:拟南芥二氢乙酸酯合酶:一般性质和反应产物抑制和磺酰胺。植物化学。1997,45:23-27。10.1016 / s0031-9422(96)00793-5。
- 5.
Prabhu v,Chatson Kb,Lui H,Abrams Gd,King J:磺胺酰胺和甲氨蝶呤通过拟南芥中甘氨酸脱羧酶/丝氨酸羟甲基转移酶酶系统的影响。植物理性。1998,116:137-144。10.1104 / pp.116.1.137。
- 6。
Loizeau K, Gambonnet B, Zhang G-F, Curien G, Jabrin S, Van Der Straeten D, Lambert WE, Rébeillé F, Ravanel S: Regulation of one-carbon metabolism in Arabidopsis: The N-terminal regulatory domain of cystathionine γ-synthase is cleaved in response to folate starvation. Plant Physiol. 2007, 145: 491-503. 10.1104/pp.107.105379.
- 7。
Storozhenko S,Navarreete O,Ravanel S,De Brouwer V,Chaerle P,Zhang GF,Bastien O,Lambert W,Rébeilléf,van der Straeten D:拟南芥催化磷酸二磷酶/二氢磷酸二烷基酶/二氢甲基氨酸合成酶:早期发展中的特定作用压力反应。J Biol Chem。2007,282:10749-10761。10.1074 / JBC.M701158200。
- 8。
Guerineau F,Brooks L,Meadows J,Lucy A,Robinson C,Mullineaux P:植物转化的磺胺酰胺抗性基因。植物mol biol。1990,15:127-136。10.1007 / BF00017730。
- 9。
李永强,李永强,李永强,李永强:拟南芥T-DNA诱变群体(GABI-Kat)的侧链测序分析。植物生态学报。2003,33(4):489 - 494。
- 10.
Navarreete O,Van Daele J,Stove C,Lambert W,Van der Straeten D,Storozhenko S:植物睾丸HPPK / DHPS在拟南芥胁迫下的叶酸独立作用。植物化学。2012,73:23-33。
- 11.
Jabrin S,Ravanel S,Gambonnet B,Douce R,Rébeilléf:植物中的单碳代谢。调节萌发和幼苗发育过程中的四氢溶胶合成。植物理性。2003,131:1431-1439。10.1104 / pp.016915。
- 12.
张杰,冯鹏,龚勇,王普文,马志强,王普文:拟南芥基因的新一代定位。植物学报,2011,67:715-725。10.1111 / j.1365 - 313 x.2011.04619.x。
- 13。
Kerns EH, Carter GT:药物设计中的类药物性质概念。医药科学。2009,15:2184-2194。10.2174 / 138161209788682479。
- 14。
碳酸酐酶失活是磺胺“酸中毒”的来源。《科学》,1941,93:66-67。10.1126 / science.93.2403.66。
- 15.
Davis BD:血浆蛋白与磺胺类药物的结合-决定药物在体内分布的一个因素。中国临床医学杂志,1994,22:753-762。10.1172 / JCI101448。
- 16。
McCracken GH:新生儿患者抗菌治疗的药理基础。am J DIS。1974,128:407-419。
- 17。
植物液泡atp结合盒转运体在体外转运叶酸和抗叶酸的研究。中国生物医学工程学报。2009,29(4):439 - 446。
- 18。
Rouhier N,Lemaire SD,Jacquot JP:谷胱甘肽在光合生物中的作用:谷胱甘肽和谷胱甘肽和谷胱甘肽的新兴功能。Annu Rev植物Biol。2008,59:143-166。10.1146 / annurev.arplant.59.032607.092811。
- 19。
OHKAMA-OHTSU N,Oikawa A,Zhao P,Xiang C,Saito K,Oliver DJ:A拟拟合中通过5-氧化丙醇的谷胱甘肽分解代谢的γ-谷氨酸转琥珀酶的途径。植物理性。2008,148:1603-1613。10.1104 / pp.108.125716。
- 20.
Zandona BR,派德左利的男子CD, Mescka CP·德·莫拉科埃略D, Sgaravatti, MB,他一向de Souza Wyse, Duval Wannmacher厘米Wajner M,巴尔加斯CR、Dutra-Filho CS:急性管理5-oxoproline诱发脂质和蛋白质氧化损伤,影响抗氧化防御年轻大鼠大脑皮层和小脑。中国生物医学工程学报,2010,31(4):457 - 461。10.1007 / s11011 - 010 - 9190 - 1。
- 21.
孙旭东,唐华,何志华:根UV-B - SENSITIVE2和根UV-B - SENSITIVE1在根UV-B感应途径中的作用。植物生理学报。2009,30(4):591 - 598。10.1104 / pp.109.139253。
确认
我们感谢拟南芥生物学研究中心(ABRC)提供种子股。加拿大自然科学和工程研究委员会(NSERC)支持KJS。该工作得到了个人赠款的支持,从加拿大创新基金会(CFI),安大略研究基金(ORF),NSERC和加拿大研究主席方案中的DSG基础。
作者信息
从属关系
相应的作者
附加信息
利益争夺
提交人声明他们没有竞争利益。
作者的贡献
KJS进行了遗传筛,制备了测绘群体,并进行了磺胺胺结构 - 活性分析。JZ,PF和PW负责全基因组测序,而RA,YG和DSG格式化并分析测序输出。DD构建了该项目,以及KJS,准备了稿件。所有作者阅读并认可的终稿。
作者为图像提交的原始文件
权利和权限
开放访问本文在“生物资源”中央有限公司的许可下公布了这是一个开放式访问条款,分配根据创意公约归因许可证的条款(https://creativecommons.org/licenses/by/2.0)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
龚Y。等等。拟南芥的前向化学遗传筛查识别影响对植物毒性化合物磺胺甲恶唑敏感性的基因。BMC植物杂志12,226(2012)。https://doi.org/10.1186/1471-2229-12-226
收到了:
公认:
发表:
关键词
- 化学基因组学
- 磺胺
- 拟南芥