抽象的
背景
苔藓Physcomitrella金属盘包含C.18.as well as也20.-多不饱和脂肪酸,可以被不同的酶代谢,形成羟脂,如环戊酮独联体(+) 12-oxo phytodienoic酸。环戊酮生物合成缺陷突变体的育性降低,孢子体形态异常和孢子发生中断。这条生物合成路线的第一步是将过氧化氢脂肪酸转化为氧化烯。该反应由氧化烯合成酶(AOS)催化,AOS属于细胞色素P450家族Cyp74的过氧化氢裂解酶(HPL)。在本研究中,我们描述了两个AOSp .金属盘、PpAOS1和PpAOS2.
结果
我们的研究结果表明,PpAOS1对两种C都有很高的活性18.和C.20.-过氧化氢脂肪酸底物,而PpAOS2仅与C20.-底物,表现出痕量活性(~1000倍低k猫/ K.米)与C18.基板。PPAOS1和PPHPL产品的分析进一步证明了两种酶具有镜像AOS和HPL催化的紧密连接的固有侧活性。通过使用网站定向诱变,我们提供了有证据表明,活性位点中的单一氨基酸残基也在确定9- / 13-AOS的催化活性 - 一种先前仅报道底物特异性13-AOS的发现。然而,通过交换相同的决定蛋白,不能将PPHPL转换成AOS。使用YFP标记的AO的定位研究表明,PPAOS2在体积中局部化,而PPAOS1可以在胞质溶胶中找到。伤口诱导的分析独联体(+)-12-氧基植物二烯酸的积累PpAOS1和PpAOS2单敲除突变体表明,与PpAOS2相比,PpAOS1的破坏导致显著降低独联体(+)-12-氧植物二烯酸形成。然而,两种突变体都没有PpAOS1也不PpAOS2表现出育性降低,孢子体形态异常或孢子发生中断。
结论
我们的研究突出了有关奥氧哌汀代谢的五种结果p .金属盘:(i)两种AOS亚型都能代谢C18.- 和c20.这表明两种酶可能具有不同的功能。(ii)位点定向突变表明9-/13-PpAOS1和ppapl的催化轨迹紧密相连,PpAOS1可以通过单个氨基酸交换相互转化为HPL。(iii)与PpAOS1不同,PpAOS2定位于发生oxylipin代谢的质体中。(iv) PpAOS1是伤口诱导的积累所必需的独联体(+)-12-氧基植物二烯酸,而PpAOS2似乎不参与该过程。(v)两种AOS的敲除突变体均表现出偏离的形态表型,提示与其他Cyp74酶存在功能重叠。
背景
氧化脂肪酸被统称为oxylipins,在真菌中具有信号传导功能[1,2],哺乳动物[3.]和开花植物[4].也已经显示出像苔藓这样的非开花植物含有奥氧化物,但对其生理作用的了解仍然是稀缺的[5].在开花植物中,羟脂衍生物茉莉酸(JA)调节发育过程和防御反应[6,7].该植物激素通过所谓的奥氧化丁蛋白途径的氧化丁蛋白途径(AOS)分支合成,所述氧化素途径在两个空间分离的细胞区间进行[8[n-3]:它可能开始于质体中,在脂酶的作用下,从膜脂中释放18:3(n-3)(在某些植物中也释放16:3(n-3)) [9].然后可以通过特定的13氧化游离脂肪酸年代脂氧合酶(13年代液态氧)的13年代-氢过氧十八碳三烯酸年代-HPOT (n))。该产物作为底物用于进一步的连续反应,由两种酶催化:AOS转化13年代-HPOT(n-3)在第一反应步骤中生成高度不稳定的环氧烯,该环氧烯在水溶液中在30秒内水解,生成α-酮醇和γ-酮醇以及环戊酮衍生物[10.,11.].在第二种酶的存在下,不管烯酮环酶(AOC)都是环烷为对映的独联体-12-氧植物二烯酸(独联体(+) -OPDA) [12.].独联体(+)-OPDA被转运到过氧化物酶体中,在那里它被还原为各自的环戊酮衍生物[13.],经三轮β氧化进一步加工,最终得到(+)-7-iso-JA [14.,15.].
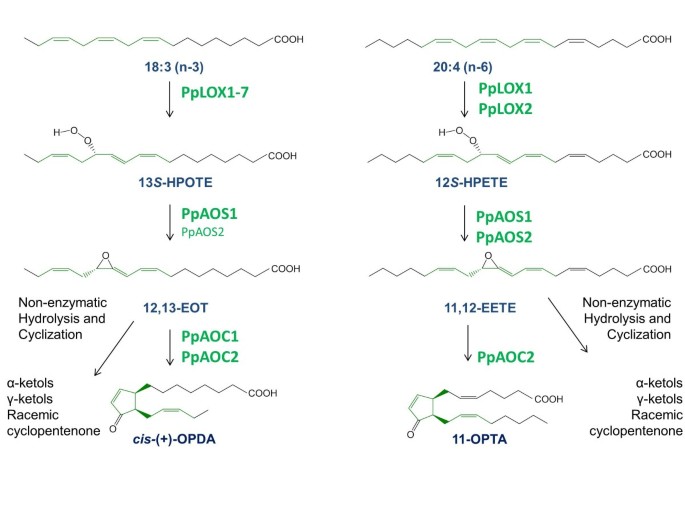
在过去几年中,在苔藓的几项研究Physcomitrella金属盘描述了一种类似于开花植物的oxylipin途径[16.- - - - - -19.].然而,与开花植物相比,此苔藓除此之外18.C——也20.多不饱和脂肪酸,通常存在于哺乳动物细胞中。此外,p .金属盘能够代谢两组产生一组不同的oxylipin(图1).在初始反应步骤中,两个不寻常的双官能LOX可以在C-12处氧化20:4(N-6),得到12-氢过氧基二核苷酸(12-HPET)[17.,20.].该产物作为至少三种酶反应的底物,可能导致不同的C8- 和c9-产物:这些挥发物要么是由双功能lox的过氧化氢裂解活性形成的[17.,19.[属于CYP74酶家族的常规氢过氧化物裂解酶(HPL)[18.,19.].另一方面,12-HPETE也可以通过PpAOS脱水得到11,12-环氧二十碳三烯酸(图)1)[16.,21.].与Clas-Sical odancanoid途径类似,这种不稳定的所有氧化烯通过形成11-氧代前列腺丙酸(11-OPTA)的一个特定AOC(PPAOC2)重新排列。16.].PpAOC2具有明显底物特异性的分子基础以及由PpAOC1和2催化的环化反应机理最近已通过x射线晶体学进行了研究[22.].有趣的是,最近的研究表明,只有在伤口和病原体攻击时独联体(+)-OPDA,但没有JA积累p .金属盘.这些调查结果导致了假设,与高等植物相比,p .金属盘仅含有oxylipin途径的质体定位部分,而过氧化物酶体部分缺失[16.,23.].与这一假设一致的是免疫细胞学研究,证明了PpLOX和PpAOC的可塑性定位[16.].
近年来国内外关于羟磷脂生物合成途径的研究进展p .金属盘(修改[[22.]])。18:3(N-3)可以通过产生13-hPOTE(N-3)的七种鉴定的含量之一氧化。该化合物由PPAOS1至12,13-环氧十八烷酸甲特异性脱水。联烯氧化物在α-和γ-酮中无酶,在水溶液中不稳定,并将其环旋转至12-氧代植物酸(OPDA)的外消旋混合物。然而,在PPAOC1 / 2存在下,对抗独联体(+) -OPDA就形成了。类似的反应从20:4(n-6)开始,由PpLOX1/2转化为12-HPETE,并由PpAOS1/2进一步脱水,生成不稳定的烯丙基氧化物衍生物11,12-环氧二十碳三烯酸(11,12- eete),该衍生物也可以非酶催化转化为各自的α-和γ-酮衍生物或外消旋环戊烯酮。只有在PpAOC2存在下,才有可能形成对映纯11-oxo前列腺烯酸(11-OPTA)。
AOS和HPL与两个另外的构件,二乙醚合酶(DES)和环氧醇合成酶一起,属于细胞色素P450亚家族CYP74 [24.- - - - - -26.].与经典p450相比,这些酶不作为单加氧酶而作为过氧化氢异构酶(HPL)或脱水酶(AOS和DES) [27.].因此,由于它们使用脂肪酸氢过氧化物作为天然底物,Cyp74s——与经典的p450相反——不需要分子氧或外部电子供体来催化。拟南芥和银胶菊两种aos的3d结构表明,Cyp74-和p450催化的这些功能差异可以通过不同的活性位点结构来解释,这些活性位点结构阻止了这些不寻常p450的单加氧酶活性[25.,28.].尽管在理解潜在的结构-功能关系方面取得了进展,但仍有一些机械性方面尚未完全理解。最近研究发现不同Cyp74s的催化轨迹密切相关[29.],单点突变可能足以使cyp74的活性相互转化[25.,27.,30.,31.].例如,对于AtAOS,已经证明一个特定的苯丙氨酸残基(Phe-137)的突变可能负责稳定中间形成的碳中心底物自由基,从而将AOS转化为HPL活性[25.,30.].此外,在AOS的i -螺旋区发现了两个保守氨基酸的突变研究也反映了这两个轨迹的紧密联系。在番茄AOS3中分别用Ile和Ala取代Phe和Ser (Phe-295和Ser-297),得到一种具有高效能酶活性的酶[31.].在番茄AOS3中分别用Ser和Tyr交换Lys-302和Thr366,得到了相似的结果[27.].
在本研究中,我们鉴定了另外一种AOS酶,PpAOS2,并分析了来自cyp74的酶的生化特性p .金属盘.我们建立了一种重组大肠杆菌该系统使我们能够大量生产和纯化PpAOS1, PpAOS2和ppphpl,并分析一套不同的生化参数,并比较不同酶的生化参数。通过位点定向突变,我们提供了进一步的证据,证明cyp74活性通过特定的单一氨基酸交换也可以应用于底物非特异性AOS。除了cyp74催化的分子细节外,我们还旨在分析PpAOS1和PpAOS2的亚细胞定位和生理功能。利用yfp标记的AOS进行定位研究,发现PpAOS2定位于质体,而PpAOS1仅在胞质中检测到。有趣的是,PpAOS1和PpAOS2的敲除突变体均未表现出与野生型不同的形态表型。
结果
第三种Cyp74酶的鉴定p .金属盘
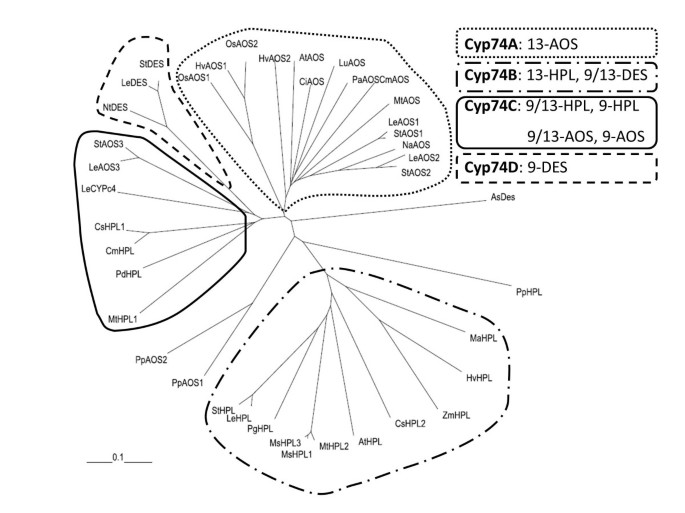
此前已鉴定出两种Cyp74酶p .金属盘,一个HPL (PpHPL) [18.]和AOS(ppaos1)[21.].进一步分析EST序列和基因组p .金属盘揭示了第三推定CYP74酶的存在。通过序列同源性,它应该是AOS,名为PPAOS2。CYP74s与不同植物的序列对齐p .金属盘酶显示类似于PPHPL [18.[AOS亚型(PpAOS1和PpAOS2)均含有cyp74家族成员的特征序列基序[25.].除了所有p450酶典型的ExxR基序[32.],这三个序列还包括独特的9个氨基酸插入血红素标志基序,其中含有必需的半胱氨酸残基,作为5th血红素配体(25.].在pppl中观察到,系统发育分析表明,所有的Cyp74来源于p .金属盘不要与开花植物中不同cyp74亚科的其他成员进行分组(图2)[18.],表明它们的氨基酸序列存在显著差异。为了验证PpAOS2为AOS的初步鉴定,我们克隆了两种PpAOS亚型,并将其与ppphpl一起表达于大肠杆菌.
不同植物Cyp74酶的系统发育分析:Allium Sativum.(作为),拟南芥(在),素类(CI),Cucumis梅洛(厘米),Cucumis一(Cs),Hordeum Vulgare.(高压)Lycopersicum esculentum(Le),穆萨ascuminata(马),公司一(女士);Medicago truncatula(公吨);尼古利亚娜attentuata.(Na),尼科尼亚塔哈瓦姆(Nt),Oryzae一(操作系统),光argentatum(PA),Prunus Dulcis.(Pd),Psidium guajava(Pg),Physcomitrella金属盘(PP),茄属植物tuberosum(英石),玉米Zm评选,AtAOS CAA63266;asd, AJ867809;AtHPL AAC69871;再见,AA072741;CmAOS AAM66138;CmHPL AAK54282;CsHPL1 AAF64041;CsHPL2 AF229812;HvAOS1 CAB86384;HvAOS2 CAB86383; HvHPL, CAC82980; LeAOS1, CAB88032; LeAOS2, AAF67141; LeAOS3, AAN76867; LeCYPc4, AAL86702; LeDES, AAG42261; LeHPL, AAF67142; LuAOS, AAA03353; MaHPL, CAB39331; MsHPL1, CAB54847; MsHPL2, CAB54848; MsHPL3, CAB54849; MtAOS, CAC86897; MtHPL2, CAC86899; MtHPL1, CAC86898; NaAOS, CAC82911; NtDES, AAL40900; OsAOS1, AY055775; OsAOS2, AAL38184; PaAOS, CAA55025; PdHPL, CAE18065; PgHPL, AAK15070; PpAOS2, XP_001759629; PpAOS1,CAC86919; PpHPL, CAC86920; StAOS1,CAD29735; StAOS2, CAD29736; StAOS3, CAI30876; StDES, CAC28152; StHPL, CAC44040; ZmHPL, AAS47027.使用ClustalX软件包,采用默认参数计算系统发生树。
克隆和表达
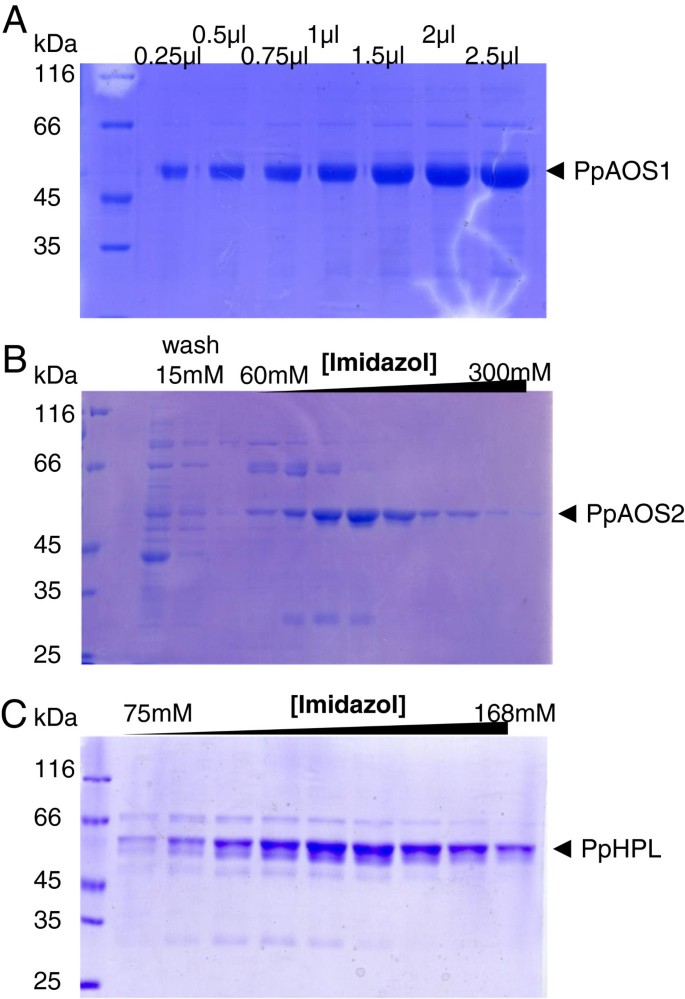
这两个AOS基因都是pcr扩增的cDNA文库p .金属盘原丝体,表达于大肠杆菌在框架中用N-末端六三氨酸肽。为了提高PPHPL的蛋白质产量,我们添加了先前用于改善ATAOS的溶解度的MAKKTS-序列[25.].用C-末端六三氨酸序列重新克隆所得片段并表达大肠杆菌.蛋白质提取基本如之前报道的那样进行[33.].通过该PPAOS1和PPAOS2以及PPHPL可以接近均匀性纯化(图3.).
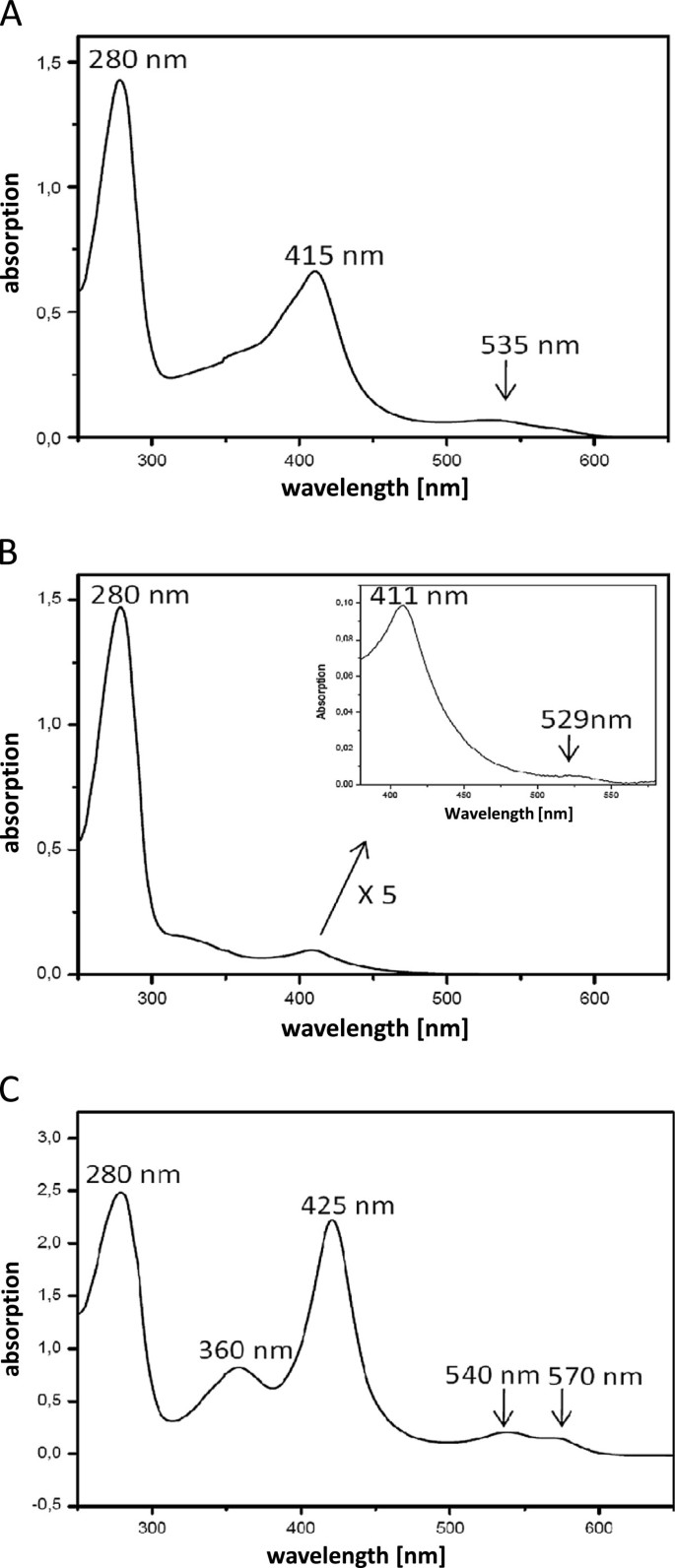
在所有的准备过程中,缓冲液呈红色,表明存在血红素辅助因子。实际上,当UV / vis PpAOS1光谱,PpAOS2 PpHPL都被记录下来,在任何情况下一个血红素蛋白质的特征吸收剖面探测:虽然UV / vis光谱显示独特的血红素吸收最大值在415 nm (Soret-band), 535海里(β频带)PpAOS1和411 nm (Soret-band)和529海里(β频带)PpAOS2(图4和B), pppl在425 nm (γ, Soret)、360 nm (δ)、540 nm (β)和570 nm (α)处有最大吸收峰(图4)4摄氏度).在这一点上值得注意的是,两种ppaos亚型的血红素占用率显著降低:根据理论摩尔消光系数在280 nm (ε)280(ppaos1)≈62000m-1厘米-1和ε.280(PpAOS2)≈57000 M-1厘米-1;用Protparam-software工具计算(http://web.expasy.org/protparam/)和ε的soret波段的预期摩尔消光系数俗≈100 000 m-1厘米-1,计算出PpAOS1的血红素含量约为。30%,而PpAOS2仅为4%。
ph值最适和动力学性质
为了确定PpAOS1和PpAOS2的最佳pH值,对13年代- 依赖于不同的pH值,在234nm处将光度测量为334nm,依赖于二加氧基十八二烯酸(13-HPOD)。虽然PPAOS1显示pH 6.5周围的最高活动,但PPAOS2的最佳pH值是pH7.0。
在模拟实验中分析了催化活性在各自的最佳pH值下对底物浓度的依赖关系。底物为18:2(n-6), 9-/13-HPOD, 18:3(n-6), 9/ 13-HPOD, 9/13- hpot (n-6), 18:3(n-3), 9/13- hpot (n-3),以及20:4(n-6), 12-HPETE的12-氢过氧化物。通过将实验得到的数据点绘制到米歇里斯-曼腾方程中所确定的动力学常数总结在表中1.范例显示在附加文件1:图S1是由PpAOS1转换9-HPOT(n-3)的Michaelis-Menten图(附加文件1:图S1A)和PpAOS2(附加文件1:图印地)。给定的k猫- 考虑到PPAOS的血红素占用分别计算出价值30%和4%(见上文)。基于K猫/ K.米- 这些结果表明,PPAOS1衍生自18:2(N-6),18:3(N-6)和18:3(N-3)的9-和13-氢过氧氧化物具有与12-相似的特异性HPETE。有趣的是,动力学数据显示与ppaos1相反,ppaos2(表2)12-HPETE具有明显的特异性;虽然该基材用K特异性转化猫/ K.米1229×106闵-1米-1C18.-氢过氧衍生物只是很差的底物猫/ K.米- 低于1×10以下6闵-1米-1.
产品分析和网站定向诱变
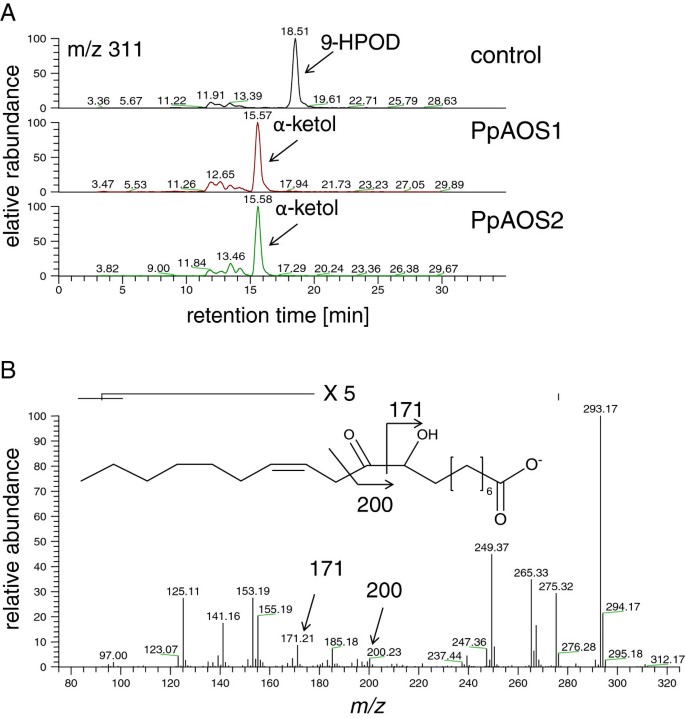
PpAOS2与C18.-氢过氧脂肪酸含量非常低,我们决定通过LC-MS分析生成的酮醇衍生物来验证AOS对这些底物的酶学性质。我们选择9作为底物年代- 用PPAOS2和PPAOS1孵育后,氢氧基十八二烯酸(9-HPOD)和比较产物形成。如图所示5这些分析表明,这两种酶(PpAOS1和2)确实都是AOS,因为它们都是从9-HPOD生成α-酮。
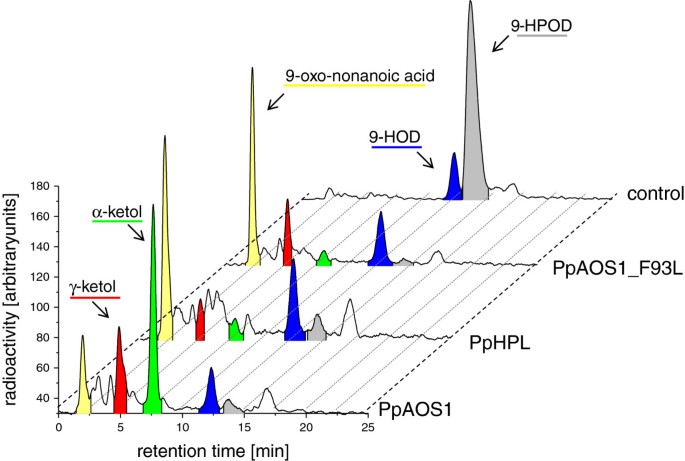
随后,可能对HPL和AOS活性至关重要的分子决定因素p .金属盘进行了分析。重点是PpAOS1和pppl,因为这些酶显示,与研究充分的AOS答:芥[36.,37.,一种广泛的底物特异性代谢产物9以及13-氢过氧脂肪酸衍生物。使用这些酶,我们想解决一个问题,即13-氢过氧化物特异性AtAOS的决定因素是否也会影响非特异性AOS酶的催化作用。为此,我们生成了一套不同的PpAOS1和pppl变体,并通过反相高效液相色谱(RP-HPLC)分析了18:2(n-6)和18:3(n-3)的9-和13-氢过氧化物异构体的特异性。一个典型的例子如图所示6.9-HPOD与PpAOS1_WT的孵育除了产生α-和γ-酮,这是由氧化烯产品的非酶水解而来,还产生了大量的特征HPL产品,9-氧壬酸。另一方面,类似的孵育表明,纯化的pppl催化9-HPOD转化为主要产物9-oxo nonanoic酸以及一组不同位点的产物在其他事物之外α和γ-ketols。以9-、13-HPOT或13-HPOD为底物时也得到了类似的结果(表)3.).这些结果与之前提出的两种酶途径的紧密联系是一致的[25.,29.,30.].
序列比对显示,两种AOS亚型均来自p .金属盘活性位点中含有严格保守的苯丙氨酸残基(PpAOS1和PpAOS2中的phe93)。该残基对AOS活性至关重要,它能稳定中间形成的碳中心底物自由基。在HPL中,这个特殊的位置通常由亮氨酸残基占据。与苯丙氨酸相反,这种残基不能稳定反应产物中间体从而导致不稳定半缩醛的形成它能自发分解成短链醛[38.].因此,将9-HPOD与各自的PpAOS1变种(其中Phe-93被Leu取代)孵育,会导致9-羰基壬酸的生成增加,同时α-酮的数量减少(图)6).分别与13-HPOD和18:3(n-3)的各自过氧化氢异构体孵育,得到相似的结果(表3.),表明该残余物是9-氢过氧化物脱水的基本决定因素。有趣的是,序列对准证明PPHPL在该特定位置也具有PHE。为了分析这种残留物的HPL活性的重要性,我们通过Leu取代PHE-151。如表所示3.对于所有测试的底物,该变体显示出未改变的活性并形成类似一组类似的产品作为野生型酶。当我们通过AOS特异性SER取代活性位点中的保守的HPL特异性ALA(ALA-169)时获得了类似的结果 - 另外据报道的残基来确定AOS活性。单个变体(PPHPL_A169S)和双变量都不是双变量(PPHPL_F151L / A169s)显示出改变的催化特异性(表3.).
PpAOS1和PpAOS2的胞间定位
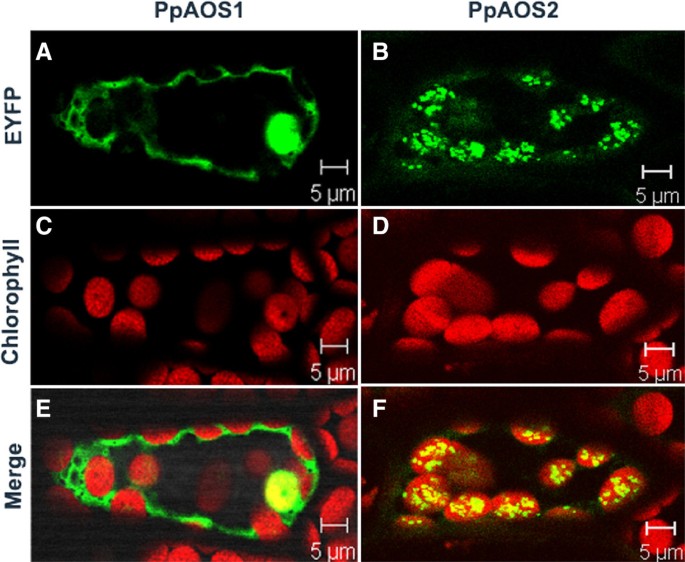
最近,通过PPHPL-YFP融合蛋白的瞬时表达显示PPHPL与塑性膜相关联p .金属盘原生质体(18.].与此一致的是生物信息学分析,预测了在pppl的n端有一个塑性过境肽序列。在PpAOS1和PpAOS2中,pSORT均未检测到塑性过境肽序列(http://psort.nibb.ac.jp/form.html), TargetP (http://www.cbs.dtu.dk/services/TargetP/)或WoLF PSORT (http://wolfpsort.org/).为了分析AOS同种型的细胞内定位,产生C-末端的YFP-融合和瞬时表达p .金属盘配子托。对于PpAOS1, YFP荧光分布在胞质内,而PpAOS2-YFP与叶绿体的红色叶绿素自荧光共定位(图)7).为了确认本地化结果,我们还产生具有C末端CFP融合的PPAOS1和PPAOS2的载体并获得类似的结果(数据未示出)。此外,我们对洋葱表皮细胞中的所有YFP和CFP融合构建体进行了瞬时表达研究。我们检测到PPAOS1-Fusions的细胞溶质定位,而对于PPAOS2-Fusions荧光仅以粒状结构观察到荧光(图7).额外尝试表达ppaos1和ppaos2p .金属盘原生质体给出了同样的结果(数据未显示)。然而,对进口的分析体外-将PpAOS1和2蛋白翻译到豌豆原生质体中失败。因此,与大多数其他Cyp74酶相比,我们的结果表明,PpAOS1可能定位于胞质,而只有PpAOS2定位于质体。在这种情况下应该注意到,类似于pppl的报告[18.], PpAOS2在叶绿体中的分布可能不是均匀的,因为在叶绿体中观察到PpAOS2聚类较为不均匀。
分析p .金属盘ΔPpAOS1和δPpAOS2——淘汰赛突变体
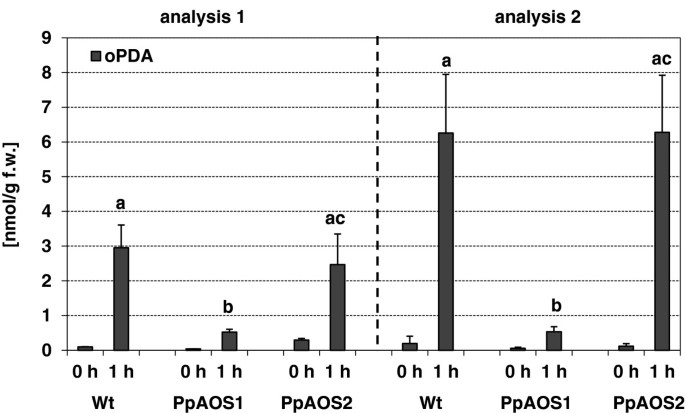
随后,分析了PPAOS1和PPAOS2的生理作用。前几项研究ΔPpAOC敲除突变体显示育性降低,孢子体形态异常和孢子发生中断[16.].调查是否删除PpAOS1和PpAOS2对繁殖也有类似的影响p .金属盘我们产生了定点清除突变体PpAOS1和PpAOS2[39.].两个独立的突变线,一个被破坏PpAOS1轨迹(ΔPpAOS1)和5个独立的突变系PpAOS2轨迹(ΔPpAOS2)均经PCR鉴定。所有敲除品系的配子载体在标准条件下生长4周,形成菌落。与野生型相比,我们没有观察到营养生长的任何差异。为了分析两种AOS亚型对孢子体形成的影响,ΔPpAOS1和δPpAOS2突变体在孢子体诱导条件下生长[40].由于突变体孢子能够像野生型孢子一样萌发,因此对孢子体发育和孢子发生均无影响。为了分析aos破坏对创伤反应的分子后果p .金属盘我们分析了独联体(+)-伤口时苔藓形成的opda。为此目的,我们进行了监控独联体(+) -OPDA-accumulationp .金属盘WT,ΔPpAOS1和δPpAOS2在机械伤害刺激1小时后用LC/ ms分析敲除苔藓。如图8是为每个使用一行的两个独立实验获得的结果PpAOS1和PpAOS2淘汰赛。虽然总的数量独联体(+)-OPDA在两个实验中略有不同,所获得的数据集表明独联体(+)-OPDA在WT和Δ中具有可比性PpAOS2,虽然发现在δ中PpAOS1减少了5-12倍。
讨论
在本研究中,我们旨在分析两种AOS亚型的生化和生理特性p .金属盘并将那些以前表征的CYP74酶,PPHPL [18.].为此目的,所有三种重组酶都纯化大肠杆菌并分析了它们的生化参数。此外,AOS同种型的亚细胞定位以及表型和伤口诱导的独联体(+)-OPDA形成ΔPpAOS1和δPpAOS2对淘汰赛线进行了调查。
在初始实验中,我们通过LC / MS分析了由PPAOS2和9-HPOD形成的产物。随着我们的动力测量表明K猫- 用c孵育ppaos218.-衍生底物的含量远低于包括PpAOS1在内的其他AOS(表1)2;我们的目的是验证PpAOS2具有真正的AOS活性,从而导致AOS产品的形成。如图所示5,这些数据表明,像PpAOS1一样,PpAOS2也具有aos活性,并形成不稳定的氧化烯衍生物,在水溶液中分解生成不同的酮醇异构体。PpAOS1和PpAOS2具有微酸性至中性pH最适(PpAOS1, pH 6.5 vs. PpAOS2, pH 7.0)。最近,PpAOS1已经确定了一个类似的最适ph值[21.].有趣的是,两种PpAOS亚型的ph优化值与相应的LOX亚型的ph优化值一致[20.],因为促进AOS活性的脂肪酸氢过氧化物底物通常由LOXs提供[43].两种AOS亚型的动力学分析表明,PpAOS1可以使用18:2(n-6)、18:3(n-6)、18:3(n-3)和20:4(n-6)衍生的12-HPETE中9-和13- lox衍生的氢过氧化物作为底物,具有相似的特异性(表)1).值得注意的是,k猫-为这些孵育所确定的值可与从其他生物体报告的AOS值相比较[25.,44].另一方面,用PPAOS2与PPAOS2的类似分析表现出与所有使用的C相似的催化活性很小18.派生的基质。而以12-HPETE为底物时,PpAOS2表现出与PpAOS1相似的高活性,表明PpAOS2对C有明显的特异性20.相移的脂肪酸氢过氧化物。该发现表明PPAOS2可以具体参与七胞苷途径p .金属盘[19.].
最近,我们发现类似于PpAOS1的pppl也可以接受C18.as well as也20.-衍生氢过氧化物为底物,并将其转化为短链醛和ω-氧脂肪酸。然而,该酶对C的9-氢过氧化物表现出偏好18.-多不饱和脂肪酸[18.].有趣的是,用AOS同种型孵育无线电标记的氢过氧化物异构体,不仅导致酮类的形成,还具有短链 - 脱脂脂肪酸(图6和表格3.).酮是典型的AOS产品,其由高稳态的氧化烯产物的非酶水解形成[10.,11.].然而,短链-羰基脂肪酸是由HPL的催化活性特别形成的产物[45].这些结果表明,PPAOS同种型均具有固有的HPL活性。这一发现符合以前的米饭和稻米的研究拟南芥AOS [30.],反映了AOS和HPL催化途径的紧密联系[25.,29.,30.].在最近的一项研究中,已经确定了连接这两个活动的分子决定因素。假设AOS活性位点上的一个特定的苯丙基残基通过稳定中间形成的碳中心底物自由基在催化中起着中心作用。利用AtAOS作为原型酶的突变研究表明,用一种高效液相色谱特异性亮氨酸替换该残基足以将AOS转化为高效液相色谱[25.,30.].然而,到目前为止,这一概念仅通过使用偏爱13-hydroperoxide C的AtAOS进行评估18.-脂肪酸 [37.].为了分析这一概念是否也可以应用于非特异性AOS,我们生成了一个由Phe到leu取代的PpAOS1变体,并分析了不同9-和13- hydroperoxc孵育纯化蛋白形成的产物18.-脂肪酸作为底物。这些数据确实表明,PpAOS1_Phe93Leu突变体在所有使用的底物中都具有显著的HPL活性,这表明野生型酶中两个区域的同分异构体在保守的Phe残基上具有相似的底物定位。我们进一步评估了Phe/ leu概念是否也适用于pppl。序列比对显示,这种特殊的AOS决定因子在Cyp74a-family (AOS)成员中确实是保守的,但有趣的是,在pppl (phe151)中也发现了它。基于aos催化机制,我们推测pppl中的Phe残基可能会稳定中间体形成的碳中心底物自由基,从而导致氧化烯的生成。当我们用不同底物同分异构体孵育AOS和HPL产物时,我们确实发现除了ω-oxo脂肪酸衍生物(HPL产物)外,还有少量其他产物(图)6和表格3.).在那些中,我们发现可以通过PPHPL的固有AOS活性形成的酮类异构体。有趣的是,与γ-酮相比,我们观察到α-酮以较低量形成的α-ketol(图6).通常,氧化烯水解导致α-酮的主要形成,而γ-酮的数量明显较少[46].然而,Grechkin和同事们指出,这种非特异性反应的轨迹高度依赖于pH值,在酸性pH下更有利于γ-酮醇的形成[46-适用于我们实验的反应条件。进一步分析了pppl中异常Phe-151对其产品特异性的影响。人们很容易认为,取代HPL中AOS特异性的苯丙氨酸会增加HPL并降低AOS活性。然而,使用各自的pphpl_phe151leu变体进行的实验显示,其产物模式与野生型酶相同。当保守的hla -specific Ala (Ala-169)被AOS-specific Ser取代时,也得到了类似的结果。据报道,这个决定因素也可以确定AOS/HPL的活性。单个变体(PPHPL_A169S)和双变量都不是双变量(PPHPL_F151L / A169s)显示出改变的催化特异性(表3.).这些结果表明,除了那些报道的AOS催化必需的pppl残基外,还可以确定产品的特异性。载于[25.,之前也得到过类似的结果。在这里,番茄HPL的一个类似的酶变体(LeHPL_L101F,A119S)仅表现出5%的AOS活性。
最近的研究表明,与开花植物相比,苔藓p .金属盘可能只利用oxylipin途径的塑性部分,而过氧化物酶体部分缺失[16.,23.].该观察结果基于伤害或病原体感染时的结果独联体(+)-OPDA在苔藓中积累,JA检测不到。免疫细胞学研究进一步支持了这一观点,表明所有LOX和AOC形式的可塑性定位[16.].我们在这里提供了支持证据,表明PpAOS2也位于质体中(图)7).然而,令人惊讶的是,PpAOS1似乎仅仅局限于胞质。如上所述,AOS产物在水溶液中极不稳定,几秒钟内通过非酶水解或自发环化分解成酮或环戊酮[11.].基于这一发现,自然发生的OPDA是对诠释的事实独联体(+) - 配置[47]讨论了几项研究(用于审查cf。[8) AOS和AOC的物理耦合在活的有机体内.尽管后来的研究表明这两种酶没有物理作用体外是必须的吗独联体(+)-OPDA [48在我们看来,如果独联体(+)-OPDA可由空间分离的PpAOC1/2和PpAOS1作用形成。另一方面,我们的动力学分析表明,PpAOS2对C有明显的特异性20.-衍生的底物,因此可能无法为ppaoc提供所需的底物独联体(+) - opda形成。为了解决这个问题,我们生成δPpAOS1和δPpAOS2消灭突变体,分析独联体(+)-OPDA的积累,并将这些结果与野生型菌株的结果进行比较。这些分析表明独联体(+) - opda受到PPAOS1中断的影响,而不是通过PPAOS2的破坏。因此,这一事实确实表明与PPAOS2相反,PPAOS1在生物合成途径中起主要作用独联体(+)-OPDA,与我们的动力学数据一致,PpAOS1和PpAOCs的空间分离提出了不稳定的PpAOS1产物如何在不被水解的情况下从胞质转位到质体的问题。如前所述[49]可以通过纯疏水环境保护联烯氧化物免受水解;因此,可以推测AOS产品嵌入膜基质中在Planta.随后随后将到目前为止的未知机制转移到塑性体中,在那里它们可以用作PPAOC的底物。通过差异局部化的事实提出了一种进一步的问题,涉及那些ppaoss的生理功能。在开花植物中,已经表明,类似的敲除突变体患有缺陷的花药和花粉发育,因此是雄性无菌[50或卵细胞发育有缺陷,因而雌性不育[51].此外,前人对Δ的研究PpAOC敲除突变体表现出在开花植物中的研究[50,51],减少独联体(+) - OPDA生物合成导致生育率降低,异常孢子体形态或中断孢子发生[16.].相比之下,ΔPpAOS1也不是δPpAOS2这里描述的敲除突变体显示出生长或孢子体发育中的任何明显偏离的表型。虽然该发现与PPAOS1的细胞溶质定位一致,但令人惊讶的是,PPAOS2的缺失也没有显示出任何表型效果。因此,发现每个AOS敲除突变体表明没有异常表型表明独联体(+)-OPDA仍在大量合成中。这一方面可能是因为PpAOS1和PpAOS2的功能重叠。然而,由于只有PpAOS2位于质体中,因此可以为PpAOCs提供氧化烯底物,这两种酶的冗余功能似乎不太可能。此外,对基因组的仔细重新调查也没有发现进一步的aos序列。另一方面,在pppl中观察到固有的AOS活动。考虑到pppl的高底物周转率[18.],其AOS侧活性仍可有效提供足够量的氧化烯产物形成独联体(+) -OPDA PpAOC。与这一假设相一致的是pppl的塑性定位[18.].
结论
我们发现两个AOS同种型p .金属盘能够代谢C18.和C.20.-衍生的脂肪酸氢过氧化物具有不同的特异性,这表明两种酶可能具有不同的底物池。与此一致,只有PpAOS2定位于发生oxylipin代谢的质体中,而PpAOS1在胞质中检测到。然而,令人惊讶的是,只有PpAOS1的破坏影响创伤反应,并导致减少形成独联体(+) -OPDA。此外,两种AOS的敲除突变体均表现出异常表型,提示其与另一种Cyp74酶PpHPL功能重叠。位点定向诱变实验证实了这一点。这表明,非特异性底物PpAOS1和pppl的催化轨迹紧密相连,可以通过单个氨基酸交换相互转化。
方法
本研究使用的所有化学品均来自Sigma-Aldrich或Carl Roth & Co.。琼脂糖购自Biozym Scientific GmbH,而所有脂肪酸购自Cayman chemicals。乙腈购自Fisher Scientific,酶购自MBI Fermentas。
PpAOS1、PpAOS2和ppphpl的克隆、表达和定点突变
这两个AOS基因都是基于est文库中cyp74 -酶的序列相似性进行鉴定的,该文库在[18.].通过5 ' -RACE获得全长cDNAp .金属盘原型。PPHPL从在[18.].利用引物将pcr片段克隆到pGEM-T载体(Promega)中Sph一世/XHO.我(ppaos1)和NHE.一世/后III (PpAOS2)限制性位点。如前所述,为了增加酶的溶解性,我们将肽序列MAKKTSS重组添加到pppl的N-;端[25.].对于异源表达PpAOS1克隆到pqe30载体(Qiagen)中,转染到大肠杆菌SG13009 [pRep4]PpAOS2和PpHPL分别克隆到pET28a和pET24b载体(Invitrogen)中,转染到大肠杆菌Bl21star。携带质粒的重组细胞在LB或2xYT培养基中培养至OD值6000.6 - 0.8。为了保证酶表达过程中血红素的产生不是限制因素,我们还添加了80 mg/L α-氨基乙酰氨基酸和150 μM 0.1 mM柠檬酸铁铵。添加1 mM异丙基β- d -硫代半乳糖苷诱导蛋白表达,16°C孵育3 d。pppl的表达如前所述[18.].根据制造商说明,使用Phusion™-“高保真”- pcr - system (Finnzyme)的位点定向诱变技术,从各自的质粒中生成具有定义的单点突变的酶变体。
YFP c端融合结构的瞬时表达
来自携带正宗克隆的质粒的EYFP由Martin Fulda(Georg-August-University,Göttingen,德国)提供。EYFP cDNA被克隆到质粒puc18-进入中[52],利用引物进行PCR不我和萨尔I限制性位点导致pUC18-Entry-YFP。PpAOS1和PpAOS2利用引物将cDNA导入pUC18-Entry-YPF埃森V和不我限制的网站。通过Gateway LR克隆酶混合(Invitrogen)ppaos1-yfp.和PpAOS2-YFP将编码序列转移到含有花椰菜花叶病毒(CaMV)的植物表达目的载体pCAMBIA33.1质粒中。35年代子,一个丙氨酸R1 / R2网关盒和CAMV-35年代- 重量器[52].洋葱表皮细胞和p .金属盘以质粒包被的1 μm金粒子为载体,在氦驱动粒子加速器(PDS-1000/He;BioRad), 350 psi的破裂盘和27英寸汞的真空。用4 ~ 8 μg质粒dna包被金颗粒。轰击后,洋葱细胞在RT下培养14 - 20 h,配子载体在长光照条件下培养(光照16 h,黑暗8 h)。此外,如前所述,构建物在苔藓原生质体中表达[18.].使用Olympus BX51 eBiforEcence显微镜或Zeiss LSM 510共聚焦显微镜记录图像。
一代的p .金属盘靶向基因敲除突变体
将基因破坏构建体转染到p .金属盘原生质体和转基因株系的再生按标准程序进行[39.].用于生成ΔPpAOS1敲除突变体,选择标记盒(号子:新霉素磷酸转移酶:号-terminator)源自vector pBIN19 [53被克隆到Xcmcdna - pgem - t亚克隆的I位点。Δ的PpAOS2通过首次克隆选择标记盒(CaMV-)获得敲除突变体35年代-promoter :: NeomycinPhosphotor转移酶:: Camv-35年代- 从PCAMBIA2300衍生的人)(AF234315.1)进入PUC18,然后括起来”PpAOS2使用620 bp的片段使用埃森一世/BglII限制性位点,最终亚克隆a 3”PpAOS2590 bp片段使用萨尔一世/后三世限制性位点。转染前,通过适当的限制性内切酶(PpAOS1:后III /APA一世;PpAOS2:后III /日月光半导体I).利用转基因植株的DNA提取液,通过PCR方法鉴定目标基因敲除株p .金属盘使用修改的ctab协议的线路[54].两个独立的PpAOS1和五个独立的PpAOS2基因敲除突变体的克隆已经在液氮上储存,并可通过国际苔藓种群研究中心(IMSC)免费获得。http://www.moss-stock-center.org/),登录号如下:ΔPpAOS1敲除突变体:IMSC 40383 (KO5), IMSC 40384 (KO21);ΔPpAOS2敲除突变体:IMSC 40686(KO9),IMSC 40687(KO14),IMSC 40688(KO71),IMSC 40689(KO77)和IMSC 40670(KO119)[55].
生长条件
配子体在标准条件下生长,在4周内形成菌落。然后在孢子体诱导条件下生长苔藓(培养条件详载于[40])。
分析环戊烯酮
环戊烯酮的分析方法如[42[植物激素核心测定用一种修饰。对于OPTA的检测,添加以下MRM转变:317/273 [降解电位(DP)-65 V,入口电位(EP)-4 V,碰撞能量(CE)-22 V]。
细胞裂解和蛋白质纯化
按照[33.[有一些修饰:简要地,通过离心(8 000×G,20分钟,4℃)来收获来自1L培养的细胞,并将所得细胞浆料溶解在150ml 100mM Tris / HCl(pH7.8)中20%甘油。加入溶滤液(0.2mg / ml),并在4℃下孵育30分钟。离心(8000×G,10分钟,4℃)沉淀的球细胞溶解在含有14mM乙酸镁的50ml 100mM磷酸钠(pH8.0)缓冲液中溶解在50ml 100mM磷酸钠中,60mM乙酸钾,0.1mm DTT,500mm尿素在-80°C下冷冻18小时。将蛋白酶抑制剂苯基甲基磺酰氟磺酰加入到0.5mm的最终浓度中,并且通过从布兰森采用超声纤维细胞欠压器(B15)裂解细胞。通过以50 000×g和4℃离心20分钟除去细胞碎片。将得到的细胞自由提取物施加在固定的Ni上2+-column (GE-Healthcare的His-Trap™HP-column),采用ÄKTAprime系统。用含有50 mM NaCl、500 mM尿素的50 mM磷酸钠缓冲液(pH 8.0)洗脱非特异性结合蛋白。在ppaos2纯化的情况下,我们应用了额外的步骤,在其中,我们用含有50 mM NaCl、500 mM尿素和15 mM咪唑的50 mM磷酸钠缓冲液(pH 8.0)清洗色谱柱,以进一步洗脱未特异性结合的蛋白。最后,用50 mM磷酸钠缓冲液(pH 8.0) 1 M NaCl、500 mM尿素和50 mM - 300 mM咪唑线性梯度洗脱特异性结合蛋白,流速为1 mL/min,洗脱时间20 min。通过SDS-PAGE分析评估洗脱蛋白的纯度[56].
动力学和pH-最佳
初步实验旨在确定酶解转化的最佳pH值为30 μM 13年代-HPOD被两个aos亚型催化。为此,我们使用Cary 100生物分光光度计(Varian)测量了在给定pH下234 nm处吸收随时间的下降。反应在室温条件下进行,pH分别为200 mM醋酸钠(pH 4.7 - 5.5)、200 mM磷酸钠(pH 5.5 - 8.0)、200 mM硼酸钠(pH 8.0 - 10.5),加入100 nM AOS启动反应。在类似的实验中,通过分析不同底物浓度在234 nm处的吸收随时间的减少来确定动力学性质。通常我们使用的浓度范围为2 μM - 100 μM。我们发现了高K的底物米- 值,浓度高达150μm。用于该分析的不同底物是:9-和13-氢过氧基衍生物为18:2(N-6)(9- / 13-HPOD),18:3(N-6)(9/13-HPOT(n-6),18:3(N-3)(9/13-HPOT(N-3))以及20:4(N-6)(12-HPETE)的12-氢过氧基衍生物。注意不同在这些实验中施用酶浓度:与9/13-HPOD,9/13-HPOT(N-3)和9/13-HPOT(N-3)和0.1nm的温育,PPAOS1浓度为0.05nm。12-HPETE。具有12- HPET的PPAOS2-浓度为1nm和100nm,用于9/13-HPOT(N-6),9/13-HPOD和9/13-HPOT(N-3)。计算k的计算猫我们考虑的价值观,PPAOS1和PPAOS2的血液占用分别为30%和4%。
而9和13异构体分别是由各自的脂肪酸与马铃薯LOX或大豆LOX孵育得到的,12-HPETE是由20:4(n-6)使用p .金属盘LOX1及2 [20.].这些程序已经描述为其他地方[18.].
产品分析
所有用于产品分析的底物为14.c标记在C-1,并制备类似上述方法。[1-14.C] -hydroperoxy脂肪酸基质通常是在1毫升100毫米钠磷酸盐缓冲剂(pH值6.0)在室温下不断摇晃,30分钟。形成产品与乙醚提取和分析,rp采用1100高效液相色谱系统(安捷伦)配有LiChroCART®125 - 4 LiChrospher®100 - rp - 18(5 μm)色谱柱(Merck),类似于前面描述的方法[57].简单地说:采用乙腈/水/乙酸(50/50/0.1,v/v/v)为溶剂体系a,乙腈/水/乙酸(80/20/0.1,v/v/v)为溶剂体系B。本研究采用梯度洗脱模式:流速:1 mL/min, 0-25 min, 100% A;从100% A到100% B 25-26分钟;26-36分钟,100% B, 36-38分钟,从100% B - 100% a。使用与色谱设备耦合的Raytest无线电检测器检测放射性标记产品。所形成的所有产品均经LC-MS分析确认,如前所述[58].
缩写
- AOC:
-
丙二烯氧化环化酶
- 代谢:
-
联烯氧化物合成酶
- HPL:
-
Hhydroperoxide裂合酶
- DES:
-
Divinylether合酶
- P450酶:
-
细胞色素P450
- YFP:
-
黄色荧光蛋白
- 液态氧:
-
脂氧合酶
- 爆炸品处理:
-
环氧十八二碳二烯酸
- 测试结束:
-
环氧octadecatrienoic酸
- h(p)ete:
-
Hydro(Pero)XY eicosatetraeno酸
- HPOT:
-
Hydroperoxy octadecatrienoic酸
- HPOD:
-
Hydroperoxy octadecadienoic酸
- JA:
-
茉莉酸
- opda:
-
独联体(+) - 12-氧代植物酸
- 球队:
-
11-oxo prostatrienoic酸
- RP:
-
反相
- 聚合酶链反应:
-
聚合酶链反应
- WT:
-
野生型
- 高效液相色谱法:
-
高压液相色谱。
参考文献
- 1。
真菌中的氧化脂素。中国海洋大学学报(自然科学版),2011,34(2):457 - 461。10.1111 / j.1742-4658.2011.08027.x。
- 2。
Tsitsigiannis di,Keller NP:奥氧化物作为发育和宿主真菌通信信号。趋势微生物。2007,15:109-118。10.1016 / J.Tim2007.01.005。
- 3.
Funk CD:前列腺蛋白和白核菌:芍洲生物学的进展。科学。2001,294:1871-1875。10.1126 / Science.294.5548.1871。
- 4.
阿科斯塔IF,农民EE:茉莉酸。拟南芥的书。编辑:Keiko T, Caren C, Luca C, Georg J, Dan K, Rob L, Ryan L, Rob MC, Harvey M, Doris W. 2010,美国植物生物学家协会,Rockville, 1-13。
- 5.
2 .王志强,王志强,王志强,等:非哺乳动物中羟化脂的生物合成。中国生物医学工程学报,2009,31(4):457 - 461。10.1016 / j.plipres.2009.02.002。
- 6.
Howe GA, Jander G:植物对昆虫食草动物的免疫。植物学报,2008,59:41-66。10.1146 / annurev.arplant.59.032607.092825。
- 7.
Wasternack C: Jasmonates:生物合成、信号转导和在植物胁迫反应和生长发育中的作用的最新进展。张志强。2007,100:681-697。10.1093 / aob / mcm079。
- 8.
茉莉酸酯生物合成的酶-结构,功能,调控。植物化学学报。2009,30(4):457 - 461。10.1016 / j.phytochem.2009.07.032。
- 9。
Ellinger D, Stingl N, Kubigsteltig II, Bals T, Juenger M, Pollmann S, Berger S, Schuenemann D, Mueller MJ: Dongle和缺陷的花药开裂1脂肪酶对损伤和病原体诱导的茉莉酸盐生物合成不是必需的:多余的脂肪酶有助于茉莉酸盐的形成。植物营养与肥料学报,2010,29(4):531 - 534。10.1104 / pp.110.155093。
- 10。
Hamberg M:玉米氢过氧化物异构酶的机制:检测12,13(S)-Oxido-9(Z),11-十八二碳酸。Biochim Biophys Acta。1987,920:76-84。10.1016 / 0005-2760(87)90313-4。
- 11.
天然丙烯氧化物的分离和表征:脂质过氧化氢代谢的不稳定中间体。美国国家科学院学报。1988年,85:3382 - 3386。10.1073 / pnas.85.10.3382。
- 12.
丙烯氧化物环化酶:植物脂质代谢的一种新酶。中国生物化学学报,1999,19(4):518-526。10.1016 / 0003 - 9861 (90) 90753 - l。
- 13。
BREITHUPT C,KURZBAUER R,Schaller F,Stintzi A,Schaller A,Huber R,Macheroux P,Clausen T:植物12-氧化钛的底物特异性的结构基础。J Mol Biol。2009,392:1266-1277。10.1016 / J.JMB.2009.07.087。
- 14。
王志强,王志强,王志强:茉莉酸的生物合成。植物营养与肥料学报,2003,22(4):457 -461。10.1104 / pp.75.2.458。
- 15.
Dave A, Graham IA: Oxylipin信号通路:茉莉酸前体顺-(+)-12-氧-植物二烯酸(cis- opda)的独特作用。植物科学学报,2012,3:42。
- 16.
Stumpe M, Göbel C, Faltin B, Beike AK, Hause B, Himmelsbach K, Bode J, Kramell R, Wasternack C, Frank W,等:藓类小Physcomitrella patens含有环戊酮,但没有茉莉酸盐:氧化烯环化酶突变导致育性降低和孢子体形态改变。植物营养学报,2010,29(6):741 - 748。10.1111 / j.1469-8137.2010.03406.x。
- 17.
Senger T, Wichard T, Kunze S, Göbel C, Lerchl J, Pohnert G, Feussner I:一种多功能脂肪加氧酶,具有脂肪酸氢过氧化物裂解活性。中国生物医学工程学报。
- 18.
Stumpe M, Bode J, Göbel C, Wichard T, Schaaf A, Frank W, Frank M, Reski R, Pohnert G, Feussner I:小Physcomitrella patens中的c9 -醛生物合成。Acta botanica sinica(云南植物研究),2006,34(5):531 - 534。10.1016 / j.bbalip.2006.03.008。
- 19。
Wichard T, Göbel C, Feussner I, Pohnert G:苔藓小Physcomitrella patens中前所未有的脂氧合酶/氢过氧化物裂解酶途径。北京化工大学学报(自然科学版),2005,44:158-161。10.1002 / anie.200460686。
- 20。
Anterola A, Göbel C, Hornung E, Sellhorn G, Feussner I, Grimes H:小Physcomitrella patens具有二十烷和十八烷两种途径的脂加氧酶。植物化学学报。2009,40(4):457 - 461。10.1016 / j.phytochem.2008.11.012。
- 21。
Bandara PK,Takahashi K,Sato M,Matsuura H,Nabeta K:Physcomitrella含有含有苯甲酸合成酶的克隆和功能分析。Biosci Biotechnol Biochem。2009,73:2356-2359。10.1271 / BBB.90457。
- 22。
Neumann P,Brodhun F,Sauer K,Herrfurth C,Hamberg M,Brinkmann J,Scholz J,Dickmanns A,Feussner I,Ficner R:Physcomitrella的晶体结构Patens AOC1和2:洞察酶机制和底物特异性的差异。植物理性。2012,10.1104 / pp.1112.205138。
- 23。
庞塞德利昂我Schmelz EA Gaggero C,卡斯特罗,阿尔瓦雷斯,Montesano M: Physcomitrella patensactivates细胞壁的强化,程序性细胞死亡和积累进化保守防御信号,如水杨酸和12-oxo-phytodienoic酸,但不是茉莉酸,uponBotrytis cinereainfection。acta botanica yunica(云南植物研究中心),2012,29(6):591 - 598。
- 24.
Nelson D,Werck-Reichhart D:以P450为中心的植物演进视图。工厂J.2011,66:194-211。10.1111 / J.1365-313x.2011.04529.x。
- 25.
李志强,李志强,李志强,等。羟磷脂生物合成酶的分子生物学研究进展。自然科学。2008,455:363-368。10.1038 / nature07307。
- 26.
CYP74酶对羟氧化脂形成的影响。植物化学学报,2006,5:347-357。10.1007 / s11101 - 006 - 9038 - 9。
- 27.
Toporkova YY,OSIPOVA EV,Mukhtarova L,GogoLev Yv,Grechkin An:Cyp74C亚家族酶的催化作用因点定向诱变而改变。Dokl Biochem Biophys。2010年,435:287-290。10.1134 / S1607672910060025。
- 28.
李丽,常志,潘志,傅志强,王旭:氧化烯合成酶晶体结构揭示的细胞色素P450 CYP74A与血红素结合方式和底物通路。美国国家科学院学报。2008年,105:13883 - 13888。10.1073 / pnas.0804099105。
- 29.
CYP74氧化烯合成酶和相关细胞色素P450酶的机制。植物化学学报。2009,30(4):531 - 534。10.1016 / j.phytochem.2009.08.005。
- 30.
赵K-B,赖伟,王志强,王志强:氧化丙烯合成酶的反应机理:量子力学/量子力学的相互作用和实验研究。中国生物化学学报,2011,27(4):514 - 514。10.1016 / j.abb.2010.07.016。
- 31.
CYP74催化作用的决定因素:通过定点诱变将烯氧合酶转化为过氧化氢裂解酶。FEBS Lett. 2008, 582: 3423-3428。10.1016 / j.febslet.2008.09.005。
- 32.
Sirim D,Widmann M,Wagner F,Pleiss J:细胞色素P450单氧基酶模块化结构的预测和分析。BMC STRUCT BIOL。2010,10:34-10.1186 / 1472-6807-10-34。
- 33。
Richardson Th,Hsu MH,Kronbach T,Barnes Hj,Chan G,Waterman Mr,Kemper B,Johnson EF:来自大肠杆菌的重组表达细胞色素P450 2C3的纯化和表征中:2C3编码P450 3B的6B-羟化酶缺陷形式。拱生物学生生物糖。1993,300:510-516。10.1006 / ABBI.1993.1069。
- 34。
Jernerénf,汉伯格M,Oliw E:Lasiodiplodia的Lasionalate 9R-Dioxygenase和Ineinnate合成酶活性。脂质。2012,47:65-73。10.1007 / s11745-011-3622-5。
- 35。
Jernerénf,霍夫曼I,oliw eh:LinoLeate 9R-Dioxygenase和Aspergillus Terreus的联烯氧化物合成酶活性。拱生物学生生物糖。2010,495:67-73。10.1016 / j.abbb2009.12.022。
- 36。
Laudert D,Pfannschmidt U,Lottspeich F,Holländer-CzytkoH,Weiler Ew:拟南芥α11angaa甲烷的克隆,分子和功能表征,八烷酸盐途径的第一酶。植物mol biol。1996年,31:323-335。10.1007 / bf00021793。
- 37。
Hughes RK, Belfield EJ, Casey R: CYP74C3和CYP74A1,植物细胞色素P450酶活性受洗涤剂胶束结合调控,并提出了新的CYP74酶分类规则。生物化学学报。2006,34:1223-1227。10.1042 / BST0341223。
- 38。
Grechkin AN, Hamberg M:“异溶氢过氧化物裂解酶”是一种异构酶,产生一种短命的脂肪酸半缩醛。Acta botanica sinica, 2004, 32(4): 427 - 434。10.1016 / j.bbalip.2003.12.003。
- 39.
Frank W, Decker EL, Reski R:研究小立碗藓的分子工具。植物生态学报。2005,7:220-227。10.1055 / s - 2005 - 865645。
- 40。
王志强,王志强,王志强,等:日照长度和温度对小绒螯蟹有性繁殖和MADS-box基因表达的影响。植物生态学报。2002,4:595-602。10.1055 / s - 2002 - 35440。
- 41。
利用甲基叔丁基醚提取油脂用于高通量脂质组学研究。中国生物医学工程学报,2008,31(4):497 - 497。10.1194 / jlr.D700041-JLR200。
- 42。
Ternes P,Feussner K,Werner S,Lerche J,Oive T,Heilmann I,Riezman H,Feussner I:神经酰胺合酶LoH1的破坏导致拟南芥的自发性细胞死亡。新植物。2011年,192:841-854。10.1111 / J.1469-8137.2011.03852.x。
- 43。
植物胁迫反应和发育过程中脂源信号的结构需求。中国生物医学工程学报。2010,5:63-77。10.1021 / cb900269u。
- 44。
Hughes RK,Belfiff Ej,Ashton R,Fairhurst Sa,Göbelc,Stumpe M,Feussner I,Casey R:来自拟南芥(CYP74A1)的Ineline氧化物合成酶(CYP74A1)表现出由单体 - 胶束协会调节的双重特异性。费用。2006,580:4188-4194。10.1016 / J.Febslet.2006.06.075。
- 45。
Vick Ba,Zimmerman DC:脂氧合酶和氢过氧化物裂解酶在发芽西瓜幼苗。植物理性。1976年,57:780-788。10.1104 / pp.57.5.780。
- 46。
Grechkin AN,Kuramshin Ra,Safonova Ey,Latypov SK,Ilyasov AV:通过联烯氧化物形成亚烯酸13-氢过氧化物的酮。两种不同机制的联烯氧化物水解的证据。Biochim Biophys Acta。1991,1086:317-325。10.1016 / 0005-2760(91)90176-i。
- 47。
Laudert D,Hennig P,Stelmach Ba,Muller A,Andert L,Weiler Ew:使用环糊精固定相,通过毛细管气相色谱 - 质谱法分析生物样品中的生物样品中的12-氧代植物酸对映射。肛门生物化学。1997,246:211-217。10.1006 / abio.1997.2012。
- 48。
关键词:顺式(+)-12-氧-植物二烯酸,酶固相合成,AOS, AOC植物营养与肥料学报。10.1016 / j.phytochem.2006.10.010。
- 49.
(8R)-8-氢过氧二十碳三烯酸在珊瑚丛中形成一种氧化烯。化学学报,1989,11:1891-1892。10.1021 / ja00187a060。
- 50.
Park J-H,Halitschke R,Kim HB,Baldwin It,Feldmann Ka,Feyereisen R:由于茉莉酸生物合成的嵌段,拟南芥中的抗癌和缺陷伤口信号转导。工厂J. 2002,31:1-12。10.1046 / J.1365-313x.2002.01328.x。
- 51.
Li L, Zhao Y, mcaig BC, Wingerd BA, Wang J, Whalon ME, Pichersky E, Howe GA: CORONATINE-INSENSITIVE1同源物对番茄种子成熟、茉莉酸信号防御反应和腺毛发育的母系控制。植物学报。2004,16:126-143。10.1105 / tpc.017954。
- 52.
(1)酵母和烟草种子中(10E,12Z)共轭亚油酸的产生。生物化学学报,2003,31(4):457 - 461。10.1016 / j.bbalip.2005.11.004。
- 53.
Bevan M:植物转化的二元农杆菌载体。核酸RES。1984,12:8711-8721。10.1093 / nar / 12.22.8711。
- 54.
Ausubel FM, Brent RE, Kingston DD, Seidmann JR, Smith JA, Struhl K:当前的分子生物学协议。1993,Green Publishing Associates和John Wiley and Sons Inc.,纽约。
- 55.
陈志强,王志强,王志强,等。小Physcomitrella patens突变体的高效低温保存。植物学报。2004,6:119-127。10.1055 / s - 2004 - 817796。
- 56.
Laemmli UK:在噬菌体T4的头部组装过程中裂解结构蛋白。自然。1970,227:680-684。10.1038 / 227680A0。
- 57。
Blée E, Joyard J:菠菜叶绿体的包膜是脂肪酸氢过氧化物的一个代谢位点。植物营养与肥料学报。1996,11:445-454。
- 58。
Brodhun F,Gobel C,Hornung E,Feussner I:从Aspergillus Nidulans的PPOA鉴定为脂肪酸血红素二氧化酶/过氧化物酶的融合蛋白和细胞色素P450。J Biol Chem。2009,284:11792-11805。10.1074 / JBC.M809152200。
确认
作者感谢Sabine Freitag和Pia Meyer的完美技术援助,感谢Uwe Langner和Ralf-Bernd Klösgen在豌豆叶绿体中进行了PpAOS1 + 2的进口实验(德国Halle/Saale马丁-路德大学)。马丁·富尔达(乔治-奥古斯特大学,Göttingen,德国)提供的eyfp质粒也得到了认可。这项工作得到了德国联邦和州政府卓越计划(EXC 294)以及国际研究培训组(IRTG) 1422的资助。JS由Göttingen神经科学与分子生物学研究生院(GGNB)生物分子项目资助。作者也感谢三位审稿人对手稿的科学和语言学方面的宝贵评论。
作者信息
隶属关系
相应的作者
附加信息
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
作者的贡献
JS、EH、BF、WF和MS克隆并突变不同的Cyp74结构体。JS分离纯化蛋白并进行孵育实验。JS、CH、AKB、BF、FB进行产品分析。利用EH进行了定位实验。FB, EH, WF, RR和IF设计了研究并撰写了论文。所有作者阅读并批准了最终的手稿。
茱莉亚·肖尔茨,弗洛里安·布罗德洪对这项工作也有贡献。
电子补充材料
12870_2012_1197_moesm1_esm.pdf.
附加文件1:图S1。以9-HPOT(n-3)为底物的PpAOS1 (A)和PpAOS(2)的动力学分析。通过加入酶开始反应,并在234 nm处用光谱法监测反应时间的变化。数据符合米凯利斯-曼腾方程。(PDF 99 KB)
作者为图像提交的原始文件
下面是作者提交的原始图片文件的链接。
权利和权限
开放访问本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
肖尔兹,J,布罗德洪,F,霍农,E。et al。生物合成氧化烯Physcomitrella金属盘.BMC植物杂志12,228(2012)。https://doi.org/10.1186/1471-2229-12-228
收到了:
接受:
发表:
关键字
- CYP74酶
- 敲除突变体
- 丙二烯氧化
- opda.
- 脂肪酸氢过氧化物