摘要
背景
在脯氨酸缺乏突变体纯合子之间的杂交p5cs1和杂合的p5cs2 (p5cs1 p5cs2 / p5cs2),用作雄性,和不同的拟南芥突变体,用作雌性,该p5cs2突变的等位基因很少传递给异交后代,这表明两种基因都携带突变的雄配子体的育性P5CS1而且P5CS2严重损害。
结果
确定花粉的育性缺陷p5cs1 p5cs2 / p5cs2突变体,突变等位基因通过花粉的传播通过两种方式进行测试。首先,遗传的子代数量与磺胺嘧啶的显性耐药标记相关p5cs2是确定。第二,数量p5cs2 / p5cs2胚胎的决心。抗感植株的比例接近50%,且没有流产胚胎,这与雄性配子体携带两者的假设一致p5cs1而且p5cs2等位基因很少遗传给后代。此外,在与野生型的互交中,约占50%p5cs2突变等位基因被传递给孢子体代p5cs1 p5cs2 / p5cs2被用作女性,而不足1%的p5cs2等位基因可遗传给异交后代p5cs1 p5cs2 / p5cs2被当作男性使用。突变体花粉的形态和功能分析显示,突变体花粉粒小,退化,不能存活,表明突变体纯合子p5cs1和杂合的p5cs2花粉发育受损,提示脯氨酸在雄配子体发育中的作用。与这些发现一致的是,我们发现花粉来自p5cs1纯合突变体,表现出与花粉相似但不明显的缺陷p5cs1 p5cs2 / p5cs2突变体。最后,我们展示花粉来自p5cs1 p5cs2 / p5cs2植物的脯氨酸含量低于野生型,从另一发育开始提供的外源脯氨酸可以部分弥补形态和功能花粉缺陷。
结论
我们的数据表明,雄性配子体的发育携带突变的两种P5CS1而且P5CS2严重损害,表明脯氨酸是花粉发育和传播所必需的。
背景
脯氨酸除了作为蛋白质源性氨基酸的作用,以及作为一种分子参与了对许多生物和非生物胁迫的响应之外,它还与植物的发育,特别是开花和繁殖有关[1- - - - - -3.].关于脯氨酸可能在正常非胁迫条件下的植物繁殖中起关键作用的第一个有说服力的证据来自于对一些植物物种中游离脯氨酸含量的测量,结果显示,在花转变后,营养组织中的脯氨酸水平较低,接着是生殖组织和器官中的脯氨酸积累[4- - - - - -8].蒋和丹德卡[7的研究报告称,游离脯氨酸会在拟南芥生殖组织中高达26%的氨基酸库,而在营养组织中只占1-3%。在花的器官中,不同的作者[7- - - - - -11]指出脯氨酸含量最高的花器官是花粉,其中脯氨酸可能占氨基酸总含量的70%以上[8].
到目前为止,尚不清楚花粉中如此大量脯氨酸积累的原因。由于花粉粒经历一个自然脱水的过程,一些作者提出相容性渗透物具有保护细胞结构不变性的作用[7,12,13],而其他[14]假定脯氨酸作为能量来源或作为支持花粉管快速和需要能量的伸长的代谢前体的作用。另一方面,花粉管的迅速伸长需要大量的细胞壁蛋白合成[15],其中一些富含脯氨酸或羟脯氨酸延伸,可能需要脯氨酸积累来维持富含脯氨酸的细胞壁蛋白的高水平合成[16].
不管它的功能如何,脯氨酸在花粉中的积累可能是由于来自外部来源的运输增加,或由于内源性脯氨酸合成和降解之间的比例增加,或由于两者的结合,但目前还没有确凿的证据来区分这些替代模式。脯氨酸通过韧皮部血管的长距离运输已有文献记载[17,18)和自AtProT1(AT2G39890),一个编码氨基酸载体的基因,最近被证明是调节植物脯氨酸吸收的,在成熟花粉中高度表达[19],转运被认为是脯氨酸在花粉粒中积累的原因。然而,AtProT家族所有基因的单、双、三敲除突变体均可获得,且与野生型相比,它们在脯氨酸含量和花粉萌发效率上均无差异[19],增加了内源性脯氨酸合成可能负责或促进花粉中脯氨酸积累的可能性。
在高等植物中,脯氨酸的合成是从谷氨酸开始的,谷氨酸在酶Δ的催化下经过两步转化为脯氨酸1-吡咯-5-羧酸合成酶(P5CS)和Δ1-pyrroline-5-carboxylate还原酶(P5CR)。存在一种替代的脯氨酸合成途径,通过δ-鸟氨酸氨基转移酶(δ-OAT;At5g46180)和P5CR,已经被一些作者假设[20.,21].然而,这一途径与脯氨酸合成的相关性最近受到了质疑[22而谷氨酸可能是植物中合成脯氨酸的唯一前体。P5CS被认为是植物脯氨酸生物合成的限速酶,在拟南芥中由两个相似基因编码P5CS1(At2g39800)和P5CS2(At3g55610) [23],而尚未有类似基因的描述P5CR(At5g14800)。
T-DNA插入突变体已被鉴定[1,3.,24)为P5CS1(SALK_063517p5cs1-4),P5CS2(GABI_452G01p5cs2-1, FLAG_139H07p5cs2-2),为基因功能的分配提供了提示。P5CS1负责非生物胁迫诱导脯氨酸积累,作为纯合子p5cs1突变体在胁迫诱导下不积累脯氨酸,对环境胁迫高度敏感[3.,24),而P5CS2是胚胎发育所必需的,如纯合子p5cs2突变体是胚胎致死的p5cs2突变等位基因只能在p5cs2/P5CS2杂合的突变体(1,24].此外,这两个基因已被证明调节拟南芥花的转变,作为纯合子突变体的开花时间p5cs1和杂合的p5cs2,比单个的延迟更大p5cs1突变体(1,2].
在一项旨在识别脯氨酸与拟南芥花通路相互作用的基因筛选过程中(Mattioli等人,在准备中),我们发现p5cs2脯氨酸缺乏时,突变很少遗传给后代p5cs1 p5cs2 / p5cs2被用作花粉供体,这表明脯氨酸在影响男性生育能力方面有另一种作用。这促成了本研究的分析,旨在评估内源脯氨酸在花粉发育和育性中的作用。我们在这里展示了在这两种基因中携带突变的雄配子体的发育P5CS1而且P5CS2严重受损,表明脯氨酸在花粉功能和发育中的作用。
结果
在十字架p5cs1 p5cs2 / p5cs2,作为雄性和拟南芥开花时间突变体,作为雌性,旨在了解脯氨酸相互作用的开花途径(Mattioli等人,在准备中)p5cs1突变等位基因总是传递给异交后代,而异交后代的传递频率p5cs2突变等位基因极低(平均0.8±0.1%)。由于没有发现明显的配子体缺陷p5cs1也不上p5cs2单突变体,这一结果表明雄性生育能力缺陷可能与两种突变体的花粉粒有关P5CS1而且P5CS2基因。
种族隔离的p5cs2自花授粉的种子种群中的突变等位基因p5cs1 p5cs2 / p5cs2符合植物配子体突变的存在
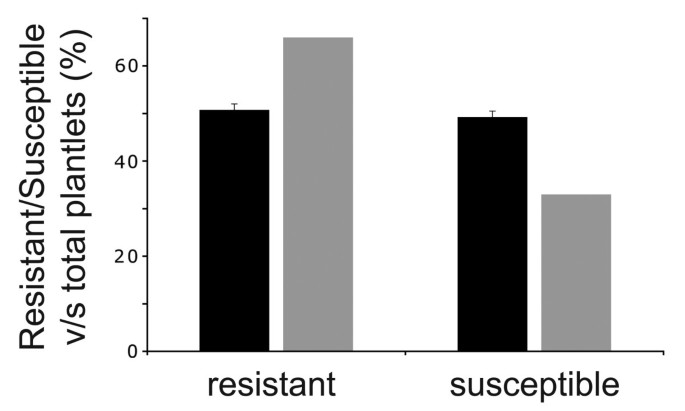
验证花粉的育性缺陷p5cs1 p5cs2 / p5cs2突变体中,磺胺嘧啶基因的分离-一个与T-DNA插入相关的主要抗性标记P5CS2-在自交的种子群体中分析p5cs1 p5cs2 / p5cs2植物.由于纯合子p5cs2单突变体胚胎致死[1],我们期望种族隔离p5cs2自交群体中磺胺嘧啶连锁抗性与易感植株的抗性比例约为2:1。另一方面,如果分离比p5cs2突变等位基因的比例应该接近1:1,这对携带这两种基因的配子体来说是一种育性缺陷p5cs1而且p5cs2突变将被证实。为了阐明这一点,831种种子,从p5cs1 p5cs2 / p5cs2在六个独立实验中,植物被种植在磺胺嘧啶平板上。如图所示1,p5cs2突变分离的抗感比为1:1,约为50%(50.6±0.1%;n = 831;P *** < 0.000 1;χ2= 45)植株对磺胺嘧啶具有抗性(图中黑色条形图)1),与假设相一致p5cs1 p5cs2配子体是不育的,几乎不能传播p5cs2对孢子体产生的等位基因。
没有流产的胚胎p5cs1 p5cs2 / p5cs2Siliques与一种阻碍纯合子形成的配子体突变一致
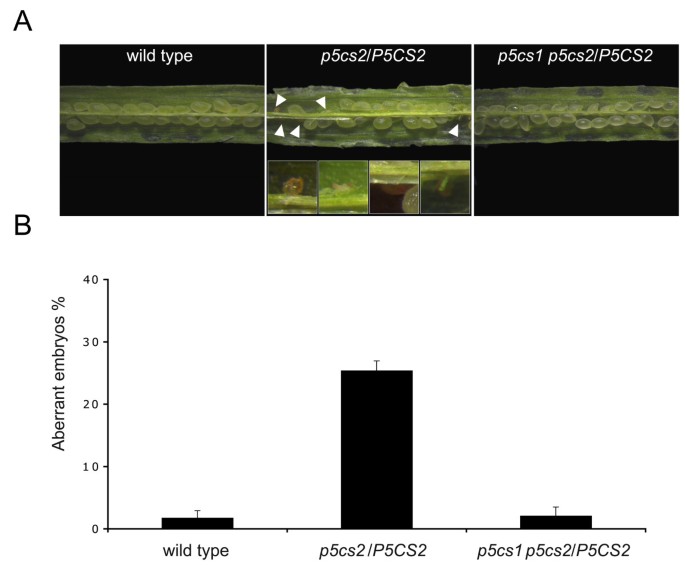
进一步确认配子体缺陷p5cs1 p5cs2 / p5cs2突变体,胚胎流产的发生率检查的角果p5cs1 p5cs2 / p5cs2.在自花杂合子的角果中可以观察到败育种子p5cs2/P5CS2突变体,约占种子总数的25%,与基因型相对应p5cs2 / p5cs2(图2(中,见白色箭头)相比之下,野生型角果的自然种子败育率约为1%(图2(左)。然而,如果配子体缺陷应该阻碍纯合子的形成,缺乏流产胚胎的角果p5cs1 p5cs2 / p5cs2将预期。确实如此,如图右侧所示2,p5cs1 p5cs2 / p5cs2角果表现出野生型样表型,败育种子不到1%。这些数据与(雄)配子体携带两者的假设是一致的p5cs1而且p5cs2等位基因很少遗传给后代。
相互之间的交叉p5cs1 p5cs2 / p5cs2和野生型证实了与花粉粒突变相关的雄性配子体缺陷P5CS1和P5CS2
从遗传学上证实携带两种花粉粒的雄性不育性p5cs1而且p5cs2突变等位基因,相互回交p5cs1 p5cs2 / p5cs2和野生型植物。收集异交角果产生的所有种子,并在含有磺胺嘧啶的培养基上发芽,以跟踪传代p5cs2突变等位基因(表1).如表所示1,当花粉从p5cs1 p5cs2 / p5cs2植物被用来给野生型雌蕊施肥,的p5cs2132株中只有1株突变等位基因可遗传给后代(0.76±0.09%;χ2= 128;P < 0.001),产生一个p5cs1 p5cs2 / p5cs2基因型。相比之下,传输的p5cs2在92例病例中,41例发生了互交的等位基因,这表明两者都发生了突变P5CS1而且P5CS2对雌性配子体无影响。
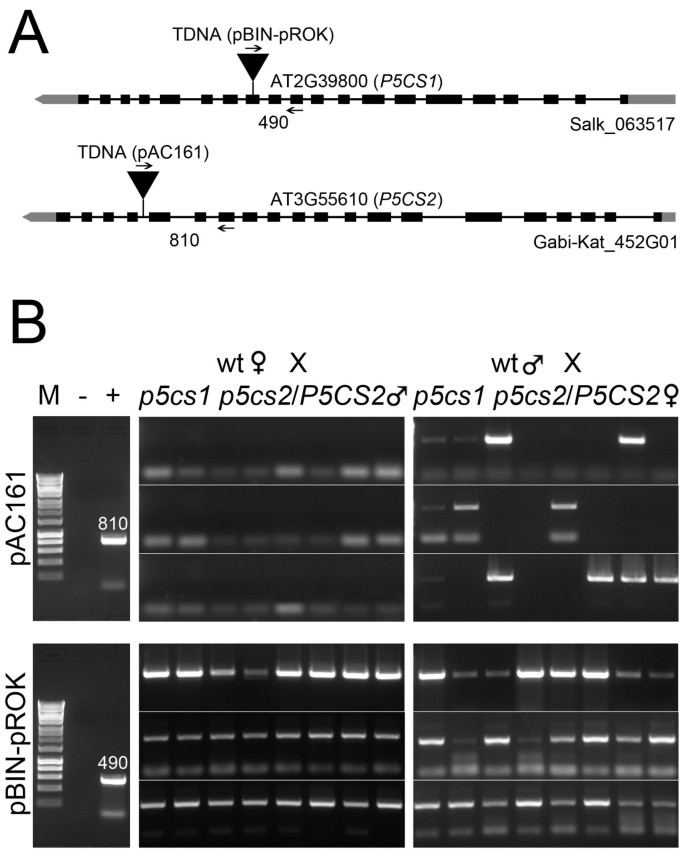
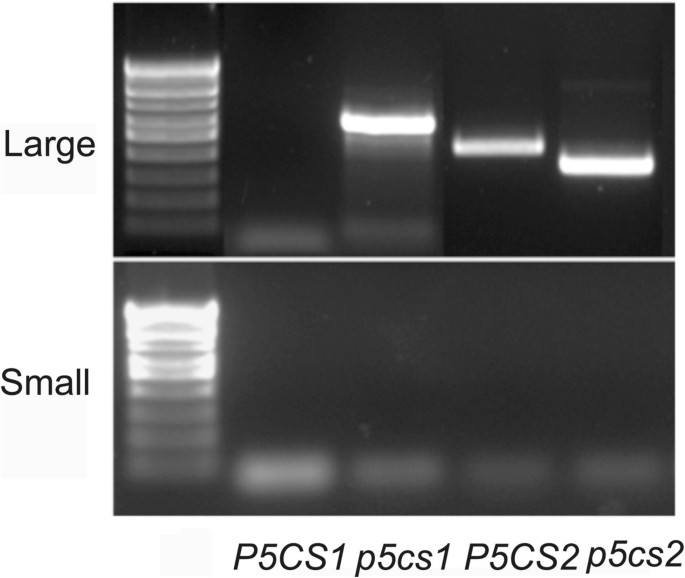
为了在分子水平上证实这些数据,从每个异交后代(雄性)中随机选择24个个体p5cs1 p5cs2 / p5cs2×母的wt和母的p5cs1 p5cs2 / p5cs2×雄性wt),用PCR分析是否存在T-DNA插入P5CS2(图3而且3 b,顶部面板),等等P5CS1(图3而且3 b,下半部分)。如图上面板所示3 b,当p5cs1 p5cs2 / p5cs2被用作男性,组合引物特异性为P5CS2对于T-DNA载体,pAC161无法检测到T-DNA插入的存在P5CS2(图3 b左边的面板)。相反,当p5cs1 p5cs2 / p5cs2被用作雌性,一个专门用于T-DNA插入的PCR产物P5CS2在24个样本中的12个样本中被扩增(图3 b最右上方的面板),提供分子的传导支撑p5cs2突变等位基因在雄性配子体中被破坏,但在雌性配子体中不被破坏p5cs1 p5cs2 / p5cs2植物。另外,如图底板所示3 b所有被分析的样本都检测到了突变体的存在p5cs1等位基因(图3 b左右底板),通过使用一对引物专门为P5CS1和T-DNA载体pROCK,以及野生型的存在P5CS1等位基因(未显示),通过使用特异的引物对P5CS1,表明所选植物来自异交事件,并排除了自花授粉亲本基因型无意污染的可能性。总的来说,与野生型植物的互交提供了遗传和分子方面的证据p5cs1 p5cs2 / p5cs2雄性受精受损.
分子间互易杂交的分析p5cs1 p5cs2 / p5cs2变种人和野生型。(一个插入突变体示意图p5cs1(Salk_063517)和p5cs2(Gabi-Kat _452G01)。T-DNA插入的位置,用于基因分型的PCR引物的位置,以及PCR产物的预期长度P5CS1(At2G39800),P5CS2(At3G55610)。(B)相关的T-DNA插入的PCR扩增P5CS2(PAC161 T-DNA,顶部面板)和P5CS1(pROK T-DNA,底部面板)在相互交叉中p5cs1 p5cs2 / p5cs2和野生型。从24个随机选择的异交植株的样本显示。顶部面板显示的结果表明P5CS2突变永远不会传递给子代(0/24)p5cs1 p5cs2 / p5cs2作为雄性(左上),但当作为雌性时,通常被隔离(12/24)。相对于wt的扩增(−,最左上方和最下方的面板),阴性和阳性对照显示在最左边的面板,p5cs2 / p5cs2(+,最左上角的面板)和p5cs1(+,最左下角)亲本基因型。PCR产物旁边的数字代表以Kb表示的预期分子量P5CS2-T-DNA(上面的面板),和P5CS1-T-DNA(底部面板)连接片段分别。
花粉的形态和功能分析p5cs1 p5cs2 / p5cs2突变体揭示花粉发育的严重缺陷
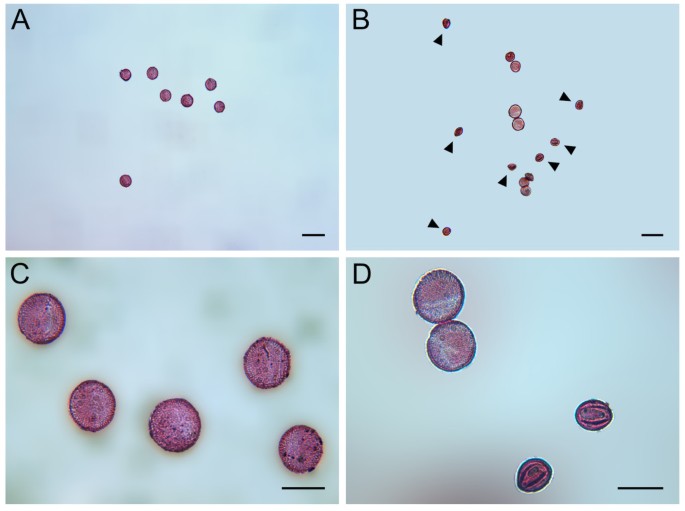
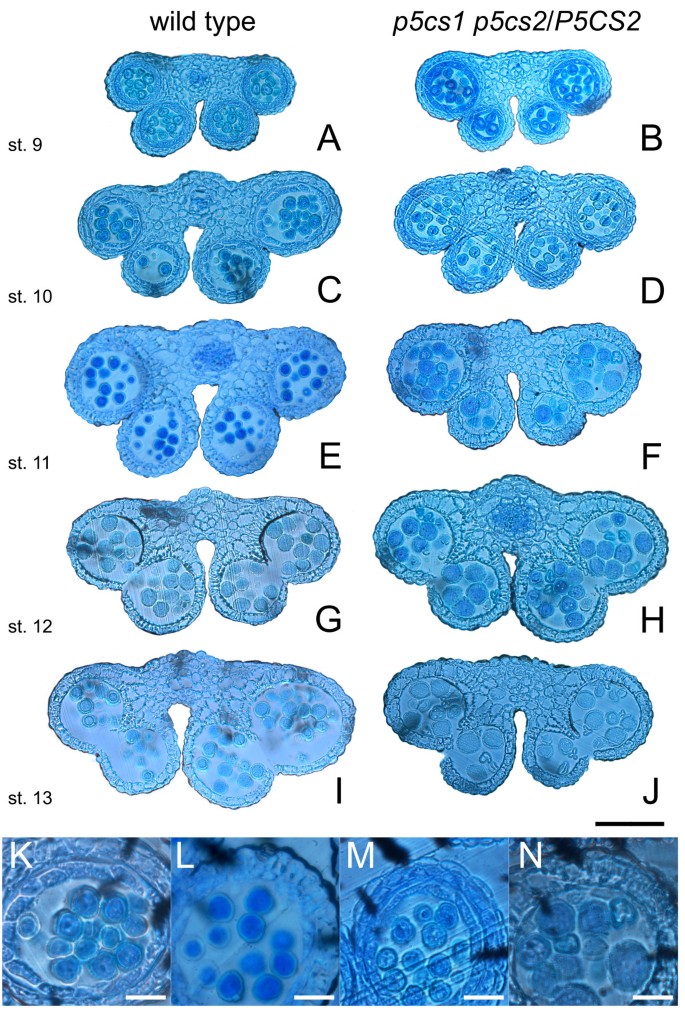
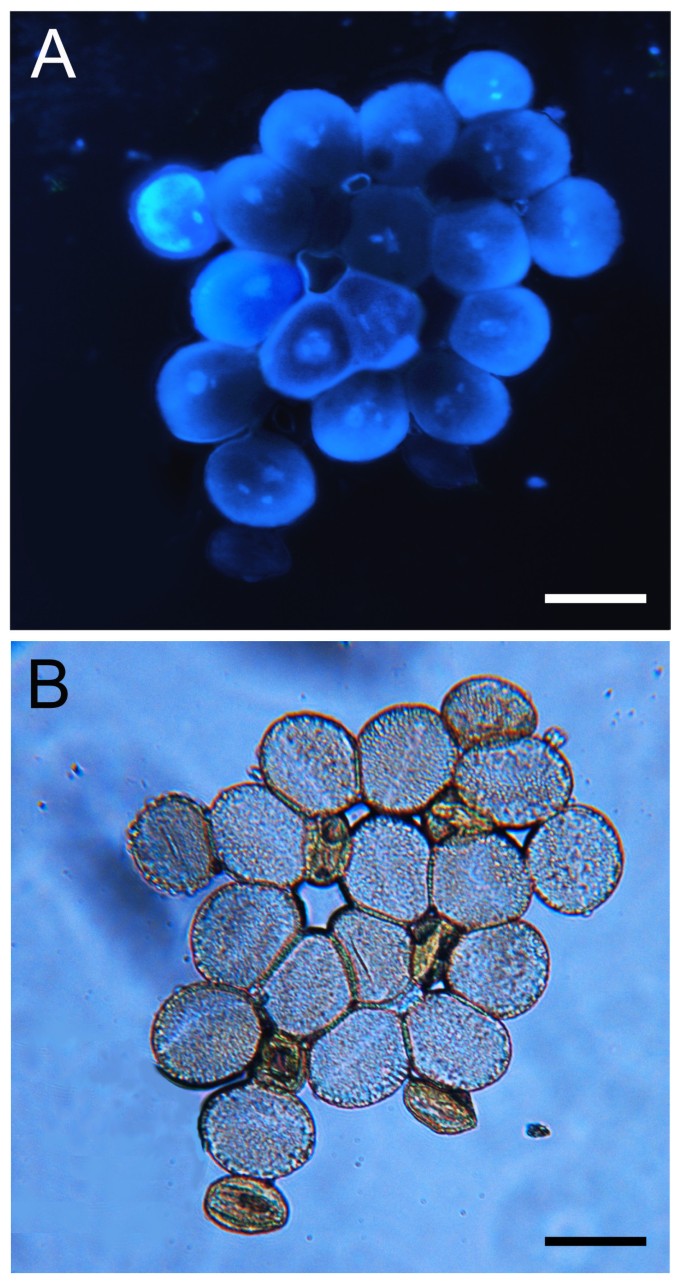
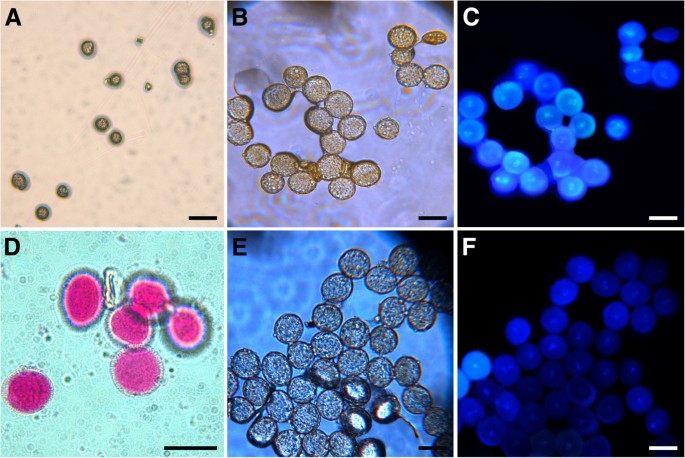
如果p5cs1 p5cs2花粉在雄性受精过程中受损,花粉粒形态异常可能是预期的。的确,如图所示4成熟花粉的显微分析p5cs1 p5cs2 / p5cs2用醋酸醋染色的植物显示出来(图4 bD),除了外形正常的花粉粒外,还有小而畸形、干瘪的花粉粒,约占花粉总粒数的一半(46.23±1.2%)。这一证据表明,在植物中纯合子p5cs1和杂合的p5cs2表明该缺陷可能发生在花粉中p5cs1 p5cs2基因型。为了了解花粉发育的哪个阶段发生了畸变,用甲苯胺染色的组织横断面p5cs1 p5cs2 / p5cs2不同发育阶段的花药[25],并与野生型进行比较分析。如图所示5,两者之间的差别首先很明显p5cs1 p5cs2 / p5cs2第11期出现野生型花药(图5 f和N),当两个花粉粒群体——一个类似于野生型,另一个显示较小的尺寸和退化的初始迹象——可以在花粉囊中区分。为了评估这种小的异常花粉是否重要,花粉粒来自野生型和p5cs1 p5cs2 / p5cs2用亚历山大染色法处理突变体,这是一种能够区分存活的红色花粉和非存活的绿色或未染色花粉的染色方法[26,27].如图所示6,一个小而异常的花粉粒群体,占总花粉粒的47.5±2.1%,在Alexander’s染色处理后选择性地出现未染色(图5)6 bD和附加文件1:图S1)。相比之下,在花粉群中存在较大的和正常的花粉p5cs1 p5cs2 / p5cs2植物的花粉染上了亚历山大氏斑点,看起来像野生型花粉一样红(图6C和附加文件1:图S1)。此外,在花粉种群内p5cs1 p5cs2 / p5cs2突变体,通过DAPI判断,大的花粉粒似乎具有正常的核含量,而小的和不能存活的花粉粒则表现为退化和缺乏DNA(图1)7一个和B)和PCR分析(图8).事实上,在dapi染色的花粉粒中p5cs1 p5cs2 / p5cs2,在小而败的花粉粒中没有观察到核,而在大而正常的花粉粒中可以看到多达三个核,与正常花粉粒一样(图1)9 f).
野生型和突变型花粉的组织学分析。不同发育阶段花药的横切面。野生型花药甲苯胺蓝染色横截面(一个,C,E,G,我),p5cs1 p5cs2 / p5cs2(B,D,F,H,J)第9至13阶段。两者之间的差别首先很明显p5cs1 p5cs2 / p5cs2野生型花药出现在第11阶段(E,F),此时在花粉囊中可以区分出两个花粉粒群体。Bar = 100 μm。(K-N)野生型(K,L)和p5cs1 p5cs2 / p5cs2(M,N),相对于第10阶段(K,M)和第11阶段(L,N)。从第11阶段(E)可以清楚地看到小的畸形花粉粒。与野生型相比,未见明显的变化p5cs1 p5cs2 / p5cs2前阶段11。Bar = 25 μm。
在体外发芽试验证实了这一点p5cs1 p5cs2花粉基本上是不可活的,这表明脯氨酸在花粉发育中的定量作用
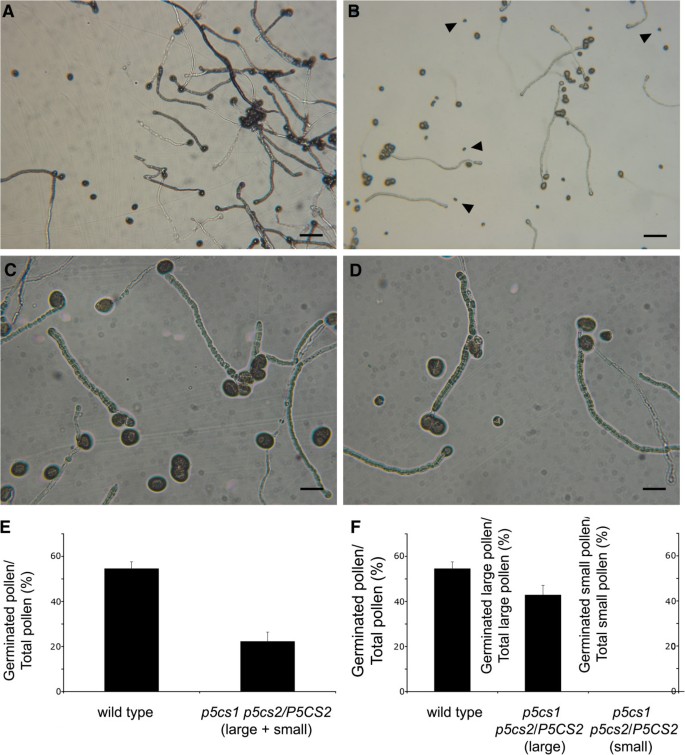
目的:进一步研究植物花粉活力p5cs1 p5cs2 / p5cs2植物,在体外用萌发试验测定了花粉的萌发能力p5cs1 p5cs2 / p5cs2植物发芽在体外(图10 b, D),与野生型花粉比较(图10C).如图所示10,当花粉从p5cs1 p5cs2 / p5cs2植物在固体萌发培养基上生长,其萌发花粉与总花粉(萌发+未萌发)的比例(包括大花粉粒和小花粉粒)比野生型减少了约50%(22±4%,对照54±2.9%)(图)10野生型花粉的平均发芽率仅为54±2.9%,这是由于该类实验的相对低效造成的。众所周知,在体外发芽不能完全代替在活的有机体内发芽率,发芽率有很大变化[28].为了尽量减少这种内在的变异,所有的实验都是通过在同一显微镜载玻片上放置来自野生型对照的花粉和来自野生型对照的花粉p5cs1 p5cs2 / p5cs2突变体。因为遗传分析表明一半的花粉粒来自p5cs1 p5cs2 / p5cs2植物的p5cs1 p5cs2基因型和形态观察表明~ 50%的花粉粒来自p5cs1 p5cs2 / p5cs2植物小而畸形,很可能假设所有的异常花粉都是如此p5cs1 p5cs2。根据这个概念,当大花粉粒和小花粉粒分别打分时,所有小花粉粒和退化花粉粒(p5cs1 p5cs2基因型的)应该不能发芽,而所有看起来像野生型的大花粉(p5cs1 P5CS2基因型)应该拉长花粉管。为了验证这一点,对大花粉粒和小花粉粒分别计算花粉发芽率,即大花粉粒占大花粉粒总数的数量,或小花粉粒占小花粉粒总数的数量(图1)10出乎意料的是,虽然小花粉粒从未观察到发芽(图1)10,图B和D),大花粉粒发芽率与大花粉粒总数的比值p5cs1 p5cs2 / p5cs2与野生型相比(43±4.2%,对照花粉54±2.9%)仅占89%,如图所示10 f,中间柱,表明两个花粉群体可能不纯,即一些花粉p5cs1 p5cs2基因型可能偶尔会退化,看起来很小,而一些花粉p5cs1 p5cs2基因型可能没有退化,或没有完全退化,但看起来很大。为了澄清这一点,通过PCR分析大或小花粉粒池中是否存在T-DNA插入P5CS1而且P5CS2。如图所示8由于花粉的形态和功能退化以及细胞核明显缺失,因此在小的花粉群中无法扩增出DNA。当从大量花粉中提取的DNA被检测是否存在突变时P5CS1,只有T-DNA插入P5CS1可以被放大(图8),证实了大花粉粒是至关重要的,并表明整个种群中都含有突变体p5cs1等位基因,如预期从一条纯合子线为p5cs1等位基因。然而,当从大量花粉中提取的DNA被检测是否存在突变时P5CS2,包括野生型和突变型P5CS2在野生型和突变型的特异性PCR产物中都发现了等位基因P5CS2基因(见图中最右边的两行8),证实了野生型花粉在某种程度上包含了两种基因突变的花粉P5CS1而且P5CS2.两种花粉都有突变P5CS1而且P5CS2在庞大的野生型花粉种群中,表明花粉具有基因型p5cs1 P5CS2可能存在于退化花粉群中。这些结果的最简单的解释是,雄配子体的适当发育依赖于脯氨酸的可利用性和基因型的花粉p5cs1 p5cs2可能在一定程度上导致花粉的整体育性缺陷p5cs1 p5cs2 / p5cs2突变体。这种推理的一个重要含义是花粉缺陷类似于,但没有在花粉粒上发现的那些严重p5cs1 p5cs2 / p5cs2植物应该存在于纯合子的花粉粒中p5cs1单突变体。因此,从纯合子植株中采集成熟花粉p5cs1用显微镜、亚历山大染色法、DAPI染色法和荧光染色法对花粉形态和活力进行分析在体外发芽试验。如图所示9微观和功能分析p5cs1花粉颗粒显示了畸形的存在(图9- d),不可行的(图9 d)和退化(图9 bC)花粉粒,尽管程度较低(约18%)p5cs1 p5cs2 / p5cs2突变体。此外,如附加文件所示2:图S2,花粉来自p5cs1在萌发培养基上生长的单个突变体,其萌发率比野生型花粉低12%左右。见附加文件2:图S2, A,发芽花粉占总花粉的百分比,包括大花粉粒和小花粉粒,是40±2%,而野生型对照的是54±2.9%,证实了在较低程度上,雄性配子体缺陷存在p5cs1单突变体。此外,当大花粉粒和小花粉粒分别打分时(附加文件2:图S2, B),大粒花粉与总大粒萌发花粉的比例为48±2.5%,而野生型对照的比例为54±2.9%,而小粒花粉从未萌发过。就像在p5cs1单突变体大花粉粒的发芽率与野生型无显著差异,萌发效率下降12%的原因必须归结于花粉粒的小和退化。
在体外花粉的萌发测定p5cs1 p5cs2 / p5cs2植物。评估花粉的活力p5cs1 p5cs2 / p5cs2植物,野生型花粉(一个在更高的放大倍数下,C),p5cs1 p5cs2 / p5cs2(B在更高的放大倍数下,D)是孵化在体外在萌发培养基上,为成功萌发评分(花粉管完全或部分伸长)。在面板(E)野生型花粉(左列)和突变型花粉(右列)的萌发花粉与总花粉的百分比。在(F)与野生型花粉(最左边一列)相比,给出了大突变花粉(中间一列)或小突变花粉(最右边一列)的发芽率占总花粉的百分比。bar = 100 μm (A, B)和25 μm (C,D)。(E)和(F)中的值表示四次独立实验的平均值±SE。
小麦花粉脯氨酸含量分析及外源脯氨酸处理p5cs1 p5cs2 / p5cs2突变体提供了脯氨酸和花粉发育之间的直接联系
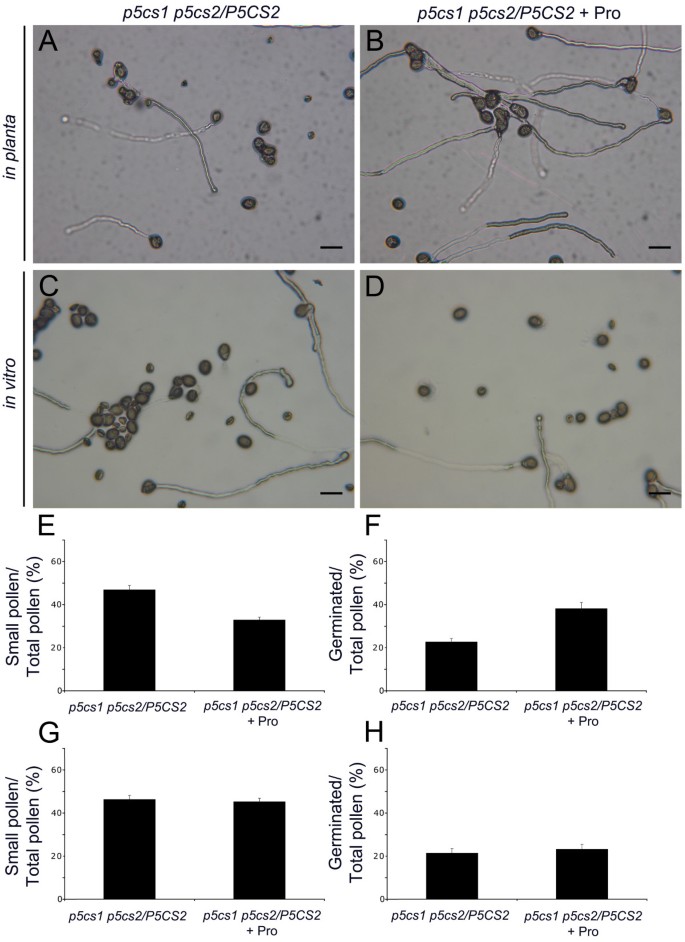
总的来说,上面的数据指向一个要求p5CS1而且p5CS2花粉的发育和功能。为了建立脯氨酸和花粉发育之间的直接关系,我们测量了花粉的脯氨酸含量p5cs1 p5cs2 / p5cs2植物,与野生型相比。大约7000个成熟的花粉粒来自野生型或p5cs1 p5cs2 / p5cs2将突变体收集在显微镜载玻片上,并对贝茨方法进行改进(详见方法)处理[29].测量结果在三个独立实验中重复,并以平均值±SE表示。两种花粉群体脯氨酸含量差异明显,野生型花粉中游离脯氨酸含量为336±31 ng,大致相当于48 pg/花粉;混合型(大粒和小粒花粉)花粉群体中游离脯氨酸含量仅为105±23 ng,相当于15 pg/花粉p5cs1 p5cs2 / p5cs2植物。突变株花粉中脯氨酸含量较低(15 pg/花粉),而野生型花粉中脯氨酸含量较低(48 pg/花粉),这表明脯氨酸缺乏与花粉缺陷有直接关系。因为在花粉群中p5cs1 p5cs2 / p5cs2植物,大约50%的花粉颗粒看起来异常,脯氨酸含量减少约50%。然而,突变株花粉中检测到的脯氨酸减少超过70%。这一结果表明,所观察到的脯氨酸减少不能仅由小的畸形花粉的败育来解释,脯氨酸含量的减少一定程度上也发生在大的野生型样花粉粒中。另外,添加10 μM l -脯氨酸在体外使花粉成熟p5cs1 p5cs2 / p5cs2在发芽培养基上生长的植物在足底发展条件下。如图所示11而添加脯氨酸对花粉萌发无显著影响在体外(图11 c, D, G和H),从花蕾发育早期到花药发育完全开裂阶段,每天喷洒脯氨酸对花粉缺陷有显著的补充作用,异常花粉的比例从47.0±2.5%下降到33.0±1.5%(图4)11 e花粉萌发率由21.3±1.3%提高到39.2±2.1%(图1)11 f).说明外源脯氨酸可以部分修复花粉的缺陷p5cs1 p5cs2 / p5cs2植物,从花粉发育开始就补充脯氨酸,证实脯氨酸在花粉发育中起作用。
讨论
根据杂交结果显示花粉在两种基因上都有缺陷P5CS1而且P5CS2在几乎完全无法成功受精的情况下,通过遗传、发育和分子证据,假设并证明了雄性配子体存活对脯氨酸的需求。
脯氨酸是花粉发育和生育所必需的
许多不同的作者都报道过脯氨酸在一些物种的花药和花粉中大量积累[7- - - - - -11,14],但目前还不清楚为什么需要这么多的脯氨酸。功能多种多样,如清除自由基[12,保护细胞膜和细胞结构[13],能源[15],代谢性前体[14],以及富含羟脯氨酸细胞壁的主要氨基酸成分[16],但这些可能性都没有得到广泛的接受。有人提出了一个有趣的假说:脯氨酸的作用可以解释多种功能[30.].
本工作提供的证据表明,来自突变体的花粉纯合子p5cs1和杂合的对于p5cs2可以传输p5cs2突变的总体频率约为0.8%,脯氨酸含量水平降低的突变[2,3.,24]花粉活力的问题越来越严重,这表明脯氨酸是雄性生育能力所必需的。
花粉中脯氨酸的积累可能依赖于内源脯氨酸的合成
除了这项工作中描述的花粉发育的缺陷,以及Mattioli等人描述的花过渡的延迟。[1],纯合子突变体的营养和生殖生长p5cs1和杂合的p5cs2,包括雌性配子体的发育,基本上是正常的。这一证据表明,少量的脯氨酸来自野生型的活动P5CS2等位基因,总是存在于孢子体组织中p5cs1 p5cs2 / p5cs2对正常的生长和繁殖是足够的,但对花粉的正常发育是不够的。
不同作者发现花粉中脯氨酸含量较高,证实了花粉发育和功能对脯氨酸的特殊需求[7- - - - - -11,14],通过突变花粉中测定的极低水平的脯氨酸,以及通过外源脯氨酸处理获得的花粉缺陷的部分修复。虽然这种互补提供了花粉发育和功能所需的脯氨酸的直接证据,但它没有指出所需的脯氨酸是来自花粉内部的内源合成,还是来自附近母细胞合成的脯氨酸,并在花粉粒内运输或扩散。这一点显然需要在以后的工作中得到理解。
然而,由于花粉来自p5cs1 p5cs2 / p5cs2是不育,一个可能的运输或扩散的脯氨酸合成在周围的孢子体细胞残馀P5CS2等位基因显然是不够的。此外,单敲除、双敲除和三敲除突变体AtProT在植物中负责脯氨酸转运的基因(At2G39890, At3G55740, At2G36590)已被分离和鉴定,但与野生型相比,没有发现脯氨酸含量和花粉萌发效率的变化[19].虽然可能不同的载体,如atht5 (At1g67640) [31]或AtLHT7 (At4G35180) [32],可能补偿、重叠或替代AtProTs,目前的证据不支持在花粉粒中脯氨酸积累的运输作用。此外,微阵列数据表明,所有参与脯氨酸合成的基因都在花粉中强烈表达[33,34,以及Szekely等人的数据。[24],在拟南芥花粉中检测到AtP5CS1-GFP和AtP5CS2-GFP的表达,证实P5CS蛋白存在于雄性配子体中。总的来说,这些数据表明花粉中脯氨酸是积极合成的。
脯氨酸是否可以在花粉粒中直接合成的问题一直是有争议的讨论对象,因为一些作者可以检测到低[8,32或没有表达P5CS在花粉19],而其他人则报道了在拟南芥花粉中存在atp5ccs - gfp蛋白,这表明脯氨酸的生物合成发生在该器官中[24].然而,在表达水平的差异P5CS不同作者观察到的基因[8,19,24,32],可能取决于花粉被分析的发育阶段,我们可以推测P5CS1/2基因只能在花粉发育的特定阶段表达,但仍能积累足够的P5CS酶,以满足花粉成熟的整体脯氨酸需求。据报道,花粉中转录物和蛋白质水平之间的时间差异也存在于其他基因中,如AtSUC1(AT1G71880),其在三细胞期转录水平高,在成熟花粉中转录水平低[35),AtSTP9(AT1G50310),其基因产物只能在萌发开始后用免疫荧光显微镜检测到[36].此外,如上所述,两者的高表达水平P5CS1,P5CS2,P5CR通过微阵列分析在花粉中检测到[33,34],直接证实了花粉粒中发生了由谷氨酸合成的内源性脯氨酸。出乎意料的是,微阵列分析也检测到δ-OAT在花粉中的表达,尽管鸟氨酸途径似乎不能弥补花粉中P5CS的缺乏p5cs1 p5cs2 / p5cs2.如果鸟氨酸途径不促进脯氨酸的合成,这些相互矛盾的证据就可以被调和。顺便说一句,这个证据支持Funck等人的发现。22他证明了鸟氨酸途径对精氨酸分解代谢至关重要,但对脯氨酸合成却没有作用。
总的来说,花粉中脯氨酸的积累可能主要依赖于内源性脯氨酸的合成,尽管还不清楚脯氨酸是来自雄性配子体内部的内源性合成,还是来自附近孢子体细胞合成的脯氨酸,并在花粉粒内运输或扩散。一种可能的假设是,随着花粉失去与周围孢子体细胞的桥体连接,变得依赖于内源性脯氨酸合成,这与花粉发育过程中可见异常的晚期表现(第11阶段)一致p5cs1 p5cs2 / p5cs2雌配子子中无明显缺陷,常嵌于孢子体细胞中。
之间的关系p5cs而且p5cr突变体
有趣的是,两个带有T-DNA插入的拟南芥突变体P5CR,emb - 2772 - 1而且emb - 2772 - 2[37表现出胚胎致死表型,类似于p5cs2突变体,在前球状阶段停止胚胎发育。然而,与此形成鲜明对比的是,到目前为止,还没有发现配子体缺陷与这些突变体有关。
虽然这并不奇怪,病变在P5CR而且P5CS2,属于同一通路的两个编码脯氨酸合成酶的基因,可能会导致胚胎发育中类似的缺陷,令人费解的是,相反p5cs2,emb - 2772无配子体缺陷。Muralla等人在拟南芥中发现了许多突变体。38胚胎有缺陷,配子体发育没有缺陷。
为了解释这一明显的悖论,作者提出杂合子孢子细胞中来自野生型等位基因转录的基因产物可能会补偿突变配子体的缺陷,当这些产物最终耗尽时,胚胎的致病性就会产生。同样,我们可以推测,与P5CS2相反,在杂合子孢子细胞中合成的P5CR转录本和/或蛋白足够稳定,可以维持花粉,但不能维持胚胎的发育。
脯氨酸可能在花粉的发育和萌发中有不同的作用
本文提供的数据表明脯氨酸是花粉发育所必需的,但没有说明脯氨酸在花粉发育中的作用。我们从组织学分析中知道5),从第11阶段开始,花粉粒的一小部分开始看起来干瘪和收缩,当两个有丝分裂完成后,小孢子开始成熟为花粉粒。正如Chiang和Dandekar假设的那样,随着花粉发育的进行,花粉变得越来越干燥,可能需要越来越多的脯氨酸来避免蛋白质变性和保存细胞结构,包括细胞核。[7].不同的作者提出了脯氨酸在保护细胞结构不变性方面的作用,无论是作为兼容渗透剂[7,清除自由基[12,24,或作为膜和细胞结构的保护者[13].虽然,从现有的数据,有丝分裂的缺陷不能排除,观察到退化的细胞结构在花粉粒p5cs1 p5cs2基因型,可能是由于脱水过程中缺乏脯氨酸的保护作用而造成细胞膜的不可逆损伤所致。
一旦花粉达到完全成熟,积累的脯氨酸就会被分解并成为能量的来源——为花粉管的快速和需要能量的延伸提供燃料[15,39和/或作为γ-氨基丁酸(GABA)的代谢前体,其分解代谢已被证明对晚期花粉管伸长和引导至关重要[40].
在未来,通过分离这两种假定的功能来解决这个问题将是很有趣的,例如在花粉粒的发育中定位p5cs1 p5cs2 / p5cs2植物非代谢相容渗透物,如甘氨酸甜菜碱。同样有趣的是,将在单倍体雄性配子体中合成的脯氨酸与在花药的二倍体孢子体组织中合成的脯氨酸的作用进行解剖。
结论
我们在这里展示纯合子的突变体p5cs1和杂合的p5cs2,脯氨酸合成缺陷,雄配子体的发育与突变P5CS1而且P5CS2并提供了花粉发育和生育需要脯氨酸的遗传证据。
方法
植物生长条件,分离和胚胎分析
野生型和突变体拟南芥在24/21℃、光强300-μE·m的生长箱中培养哥伦比亚-0 (Col-0)生态型植物-2·年代-1每天光照16小时,黑暗8小时以下。拟南芥纯合子的p5cs1(SALK_063517),最初从SALK集合中获得,是[3.在14号外显子中包含一个prock衍生的T-DNA。拟南芥的杂合的p5cs2(GABI_452G01),最初从GABI-Kat集合中获得,是插入突变体,描述在[1],在18号外显子中包含一个PAC161衍生的T-DNA。如在[1,3.]p5cs2 / p5cs2胚在纯合子状态下是致死的,必须在杂合子状态下繁殖吗.拟南芥纯合子的p5cs1和杂合的p5cs2(p5cs1 p5cs2 / p5cs2),已在别处描述过[1,3.].为分离分析,种子自受精p5cs1 p5cs2 / p5cs24℃分层3天,表面除菌,在MS上萌发1/2平板中添加12 μg/ml磺胺嘧啶。通过对抗性过感植株数量的评分计算分离率,并通过随机样本的PCR分析确认分离率。使用引物5 ' - caagcaatggtggaagagtaaa -3 '和5 ' - CGGGGCTCAAGAAAAATCC -3 '检测磺胺嘧啶抗性基因。在胚胎分析中,来自自受精野生型的角果,p5cs2/ P5CS2突变体,或p5cs1 p5cs2/P5CS2在蔡司史蒂夫SV 6型光学立体显微镜(卡尔蔡司微成像公司,耶拿,德国)下解剖和分析突变体。使用Jenoptik ProgRes®C3数码相机(Jenoptik, Jena, Germany)获取数字图像。所有的分析都至少重复了四次。以百分数为依据,用χ分析其差异有统计学意义2分析。
植物十字架
在十字架p5cs1 p5cs2 / p5cs2和开花时间突变体F1代被允许自受精和存在p5cs2从F2代通过磺胺嘧啶选择或磺胺嘧啶抗性基因的PCR基因分型对突变等位基因进行评估。确认数据,排除开花时间突变基因型对黄曲霉传播可能的干扰p5cs2突变,相互交叉p5cs1 p5cs2 / p5cs2野生型。T-DNA插入的传输P5CS2通过对在含磺胺嘧啶固体培养基上萌发的异交种子进行磺胺嘧啶筛选,或对未经筛选的植株进行磺胺嘧啶抗性基因的PCR基因分型2分析。
花粉的形态和功能特征
为了进行火红素染色,花粉是通过在显微镜载玻片上涂抹四周树龄的成熟花朵来收集的。在1%醋酸乙酸中短暂孵育后,将花粉粒在50%醋酸中冲洗,并在配有Jenoptik ProgRes®C3数码相机的Leitz Laborlux D光学显微镜(Leitz, Wetzlar, Germany)下进行检查。为了进行组织学分析,将不同发育阶段的花芽嵌入Technovit 7100 (Kulzer)中,用1%甲苯胺蓝对3-mm的截面进行染色,如[41在Leitz Laborlux D光学显微镜下分析(Leitz, Wetzlar, Germany)。为了评估花粉活力,收集花芽或分离的花药,在Carnoy固定液(6酒精:3氯仿:1醋酸)中固定一夜,并用Peterson等人(2010)描述的改良Alexander染色剂染色。DAPI(4 ', 6-二胺基-2-苯基吲哚)染色[42],收集成熟花粉,在DAPI染色液(0.1 M磷酸钠缓冲液,pH值为7,1 mM EDTA, 0.1% trton - x -100和0.4 μg/ml DAPI)中孵育30′,用蔡司Axioskop 2 +显微镜(卡尔蔡司微成像公司,德国Jena)分析,DAPI过滤器组包括激励过滤器(BP 365/12 nm)、分束器(395 nm)和发射过滤器(LP 397 nm)。使用Jenoptik ProgRes®C3数码相机(Jenoptik, Jena, Germany)采集数字图像。
分子分析
在蔡司史蒂夫SV 6型光学立体显微镜(卡尔蔡司微成像公司,德国耶拿)下按大小(大和小)分离花粉粒,制备约500个花粉粒池并在−20℃下冷冻。采用改良的CTAB(十六烷基三甲基溴化铵)方案从这些样品中提取花粉DNA,根据[43].由于有一层坚硬的花粉外壳,在最初的步骤中进行了主要的修改,包括在显微镜载片和盖片之间挤压花粉,用50 μl CTAB缓冲液提取花粉,并在95°C下加热15 '。PCR条件为94°C 3’,随后在94°C 30”,58°C 1’,72°C 50”的35个循环。引物对为磺胺嘧啶抗性基因的5 ' -CAAGCAATGGTGGAAGAGTAAA-3 '和5 ' -CGGGGCTCAAGAAAAATCC-3 ', T-DNA插入的5 ' -GGAGCAGAATGGTTTTCTCG-3 '和5 ' -TATCTGGGAATGGCGAAATC-3 'P5CS2基因为5 ' - ggagcagaatggttttctcg -3 '和5 ' - tggaaaacagcagcactgtc -3 'P5CS2,5 ' - ctgttgggggtaaactcatg -3 '和5 -GCGTGGACCGCTTGCTGCAACT-3 '用于T-DNA插入P5CS1,基因为5 ' - ctgttgggggtaaactcatg -3 '和5 ' -CTCTGCAACTTCGTGATCCTC-3 'P5CS1。
在体外花粉萌发
第13期花朵的成熟花粉[44]收集,转移到涂有新鲜制备的萌发培养基(5 mM CaCl2, 1 mM MgSO4, 5 mM KCl, 0.01 mM H3BO3, 10%蔗糖和1.5%琼脂糖,pH 8.0)的玻片上,在21℃的潮湿室中保存一夜。最小化在体外萌发变异性,野生型植物的花粉总是包含附近的花粉p5cs1 p5cs2 / p5cs2同一显微镜载玻片上的植物。
花粉萌发分析用Leitz Laborlux D显微镜(Leitz, Wetzlar, Germany)检查载玻片,用Jenoptik ProgRes®C3数码相机(Jenoptik, Jena, Germany)采集随机选择的田间数字图片。为了确定花粉萌发效率,在四个独立的实验中,从每个副本随机选择的五个田地中对发芽和未发芽花粉的数量进行评分。以百分数为依据,用χ分析其差异有统计学意义2分析。
脯氨酸测定与外源脯氨酸互补
脯氨酸测量方法修改自[29成熟花粉粒(~ 5 ~ 10.000)采集在显微镜载玻片上,用载玻盖玻璃打碎,用30 μl 3% (w/v)的磺基水杨酸水溶液提取。离心(12.000 ×g for 10’)后,将上清加入30 μl酸性ninydrin和30 μl冰乙酸,在两端热封的巴斯德移液管尖组成的微试管中,80℃反应2h。用60 μl甲苯提取反应混合物,用NanoDrop 2000显微分光光度计(Thermo Scientific, Wilmington, USA)在520 nm处测量其光密度。用l -脯氨酸建立标准曲线,测定脯氨酸浓度。在体外用添加10 μM l -脯氨酸的萌发液包被成熟花粉的载玻片进行补足。在活的有机体内用10 μM脯氨酸对早期发育的花序进行补充。收集经脯氨酸处理的第13期花的成熟花粉,并进行如上分析。
参考文献
- 1.
Mattioli R、Falasca G、Sabatini S、Costantino P、Altamura MM、Trovato M:脯氨酸生物合成基因P5CS1和P5CS2在拟南芥花的转变中具有重叠作用,但在胚胎发育中没有作用。植物工程学报,2009,37(4):447 - 447。10.1111 / j.1399-3054.2009.01261.x。
- 2.
Mattioli R, Costantino P, Trovato M:植物脯氨酸积累:不仅仅是胁迫。植物信号行为。2009,4:1016-1018。10.4161 / psb.4.11.9797。
- 3.
Mattioli R, Marchese D, D 'Angeli S, Altamura MM, Costantino P, Trovato M:拟南芥细胞内脯氨酸水平的调控对开花时间和花序结构的影响。植物生物学杂志,2008,26(3):378 - 378。10.1007 / s11103 - 007 - 9269 - 1。
- 4.
Vansuyt G, Vallee J- c, Prevost J: La pyroroline -5-羧酸盐réductase et La脯氨酸déhydrogénase chez tobacco tabacum var. Xanthi n.c. en function de son développement。蔬菜学报,1997,19:95-105。
- 5.
维纳坎普JH,库特JTM:蚕豆植物在短时间水分滞留期间和之后的游离脯氨酸和天冬酰胺的来源。植物学报,1988,32:102-109。
- 6.
Mutters RG、Ferreira LGR、Hall AE:不同温度条件下耐热和热敏性豇豆花药和花粉脯氨酸含量作物科学,1998,29:1497-1500。10.2135 / cropsci1989.0011183X002900060036x。
- 7.
蒋海辉,丹德卡·安:拟南芥脯氨酸积累在发育过程中的调控及其对干旱的响应。植物细胞环境学报,1995,18:1280-1290。10.1111 / j.1365-3040.1995.tb00187.x。
- 8.
Schwacke R, Grallath S, Breitkreuz KE, Stransky H, Frommer WB, Rentsch D:番茄花粉中脯氨酸、甘氨酸甜菜碱和-氨基丁酸的转运蛋白LeProT1。植物学报,1999,11:377-391。
- 9.
Khoo U, Stinson HT:细胞质雄性不育花药与正常可育花药游离氨基酸的差异。中国生物医学工程学报,2004,24(3):354 - 357。10.1073 / pnas.43.7.603。
- 10.
烟草花药在体内发育过程中的游离氨基酸。植物工程学报,1998,27(4):527-531。10.1111 / j.1399-3054.1983.tb02780.x。
- 11.
Lansac AR, Sullivan CY, Johnson BE:高粱(双色高粱)花粉中游离脯氨酸的积累。中国机械工程学报,1996,32(4):447 - 447。10.1139 / b96 - 006。
- 12.
Smirnoff N, Cumbes QJ:相容溶质的羟基自由基清除活性。植物化学学报,1998,28:1057-1060。10.1016 / 0031 - 9422(89) 80182 - 7。
- 13.
甘氨酸甜菜碱和脯氨酸对洋葱表皮细胞质膜抵抗NaCl胁迫的保护作用。植物生理与生物化学,1998,36:767-772。10.1016 / s0981 - 9428(98) 80028 - 4。
- 14.
红曲Z, Croes AF:花粉中的脯氨酸代谢:在萌发和早期管生长过程中脯氨酸的降解。植物学报,1998,19(4):449 - 449。10.1007 / BF00998813。
- 15.
红曲Z, Croes AF, Linskens H:矮牵牛萌发花粉中蛋白质合成:脯氨酸的作用。植物学报,2002,26(4):447 - 447。10.1007 / BF00387864。
- 16.
植物细胞壁蛋白的结构和功能。植物生态学报,1998,25(5):369 - 371。
- 17.
Girousse C, Bournoville R, Bonnemain JL:水分亏缺对紫花苜蓿韧皮部液脯氨酸和其他氨基酸浓度的影响。植物生理学报,1998,19(4):369 - 369。
- 18.
Mäkelä P, Peltonen-Sainio P, Jokinen K, Pehu E, Setälä H, Hinkkanen R, Somersalo S:叶施甜菜碱在作物植物中的吸收和转运。植物生态学报,1998,21(4):371 - 371。10.1016 / s0168 - 9452 (96) 04527 - x。
- 19.
Lehmann S, Gumy C, Blatter E, Boeffel S, Fricke W, Rentsch D: AtProT家族相容性溶质运输的植物函数。中国生物医学工程学报,2011,32(5):557 - 557。10.1093 / jxb / erq320。
- 20.
Mestichelli LJJ, Gupta RN, Spencer ID:鸟氨酸到脯氨酸的生物合成路线。中国生物医学工程学报,1997,25(4):394 - 394。
- 21.
罗思华,吴晓明,张晓明,张晓明,等:拟南芥中鸟氨酸- δ-氨基转移酶cDNA的分离及盐胁迫对其表达的影响。植物学报,1998,27(4):369 - 371。10.1104 / pp.117.1.263。
- 22.
Funck D, Stadelhofer B, Koch W:鸟氨酸-δ-氨基转移酶是精氨酸分解代谢所必需的,而不是脯氨酸的生物合成。植物生物学杂志,2008,8:40-10.1186/1471-2229-8-40。
- 23.
Strizhov N, Ábrahám E, Ökresz L, Blickling S, Zilberstein A, Schell J, Koncz C, Szabados L:拟南芥中两个控制脯氨酸积累的P5CS基因在盐胁迫下的差异表达需要ABA,受ABA1、ABI1和AXR2调控。植物学报,1997,12:557-569。10.1046 / j.1365 - 313 x.1997.00557.x。
- 24.
Székely G, Ábrahám E, Cséplo Á, Rigo G, Zsigmond L, Csiszár J, Ayaydin F, Strizhov N, Jásik J, Schmelzer E, Koncz C, Szabados L:拟南芥重复P5CS基因在胁迫调控和脯氨酸生物合成发育控制中起着不同的作用。植物学报,2008,32(4):441 - 441。10.1111 / j.1365 - 313 x.2007.03318.x。
- 25.
Sanders PM, Bui AQ, Weterings K, McIntire KN, Hsu YC, Lee PY, Truong MT, Beals TP, Goldberg RB:拟南芥雄性不育突变体的花药发育缺陷。有性植物学报,1999,11:297-322。10.1007 / s004970050158。
- 26.
Alexander MP:败花粉和非败花粉的差异染色。染色技术,1996,44:117-122。
- 27.
Peterson R, Slovin JP, Chen C:败育与非败育花粉粒差异染色的简化方法。植物生物学杂志,2010,1:e13。
- 28.
Johnson-Brousseau SA, McCormick S:一种用于描述拟南芥花粉突变体和配子体表达基因的方法概要。植物学报,2004,38(4):371 - 371。10.1111 / j.1365 - 313 x.2004.02147.x。
- 29.
Bates LS:水胁迫研究中游离脯氨酸的快速测定。植物生态学报,2003,27(4):447 - 447。10.1007 / BF00018060。
- 30.
王晓燕,王晓燕,王晓燕,等:胁迫对植物渗透性积累的影响。植物细胞环境学报,1998,21:535-553。10.1046 / j.1365-3040.1998.00309.x。
- 31.
Hruz T, Laule O, Szabo G, Wessendorp F, Bleuler S, Oertel L, Widmayer P, Gruissem W, Zimmermann P: genevetrager V3:转录组meta分析的参考表达数据库。2008,生物信息学进展,420747。
- 32.
Foster J, Lee YH, Tegeder M: LHT氨基酸转运体家族成员在花中的独特表达表明了在植物繁殖中的特殊作用。有性植物学报,2008,21:143-152。10.1007 / s00497 - 008 - 0074 - z。
- 33.
拟南芥eFP浏览器。http://bar.utoronto.ca/efp.
- 34.
Genevestigator。https://www.genevestigator.com.
- 35.
Bock KW, Honys D, Ward JM, Padmanaban S, Nawrocki EP, Hirschi KD, Twell D, Sze H:通过转录组学将膜运输与雄性配子体的发育和功能结合起来。植物生理学报,2006,30(4):371 - 371。10.1104 / pp.105.074708。
- 36.
陈晓明,陈晓明,陈晓明,Büttner M:拟南芥花粉中葡萄糖特异性AtSTP9单糖转运体的功能鉴定及表达分析。植物生理学报,2004,24(3):366 - 366。10.1104 / pp.103.026674。
- 37.
SeedGenes项目。http://seedgenes.org.
- 38.
王晓燕,王晓燕,王晓燕。拟南芥生殖致病性的分子基础。科学通报,2011,6:12。
- 39.
胁迫诱导植物脯氨酸积累的代谢意义。植物生长学报,1997,21:79-102。10.1023 /: 1005703923347。
- 40.
Palanivelu R, Brass L, Edlund AF, Preuss D:花粉管的生长和引导受一种控制GABA水平的拟南芥基因POP2调控。细胞科学,2003,114:47-49。10.1016 / s0092 - 8674(03) 00479 - 3。
- 41.
Cecchetti V、Altamura MM、Falasca G、Costantino P、Cardarelli M:生长素调节拟南芥花药开裂、花粉成熟和花丝伸长。植物学报,2008,20:1760-1774。10.1105 / tpc.107.057570。
- 42.
Park SK, Howden R, Twell D:拟南芥配子体突变gemini pollen1破坏小孢子极性、分裂不对称和花粉细胞命运。发展,1998,125:3789-3799。
- 43.
Stewart CN, Via LE:一种用于RAPD指纹和其他PCR应用的快速CTAB DNA分离技术。生物技术学报,1993,14:748-751。
- 44.
拟南芥:形态学和发育图谱。柏林和纽约:Springer-Verlag 1993。
致谢
这项工作得到了MIUR、FIRB和ERA-PG对PC的研究资助,以及Università La Sapienza (Progetto di Ateneo)对MT的研究资助的部分支持。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们没有竞争利益。
作者的贡献
MT撰写并指导了这项工作,进行了互交、原色染色和亚历山大染色,RM进行了分离和siilique分析,DAPI染色,萌发分析和脯氨酸互补分析,CL进行了组织学分析,MB进行了分子分析,PC提供了资金支持并修改了手稿。所有作者阅读并批准了最终稿件。
电子辅料
图S1。
额外的文件1:p5cs1 p5cs2 / p5cs2有亚历山大污点的花药。一幅p5cs1 p5cs2 / p5cs2有亚历山大污点的花药。小而畸形的花粉颗粒清晰可见p5cs1 p5cs2 / p5cs2花药,作为非染色花粉花粉粒与野生型样,红色染色,花粉粒。Bar = 50 μm。(TIFF 3 MB)
图S2。
额外的文件2:在体外花粉的萌发测定p5cs1单突变体。评估一个突变体在花粉活力中可能存在的缺陷P5CS1基因,纯合子敲除的花粉p5cs1突变是孵化在体外在发芽培养基上进行评分。(A)与野生型(左列)相比,萌发型与总花粉(萌发+非萌发)的百分比,包括大花粉粒和小花粉粒(右列)。(B)大(中柱)、小(右柱)和野生型花粉(左柱)与大(中柱)、小(右柱)和野生型花粉(左柱)总萌发花粉的百分比。(A)和(B)中的值表示四次独立实验的平均值±SE。(JPEG 861 KB)
作者提交的图片原始文件
下面是作者提交的原始图片文件的链接。
权利和权限
开放获取本文由BioMed Central Ltd.授权发布。这是一篇开放获取文章,根据创作共用授权协议(https://creativecommons.org/licenses/by/2.0),它允许在任何媒体上不受限制地使用、分发和复制,只要原著被恰当地引用。
关于这篇文章
引用这篇文章
R.马提奥利,M.比安库奇,C.朗斯。et al。脯氨酸是拟南芥雄性配子体发育所必需的物质。BMC植物杂志12,236(2012)。https://doi.org/10.1186/1471-2229-12-236
收到了:
接受:
发表:
关键字
- 脯氨酸
- 雄配子体
- 拟南芥
- p5cs1 p5cs2 / p5cs2