摘要
背景
为了深入了解番茄果实抗坏血酸(AsA)库的调控,分别在“低”和“高”AsA番茄品种“艾尔萨克雷格”和“圣托里尼”的果实中进行了代谢产物分析、非标记和放射性标记基质喂养实验、酶活性测量和基因表达研究。
结果
两个品种在成熟过程中AsA总量(totAsA、AsA +脱氢抗坏血酸)和AsA积累量表现出不同的分布,但均在破碎期呈现出特征峰值。基质饲喂实验表明,l -半乳糖途径是番茄果实中AsA生物合成的主要途径,但其他途径的基质可以在特定发育阶段增加AsA库。此外,我们还发现,年轻果实比成熟果实表现出更高的AsA生物合成能力,但这并不会导致更高的AsA浓度,这是由于AsA分解率的提高(“Ailsa Craig”)或AsA回收率的降低(“Santorini”),这取决于品种。在成熟后期,两个品种果实对AsA浓度的差异可以通过AsA回收活性的差异来解释。AsA代谢基因的表达分析表明,只有一个同源的gdp - l -半乳糖磷酸化酶(SlGGP1),以及两种单脱氢抗坏血酸还原酶(SlMDHAR1而且SlMDHAR3)与‘艾尔萨克雷格’果实成熟过程中果实toasa - asa浓度变化相关,且仅表达SlGGP1与红色成熟圣托里尼水果中高浓度的AsA有关。
结论
结果表明,“艾尔萨克雷格”和“圣托里尼”使用互补机制来保持水果的AsA池。在低AsA品种(' Ailsa Craig ')中,AsA生物合成的替代途径可能是通过l -半乳糖来补充生物合成,而在高AsA品种(' Santorini ')中,增强的AsA回收活动似乎是成熟后期AsA积累的原因。基因表达研究表明SlGGP1和两个正交正交体SlMDHAR在成熟过程中与totAsA-AsA浓度密切相关,是潜在的育种和选择标记开发的良好候选。
背景
l -抗坏血酸(AsA,维生素C)是植物中最丰富的低分子量抗氧化剂之一,在暴露于(a)生物应激因子后产生的活性氧的解毒中发挥关键作用。除了抗氧化特性外,AsA还在植物发育和激素信号、细胞周期、细胞扩张中发挥重要作用,它是细胞氧化还原系统的一部分,也是几种重要酶的辅助因子[1,2].增强的水果AsA库也被认为与提高硬水果品种的收获后果实质量有关,如梨和苹果[3.,4],而苹果和苹果的多酚类化合物含量较高[4]和番茄[5水果。长期以来,膳食中AsA摄入量的增加也与几种与人类压力相关的疾病和障碍的发病率降低有关[6].鉴于其对所有代谢活性组织的重要性,了解植物AsA代谢的调控一直是一个广泛感兴趣的话题,特别是对于开发具有更高营养价值和潜在提高抗胁迫能力的富含AsA的新型品种的长期目标。
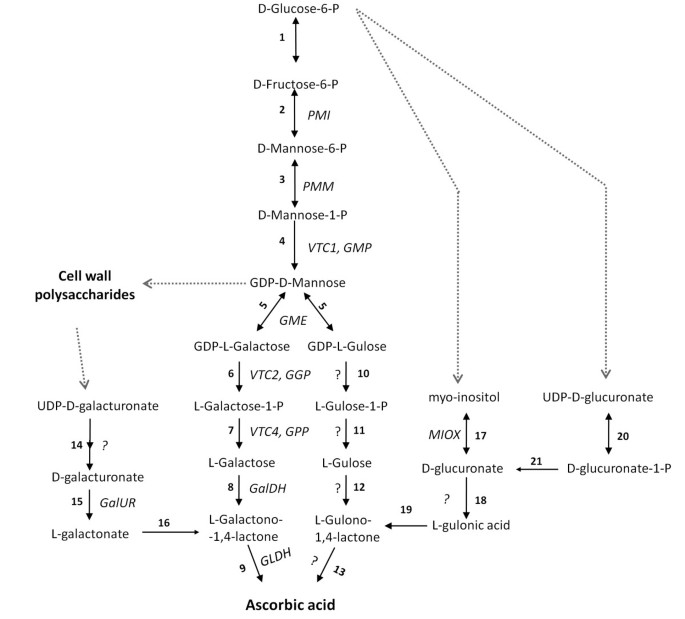
在植物中,AsA通过l -半乳糖途径进行生物合成(图1)最初由惠勒等人描述。[7]被认为是AsA在不同物种中积累的主要途径[8- - - - - -10],该途径中的几个结构基因被认为是不同物种果实AsA浓度的关键调节因子。其中包括gdp - l -半乳糖磷酸化酶(GGP, VTC2)在猕猴桃内[9]和苹果[10],以及l -半乳糖-1-磷酸酶(GPP, VTC4) [11]和gdp -甘露糖-3,5- epiimerase (GME) [12]在番茄里。可能的替代生物合成途径(图1),涉及糖醛酸[13,14, L-gulose [15),或myo肌醇(16]在一些植物物种中也得到了证实,但迄今为止,没有令人信服的证据表明这些在生理条件下对AsA库有显著贡献,可能除了草莓[14,17].尽管如此,我们不能排除这些替代途径可以在某些发育阶段,如果实成熟后期,补充l -半乳糖的合成[18].
高等植物中主要的和替代的l -抗坏血酸生物合成途径。带问号的反应还有待确认。1、葡萄糖-6-磷酸异构酶;2、甘露糖-6-磷酸异构酶(PMI;EC 5.3.1.8);3、磷漠变酶(PMM;EC 5.4.2.8);4、gdp - d -甘露糖焦磷酸化酶(VTC1或GMP;EC 2.7.7.13);5、gdp - d -甘露糖”,5”沃豪分公司差向异构酶(加工工厂;EC 5.1.3.18);6、gdp - l -半乳糖磷酸化酶(VTC2或GGP;EC 2.7.7.69);7、l -半乳糖-1- p磷酸酶(VTC4或GPP;EC 3.1.3.25);8、l -半乳糖脱氢酶(GalDH;EC 1.1.1.48);9、l -半乳糖-1,4-内酯脱氢酶(GLDH;EC 1.3.2.3); 10, nucleotide pyrophosphatase or sugar-1-P guanyltransferase; 11, sugar phosphatase; 12, sugar dehydrogenase; 13, L-gulono-1,4-lactone oxidase (EC 1.1.3.8); 14, D-galacturonate-1-phosphate uridyltransferase and D-galacturonate-1-phosphate phosphatase (possible); 15, D-galacturonate reductase (GalUR; EC 1.1.1.n9); 16, aldonolactonase; 17,myo-肌醇加氧酶(MIOX;EC 1.13.99.1);18、d -葡萄糖苷酸还原酶(EC 1.1.1.19);19日,L-gulonolactonase;20, d -葡萄糖醛酸盐-1-磷酸脲基转移酶;21, d -葡萄糖醛酸-1-磷酸磷酸酶。
氧化后的AsA可再生,或以还原剂谷胱甘肽(GSH)作为还原剂来源,通过抗坏血酸-谷胱甘肽循环回收[19].初级氧化产物单脱氢抗坏血酸(MDHA)可以自发地与脱氢抗坏血酸(DHA)和AsA不成比例,或者通过NAD(P)依赖的单脱氢抗坏血酸还原酶(MDHAR)的活性被还原回AsA。DHA本身也可以通过脱氢抗坏血酸还原酶(DHAR)的活性回收回AsA。一些研究已经证明了AsA-谷胱甘肽循环在防止AsA库(包括烟叶)枯竭方面的重要性[20.,21]和番茄[22,23].的正交正交的过表达达哈(GenBank ID: AY971873.1)茄属植物lycopersicum)导致成熟的绿色和红色果实中AsA的浓度增加了1.6倍[24].然而,同一组显示过表达的正交正交MDHAR(GenBank ID: L41345.1)导致成熟绿色果实中AsA浓度下降0.7倍,突出了通过循环控制AsA池大小的复杂性。
与其他水果种类相比,番茄的AsA含量只有中等水平[1],但它在人类饮食中的重要地位和它的高消费量意味着即使AsA含量相对较小的增加也会对消费者产生深远的影响。我们不知道对番茄品种中AsA浓度的广泛系统调查,但数据表明,商业品种的果实AsA浓度明显低于野生品种[22],并进一步显示出有限的变化[22,25].这表明,在番茄驯化/育种过程中,可能存在对低AsA含量的无意选择。
虽然有一些关于番茄中AsA内稳态控制的研究[11,12,18,22,23,25,26],迄今为止,结果是矛盾的,可能是由于使用不同的品种,生长条件和方法。在这里,我们开始确定番茄果实总AsA (totAsA)和成熟过程中AsA浓度的调控机制,并了解为什么一些品种能够比其他品种积累更多的AsA。采用的实验方法包括水果代谢产物分析、非和放射性标记的底物饲喂实验、AsA循环和抗氧化酶活性测量以及成熟过程中AsA候选基因表达谱的结合。研究的两个品种是“低asa”的“Ailsa Craig”,一个被广泛研究的模型品种,和“高asa”的“Santorini”,一个源于希腊“圣托里尼岛”的耐旱品种。所有结果的整合使我们能够建立两个品种的调控模型,并确定关键的调控成分。
结果
水果成熟
在我们水培系统的标准化温室条件下,“圣托里尼”果实成熟的速度略快(授粉后50天),比“艾尔萨克雷格”(52DAP)的果实成熟得更快。“圣托里尼”果实的大小也平均为“艾尔萨克雷格”果实的60%,但在整个成熟过程中,果实含水量或总可溶性固形物含量在栽培品种之间没有显著差异(附加文件)1:表S1)。为了弥补成熟时间的差异,并减轻实验过程中环境条件变化的影响,在整个实验过程中,根据“方法”中所述的外部和内部果实检查,两个品种的果实在相同的生理阶段收获。然后将这些果实根据成熟状态汇集起来进行分析。
成熟过程中AsA和GSH浓度的变化
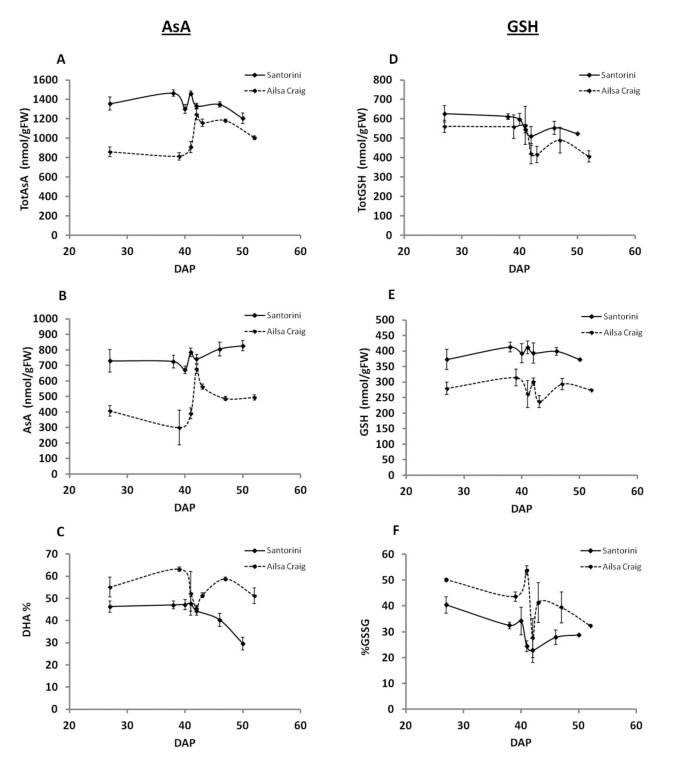
果实果皮组织中totAsA (AsA + DHA)、AsA和% DHA的浓度在两个品种间存在显著差异,但在成熟过程中也存在差异(图2;额外的文件2:表S2)。具体而言,在同一发育阶段,“圣托里尼”果实的totAsA和AsA浓度平均比“艾尔萨克雷格”果实高1.3倍和1.6倍(图2)2- b)。“圣托里尼”果实中totAsA和AsA浓度分别高出1.8倍和2.4倍,在MG阶段观察到的差异最大。这一阶段代表了细胞扩张期的结束,此时水果已达到最终大小。在完全成熟的红色阶段,“圣托里尼”水果的AsA含量是“艾尔萨克雷格”水果的1.7倍,但由于DHA的比例较低(% DHA;数字2摄氏度), totAsA水平仅高出1.2倍。
果实成熟过程中l -抗坏血酸和谷胱甘肽浓度的测定。总抗坏血酸(totAsA;一个)、l -抗坏血酸(AsA;B), %脱氢抗坏血酸(% DHA;C)、总谷胱甘肽(totGSH;D)、谷胱甘肽(GSH;E)和%氧化谷胱甘肽(% GSSG;F在温室水培系统中生长的“Santorini”(黑线)和“Ailsa Craig”(虚线)果实成熟过程中的果皮。成熟期用授粉后天数(DAP)表示。圣托里尼:27DAP,未成熟绿色(IG);38DAP,成熟绿(MG);40衣冠楚楚,b - 1;41DAP,断路器(B);42dap, b + 1;46个衣冠楚楚的,粉色;50个衣冠楚楚的,红色的。《艾尔萨·克雷格》:27DAP IG; 39DAP, MG; 41DAP, B-1; 42DAP, B; 43DAP, B + 1; 47DAP, pink; 52DAP, red. Results are represented as the mean of three biological replications ± SD. Statistical analysis is provided in Additional file2:表S2。
成熟过程中totAsA的变化表明,在‘圣托里尼’果实发育早期totAsA浓度较高,但此后变化不大。相比之下,' Ailsa Craig '果实的totAsA浓度在发育早期相对较低,但在破裂期后显著增加。在这两个品种中,totAsA的最高浓度都出现在破裂期,在这个阶段我们观察到浓度急剧和短期的峰值(图2).据我们所知,这是第一次在番茄或其他水果中观察到totAsA浓度如此短时间的波动。由于每个成熟阶段的水果都是在几周内收获的,然后汇集在一起,这些代谢物含量的变化与环境条件无关。水果AsA浓度的变化通常遵循totAsA浓度分布,唯一的例外是“圣托里尼”在B + 1阶段后AsA池的大小略有增加,而“艾尔莎·克雷格”在破裂阶段前后浓度变化较大(图2)2 b;额外的文件2:表S2)。目前尚不清楚破裂期totAsA-AsA浓度峰值的生物学基础是什么,但我们认为这是一个重要的诊断特征,在这项工作中,它被用于帮助识别候选基因,其表达受水果totAsA-AsA浓度变化的调控或相关。
DHA在totAsA池中的比例(% DHA)是组织经历氧化应激程度的指示。在“圣托里尼”水果中,在红色过渡阶段,% DHA从47.7%下降到29.6%2摄氏度),表明在成熟开始后,氧化应激水平降低或AsA回收能力提高。相比之下,在整个成熟过程中,“艾尔萨·克雷格”水果的DHA含量一直较高,在红色阶段占总DHA含量的51.2%,而“圣托里尼”水果在同一阶段仅占29.6%。有趣的是,“艾尔萨·克雷格”水果中的% DHA在破裂阶段特别下降,但“圣托里尼”水果中没有明显变化(图2摄氏度).
总谷胱甘肽浓度[totGSH;GSH +氧化GSH (GSSG)]、GSH和% GSSG在两个品种之间存在差异,在成熟过程中也存在差异(图二维- f;额外的文件2:表S2)。在整个成熟过程中,“圣托里尼”的totGSH-GSH浓度平均高出1.2倍和1.4倍,在红色阶段观察到的差异最大,totGSH和GSH浓度分别是“艾尔萨克雷格”的1.3倍和1.4倍(图)二维- e)。
两个品种在整个成熟过程中totGSH-GSH浓度的变化相似(图二维-E),同样具有特征性,但统计上不显著,谷胱甘肽浓度的变化发生在断路器阶段(图2 e).两个品种的谷胱甘肽浓度在IG阶段均最高,与totAsA-AsA库的结果相似,与“圣托里尼”相比,“艾尔萨克雷格”果实的谷胱甘肽库在整个成熟过程中氧化程度更高(图)2摄氏度而且2 f).
果实成熟过程中AsA代谢的变化
使用非生物合成前体和放射性标记生物合成前体进行基质喂养实验,以检测果实组织吸收AsA和DHA的能力以及它们合成AsA的能力的变化。这些实验对果实组织中AsA库的氧化还原状态没有显著影响,因此只介绍和讨论了组织中AsA浓度的变化。由于我们无法在对照培养培养基中检测AsA- totasa(结果未显示),因此在我们的培养条件下,AsA或DHA不太可能从组织中显著扩散。
在对照样品中(没有底物存在),24小时后totAsA显著损失,导致两个品种的IG和红色果盘的totAsA池大小减少了约2倍(附加文件)3.:表S3)。这大概反映了与组织损伤相关的应激导致的AsA氧化造成的损失,与黑醋栗的研究结果相似[27]和苹果[28].然而,有些令人惊讶的是,MG果盘的totAsA池大小在24小时的孵育期内基本保持稳定,这表明在这一阶段AsA回收的抗应力能力有所提高。
非放射性标记的基底研究
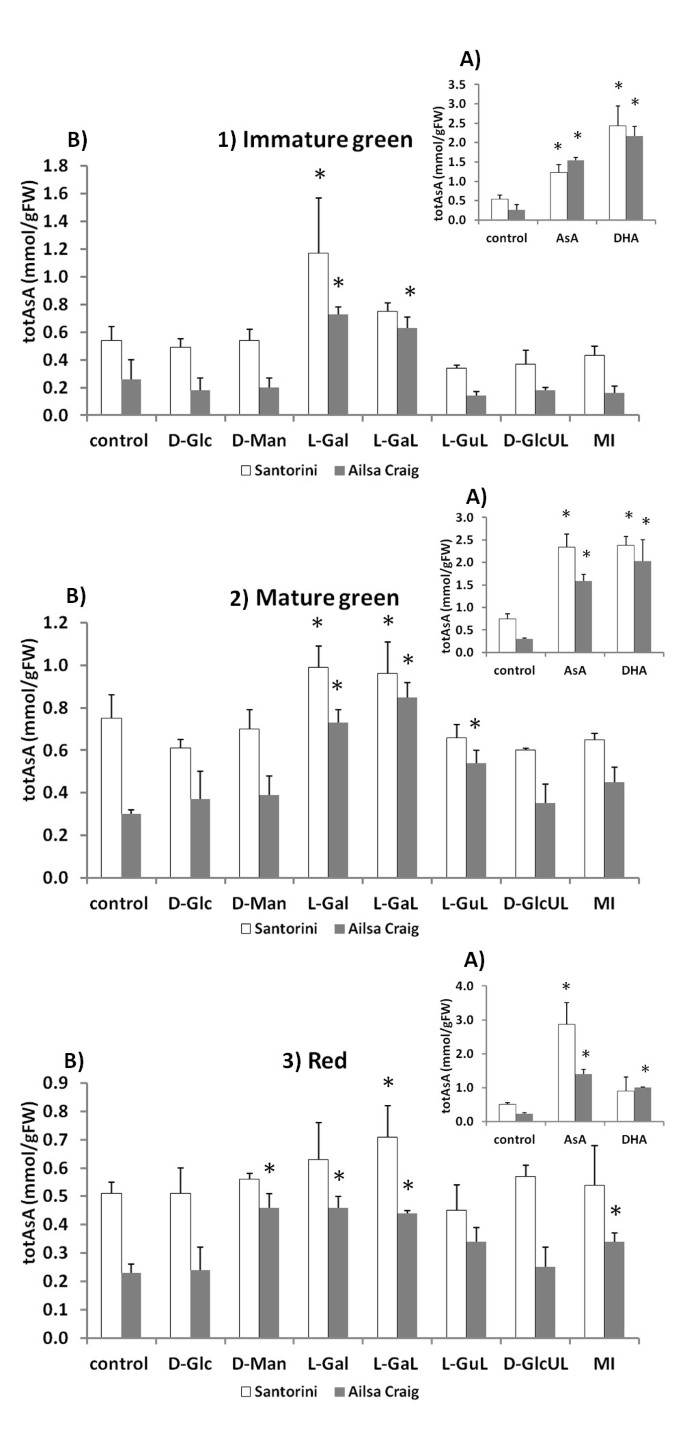
将果盘与未标记的AsA或DHA一起孵育,可以显示组织对这些不同形式的维生素c的吸收能力。结果表明,在两个品种中,DHA是IG阶段的首选吸收形式,也是' Ailsa Craig ' MG果盘的首选吸收形式3.-1B和2B)。然而,在红色果瓣中,AsA最有效地提高了totAsA水平,导致两个品种的totAsA水平比对照提高了6倍(图2)3.3个;额外的文件3.:表S3)。这表明,根据果实成熟阶段的不同,对还原或氧化AsA的偏好有所不同。此外,研究发现低AsA的“Ailsa Craig”品种在果实发育早期对AsA和DHA的吸收率明显更高,这表明这两个品种利用外部AsA来源的能力不同(图)3).这可能反映了AsA库的大小和氧化还原状态的差异(“艾尔萨·克雷格”水果通常比“圣托里尼”水果的toasa -AsA浓度更低,DHA百分比更高),内源性AsA生物合成能力的差异,或外部AsA/DHA运输能力的能量需求和能力的差异。
l -抗坏血酸前体底物的非放射性标记喂养实验。与之孵育的效果一个来自l -半乳糖途径的d -葡萄糖(D-Glc), d -甘露糖(D-Man), l -半乳糖(L-Gal)和l -半乳糖-内酯(L-Gal), l -古洛诺-内酯(L-GuL), d -葡萄糖醛酸-内酯(D-GlcUL),和myo-肌醇(MI)从替代生物合成途径,并与B) l -抗坏血酸(AsA)和脱氢抗坏血酸(DHA),对1)未成熟的绿色,2)成熟的绿色和3)红色的“圣托里尼”(白色)和“艾尔萨克雷格”(灰色)的totAsA浓度(mmol/gFW)进行24小时。结果表示三次重复±SD的平均值,星号表示24小时内与对照组显著不同的值(t-test, P < 0.05)。
两个品种的果皮组织均能形成新创AsA合成,但这种能力根据所提供的衬底而变化(图3 b;额外的文件3.:表S3)。在所有成熟阶段,用15 mM l -半乳糖(L-Gal)和/或l -半乳糖-1,4-内酯(L-Gal)孵育可显著提高组织totAsA浓度。在“圣托里尼”中,IG果盘与L-GaL的孵育引起的增幅最大(2.2倍),而在“艾尔萨克雷格”中,MG果盘与L-GaL的孵育引起的增幅最大(2.9倍)。相比之下,除“Ailsa Craig”红果瓣与D-Man孵育外,15 mM d -葡萄糖(D-Glc)或15 mM d -甘露糖(D-Man)对totAsA水平无显著影响。来自替代AsA生物合成途径的前体[l -gulono- 1,4 -内酯(L-GuL),或myo-肌醇(MI)]也只对totAsA池大小有有限的影响,而且只在' Ailsa Craig '果实的特定成熟阶段。例如,分别用L-GuL或MI孵育' Ailsa Craig '的MG和红色果瓣,totAsA的平均浓度分别比对照组提高了1.8-或1.5倍(图2)3 b;额外的文件3.:表S3)。
总的来说,这些基质培养实验在低asa的“Ailsa Craig”品种中比富含asa的“Santorini”品种中增加了更多的totAsA池大小,在两个品种中,年轻果实中比红色果实中增加更多。这可能表明“艾尔萨克雷格”比“圣托里尼”对底物的限制更大,或者品种对底物的吸收能力不同,类似于对AsA和DHA吸收的观察结果,可能是由于果实生理/形态的差异。在任何发育阶段,孵育均未显著影响组织totGSH-GSH浓度(数据未显示)。
放射性标记基底研究;周转率和生物合成
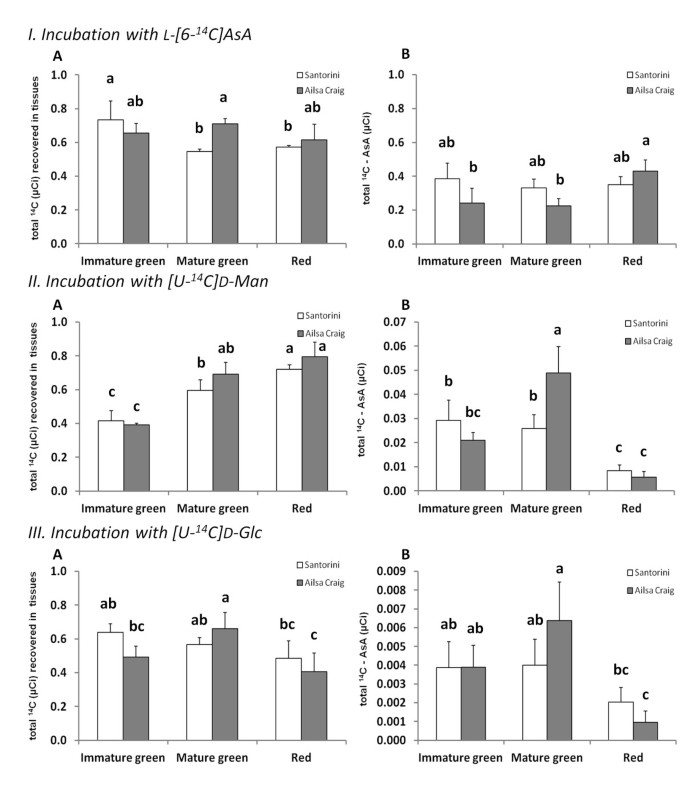
用放射性标记的生物合成基质培养水果盘,使我们能够确定它们的摄取率(总放射性标记的回收率)和转化为totAsA的率(总放射性标记的回收率)14C-AsA),没有底物抑制作用的可能性。用L-[6-]培养14C]AsA被用来确定AsA池的净吸收和周转率(分解)在总量中的显著比例14由于AsA降解和/或转化,在其他代谢产物中发现了C-AsA放射性标签(图4我-A和-B)结果表明,两品种对L-[6-]的吸收能力无显著差异14C]AsA超过24小时,MG期除外(图4我-A),其中从“艾尔萨·克雷格”皮盘中回收的总放射性标签比从“圣托里尼”皮盘中回收的总放射性标签多15%。但是,从回收的放射性标签总量来看14在C-AsA中,我们发现'圣托里尼'的totAsA池在成熟过程中的平均周转率高于'艾尔萨克雷格',分别为13.8和10.9 nmol totAsA/gFW/h1).相比之下,在IG期和MG期成熟前,“艾尔萨·克雷格”果实的%周转率较高。在“圣托里尼”中,不同果实发育阶段的转化率没有显著差异,尽管MG阶段的绝对转化率(nmol totAsA/gFW/h)较低,但红色阶段的转化率与幼果(IG)一样高。相比之下,在‘艾尔萨·克雷格’中,果实的周转率在整个发育过程中持续下降,在红色阶段,周转率仅为‘圣托里尼’果实的18%。这表明,要么是AsA的回收效率更高,要么是‘艾尔萨克雷格’品种对AsA的需求总体上更低。
l -抗坏血酸(AsA)前体底物的放射性标记喂养实验。摄取和转化141 μCi L-[6-]在“Santorini”(白色)和“Ailsa Craig”(灰色)的未成熟果盘(绿色)、绿色和红色果盘(白色)孵育24 h后,C含量显著增加14a (I), [U-14C] D-Mannose (U -14C] d男人;II)和[U- .14C]葡萄糖(U -14C] D-Glc;III).结果用组织中回收的总放射性标签(μCi)表示(一个),作为总放射性标签(μCi)并入total14C-AsA (B).数据显示三个独立实验的平均值±标准差。不同字母表示SAS中Duncan's multiple-range检验值之间存在显著差异(P < 0.05)。
与L-[6-14C]在AsA培养中,不同品种在任何发育阶段对其他放射性标记底物的吸收率均无显著差异。摄取14C-D-Man随着成熟增加2倍左右(图4II-A),而摄取14C-D-Glc实际上随着成熟而略有下降(图4III-A)。从总数来看14C放射性标签回收为总14C-AsA(即AsA生物合成速率),我们可以看到,回收率取决于品种和发育阶段,以及底物本身(图2)4II-B和III-B)。此外,正如预期的那样[1,27,28]、[U -14C . D-Man是一种比[U-14C] D-Glc。两个品种间[U-]含量差异不显著14C . D-Man放射性标签恢复为总14C-AsA,除了MG阶段,在这个阶段,' Ailsa Craig '的合并大约是它的两倍。矛盾的是,这是两个品种之间totAsA(1.8倍)- AsA(2.4倍)浓度差异最大的阶段(图2),表明“Ailsa Craig”在这个阶段可能会受到底物限制。如其他系统所报告的[12,28,29的转换速率14C-D-Glc明显低于14C-D-Man,最多只有0.6%的总回收率14“Ailsa Craig”中MG水果中的C-AsA(图4III-B)。然而,测定的AsA生物合成速率14C-D-Glc在发育过程中表现出与孵育时观察到的相同的变化14C-D-Man品种的MG果率最高,红期最低。
果实成熟过程中AsA循环和抗氧化酶活性的变化
在整个成熟过程中,酶参与了AsA循环和抗氧化防御。在所有情况下,活性谱都以每毫克鲜重的活性(FW)为单位表示,因为活性谱与以可溶性蛋白含量为基础表达时所获得的活性谱相同(数据未显示)。
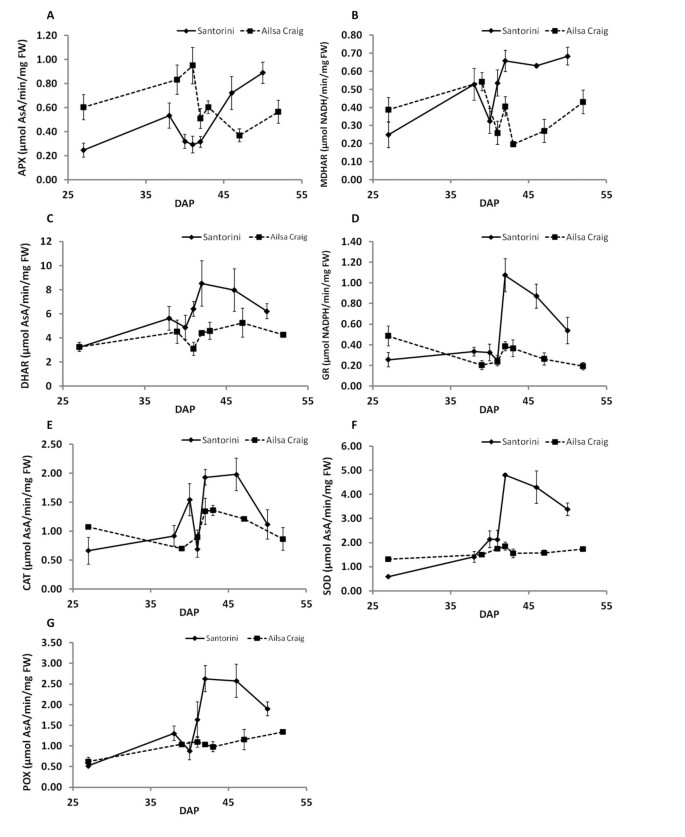
与衬底补料实验结果(图3.,4),两个品种在成熟过程中表现出不同的活性分布(图5).总的来说,在整个成熟过程中,'艾尔萨克雷格'的活性变化较小,在破壳期之前,除抗坏血酸过氧化物酶(APX)外,其他酶活性在两个品种中基本相当。然而,直到B-1期,“Ailsa Craig”的APX活性高出约2倍。不同品种之间的主要差异发生在破裂期之后,“圣托里尼”的所有酶活性都增加了,并且远高于“艾尔萨克雷格”,这表明“圣托里尼”水果应对氧化应激的能力增强了。这可能有助于保持较高的totAsA-AsA浓度和较低的DHA %(图2),这可能代表了“圣托里尼”通常种植的高光、高温和低水分条件下的构成适应机制的一部分。
抗氧化酶活性。抗坏血酸过氧化物酶(APX;一个),单脱氢抗坏血酸还原酶(MDHAR;B)、脱氢抗坏血酸还原酶(DHAR;C)、谷胱甘肽还原酶(GR;D),过氧化氢酶(CAT;E)、超氧化物歧化酶(SOD;F)和过氧化物酶(POX;G)根据“圣托里尼”和“艾尔萨克雷格”果实成熟过程中的蛋白质含量和新鲜重量,在温室的水培系统中种植。成熟期用授粉后天数(DAP)表示。圣托里尼:27DAP,未成熟绿色(IG);38DAP,成熟绿(MG);40衣冠楚楚,b - 1;41DAP,断路器(B);42dap, b + 1;46个衣冠楚楚的,粉色;50个衣冠楚楚的,红色的。《艾尔萨·克雷格》:27DAP IG;39衣冠楚楚,毫克;41衣冠楚楚,b - 1;42衣冠楚楚,B;43dap, b + 1;47个衣冠楚楚的,粉色; 52DAP, red. Results are represented as the mean of three replications ± SD. Each replication consisted of pooled samples as explained in materials and methods, and was the same used for AsA determination and gene expression analysis.
在整个成熟过程中AsA浓度的变化部分反映在酶活性测量的变化上。例如,在‘圣托里尼’果实中,APX (P < 0.001)、MDHAR (P < 0.001)和过氧化物酶(POX, P < 0.05)活性与AsA浓度相关,而在‘艾尔萨克雷格’果实中,APX (P < 0.05)、过氧化氢酶(CAT, P < 0.0001)和超氧化物歧化酶(SOD, P < 0.05)活性与AsA水平相关(补充文件)4:表S4),再次表明这两个品种有不同的机制来处理氧化应激。然而,特别令人感兴趣的是在破断阶段MDHAR活性的变化,它遵循与“Ailsa Craig”中totAsA-AsA浓度变化相同的特征模式(图)2而且5 b).MDHAR也是在裂解阶段表现出最显著的活性增加的酶,与' Santorini '和' Ailsa Craig '中的B-1相比,分别增加了65%和56%。这对应于“圣托里尼”和“艾尔萨克雷格”的AsA浓度分别增加了17%和73%。
果实成熟过程中asa相关基因相对表达量的变化
来自l -半乳糖生物合成和asa循环途径的16个番茄同源基因的表达(表2)2)在“Ailsa Craig”果实成熟过程中的果皮组织中进行了研究6).准确的实时定量PCR (qPCR)结果取决于使用合适的参考基因[30.]其表达在成熟过程中没有显著变化。从我们样本集中测试的七个可能的内参基因中,网格蛋白适配器复合物中亚单位(CAC)和蛋白磷酸酶2A催化亚基(PP2Acs)在成熟过程中稳定性最高,稳定性值分别为0.344和0.369(附加文件5:表S5)。因此,所有的表达数据都相对于这两个基因的几何平均值进行表达,基本上如上所述[31].
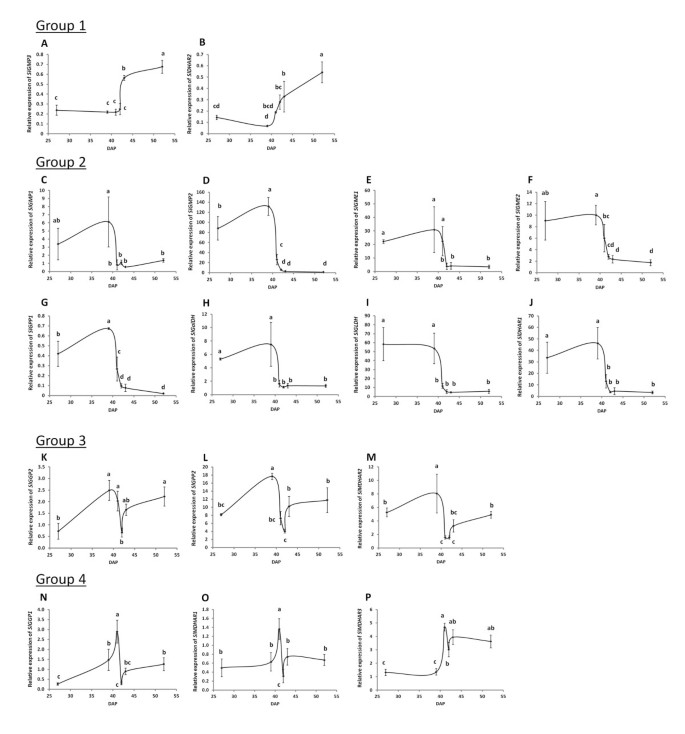
基因表达研究。‘艾尔萨·克雷格’果实未成熟绿色时l -抗坏血酸(AsA)代谢相关基因相对表达的变化(IG;27DAP),成熟绿(MG;39DAP), B-1 (41DAP),断路器(B;42DAP)、B + 1 (43DAP)、红色(52DAP)级。成熟期用授粉后天数(DAP)表示。qPCR值按表达的几何平均值归一化CAC而且PP2Acs.结果以三个生物(每个生物由3个相同阶段的样本库组成)和两个技术复制±SD的平均值表示。根据基因在成熟过程中的相对表达模式,将其分为四类:1)随成熟而增加(一个,SlGMP3;B,SlDHAR2), 2)随成熟而减少(C,SlGMP1;D,SlGMP2;E,SlGME1;F,SlGME2;G,SlGPP1;H,SlGalDH;我,SlGLDH;J,SlDHAR1), 3) MG阶段达到峰值(K,SlGGP2;l,SlGPP2;米,SlMDHAR2)和4)在B-1阶段达到峰值(N,SlGGP1;O,SlMDHAR1;P,SlMDHAR3).不同字母表示SAS中Duncan's multiple-range检验值之间存在显著差异(P < 0.05)。
成熟过程中的表达谱允许我们将这些同源物分为四组(图6)如下;1)成熟过程中表达量急剧增加的基因,2)成熟过程中表达量下降的基因,3)MG期表达量达到峰值的基因,4)破碎期前一天表达量达到峰值的基因(图6).
第1组剖面含有甘露糖焦磷酸化酶的同源物(SlGMP3, SGN-U584300)和达哈(SlDHAR2SGN-U577467)。表达水平增加3.4- (SlGMP3)或6.1倍(SlDHAR2)从MG到‘Ailsa Craig’果实的红色阶段(图6;组1)。
大多数AsA生物合成和循环基因图谱被归为第2组,在MG期之前基因表达量较高,然后急剧下降,并在整个成熟过程中保持低表达(图2)6;第二组)。这一组包括GMP(SlGMP1SGN-U568548;SlGMP2SGN-U568547),GME(SlGME1SGN-U581327;SlGME2SGN-U580362),GPP(SlGPP1, SGN-U600217),以及达哈(SlDHAR1, SGN-U583361),以及l -半乳糖脱氢酶(SlGalDH, SGN-U565558)和l -半乳糖内酯脱氢酶(SlGLDHSGN-U585649)。在这个组中,表达水平从4.5- (SlGMP1)至120倍(SlGMP2)整个成熟过程。
组3的基因在破断期前后表达出现短期但剧烈的变化(图6;组3)。该组包含GGP(SlGGP2SGN-U573852),GPP(SlGPP2, SGN-U568299)MDHAR(SlMDHAR2SGN-U573751)。表达谱的特征是在MG时达到峰值,然后在B-1阶段下降,然后在B + 1阶段急剧增加,随后在成熟的其余阶段保持恒定表达。
第四组含有关键生物合成酶的另一种同源物GGP(SlGGP1, SGN-U579800)和两个循环基因拷贝MDHAR(SlMDHAR1SGN-U583672;SlMDHAR3, SGN-U584073)6).这些转录本被证明是最有趣的,因为它们的相对表达谱显示了与“Ailsa Craig”中toasa - asa水平观察到的相同的破断阶段特征变化,但延迟了一天(图2)2).
为了确认第4组转录本在解释totAsA-AsA浓度的品种特异性差异中的作用,还在富含asa的品种(' Santorini ')的红色果实中测试了这三个基因的表达。在此,qPCR值以CAC为基准进行归一化处理,因为CAC在两个品种红果间的表达最为稳定。结果清楚地表明,只有表达SlGGP1与‘Ailsa Craig’红色果实的表达量相比,显著升高(2倍)(表3.).然而,相对的表达SlMDHAR1而且SlMDHAR3虽然不同品种间没有显著差异,但“圣托里尼”红色果实的MDHAR活性平均高出1.6倍,这再次表明asa循环在维持较高的toasa - asa库中发挥了作用。
讨论
两个番茄品种的AsA和GSH浓度
完全成熟的番茄果实中totAsA-AsA含量“适中”[1]与黑醋栗等其他品种的果实相比[27]和猕猴桃[9].在标准化水培温室条件下,“Santorini”和“Ailsa Craig”红熟期果实AsA浓度分别为14.6和8.69 mg/100gFW,品种间差异为1.7倍。这与在希腊田间条件下观察到的同一品种之间的差异相同[25],表明番茄中AsA池大小的调控具有强大而稳定的遗传基础。然而,大田种植的番茄与温室种植的番茄相比,其果实AsA含量高出约1.5倍,这可能是由于田间种植的番茄经历了更高的辐照度(和温度)[32].然而,红熟水果中totAsA浓度的差异并不大(分别为“圣托里尼”和“艾尔萨克雷格”的21.2 nmol/gFW和17.7 nmol/gFW),因为“艾尔萨克雷格”的AsA池中含有更高的DHA %(即它被氧化得更多)。这可能是由于在这一阶段参与AsA循环的酶的活性较低(图5).
平均而言,在整个成熟过程中,“圣托里尼”水果中的totAsA、AsA和GSH浓度是“艾尔萨克雷格”的1.8倍、2.4倍和1.4倍。而totGSH-GSH的浓度在成熟过程中没有显著变化。由于两个品种的成熟时间相似,果实含水量也没有显著差异,因此这种变化不太可能与代谢物“稀释”效应有关(附加文件)1:表S1)。因此,这些差异代表了果实积累到asa能力的明显遗传差异。
番茄果实成熟过程中AsA和GSH的积累
在果实成熟过程中totAsA的积累已经在一些植物物种中得到了很好的研究,报告显示,其模式因所研究的物种和栽培品种以及生长条件而异。例如,在不同番茄品种的果实中,totAsA浓度都显示出增加[11,18,33,34],或保持基本不变[35]在成熟过程中。即使在相同的生长条件下,两个栽培品种也表现出不同的果实对asa积累的模式。尽管如此,这两个品种的一个共同特征是在破乳阶段toasa -AsA浓度的峰值,这被证明有助于理解在成熟过程中调节AsA浓度的因素。番茄的破裂期(果实颜色第一次从绿色变成红色)标志着成熟的开始,与乙烯相关代谢途径的诱导有关,并导致果实代谢的重大转变。AsA(和谷胱甘肽)浓度激增的生物学基础尚不清楚,但H2O2先前曾在番茄中报道过破壳期的积累[33].虽然H2O2在这里没有测量,totAsA-AsA池大小的增强可能表明了对H的这种增加的适应性反应2O2浓度。
在“Ailsa Craig”中,由于AsA和谷胱甘肽浓度的增加,裂解阶段DHA %下降15%,GSSG %下降48%。与B-1阶段相比,“Ailsa Craig”水果中MDHAR活性增加了56%,这些结果表明,AsA循环能力的增强可能与这些阶段AsA和谷胱甘肽的增加有关。不幸的是,我们没有关于在这个特定时间点AsA生物合成能力(基质培养)变化的数据,因为没有足够的果实来进行所有的培养。然而,在圣托里尼岛也观察到了类似的结果,在破裂阶段,MDHAR活性增加65%与AsA池的增加相关。事实上,MDHAR是唯一一种活性与两个品种在破果期果实toasa - asa水平增加有关的酶,尽管活性结果代表了所有亚细胞亚型的平均活性,但其表达的变化支持了这一结果SlMDHARs《艾尔萨·克雷格》- - - - - -参见下面的讨论。
之前对番茄果实中谷胱甘肽水平的研究表明,在成熟的后期,谷胱甘肽浓度会增加,但谷胱甘肽的变化与AsA的变化无关。33].我们的研究结果支持这些结论,我们发现在两个品种的成熟过程中,totGSH和GSH浓度分布与totAsA-AsA分布不同,这表明这些抗氧化池受到不同的调控。
番茄果实中AsA的摄取、生物合成和循环利用
早期对叶细胞悬浮培养的研究表明,AsA的首选摄取形式是氧化形式的DHA [13,36].我们对两个品种的年轻番茄果实的研究结果支持这一观点,但在红色阶段成熟结束时,人们明显偏好AsA,与用DHA孵育相比,‘圣托里尼’的totAsA池的大小增加了3.3倍,‘艾尔萨克雷格’的totAsA池的大小增加了1.4倍。不同品种的这些不同反应可能与‘圣托里尼’成熟果实中totAsA池较少的氧化还原状态有关,或者与豆苗中报道的外部AsA/DHA的能量需求和运输能力的差异有关[37].
果实组织合成AsA的能力新创已在几种水果品种的底物饲喂实验中证实,包括小胡瓜[38],苹果[28,39]、黑醋栗[27].在这两个番茄品种中,细胞间totAsA-AsA的最高积累发生在与L-Gal或L-Gal孵育的果盘之后。这是可以预料的,因为这些是l -半乳糖途径的最后两个酶促步骤的底物(图1).结果还表明,当提供外部碳源时,随着细胞间totAsA-AsA浓度的增加,L-Gal途径的底物比其他生物合成途径的前体更有效。尽管如此,L-GuL或MI也能分别提高MG和红色果实的totAsA水平,但仅在低asa的品种“Ailsa Craig”中。与L-GuL孵育之前已报道有效刺激AsA水平拟南芥叶悬浮培养[13]和苹果[28,而过度表达myo肌醇加氧酶拟南芥,该基因编码负责MI转化为d -葡萄糖苷酸盐的酶(图1),支持心肌梗死是AsA的潜在前体,至少在叶组织中是如此[16].与之前苹果公司的报告一致[40], d -葡萄糖醛酸内酯(D-GlcUL)在任何成熟阶段都没有增加果实totAsA水平,但对这种底物的吸收效率或反馈抑制作用知之甚少。因此,替代AsA生物合成途径的存在或功能似乎是品种和/或发育阶段特定的。
两个品种的幼果(IG, MG)均表现出高于成熟果实的AsA生物合成能力,可能有助于在果实细胞分裂和扩张阶段支持更高的细胞代谢速率。尽管如此,红色成熟的水果具有更高的AsA浓度(图2 b).同样,尽管totAsA-AsA浓度较低,“艾尔萨克雷格”水果的AsA生物合成能力高于“圣托里尼”水果。因此,生物合成能力与totAsA-AsA浓度无关。高AsA品种与低AsA品种的生物合成能力较低,可能代表了AsA对圣托里尼果实中AsA生物合成的反馈抑制结果,也可能是由于这些圣托里尼果实对AsA的需求较低,或吸收能力的差异。先前已经在菠菜中观察到AsA池的反馈调节[41],以及在豌豆苗中[29],其中l -半乳糖生物合成途径中最后一种酶GLDH的活性被增加的AsA水平竞争性地抑制。
由于AsA生物合成速率的差异与果实totAsA-AsA浓度的品种差异或成熟过程中观察到的变化无关,totAsA-AsA的积累可能是由于AsA周转率和AsA循环速率的差异造成的。事实上,我们的研究结果表明,这两种机制都显著影响水果totAsA池的大小。例如,在同一发育阶段,‘艾尔萨·克雷格’的果实中,幼果(低AsA)的AsA库的%周转率显著高于‘艾尔萨·克雷格’的红色(高AsA)果实(2倍),而‘圣托里尼’幼果的AsA库的%周转率比‘艾尔萨·克雷格’的果实低1.7倍。然而,“圣托里尼”水果的实际周转率更高,再次表明AsA库的大小和周转率之间可能存在联系。29].另一方面,“Ailsa Craig”中的totAsA池更小,氧化程度更高2摄氏度),而这种品种对AsA的回收能力较低(图5).有趣的是,在所有测定的酶中,MDHAR活性的增强与两个品种在破粒期测定的totAsA-AsA浓度的增加有关。
因此,总结本节,AsA生物合成能力在果实发育早期较高,即使AsA(在两个栽培品种中)和totAsA(仅在' Ailsa Craig '中)的浓度在成熟后期较高。在IG水果中toasa -AsA的缺乏是由于AsA池的较高的周转率。这两个品种的净重也不同新创生物合成能力,“低asa”“艾尔萨克雷格”实际上显示出更高的生物合成能力。同样,这是由果实发育早期AsA池的更高%周转率和较低的AsA循环率所补偿的,与“圣托里尼”相比,AsA的氧化氧化还原状态更为明显。
在整个成熟过程中AsA调控的候选基因
与猕猴桃的结果相似[9]和番茄[11],我们发现大多数来自l -半乳糖途径的生物合成基因在果实发育早期具有较高的相对表达(图6(第2组和第3组)。这与测量到的更高的生物合成能力有关,可能反映了细胞分裂/扩张对AsA的需求增加[42].在之前的研究中,增强的表达GPP在' Ailsa Craig '果实成熟过程的后期,由northern blot分析监测到,与AsA浓度的增加有关[11].然而,两者之间并没有这样的相关性GPP在“艾尔萨·克雷格”果实成熟过程中,我们观察了其表达和AsA水平。事实上,在所有检测的基因中,只有“第4组”基因的相对表达模式(SlGGP1,SlMDHAR1而且SlMDHAR3)(图6(P < 0.001)与打破期前后水果toasa - asa水平的变化呈强相关(延迟1天)6:表S6)。在番茄叶片中,基因表达和AsA浓度变化之间也有类似的延迟[26].因此,这三个基因似乎是调控果实AsA浓度的良好候选基因。的表达也有显著的相关性SlGMP2而且SlGGP2和AsA浓度在这一阶段(P < 0.05),但与totAsA浓度无关(附加文件6:表S6),表明这些转录本也可能在调节减少的AsA池的大小方面发挥作用。
GGP (VTC2)代表AsA生物合成的第一个承诺步骤,以前曾被认为是植物中一个关键的限速步骤[5,9,10,43].我们实验室最近的研究结果表明,苹果的近亲GGP是水果中totAsA-AsA浓度的关键调节因子[10],其他人已经表明,异位表达的单一猕猴桃GGP转基因番茄(3- 6倍)和草莓(2倍)中totAsA含量均有所增加[5].因此,我们在这里的结果支持了一个中心作用GGP在几种不同植物的果实中对果实池的调节。此外,虽然我们不能排除其他基因在高AsA品种成熟过程中对果实AsA池大小的调节起作用的可能性,但差异SlGGP1不同品种间果实totAsA-AsA的表达也有一定的差异,红熟果实中totAsA-AsA的表达量是红熟果实的两倍”圣托里尼的低asa品种,'艾尔萨克雷格'(表3.).然而,这些结果应该通过测试进一步验证SlGGP1在totAsA-AsA浓度范围更广的番茄品种的果实中表达。
在几个番茄种群的数量性状位点(QTL)研究的基础上,Stevens和他的合著者提出了一个直系同源的角色MDHAR,作为番茄果实AsA遗传控制的候选基因[22,23].这个候选基因对应于SlMDHAR2(SGN-U573751),但本研究的基因表达谱并不支持这一结论,另有研究表明过表达SlMDHAR2甚至会导致MG水果中AsA含量的适度降低[24].然而,MDHAR活性与‘圣托里尼’果实成熟过程中的AsA浓度密切相关(附加文件)4:表S4),并与‘Ailsa Craig’果实中toasa - asa在破果期前后的短期变化有关(图4)5),同时表达另外两个MDHARorthologues,SlMDHAR1(SGN-U583672)和SlMDHAR3(SGN-U584073),确实密切反映了“Ailsa Craig”果实在这一阶段totAsA-AsA浓度的变化(图6).相反,另一个主要的asa循环基因的两个同源基因的表达水平达哈,并没有反映toasa - asa变化的变化(图6).
尽管这里给出的结果表明SlMDHAR1而且SlMDHAR3在“艾尔萨克雷格”成熟过程中,对照AsA库基因产物的相对表达量在红期两品种间无显著差异。尽管如此,在高asa品种的果实中,MDHAR酶活性实际上高出1.6倍。这种基因表达和酶活性之间的差异可能与活性结果代表所有亚细胞亚型的平均活性有关,而表达结果代表基因家族中单个成员的表达。
结论
在这项工作中,我们试图揭示两个果实toasa -AsA水平不同的番茄品种在果实成熟过程中AsA代谢的调控,从而确定关键的调控元件。基质饲喂实验表明,与其他果实种类一样,年轻的番茄果实在成熟开始前具有更高的积累和合成AsA的能力(IG和MG果实),生物合成主要通过l -半乳糖生物合成途径进行。然而,在这些早期发育阶段,尽管生物合成能力增强,但由于AsA库的分解率较高(“Ailsa Craig”),可能是由于发育中的组织在细胞扩张中对AsA的需求增强,或由于AsA循环活动低(“Santorini”),水果并没有积累高toasa -AsA浓度。
在这两个品种中(但在' Ailsa Craig '中更大程度上),totAsA和AsA浓度在成熟后期显著增加,我们的结果表明,这是由于循环增加和/或分解再次减少,这取决于品种。比较两个品种,在破裂期后AsA回收能力的增加似乎是高AsA品种(' Santorini ')果实中toasa -AsA水平提高的原因,尽管在同一发育阶段,它的净生物合成能力低于低AsA品种(' Ailsa Craig ')。这种较低的生物合成能力可能是由于AsA生物合成前体的吸收能力较低,或者由于AsA本身水平的增加对AsA生物合成的反馈抑制。这两个品种的一个以前未被认识的特征是果实中tasa - asa浓度在破果期出现一个尖峰。这一高峰可能具有商业意义,因为番茄通常在破裂阶段采摘,然后让其成熟。
从AsA代谢基因的检测范围来看,只有SlGGP1和两个基因副本SlMDHAR与' Ailsa Craig '成熟过程中totAsA-AsA浓度的变化相关。而在红色阶段只有差异的表达SlGGP1虽然“圣托里尼”水果中的MDHAR酶活性更高,但这足以解释asa水平。因此,果实totAsA-AsA浓度似乎受到生物合成和循环活动的变化的调控,这些机制的相对贡献取决于品种和发育阶段。鉴定这些候选基因的功能等位基因将使我们能够了解它们在水果AsA调控中的相对贡献,并有助于开发适合育种和选择的分子标记。
方法
植物材料与生长
番茄(茄属植物lycopersicum;简历。“艾尔萨·克雷格”和简历。“圣托里尼”)于2008年夏天在比利时鲁汶大学的温室中使用标准温室水培系统进行栽培。植物生长在20°C下,补充光照16小时(当阳光低于250 W/m时)2,补充照明75w /m2),然后在18°C的黑暗条件下进行8 h。植物接受了完整的营养液(附加文件7:表S7),电导率(EC)维持在2.0±0.2 dS·m1pH为6.0±0.3,灌溉频率根据浸出液的EC和pH调整。为了加速成熟,保证果实品质均匀,每株只保留5个桁架,每个桁架最多保留3个果实。
抽样
所有的水果都是在28th8月15日th2008年9月。在此期间,从20株单株的不同桁架中随机抽取了两个栽培品种中至少10个相同成熟阶段的果实。果实在授粉后7天(DAP)进行标记,并在以下阶段之一收获:未成熟绿色(IG)、成熟绿色(MG)、破裂前一天(B-1)、破裂后一天(B + 1)、粉红色和红色阶段。在温室条件下,“圣托里尼”果实的上述生育期分别为27、38、40、41、42、46和50 DAP,“艾尔萨克雷格”果实的上述生育期分别为27、39、41、42、43、47和52 DAP。果实外表面首次出现橙色(类胡萝卜素生物合成)被用来定义破裂阶段。为了保证发育的同步性,对果实进行了内部(种子和房室果冻的发育、色素沉着)和外部(大小、形状、皮肤颜色)的检查,只保留那些出现相同阶段的果实进行进一步分析。在每个发育时间点,在18天内收集的收获水果的果皮组织被组合在三个池中,每个池中至少有三个水果,并立即在液氮中冷冻。每个发育池都包含在不同日期收获的水果(但在相同的生理阶段),消除了由于实验期间环境差异造成的变化。
AsA和GSH测量
用高效液相色谱法测定还原AsA和谷胱甘肽,基本与Davey等人描述的一致。[44].提取液过滤后注射到HPLC系统(Waters 2690分离模块),该系统配备C18火箭柱(GRACE, 53毫米x 7毫米)。AsA和GSH分别在243 nm和197 nm处检测到(Waters 996光电二极管阵列检测器)。
AsA生物合成能力的测定
通过将直径为1厘米的水果果皮与AsA生物合成的非放射性标记糖前体孵育来研究AsA生物合成的能力,并通过HPLC分析随后抗氧化剂含量随孵育时间的变化[12,44].分别用IG、MG和红果进行孵育。圣托里尼和cv。艾尔莎•克雷格。使用了以下前体分子:D-Glc, D-Man, L-Gal, L-Gal, L-GuL, D-GlcUL和MI,以及AsA和DHA,浓度均为15 mM (Sigma-Aldrich)。在pH为6.8的条件下进行培养,使用20 mM MES缓冲液和200 mM d -甘露醇作为渗透剂。所有孵育均在25°C下连续光照24小时。24小时的对照样品由相同的孵育介质组成,不添加AsA生物合成的糖前体。每个样本集使用三个重复。
用直径为1厘米的水果果皮果盘(与之前的阶段相同)进行无线电标记研究μCi (L-[6-]14(U - C]亚撒,14C]D-Man和[U-14C]D-Glc,比活性均为50μCi / 250μL (Amersham生物科学欧洲有限公司,罗森达尔,荷兰)。所有孵育均在室温(~25°C)连续光照下进行24小时。然后用无菌等渗溶液和提取的AsA冲洗三次,进行HPLC分析。使用Ramona 2000放射性检测器(Raytest Isotopenmeßgeräte, GmbH)在线检测提取物中的放射性标签,在紫外检测器[44].
酶提取和测定
将储存的生物重复的冷冻水果组织样本在液氮中粉碎成细粉。总蛋白从3-4克均质组织中提取,使用相同体积的磷酸盐缓冲液(50 mM, pH 7.6),其中含有1mm EDTA, 0.3% Triton X-100, 1%聚乙烯聚吡啶烷酮(PVPP)和10%甘油,以及新鲜制备的0.5 mM AsA和1mm二硫苏糖醇(DTT)。然后将匀浆在14000 x g下在4℃下离心20分钟,上清液通过不含离子的Sephadex g -25柱(PD 10, GE Healthcare),与25 ml 0.1 M磷酸盐缓冲液(pH 7.4)平衡,其中含有1 mM EDTA和10%甘油,然后在−80℃下以等分液储存。根据Bradford方法,分三次定量提取液的蛋白质含量[45].
APX (EC 1.11.1.11)的活性通过监测在A处吸光度的下降来测定290,改编自中野和浅田[46].MDHAR (EC 1.6.5.4)的活性通过测定340 nm处吸光度的下降[47],而DHAR的活性(EC 1.8.5.1)是通过监测AsA的gsh依赖性生产来测定的,并减去非酶的DHA还原率[47].谷胱甘肽还原酶(GR;EC 1.6.4.2)通过跟踪340 nm处由于gsh依赖的NADPH氧化而导致的吸光度下降来测定[48].过氧化氢酶(CAT);EC 1.11.1.6)活性测定采用直接测定H2O2超氧化物歧化酶(SOD;EC 1.15.1.1)在含有50 mM Pipes缓冲液、pH为7.5、0.4 mM邻二酰二胺、0.5 mM二乙烯三胺五乙酸和26 μM核黄素的反应溶液中测定活性,在450 nm吸光度下测定15分钟。邻苯三酚过氧化物(POX)活性的测定方法由Chance和Maehly [49].
asa相关候选基因在番茄中的相对表达
选择植物AsA代谢途径(生物合成和循环利用)中的结构基因作为番茄果实AsA浓度的潜在调控基因。基因的序列拟南芥或果实品种均从GenBank (http://www.ncbi.nlm.nih.gov/genbank/),或PLAZA 2.0 (http://bioinformatics.psb.ugent.be/plaza/),并在番茄参考基因组(http://solgenomics.net).在genous软件version 5.6.3中,使用BLOSUM62矩阵和邻域连接法构建的系统发育树在MUSCLE中对所有同源物的氨基酸序列进行比对[50]以确定每个番茄的直系同源拟南芥加入。
基因表达研究遵循MIQE(发表定量实时PCR实验的最低信息)指南进行[30.].采用改良的CTAB法从果肉组织中分离总RNA [51].用NanoDrop 2000 (Thermo Scientific)测定提取的总RNA的纯度为260/280 nm和260/230 nm的比例,用1%琼脂糖凝胶(gel Doc EZ Imager by Bio-Rad)电泳检查完整性。随机引物将1 μg总RNA用Superscript II (Invitrogen)反转录为cDNA。基因特异性引物对(表2)采用Primer3软件4.0版(http://frodo.wi.mit.edu/primer3/)采用以下条件:产品尺寸在75 ~ 200 bp之间,最优为120 bp;GC%范围为40-55%;自互补和3 '自互补分别设为4和1;所有其他参数设置为默认值。
采用SYBR Green I实时定量PCR (real-time quantitative PCR, qPCR)技术检测了果实成熟过程中asa相关基因的表达谱。在我们的样本集中评估了七个发表的内参基因的表达稳定性(附加文件)5:表S5)使用NormFinder软件(http://www.mdl.dk/publicationsnormfinder.htm).所有反应均以1 μl cDNA template (50 ng)、7.5 μl Absolute (7.5 μl)为双份TMQPCR SYBR Green Mix,每个引物(3.75 mM)取1 μl,终体积为15 μl。循环条件为:95°C变性10 min, 95°C变性20 s, 63°C退火20 s, 72°C拉伸20 s,循环45次。熔化曲线分析,从55°C到95°C,升温0.5°C/s,用于确认扩增的特异性。反应效率的接受标准范围为0.83至1.03,R和R均为2> 0.97。对于每次运行,包括一个基于从所有样品中汇集的cDNA的标准曲线,以在不同稀释范围内进行分析。相对定量表达水平使用比较CT方法(52].每个样品三次生物复制各进行两次技术复制。所有表达数据均以相对于两个最稳定的内参基因几何平均值的表达比计算[31].
描述性统计分析
所有性状均采用SAS 9.2软件包(SAS Institute)进行统计分析。采用Duncan多元检验(5%)评价品种间和不同时期的差异,采用Pearson相关系数比较成熟过程中抗氧化性状、酶活性和基因表达之间的相关性。
缩写
- APX型:
-
抗坏血酸盐peroxidise
- 亚撒:
-
L-ascorbic酸
- B:
-
断路器
- CAC:
-
网格蛋白接合复合物中亚基
- 猫:
-
过氧化氢酶
- 衣冠楚楚的:
-
授粉后几天
- DHA:
-
dehydroascorbate
- 达哈:
-
dehydroascorbate还原酶
- D-Glc:
-
葡萄糖
- D-GlcUL:
-
D-glucuronolactone
- d男人:
-
D-mannose
- L-Gal:
-
L-galactose
- L-GaL:
-
L-galactono-1, 4-lactone
- L-GuL:
-
L-gulono-1, 4-lactone
- 搞笑:
-
不成熟的绿色
- GalDH:
-
L-galactose脱氢酶
- GGP:
-
GDP-L-galactose磷酸化酶
- GLDH:
-
L-galactonolactone脱氢酶
- GME:
-
5-epimerase GDP-mannose 3日
- GMP:
-
GDP-mannose焦磷酸化酶
- GPP:
-
L-galactose-1-phosphate phosphatise
- GR:
-
谷胱甘肽还原酶
- 谷胱甘肽:
-
谷胱甘肽
- GSSG:
-
氧化谷胱甘肽
- MDHA:
-
monodehydroascorbate
- MDHAR:
-
monodehydroascorbate还原酶
- 毫克:
-
成熟的绿色
- 心肌梗死myo:
-
肌醇
- 痘:
-
peroxidise
- PP2Acs:
-
蛋白磷酸酶2A催化亚基
- 草皮:
-
超氧化物歧化酶
- totAsA:
-
总亚撒
- totGSH:
-
总谷胱甘肽。
参考文献
- 1.
Davey MW, Van Montagu M, Inze D, Sanmartin M, Kanellis A, Smirnoff N, Benzie IJJ,菌株JJ, Favell D, Fletcher J:植物l -抗坏血酸:化学、功能、代谢、生物利用度和加工效果。中国农业科学,2000,30(4):457 - 457。10.1002 / (SICI) 1097 - 0010 (20000515) 80:7 < 825:: AID-JSFA598 > 3.0.CO; 2 - 6。
- 2.
Smirnoff N, Conklin PL, Loewus FA:植物中抗坏血酸的生物合成:复兴。植物化学学报,2001,27(3):337 - 344。10.1146 / annurev.arplant.52.1.437。
- 3.
弗兰克C,巴滕斯M,拉默廷J,韦伯文P:戴维MW。Nicolai BM: cv中抗坏血酸浓度。在果实发育和收获后储存期间的会议梨。食品化学学报,2003,51:457 - 463。
- 4.
王晓明,王晓明,王晓明,等。苹果维生素C和抗氧化成分与采后病原菌侵染的关系。中国农业科学,2007,27(3):357 - 357。10.1002 / jsfa.2777。
- 5.
Bulley S, Wright M, Rommens C, Yan H, Rassam M, Lin-Wang K, Andre C, Brewster D, Karunairetnam S, Allan AC,等:通过过表达l-半乳糖通路基因gdp -l-半乳糖磷酸化酶增强果实和块茎抗坏血酸。中国生物工程学报,2012,30(3):349 - 349。10.1111 / j.1467-7652.2011.00668.x。
- 6.
Diplock AT, Charleux JL, Crozier-Willi G, Kok FJ, Rice-Evans C, Roberfroid M, Stahl W, Vina-Ribes J:功能性食品科学与活性氧化物种的防御。王志强,王志强,1998,30(4):457 - 457。10.1079 / BJN19980106。
- 7.
Wheeler GLJM, Smirnoff N:高等植物维生素C的生物合成途径。自然科学,1998,39(3):369 -369。10.1038/30728。
- 8.
Conklin PL, Gatzek S, Wheeler GL, Dowdle J, Raymond MJ, Rolinski S, Isupov M, Littlechild JA, Smirnoff N:拟南芥VTC4编码l -半乳糖-1- p磷酸酶,一种植物抗坏血酸生物合成酶。中国生物医学工程学报,2006,29(2):344 - 344。10.1074 / jbc.M601409200。
- 9.
Bulley SM, Rassam M, Hoser D, Otto W, Schuenemann N, Wright M, MacRae, Gleave A, Laing W:猕猴桃基因表达和拟南芥基因过表达研究表明,gdp - l -半乳糖鸟苷转移酶是维生素C生物合成的主要控制点。应用物理学报,2009,30(3):344 - 344。10.1093 / jxb / ern327。
- 10.
Mellidou I, Chagné D, Laing W, Keulemans J, Davey MW: gpd - l -半乳糖磷酸化酶的等位基因变异是影响苹果果实维生素C含量的主要因素。中国农业科学,2012,29(4):529 - 529。10.1104 / pp.112.203786。
- 11.
Ioannidi E, Kalamaki MS, Engineer C, Pateraki I, Alexandrou D, Mellidou I, Giovannonni J, Kanellis AK:番茄果实发育成熟过程中抗坏血酸相关基因的表达分析。应用物理学报,2009,30(3):344 - 344。10.1093 / jxb / ern322。
- 12.
Gilbert L, Alhagdow M, Nunes-Nesi A, Quemener B, Guillon F, Bouchet B, Faurobert M, Gouble B, Page D, Garcia V等:GME在番茄抗坏血酸和非纤维素细胞壁生物合成的交叉点起关键作用。植物学报,2009,30(4):344 - 344。10.1111 / j.1365 - 313 x.2009.03972.x。
- 13.
王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明。拟南芥细胞悬浮培养中抗坏血酸合成的研究。植物科学学报,2004,29(3):357 - 357。10.1104 / pp.121.2.535。
- 14.
Agius F, Gonzalez-Lamothe R, Caballero JL, Munoz-Blanco J, Botella MA, Valpuesta V:通过过表达d -半乳糖醛酸还原酶提高植物维生素C水平。中国生物工程学报,2003,29(4):457 - 457。10.1038 / nbt777。
- 15.
Wolucka BA, Van Montagu M: gdp -甘露糖3 ',5 ' -外素酶形成gdp - l - gullose,一种假定的植物中维生素C的生物合成中间体。中国生物医学工程学报,2003,27(3):357 - 357。10.1074 / jbc.M309135200。
- 16.
Lorence A, Chevone BI, Mendes P, Nessler CL:肌醇加氧酶为植物抗坏血酸生物合成提供了一个可能的切入点。中国农业科学,2004,27(4):344 - 344。10.1104 / pp.103.033936。
- 17.
Cruz-Rus E, Amaya I, Sanchez-Sevilla JF, Botella MA, Valpuesta V:草莓果实中l -抗坏血酸含量的调控。应用物理学报,2011,32(3):344 - 344。10.1093 / jxb / err122。
- 18.
Badejo AA, Wada K, Gao Y, Maruta T, Sawa Y, Shigeoka S, Ishikawa T:易位和替代d -半乳糖途径与d -甘露糖/ l -半乳糖途径共同促进番茄果实成熟中抗坏血酸水平的提高。应用物理学报,2011,29(3):344 - 344。
- 19.
Foyer CH, Noctor G:抗坏血酸和谷胱甘肽:氧化还原中心的心脏。中国生物医学工程学报,2011,27(3):344 - 344。10.1104 / pp.110.167569。
- 20.
陈志涛,凌娟,常胜生,Gallie DR:通过增强抗坏血酸循环提高植物维生素C含量。自然科学进展,2003,30(3):357 - 357。10.1073 / pnas.0635176100。
- 21.
Eltayeb AEKN, Badawi GH, Kaminaka H, Sanekata T, Shibahara T, Inanaga S, Tanaka K:单脱氢抗坏血酸还原酶在转基因烟草中的过表达增强了对臭氧、盐和聚乙二醇胁迫的耐受性。植物学报,2007,25(3):357 - 357。10.1007 / s00425 - 006 - 0417 - 7。
- 22.
Stevens R, Buret M, Duffe P, Garchery C, Baldet P, Rothan C, Causse M:影响3个番茄居群果实抗坏血酸含量的候选基因和数量性状位点。植物科学学报,2007,29(3):344 - 344。10.1104 / pp.106.091413。
- 23.
Stevens R, Page D, Gouble B, Garchery C, Zamir D,原因M:番茄果实抗坏血酸含量与单脱氢抗坏血酸还原酶活性和耐寒性有关。植物生态学报,2008,31:1086-1096。10.1111 / j.1365-3040.2008.01824.x。
- 24.
Haroldsen VM, Chi-Ham CL, Kulkarni S, Lorence A, Bennett AB:番茄DHAR和MDHAR成分表达影响果实抗坏血酸水平,而不影响叶片抗坏血酸水平。植物化学学报,2011,29(4):344 - 344。10.1016 / j.plaphy.2011.08.003。
- 25.
Mellidou I, Siomos A, Gerasopoulos D:第二届樱桃番茄国际会议2005年6月9-11日2005年。“圣托里尼”、“Chiou”、“Limnou”和“艾尔萨克雷格”番茄的果实组成和代谢。2005年,希腊:圣托里尼岛。
- 26.
Massot C, Stevens R, Genard M, Longuenesse j j, Gautier H:光照对番茄叶片抗坏血酸含量和抗坏血酸相关基因表达的影响大于果实。植物学报,2011,29(3):344 - 344。
- 27.
Hancock RD, Walker PG, Pont SDA, Marquis N, Vivera S, Gordon SL, Brennan RM, Viola R:黑黑Ribes nigrum果实中l -抗坏血酸的积累是通过l -半乳糖途径进行原位生物合成的。植物学报,2007,34:1080-1091。10.1071 / FP07221。
- 28.
王志强,王志强,王志强,等:海棠抗氧化代谢的分布、发育及胁迫响应。植物细胞环境学报,2004,27:1309-1320。10.1111 / j.1365-3040.2004.01238.x。
- 29.
panca J, Smirnoff N:豌豆幼苗抗坏血酸合成和周转的控制。应用物理学报,2000,51:669-674。10.1093 / jexbot / 51.345.669。
- 30.
Bustin SA:为什么需要qPCR发表指南?- MIQE的理由。方法学报,2009,50:217-226。
- 31.
Vandesompele J, De Preter K, Pattyn F, Poppe B, Van Roy N, De Paepe A, Speleman F:多内控基因几何平均实时定量RT-PCR数据的精确归一化。中国生物工程学报,2002,3:H0034。
- 32.
杜马勇,刘志刚,刘志刚,刘志刚。环境因子和农业技术对番茄抗氧化含量的影响。中国农业科学,2003,30(3):369-382。10.1002 / jsfa.1370。
- 33.
Jimenez A, Creissen G, Kular B, Firmin J, Robinson S, Verhoeyen M, Mullineaux P:番茄果实成熟过程中氧化过程和抗氧化系统成分的变化。植物学报,2002,29(3):344 - 344。10.1007 / s004250100667。
- 34.
Gautier H, Massot C, Stevens R, Serino S, Genard M:番茄果实抗坏血酸含量的调控对果实辐照度的依赖性大于对叶片辐照度的依赖性。学报学报,2009,39(3):344 - 344。
- 35.
Alhagdow M, Mounet F, Gilbert L, nunez - nesi A, Garcia V, Just D, Petit J, Beauvoit B, Fernie AR, Rothan C,等:线粒体抗坏血酸合成酶L-半乳糖-1,4-内酯脱氢酶沉默对番茄植株和果实发育的影响。中国农业科学,2007,29(4):457 - 457。10.1104 / pp.107.106500。
- 36.
Horemans N, sarka A, De Bock M, Raeymaekers T, Potters G, Levine M, Banhegyi G, Guisez Y:脱氢抗坏血酸和葡萄糖通过两种不同的机制进入拟南芥细胞培养。中国生物医学工程学报,2008,29(4):344 - 344。10.1016 / j.febslet.2008.07.001。
- 37.
何瑞敏,李志刚,李志刚。高等植物细胞膜抗坏血酸载体优先易位完全氧化的(脱氢抗坏血酸)分子。中国植物学报,2004,27(4):344 - 344。
- 38.
Hancock RD, McRae D, Haupt S, Viola R:韧皮部中l -抗坏血酸的合成。中国生物医学工程学报,2003,3:7-10.1186/1471-2229- 7。
- 39.
王晓明,李志强,王晓明,等。苹果果实l -抗坏血酸生物合成能力的研究。中国农业生物工程学报,2005,30(2):357 - 357。
- 40.
李明杰,马凤文,张敏,蒲芳:苹果果实中抗坏血酸的分布与代谢。联欢晚会)。植物科学学报,2008,44(3):344 - 344。10.1016 / j.plantsci.2008.03.008。
- 41.
Mieda T, Yabuta Y, Rapolu M, Motoki T, Takeda T, Yoshimura K, Ishikawa T, Shigeoka S: l -抗坏血酸对菠菜l -半乳糖脱氢酶的反馈抑制中国生物医学工程学报,2004,29(4):344 - 344。10.1093 /卡式肺囊虫肺炎/ pch152。
- 42.
李志刚,李志刚,李志刚,李志刚,李志刚。黄花狼疮幼苗抗坏血酸含量变化与生长发育的关系。植物营养学报,1997,15(3):344 - 344。10.1016 / s0176 - 1617(97) 80125 - 3。
- 43.
Linster CL, Clarke SG:高等植物中l -抗坏血酸的生物合成:VTC2的作用。植物科学进展,2008,13:567-573。10.1016 / j.tplants.2008.08.005。
- 44.
Davey MW, Dekempeneer E, Keulemans J:火箭动力高效液相色谱分析植物抗坏血酸和谷胱甘肽。中国生物医学工程学报,2003,27(3):344 - 344。10.1016 / s0003 - 2697(03) 00047 - 2。
- 45.
Bradford MM:利用蛋白质-染料结合原理,快速、灵敏地定量微量蛋白质的方法。中国生物化学杂志,2003,27(3):344 - 344。10.1016 / 0003 - 2697(76) 90527 - 3。
- 46.
中野Y,浅田K:菠菜叶绿体中抗坏血酸过氧化物酶的纯化——其在抗坏血酸耗尽培养基中的失活和单脱氢抗坏血酸自由基的再活化。植物生理学报,1997,29(4):344 - 344。
- 47.
Arrigoni O, Dipierro S, Borraccino G:抗坏血酸自由基还原酶,抗坏血酸系统的关键酶。中国科学(d辑),2001,30(4):344 - 344。10.1016 / 0014 - 5793(81) 80729 - 6。
- 48.
Edwards EA, Rawsthorne S, Mullineaux PM:多种形式谷胱甘肽还原酶在豌豆叶片中的亚细胞分布。植物学报,1998,18(3):379 - 379。
- 49.
机会B, Maehly AC:过氧化氢酶和过氧化物酶的检测。方法酶学杂志,1995,2:764-775。
- 50.
Drummond AJ, Ashton B, Buxton S,张M, Cooper A, Duran C, Field M, Heled J, Kearse M, Markowitz S, Moir R, Stones-Havas S, Sturrock S, Thierer T, Wilson A: genous v5.4。2011年,可从http://www.geneious.com/.
- 51.
Gasic K, Hernandez A, Korban SS:从富含多酚和多糖的苹果组织中提取RNA构建cDNA文库。植物分子生物学学报,2004,22:437-438。10.1007 / BF02772687。
- 52.
Pfaffl MW: qPCR的持续进化。方法与工程,2010,30(3):344 - 344。10.1016 / j.ymeth.2010.02.005。
确认
本工作得到了EU-FOOD-CT-2006-016214和COST-STSM-924-02757的部分支持。IM得到了鲁汶大学的FLOF奖学金的支持,以及希腊国家奖学金基金会(IKY)的奖励。这件作品是为了纪念Vasileios Mellidis。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
IM设计了实验,种植了番茄植株并采样了果实,定量了代谢产物,进行了底物饲喂实验,测定了酶活性,进行了基因表达研究并撰写了手稿。JK监督了实验并编辑了手稿。AKK帮助设计了实验,并编辑了手稿。MWD设计了实验,帮助解释了结果,并在很大程度上对手稿的修改做出了贡献。所有作者都阅读并批准了最终的手稿。
电子辅助材料
12870 _2012_1194_moesm1_esm.pdf
附加文件1:表S1。“圣托里尼”和“艾尔萨克雷格”不同成熟期整颗番茄果实的鲜重(g)、含水量百分比和总可溶性固形物(°Brix)。成熟期:IG,未成熟绿;MG,成熟绿;B-1,断路器−1天;B,断路器;B + 1,断路器+ 1天;PK,粉色;R,红色。结果以10个番茄果实的平均值±SD表示。 (PDF 41 KB)
12870 _2012_1194_moesm2_esm.pdf
附加文件2:表S2。果实发育成熟过程中l -抗坏血酸和谷胱甘肽的测定。总抗坏血酸(totAsA)、l -抗坏血酸(AsA)、总谷胱甘肽(totGSH)和谷胱甘肽(GSH)浓度(nmol/gFW)在‘Santorini’和‘Ailsa Craig’果实发育和成熟过程中的变化。成熟期:IG,未成熟绿;MG,成熟绿;B-1,断路器−1天;B,断路器;B + 1,断路器+ 1天;PK,粉色;R,红色。 Results are represented as the mean of three biological replications. Statistical analysis was carried out for each cultivar independently. Means of each cultivar with the same letter are not significantly different (a = 0.05) based on Duncan’s multiple-range-test in SAS. (PDF 84 KB)
表S3。
附加文件3:AsA前驱体基底的非放射性标记喂养实验。与d -葡萄糖(D-Glc), d -甘露糖(D-Man), l -半乳糖(L-Gal)和l -半乳糖-内酯(L-Gal)孵育的效果,从l -半乳糖途径,l -古洛诺-内酯(L-GuL), d -葡萄糖醛酸-内酯(D-GlcUL),和myo在' Santorini '和' Ailsa Craig '的未成熟绿色(IG)、成熟绿色(MG)和红色果盘的总AsA (totAsA)浓度(mmol/gFW)的24小时内,从替代生物合成途径中提取-肌醇(MI),或AsA本身和DHA。结果表示三次重复±SD的平均值,星号表示24小时内与对照组显著不同的值(t-test, P < 0.05)。(pdf 90kb)
12870 _2012_1194_moesm4_esm.pdf
附加文件4:表S4。“圣托里尼”和“艾尔萨克雷格”果实成熟过程中抗坏血酸与酶活性的相关性圣托里尼和艾尔萨克雷格果实中抗坏血酸(AsA)、总抗坏血酸(totAsA)、%脱氢抗坏血酸(% DHA)与抗坏血酸过氧化物(APX)、单脱氢抗坏血酸还原酶(MDHAR)、脱氢抗坏血酸还原酶(DHAR)、谷胱甘肽还原酶(GR)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和过氧化物酶(POX)活性之间的Pearson相关系数。* * * P < 0.05, P < 0.01, * * * P < 0.001, * * * * P < 0.0001, n不显著。(pdf 72 kb)
12870 _2012_1194_moesm5_esm.pdf
附加文件5:表S5。“艾尔萨克雷格”果实成熟期稳定性的内参基因引物序列列表利用NormFinder软件对“Ailsa Craig”果实在整个成熟过程中内参基因的稳定性进行了评估。(pdf 38kb)
表S6。
附加文件6:“艾尔萨·克雷格”果实破果期抗坏血酸与基因表达的相关性asa相关基因从生物合成和循环途径表达的Pearson相关系数(列于表2)分别在破裂前一天、破裂后一天和破裂期后一天测量,并在破裂期后一天和破裂期后两天测量抗坏血酸(AsA)和总抗坏血酸(totAsA),即假设基因表达和水果AsA浓度变化之间延迟一天。* * * P < 0.05, P < 0.01, * * * P < 0.001, * * * * P < 0.0001, n不显著。(pdf 39kb)
12870 _2012_1194_moesm7_esm.pdf
附加文件7:表S7。用于水培番茄的营养液的组成。(pdf 18kb)
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
梅利多,我,库勒曼斯,J.,卡奈里斯,A.K.et al。高和低维生素C番茄品种成熟过程中果实抗坏血酸浓度的调节。BMC植物生物学12,239(2012)。https://doi.org/10.1186/1471-2229-12-239
收到了:
接受:
发表:
关键字
- 抗坏血酸盐生物合成
- 抗坏血酸盐回收
- 抗坏血酸盐营业额
- 候选基因
- GDP-L-galactose磷酸化酶
- 基因表达
- Monodehydroascorbate还原酶