摘要
背景
在植物中,多步磷传递信号通路介导对环境因素和植物激素的反应。该系统由三个连续的伙伴组成:混合组氨酸-天门冬氨酸激酶(HKs),含组氨酸的磷酸化转移蛋白(HPts)和反应调节因子(RRs)。在第三个伙伴中,b型RR家族成员是路径的最终输出元素;它们作为转录因子,在细胞分裂素的早期反应中起着关键作用拟南芥.多步磷传递系统的伙伴之间的相互作用研究主要集中在参与细胞分裂素或乙烯通路的主角,而关于渗透胁迫信号通路伙伴的报道很少。
结果
在杨树,我们在Dorskamp基因型中鉴定了8个b型RR蛋白,rr12 - 16,19,21和22。为了评估HPt/ b型RR相互作用,从而确定渗透感应多步磷接力系统中潜在的第三伙伴,我们在植物细胞中结合双分子荧光互补(BiFC)分析进行了全球酵母双杂交(Y2H)试验。我们发现所有b型RRs都能与HK1的HPt优势伙伴(HPt2、7和9)相互作用,而HK1可能参与渗透感应途径。然而,根据所研究的HPt,观察到不同的相互作用剖面。HPt/RR相互作用显示出核定位,而HPt的核定位和细胞质定位以及RR蛋白的核定位得到验证。虽然HPt/RR相互作用的核定位是预期的,但这项工作构成了在植物中这种相互作用的第一个证据。此外,通过强调b型RR转录本和属于潜在渗透传感途径的其他伙伴(HK1和HPts)的共同表达,这种伙伴关系的相关性得到了加强。
结论
基于已鉴定的b型RR蛋白与HPt蛋白相互作用的研究,以及这些潜在伴侣在杨树器官中的转录本共表达分析,我们的结果支持RR12、13、14、16和19能够与HK1、HPt2、7和9的主要伴侣相互作用,这种HPt/RR相互作用发生在细胞核内。总的来说,这5个b型转录因子可能是研究中渗透信号通路的第三个主角杨树.
背景
植物表现出复杂的传感和信号系统,对干旱或渗透胁迫等环境信号和包括细胞分裂素在内的植物激素作出各种反应。由此产生的细胞内信号转导明显依赖于磷酸化事件,这是由多步磷酸化中继信号介导的。该系统包括三个组成部分:混合组氨酸-天门冬氨酸激酶(HK)受体,含有组氨酸的磷酸化转移蛋白(HPt)和反应调节因子(RR)。其中最具特征的相应系统是酵母中的渗透反应通路。该系统由HK受体Sln1p、HPt、Ypd1p和RR、Ssk1p [1,2].磷酸接力包括在不同的伙伴之间将磷酸从his残基转移到asp残基。在高渗透压条件下,Sln1p无活性且未磷酸化,导致未磷酸化的细胞质RR Ssk1p积累。这种活性形式的Ssk1p能够激活HOG1 MAP激酶途径,诱导基因表达,导致通过甘油合成来保护细胞。在拟南芥,与酵母中发现的相似的多步磷接力成员参与了信号通路:拟南芥组氨酸激酶,拟南芥组氨酸磷转移蛋白(AHPs)和拟南芥反应调节器(ARR) [3.].AHK家族由六种杂交组氨酸蛋白激酶组成,AHK1, AHK2, AHK3, AHK4 (CRE1/WOL), AHK5和CKI1。后者CKI1和AHK5参与了大配子生的发育[4- - - - - -6]和气孔关闭[7分别)。该家族还包括细胞分裂素受体AHK2, AHK3, AHK4 [8- - - - - -11]和AHK1,它是渗透传感途径的第一个伙伴,在酵母和酵母两种模型中显示渗透传感器功能拟南芥[12,13].后者也在种子成熟过程中的脱水过程中起调节作用[14].与AHK1相反,细胞分裂素受体AHK2, 3和4是渗透胁迫的负调节因子[13].对于第二个伙伴,5个ahp介导AHKs和arr之间的磷传递。Uraoet al。发现渗透传感器受体AHK1只能与一种HPt蛋白AHP2相互作用[15].通过酵母双杂交试验进行的多步磷酸中继信号通路成员相互作用网络研究显示AHP2与一些arr相互作用[16,17].在氨基酸序列结构比较的基础上,将ARR家族成员细分为a型、b型、c型和伪rrs四组[3.,18].在这些群体中,b型RR家族成员被认为是His-to-Asp磷酸化转导网络中的关键转录调节因子。这些RR由一个具有保守的D-D-K基序的磷酸受体结构域(RR结构域)和一个大的c端延伸介导序列特异性dna结合结构域(最初称为B基序)组成[3.,19].根据Riechmann的分类[20.], B基序似乎是植物单一myb相关结构域的代表,属于GARP亚家族。GARP结构域或B基序是仅在植物中发现的转录因子,其名称来源于在玉米GOLDEN2基因序列中发现的B型ARR蛋白拟南芥,和Psr1 from衣藻[20.].c端延伸段包含一个富含脯氨酸和谷氨酰胺残基的转录激活区,因为它通常在转录激活子中出现[21]以及核定位信号(nss),负责向核定向的b型RRs [22- - - - - -27].在b型RR家族的11个成员中拟南芥(ARR1, 2, 10, 11, 12, 13, 14, 18, 19, 20, 21), AHP2的一些相互作用伙伴[16,17,28]已被证明与细胞分裂素信号转导有关[29- - - - - -32].该信号从细胞膜传递到细胞核,在细胞核中,这些RRs作为转录因子,在主要细胞分裂素反应途径的最后一步中起作用。虽然b型RR基因表达不受细胞分裂素诱导,b型RRs作为细胞分裂素信号通路的阳性调节因子[31- - - - - -34]通过增强细胞分裂素靶基因的转录,包括a型ARRs [25,29],它们反过来充当负调节器,允许对通路进行反馈控制[25,35].虽然b型RRs参与细胞分裂素信号通路的研究较为详细,但其在其他植物渗透信号通路中的作用尚不清楚拟南芥尤其是木本植物。在杨树trichocarpa, a型11个,b型11个,c型10个,伪rr 17个[18,36].转录组学分析显示,在杂交杨树717-1B4基因型中,部分细胞分裂素信号通路组分(HK、HPt和RR)对应的基因在芽器官发生过程中受到调控。37].而且,在相同的基因型,拉米雷斯-卡瓦哈尔等.[38],表明RR13通过抑制不定根的形成作用于细胞分裂素通路下游。在杨树Dorskamp基因型中,我们发现了一个假定的渗透传感器HK1 [39],以及10个HPts (HPt1 ~ HPt10)。最近的一项研究使我们提出HPt2, 7和9作为HK1的具体合作伙伴杨树渗透信号通路[40].
为了更详细地描述杨树渗透传感途径所涉及的分子机制,我们分析了HK1的三个HPt伙伴(HPt2、7和9)与不同b型RRs的潜在相互作用。因此,我们从杨树基因型中分离出8个b型RRs,并通过酵母双杂交(Y2H)和双分子荧光互补(BiFC)试验进行了相互作用试验。这些试验表明,3个HPts与8个b型rr相互作用,并根据报告基因激活水平的不同表现出不同的相互作用谱。交互研究在足底对一些b型rr的BiFC分析证实了HPt/B-RR相互作用的核定位。一些b型RR和HPt转录本在同一杨树器官中的共表达,使我们强调了其中5个作为这3种HPt蛋白的潜在搭档。
结果
8种杨树b型反应调节剂的分离
以…为基础杨树从一个根cDNA文库中分离到8个编码b型RRs的cDNA: RR12、13、14、15、16、19、21、22 (EMBL: FN908138 ~ FN908145)。我们没有成功分离出RR17、18和20。这些新分离的杨树b型RRs的氨基酸序列具有共同的结构设计,由接受磷的受体结构域、GARP dna结合结构域和两个假定的nls组成。这些b型RRs与模式植物的系统发育关系,拟南芥(arr),玉米(ZmRRs),甘氨酸max(GmRRs),而且栽培稻(OsRRs),由基于b型RR全长氨基酸序列比对的根树表示(图1).这些分析表明,不同的b型RR家族成员分散在不同的组中,与种无关,但在大多数情况下,以种特异性对为组。
HPt2, HPt7和HPt9在酵母中与b型反应调节器的子集相互作用
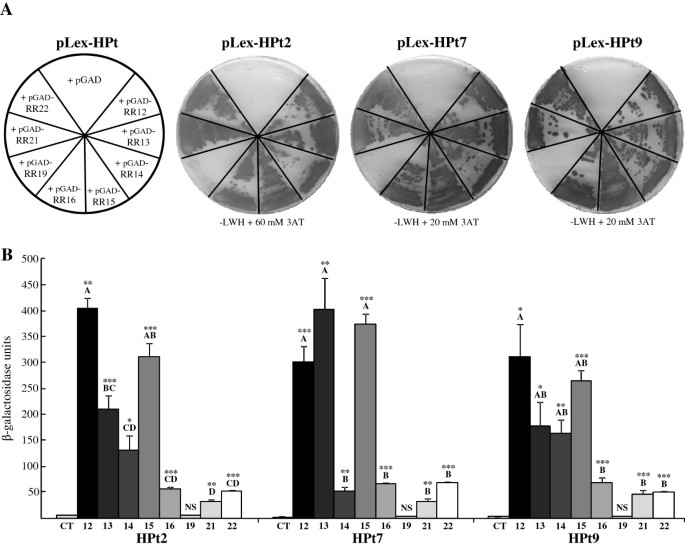
为了研究三个感兴趣的HPts (HPt2, 7,9)与8个分离的b型rr的相互作用,我们进行了Y2H分析。由于b型RR在“诱饵”结构中的表达导致第一报告基因的强烈自动激活(HIS3)(数据未显示),所有b型rr被用作“猎物”,而测试的3个HPts被克隆在“诱饵”载体中。该分析揭示了3个HPts与7个b型rr (RR12、RR13、RR14、RR15、RR16、RR21和RR22)的相互作用。使用该系统未检测到HPts和RR19之间的相互作用(图2A)。这些结果通过对第二报告基因激活对应的ß-半乳糖苷酶活性的估计得到确认(图2B).作为相互作用背景的对照,我们将每个pLex-HPt与空pGAD载体结合使用,没有导致显著的ß-半乳糖苷酶活性。正如预期的那样,在测试三种HPts与RR19的相互作用时,也获得了类似的低水平活性。相比之下,我们观察到其他RRs与三个HPts有显著的相互作用。事实上,对于HPt2和9,揭示了类似的相互作用模式,包括RR12的ß-半乳糖苷酶活性强,RR13、14和15的ß-半乳糖苷酶活性中等,RR16、21和22的ß-半乳糖苷酶活性弱。另一方面,HPt7呈现出两组rr分离的相互作用模式,第一组ß-半乳糖苷酶活性较强(RR12、13和15),第二组ß-半乳糖苷酶活性较弱(RR14、16、21和22)。
在酵母双杂交系统中,HPt2, HPt7和HPt9与b型RRs的一个子集相互作用。一个) HPt/ b型RR相互作用的X-gal分析。HPts (HPt2, 7, 9)与b型RRs (RR12, 13, 14, 15, 16, 19, 21和22)的相互作用,以及相应的X-gal检测,缺乏补充60 (HPt2)或20 (HPt7, 9) mM 3AT的亮氨酸-色氨酸-组氨酸缺乏培养基(−LWH)。Bß- HPt/ b型RR相互作用的半乳糖苷酶活性测定。每个HPt/ b型RR相互作用ß-半乳糖苷酶活性测量的三个独立重复的均值±标准误差。每个HPt的阴性对照(CT)是HPt2、7或9与空载体pGAD的相互作用背景。将HPt/RR相互作用的平均值与各自阴性对照进行t检验,用星号表示差异显著:*P < 0.05, **P < 0.01, ***P < 0.001, NS表示不显著。对HPts与RR12、13、14、15、16、21、22相互作用的均值进行方差分析,然后进行Scheffe检验;不同字母表示差异显著(P≤0.05)。
HPt/RR相互作用发生在核室中
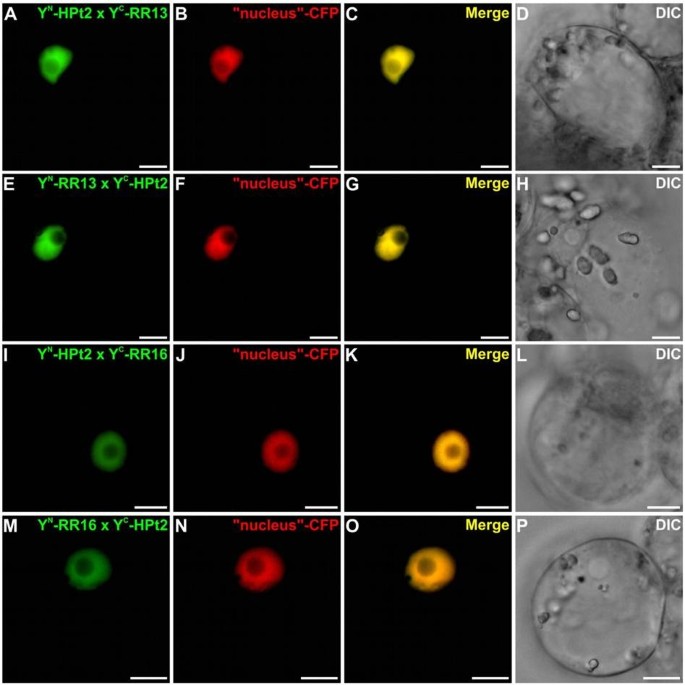
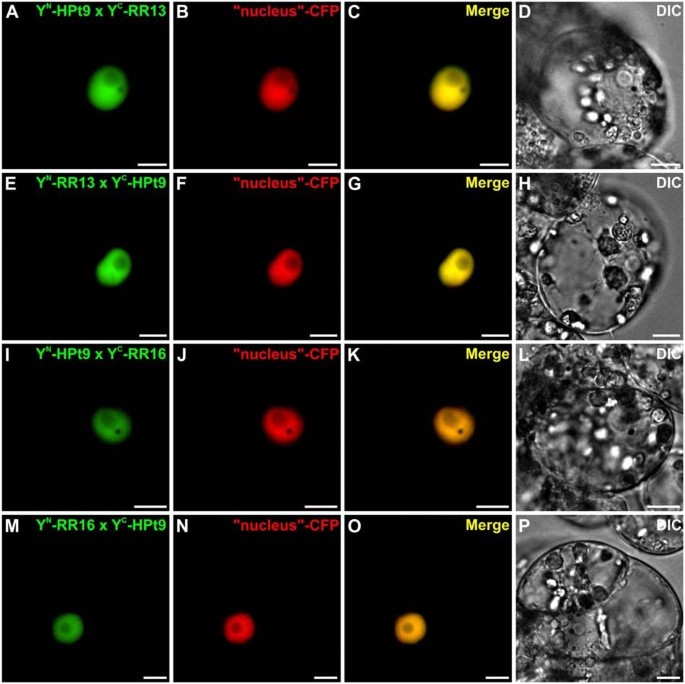
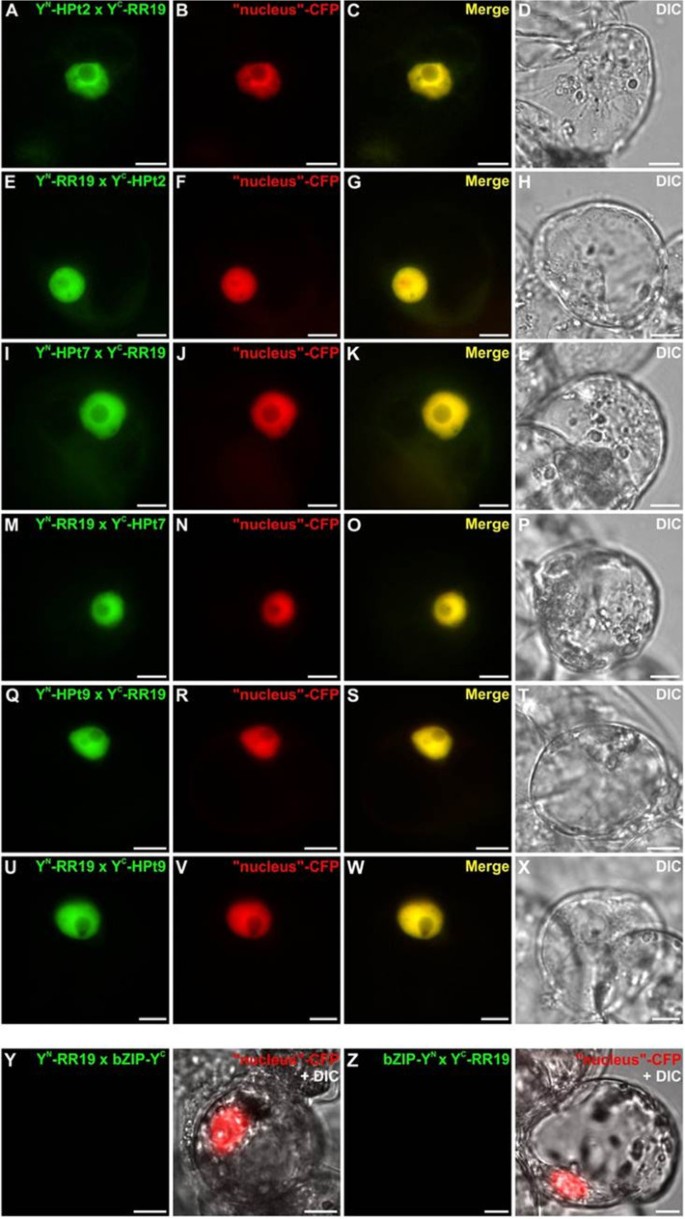
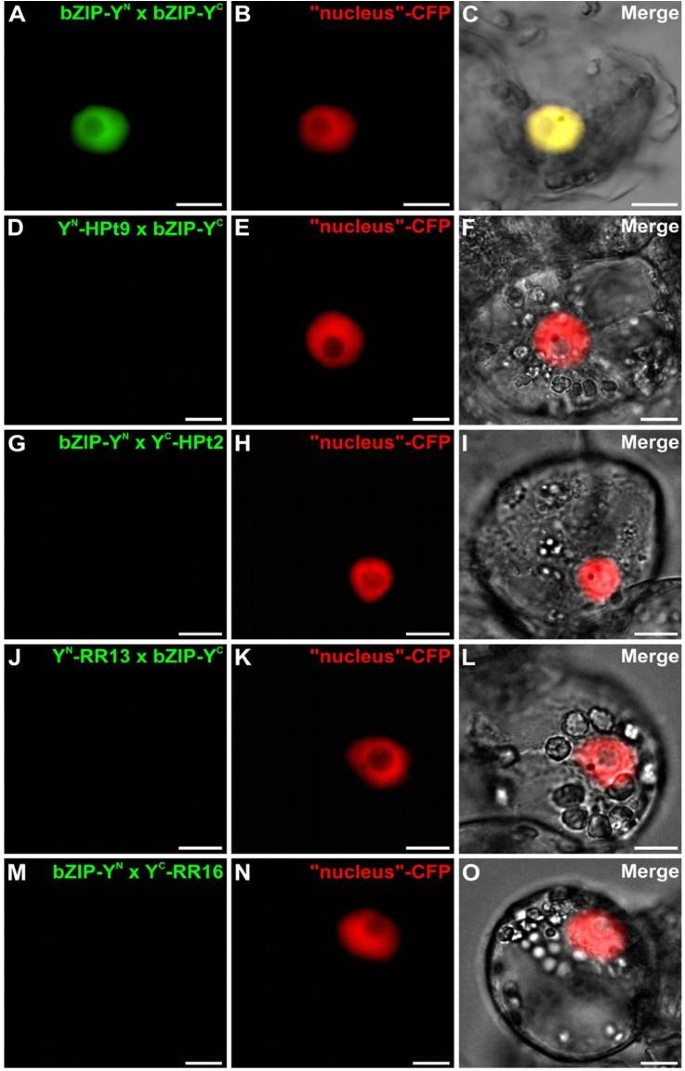
确认和定位在足底在Y2H实验中观察到的HPt/RR相互作用,我们在Y2H实验中使用BiFC检测HPts是否能与b型RRs相互作用Catharanthus roseus也叫细胞。为了这样的分析,测试了Y2H系统中检测到的四种相互作用:HPt2/RR13, HPt2/RR16, HPt9/RR13和HPt9/RR16。此外,为了证实HPt/RR19在酵母中缺乏相互作用,我们进行了BiFC实验来测试RR19与hpt2,7,9之间的相互作用在足底.HPt2、7、9、RR13、16和19编码序列分别融合到n端(YFPN)或c端(YFPC)黄色荧光蛋白(YFP)片段在其n端产生:YFPN-HPts, YFPC-HPts和YFPNrrs, YFPCrrs。在共转化实验中,HPt2与RR13或RR16结构物的不同组合导致植物细胞内形成BiFC复合物(图3.A, E, I, M),该信号与cyan荧光蛋白(CFP)细胞核标记物的荧光完美融合(图3.A-P)表示这种相互作用的核局部化。类似的结构,用于测试相互作用HPt9/RR13和HPt9/RR16使用BiFC测定,显示在这两种情况下YFP重构(图4A, E, I, M)。两种相互作用组合均显示出核荧光信号,这可以通过与共表达CFP核标记物的信号共定位来证明(图4p)。对于RR19,在与HPt2相互作用的情况下,观察到植物细胞内形成BiFC复合物(图5A, E), HPt7(图5I, M)和HPt9(图5Q, U),该信号也与CFP核标记物完美融合(图5A-X)表示这三种相互作用的核定位。作为阳性对照,共表达融合蛋白bZIP-YFP时,可见到BiFC复合体重构N和bZIP-YFPC,证实了该已知转录因子同型二聚体的核定位(图6a - c)。与此相反,共表达融合蛋白YFP时,无法观察到YFP的重组C-HPt2, YFPN-HPt9, YFPN-RR13, YFPC-RR16, YFPN或YFPC-RR19与融合蛋白bZIP-YFP结合C或bZIP-YFPN(图6D-F, G-I, J-L, M-O和图5Ya-b, Za-b),从而验证b型rr (RR13, 16, 19)与HPts (HPt2, 7, 9)相互作用的特异性。在足底。这项相互作用研究证实了在足底Y2H分析检测到RR13或RR16与HPt2或HPt9之间的一些相互作用。与Y2H系统相比,BiFC检测突出了RR19与三种感兴趣的HPts相互作用的能力。这些HPt/RR相互作用的全部发生在核室中。
r19 /HPts (HPt2, 7和9)相互作用分析c . roseus也叫使用BiFC分析细胞。使用表达HPt2/RR19的质粒组合共同转化细胞(一个-H), HPt7/RR19 (我-P)和HPt9/RR19 (问-X)。对于每一种组合,与CFP核标记物进行额外的共转化(B,F,J,N,R,V).合并图像显示两个荧光信号的共定位(C,G,K,O,年代,W).用微分干涉造影术(DIC)观察其形态(D,H,J,P,T,X).比例尺= 10 μm。作为阴性对照,使用两种质粒组合:YFPN-RR19 / bZIP - YFPC和bZIP-YFPN/ YFPC-RR19 (丫-b,咱-b),并辅以与CFP核标记的共转化。用微分干涉造影术(DIC)观察其形态(Yb,Zb).比例尺= 10 μm。
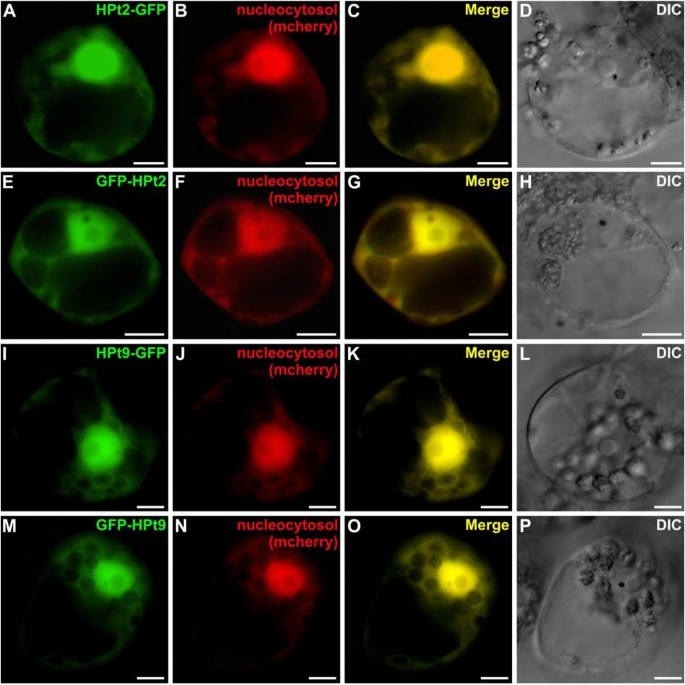
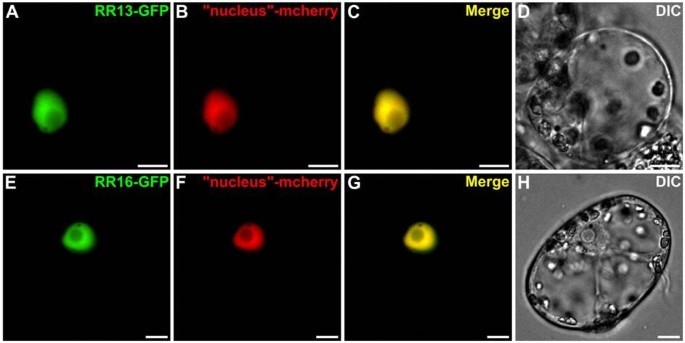
这些相互作用的核定位促使我们研究这些不同伙伴HPt2, HPt9, RR13和RR16的亚细胞定位,使用gfp融合蛋白的瞬时表达c . roseus也叫细胞。本研究表明HPt2(图7A-H)和HPt9(图7I-P) gfp融合蛋白通过与mcherry核-胞质标记物的荧光完美融合显示出核和胞质定位(图7C, G, K, O)。相比之下,RR13(图8A-D)和RR16(图8E-H) GFP融合蛋白仅定位于核内,这可以通过GFP荧光信号与共表达的mcherry核标记物信号的共定位来证明(图8C, G)验证RR13和RR16核定位。
b型RRs转录本的表达谱杨树
HPts和b型RRs之间相互作用的生理存在依赖于这两个伙伴在植物器官中的伴随存在。因此,每个蛋白质转录本的分布已经通过RT-PCR方法进行了评估。为此,在对照或胁迫条件下(以50 g/L的聚乙二醇6000 [PEG 6000]处理10分钟),从杨树扦插的各个器官(根、茎、叶柄、叶)中提取rna,并进行逆转录。使用特定引物通过PCR扩增得到的cdna(附加文件)1)b型RRs而且网格蛋白基因作为对照(图9C)RR13在30次扩增循环后,在所有器官和条件下均被检测到(图9A),需要10个额外的周期来检测在所有器官和条件下的转录本RR12,14,16而且19(图9B)RR15,21而且22在这些条件下未检测到(数据未显示)。分析表明,在所有杨树中b型RRs,以及RR12,13,14,16而且19比其他的表达更明显RR13.此外,在我们的研究条件下,应用渗透约束并不能检测到转录本表达的显著变化b型RRs研究。
讨论
b型响应调节器是His-to-Asp磷酸接力系统的最终输出元件。尽管系统地识别和描述了属于这些系统的不同伙伴拟南芥,Zea mays, Glycine max,而且栽培稻在美国,这些草本植物系统中只有少数成员被确定为与干旱相关的行为体。在拟南芥,研究表明,组氨酸-天门冬氨酸激酶(AHK1)是渗透胁迫信号的正向调节因子AHK1盐胁迫和脱水调节基因表达[13,14].此外,在三个真实的ahp (AHP1, 2和3)中,只有AHP2被证明是该渗透传感器的相互作用伙伴[15].而AHP2的b型RR相互作用伙伴[16,17,28显然在细胞分裂素的反应中起着关键作用[29- - - - - -32]或乙烯[44].到目前为止,关于渗透胁迫信号伙伴之间属于多步磷传递系统的相互作用网络的信息很少。
本研究的目的是确定,在杨树通过揭示渗透传感器HK1的3个主要相互作用伙伴与b型RRs之间的相互作用,揭示了渗透胁迫信号的潜在第三伙伴。基于同源性方法,我们从多斯坎普杨树基因型中分离出8个cdna,编码具有b型RR家族成员共同特征的RRs。对杨树b型RR和其他模式植物的几种RR的系统发育分析表明,在大多数情况下,b型RR家族成员可以独立于种进行分类,但在种内存在配对。在拟南芥,根据序列比较和表达模式,将b型RRs分为三个亚群:BI亚群是细胞分裂素反应中含有ARR的最大亚群[25,29], BII和BIII分别由ARR13/ARR21和ARR19/ARR20表示[27,33,45].我们的根树产生了相同的全局方案:的子组BI的b型rr拟南芥特别是与其他树种的大量b型rr聚集在一起,特别是与孤立的杨树b型rr聚集在一起。
我们没有成功分离出II子组的RR17和20,也没有分离出i子组的RR18p . trichocarpa基因型,RR17而且RR20不以根[表示36],这与我们孤立他们的困难是一致的。另一方面,在Dorskamp基因型中,我们分离到了RR14,而没有分离到RR18,分别在Dorskamp基因型中未检测到和检测到p . trichocarpa基因型。中观察到的b型rr的微分表达式p . trichocarpa而且p .摘要(Bartr)。马什xp .黑质L. Dorskamp基因型可以通过遗传变异来解释。
为了确定可能参与渗透途径的伙伴,我们在酵母中进行了HPts (HPt2, 7和9),HK1的主要伙伴和8个分离的b型rr之间的整体相互作用分析。使用的两种定性方法都使我们获得了这些HPts的b型RR伙伴的概述。除RR19外,所有b型rr均与3个HPts存在强相互作用,相互作用谱不同。根据第二报告基因(β-半乳糖苷酶)激活水平的不同,HPt2和HPt9出现了三组RR,而HPt7则分为两组RR。
为了证实Y2H分析观察到的伙伴关系,还分析了一些HPt/RR相互作用在足底使用BiFC分析.在酵母中观察到的相互作用中,选择了两个HPts和两个b型RRs: i) HPt2和HPt9,它们与HK1相互作用最强,根据它们在酵母中的表达谱,它们似乎是渗透感应途径的关键角色杨树[40], ii) RR13和RR16,分别与三种HPts表现出强或弱的β-半乳糖苷酶活性。这些BiFC检测表明,HPt2和HPt9与RR13或RR16相互作用c . roseus也叫细胞。在拟南芥,一项关于细胞分裂素反应因子(Cytokinin Response Factors, CRFs)与细胞分裂素信号通路其他成员相互作用的研究表明,与Y2H方法相比,BiFC技术可以更完整地检测相互作用[46].基于本研究,由于在Y2H体系中观察不到HPt2, 7,9 /RR19的相互作用,我们决定通过测试RR19的相互作用能力来完成相互作用研究在足底一对。在CRFs研究中,BiFC分析显示RR19与HPt2、7和9存在相互作用。Cutcliff等.[46],推测在Y2H系统中缺乏某种相互作用可以解释为蛋白质上缺乏植物特异性的翻译后修饰或植物特异性蛋白促进该蛋白的相互作用。整个HPt/RR相互作用在足底发生在细胞核中。为了验证这项研究,我们证实HPt2和9具有核和细胞质定位,而RR13和16位于细胞核中。虽然第二和第三个合作伙伴的本地化已经在拟南芥[22- - - - - -27],并且HPt/ b型RR相互作用的核定位是预期的,这些相互作用的定位到目前为止只是假定的。我们的研究首次在植物细胞中明确了这种定位。
为了加强第二和第三伙伴之间相互作用的假设在足底,分析了在同一植物器官中同时存在的两个伙伴(HPts和b型RRs)的转录本。前面的分析表达HK1而且成在对照和渗透胁迫条件下,杨树扦插4个不同器官的基因只显示HK1,HPt2,7而且9在所有被测试的器官和条件中共表达[40].在本研究中,我们还分析了b型RR基因在相同杨树扦插器官和条件下的表达情况RR12,13,14,16而且19表达在相同的器官和条件下比HK1这三个成.与HPts相比,b型RR均无器官特异性表达。然而,缺少的RR15,21而且22尽管它们能够与酵母中的HPts发生物理上的相互作用,但我们可以得出结论,这些b型RRs在这些器官的渗透信号通路中不太重要。
杨树b型基因RR12、13、14、16和19与HK1的主要伙伴HPt2、7和9相互作用,并在杨树主要器官中同时表达,可能参与了杨树渗透感应途径。然而,一些拟南芥与这5个杨树RRs同源的b型RRs是细胞分裂素或乙烯信号通路的转录因子,如ARR2参与叶片衰老[47],乙烯响应[44]和对病原体的抵抗力[48].因此,这些转录因子就像一组主角一样,将几种信号通路连接起来,以协调不同的发育过程和应激反应[19].这一假设与已知的细胞分裂素、ABA和非生物胁迫之间的相互作用是一致的[13,49,50].
结论
在目前的工作中,在杨树(Dorskamp基因型)。在酵母中,几乎所有被测试的b型RRs (RR19除外)都与假定的杨树渗透传感器HK1的三个优先伙伴HPt2、7、9相互作用。一些HPt/RR相互作用被证实在足底仅检测到RR19与HPts相互作用的能力在足底.所有HPt/RR相互作用均表现为核定位,HPts为核蛋白和细胞质蛋白,b型RRs为核蛋白。下游信号伙伴在杨树器官中的共表达突出了RR12、13、14、16和19作为潜在的渗透感应途径的第三伙伴的相关性杨树.然而,它们在渗透胁迫反应基因转录中的具体意义仍有待研究。
方法
b型RR cds的分离及系统发育分析
我们使用的参考基因来自杨树trichocarpab型响应声(PtRR12至PtRR22) [36]在JGI中搜寻它们的核苷酸序列杨树trichocarpa(v1.1),并设计了每个RR对应的特定引物对(附加文件1),以便将他们的cds与摘要(Bartr)。马什xp .黑质L. Dorskamp基因型。采用Marathon cDNA Amplification Kit (Clontech)和Taq Advantage polymerase (Clontech)构建根cDNA文库,引物终浓度为0.2 μM。PCR产物克隆至pGEM-T载体(Promega),测序并与pGEM-T进行比较p . trichocarpa使用ClustalW的b型rr序列[51]在BIOEDIT版本7.0.9中实现[52].
杨树所有b型RRs的多氨基酸序列比对拟南芥,玉米,甘氨酸,水稻(附加文件2),使用Muscle [41]纳入软件MEGA 5内[42].最大似然树重建使用MEGA 5进行,并使用Jones-Taylor-Thornton模型生成[43].我们的分析只使用了同时包含RR结构域(受体结构域)和Myb dna结合结构域的RR。ARR22序列(EMBL: At3g04280.1), c型RR来自拟南芥,被用作外组[18].通过1000个自举重复来评估树的稳健性。
酵母双杂交相互作用试验
双杂交分析使用LexA dna结合域编码诱饵载体(pBTM116,简称pLex)和Gal4激活域编码猎物载体(pGADT7, Clontech)进行。将RR cds克隆到pGAD载体中Xma我萨尔I (rr12, rr13, rr14, rr16, rr21, rr22),班我-XhoI (RR15)和班我萨尔I (RR19)片段来源于pcr扩增的pGEMT-RR克隆。
酵母菌株L40Δ (MATa ade2-101 his3-200 leu2- 3112 trp1-901 URA3 -52 LYS2::(lexA op)x4-HIS3 URA3::(lexA op)x8-lacZ gal4Δ)根据Gietz的醋酸锂方法进行所有转化et al。[53].将共转化酵母选择到缺乏亮氨酸-色氨酸的培养基(−LW)上,在30℃下培养4天,然后将其剥离到缺乏亮氨酸-色氨酸-组氨酸的培养基(−LWH)上,在30℃下培养4天。由于HPts的自动激活,3-氨基- 1,2,4 -三唑(3AT)被添加到60 mM (HPt2)或20 mM (HPt7和9)的-LWH培养基中。X-Gal测定根据源自Fromont-Racine的叠加法进行et al。[54]通过(直接在含有条纹阳性酵母的-LWH培养基上)涂抹10ml含有琼脂(0.5%)、磷酸盐缓冲液(0.25 M)、SDS(0.1%)和X-Gal(0.04%)的X-Gal混合物。在30°C下,让蓝色出现3h至5h。使用两种不同的报告基因(HIS3而且LacZ),所有的相互作用都被测试了至少两次。
ß-半乳糖苷酶活性测定
在-LW培养基上生长的酵母菌菌落重悬于Z缓冲液(Na2HPO4,不2阿宝4,氯化钾,MgSO4)过量600在0.5 ~ 0.7之间,最终浓度为300 μL。用液氮/37°C孵育3个循环,100 μL进行3个重复试验。200 μL的昊图公司将-nitrophényl-ß-D-galactopyranoside (ONPG, 4 mg/mL)加入Z缓冲液中,37℃孵育5 min,然后用200 μL 1 M Na停止反应2有限公司3..上清100 μL转入微孔板测OD420阅读。ß-半乳糖苷酶单位表示为米勒单位。每次HPt/RR相互作用测试至少使用三个独立克隆。采用SPPS 11.0 (SPSS, Chicago, IL, USA)统计软件进行数据管理和统计分析。对于每个变量,用夏皮罗-威尔克检验检验分布的正态性。均值用其标准误差表示,用t检验或方差分析进行比较,然后进行谢弗检验。所有统计学检验均认为P≤0.05为显著性。
用BiFC分析研究HPts与b型RRs的相互作用
采用pSPYNE(R)173和pSPYCE(MR)质粒进行BiFC检测[55],使一种融合到分裂yfp片段c端的蛋白得以表达。对于HPt2, HPt7, HPt9, RR16和RR19,使用特定引物扩增的cdna通过SpeI在帧中与n端(YFP)编码序列的3 '端相连N,氨基酸1-173)和c端(YFPC,氨基酸156-239)的YFP片段。RR13 cdna通过BamHI的相同配置。这导致HPt2, HPt7, HPt9, RR13, RR16和RR19产生了两种不同的融合蛋白,每种类型的融合都包括YFPN-HPt2和YFPC-HPt2,如HPt2所述。的瞬态变换c . roseus也叫根据guidrimand使用CFP核标记物对细胞进行粒子轰击和YFP成像et al。[56]适用于BiFC测定[57].
gfp融合蛋白表达质粒
为了表达HPt-GFP和RR-GFP融合蛋白,用特异性引物PCR扩增HPts (HPt2和9)和RRs (RR13和16)的完整编码序列SpeI (HPt2和9,RR16)或XbaI (RR13)限制四肢部位。扩增后的cDNA随后被克隆到Spe我或XbaI限制位点pSCA-cassette GFPi [56]在GFP编码序列的5 '端帧中。
的瞬态变换c . roseus也叫根据guidrimand,使用mcherry核和核浆标记物对细胞进行粒子轰击和YFP成像等.[56].
RT-PCR分析b型RR转录本
这项研究是用摘要(Bartr)。马什xp .黑质L.克隆Dorskamp基因型。通过向生长培养基中添加50 g/L的PEG 6000,对水培生长1个月的生根扦插施加渗透胁迫[58].根、茎、叶柄和叶分别在胁迫0分钟和10分钟后收获并冷冻。RNA提取使用NucleoSpin®RNA植物迷你试剂盒(machery - nagel),按照制造商的说明进行。将1 μg总RNA按照制造商的程序使用M-MuLV逆转录酶RNase H- (Finnzyme)进行逆转录,并作为PCR扩增模板。所有PCR反应均在最优和比较的条件下进行三次。网格蛋白被用作表达控制基因。扩增片段经1.2%琼脂糖凝胶电泳分离,溴化乙锭染色,紫外光下分析。进行了三个独立的生物学实验。
参考文献
Maeda T, Wurgler-Murphy SM, Saito H:酵母渗透感应MAP激酶级联调控的双组分系统。自然科学,1994,37(4):344 - 344。10.1038 / 369242 a0。
Posas F, Wurgler-Murphy SM, Maeda T, Witten EA, Thai TC, Saito H:酵母HOG1 MAP激酶级联在SLN1-YPD1-SSK1“双组分”渗透传感器中受多步磷酸中继机制调控。细胞,1996,86:865-875。10.1016 / s0092 - 8674(00) 80162 - 2。
黄毅,陈海春,陈海春。拟南芥双组分信号转导通路。植物科学学报,2002,29(4):457 - 457。10.1104 / pp.005504。
Pischke MS, Jones LG, Otsuga D, Fernandez DE, Drews GN, Sussman MR:拟南芥组氨酸激酶在大配子发生中至关重要。《美国国家科学院学报》上。2002, 29(4): 457 - 457。10.1073 / pnas.232580499。
Hejátko J, Pernisová M, Eneva T, Palme K, Brzobohatý B:组氨酸激酶CKI1可能参与拟南芥雌配子体发育。中国生物医学工程学报,2003,26(4):443-453。10.1007 / s00438 - 003 - 0858 - 7。
邓艳,董辉,穆杰,任波,郑波,季珍,杨文春,梁燕,左娟:拟南芥组氨酸激酶CKI1在组氨酸磷转移蛋白上游调控雌性配子体发育和营养生长。植物学报,2010,22:1232-1248。10.1105 / tpc.108.065128。
Desikan R, Horák J, Chaban C, Mira-Rodado V, Witthöft J, Elgass K, Grefen C,张M-K, Meixner AJ, Hooley R, Neill SJ, Hancock JT, Harter K:组氨酸激酶AHK5在拟南芥保护细胞中整合内源性和环境信号。公共科学学报,2008,3:e2491-10.1371/journal. pone.net .0002491。
Inoue T, Higuchi M, Hashimoto Y, Seki M, Kobayashi M, Kato T, Tabata S, Shinozaki K, Kakimoto T:拟南芥CRE1细胞分裂素受体的鉴定。自然科学,2001,39(3):344 - 344。10.1038 / 35059117。
Yamada H, Suzuki T, Terada K, Takei K, Ishikawa K, Miwa K, Yamashino T, Mizuno T:拟南芥AHK4组氨酸激酶是一种细胞分裂素结合受体,可将细胞分裂素信号转导到细胞膜上。植物生理学报,2001,29(4):344 - 344。10.1093 /卡式肺囊虫肺炎/ pce127。
Ueguchi C, Koizumi H, Suzuki T, Mizuno T:拟南芥中传感器组氨酸激酶基因的新家族。植物生理学报,2001,29(4):344 - 344。10.1093 /卡式肺囊虫肺炎/ pce015。
Higuchi M, Pischke MS, Mähönen AP, Miyawaki K, Hashimoto Y, Seki M, Kobayashi M, Shinozaki K, Kato T, Tabata S, Helariutta Y, Sussman MR, Kakimoto T:拟南芥细胞分裂素受体家族在植物中的功能。《美国国家科学院学报》上。2004, 30(4): 528 - 528。10.1073 / pnas.0402887101。
Urao T, Yakubov B, Satoh R, Yamaguchi-Shinozaki K, Seki M, Hirayama T, Shinozaki K:拟南芥跨膜杂交型组氨酸激酶的渗透传感器功能。植物科学学报,1999,30(4):344 - 344。
Tran L-SP, Urao T, Qin F, Maruyama K, Kakimoto T, Shinozaki K, Yamaguchi-Shinozaki K:拟南芥AHK1/ATHK1和细胞分裂素受体组氨酸激酶在脱落酸、干旱和盐胁迫下的功能分析。《美国国家科学院学报》上。2007, 40(4): 344 - 344。10.1073 / pnas.0706547105。
Wohlbach DJ, Quirino BF, Sussman MR:拟南芥组氨酸激酶ATHK1的分析揭示了植物渗透胁迫感知与种子成熟之间的联系。植物科学学报,2008,30(4):344 - 344。10.1105 / tpc.107.055871。
Urao T, Miyata S, Yamaguchi-Shinozaki K:拟南芥双组分系统中asp磷酸化信号通路的可能。中国生物医学工程学报,2000,29(3):344 - 344。10.1016 / s0014 - 5793(00) 01860 - 3。
Dortay H, Mehnert N, Bürkle L, Schmülling T, Heyl A:拟南芥细胞分裂素信号通路蛋白相互作用分析。中国农业科学,2006,27(3):344 - 344。10.1111 / j.1742-4658.2006.05467.x。
Dortay H, Gruhn N, Pfeifer A, Schwerdtner M, Schmülling T, Heyl A:拟南芥双组分信号通路的相互作用图。中国生物医学工程学报,2008,27(3):349 - 349。10.1021 / pr0703831。
Pils B, Heyl A:解开细胞分裂素信号的进化。植物科学学报,2009,29(3):344 - 344。10.1104 / pp.109.139188。
Gupta S, rashote A:细胞分裂素信号通路的下游组分及其在植物中的作用。中国生物医学工程学报,2012,29(3):344 - 344。10.1007 / s00299 - 012 - 1233 - 0。
Riechmann JL, Heard J, Martin G, Reuber L, Jiang C-Z, Keddie J, Adam L, Pineda O, Ratcliffe OJ, Samaha RR, Creelman R, Pilgrim M, Broun P, Zhang JZ, Ghandehari D, Sherman BK, Yu G-L:拟南芥转录因子:真核生物全基因组比较分析。科学通报,2000,29(3):349 - 349。10.1126 / science.290.5499.2105。
Triezenberg S:转录激活结构域的结构和功能。《生物工程学报》,1995,5:1 - 6。10.1016 / 0959 - 437 x(95) 80007 - 7。
Sakai H,青山T, Oka A:拟南芥ARR1和ARR2响应调控因子作为转录激活因子。植物学报,2000,29(3):344 - 344。10.1046 / j.1365 - 313 x.2000.00909.x。
杨春华,李志刚,李志刚,等:拟南芥histo -asp磷酸化信号的细胞定位。中国生物工程学报,2001,29(4):457 - 457。10.1271 / bbb.65.2113。
Lohrmann J, Sweere U, Zabaleta E, Bäurle I, Keitel C, Kozma-Bognar L, Brennicke A, Schäfer E, Kudla J, Harter K:响应调控因子ARR2:参与拟南芥线粒体复合体I组分核基因表达的花粉特异性转录因子。中国生物医学工程学报,2001,29(3):344 - 344。10.1007 / s004380000400。
黄毅,陈志军:拟南芥细胞分裂素信号转导的双组分通路。自然科学,2001,413:383-389。10.1038 / 35096500。
Hosoda K, Imamura A, Katoh E, Hatta T, Tachiki M, Yamada H, Mizuno T, Yamazaki T:拟南芥myb相关DNA结合基序GARP家族的分子结构。中国生物医学工程学报,2002,26(3):344 - 344。10.1105 / tpc.002733。
Mason MG, Li J, Mathews DE, Kieber JJ, Schaller GE:拟南芥b型反应调控因子表达模式重叠。植物科学学报,2004,27(3):344 - 344。10.1104 / pp.103.038109。
Imamura A, Hanaki N, Nakamura A, Suzuki T, Taniguchi M, Kiba T, Ueguchi C, Sugiyama T, Mizuno T:与His-Asp磷酸化转导相关的Arabiopsis thaliana反应调控因子的编译和表征。植物生理学报,1999,30(4):344 - 344。10.1093 / oxfordjournals.pcp.a029600。
Sakai H, Honma T,青山T, Sato S, Kato T, Tabata S, Oka A: ARR1,对细胞分裂素立即反应的基因转录因子。科学通报,2001,29(4):344 - 344。10.1126 / science.1065201。
Mason MG, Mathews DE, Argyros DA, Maxwell BB, Kieber JJ, Alonso JM, Ecker JR, Schaller GE:多种b型反应调控因子介导拟南芥细胞分裂素信号转导。中国生物医学工程学报,2005,27(3):344 - 344。10.1105 / tpc.105.035451。
Yokoyama A, Yamashino T, Amano Y- i, Tajima Y, Imamura A, Sakakibara H, Mizuno T: b型ARR转录因子ARR10和ARR12参与细胞分裂素介导的拟南芥根原生木质部分化调控植物生理学报,2007,29(4):344 - 344。
Ishida K, Yamashino T, Yokoyama A, Mizuno T:在拟南芥生命周期中,ARR1, ARR10和ARR12这三种b型反应调控因子在细胞分裂素信号转导中起着重要但多余的作用。植物生理学报,2008,29(4):344 - 344。10.1093 /卡式肺囊虫肺炎/ pcm165。
Imamura A, Kiba T, Tajima Y, Yamashino T, Mizuno T:拟南芥中his- asp磷酸化信号转导中ARR11响应调节因子的体内外特性。植物生理学报,2003,29(4):334 - 334。10.1093 /卡式肺囊虫肺炎/ pcg014。
Argyros RD, Mathews DE, Chiang Y-H, Palmer CM, Thibault DM, Etheridge N, Argyros DA, Mason MG, Kieber JJ, Schaller GE:拟南芥B型反应调控因子在细胞分裂素信号通路和植物发育中起关键作用。植物学报,2008,30(4):344 - 344。10.1105 / tpc.108.059584。
到JPC, Deruère J, Maxwell BB, Morris VF, Hutchison CE, Ferreira FJ, Schaller GE, Kieber JJ:细胞分裂素通过双组分磷relay调节a型拟南芥反应调节活性和蛋白质稳定性。植物学报,2007,29(3):389 - 397。10.1105 / tpc.107.052662。
Ramírez-Carvajal GA, Morse AM, Davis JM:杨树细胞分裂素反应调节基因家族的转录谱表明其在植物发育中的不同作用。环境科学学报,2008,29(3):344 - 344。
杨晓燕,杨晓燕,杨晓燕,杨晓燕。杨树茎部器官发生的基因组转录组分析。中国生物医学工程学报,2009,29(3):342 - 344。
Ramírez-Carvajal GA, Morse AM, Dervinis C, Davis JM:细胞分裂素b型反应调控因子PtRR13是杨树不定根发育的负调控因子。植物科学学报,2009,30(3):357 - 357。10.1104 / pp.109.137505。
Chefdor F, Bénédetti H, Depierreux C, Delmotte F, Morabito D, Carpin S:杨树渗透胁迫传感:磷传递系统的组分识别。中华人民共和国学报,2006,29(3):344 - 344。10.1016 / j.febslet.2005.11.051。
Héricourt F, Chefdor F, Bertheau L, Tanigawa M, Maeda T, Guirimand G, Courdavault V, Larcher M, Depierreux C, Bénédetti H, Morabito D, Brignolas F, Carpin S:组氨酸-天门冬氨酸激酶HK1的特性和组氨酸磷酸转移蛋白作为白杨多步磷酸传递的潜在伙伴的鉴定。杂志的植物。10.1111 / ppl.12024。
Edgar RC: MUSCLE:多序列比对,高精度,高通量。中国生物医学工程学报,2004,29(4):344 - 344。10.1093 / nar / gkh340。
Tamura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S: MEGA5:利用最大似然,进化距离和最大简约方法进行分子进化遗传学分析。分子生物学杂志,2011,28:2731-2739。10.1093 / molbev / msr121。
Jones DT, Taylor WR, Thornton JM:从蛋白质序列中快速生成突变数据矩阵。中国生物工程学报,2002,23(4):457 - 457。
Hass C, Lohrmann J, Albrecht V, Sweere U, Hummel F, Yoo SD, Hwang I, Zhu T, Schäfer E, Kudla J, Harter K:拟南芥乙烯信号和激素信号整合的响应调节因子2介导。环境科学学报,2004,23:369 - 369。10.1038 / sj.emboj.7600337。
Tajima Y, Imamura A, Kiba T, Amano Y, Yamashino T, Mizuno T:拟南芥his- asp磷酸化信号转导中b型响应调控因子的比较研究。植物生理学报,2004,45:28-39。10.1093 /卡式肺囊虫肺炎/ pcg154。
Cutcliffe JW, Hellmann E, Heyl A, Rashotte AM: CRF在拟南芥中通过CRF结构域相互之间以及与细胞分裂素信号通路成员之间形成蛋白-蛋白相互作用。应用物理学报,2011,32(2):379 - 379。10.1093 / jxb / err199。
金海杰,刘海红,洪晓红,吴洪红,林波,李ic,辛J,南HG,黄一:细胞分裂素介导的AHK3通过ARR2磷酸化调控拟南芥叶片寿命。美国国家科学研究院。2006, 30(4): 344 - 344。10.1073 / pnas.0505150103。
崔俊,苏huh, Kojima M, Sakakibara H, Paek K-H, Hwang I:细胞分裂素激活转录因子ARR2通过TGA3/ npr1依赖的水杨酸信号通路促进植物免疫。生物工程学报,2010,29(3):344 - 344。10.1016 / j.devcel.2010.07.011。
陈丽萍,杨晓明,杨晓明:细胞分裂素双组分系统在ABA和渗透胁迫信号传递中的作用。植物生态学报,2010,30(4):344 - 344。10.4161 / psb.5.2.10411。
Nishiyama R, Watanabe Y, Fujita Y, Le DT, Kojima M, Werner T, Vankova R, Yamaguchi-Shinozaki K, Shinozaki K, Kakimoto T, Sakakibara H, Schmülling T, Tran L-SP:细胞分裂素突变体和细胞分裂素代谢基因的调控分析揭示了细胞分裂素在干旱、盐和脱落酸反应以及脱落酸生物合成中的重要调控作用。植物学报,2011,23:2169-2183。10.1105 / tpc.111.087395。
Thompson JD, Higgins DG, Gibson TJ: CLUSTAL W:通过序列加权、位置特定间隙惩罚和权重矩阵选择提高渐进式多序列对齐的灵敏度。中国生物医学工程学报,1994,22:473 - 480。10.1093 / nar / 22.22.4673。
大厅TA: BioEdit:一个用户友好的生物序列比对编辑器和分析程序,适用于windows 95/98/NT。中国生物医学工程学报,1999,41:95-98。
Gietz RD, Schiestl RH, Willems AR, Woods RA:通过LiAc/SS-DNA/PEG程序对完整酵母细胞转化的研究。酵母,1995,11:355-360。10.1002 / yea.320110408。
Fromont-Racine M, Rain J-C, Legrain P:通过详尽的双杂交筛选对酵母基因组进行功能分析。王志刚,1997,30(4):377 - 382。10.1038 / ng0797 - 277。
Waadt R, Schmidt LK, Lohse M, Hashimoto K, Bock R, Kudla J:多色双分子荧光互补揭示了植物中CBL/CIPK复合物同时形成。植物学报,2008,29(4):344 - 344。10.1111 / j.1365 - 313 x.2008.03612.x。
Guirimand G, Burlat V, Oudin A, Lanoue A, St-Pierre B, Courdavault V:粒子轰击法优化玫瑰葵细胞瞬时转化及其在羟甲基丁烯基4-二磷酸合酶和香叶醇10-羟化酶亚细胞定位中的应用。植物细胞学报,2009,28:1215-1234。10.1007 / s00299 - 009 - 0722 - 2。
guidrimand G, Courdavault V, Lanoue A, Mahroug S, Guihur A, Blanc N, Giglioli-Guivarc 'h N, St-Pierre B, Burlat V:夹克桃科中Strictosidine的激活:向“核定时炸弹”?中国生物医学工程学报,2010,30(4):344 - 344。
杨晓明,杨晓明,杨晓明,杨晓明。干旱胁迫和渗透胁迫对杨树脱水诱导的影响。植物化学学报,2002,30(4):344 - 344。10.1016 / s0981 - 9428(02) 01468 - 7。
确认
本研究由康塞尔Régional du Centre和康塞尔Général du Loiret资助。LB获得了法国康塞尔Régional Région中心的博士学位。感谢A Guichard (EA 1207, Orléans大学,法国)和M Larcher (EA 1207, Orléans大学,法国)的技术援助。我们非常感谢C Bertheau博士(奥地利Bokü大学)和D Auguin博士(法国Orléans大学,EA 1207)为系统发育树的构建提供了有用的建议。我们也感谢J-C博士Leplé (AGPF, INRA of Orléans, France)的设计网格蛋白引物。我们特别要感谢W Strong博士(加拿大bc省森林、土地和自然资源运营部)的语言校对。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
LB协调了该项目从细化到提交论文。她进行了相互作用研究的技术实验,包括双杂交实验、β-半乳糖苷酶活性剂量和GFP/BiFC实验的质粒构建。她进行了系统发育数据分析,并撰写了论文。FC对杨树b型RRs进行分离,并对其表达谱进行分析。GFP/ bifc成像实验由GG和VC全权负责。FB参与了统计分析。FH共同监督LB博士工作。LB PhD的导师SC构思并协调,完成了部分实验并起草了手稿。FC, VC, CD, DM和FH参与了稿件的编辑,所有作者都阅读并批准了最终稿件。
电子辅助材料
12870 _2012_1211_moesm1_esm.xls
附加文件1:表S1:序列杨树b型rr而且网格蛋白基因特异性引物用于共表达分析。(xl34kb)
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
伯索,L.,切夫多,F.,吉里蒙德,G.。et al。鉴定了五种b型响应调节器作为多步磷接力系统的成员,与含有组氨酸的磷转移伙伴相互作用杨树osmosensor。BMC植物生物学12,241(2012)。https://doi.org/10.1186/1471-2229-12-241
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-12-241
关键字
- 响应调节器(RR)
- 含组氨酸的磷酸转移蛋白
- Osmosensing通路
- 杨树