抽象的
背景
多倍性会导致遗传瓶颈,尤其是单系起源的物种。栽培花生是一种遗传多样性有限的异源四倍体,可能是单一起源和驯化共同作用的结果。花生野生亲缘系是新等位基因的重要来源,可用于拓宽栽培的遗传基础。本研究以一个人工合成的双二倍体作为野生等位基因供体的回交群体为材料,在两种水分条件下,对花生产量、适应和驯化相关的几个性状进行了详细的QTL研究。
结果
在两个水处理中共定位了95个qtl。约有一半的QTL的正效应与野生亲本的等位基因相关,且与产量构成相关的几个QTL是针对限水处理的。对同一性状的qtl定位到非同源基因组区域,表明由于多倍体化的结果,在亚基因组中存在差异控制。与种子和荚果大小以及植株和荚果形态相关性状的qtl值得注意的聚类表明,与许多作物一样,少量的位点对花生驯化有贡献。
结论
在我们的研究中,我们已经鉴定了将栽培花生与其野生亲缘分化的qtl,以及对花生产量和适应性相关的几个性状产生正变异的野生等位基因。这些发现为利用野生亲缘改良花生提供了新的机会。
背景
多倍体意味着相同(Autopolyploid)或不同(AllopolyPloid)基因组的两组或更多种成套染色体存在于相同的核中。它是植物演进中的突出和重要的过程[1那2].多倍性被认为是通过增加等位基因多样性、保持全基因组杂合度和允许出现新的表型变异而赋予某些栽培物种适应价值的重要因素[3.-6.].多倍体形成的阶段通常包括来自祖细胞的繁殖分离,导致严重的遗传瓶颈。然而,由于大多数多倍体物种从其野生祖细胞常常形成[7.],适度的多态性水平已被保存在多倍体植物中。花生(落花生hypogaeaL.)是南美本土的异源四倍体(2n = 4x = 40),具有AB基因组。栽培花生的异源多倍体结构可能来自于两个野生二倍体物种之间的单一杂交,随后进行染色体加倍[8.].因此,其单胞生成和驯化效应极大地缩小了培养物的遗传基础。
花生初级基因池包含精英育种线和栽培物种的体重答:hypogaea和A. Monticola.,一种密切相关的野生四倍体种类栽培花生[9.].虽然该基因库中大量的表型变异显着,但已经观察到基因型之间的有限DNA多态性水平[10-14].随着分子标记数量的增加,已投入努力开发遗传图[15那16].最近报道了用于生理参数和产量组分特征的QTL,并终于报道了与耐旱耐受性相连的[17].然而,尽管获得抗病和抗非生物胁迫的花生新品种面临挑战,但在种内育种中整合分子标记的研究进展甚微。
栽培花生的继发基因池主要包括野生二倍体(2n = 2x = 20),代表可用于改善培养物的新等位基因的重要来源。已经进行了广泛的工作,以表征该基因库物种之间的遗传关系,并使用分子标记培养花生[18-23]和细胞遗传学[24-26].一些野生二倍体物种被假设为栽培物种的可能祖先。最近的研究提出答:duranensis(一个基因组)和A. iPaensis.(B基因组)为最可能的野生祖先[24那27那28].Faveroet al。[29通过杂交产生了一种合成的二倍体A. iPaensis.和答:duranensis和染色体数量的加倍。当与每个植物品种交叉时,这种壮双倍胶片产生了肥沃的杂种答:hypogaea.此外,在野生物种中鉴定了对几种疾病的抗性[30.-33]和抗病qtl最近在一个涉及野生二倍体物种的杂交中被定位[34].野生二倍体植物抗病基因的渐渗答:cardenasii还报道了精英花生品种[35那36].然而,据报道,从花生野生物种到栽培物种的有效转移到植物密集型[37[诸如产量等复杂性状变异的基因均未报告我们的知识。因此,存在于野生物种中存在的遗传变异仍然很大程度上是欠缺的。
野生近缘种是基因的一个重要来源,这些基因已被成功地用于提高各种作物的生产力和适应性[38-40].坦克利et al。[41.]提出了一种有效的先进的高速公路 - QTL(AB-QTL)方法来检测和映射有价值的QTL,并同时将它们从野生转移到栽培物种。这种方法已被广泛采用映射和突出的QTL涉及在几种物种中复杂性状的QTL [42.].
在作物及其野生祖先之间的杂交中,QTL定位也是识别涉及形态和生理变化的基因组区域的一种强有力的手段,这些变化将作物与其野生亲缘物种区分开来[43.].这些在人为影响下的植物进化所产生的形态和生理差异被包括在一个称为“驯化综合症”的通用术语中[44.那45.].几乎所有重要的农艺驯化物种都具有驯化综合症的特征。驯化的目标包括种子传播和休眠机制的丧失,植物生长习性的改变和收获植物部分的大小的增加[46.-48.].虽然花生没有荚果开裂,但仅在野生物种中观察到的长钉和地峡已被确定为种子传播的潜在机制[49.].在培养的花生荚中,峡部几乎不存在,并且已经给予了或多或少的深层荚收缩,这可能代表斯蒂姆斯的遗迹。与野生物种相比,栽培花生还显示出更紧凑的生长习惯。然而,培养物种中仍存在大范围的变异。属于亚种的品种快餐以直立的生长习惯为特征,伴随着诸如Pod收缩的损失和种子休眠的特征。匍匐的生长习惯通常伴随着具有标记收缩和种子的小水果,展示了休眠。这些可以被视为原始的角色,主要是属于的品种hypogaea.亚种 [50.].
尽管鉴定出了栽培花生的两个最可能的野生祖先,但对驯化花生的进化知之甚少,与驯化相关的基因组区域也从未被报道过。我们最近发表了一份利用BC构建的基于ssr的遗传图谱1F1衍生自横磷脂骨之间的交叉(A. iPaensis.×答:duranensis)X4和一种栽培花生品种,以及对BC野生DNA片段全基因组渗入的分析2F1一代(51.].作为本研究的后续行动,我们产生了一个AB-QTL人口,代表了映射花生驯化的QTL的一个很好的机会,并探索野生物种中剩余的农艺上有趣的等位基因储层。由于花生主要在干旱和半干旱热带地区的雨量条件下种植,它通常面临中度至严重的干旱状况[52.那53.].因此,重要的繁殖目的是开发可以在有限条件下产生合适产率的品种。
在本文中,我们提供了对花生生产率的几个特征的详细QTL分析,以及在两个水中制度下的适应以及驯化综合征。基于这些结果,我们报告了对复杂性状有贡献阳性变化的野生等位基因的鉴定,我们概述了参与驯化过程的花生基因组的几个区域,并比较QTL在子组织中的分布。
方法
人口发展
共有142种植物(公元前87年)3.F1和公元前552F2)使用44 bc制作2F1植物源自栽培的Fleur11品种之间的交叉,用作复发父母和Amphidiploid AIAD(A. iPaensis.KG30076×A.duranensisV14167)X4[29],用作捐助者父母。Fleur11是塞内加尔种植的当地花生品种,是一种西班牙类型,具有直立的生长习性,低于中等的Pod收缩,短周期(90天),高屈服和耐旱耐受性。这些人口在中心D'Etude Regional Pour L'AmélioRationdeL'AweariationàLaSécheresse(Ceraas),Thiès,塞内加尔的温室条件下生产。生产BC的育种计划2F1以前曾描述过个人[51.].公元前44年2F1用作女性父母的个人是:i)与Fleur11和II的回复允许自我授粉。在温室中,共收获了565种种子,并在大型深盆中单独播种。从幼苗和BC中提取DNA3.F1个人与BC有区别2F2使用115个SSR标记的个人,共产生147个映射的基因座。选择这些基因座可提供先前制备的遗传图的定期覆盖[51.].所有公元前3.F1和公元前2F2个体被允许自花授粉产生BC3.F2和公元前2F3.这些家庭随后被用于表型实验。142个人的选择(即公元前87年3.F1和公元前552F2作为最终群体保留的是基于两个标准:i)在147个基因座中的每一个的杂合或纯合的情况下最大化供体等位基因频率,以及(ii)每次BC产生的种子数量3.F1和公元前2F2个体,这可能是花生的一个强烈限制因素。
田间准备
该实验在2009年9月至2009年12月在Bambey(14.42°N和16.28W°)的中心国家De Recherche Agronicique(CNRA)进行了该实验。在该研究站中,土壤是铁鳞状,砂含量为90%,低粘土含量(3-6%)。播种前四十五天,该领域被耕作消除杂草。在播种前4周和3天加入一百五十千克/公顷的有机肥和1吨/公顷的矿物肥料(6-20-10)。在播种之前,该领域在播种之前手动无杂草。
实验设计
142个回交家族(BC3.F2和公元前2F3.)在两次水中制度下测试Fleur11父母:浇水和有限的水平。对于每种水域,α-晶格实验设计与每复制两种复制和9个块使用。块包含16行,每个3米。个人以10株植物排列。植物之间的间距是30厘米,行之间的50厘米。由于每个BC家族的种子有限,每山每山的一粒种子深度播种。在播种之前,将种子用麦芽糖(Capafol 10%,苯甲酸10%,碳呋库兰20%)处理,以保护它们免受昆虫和疾病。
水资源管理
在Bambey研究站的地理区域,雨季持续了大约3个月,从7月初到9月下旬。实验16th2009年9月。在两种治疗中(浇水,有限),从播种日期(DAS)播种至43天的播种日期(降雨+额外灌溉)的总量为184毫米。在此之后,对应于荚填充阶段,通过扣留灌溉至84 das,在水有限的处理中施加应力,其总应力持续时间为40天。从84 das重新启动灌溉到收获(95 das),加入21毫米水。水有限处理中收到的水总量为205毫米。在浇水良好的处理中,在整个实验中持续灌溉直至收获,315毫米的水施加。
土壤水分状况
使用Diviner 2000电容剖面探针(Sentek Environmental Technologies, stesteney, Australia)从播期到胁迫结束(84 DAS),每隔4天在1 m深度以10 cm的间隔测量土壤体积含水量。在每个处理中,取12根通路管的测量平均值。进入管随机分散在处理区。土壤水分有效性在10 cm至1 m各深度的变化以土壤蒸腾水(FTSW)的分数表示,使用以下公式:
在SWCERD, SWC工务计划和SWC足球俱乐部对应于有效生根深度,永久性衰弱点和现场容量的土壤含水量[54.].田间容量值是根据先前在Bambey进行的一项研究得出的[55.].
特质评价
除了开花的日子外,植物生长习惯和主干高度,收获后所有特征都记录。播种并暴露于环境温度(30-35°C)后,将该植物收获。1个月,以允许完全干燥荷泊和豆荚。共27个特征(表1)在BC评估3.F2和公元前2F3.一个或两个水资源下的家庭。每个BC的每个特征的表型价值3.F1和公元前2F2通过平均相应的BC的值获得个人3.F2和公元前2F3.家庭。然后以每株植物表达特征值。如上所述,由于种子数量的限制,播种了每山的一粒种子。因此,每家庭的至少3至最多10种植物(平均8.5株植物)和每种复制,评价该性状。有关特质测量的细节如下。
往开花的日子
播种至开花的天数(DFL.)在第一个花外观日期评估。
工厂建筑
植物的生长习性(“大酒店”)及主杆高度(PH值),分别在结荚期和播后60 d水分充足条件下进行。使用花生的描述符在1-6级记录植物生长习性[56.其中,1 =斜卧1,2 =斜卧2,3 =斜卧1,4 =斜卧2,5 =斜卧3,6 =直立。主茎高度从子叶腋到顶芽。
Pod形态学
盆景(PB),收缩(个人电脑),长度(PL)及宽度(预警指示器)在30个豆荚中评估。除了豆荚收缩之外,在两个水域中测量所有特征,仅在含水良好的情况下测量。根据地下室的描述符,在0-9规模上记录盆景和收缩。使用具有数字显示器的卡钳测量豆荚长度和宽度。
种子形态
种子长度(sl)及宽度(SWI.),用带数字显示器的卡尺对两种水分状态下的30粒种子进行了评价。
产量组件
基于荚,润滑性和种子干料的两个水分形式测定产率组分。首先称量总生物质以确定每株植物的总生物质(TB.).取去荚果并称重,以确定每株荚果总重量(PW).每株植物的拖拉重量(HW)计算为总生物质和总豆荚之间的差异。每株植物的总豆荚(PN)测定,100个豆荚被随机取样并称重(HPW.).炮轰100个豆荚,数为含有深色内膜颜色的成熟豆荚(PMAT.).称量100个豆荚中含有的所有种子,并将成熟的种子与未固化的种子分离并计数。100种子的重量(HSW)的计算方法为成熟种子的重量除以成熟种子的数量乘以100。每株种子总重量(sw)和每个植物成熟种子的总数(桑),根据总结荚数(PN)、100结荚成熟种子数(NMSH)和100结荚种子重(SWH)估算:
壳体重量(SHW)被计算为100个Pod重量和100种种子重的差异相对于每株植物的总豆荚数:
收获指数(嗨),以荚果重量占总生物量的百分比计算。
计算荚果数(STI-PN),种子号码(STI-SN), 100荚重(STI-HPW), 100粒重(STI-HSW),豆荚重量(STI-PW)、种子重量(STI-SW)、茎重(STI-HW)和总生物量(STI-TB)使用以下公式:
与YIS =在压力条件下为给定性状的单个(I)的表型值,yiw =在含水条件下给定的特征的表型价值(i),ỹm=含水量良好的所有基因型的特征均值状况 [57.].
统计分析
首先使用通过观察总数的表型类的频率的比率将诸如植物生长习惯(GH),POD收缩(PC)和喙(PB)转化为定量数据的定性数据。使用R统计编程语言进行所有统计分析[58.].对每个性状进行基本统计分析(均值和标准差)。数据正态性用夏皮罗正态检验进行检验。采用方差分析(ANOVA)估计各水处理对各性状的遗传和复制效应。这是按照标准的线性模型进行的基因型,复制,阻断和相互作用的影响,如
与Y.IJK.=某一特征的观察值,μ =总体的均值,G一世=基因型效应,rj=复制效应,bjk= block within replication effect and eIJK.=残余错误。此外,在具有基因型,水分制度,复制和块和互动效应的固定模型的标准程序之后进行两种水域方差的组合分析。
与Y.ijkl=某一特征的观察值,μ =总体的均值,G一世=基因型效应,Wj=水政权效应,rjk=水政权效应中的复制,B. jkl=复制内阻滞和水态效应,G一世* W.j=基因型×水环境相互作用和eijkl=残余错误。
广义遗传力的估计计算为
在σ2G基因型变异是σ吗2E.残差,MSG和女士E.遗传和残差均方和r的重复次数。
使用R/lme4软件包拟合的线性混合模型对每个水况的数据进行分析。在该模型中,我们认为复制和复制中的块是固定效应,基因型是随机效应。从该模型中提取各基因型和性状的最佳线性无偏预测因子(BLUP),用于QTL分析。
分子分析和QTL鉴定
以前产生的遗传图谱[51.]进行QTL分析。得到147个基因座的骨架图,每12 cM有1个基因座覆盖整个LG。利用这些标记对142个群体个体进行基因型分析。种间高级回交居群(BC2F2公元前,3.F1)在某些位点上携带野生供体等位基因频率较低的风险。为了克服这种情况,我们在每个标记处检查了种群的基因型组成,并评估了每个基因型类中的个体数量(即,对循环亲本来说是纯合子的,对供体亲本来说是杂合子的和纯合子的)。部分基因座与供体亲本纯合的个体数小于5个。这些标记上的基因型被缺失的数据所替代。QTL鉴定采用标准区间作图法(SIM),采用R/ QTL包[59.].由于我们先进的回复人口的具体家庭结构,BC发电中的个人3.F1和公元前2F2分别考虑以使用MDM和Grafgen软件计算每1cm间隔的基因型概率[60.,考虑到在侧翼标记处观察到的世代和基因型。然后将两代的基因型概率合并,得到的文件被认为是一个唯一的F2人口并进一步进口到R / QTL。每个特征和治疗的QTL检测使用以下模型进行:
其中,y是观察到的表型,μ分别是群体的平均值,α和δ分别的QTL的添加剂和优势效应,Z1和z2QTL基因型的概率是否取决于侧翼标记基因型,βx BC2F1家庭协变量效应(44级),ε为残差。
采用二维双qtl基因组扫描方法,检测同一连锁群中是否存在两个qtl。在某些特定情况下,单个QTL基因组扫描方法的LOD曲线对一个连锁群显示出两个不同的LOD峰。对每个性状进行1000个基因排列,确定显著QTL效应的LOD阈值,基因组显著性水平为α = 5% [61.].使用1.5-LOD支持间隔方法获得QTL位置的置信区间估计[62.].表型方差的比例(R.2),通过拟合QTL与BC的模型得到2F1家庭协变量。表型方差的比例(R.2),通过拟合所有检测到的qtl与BC的模型得到2F1家庭协变量。Chi-Square试验用于评估子瘤之间的QTL数和职业LG之间的分布1:1的比例。使用SpiderMap软件(Rami,未发表)获得QTL的图形表示。
结果
土壤水分状况及胁迫强度
土壤水分测量结果表明,在水分充足的处理下,计算得到的FTSW值保持在0.80 ~ 0.50之间(附加文件1,图S1)。一般认为,这一范围足以让植物免受压力的影响[63.].在限水处理中,FTSW值从43 DAS时的0.8逐渐降低到84 DAS时的0.15。我们将这一时期分为三个不同的应力强度级别-低,中等和严重-(在附加文件中说明1(图S1)分别对应于花生生殖阶段R5-R6、R6-R7和R7-R8,由Boote描述[64.].从种子形成结束到豆荚成熟的开始(R6-R7)的开始,并且从豆荚成熟的开始时发生严重应激以收获成熟度(R7-R8)。这些强度水平的特征在于在下午萎的植物,用于中等应力条件,并且在中午的严重应激条件下。
性状变异和遗传力
大多数性状的表型值均为正态分布(附加文件)2,图S2)。每个条件中每个性状的人口倾向于朝向复发性Fleur11父母的表型值倾斜(表1).DFL变化范围较小(4 d),变化范围为播后18 ~ 21 d。相反,观察到形态性状具有很高的变异性。植物生长习性(GH)表现出从完全匍匐到完全直立的多种形态。PB和PC的变化幅度相似,分别为从不存在到非常显著和从不存在到非常深。产量构成性状的变异范围也很广1).一般来说,在荚果和种子数量上优于轮回亲本的基因型荚果和种子更小。然而,我们观察到一些基因型在保持100粒重的情况下,在荚果数上优于栽培亲本。HSW未发生越界分离,其最佳基因型与轮回亲本相似。
两种水处理之间的比较表明,水应激对对应于谷物填充和荚成熟度的R6-R8发育阶段的负面影响。因此,SW和PMAT是受影响最大的特征,人口平均降低了21.0%和18.9%。水分胁迫也会产生带负面影响的TB,PW和HW,减少分别为17.4%,12.8%和17.2%,以及较小程度的HPW,HSW,PN和Sn,减少8.9%,2.4%,6.8%和分别为6.0%。收获指标值在两个条件下相似。
方差分析表明,两水处理各性状基因型间差异显著(P≤0.001)。广义遗传力估算值在两种水处理中相似,但PW、HPW和SW在限水处理中较高1).对结核、PW、HW、PN、SN、SHW、HI和PMAT的遗传力估计为中等,在水分条件良好的处理下为0.39 ~ 0.54,在水分限制的处理下为0.39 ~ 0.62。在这两种条件下,HPW、HSW、DFL和植株、荚果和种子形态性状的遗传力估计值在0.54 ~ 0.90之间(见表)1).组合方差分析显示,PW、SN、SHW和PMAT(数据未显示)等少数性状存在显著的基因型×水处理交互作用(P≤0.05)。
特征之间的相关性
水分充足处理和限水处理性状间的表型相关性见表2.在两种水处理中观察到相同的趋势。在TB和HW之间,在PW,PN,SN和SHW之间以及HSW和HPW之间获得最高值(高达0.80)。HI与HW呈负相关,但与PW,PN,SW,SN和PMAT呈正相关。豆荚和种子形态相关性状的表型相关性,HSW和HPW的相关性为0.23至0.95。SWI,HSW和HPW之间获得的最高相关性(表2).主茎高(PH)与各性状均呈显著正相关。
QTL识别
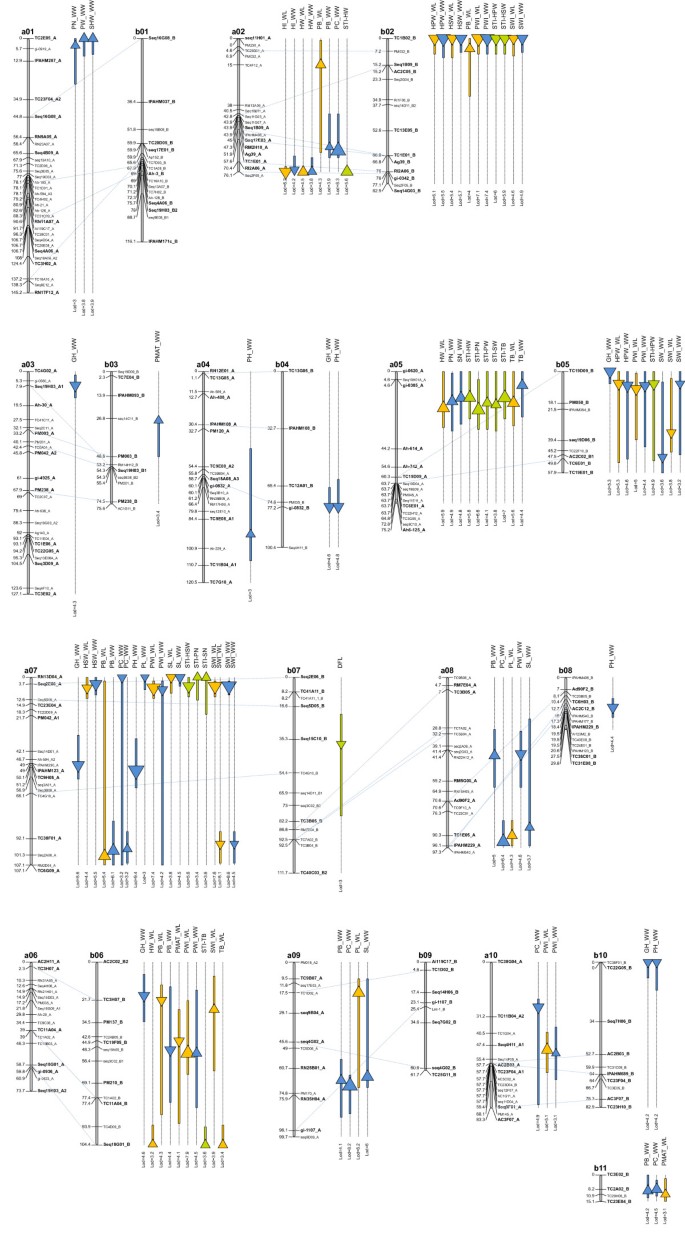
表中提供了两次水域中检测到的QTL的摘要3..为分析的27个特征中的每一个检测到至少一个QTL,共有95个QTL映射在两个环境中(图1).
往开花的日子
在LG B07上检测到DFL的一个QTL,解释了9.3%的表型方差(图1).有趣的是,开花早熟与野生双二倍体亲本的等位基因有关。
工厂建筑
总共11个QTL,分别解释了9.8%至26.0%的表型方差,参与了工厂建筑的变化(表3.).结果表明,在LGs a04、a07、b04、b08和b10上的5个qtl均检测到PH值的增加,LGs b04、a07、b08和b10上的Fleur 11等位基因有增加PH的趋势,而LGs a04上的PH值增加与双二倍体等位基因有关。5个qtl共同解释了40.9%的表型变异。有趣的是,两个qtl位于lga04和b04的同源区域,但这两个qtl关联等位基因的亲本来源不同(图)1).6个定位在LGs上的qtl分别为a03、a07、b04、b05、b06和b10。在GH的qtl中,所有具有直立生长习性表型的等位基因均来自Fleur11。总的来说,他们解释了46.1%的表型变异。在LGs b04、a07和b10上发现了PH和GH的qtl共定位。
Pod形态学
在考虑两种水处理时,总共检测到与POD形态相关的特征的QTL。这些QTLs的单独解释了表型方差的8.5%至23.9%(表3.).在检测到的10个PB qtl中,有6个位于LG a02、b06和a07上的qtl在两种条件下均被检测到,其中3个位于LG a08、a09和b11上的qtl是针对正常水处理的,1个位于LG b02上的qtl是针对限水处理的(图)1).在LGs的qtl上,a02、a07、a08、a09、b02和b11的双二倍体等位基因表现出喙突出的趋势,而LGs的b06的喙突出的增加与Fleur11等位基因有关。总体而言,PB的qtl分别解释了水分充足和限水处理中42.8%和38.2%的表型变异。对PC的7个qtl位点分别位于a02、a07、a08、a09、a10和b11。LGs a02、a08、a09和b11 qtl上的双二倍体等位基因与缢缩深度相关。在lga10上,缢缩荚果表型与Fleur11等位基因相关。LG a07上的两个qtl相互排斥。总体而言,与缢缩深度相关的qtl解释了50.2%的表型变异。在PWI检测到的11个qtl中,在两个水处理中检测到10个位于LG a07、a10、b02、b05和b06上的qtl,其中一个位于LG a08上的qtl是在良好水处理中检测到的(图)1).所有QTL分别解释了49.2%和58.5%,分别在浇水和有限的水处理处理中的变化。LGS A07,A08,B02,B05上的QTLS的Fleur11等位基因在LGS A10和B06上随着豆荚宽度的增加而相关,荚宽度增加与Amphidiploid等位基因有关。PL检测到三个QTL。在LG A07上的QTL上的Fleur11等位基因仅在浇水的处理中检测到,与荚的增加有关。在LG A08和A09上的QTL上的Amphidiploid等位基因仅在水有限的处理中检测到,负责荚长度的损伤。
种子形态
在考虑两种水处理时,将检测到与种子形态相关的特征的共有13个QTL。这些QTLS单独解释了表型方差的8.7%至23.0%(表3.).在为SWI检测到的九个QTL中,在两种处理中检测到八个,其中4个QTL位于LG A07上的LG A07上,在LG B02上,在LG B05上。在LG B06上检测到的QTL特定于水有限的处理(图1).总体而言,这些QTL分别解释了38.6%和55.5%的含水量和有限的治疗中的表型变异。令人惊讶的是,为SWI检测到的QTL的大约一半的QTL被分布在LG A07上,在SEQ2E06_A轨迹附近的近侧位置处,两个QTL在TC38F01_A基因座附近的远端位置处。对于LGS A07,B02和B05上的QTLS,Fleur11的等位基因在两种水处理中赋予了优越的种子宽度。LG B06上QTL的种子宽度增加与Amphidiploid等位基因有关。为SL检测到四个QTL。位于LG A07上的两个QTL在两种水处理中检测到具有来自Fleur11的有利等位基因,而位于LG A08和A09上的两个QTL具有良好的浇水治疗,具有来自Amphidiploid的有利等位基因。
产量组件
对于两种水处理中的11个产量组分特征,总共26例QTL解释了9.2%至20.6%的表型方差(表3.).每个产量构成性状的qtl数量为1 ~ 5个。在三个对结核有显著影响的qtl中,有两个位于LG a05上的qtl在两种水处理中均被检测到,而在LG b06上的一个qtl则是针对限水处理的(图)1).在所有qtl中,TB的增加均与双二倍体等位基因有关。在水分充足的条件下,在LGs a01和b05上分别检测到PW和SW的QTL。在PW的QTL上,野生等位基因使单株荚果重增加2.6 g。对于SW来说,阳性效应与Fleur11等位基因有关。共检测到4个与HW相关的qtl,其中2个在lga02上,在水分处理上一致;2个在lga05和b06上,在限水处理上一致。在所有qtl中,HW的增加均与双二倍体等位基因有关。有趣的是,LGs a05和b06上HW的qtl与TB的qtl位于相同的基因组区域,表明TB的增加可能与HW的增加有关。在两个水处理中均检测到LG a02上的HI qtl,且与Fleur 11等位基因相关。PN的2个qtl位于lga01和a05上,SN的1个qtl位于lga05上。 On LG a01, a QTL for PN colocalized with the one for PW, and on LG a05 a QTL for SN colocalized with the one for PN (Figure1).PN和SN qtl上的野生等位基因分别促进了单株荚果数和种子数的增加。检测到4个HSW和4个HSW的qtl。在不同水处理上,HSW在LGs a07和b02和HPW在LGs b02和b05上的qtl一致。HSW和HPW的qtl分别解释了35.6%和42.3%的表型变异,且正效应与Fleur11等位基因有关。在LG a01上检测到1个SHW的QTL,并与PW和SN的QTL共定位。该QTL的双二倍体等位基因与SHW增加有关。在水分充足的处理下,LG b03和水分限制的处理下,LG b06和b11上检测到3个提高荚果成熟率的qtl。LGs b03和b11上的QTL阳性效应与双二倍体等位基因相关,而LGs b06上的QTL阳性效应与Fleur11等位基因相关。
QTL与压力耐受指数相关
对于LGS B06和A05上的总生物质(STI)的总生物量(STI),总共13个QTL对LGS B06和A05的总体(STI-TB),LG A05上的豆荚(STI-PW),一个用于种子重量(STI-SW)在LG A05,两个用于LGS A02和A05上的HAULM重量(STI-HW),在LGS B02和B05上进行100个豆荚(STI-HPW),在LGS上为100个种子重量(STI-HSW)A07和B02,两个用于LG A05和A07上的POD编号(STI-PN)和LG A07上的种子数(STI-SN)。这些QTLs单独解释了10.4%至20.1%的表型方差(表3.).在大多数情况下,与计算它们的特性分开的STI相关QTL。一些例外包括LG A05和LG A07上的STI-PW,STI-PN和STI-SN的QTL,其中显然检测到PW,PN和Sn的QTL(图1).STI-HPW和STI-HSW的QTL的正效应与Fleur11等位基因有关。对于其他相关的QTLS,对阳性胶质等位基因有关的正效。
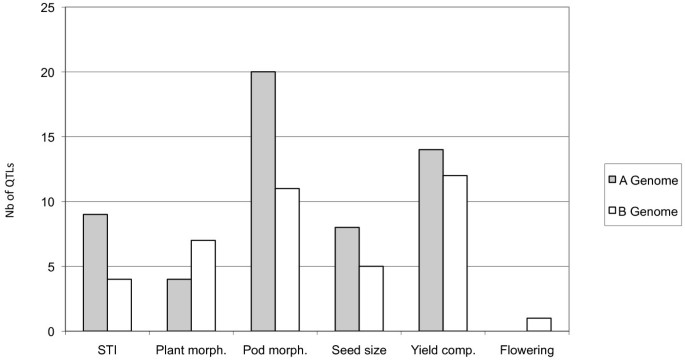
QTL的亚基组学分布
考虑两种水分条件时,每个性状和每个LG的qtl数量分别为1 ~ 11个和0 ~ 20个。未检测到lga06、b01和b09的qtl。共定位到55个qtl,其中LG a07上的qtl最多20个。在B基因组中共检测到40个qtl,其中在LGs b02和b06上的qtl最多为11个。每个性状类别和每个基因组检测到的qtl数量如图所示2.亚基因组上的qtl数量(B基因组为40个,A基因组为55个)没有显著差异(P = 0.12)。结果表明,部分性状的QTL具有亚基因组特异性,包括仅在a基因组上检测到的PL和SL (LGs a07、a08和a09),以及仅在B基因组上检测到的DFL、PMAT和HPW (b02、b03、b05、b06、b07、b11)。QTL分布差异显著(P > 0.001)。最引人注目的例子是同源株LGs a06和b06之间的QTL数量差异(0比11),同源株LGs a07和b07之间的QTL数量差异(20比1)1).此外,除了Pb和pH的QTL,映射到LGS A02 / B02和A04 / B04上的职业区域,对于给定的特征的所有其他QTL映射到不同的作主LGS,从而表示QTL在职业LGS之间的QTL位置的显着不一致。
讨论
在我们的研究中,我们开发了衍生自Fleur11之间的交叉的三交易学的基因群体和两性倍双相之间A. iPaensis.和答:duranensis,代表异源四倍体栽培物种最可能的野生祖先[24那27-29].这种材料使我们能够在两个水资源下映射几个QTL,以便在两个水域下进行重要的农艺性状,以探讨野生物种的有用等位基因的储层,分析对定量性状变异的群组合贡献,并鉴定与驯化相关的染色体区域。
花生野生亲属代表了花生改善的有用等位基因储层
花生野生亲缘系长期以来一直被用作重要的抗病基因库。利用直接野生二倍体×栽培或通过野生二倍体×栽培杂交将抗病基因导入栽培种已成功用于花生改良[65.-67.].然而,由于缺乏分子资源和定位群体资源,利用花生野生亲缘来分析在正常和水分限制条件下的产量等更复杂性状的分子基础受到了阻碍。
本研究采用AB-QTL定位方法,对花生野生物种在栽培花生重要农艺性状上的遗传潜力进行了评估。共检测到95个qtl。大约一半的QTL正效应与双二倍体等位基因有关。这些qtl解释了大部分表型变异,对一些有价值的农艺性状如开花早熟(9.0%)、单株荚果重(11.7%)、单株荚果数(9.0% ~ 14.2%)、单株种子数(14.4%)、荚果大小(8.0% ~ 22.0%)、种子大小(11.3%)、种子大小(11.3%)等性状有积极的贡献。荚果成熟度9.5%,生物量产量9.0% ~ 17.0%。与荚果和种子大小、荚果成熟度和生物量增加有关的几个qtl是特定于水分限制处理的。
我们观察到不同水分处理的qtl高度一致。如荚果、种子大小和产量构成的25个qtl中,有17个(68.0%)在不同水分处理的基因组定位上保持一致。QTL在不同水分处理中表现出的稳定性可能是由于在试验期间发生了较晚的严重胁迫,导致G × E值较低,从而导致QTL × E互作。然而,我们实验中的最终压力代表了萨赫勒地区最常见的干旱事件[54.那68.].
我们使用应力耐受索引(STI)用于在良好浇水和水胁迫条件下破译产量性能的分子基础,因为这些指标被认为是鉴定结合高产量和应力耐受潜力的基因型的良好标准[57.].此外,据报道,在花生中,STI的产量与干旱下的产量之间存在正相关[53.那69.].十三QTL被映射到与STI相关的特征。在九个QTL时注意到的积极效果来自Amphidiploid。大多数QTL用于STI相关的特征,其与计算它们的特性的QTL合作。这表明,如上所述,浇水和有限的水处理下的性能之间的正相关关系。特别兴趣的是LG A07上的STI-PN和STI-SN QTL,其映射在基因组区域上,其中映射了PN和SN的QTL。此外,它们与STI-HSW QTLS和其他几种QTL共同定位,这些QTL涉及在含水量和有限的水处理的种子大小下的种子大小增加。对于STI-Pn和STI-Sn的QTLS的有利等位基因来自Amphidiploid,而在该区域中,在该区域中的阳性等位基因在所有检测到的QTL中来自Fleur11。这表明这是一个关键区域,可以参与维持大型种子和在水胁迫下产生更多种子之间的权衡。在培养的等位基因结构中,可以获得大尺寸的种子的生产,而在野生配置中将是种子数。
这些结果表明,花生野生亲属是改善在含水量和有限条件下的重要农业性状的宝贵来源。
相同性状的qtl主要分布在非同源区域
在我们的研究中,最显著的结果是同源LGs的QTL分布差异巨大,同源LGs之间缺乏QTL一致性,而花生A和B基因组之间有良好的共线性报道[51.那70那71.].相同性状的QTL在非职业区域的96%的病例中映射。由于在两个基因组中缺乏在一个基因组中缺乏分离等位基因而导致的非职业QTL位置可能导致两种亚因素中的不同基因的自然和/或人类驱动的选择。这些结果也可以通过基因表达中的基因表达和/或通过基因的运动来解释,导致离殖性破坏的基因的运动,因为杂交和/或同种异体四倍化。
在多倍体小麦中报道了基因的运动,导致多倍体的性能破坏[72.通过同源BAC序列比较。基因表达的变化,包括基因组特异性基因沉默、同源基因的不平等表达、基因的新功能或亚功能化,已经在小麦、棉花和芸苔属等多种异源多倍体中得到了广泛的研究[73.].在棉花中,A和D亚基因组表达的高度变异已被报道[74.-76.].此外,荣et al。[77.报道了四倍体棉花的A和D亚基因组在大部分非同源位点贡献了棉纤维发育的qtl。然而,在六倍体小麦中,一些作者已经描述了同源LG上相同性状的qtl定位[78.-80].这表明,亚基因组对qtl的贡献可能取决于多倍体谱系。
关键形态性状qtl的聚类分析:驯化足迹
作物与其野生祖先显著的表型差异被称为驯化综合症。
在本研究中,我们认为种子和荚果大小(SWI、SL、PWI和PL)、100粒种子和荚果重(HSW、HPW)、荚果缢缩(PC)和植物生长习性(GH)是花生驯化综合征的主要相关性状。这些性状的遗传力为0.71 ~ 0.90。共检测到53个qtl。其中半数以上聚集在LGs a07(11个qtl)、b02(10个qtl)、b05(8个qtl) 3个基因组区域。所有对HSW和HPW有主要影响的qtl,大部分对PWI、SWI和SL有影响的qtl,以及一个对PC和GH有影响的qtl都在这三个基因组区域中被定位。这些qtl单独解释了10.0% ~ 26.0%的表型变异,且有利等位基因均来自栽培种。其他参与PC和GH变异的qtl在10个不同的LGs上单独或与PWI、SWI、PL和SL效应较低的qtl聚类。荚果大小、种子大小、HSW、HPW等性状与其相关qtl的聚类高度相关,表明在每个区域中,这些性状变异是由一个多效效应基因或数量有限的连锁基因造成的。
影响荚果和种子大小的qtl集中在三个基因组区域,而影响植物和荚果形态的qtl则分散在整个基因组区域。考虑数量和分布的主要植物形态学和pod收缩遗传图谱和原始增长习惯和收缩深处仍然存在于花生种植物种,这些特征不太可能被人类选择的主要焦点在驯化的初期阶段。花生驯化的早期可能是在LGs a07、b02和b05的QTL群中固定了增加荚果和种子大小的等位基因。植物生长习性和荚果形态的初步改变可能与荚果和种子大小的增加共同开始,因为这些性状的qtl在同一簇中发现。随后的改进可能与植株生长习性向直立型的修饰、荚果形态的修饰以及其他qtl荚果和种子大小的增加有关。这些改良可能发生在不同的时间和地点,可能是花生亚种间形态差异的原因。我们对有限数量的驯化相关qtl及其在花生基因组特定区域的聚类结果与包括番茄在内的广泛作物的报道一致[81)、玉米(82], 白饭 [83], 小麦 [84和豆子[46.].我们的结果可以使用尺寸更大的群体进一步确认,因为至少在向日葵的情况下,对于驯化相关的特征,许多QTL的许多QTL进行映射[47.].
比较QTL分析是揭示植物家族驯化遗传基础的有力工具。在谷物中,特别是在玉米、高粱和水稻中,定位于同系区域的少量qtl控制着一些驯化性状[85].在茄科,Doganlaret al。[86报道称,与茄子果实重量、形状和颜色相关的基因座中,有40%在番茄、土豆和/或辣椒中存在假定的同源基因座。然而,在豆科植物中,茄子[87认为,虽然在豌豆和常见的豆类驯化期间已经改变了类似数量的基因,但这些基因是不同的。然而,这些作者表明,负责种子重量,光周期敏感性和种子休眠的基因可能涉及同源或直晶序列。种子重量是豆科州驯化中最重要的性状之一[48.].豆类物种的比较QTL分析表明,种子重量的QTL位于原始地区莲花LG 2,大豆LG b1,豌豆LG I,鹰嘴豆LG 8 [88].近年来对豆科共系的研究表明莲花LG2与落花生LG 7及LG 5 [89那90].这两个落花生与本研究中携带种子大小QTL区域的LG a07和b05共线。这些结果表明,同源区可能参与了花生和几种豆科植物种子重量的遗传控制。通过对这些豆科植物种子大小qtl的定位和基因克隆,可以进一步研究这些豆科植物种子大小qtl的同源性。
结论
此手稿报告了对花生生产力和驯化中涉及的若干特征的详细QTL分析,使用狂野×培养先进的回复人口。我们在两个水处理中共映射了95个QTL。野生等位基因对许多贵重物系的积极变化贡献了积极的变化,例如开花预录,种子和豆荚,长度和尺寸以及豆荚成熟度。我们还映射了花生驯化相关QTL,并提出了在驯化过程中的关键特征的临时固定序列,可以解释花生亚种之间的形态差异。在我们的研究中,我们还表明花生A和B子组织作为多倍化的可能后果,将QTL贡献了QTL。我们对野生物种对花生改善的积极贡献的调查结果与许多其他作物报告的内容一致,并为利用花生野生物种剩余的有用等位基因储层提供了新的机会。
参考文献
- 1.
多倍体的基因组进化。植物生态学报。2000,42(4):497 - 503。10.1023 /: 1006392424384。
- 2.
Adams KL,Wendel JF:植物中的多倍体和基因组进化。CurrOp植物BIOL。2005,8:135-141。10.1016 / J.PBI.2005.01.001。
- 3.
多倍性:周期性形成和基因组进化。生态学报。1999,14:348-352。10.1016 / s0169 - 5347(99) 01638 - 9。
- 4.
Paterson AH:多倍体、进化机会和作物适应。acta photonica sinica, 2005, 32(4): 441 - 446。10.1007 / s10709 - 003 - 2742 - 0。
- 5。
多倍性与作物改良。作物科学,2006,46:S-3-14。
- 6。
Fawcett JA, Maere S, Van de Peer Y:具有双基因组的植物可能有更好的机会在白垩纪-第三纪灭绝事件中存活下来。美国国家科学院学报。2009年,106:5737 - 5742。10.1073 / pnas.0900906106。
- 7。
Soltis de,Albert VA,Leebens-Mack J,Bell CD,Paterson Ah,Zheng C,Sankoff D,Depamphilis CW,Wall PK,Soltis PS:多倍体和AgeniSperm多样化。我是J机器人。2009,96:336-348。10.3732 / AJB.0800079。
- 8.
Kochert G,Stalker Ht,Gimenes Ma,Galgaro Ml,Lopes Cr,Moore K:RFLP和细胞遗传学证据对同种异体浸入花生的原始和演化,落花生hypogaea(豆科).中国海洋大学学报(自然科学版)。10.2307 / 2446112。
- 9.
Dwivedi SL, Bertioli D, Crouch JH, Valls JFM, Upadhyaya HD, Favero AP, Moretzsohn MC, Paterson AH:花生。植物基因组定位与分子育种。编辑:Kole C. Springer-Verlag。柏林,海德堡;2: 2007:115 - 151。10.1007 / 978 - 3 - 540 - 34388 - 2 _3。
- 10.
花生栽培过程中多态DNA标记的鉴定落花生hypogaeal .)。Euphytica。1997,97:143-149。10.1023 /答:1002949813052。
- 11.
Hopkins Ms,Casa Am,Wang T,Mitchell Se,Dean Re,Kochert Gd,Kresovich S:在花生中发现和表征多态简单序列重复(SSR)。农作物科学。1999年,39:1243-1247。10.2135 / cropsci19999.0011183x003900040047x。
- 12.
Gimenes M,Hoshino A,Barbosa A,Palmieri D,Lopes C:栽培花生微卫星标志物的表征和可转移性(落花生hypogaea).生物谷bioon . 2007, 7: 9-10.1186/1471-2229-7-9。
- 13.
陈志强,陈志强,陈志强,等:新型微卫星标记的分离、鉴定及其在栽培花生多样性评价中的应用(英文)落花生hypogaea).植物生态学报。2008,8:55-10.1186/1471-2229-8-55。
- 14.
梁旭,陈旭,洪勇,刘辉,周刚,李树,郭斌:est - SSR标记在花生栽培中的应用落花生hypogaea土地落花生野生物种。BMC植物BIOL。2009,9:35-10.1186 / 1471-2229-9-35。
- 15.
Varshney R,Bertioli D,Moretzsohn M,Vadez v,Krishnamurthy L,Aruna R,Nigam S,Moss B,Seetha K,Ravi K,He G,Knapp S,Hoiseton D:培养地生的第一个基于SSR的遗传联系地图(落花生hypogaeal .)。Al Appl Genet。2008,118:729-739。
- 16。
洪Y,陈X,梁X,刘H,周G,Li S,Wen S,Holbrook CC,Guo B:栽培花生的SSR基复合遗传联系地图(落花生hypogaeal .)基因组。生物谷bioon . 2010, 10: 17-10.1186/1471-2229-10-17。
- 17。
Ravi K, Vadez V, Isobe S, Mir RR, Guo Y, Nigam SN, Gowda MVC, Radhakrishnan T, Bertioli DJ, Knapp SJ, Varshney RK:花生耐旱相关性状的几个小主效qtl和大量上位性qtl的鉴定(落花生hypogaeal .)。Al Appl Genet。2010,122:1119-1132。
- 18。
花生与野生亲缘植物的同工酶变异及其亲缘关系(落花生l . - - - - - -豆科).《中国科学院院刊》1993年第5期。
- 19.
RAPD和ISSR是花生遗传多样性分析、品种鉴定和系统发育关系的有用遗传标记。落花生hypogaea)栽培品种和野生种。基因组学。2001,44:763-72。
- 20.
Gimenes MA, Lopes CR, Galgaro ML, Valls JFM, Kochert G:断面物种遗传变异的RFLP分析落花生,属落花生(豆科).Euphytica。2002,123:421-429。10.1023 /答:1015033700110。
- 21.
Moretzsohn M, Hopkins M, Mitchell S, Kresovich S, Valls J, Ferreira M:花生遗传多样性(落花生hypogaeaL.)及其野生亲属,基于基因组高变区分析。BMC植物BIOL。2004,4:11-10.1186 / 1471-2229-4-11。
- 22.
Tallury SP, Hilu KW, Milla SR, Friend SA, Alsaghir M, Stalker HT, Quandt D:基因组亲和落花生部分落花生(蝶形花科):分子和细胞遗传学证据。Al Appl Genet。2005,111:1229-1237。10.1007 / S00122-005-0017-0。
- 23.
辛格kp,singh a,raina sn,singh ak,ogihara y:核糖体DNA重复单位多态性和花生中的遗传性(落花生hypogaea植物资源及近缘野生种。中国科学:地球科学。2002,23(4):421 - 427。10.1023 /: 1014966101927。
- 24.
Seijo G, Lavia GI, Fernandez A, Krapovickas A, Ducasse DA, Bertioli DJ, Moscone EA:栽培花生(arachis hypogaea,豆科植物)它的近亲透露了双重Gish。我是J机器人。2007,94:1963-1971。10.3732 / ajb.94.12.1963。
- 25。
Robledo G, Lavia G, Seijo G:野生物种间的亲缘关系落花生通过FISH定位rDNA位点和异染色质检测发现A基因组的物种。应用电子学报。2009,18:1295-1307。10.1007 / s00122 - 009 - 0981 - x。
- 26。
Robledo G,Seijo G:野生B基因组中的物种关系落花生物种(部分落花生)基于RDNA基因座和异铬胺检测的鱼类测绘:基因组排列的新提案。Al Appl Genet。2010,121:1033-1046。10.1007 / s00122-010-1369-7。
- 27。
Milla Sr,Isleib Tg,Stalker HT:分类物系之间的关系落花生教派。落花生的AFLP标记。基因组学杂志。2005,48:1-11。10.1139 / g04 - 089。
- 28。
burrow MD, Simpson CE, Faries MW, Starr JL, Paterson AH:最近描述的B-和a基因组的分子生物地理研究落花生这也为花生的起源提供了新的见解。基因组学杂志。2009,52:107-119。10.1139 / g08 - 094。
- 29.
Favero AP,SIMPSON CE,Valls JFM,Vello Na:通过可与可磁性研究的可联合性研究研究培养花生的演变arachis ipaensis.,一个。Duranensis.和A.hypogaea..农作物科学。2006,46:1546-1552。10.2135 / cropsci2005.09-0331。
- 30。
Reddy AS, Reddy LJ, Mallikarjuna N, Abdurahman MD, Reddy YV, Bramel PJ, Reddy DVR:花生芽坏死病毒(PBNV)野生抗性鉴定落花生种质。Ann Appl Biol。2000,137:135-139。10.1111 / J.1744-7348.2000.TB00045.x。
- 31。
Sharma Sb,Ansari Ma,Varaprasad Ks,Singh Ak,Reddy LJ:抵抗力有是在野生落花生物种*。植物营养与肥料学报,2003,22(4):537 - 541。10.1023 /: 1008754812257。
- 32。
潘德·S,饶·金:对野生的抵抗落花生温室试验中晚叶点和锈病的种类。植物DIS。2001,85:851-855。10.1094 / PDIS.2001.85.8.851。
- 33。
Dwivedi SL, Pande S, Rao JN, Nigam SN:种间衍生物对晚叶斑病和锈病的抗性成分及其在花生叶面抗病育种中的意义(落花生hypogaeal .)。acta physica sinica, 2002, 31(4): 481 - 488。10.1023 /: 1015707301659。
- 34.
Leal-Bertioli S, Jose AC, alvesfreitas D, Moretzsohn M, Guimaraes P, Nielen S, Vidigal B, Pereira R, Pike J, Favero A, Parniske M, Varshney R, Bertioli D:控制疾病抗性的候选基因组区域的鉴定落花生.BMC植物BIOL。2009,9:112-10.1186 / 1471-2229-9-112。
- 35.
SIMPSON CE,Starr JL:注册“浣熊”花生。农作物科学。2001,41:918-10.2135 / Cropsci2001.413918x。
- 36.
Simpson Ce,Starr Jl,Church Gt,Burow Md,Paterson啊:注册“Nematam”花生。农作物科学。2003年,43:1561-10.2135 / Cropsci2003.1561。
- 37.
Garcia GM, Tallury SP, Stalker HT, Kochert G:分子分析落花生种间杂交。应用电子学报。2006,12:1342-1348。10.1007 / s00122 - 006 - 0236 - z。
- 38.
Tanksley SD,McCouch SR:种子银行和分子图:从野外解锁遗传电位。科学。1997年,277:1063-1066。10.1126 / Science.277.5329.1063。
- 39。
Gur A,Zamir D:未使用的自然变异可以提升植物育种的产量障碍。Plos Biol。2004,2:E245-10.1371 / journal.pbio.0020245。
- 40.
Hajjar Hodgkin:使用野生亲属在作物改进:过去20年的发展调查。Euphytica。2007,156:1-13。10.1007 / s10681-007-9363-0。
- 41.
Tanksley SD,Grandilto S,Fulton TM,Zamir D,Eshed Y,Petiard v,Lopez J,Beck-Bunn T:番茄精英加工线和野生相对L之间的交叉前进的QTL分析。pimpinellifolium..《中国科学院院刊》1996年第1期。10.1007 / BF00223378。
- 42.
Swamy BPM,Sarla N:从野生物种中产生增强定量特质基因座(QTL)。Biotechnol Adv。2008,26:106-120。10.1016 / J.BioteChAdv.2007.09.005。
- 43.
帕特森啊:QTL映射有什么教导我们关于植物驯化?新植物。2002,154:591-608。10.1046 / J.1469-8137.2002.00420.x。
- 44.
汉默:这是家庭综合症。《文化》,1984,32:11-34。10.1007 / BF02098682。
- 45.
Harlan JR:驯化的起源和过程。草进化和驯化。G.P.查普曼。剑桥大学出版社;1992年:159-175。
- 46.
普通豆类驯化综合征的遗传控制。作物科学,1996,36:1037-1045。10.2135 / cropsci1996.0011183X003600040037x。
- 47.
杨志刚,杨志刚,杨志刚:向日葵驯化的遗传分析。遗传学杂志。2002,161:1257。
- 48.
Gepts P:作为长期选择实验的庄稼归化。植物品种rev.2004,24:1-44。
- 49。
Pickersgill B:美洲植物的驯化:孟德尔和分子遗传学的见解。《中国科学院院刊》2007年第1期。10.1093 / aob / mcm193。
- 50.
Krapovickas A,Gregory W:CaxonomíadelGénero落花生(豆科).1994, 8: 1-186。
- 51.
Foncéka D, Hodo-Abalo T, Rivallan R, Faye I, Sall MN, Ndoye O, Fávero AP, Bertioli DJ, Glaszmann J-C, Courtois B, Rami J-F:野生渗入到栽培花生的遗传定位:一种扩大最近一种异源四倍体遗传基础的方法。植物学报。2009,33(6):693 - 698。
- 52.
Reddy Ty,Reddy VR,Anbumozhi V:Groudnut的生理反应(落花生hypogeaL.)干旱压力及其改善:批判性评论。植物生长调节。2003,41:75-88。10.1023 /答:1027353430164。
- 53.
Clavel D, Drame NK, Roy-Macauley H, Braconnier S, Laffray D: 4种萨赫勒地区花生对干旱的早期响应与田间干旱适应的分析(落花生hypogaeal .)品种。环境科学学报。2005,54:219-230。10.1016 / j.envexpbot.2004.07.008。
- 54。
Clavel D, Sarr B, Marone E, Ortiz R:西班牙落花生品种的潜在农艺生理特性(落花生hypogaeaL.)作为循环终止干旱条件下的选择标准。农艺知。2004,24:101-111。10.1051 / Agro:2004006。
- 55。
Sarr B, Lecoeur J, Clouvel P:糖果花生的灌溉调度(落花生hypogeaeaL.)在塞内加尔使用简单的水平衡模型。农业局管理。2004,67:201-220。10.1016 / J.AGWAT.2004.01.004。
- 56。
IBPGR, ICRISAT:花生的描述。罗马,意大利和帕坦切鲁,美联社,印度:Int。中国植物遗传资源委员会。半干旱热带作物研究所;1992.
- 57。
Fernandez GCJ:评估压力耐受的选择标准。温度和水胁迫下蔬菜和其他粮食作物适应的国际研讨会。Taïwan:Kuo C.G.,1992:257-269。
- 58.
R开发核心团队:R:统计计算的语言和环境。奥地利维也纳;2010.
- 59.
吴海涛,吴海涛,吴海涛等:R/qtl:杂交组合的qtl定位。生物信息学。2003,19:889-890。10.1093 /生物信息学/ btg112。
- 60.
MDM:在复杂的育种方案中计算完全信息性基因型频率的程序。何立德。2002,93:227-8。10.1093 / jhered / 93.3.227。
- 61.
邱吉尔(Churchill GA, Doerge RW):数量性状作图的经验阈值。遗传学。1994,138:963-971。
- 62.
Broman KW,Senś:带有R / QTL的QTL映射指南。Springer verlag;2009年。
- 63.
Sadras Vo,Milroy SP:叶膨胀和煤气交换响应的土壤 - 水阈值:综述。现场裁剪。1996,47:253-266。10.1016 / 0378-4290(96)00014-7。
- 64.
Boote KJ:花生生长阶段(落花生hypogaeal .)。花生科学。1982,9:35-40。10.3146 / I0095-3679-9-1-11。
- 65.
跟物HT:利用落花生cardenasii作为一个来源尾孢属花生改善的叶斑抗性。Euphytica。1984,33:529-538。10.1007 / bf00021154。
- 66.
从种间花生杂交衍生出的群体的循环选择进展。《自然》1991,52:79-84。
- 67.
Garcia Gm,Stalker HT,Shroeder E,Kochert G:鉴定RAPD,瘢痕和RFLP标记与线虫抗性基因紧密相关的RAPD,瘢痕和RFLP标记落花生cardenasii成落花生hypogaea.基因组学。1996,39:836-45。10.1139 / g96 - 106。
- 68.
王志强,王志强,王志强:萨赫勒地区花生品种季末耐旱性评价。中国农业科学,1995,21(4):457 - 461。10.1017 / S0021859600074529。
- 69.
Songsri P,Jogloy S,Kesmala T,Vorasoot N,Akkasaeng C,Patanothai A,Holbrook CC:抗旱性性质的可遗传性和抗旱性抵抗和花生农艺性状的相关性。农作物科学。2008,48:2245-2253。10.2135 / cropsci2008.04.0228。
- 70。
花生染色体从合成二倍体向栽培花生的传递遗传学研究(落花生hypogaeal .)。拓宽单味多倍体物种的基因库。遗传学。2001,159:823-37。
- 71。
Moretzsohn M, Barbosa A, Alves-Freitas D, Teixeira C, Leal-Bertioli S, Guimaraes P, Pereira R, Lopes C, Cavallari M, Valls J, Bertioli D, Gimenes M:花生(豆科)b基因组及其与A基因组同位的连锁图谱。植物营养与肥料学报。2009,9:40-10.1186/1471-2229-9-40。
- 72.
高胜,顾玉强,吴杰,科曼- derr D,霍宁,Crossman C,贾杰,左强,任志,Anderson OD,孔旭:多倍体小麦基因组中含有多个prolamin基因的基因组区域的快速进化和复杂结构。植物营养与肥料学报。2007,32(6):759 - 762。10.1007 / s11103 - 007 - 9208 - 1。
- 73.
Doyle JJ, Flagel LE, Paterson AH, Rapp RA, Soltis DE, Soltis PS, Wendel JF:植物基因组合并和加倍的进化遗传学。2008, 42: 443-461。10.1146 / annurev.genet.42.110807.091524。
- 74.
Adams KL,Cronn R,Percifield R,Wendel JF:由多倍体复制的基因对转录组和特定器官的互敏沉默表示不等贡献。美国国家科学院学报。2003,100:4649-4654。10.1073 / pnas.0630618100。
- 75.
jodhary B, Flagel L, Stupar RM, Udall JA, Verma N,施普林格NM, Wendel JF:多倍体棉花同源基因的互作沉默、转录偏好性和功能分化Gossypium.).遗传学。2009,182:503-517。10.1534 / genetics.109.102608。
- 76.
鞭毛乐,Wendel JF:异种情况下的进化率变化,基因组优势和重复基因表达演变。新植物。2010,186:184-193。10.1111 / J.1469-8137.2009.03107.x。
- 77.
荣J, Feltus FA、Waghmare VN皮尔斯GJ, Chee PW, Draye X, Y分明,赖特RJ,威尔金斯助教,可能OL,史密斯连续波,Gannaway JR万德尔摩根富林明,帕特森啊:多倍体棉花QTL的荟萃分析显示不平等的贡献subgenomes复杂网络的基因和基因集群涉及棉绒纤维的发展。中国生物医学工程学报。10.1534 / genetics.107.074518。
- 78。
关键词:小麦,农艺性状,QTL分析,Courtot ×中国春品种间分子标记连锁图谱中国科学(d辑):地球科学(英文版)。
- 79。
朱昌刚,徐胜,傅立森。小麦双单倍体群体全基因组ssr和诱捕定位及农艺性状QTL鉴定。生物技术学报。2008,22:251-266。10.1007 / s11032 - 008 - 9171 - 9。
- 80。
Quarrie SA, Steed A, Calestani C, Semikhodskii A, Lebreton C, Chinoy C, Steele N, Pljevljakusić D, Waterman E, Weyen J, Schondelmaier J, Habash DZ, Farmer P, Saker L, Clarkson DT, Abugalieva A, Yessimbekova M, Turuspekov Y, Abugalieva S, Tuberosa R, Sanguineti M-C, Hollington PA, Aragués R, Royo A, Dodig D:六倍体小麦的高密度遗传图谱(小麦L.)来自CrossChin备的Spring×SQ1及其用于比较QTL在一系列环境中进行谷物产量。Al Appl Genet。2005,110:865-880。10.1007 / S00122-004-1902-7。
- 81。
关键词:番茄,果实大小,形状,遗传变异计算机应用。1999,99:978-987。10.1007 / s001220051405。
- 82。
基于玉米大刍草回交资源驯化位点的连锁定位。基因工程学报。2007,31(4):429 - 434。10.1534 / genetics.107.076497。
- 83.
《水稻驯化的复杂历史》。张志强。2007,100:951-957。10.1093 / aob / mcm128。
- 84.
Peng J,Ronin Y,Fahima T,Röderms,李Y,Nevo e,Korol A:驯化在小麦祖的小麦Dicoccoides中的定量特质基因座。美国国家科学院学报。2003,100:2489-2494。10.1073 / PNAS.252763199。
- 85.
林永荣,李志,李志平,刘世昌,李志平:通过相应基因位点的独立突变实现谷类作物的趋同驯化。科学。1995,269:1714-1718。10.1126 / science.269.5231.1714。
- 86.
Doganlar S,Frary A,Daunay M-C,Lester RN,Tanksley SD:基因功能的保护茄科如茄子中驯化性状的比较映射所揭示。遗传学。2002,161:1713-1726。
- 87.
禾兰属植物:伴随禾兰驯化的遗传变化Pisum一豆科植物的“驯化综合症”是否有共同的遗传基础?《中国科学院院刊》2007年第1期。10.1093 / aob / mcm122。
- 88.
Gondo T,Sato S,Okumura K,Tabata S,Akashi R,Isobe S:模型豆类多重农艺性状的定量特征轨迹分析Lotus对虾.基因组学。2007,50:627-637。10.1139 / g07 - 040。
- 89.
Hougaard BK,Madsen LH,Sandal N,De Carvalho Moretzsohn M,Fredslund J,Schauser L,Nielsen Am,Rohde T,Sato S,Tabata S,Bertioli DJ,Stougaard J:豆类锚标在phoudolusulus寻常,莲花japonicus,medicago truncatula和arachis.中国生物医学工程学报。10.1534 / genetics.108.090084。
- 90.
Bertioli D, Moretzsohn M, Madsen L, Sandal N, Leal-Bertioli S, Guimaraes P, Hougaard B, Fredslund J, Schauser L, Nielsen A, Sato S, Tabata S, Cannon S, Stougaard J:共同性分析落花生与莲花和Medicago.阐明了豆类基因组结构,稳定性和演化的新光。BMC基因组学。2009,10:45-10.1186 / 1471-2164-10-45。
致谢
作者非常感谢Angelique D'Hont和David Pop,为您的稿件以及Delphine Luquet进行批判,以便在分析土壤水数据方面的帮助下。本研究由Cirad和一代挑战计划资助。
作者信息
从属关系
通讯作者
额外的信息
作者的贡献
DF设计和协调了这项研究,参与了人口发展、实地评价、基因分型数据制作,进行了数据分析并起草了手稿,HAT参与了人口发展和实地人口评价,IF和ON参与了实地人口评价,RR和HV参与了基因分型数据的生成,MCM参与了本研究中使用的SSR标记的开发,DJB和JCG参与了本研究的设计,BC参与了手稿的编辑和数据分析。JFR构思、设计和协调了这项研究,参与了数据分析和手稿的编辑。所有作者都已阅读并批准了最终稿。
电子辅料
12870 _2011_992_moesm1_esm.pdf
附加文件1:图S1。含水量和有限的水平治疗中的人口评估过程中的FTSW变异。R5至R8对应于花生生殖阶段。I至III对应于压力强度水平。(PDF 35 KB)
12870_2011_992_moesm2_esm.pdf.
附加文件2:图S2。在人口中测量的特征的分布。黑色箭头代表培养的父级Fleur11的价值。(PDF 307 KB)
作者的原始提交的图像文件
权利和权限
开放获取本文在“生物资源”中央有限公司的许可下公布了这是一个开放式访问条款,分配根据创意公约归因许可证的条款(https://creativecommons.org/licenses/by/2.0.),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
Fonceka,D.,Tossim,Ha。,Rivallan,R.et al。花生的驯化和遗留等位基因:种间QTL定位揭示了驯化足迹和育种有用的自然变异。BMC植物BIOL.12,26日(2012年)。https://doi.org/10.1186/1471-2229-12-26
已收到:
公认:
发表:
关键字
- 产量组件特征
- 野生二倍体物种
- 强调宽容指数
- 高级回复人口
- 植物生长的习惯