- 研究文章
- 开放获取
- 发表:
组合分析来自R2R3Myb, bHLH和WDR家族的lupulin腺体转录因子,表明其调控复杂chs啤酒花丙烯类黄酮合成的关键基因h1 (忽花布l .)
植物生物学体积12,文章编号:27(2012)
摘要
背景
啤酒花的Lupulin腺体产生一种特殊的代谢组,包括啤酒花苦酸和对酿造过程有价值的丙烯类黄酮,具有很好的健康有益作用。转录因子(TF)介导的对关键酶之一查尔酮合成酶(CHS_H1)低聚家族调控的详细分析,是解剖导致这些化合物积累的生物合成途径的重要组成部分。查尔酮合成酶是啤酒花中丙烯类黄酮的直接前体,能够有效催化柚皮苷查尔酮的生成。
结果
黄酮调节转录因子的同源物HlMyb2(平方米),HlbHLH2(B2)和HlWDR1(W1)从啤酒花品种Osvald’s 72中克隆得到。使用“组合”瞬时GUS表达系统,我们发现这些独特的与lupulin-gland相关的tf显著激活了的启动子(P)chs_H1在B2, W1和M2或前面描述的三元组合中霍奇金淋巴瘤Myb3 (M3)。启动子的激活强烈依赖于Myb-P结合盒TCCTACC在其5'端区域有一个核心序列CCWACC,似乎启动子的复杂性起着重要作用。m2b2w1介导的激活明显超过了自身的表达强度chs_H1基因由CaMV的35S启动子驱动,M3B2W1导致了30%的35S:chs_H1表达水平,用real-time PCR定量。另一个新克隆的跳跃TF,霍奇金淋巴瘤Myb7含有转录阻滞剂样基序pdLNLD/ELxiG/S (PDLNLELRIS),被认为是一种有效的抑制chs_H1-activating TFs。啤酒花和啤酒花的比较分析答:芥tf显示P的复杂活化chs_H1和Pchs4 .组合或独立的方式。
结论
通过对各种不同的lupulin腺体特异性转录因子的序列和功能的研究,我们可以深入了解其调控的复杂特征chs_H1基因,依赖于R2R3Myb、bHLH和WDR TF同源物组合的可变激活和Myb阻遏剂的抑制。
背景
跳(忽花布L.)植物主要为酿酒业栽培,作为包含在lupulin腺体中的味道活性次级代谢物的来源,即在啤酒花雌性花序(球果)中发育的腺状毛状体。此外,啤酒花在传统医学中已经被人们熟知了很长时间,最近,由于其非常有趣的药用特性,包括啤酒花苦酸和丙烯化类黄酮在内的一些lupulin代谢组中的化合物受到了特别的关注,例如,[1- - - - - -3.].黄胡酚(X),是lupulin腺体中主要的戊酰化查尔酮,是一种迷人的癌症化学预防化合物,在癌变的所有阶段表现出广谱的抑制机制[4].尽管X的生物利用率很低[2,5- - - - - -7],在肝脏等特定靶组织中获得了有趣的体内抗炎结果[8].另一种由狼疮素衍生的丙烯基类黄酮,8-丙烯酰柚素(8-PN),是迄今为止已知的最有效的植物雌激素之一[9,10].连同它的前体异氧花腐酚(异氧花腐酚可在体内被肠道菌群代谢为8-PN) [11],这些化合物被认为是啤酒花提取物的活性成分,旨在缓解更年期症状[12,13].
在啤啤花球果中,作为戊烯类黄酮前体的核桃苷查尔酮的生物合成归因于编码CHS_H1蛋白的基因具有所谓的“真”查尔酮合成酶(EC 2.3.1.74)活性,该基因通过丙二酰辅酶a和丙二酰辅酶a的缩合有效催化核桃苷查尔酮的生成p-coumaroyl-CoA [14,15].此外,重组CHS_H1可以利用异戊基和异丁基辅酶a底物,尽管速率较低,因此也可以参与啤酒花苦酸的生物合成[15].CHS_H1由一个在跳果中有特异性表达的基因家族编码[16].其他与狼疮素腺相关的查尔酮合成酶样酶已被描述。例如,缬甲酮合成酶[17是一种酶,可被认为是啤酒花苦味生物合成的主要成分。vps样同源物CHS4在狼疮素腺体中也有高表达,但该酶不催化柚皮素查尔酮的形成,其功能目前仍不清楚[15,18].
启动子元素的复杂性chs_H1基因提示有几种类型的转录因子(tf)参与,主要来自Myb、bHLH和bZip家族[16,19- - - - - -21],以独立或组合的方式[22].在最近的几篇综述中,已经描述了tf在类黄酮生物合成途径调控中的独立或组合活性[23- - - - - -26].三种tf,即R2R3Myb (M), bHLH (B)和WDR (W),通过蛋白质相互作用形成三元配合物(MBW配合物)发挥组合激活作用[26].这种MBW复合体组织严密,每个亚基都有特定的功能,如与DNA结合、激活靶基因的表达或稳定转录因子复合体[23].在黄酮类化合物的生物合成途径中发现了明显的MBW配合物拟南芥而且佩妮矮牵牛分别作为TT2/TT8/TTG1复合物(Transparent Testa 2/Transparent Testa 8/Transparent Testa Glabra 1)驱动种皮着色[27,28和调节花冠中花青素积累的三倍组合复合体AN2/AN1/AN11(花青素2/1/11);有关评论,请参见[23,26,29].在豌豆中,三元配合物对类黄酮生物合成途径的调控也已被证实[30.),Lotus对虾[31,并已被提议白苏子[32,日本牵牛花[33,葡萄藤[34),Pyrus[35].
除了三重组合外,使用异位TF表达分析的经典遗传或分子遗传研究中的许多例子已经证明或预测了由来自R2R3Myb、bHLH和WDR类的两个TF组成的二元复合物增强的类黄酮生物合成[34,36- - - - - -40].
为了跳chs_H1基因,直接启动子激活的异源PAP1 TF拟南芥而且霍奇金淋巴瘤bZIP1和霍奇金淋巴瘤先前使用瞬态表达系统演示了来自跳点的bZIP2 tf [16,21].两跳R2R3Myb tf,即;霍奇金淋巴瘤Myb1和霍奇金淋巴瘤Myb3,在我们之前的研究中已经被描述过[19,20.]和引起的各种生物效应霍奇金淋巴瘤Myb3亚变异已在异源转基因基因中被证实[20.].尽管根据序列相似性和在跳果中的特异性表达,这些Myb tf被认为参与了lupulin代谢组的产生[19,20.,它们对激活的影响chs基因还没有得到详细的研究。
在目前的工作中,我们克隆了新的lupulin特异性tf,并通过组合瞬时表达试验表明霍奇金淋巴瘤bHLH2和霍奇金淋巴瘤WDR1转录因子强烈激活chs_H1基因与霍奇金淋巴瘤Myb2和霍奇金淋巴瘤跳跃的Myb3 tf,提示三元配合物的形成。本研究证实了TFs的作用模式强烈地依赖于TFs的组成chs促进者霍奇金淋巴瘤Myb7作为激活复合物的抑制因子。
结果
啤酒花R2R3Myb、bHLH和WDR转录因子的克隆、序列比较和基因组学分析
在我们之前的工作中,我们克隆了两个真实的R2R3Myb转录因子,它们在捷克啤酒花品种Osvald’s 72的球果中有特异性表达,即霍奇金淋巴瘤Myb1 [GenBank:AJ876882] [19),霍奇金淋巴瘤Myb3 [GenBank:AM501509] [20.].在目前的工作中,根据Nagel等人的说法,我们从Osvald's 72中分离并纯化了lupin腺体。[41],构建了一个lupulin腺体特异性cDNA文库。该cDNA文库具有较高的特异性和复杂性(3.5 × 106pfu)比之前从啤酒花花序和球果中构建的cDNA文库要多[19].我们对GenBank数据库中可用的两个R2R3Myb tf使用序列基序。AB292245和AB292244]进行扩增霍奇金淋巴瘤Myb2 [GenBank: FN646081]和霍奇金淋巴瘤Myb7 [GenBank:FR873650],分别来自cDNA文库。两个克隆在几个点突变上存在差异,此外,该克隆发现了一个18 bp的缺失霍奇金淋巴瘤Myb2与原始数据库序列的比较[GenBank:AB292245]。通过在TrichOME数据库(http://trichome.noble.org/trichomedb/)。为了获得HlWDR1的全长cDNA克隆[GenBank: FN689721],我们首先从该基因的EST中鉴定了5'区h . lupulusvar。凤凰城。从Osvald's 72 cv的lupulin腺体特异性文库中获得完整的cDNA。使用5'引物和寡聚- dt锚定引物的组合,然后按照方法中所述进行嵌套PCR。所有新获得的cds序列的真实性都通过高保真RT-PCR克隆的测序来验证。
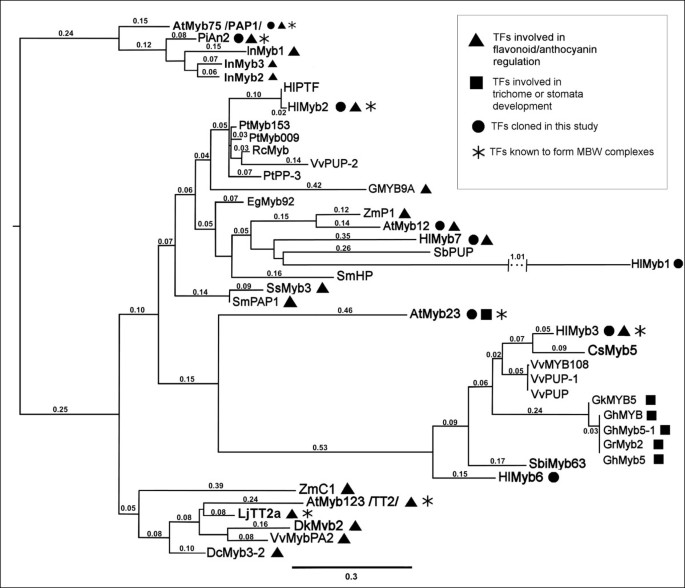
目前,从72个Osvald品种中提取了7个R2R3Myb全长因子。从这些序列中,两个新克隆的霍奇金淋巴瘤Myb2和霍奇金淋巴瘤在R2R3结构域内,Myb7的氨基酸同源性为67% ~ 82%答:芥AtMyb12 [GenBank: NM_130314]和P1 tf fromz梅斯[GenBank: NM_001111873]参与了类黄酮的生物合成。通过与BLAST分析中选择的各种相关R2R3 Myb tf进行更广泛的比较,可以看出霍奇金淋巴瘤Myb7和霍奇金淋巴瘤Myb2在不同密切相关的集群中(图1).之前克隆的霍奇金淋巴瘤Myb1 [19正聚在一起霍奇金淋巴瘤然而,Myb7序列与ZmP1的相关性较小。霍奇金淋巴瘤早期发现的代谢组调节剂Myb3 [20.正聚在一起小麦,葡萄,g .分子如前所述的Mybs [20.].这个TF聚集在一起霍奇金淋巴瘤Myb6,而其他两个跳Mybs 4和5是完全不相关的,不包括在Myb序列的分析数据集中(见附加文件1).在现有的R2R3Mybs中,其中一些被证实参与花青素代谢或/和形成三元BMW配合物的表体发育,如AtTT2 [GenBank: NM_122946], AtMyb75 [GenBank: NM_104541], AtMyb23 [GenBank: NM_123397]和PiAN2 fromp . integrifolia[基因库:AF146703]。
霍奇金淋巴瘤Myb2代表典型的R2R3Myb,预测质量为29.7 kDa, pI为8.16。霍奇金淋巴瘤Myb7是一种R2R3Myb,预测蛋白质量为29.6 kDa, pI为8.19。这些特征接近于其他形成三元络合物的Myb tf,如TT2答:芥(29.6 kDa, pI 8.8)或AN2 fromp .矮牵牛(29.0 kDa, pI 7.23)。在相同的分子质量范围内,但酸性更强的是啤酒花Myb3的亚变异,即s-霍奇金淋巴瘤Myb3 (29.9 kDa, pI 6.4)和l-霍奇金淋巴瘤Myb3 (30.3 kDa, pI 6.19)。的c端区域霍奇金淋巴瘤Myb7,我们发现了一个PDLNLELRIS motif,它符合植物Myb阻滞剂的pdLNLD/ELxiG/S的一致特征[42]在答:芥而且z梅斯[43,44],与II AP2/ERF转录抑制子相似[45].当R3重复进来时霍奇金淋巴瘤Myb2完美匹配子群IIIf bHLH相互作用基序[DE] L×2[RK]×3L×6L×3R [24,38,46),霍奇金淋巴瘤Myb7序列只部分匹配这个motif(66%的身份)和霍奇金淋巴瘤Myb3这个主题是缺席的(见附加文件2).然而,下面的共识顺序。l噢cLHphhGNRWShIAth(根据博克共识,http://coot.embl.de/Alignment//consensus.html)是这个相互作用区域的特征,其中大多数假定的相互作用残基位置(下划线)是暴露在表面的疏水氨基酸。
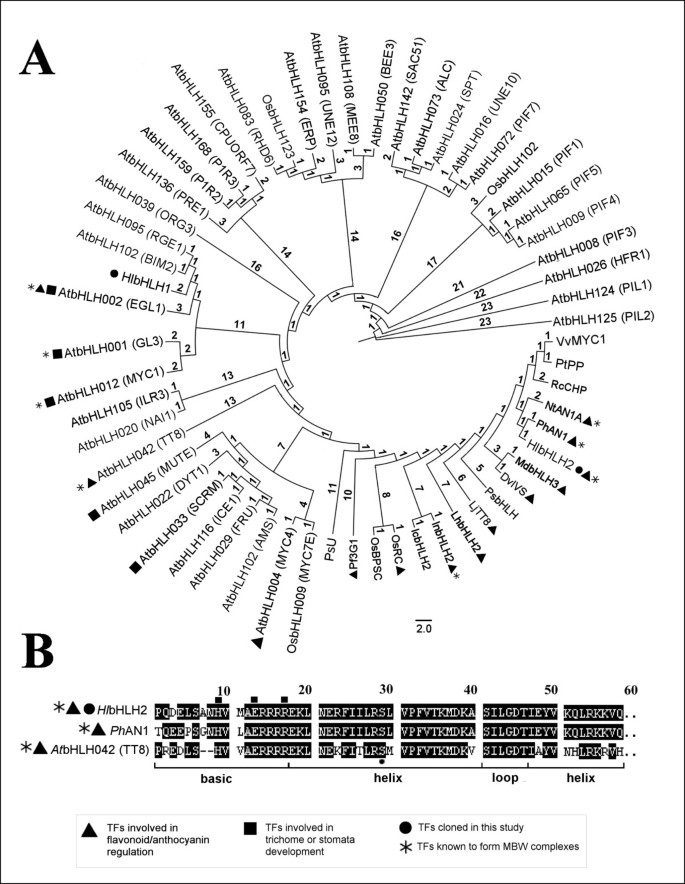
克隆的HlbHLH2cDNA序列编码一个酸性(pi5.1)蛋白,分子量为77.1 kDa。根据BLAST和cartero - paulet等数据集中所选植物bHLH转录因子序列的bHLH结构域分析[47],霍奇金淋巴瘤bHLH2与bHLH AN1同源性最高p .矮牵牛(90%的氨基酸在bHLH结构域内相同)。根据cartero - paulet等人的排列,它与几个参与花青素通路调控的bHLH tf聚类,属于一个广泛的簇,涵盖与类黄酮/花青素代谢、毛状体、气孔复合物和花发育相关的生物功能tf,其功能类别为1、2、5和10。[47)(图2).一些相关的序列被描述成MBW复合体(图2,更多细节描述在附加文件3.).对bHLH碱基区进行比较,发现其结构中存在氨基酸基序(H9, E13, R17)霍奇金淋巴瘤g盒结合剂的bHLH2结构域特性[47],类似于具有良好特征的bHLH AN1p .矮牵牛和bHLH TT8答:芥[48)(图2 b).
选定植物bHLH转录因子氨基酸序列的系统发育分析(A)和bHLH2结构域的对齐分析(B).利用PhyML v. 3.0软件对58个植物bHLH转录因子的bHLH结构域序列进行分析。使用FigTree v.1.3.1可视化了面板A中所示的极树形图。(见方法)。分支的长度用对应刻度的aLTR值表示。hop的bHLH域对齐霍奇金淋巴瘤bHLH2,牵牛花PhAN1和答:芥AtbHLH042 (TT8)如图b所示霍奇金淋巴瘤bHLH2通过与TT8结构域的相似性被识别,如[48].基本区域内对G-box DNA结合剂至关重要的氨基酸[47都用正方形表示。参见附加文件3.用于氨基酸比对、ID号和个别tf的注释。
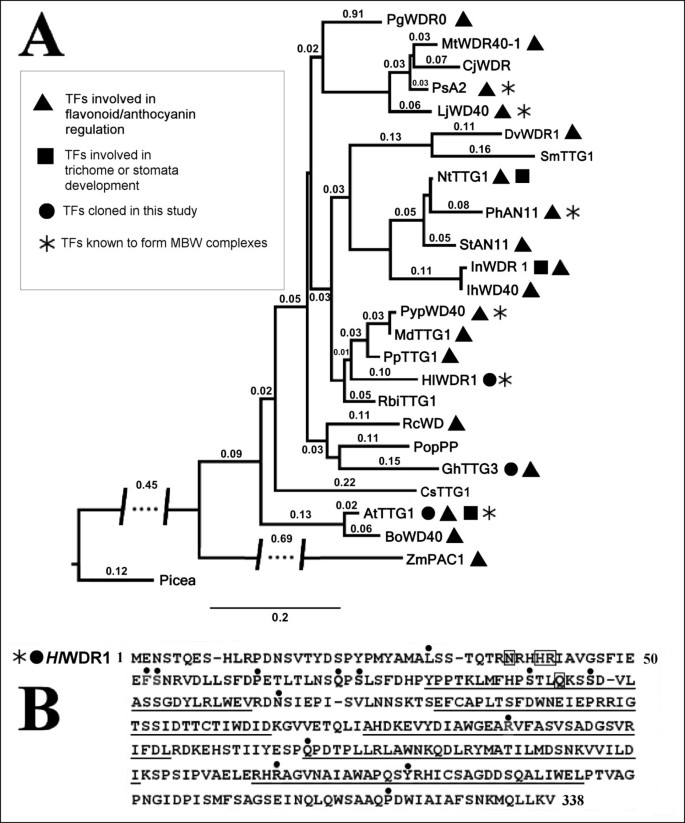
克隆的HlWDR1cDNA编码一个38 kDa的蛋白质,其pI为4.9。利用BLAST中选择的序列对该TF进行系统发育分析,发现双子叶植物群中WDR簇密切相关(图3,有关更多详细信息,请参见附加文件4).这些转录因子大部分被证实能调节花青素代谢,其中一些还能形成MBW复合物。霍奇金淋巴瘤WDR1与最近报道的从梨、苹果、李子和覆盆子中分离出来的序列具有最高的相似性(图3).啤酒花WDR1与来自的AN11蛋白有78.6%的氨基酸相同p .矮牵牛de Vetten等人最初将其定性为植物WDR。[49)(图3 b).更详细的比较霍奇金淋巴瘤WDR1与Ph值AN11确定了5个多肽序列组成wd重复序列,根据[49].只确定了9个非同等职位霍奇金淋巴瘤WDR1重复比较Ph值AN11(图3 b,序列下划线)。
为了评估新克隆的啤酒花转录因子编码基因的复杂性霍奇金淋巴瘤Myb2,霍奇金淋巴瘤bHLH2和霍奇金淋巴瘤对啤酒花品种Osvald’s 72的基因组DNA进行WDR1、Southern blot分析,并根据已知的cDNA序列选择几种酶切酶切。与从cDNA片段创建的探针杂交霍奇金淋巴瘤Myb2,霍奇金淋巴瘤bHLH2和霍奇金淋巴瘤WDR1基因在所有被测基因中显示为单一条带(图4)当与生态RI (HlbHLH2而且HlWDR1),Xho我(HlbHLH2而且HlMyb2),Xba我(HlMyb2而且HlWDR1),太平洋标准时间我(HlbHLH2),Bgl二世(HlMyb2),Bam嗨(HlWDR1)的酶。这表明克隆的跳转录因子HlMyb2, HlbHLH2而且HlWDR1在奥斯瓦尔德的72个啤酒花基因组中是相当独特的。的情况下出现两个波段HlbHLH2裂解与生态RI(5.7和0.6 kb)和HlMyb2裂解与XbaI(6.0, 4.0和3.2 kb)可能是由于某些内含子内的裂解。
从啤酒花cv中分离的5 μg基因组DNA的Southern blot分析。奥斯瓦尔德的克隆人72。这个污点与a杂化了32p标记cDNA片段.(一个)霍奇金淋巴瘤WDR1基因:BamHI (Ba)和Xba我(Xb)不切内霍奇金淋巴瘤WD40基因,EcoRI (E)在cDNA 5'端146 bp处有一个酶切位点。(B)霍奇金淋巴瘤bHLH2基因:EcoR我(E),XhoI (Xh)和太平洋标准时间我(P)不切内霍奇金淋巴瘤bHLH2基因。(C)霍奇金淋巴瘤Myb2基因:XbaI (Xb)不切霍奇金淋巴瘤Myb2基因,BglII (Bg)和XhoI (Xh)有一个限制尺寸,但只有69个resp。从cDNA的3'端开始43 bp。箭头显示了限制性片段与cDNA探针片段杂交的位置。估计的大小以千基(kb)表示。
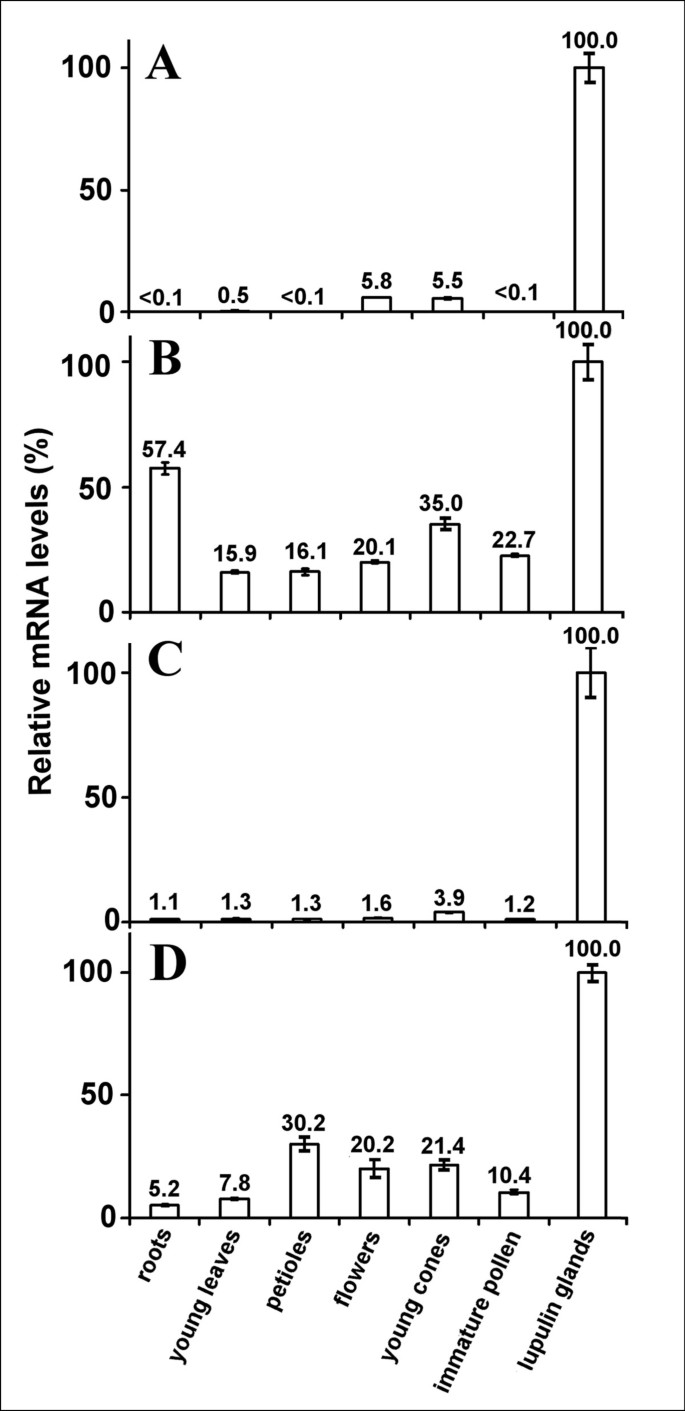
转录因子的比较表达水平分析HlMyb2/7,HlbHLH2而且HlWDR1在啤酒花组织中显示出对狼疮素腺体的特异性
利用从毛状体数据库中预选的序列基序扩增啤酒花中的Myb、bHLH和WDR基因,并从纯化的腺状体制备的cDNA文库中克隆。这证实了最初的特异性为lupulin腺体。为了验证克隆的跳跃转录因子表达的特异性HlMyb2, HlMyb7, HlbHLH2, HlWDR1我们用实时定量PCR (RT - qPCR)分析了各种组织的mRNA水平。根据以往的经验和其他人的报道,选择甘油醛-3-磷酸脱氢酶(GAPDH) mRNA作为管家基因进行归一化[41,50,51].为了避免啤酒花球果苞片的RNA污染,按照Nagel等人的建议,对克隆Osvald’s 72的lupulin腺体进行了仔细的分离和纯化。[41].gapdh归一化结果表明HlMyb2表达对狼疮素腺体具有高度特异性(图5),因为在花和幼球果中的相对表达量仅为5%左右,而在其他组织中仅发现了少量PCR产物。得到了几乎相同的结果HlbHLH2(图5度),在除纯化的lupulin腺体外的其他组织中仅检测到约1%的表达。在整个幼球果中检测到4%的相对表达水平。的表达HlWDR1对lupulin腺体的特异性较低(图5 d).在叶柄、花和整个幼果中观察到该TF的高度显著的相对表达量,达到20%以上,这些幼果中成熟的lupin腺体只占球果组织总重量的微不足道的一部分。此外,未成熟的花粉被发现有HlWDR1mRNA相对表达量约为10%。此外,低表达HlWDR1在嫩叶和根等体细胞组织中检测到(图5 d).观察到的最低特异性的狼疮腺HlMyb7其中,根和整个幼果的相对表达量分别为57%和35%,而其他组织包括叶、花和未成熟花粉也有超过15%的高表达量(图5 b).
组合瞬时表达分析所选的lupulin腺体tf显示pchs_H1和chs_H1
根据我们的结果,HlMyb2而且HlbHLH2表现出高特异性表达的狼疮素腺体类似于之前的研究HlMyb3[21].虽然表达HlWDR1而且HlMyb7特异性较低,它们的相对表达水平仍在腺毛体中最为明显。考虑到所有这些转录因子与已知类黄酮途径调控因子的高度序列相似性及其特定的表达模式,这些转录因子很可能参与了类黄酮途径调控基因的调控chs_H1,预计参与了在狼疮素腺体中次生代谢物的生物合成[52].
为了评估克隆tf的功能,我们使用了以前开发的“组合瞬时表达”系统[16,21].在本实验中,激活chs_H1启动子(Pchs_H1)与GUS内参基因融合(图6)在共渗后测量农轴承Pchs_H1和跳跃tf向量在各种组合到n benthamiana叶子。只有微不足道的背景信号由P的激活chs_H1由内叶tf检测到[16,21].
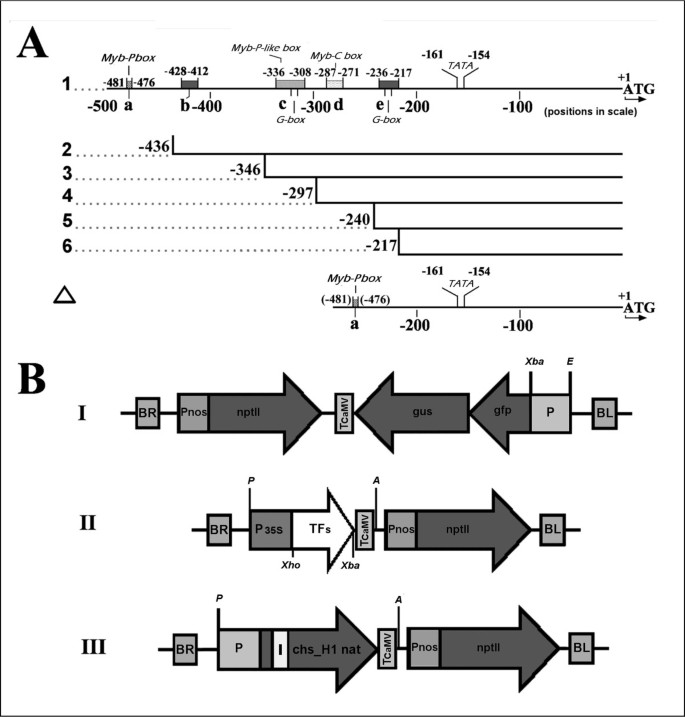
分析变量的原理图chs_H1启动子(A)和用于叶片渗透的植物载体T-DNA部分的表达盒(B).推广计划(一个)是有规模的。我:Pchs_H1的总结如上所述[16并在本文中进行了分析。详情见正文。: a, Myb-P盒子;b, Myb-like box;c, Myb-P/bHLH与G-box结合位点;d,植物MYB igg样结合位点;e/bHLH结合位点与G-box结合;植物病媒计划(B)的规模并不大。I:包含所分析启动子(P)的载体pBGF-0的总体方案。II:包含啤酒花35s驱动转录因子(TF)的载体pLV-07的总体盒。磁带III显示了本机chs_H1基因(载体pLV-67)。编码序列为深灰色,启动子以P标记,内含子以i标记,分别为右、左T-DNA边界BR和BL。NptII是对卡那霉素耐药的新霉素磷酸转移酶基因。该基因由nopalin合成酶启动子(Pnos)驱动。图示CaMV (TCaMV)终止器。植物载体中整合启动子和片段的限制性位点分别为XbaI (X)、EcoRI (E)、AscI (A)和PacI (P)。
Pchs_H1包含前面描述的几个Myb和bhlh绑定框[16]并在本文中进一步分析(图6).根据PLACE数据库,序列TCCTACC (MybPZm盒子)包含的一致性z梅斯P因子结合盒[53在-481到-476号位置被发现。这一潜在的TF结合盒与新克隆的显著相似性有关霍奇金淋巴瘤Myb2和霍奇金淋巴瘤Myb7到这个Zm评选P1因子(图1).在-428到-412的位置,利用基因组数据库(http://www.genomatix.de)与GA-Myb蛋白一致[54].对于位置-336至-328,使用PLACE数据库找到符合myb - p相关共识序列MACCWAMC的序列CACCAAAC [55在-287 ~ -271位发现了一个植物MYB igg型样结合位点,即T一个AGGTAGTTGA(不匹配下划线),它类似于z梅斯C1 myb -结构域蛋白(Myb-C box) [56].另外,两个具有CACGTG序列的典型bHLH g结合盒可能对霍奇金淋巴瘤bhlh2介导的Pchs_H1 [57],分别位于-224至-229和-313至-318位置6).
瞬时GUS活性在浸润后66 ~ 92 h达到最大值,随后随TF或TF组合共浸润而下降。例如,霍奇金淋巴瘤Myb3变体和所有包含霍奇金淋巴瘤Myb3基因在浸润后4 d达到峰值(dpi)霍奇金淋巴瘤除M2W1二元复合体外,Myb2基因在66-68 h dpi时活性最高。
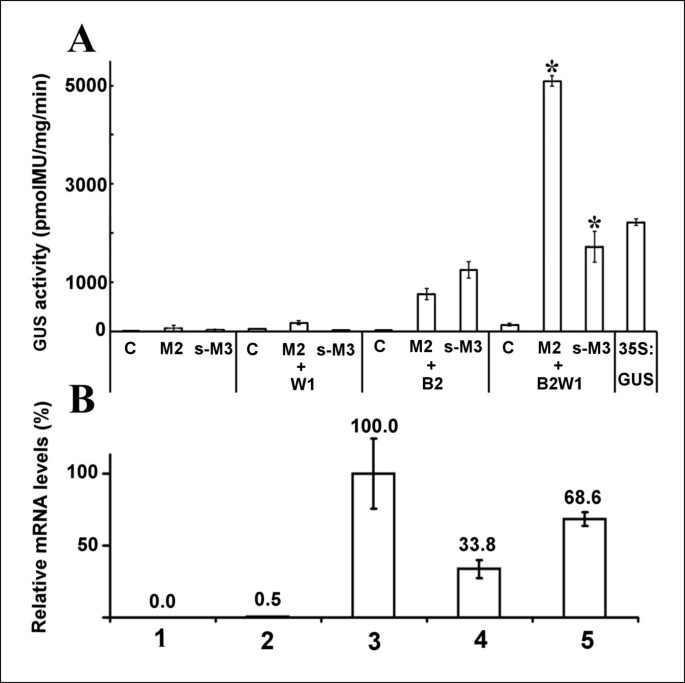
根据我们的结果,Pchs与。共渗后观察到_H1霍奇金淋巴瘤Myb2(图3.).在40 pmol MU/mg/min的水平上发现了一个非常弱的激活信号霍奇金淋巴瘤根据我们之前的研究[21].P的活化程度也很低chs_H1被找到霍奇金淋巴瘤bHLH2,尽管存在两个bHLH g -box(图6),且未观察到超过背景信号的激活霍奇金淋巴瘤WDR1 TF是单独应用的(未显示)。然而,Pchs_H1在被研究的tf的Myb/bHLH二元和三元组合中都被观察到(图7一个).三元组合导致M3B2W1为1721±315 pmol MU/mg/min, M2B2W1为5089±107 pmol MU/mg/min7一个).M2B2W1组合显著超过CaMV强的35S启动子所引起的激活(1658±102 pmol MU/mg/min)。
分析激活chs_H1启动子(A)和整体chs_H1基因(B).通过GUS活性的组合瞬时表达分析启动子激活(一个);的相对水平chs用RT - qPCR检测_H1 mRNA,并归一化检测延伸因子1管家基因的激活情况chst_h1基因被TFs (B).渗透农A区菌株:c对照,浸润农无植物载体的lba4404;平方米,霍奇金淋巴瘤Myb2;s-M3;s -霍奇金淋巴瘤Myb3;+W1,组合霍奇金淋巴瘤WDR1;+B2,和的组合霍奇金淋巴瘤bHLH2;+B2W1,结合HlbHLH2和霍奇金淋巴瘤WDR1, 35S:GUS, CaMV 35S启动子驱动ß-葡糖苷酸酶。B区样品:1、控制lba4404的渗透;2,chs_H1基因;3.chs_H1基因+ TF组合霍奇金淋巴瘤Myb2 /霍奇金淋巴瘤bHLH2 /霍奇金淋巴瘤WDR1;4,chs_H1基因+ tf组合s-霍奇金淋巴瘤Myb3 /霍奇金淋巴瘤bHLH2 /霍奇金淋巴瘤WDR1。柱形表示α水平= 0.05的置信区间。
为了测定真正激活的转录chs_H1基因具有非常保守的启动子区域[16我们进行了tf与“原生”的协同渗透。chs_H1基因含有天然内含子序列(图6 b)如前所述[16].的相对表达水平chs用RT qPCR和35S检测_H1 mRNA:chs_H1被用作参考(图7 b).与之前的结果相对应的是,三元组合M3B2W1和M2B2W1被发现强烈激活自然chs_H1基因的构建表明两种测定结果具有良好的一致性。
为了能够描述与M3B2W1和M2B2W1所观察到的强激活相关的结合位点,M2B2W1是Pchs缺少预测的tf结合框的_H1被插入(图6)的参考矢量(图6 b),并在瞬时表达系统中进行分析(表1).研究发现,大多数启动子活性(约50%)依赖于MybP盒子的存在,尽管在包含myb -类盒子、Myb-P类盒子、Myb-C盒子和两个g盒子的变体2中仍观察到显著活性(约50%)(图)6、表1).通过去除盒子,两个三元组合的启动子活性逐渐下降,与包含一个g盒子的结构5的低活性相似。为了证实P的高度依赖性chs_H1在Myb-P盒子上,我们通过三次突变将序列TCCTACC改变为TAAC格式ACC(下划线为突变核苷酸)(表1).在两个三元组合中都观察到约50%的下降。尽管Myb-P盒子起着至关重要的作用,一个ΔPchs_H1变体包含Myb-P盒附在TATA盒的上游(图6)不活跃,提示Pchs_H1在启动子序列长度和/或特定顺序上的激活。
活化复合物与所选化合物的取代和互补h . Lupulus- - -答:芥-派生的myb tf
为了研究可能的功能互补,相关的Myb转录因子h . lupulus而且答:芥采用瞬时表达系统进行比较。除了Pchs_H1,还有启动子Pchs对啤酒花中4个查尔酮合成酶样基因进行了分析。基因chs4个之前由Novák等人克隆[GenBank: AJ430353]。[18].Pchs4序列长度为629 bp,结构与P不同chs_H1,同时仍然包含类似的Myb和bHLH框。使用PLACE数据库可以识别MybPZm评选箱芯CCWACC(序列CCAACC) [53]在-101 ~ -95位置,对应于一致序列MACCWAMC(序列AACCTAAC)在-92 ~ -85位置的Myb P-like box [55和另一个潜在的具有一致序列WAACCA的Myb1AT盒子[59位置-212到-207(序列TAACCA)。一个bHLH g结合盒(序列CACGTG)和一个e结合盒(CACATG) [60]分别出现在-132 ~ -127和-120 ~ -115位置。
各TF组合的相对激活水平见表2.据观察,Pchs_H1启动子对三元组合的响应最强,而Pchs对于独立的Myb动作或二元组合,发现4。此外,答:芥-派生的在Myb23 (At5g40330),在Myb75 (在PAP1,At1g56650)明确补充了三元MBW组合中的M分量,而在Myb12在MBW组合中没有比MB或MW组合的激活增强。在Myb12也强烈激活Pchs4当单独或MW组合使用时。在Myb75和霍奇金淋巴瘤Myb2是Pchs_H1对P的激活能力较低chs4.有趣的是,在亚变异中观察到明显的差异霍奇金淋巴瘤Myb3 [20.].而l-HlMyb3对P的激活达到最大值chs4在MB组合中,P的激活最大chs较短的变种s-被观察到_H1霍奇金淋巴瘤Myb3在MBW组合中。这两个霍奇金淋巴瘤在MB组合中,Myb3子变异对两种启动子都有显著影响2,亦见图7),这在P中更为明显chs4(表2).霍奇金淋巴瘤Myb1 [19是P的最弱激活剂chs_H1,尽管MBW联合仍观察到诱导率为304±47 pmol GUS/mg/min。最后,尽管霍奇金淋巴瘤Myb7与其他研究的myb有一些相似之处1),它不是任何组合的激活剂,也不是Pchs_H1也不是Pchs4.
HlMyb7是启动子激活的抑制因子
虽然霍奇金淋巴瘤Myb7与其他被调查的myb相关,特别是与在Myb12和霍奇金淋巴瘤Myb2,这种跳跃衍生的转录调控因子显示没有激活跳跃的能力chs启动子(图1).我们发现了一个转录抑制motif PDLNLELRIS,在的C末端区域霍奇金淋巴瘤Myb7的抑制活性霍奇金淋巴瘤通过测定Pchs_H1在含有MBW ×的瞬时表达系统中的活性霍奇金淋巴瘤Myb7的组合霍奇金淋巴瘤Myb2, s -霍奇金淋巴瘤Myb3和在Myb75 (PAP1)(图8).的添加霍奇金淋巴瘤Myb7显著降低参照GUS活性。类似的抑制霍奇金淋巴瘤在二元组合中观察到的Myb7在50 - 90%范围内,以及个体Myb基因对两者的独立作用chs启动子(数据未显示),表明该Myb具有更广泛的抑制活性。为了分析Myb-P盒子在这种抑制作用中的可能作用,P2chs_H1结构(表1)用于分析霍奇金淋巴瘤Myb7与M2B2W1 ×共渗后对启动子活性的影响霍奇金淋巴瘤Myb7, s-M3B2W1 ×霍奇金淋巴瘤Myb7和相应的控件没有霍奇金淋巴瘤Myb7。由于抑制活性也被发现达到约50%(数据未显示),极有可能Myb-P盒子没有发挥主要作用。
克隆tf对异源体系中花青素积累的影响佩妮矮牵牛叶子
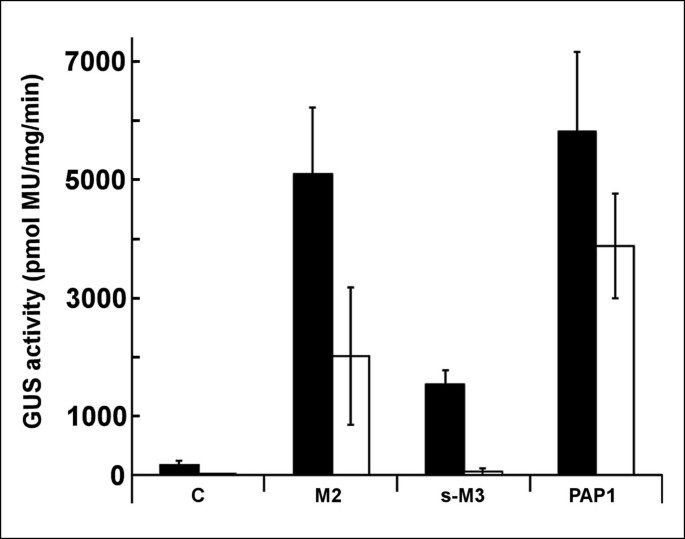
本研究中所研究的啤酒花衍生的转录因子均与调控类黄酮途径的已知转录因子有关。因为明显的激活chs与h1基因相比,啤啤花衍生的转录因子有望增加柚皮苷查尔酮的库,从而刺激下游花青素的生物合成和积累。然而,在lupulin腺体中,彩色花青素是检测不到的,因为最有可能的是查尔酮异构酶和花青素生物合成的进一步下游酶没有表达。相反,狼疮素腺体积聚丙烯化查尔酮和其他萜类酚,组成高度特异性的狼疮素代谢组[52].另一方面,柚皮苷查尔酮的积累p .矮牵牛可能导致花青素的积累。为了进一步研究克隆的跳跃TF在不同组合下的特异性,以及它们激活花青素通路的潜力,一个短暂的TF表达系统p .矮牵牛是使用。相比较而言,在PAP1作为一种调控因子,具有协同激活矮牵牛叶花青素生物合成的能力AtPAP1而且chs_H1基因串联排列[16])。因此,在PAP1或/和跳chs_H1激活剂,如s-霍奇金淋巴瘤Myb3,霍奇金淋巴瘤Myb2,霍奇金淋巴瘤bHLH2和霍奇金淋巴瘤WDR1(图7)在特定组合中分析可能的花青素诱导。
结果表明,只有共渗chs_H1基因(图6 b(3) withAtPAP1而且HlbHLH2在矮牵牛的叶子中强烈诱导蓝色花青素的积累(图9, HPLC结果见附加文件5).这可能是由于查尔酮库的增加和下游花青素生物合成基因的激活。两者的渗透AtPAP1或HlbHLH2单独使用没有导致任何可检测到的花青素水平(附加文件5).根据保留时间和紫外-可见光谱,诱导的叶片花青素代谢物的形态与矮牵牛花蓝色花冠组织中花青素的形态在定性上非常相似。然而,在数量组成上发现了显著的差异。令人惊讶的是,三元组合中只观察到少量的花青素代谢物在导致Pchs_H1如上图所示(表2).无论是与啤酒花衍生的Mybs的组合,霍奇金淋巴瘤Myb2或s-Hl激活P的Myb3chs_H1,即s -M3B2,s -M3B2W1和M2B2W1导致矮牵牛叶中蓝色色素沉着。代谢高度活跃s-HlMyb3 [20.],导致叶片上出现黄斑霍奇金淋巴瘤bHLH2(图9).跳tf,霍奇金淋巴瘤Myb2,s-HlMyb3和WDR1不能共同诱导矮牵牛叶花青素的生物合成。
讨论
狼疮素腺相关转录因子的序列和功能特性及其在狼疮素代谢组生物合成调节中的潜在作用
四种新的转录调控因子,即霍奇金淋巴瘤Myb2,霍奇金淋巴瘤Myb7,霍奇金淋巴瘤bHLH2,霍奇金淋巴瘤WDR1,从捷克啤酒花品种Osvald’s 72中分离克隆。所有这些转录因子在lupulin腺体中都有高度特异性的表达,并与已知的Myb、bHLH和WDR转录因子高度相似,这些转录因子都是各种植物类黄酮生物合成途径的调节因子。其中一些类黄酮生物合成的调节剂[24,61形成三元MBW活化配合物,如(PhAN2/AN1/AN11)p .矮牵牛[29和(AtTT2/TT8/TTG1)在答:芥[28以及最近在豌豆中发现的TF复合物[30.),Lotus对虾[31].据报道,MBW复合物不仅调节色素沉着,还调节表皮细胞的命运,包括毛状体的起始和进一步发展[26,62].因此,从进化的角度来看,组合MBW机制可能参与了与lupulin代谢组生物合成相关的基因的激活。利用组合瞬时表达系统,M2B2W1组合协同诱导了非常强的原生激活chs_H1。该基因编码一种关键的跳“真”查尔酮合成酶,该酶具有以高催化率生产柚皮苷查尔酮的能力[16],因此,它可能在生物合成途径中发挥重要作用,导致在lupulin腺体中积聚丙烯酰化查尔酮,包括黄腐酚和去甲基黄腐酚(强效植物雌激素8-PN的直接前体)[14,16].
新近被孤立的霍奇金淋巴瘤Myb2在R3域内表现出一个典型的序列基序[DE]Lx2[RK]x3Lx6Lx3R,这是可能与IIIf bHLHs子群成员相互作用的特征[24,38,46].这一发现是符合能力的霍奇金淋巴瘤Myb2强烈激活Pchs使用组合瞬态表达式系统的M2B2W1组合中的_H1。另一方面,明确的协同效应也观察到多功能性的亚变异霍奇金淋巴瘤Myb3(先前克隆并描述过[20.),尽管bhlh相互作用基序在其氨基酸序列中缺失。特别是较短的子变体s-霍奇金淋巴瘤Myb3的显著激活chss-M3B2二元组合和s-M3B2W1三元组合中的_H1基因。这表明霍奇金淋巴瘤bHLH2能够与s-相互作用霍奇金淋巴瘤通过在这些暴露在蛋白质表面的位置上的疏水残基,或其他替代方法,来实现Myb3。根据我们未发表的结果,电泳迁移率转移试验(EMSA)显示放射性标记的Pchs_H1和从含有s-M3B2和s-M3B2W1复合体的叶片中提取的蛋白质。需要更多的实验来阐明这种相互作用。的n端区域的不同长度霍奇金淋巴瘤Myb3对其激活P的能力有至关重要的影响chs_H1在M3B2和M3B2W1组合中,因为l-M3B2W1组合几乎没有观察到协同作用。过表达l-和s-的发散效应霍奇金淋巴瘤Myb3 TFs较早被观察到,反映在矮牵牛叶中代谢物组成的变化,以及形态发生的变化答:芥而且p .矮牵牛transgenotes [20.].功能分析见表2证实了所选的啤酒花lupulin腺体特异性Mybs的互补作用答:芥多种二元或三元组合的Mybs,表明这些tf不仅顺序相似,而且功能相似。例如,在PAP1结合霍奇金淋巴瘤bHLH2和霍奇金淋巴瘤WDR1具有较强的协同效应。PAP1与MBW配合物中其他组分的相互作用答:芥已在前面描述过[28].在我们的实验中,三元MBW组合还观察到最高的协同作用在而类黄酮调节剂为Myb23在Myb12仅对BM和BW二元组合产生协同反应,提示蛋白质具有一定的特异性:这些tf之间的蛋白质相互作用。除了R2R3 Mybs,我们还确认了霍奇金淋巴瘤WDR1由TTG1从答:芥(没有显示)。
新克隆的霍奇金淋巴瘤Myb7似乎是一种潜在的R2R3Myb负调控因子chs_H1和chs因为啤酒花在瞬时表达系统中表现出显著的抑制活性。这与在该蛋白c端发现的符合4 R2R3Mybs亚群一致的pdLNLD/ELxiG/S序列特征的PDLNLELRIS序列一致[63],这是保守的压制区域在Myb4抑制因子[42].由霍奇金淋巴瘤发现Myb7独立于位于P蛋白5'区域的Myb-P盒子上chs_H1,但它是否通过与MBW组分、其他蛋白质的相互作用或与启动子序列中的其他元素的结合来发挥其抑制活性还有待确定。
Upregulation的chs由s-M3B2W1和M2B2W1组合的_H1基因可能会增加柚皮素查尔酮前体的可用池,用于进一步生产lupulin戊烯基查尔酮,由下游跳基因(包括戊烯酰基转移酶)的表达共同决定[64),而O-甲基转移酶1 [41].而跳跃则由单个转变而成AtPAP1该基因的特征是球果和花中花青素、芦丁和异槲皮苷的产量显著高于野生型植物[65],花青素没有在lupulin腺体中积累[52],很可能是由于在这些专门的结构中缺乏特定的酶机制的表达。相反,s-M3B2W1和M2B2W1组合中的跳跃tf不能共同激活花青素通路p .矮牵牛正如发现的在PAP1B2结合,从而支持了关于lupulin特异性tf功能专业化的观点。根据我们未发表的结果,无论是s-M3B2W1还是M2B2W1组合都不能诱导其他啤酒花基因的启动子,如缬甲酮合成酶或O-甲基转移酶1 (Pomt1) (21],证实其特异性chs_H1基因。
无论是三元组合s-M3B2W1, M2B2W1,还是Pchs_h1激活的s-M3B2、M2B2配合物能够诱导矮牵牛叶中花青素的生成。叶片代谢产物和蓝色花青素水平的显著升高是由于在PAP1B2的结合可能是由于一种能力在PAP1B2复合体也能激活矮牛属植物的下游基因,如查尔酮异构酶(CHI)、黄酮3-羟化酶(F3H)、二氢黄酮醇4-还原酶(DFR)和花青素合成酶(ANS) [66].的确,代谢组和mRNA筛选显示过表达的在PAP1基因激活了至少25个矮牵牛基因,也产生了一些新的代谢物[67].因此,需要进一步的研究来阐明可能被分离的跳跃转录因子组合作用上调的跳跃基因的结构。
啤酒花的建议规管chs根据组合分析预测的基因
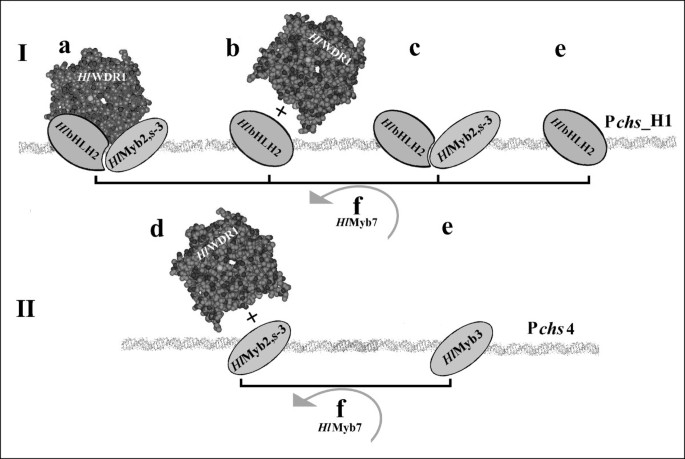
为了分析新克隆的跳跃tf的功能特性,我们选择使用组合瞬时表达式系统,因为跳跃转换[68]和培育以达到开花是非常费力和耗时的,特别是对各种组合的tf的研究。而这种瞬时表达检测的特征是一个可忽略的背景信号,即来自内源性的信号n benthamianaTFs [21],它使我们能够有效地比较不同的跳tf组合对不同启动子结构的激活。截断启动子结构的比较揭示了P的主要依赖性chss-M3B2W1和M2B2W1组合在单个Myb-P box特征上激活h1,以结合P1的TF玉米[53].然而,其他的结合箱,如MYB -like box, MYB - p -related box, MYB ig -like box以及驱动类黄酮通路的bHLH G-box结合物的G-binding位点特征[23也有助于整个活动。因此,启动子的每个成分似乎都影响激活程度,正是启动子的整体组成决定了特定的tf参与特定的组合。这一点在两者的比较中很明显chs启动子驱动在狼疮素腺中高表达的查尔酮合成酶,即,chs_H1和chs4(见图7、表2).图中显示了所研究的tf与不同启动子的相互作用示意图10.具有相似电位的Myb和bHLH结合盒的不同空间组成的两个启动子被相同的转录因子激活不同。Pchs_H1不仅主要被M2B2W1/s-M3B2W1三元配合物激活,还被B2W1和MB二元组合以及的作用激活霍奇金淋巴瘤bHLH2独立于跳B2和W110 a, b, c, e).单一的Myb和MW二元组合没有导致P的激活chs_H1。这与P形成了鲜明的对比chs4、凡“直接激活”的由霍奇金淋巴瘤Myb3或二进制s-M3W1组合是首选的(图10 d, e).P的激活chs4由M2B2W1三元络合物可忽略不计(见表2),以及任何组合,包括霍奇金淋巴瘤bHLH2(图10).有趣的是,这两种启动子都可以被霍奇金淋巴瘤Myb7抑制因子(图8;数字10).tf的组合作用一般依赖于特定启动子的组成,这在最近综述的许多研究中得到了说明[23,24,69].虽然我们没有观察到Pchs_H1与n benthamiana我们不能排除一些内源性的影响n benthamianaP的组合调节的tfchs_H1在异源系统中。我们将进行进一步研究,以确定拟议的监管模式。lupin代谢组生物合成基因的具体协同调控取决于形成实际TF平衡的个体TF的稳定状态水平。因此,可以想象,像M2B2W1这样的复合体通过下调特定的TF复合体成分而失衡,可能导致基因表达的显著减少,从而导致lupulin代谢组的产生。为了支持这一观点,我们应该注意到,最近我们在感染了啤酒花抑制类病毒(HSVd)的患病啤酒花的脱色叶柄中检测到了tf的失衡表达(未发表)。
P的简化格式chs_H1 (I)和Pchs4 (II)在异源体系中观察到的跳跃tf组合激活n benthamiana.基本方案由Baudry等人提供。[27].三维模型霍奇金淋巴瘤方案中的WDR1通过SWISS-MODEL Workspace(参见Methods)获得。(一个)由MYB、bHLH和WDR tf组成的整个三元配合物;(b) bHLH和WDR二元组合;(cMYB和bHLH组合;(dMyb和WDR组合;(e)“直接”独立的跳跃tf作用,不需要与分析的跳跃tf复合;(f) HlMyb7的抑制作用。图中没有标度,假设tf与启动子结合位点相互作用。绑定框没有显示在方案中。该方案不考虑接近背景相互作用的弱信号。
结论
本研究利用啤酒花(hop)的cDNA文库,克隆了植物R2R3Myb、bHLH和WDR家族对应的新的TF同源物。忽花布L.)狼疮腺组织。克隆的霍奇金淋巴瘤Myb2和-7,霍奇金淋巴瘤bHLH2和霍奇金淋巴瘤WDR1转录因子与已知的调控类黄酮生物合成途径的转录因子高度相似,并在lupulin腺体中高度特异性表达。利用组合瞬时表达系统对这些转录因子的功能活性进行了研究烟草benthamiana.这些实验对调节的复杂性提供了新的见解chs_H1基因,以及进入差异激活chs_H1启动子和lupin特异性查尔酮合成酶4启动子。该调节涉及三元、二元和独立的tf作用的变化。跳和的互补答:芥tf表现在特定的组合中。跳ch激活tf,霍奇金淋巴瘤Myb2和3,霍奇金淋巴瘤bHLH2和霍奇金淋巴瘤WDR1在各种组合中都不能诱导花青素通路p .矮牵牛提示在啤酒花腺毛体的特化组织中MBW机制的特化。霍奇金淋巴瘤Myb7被认为是一种R2R3阻遏剂,可以作为一种潜在的狼疮素代谢组生物合成的协同调节因子。
方法
植物材料和植物栽培条件
捷克半早红茎啤酒花Osvald无性系72是在Žatec(北波西米亚)啤酒花研究所世界啤酒花收藏的自然田间条件下生长的。佩妮矮牵牛简历。安德里亚和烟草benthamiana温室温度25±3℃。植物生长在自然光照条件下,补充光照[170 μmol m-2 s-1 PAR]以维持16 h的日间周期。
狼疮素腺的分离纯化、cDNA文库的制备及转录因子cDNA的克隆
根据Nagel等人的研究,在2009年8月上半月和2010年8月采集的啤酒花品种Osvald's克隆72的完全成熟球果中分离出了Lupulin腺体。[41].分离得到的狼疮素腺体按照说明书进行RNA提取、纯化和啤酒花cDNA文库构建。简单地说,腺组织被冷冻在液氮中,并在音乐会植物RNA试剂(Invitrogen)中研磨。然后用离心和氯仿处理去除细胞碎片,然后用异丙醇沉淀RNA。根据RNeasy Plant Mini Kit程序(Qiagen)在DNaseI处理柱上进行溶解RNA纯化,随后用Dynabeads mRNA纯化试剂盒(Invitrogen Dynal)分离mRNA。纯化的mRNA样本分别根据ZAP-cDNA Synthesis Kit和ZAP-cDNA Gigapack III Gold packaging Kit说明书(Stratagene)进行cDNA文库构建和lambda包装。
通过筛选获得了转录因子cDNA的克隆基序忽花布基因库EST (http://www.ncbi.nlm.nih.gov)及TrichOME (http://trichome.noble.org/trichomedb/)数据库。总共有258,472个ESTs使用Advanced BLAST 2.0脚本(http://blast.ncbi.nlm.nih.gov/).得到的EST序列用于设计引物序列,用于筛选lupulin gland特异性cDNA文库。采用高保真ppo聚合酶(Roche Molecular Biochemicals)进行扩增。
霍奇金淋巴瘤Myb2(克隆2962)使用引物组合“Myb2 start”和“Myb2 stop”从库中扩增,霍奇金淋巴瘤Myb7(克隆2265)使用引物“Myb7 start”和“Myb7 stop”和for进行扩增霍奇金淋巴瘤bHLH2(克隆3497)扩增使用引物“bHLH start”和“bHLH stop”。所有引物序列都列在附加文件中6.用于放大霍奇金淋巴瘤WDR1(3140),采用两步扩增反应。首先,使用引物组合“WDR start”和3’oligo d(T)-anchor引物(5’/3’RACE Kit 2)从文库中获得cDNA片段的混合物nd然后使用“WDRnes”引物和“PCR WDR锚点”引物进行嵌套反应。然后克隆出一个长度约为1.6 kb的片段。
互补的在Myb12和在Myb23是从答:芥var. Columbia使用Titan One Tube RT-PCR(分子生物化学),包括高保真度Pwo聚合酶(罗氏分子生物化学)和引物来自GenBank数据库中描述的序列(见附加文件)6).
基因组DNA制备和基因组印迹
用CTAB法制备啤酒花基因组DNA [70].从每株植物中提取5 μg DNA,用50单位的生态RI,Bam你好,Xba我,Xho我,Bgl二世,或太平洋标准时间I加入150 μl反应液,37°C孵育过夜。如前所述,对消化后的DNA进行电泳和印迹检测[21根据Church和Gilbert的规定,在缓冲液中进行预杂交(在65°C条件下2小时,30ml)和杂交(在65°C条件下过夜,20ml) [71使用杂交烤箱。这些膜被杂交成HlWDR1, HlbHLH2或HlMyb2全长cDNA探针,特异性活性5 × 107cpm /μg DNA。杂交信号通过使用Typhoon 9200成像仪(Amersham Pharmacia)进行磷酸化成像检测。
RNA分离和实时PCR分析
对于实时定量PCR (RT qPCR)和逆转录聚合酶链式反应(RT-PCR),在RNA纯化和柱上DNA切割(RNeasy plant total RNA kit, Qiagen)后,使用Concert™植物RNA试剂(Invitrogen)从100 mg植物叶片组织中分离总RNA。跳转转录因子RT qPCR引物组合列在附加文件中6.所有引物的退火温度都接近58℃,并扩增了特有的、非保守的tf区域。4微克总RNA用oligo dT18引物和SuperscriptII逆转录酶(Invitrogen)在42℃下反转录60分钟。共5 μl 50 ×稀释的cDNA,用0.6单位的Hot Start Ex Taq聚合酶(TaKaRa Bio)、Taq缓冲液1 ×、dNTPs 200 μM、SYBR Green 1:20 000(分子探针)和引物375 nM进行20 μl PCR反应。所有扩增在Bio-Rad IQ5循环器上进行40个循环(94℃20 s, 59℃30 s, 72℃30 s),然后进行初始变性/Taq激活步骤(94℃5分钟)。通过熔融分析和2%琼脂糖凝胶电泳确定产物的尺寸。使用Bio-Rad IQ5光学系统2.0版本软件对数据进行分析和量化。参考转录本甘油醛-3-磷酸脱氢酶(GAPDH)的丰度[41,50,51],在每个样本中并行估计。如前所述,使用引物组合“HL-GAP-F1”和“HL-GAP-R1”扩增GAPDH [21].用“δ - δ法”将相对值标准化为GAPDH,并根据Pfaffl [72].数据点表示每次PCR反应两次重复的平均值±标准差。在RT-PCR扩增中,我们使用cDNA引物和高保真的Titan One Tube RT-PCR试剂盒(罗氏分子生物化学公司)。
植物表达载体的构建及蛋白的制备chs_H1启动子子变异
TFsHlMyb2, HlMyb7, HlbHLH2而且HlWDR1利用引物对组合,用高保真的Pwo聚合酶重新扩增CDS(序列见附加文件)6): "5'Myb2Apa"和"3'Myb2Kpn";"5'MYB7Xho"和"5'MYB7Xba;"bHLHKpn"及"bHLHBam";"5'HlWDXho"和"3'HlWDXba"。
对于克隆的答:芥TFsAtMyb12而且AtMyb23我们使用的克隆引物组合为“3’myb12xba”和“5’myb12xho”;"5'Myb23Xho"和"3'Myb23Xba"。
制备的CDS片段HlWDR1, HlMyb7, AtMyb12而且AtMyb23用Xho我和Xba我;HlMyb2与美国心理学协会我和Kpn我和HlbHLH2与Kpn我和BamH1。然后将凝胶纯化的片段克隆到中介载体pLV68对应的唯一位点,融合到35S CaMV启动子上[16].使用限制性酶切取包含35S CaMV启动子的整个TF盒Asc我和PacI和克隆在植物载体pLV07中,如Vrba和matouieek所描述[73].这些向量在农冻融法培养菌株lba4404 [74和用于叶片渗透n benthamiana或p .矮牵牛如上所述的叶子[16].的霍奇金淋巴瘤携带myb3的植物载体和农菌株以前有过描述[20.].
的chs_H1启动子序列较早分离[14],并克隆到先前的参考GUS载体[16].5'的删减变体(表2)使用附加文件中列出的5'引物进行扩增6:变种/引物:1/1PchsH1Eco;2/2PchsH1Ec;3/3PchsH1Eco;3/4PchsH1Eco;4/4PchsH1Eco;5/5PchsH1Eco;6/6PchsH1Eco结合3'引物“Pchs1endXba”。为了制备Myb-P盒子的突变变体,引物“mutPmyb5”与“Pchs1endXba”结合。P的变化chs_H1使用“deltaPmyb5”和“Pchs1endXba”引物的组合制备。在这种情况下,启动子的变体6作为PCR模板。启动子Pchs4 (600 bp)从chs4基因[GenBank:AJ430353] [18克隆1746),使用引物“Pchs4Eco”和“Pchs4Xba”。然后将启动子区与GFP/GUS基因融合,克隆到独特的环境中生态国际扶轮和XbaI植物载体pBGF-0 [58]如前所述[16].阴性对照为pBGF-0载体浸润,阴性对照为含有35S:GUS/GFP融合盒的p35SBGF构建体(克隆3771)。菌株总结农使用和制备的T-DNA结构可以在附加文件中找到7.
组合瞬时表达系统和GUS分析
在外径下制备农菌悬液进行共渗600= 1.0,等体积的每种悬浮液在浸润前混合。n benthamiana幼苗播种在平地上,在温室条件(22°C - 24°C)下生长18至21天。农如前所述,激活携带适当基因结构的细胞并将其注入叶片[21].ß-葡糖苷酸酶(GUS)活性在浸润后3-4 d的处理叶扇区均质组织中使用荧光测定法测定[75由matouiek等人修改。[21].使用VersaFluor™荧光计(Bio-Rad)测定释放荧光染料4-甲基伞形花序酮(MU)的量,激发波长为365 nm,发射波长为455 nm。用新鲜制剂MU (100 nM)作为标准校准荧光计。GUS活性在pmol MU .mg中表达-1新鲜纸巾。分钟-1.每个实验变量至少进行了三次独立的重复实验。采用Microsoft Excel 2010软件对数据进行统计分析。
花青素代谢物分析
的叶子p .矮牵牛在分析花青素之前进行冻干处理。将冻干植物材料在砂浆中研磨后,用1ml甲醇/醋酸/水(9/1/10,v/v/v)在eppendorfs中提取10-20 mg的样品,超声处理后,在4℃保存16 h。18000 rpm离心10分钟后,使用配备996光电二极管阵列检测器(PDA)的Waters Alliance 2695分离模块(Waters, Zellik, Belgium)对上清液进行高效液相色谱(HPLC)分析。色谱柱为Agilent Zorbax Bonus RP (Agilent, Diegem, Belgium, 3.5 μm, 150 × 3.0 mm),进样量为10 μL。采用溶剂B(乙腈/醋酸/磷酸/水,25/20/1.5/53.5 v/v/v/v)在溶剂A(水/磷酸,98.5/1.5,v/v)中按以下时间表进行线性梯度洗脱:0分钟:25% B在A中,12分钟:35% B在A中,18分钟:48% B在A中,37分钟:在100%的溶剂B中洗涤5分钟后,柱在25%的B在A中重新平衡10分钟。从3d数据中提取530 nm色谱图。使用标准参数进行峰值积分。叶中的其他次生代谢物p .矮牵牛根据前面的描述进行分析[21].
生物信息学分析
除了克隆tf外,我们还使用了序列比较和聚类分析霍奇金淋巴瘤Myb2,霍奇金淋巴瘤Myb7,霍奇金淋巴瘤bHLH2和霍奇金淋巴瘤nncbi服务提供的核苷酸和蛋白质数据库中的WDR1, Myb, bHLH和WDR氨基酸序列(见附加文件)2,附加文件3.和附加文件4).序列分析采用系统发育管道(http://phylogeny.lirmm.fr/phylo_cgi/simple_phylogeny.cgi) [76].这些树是使用PhyML v. 3.0 (http://www.atgc-montpellier.fr/phyml) [77].生成的数据用FigTree v.1.3.1可视化。(http://tree.bio.ed.ac.uk/software/figtree).一些序列比较与DNASIS的Windows,版本2.6(日立软件工程公司,东京,日本)。由[描述的氨基酸类78用于蛋白质比较。植物独联体-作用DNA调控元件(PLACE)数据库[79]和genomic atix (Eldorado Gene2Promoter)软件的PromoterInspector选项(http://www.genomatix.de)用于筛选tf结合位点。NR2R3区域三维结构的蛋白质比较分析霍奇金淋巴瘤Myb2和霍奇金淋巴瘤Myb3通过SWISS-MODEL工作空间(http://swissmodel.expasy.org/ / SWISS-MODEL.htm) [80使用加载模板1h88C.pdb。使用Swiss-PdbViewer v3.7b2进行三维结构对齐和结构分析[81].
缩写
- 8-PN:
-
8-prenylnaringenin
- 答:
-
花青素合成酶
- EMSA:
-
电泳迁移率迁移试验
- F3H:
-
黄烷酮3-hydroxylase
- GADPH:
-
glyceraldehyde-3-phosphate脱氢酶
- 格斯:
-
ß葡萄糖醛酸酶
- 高效液相色谱法:
-
高效液相色谱法
- HSVd:
-
跳特技类病毒
- 气:
-
查耳酮异构酶
- CHS:
-
查耳酮合酶
- OMT:
-
O甲基transferase1
- 病人:
-
启动子
- 的地方:
-
植物独联体-作用调控DNA元素数据库
- RT qPCR:
-
实时定量PCR
- TF:
-
转录因子
- 副总裁:
-
valerophenone合酶
参考文献
- 1.
Zanoli P, Zavatti M:生药学和药理概况忽花布中华民族药理学杂志,2008,16(3):383-396。10.1016 / j.jep.2008.01.011。
- 2.
Magalhaes PJ, Carvalho DO, Cruz JM, Guido LF, Barros AA:黄腐酚的基本原理和健康益处,黄腐酚是从啤酒花和啤酒中提取的一种天然产物。通信学报,2009,4(5):591-610。
- 3.
Van-Cleemput M、Cattoor K、De-Bosscher K、Haegeman G、De-Keukeleire D、Heyerick A: Hop (忽花布苦味酸是一种多功能生物活性化合物。中国生物医学工程学报,2009,32(6):369 - 369。10.1021 / np800740m。
- 4.
Gerhäuser C, Alt A, Heiss E, Gamal-Eldeen A, Klimo K, Knauft J, Neumann I, Scherf HR, Frank N, Bartsch H, Becker H:啤酒花的天然产物黄腐酚的癌症化学预防活性。中华肿瘤杂志,2002,1(11):959-969。
- 5.
Avula B, Ganzera M, Warnick JE, Feltenstein MW, Sufka KJ, Khan IA:高效液相色谱法测定大鼠血浆、尿液和粪便样品中的黄腐酚。有色金属学报,2004,42(7):378-382。
- 6.
Bolca S, Wyns C, Possemiers S, Depypere H, De-Keukeleire D, Bracke M, Verstraete W, Heyerick A:补充异黄酮,戊烯类黄酮和木酚素改变了人类对植物雌激素衍生的17 β -雌二醇等价物的接触。中华营养杂志,2009,139(12):2293-2300。
- 7.
Bolca S, Li J, Nikolic D, Roche N, Blondeel P, Possemiers S, De-Keukeleire D, Bracke M, Heyerick A, Van-Breemen RB, Depypere H:啤酒花丙烯类黄酮在人乳腺组织中的分布。食品科学学报,2010,42(2):394 - 394。
- 8.
多恩C, Kraus B, Motyl M, Weiss TS, Gehrig M, Schölmerich J, Heilmann JC, Hellerbrand C:黄腐酚,一种从啤酒花中提取的chalcon,抑制肝脏炎症和纤维化。食品科学学报,2010,38(2):359 - 361。10.1002 / mnfr.200900314。
- 9.
Milligan SR, Kalita JC, Heyerick A, Rong H, De-Cooman L, De-Keukeleire D:啤酒花中一种强效植物雌激素的鉴定(忽花布L.)和啤酒。中华内分泌杂志1999,84(6):2249-2252。10.1210 / jc.84.6.2249。
- 10.
查德威克LR,泡利GF,法恩斯沃斯NR:生药学忽花布L.(啤酒花),强调雌激素的特性。植物医学,2006,13(1-2):119-131。10.1016 / j.phymed.2004.07.006。
- 11.
Possemiers S, Bolca S, Verstraete W, Heyerick A:肠道微生物组:体内的一个独立器官,具有影响植物活性的代谢潜力。水产学报,2011,82(1):53-66。10.1016 / j.fitote.2010.07.012。
- 12.
Heyerick A, Vervarcke S, Depypere H, Bracke M, De-Keukeleire D:首次前瞻性、随机、双盲、安慰剂对照研究:使用标准啤酒花提取物缓解更年期不适。中国农业科学,2006,29(3):394 - 394。10.1016 / j.maturitas.2005.10.005。
- 13.
Erkkola R, Vervarcke S, Vansteelandt S, Rompotti P, De-Keukeleire D, Heyerick A:一项关于使用标准啤酒花提取物缓解更年期不适的随机、双盲、安慰剂对照、交叉初步研究。植物医学,2010,17(6):389-396。10.1016 / j.phymed.2010.01.007。
- 14.
马图ek J, Novák P, Bříza J, Patzak J, Niedermeierová H:啤酒花中ch -特异DNA和cDNA序列的克隆与鉴定。(忽花布l .)。植物生态学报,2004,22(6):366 - 366。10.1016 / s0168 - 9452 (02) 00050 - x。
- 15.
Novák P, Krofta K, matouiek J:查尔酮合成酶同源物忽花布:一些酶的性质和表达。植物学报,2006,50(1):48-54。10.1007 / s10535 - 005 - 0073 - y。
- 16.
matouiek J, Vrba L, Skopek J, Orctová L, pezina K, Heyerick A, Baulcombe D, De-Keukeleire D:一种“真”查尔酮合成酶的序列分析(ch_H1)来自hop (忽花布L.)和PAP1激活ch异源系统中的_H1。农业食品化学,2006,54(20):7606-7615。10.1021 / jf061785g。
- 17.
冈田克也Y, Ito凯西:valerophenone合成酶基因的克隆和分析表达特别的蛇麻素腺跳(忽花布l .)。生物工程学报,2001,29(3):369 - 369。10.1271 / bbb.65.150。
- 18.
Novák P, matouek J, Bříza J:缬甲酮合成酶样查尔酮合成酶同源物忽花布.中国生物技术学报,2004,26(3):376 - 376。10.1023 /: 1024326102694。
- 19.
matouek J, Vrba L, Novák P, Patzak J, De-Keukeleire J, Škopek J, Heyerick A, Roldán-Ruiz I, De-Keukeleire D:啤酒花(Humulus lupulus L.)中调节因子HlMyb1的克隆与分子分析及啤酒花生产生物活性丙烯化类黄酮的潜力。农业食品化学,2005,53(12):4793-4798。10.1021 / jf050175y。
- 20.
matouek J, Kocábek T, Patzak J, Škopek J, Maloukh L, Heyerick A, Fussy Z, Roldán-Ruiz I, De-Keukeleire D: HlMyb3被认为是啤酒花(Humulus lupulus L.)的调控因子,在异源基因中表现出不同的生物学效应。农业食品化学学报,2007,55(19):7767-7776。10.1021 / jf071153 +。
- 21.
matouek J, Kocábek T, Patzak J, Stehlík J, Füssy Z, Krofta K, Heyerick A, Roldán-Ruiz I, Maloukh L, De-Keukeleire D:推测参与啤酒花(Humulus lupulus L.)中lupulin代谢组调控的HlbZip1和HlbZip2转录因子的克隆和分子分析。农业食品化学,2010,58(2):902-912。10.1021 / jf9043106。
- 22.
植物转录调控:组合调控的重要性。植物生理学报,2004,24(4):378 - 378。10.1104 / pp.118.4.1111。
- 23.
Hichri I, Barrieu F, Bogs J, Kappel C, Delrot S, Lauvergeat V:黄酮生物合成途径转录调控的研究进展。中国生物医学工程学报,2011,32(6):369 - 369。10.1093 / jxb / erq442。
- 24.
Feller A, Machemer K, Braun LE, Grotewold E:植物Myb和bHLH转录因子的进化和比较分析。植物生态学报,2011,26(1):1 - 6。10.1111 / j.1365 - 313 x.2010.04459.x。
- 25.
杜红,黄燕,唐燕:异黄酮生物合成的遗传与代谢工程。中国生物医学工程学报,2010,29(3):369 - 369。10.1007 / s00253 - 010 - 2512 - 8。
- 26.
Ramsay NA, Glover BJ: MYB-bHLH-WD40蛋白复合物与细胞多样性的进化。植物动态,2005,10(2):63-70。10.1016 / j.tplants.2004.12.011。
- 27.
Baudry A、Heim MA、Dubreucq B、Caboche M、Weisshaar B、Lepiniec L: TT2、TT8和TTG1协同调控了BANYULS和原花青素生物合成的表达拟南芥.植物学报,2004,39(3):366- 366。10.1111 / j.1365 - 313 x.2004.02138.x。
- 28.
Baudry A, Caboche M, Lepiniec L: TT8在一个涉及TTG1和同源MYB和bHLH因子的反馈调控中控制自己的表达,允许黄酮类化合物在细胞特异性的强积累拟南芥.植物学报,2006,29(5):366 - 366。10.1111 / j.1365 - 313 x.2006.02733.x。
- 29.
矮牵牛属植物花青素1通过不同的遗传机制控制色素合成、液泡pH值和种皮发育。植物科学学报,2002,14(9):2121-2135。10.1105 / tpc.003772。
- 30.
Hellens RP、Moreau C、lynn - wang K、Schwinn KE、Thomson SJ、Fiers MWEJ、Frew TJ、Murray SR、Hofer JMI、Jacobs JME、Davies KM、Allan AC、Bendahmane A、Coyne CJ、Timmerman-Vaughan GM、Ellis THN:孟德尔白花性状的鉴定。PLoS ONE。2010, 5 (10): e13230-10.1371/journal.pone.0013230。
- 31.
吉田K,岩坂R,岛田N, Ayabe S,青木T,樱田M:日本莲二氢黄酮醇4-还原酶多基因家族的转录控制。植物生态学报,2010,29(6):366 - 366。10.1007 / s10265 - 010 - 0325 - 6。
- 32.
山崎勇,王晓燕,王晓燕。植物化学型中花青素合成的调控机制白苏子中国生物医学工程学报,2003,14(3):191-197。10.1016 / s1369 - 703 x (02) 00222 - x。
- 33.
Morita Y, Saitoh M, Hoshino A, Nitasaka E, Iida S:日本牵牛花中R2R3-MYB、bHLH和WDR转录调控因子cdna的分离及白花c和ca突变的鉴定。植物生理学报,2006,29(4):369 - 369。10.1093 /卡式肺囊虫肺炎/ pcj012。
- 34.
Matus JT, Poupin MJ, Cañón P, bordu E, Alcalde JA, Arce-Johnson P:葡萄类黄酮合成相关基因WDR和bHLH的分离(葡萄l .)。植物生物学杂志,2010,32(6):371 - 371。10.1007 / s11103 - 010 - 9597 - 4。
- 35.
张鑫,艾伦·AC,易强,陈亮,李凯,舒强,苏娟:云南红梨果皮着色过程中差异基因表达分析。植物分子生物学学报,2011,29(2):305-314。10.1007 / s11105 - 010 - 0231 - z。
- 36.
Grotewold E, Sainz MB, Tagliani L, Hernandez M, Bowen B, Chandler VL:玉米C1中与bHLH辅助因子相互作用的Myb结构域残基的鉴定。中国科学:地球科学,2004,25(4):359 - 359。10.1073 / pnas.250379897。
- 37.
Hernandez JM, Heine GF, Irani NG, Feller A, Kim MG, Matulnik T, Chandler VL, Grotewold E:不同的机制参与R2R3 MYB转录因子C1的r依赖性活性。中国生物医学工程学报,2004,29(4):369 - 369。10.1074 / jbc.M407845200。
- 38.
Zimmermann IM, Heim MA, Weisshaar B, Uhrig JF:拟南芥MYB转录因子与R/B样BHLH蛋白相互作用的综合鉴定。植物学报,2004,40(1):22-34。10.1111 / j.1365 - 313 x.2004.02183.x。
- 39.
黄酮类化合物:生物化学通路调节和进化的彩色模型。植物科学进展,2005,10(5):236-242。10.1016 / j.tplants.2005.03.002。
- 40.
Butelli E, Titta L, Giorgio M, Mock HP, Matros A, Peterek S, Schijlen EG, Hall RD, Bovy AG, Luo J, Martin C:通过转录因子的表达富集番茄果实中促进健康的花青素。中国生物技术,2008,26(11):1301-1308。10.1038 / nbt.1506。
- 41.
Nagel J, Culley LK, Lu Y, Liu E, Matthews PD, Stevens JF, Page JE:对啤酒花腺毛体的EST分析鉴定了一种催化黄腐酚生物合成的o -甲基转移酶。植物学报,2008,20(1):186-200。10.1105 / tpc.107.055178。
- 42.
Jin HL, Cominelli E, Bailey P, Parr A, Mehrtens F, Jones J, Tonelli C, Weisshaar B, Martin C: AtMYB4转录抑制控制拟南芥抗紫外线防晒霜的产生。中国生物医学工程学报,2000,19(22):6150-6161。10.1093 / emboj / 19.22.6150。
- 43.
Preston J, Wheeler J, Heazlewood J, Li SF, Parish RW: AtMYB32在花粉发育过程中是必需的拟南芥.植物学报,2004,26(6):979-995。10.1111 / j.1365 - 313 x.2004.02280.x。
- 44.
Silvia F, Fathi MS, Tamara M, Montserrat C, Pere P, Joan R, David CR:两个新的玉米R2R3-MYB转录因子下调玉米和拟南芥咖啡酸o甲基转移酶基因。植物生物学杂志,2006,32(6):369 - 369。10.1007 / s11103 - 006 - 9058 - 2。
- 45.
Ohta M, Matsui K, Hiratsu K, Shinshi H, Ohme-Takagi M: II类ERF转录阻遏子的抑制域共享一个主动抑制的基本基序。植物细胞学报,2001,13(8):1959-1968。
- 46.
Lin-Wang K, Bolitho K, Grafton K, Kortstee A, Karunairetnam S, McGhie TK, Espley RV, Hellens RP, Allan AC:与蔷薇科花青素生物合成途径调控相关的R2R3 MYB转录因子植物生物学杂志,2010,10:50-10.1186/1471-2229-10-50。
- 47.
cartero - paulet L, Galstyan A, rogg - villanova I, Martinez-Garcia JF, Bilbao-Castro JR, Robertson DL:拟南芥、杨树、水稻、苔藓和藻类中bHLH转录因子家族的全基因组分类和进化分析。植物生理学报,2010,29(3):369 - 369。10.1104 / pp.110.153593。
- 48.
Nesi N, Debeaujon I, Jond C, Pelletier G, Caboche M, Lepiniec L: TT8基因编码拟南芥中DFR和BAN基因表达所需的基本螺旋-环-螺旋结构域蛋白。植物生态学报,2000,12(10):1863-1878。
- 49.
De-Vetten N, Quattrocchio F, Mol J, Koes R:矮牵牛花中控制花色素的an11基因座编码了酵母、植物和动物中保存的一种新的WD-repeat蛋白。中国生物技术学报,2004,21(4):369 - 369。10.1101 / gad.11.11.1422。
- 50.
王刚,田玲,Aziz N, Broun P,戴X,何静,King A,赵晓萍,Dixon RA:啤酒花腺毛中萜烯的生物合成。植物生理学报,2008,29(3):369 - 369。10.1104 / pp.108.125187。
- 51.
Maloukh L, Matousek J, Van-Bockstaele E, Roldán-Ruiz I:雌性啤酒花(Humulus lupulus L)组织实时pcr规范化的管家基因选择。植物生物化学与生物技术。2009,18(1):53-58。
- 52.
De-Keukeleire J, Ooms G, Heyerick A, Roldán-Ruiz I, Van-Bockstaele E, De-Keukeleire D:啤酒花(Humulus Lupulus L.)开花过程中α-酸、β-酸、去甲基黄腐酚和黄腐酚的形成与积累。农业食品化学,2003,51(15):4436-4441。10.1021 / jf034263z。
- 53.
Grotewold E, Drummond BJ, Bowen B, Peterson T: myb-同源P基因通过直接激活一个类黄酮生物合成基因亚群控制玉米花器官中的苯酞色素沉着。细胞科学,1994,76(3):543-553。10.1016 / 0092 - 8674(94) 90117 - 1。
- 54.
Gubler F, Raventos D, Keys M, Watts R, Mundy J, Jacobsen JV:谷物粉粉中GAMYB转录激活子的靶基因和调控域。植物学报,1999,17(1):1-9。10.1046 / j.1365 - 313 x.1999.00346.x。
- 55.
Sablowski RWM, Moyano E, Culianez-Macia FA, Schuch W, Martin C, Bevan M:花特异性myb蛋白激活苯丙类生物合成基因的转录。中国生物医学工程学报,1994,13(1):128-137。
- 56.
Sainz MB, Grotewold E, Chandler VL:玉米C1蛋白直接激活花青素启动子的证据以及相关Myb结构域蛋白与DNA结合的比较。植物生态学报,2004,25(4):369 - 369。
- 57.
Loake GJ, Faktor O, Lamb CJ, Dixon RA: H-box [CCTACC(N), CT]和G-box (CACGTG)顺式元件的组合对于苯丙酸通路中间对香豆酸前馈刺激查尔酮合成酶启动子是必要的。美国国家科学研究院。中国农业科学,2003,21(4):369 - 369。10.1073 / pnas.89.19.9230。
- 58.
Chytilová E, Macas J, Galbraith DW:靶向细胞核的绿色荧光蛋白,一种对植物生物学研究有用的转基因表型。植物学报,1999,30(6):645-654。10.1006 / anbo.1999.0866。
- 59.
安倍,山口-筱崎K, Urao T:拟南芥MYC和MYB同源体在干旱和脱落酸调控基因表达中的作用。植物生态学报,2004,22(3):369 - 369。
- 60.
Stålberg K, Ellerstöm M, Ezcurra I, Ablov S, Rask L:在转基因过程中,E-box/ABRE基序的重叠破坏导致了napA贮藏蛋白启动子的高转录芸苔属植物显著种子。植物生态学报,1998,21(4):514 -519。
- 61.
植物中基本螺旋-环-螺旋蛋白的起源和多样性。中华分子生物学杂志,2010,27(4):862-874。10.1093 / molbev / msp288。
- 62.
Zhao M, Morohashi K, Hatlestad G, Grotewold E, Lloyd A: TTG1-bHLH-MYB复合物通过直接靶向调控位点控制毛状体细胞命运和模式。发展,2008,135:1991-1999。10.1242 / dev.016873。
- 63.
Kranz HD, Denekamp M, Greco R, Jin H, Leyva A, Meissner RC, Petroni K, Urzainqui A, Bevan M, Martin C, Smeekens S, Tonelli C, Paz-Ares J, Weisshaar B:研究R2R3-MYBgene家族成员的功能特征拟南芥.植物学报,1998,16(2):366 - 366。10.1046 / j.1365 - 313 x.1998.00278.x。
- 64.
De-Keukeleire J, Roldán-Ruiz I, Van-Bockstaele E, Heyerick A, De-Keukeleire D:啤酒花中丙烯化查尔酮生物合成相关基因的筛选(忽花布l .)。学报(ISHS)。2005, 668: 93-100。
- 65.
Gatica-Arias A, Stanke M, Born U, Aldinger C, Höhnle M, Farag M, matouek J, Wessjohann L, Weber G:转基因啤酒花中类黄酮的产生(忽花布L.)被PAP1/MYB75从拟南芥植物生理学报,2012,31(1):111-119。10.1007 / s00299 - 011 - 1144 - 5。
- 66.
Saito R, fuuta N, Ohmiya A, Itoh Y, Ozeki Y, Kuchitsu K, Nakayama M:矮牵牛属植物边缘picotee花瓣形成过程中花青素生物合成的调控。植物科学学报,2006,30(4):378 - 378。10.1016 / j.plantsci.2005.12.003。
- 67.
Tohge T、Nishiyama Y、Hirai MY、Yano M、Nakajima J、Awazuhara M、Inoue E、Takahashi H、Goodenowe DB、Kitayama M、Noji M、Yamazaki M、Saito K: MYB转录因子过表达拟南芥植物的代谢组和转录组综合功能基因组学分析植物学报,2005,42(2):218- 218。10.1111 / j.1365 - 313 x.2005.02371.x。
- 68.
胡乐曼,陈晓明,陈晓明,陈晓明。农杆菌介导的啤酒花(Humulus lupulus L.)再生及转化研究。植物细胞学报,2003,22(3):210-217。10.1007 / s00299 - 003 - 0676 - 8。
- 69.
Ishida T, Kurata T, Okada K, Wada T:毛状体和根毛发育的遗传调节网络。植物生态学报,2008,29(5):366 - 366。10.1146 / annurev.arplant.59.032607.092949。
- 70.
Murray MG, Thompson WF:高分子量植物DNA的快速分离。核酸学报,1980,8(19):4321-4325。10.1093 / nar / 8.19.4321。
- 71.
Church GM, Gilbert W:基因组测序。美国国家科学研究院。科学通报,32(4):361 - 361。10.1073 / pnas.81.7.1991。
- 72.
Pfaffl MW:实时RT-PCR中相对定量的新数学模型。核酸学报,2001,29(9):2002-2007。
- 73.
Vrba L, matouieek J:转基因马铃薯植株中7SL RNA基因的表达。植物工程学报,2005,49:371- 371。10.1007 / s10535 - 005 - 0010 - 0。
- 74.
陈晓燕,陈晓燕,陈晓燕。农杆菌的转染和转化研究。中国生物医学工程学报,1998,26(2):381 - 381。10.1007 / BF00267408。
- 75.
Jefferson RA:植物嵌合基因的分析:GUS基因融合系统。植物生物学杂志,1998,5(4):387- 396。10.1007 / BF02667740。
- 76.
Dereeper A, Guignon V, Blanc G, Audic S, Buffet S, Chevenet F, Dufayard JF, Guindon S, Lefort V, Lescot M, Claverie JM, Gascuel O:系统发育。fr:非专家的鲁棒系统发育分析。核酸学报,2008,36:465-469。10.1093 / nar / gkn180。
- 77.
Guindon S, Dufayard JF, Lefort V, Anisimova M, Hordijk W, Gascuel O:估计最大似然系统发育的新算法和方法:评估PhyML 3.0的性能。中国生物医学工程学报,2010,59(3):307-321。10.1093 / sysbio / syq010。
- 78.
王晓燕,王晓燕,王晓燕,等。PP2C蛋白超家族的研究进展。蛋白质学报,1996,5(7):1421-1425。10.1002 / pro.5560050720。
- 79.
高志强,黄志强,黄志强,李志强,李志强,等。植物顺式作用调控DNA元件(PLACE)数据库:1999。核酸学报,1999,27(1):297-300。10.1093 / nar / 27.1.297。
- 80.
Arnold K, Bordoli L, Kopp J, Schwede T:一个基于网络的蛋白质结构同源建模的瑞士模型工作区。生物信息学,2006,22(2):195-201。10.1093 /生物信息学/ bti770。
- 81.
Guex N, Peitsch MC: SWISS-MODEL和Swiss-PdbViewer:比较蛋白质建模的环境。电泳,1997,18(15):2714-2723。10.1002 / elps.1150181505。
确认
作者感谢生物中心AS CR v.v.i.植物分子生物学研究所(IPMB)的Helena Matoušková, Olga Horáková, Lidmila Orctová和David Pech为我们提供了出色的技术支持。作者感谢IPMB的Jan Stehlík对RT qPCR的帮助。作者要感谢比利时根特大学名誉教授Denis De Keukeleire对手稿主题的宝贵讨论和对手稿的校对。本研究得到了捷克科学基金会GACR 521/08/0740、农业部国家农业研究局CR项目QH81052、GA ASCR AV0Z50510513以及国际合作项目FP7-REGPOT-2008-1 MOBITAG No.229518的资助。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
JM作为组长构思并协调了该项目,从cDNA文库中分离出了啤酒花TF基因,将其克隆到农杆菌属并起草了手稿。TK负责瞬时表达分析,ZF制备啤酒花cDNA文库,JPa筛选ESTs, JPr进行实时qPCR分析,AH对花青素等次生代谢物进行HPLC分析。所有作者阅读并批准了最终稿件。
电子补充材料
12870 _2011_999_moesm1_esm.pdf
附加文件1:图1所示的系统发育树中包含的R2R3Myb转录因子列表和R2R3结构域内的氨基酸序列比对。(pdf 484 kb)
蛋白质n端/R2/R3区三维结构的比较分析
附加文件2:霍奇金淋巴瘤Myb2, l -霍奇金淋巴瘤Myb3和s-霍奇金淋巴瘤Myb3.根据模板1h88C对理论结构进行了计算和描述。pdb使用SWISS-MODEL工作区。使用Swiss-PdbViewer v3.7b2(参见方法)对三维结构进行对齐。结构被表示为单条带,R2和R3重复的位置显示在对齐s-上霍奇金淋巴瘤Myb3 / l -霍奇金淋巴瘤Myb3;形成bhlh结合位点的基本残基的位置霍奇金淋巴瘤Myb2显示在s-的结构对齐上霍奇金淋巴瘤Myb3 /霍奇金淋巴瘤Myb2。疏水氨基酸取代s-中bhlh结合残基的位置霍奇金淋巴瘤Myb3在括号之间。结构偏差最大的位置在结构上用填充箭头和空心箭头表示。N和C分别是N端和C端。(pdf 141kb)
12870 _2011_999_moesm3_esm.pdf
附加文件3:图2A所示的系统发育树中包含的bHLH转录因子列表和bHLH结构域内氨基酸序列的对齐。(pdf 271kb)
系统发育树中包含的WDR tf列表如图所示
附加文件4:3氨基酸序列的排列.(pdf 984 kb)
12870 _2011_999_moesm5_esm.pdf
附加文件5:矮牵牛叶中花青素色素的相对含量(%)与不同的啤酒花tf或在用高效液相色谱法对矮牵牛深蓝色花冠中的花青素进行比较。(pdf 670kb)
12870 _2011_999_moesm6_esm.pdf
附加文件6:本研究中使用的寡核苷酸引物。本研究中使用的寡核苷酸引物列表,按其指定用途排列。(pdf 100kb)
的列表
附加文件7:根癌土壤杆菌株和载体.表农用于分析来自R2R3Myb、bHLH和WDR家族的lupulin gland转录因子的菌株和载体。(pdf 188kb)
Pchs_H1基因的修饰变异体由跳TFs驱动的GUS活性的组织化学和定量分析(补充表
附加文件8:1).(pdf 451kb)
作者提交的图片原始文件
下面是作者提交的原始图片文件的链接。
权利与权限
开放获取本文由BioMed Central Ltd.授权发布。这是一篇开放获取文章,根据创作共用授权协议(https://creativecommons.org/licenses/by/2.0),它允许在任何媒体上不受限制地使用、分发和复制,只要原著被恰当地引用。
关于本文
引用本文
马图埃克,Kocábek,帕特扎克。et al。组合分析来自R2R3Myb, bHLH和WDR家族的lupulin腺体转录因子,表明其调控复杂chs啤酒花丙烯类黄酮合成的关键基因h1 (忽花布l .)。植物生物学12日,27(2012)。https://doi.org/10.1186/1471-2229-12-27
收到了:
接受:
发表:
关键字
- 查耳酮
- 腺毛
- 瞬时表达式系统
- 花青素途径
- 黄酮生物合成途径