摘要
背景
近年来,基于成像的自动化、非侵入性和非破坏性的高通量植物表型平台已成为植物生物学的流行工具,为植物表型学领域奠定了基础。这样的平台获取和记录大量的原始数据,这些数据必须准确而可靠地校准、重建和分析,这就需要开发复杂的图像理解和量化算法。原始数据可以用不同的方式处理,过去几年出现了两种主要方法:2D图像处理和3D网格处理算法。直接的图像量化方法(通常是2D)由于相对简单而主导了目前的文献。然而,三维网格分析提供了巨大的潜力来准确估计特定的形态特征横截面和监测他们随着时间的推移。
结果
在本文中,我们提出了一种新的基于三维网格的技术,用于时态高通量植物表型学的分析,并进行初步测试陆地棉营养生长。该方法基于先前从多视角图像重建的植物网格,包括形态学网格分割、表型参数估计和植物器官随时间的跟踪。初步研究的重点是提出和验证该方法在双子叶植物(如棉花)上的准确性,但我们相信该方法将更广泛地适用。这项研究涉及到将我们的技术应用于一组六个陆地棉(棉花)植物在四个时间点上进行了研究。在每个时间点对每个植物进行人工测量,用于评估管道的准确性,并量化形态参数估计的误差。
结论
通过直接将基于自动网格的定量数据与人工测量的单个茎高、叶宽和叶长进行比较,我们得到的平均绝对误差分别为9.34%、5.75%、8.78%,相关系数分别为0.88、0.96和0.95。叶子的时间匹配在95%的情况下是准确的,在四个时间点上分析植物所需的平均执行时间为4.9分钟。因此,基于网格处理的方法适合于植物表型特征的四维定量监测。
背景
在未来几十年,预计人类将需要加倍生产粮食和生物燃料,以满足全球需求。1].为了利用现有资源实现这一目标,需要识别、量化和培育新的植物特征,以在现有环境中获得更高产的植物品种。这将需要更好地了解植物的遗传组成如何在高分辨率和高通量下决定其表型(可见性状)。植物表型学包括筛选大量的种质资源,以促进发现新的有趣的性状(向前phenomics),并分析已知的表型数据,以揭示参与它们进化的基因,并将这些基因用于植物育种(反向phenomics) [1].被调查的植物通常生长在完全受控的条件下(生长室或温室),并受到不同的环境条件和压力(例如干旱、盐、热等),主要目的是通过各种测量来监测它们的表型反应[2,3.].
感兴趣的常见植物形态性状包括主要茎高、大小和倾角、叶柄长度和起始角,以及叶宽、长度、倾角、厚度、面积和生物量等参数[1- - - - - -4].收集这些数据的通常程序包括许多费力的手工测量,通常需要破坏性的收获,因此需要对单个植物基因型或品种进行多次复制,以便随着时间的推移连续收获。对200株植物进行典型的人工表型分析(每日目标)将需要大约100工时的工作(≃根据植物的大小和复杂程度,每株需要30分钟),这是不切实际的。鉴于基因发现和农业作物改良的重要性,开发解决方案来自动化这一繁琐的任务是势在必行的。
高通量植物表型旨在通过种植、测量和分析数千株植物来扩展标准方法[5].近年来,植物表型研究出现了高通量植物筛选设施[1,6];然而,很少有图像和网格处理解决方案可用于分析捕获的大量数据并提取产量决定因素(即植物、叶片或根特征)。现有解决方案中,PHENOPSIS [7]及GROWSCREEN [8,9],为叶片表型(叶宽、长、面积和周长)和根系数据监测(根数、根面积和生长速度)提供基于二维图像处理的半自动解决方案。板(10],另一种基于2d图像的叶片形状和大小探测工具提出了对各种植物物种的叶片分析。最近的图像处理解决方案,如TraitMill [11]及HTPheno [12],提供更一般的植物分析和测量信息,如植物高度、宽度、重心、投影面积和生物体积,并提供比色分析(例如植物之间的绿色差异)。由于水稻作为主要食物资源的重要性,已经开发了基于图像的水稻表型解决方案[6,13],包括粒度(长度、宽度和厚度)、穗长和分蘖数等参数的测量。在过去两年中,已开发出用于高通量研究植物根系特征(产量决定因素)的全自动成像技术[14- - - - - -16],分析根系平均半径、面积、最大水平宽度和长度分布等非破坏性表型性状。
最新的应用为植物分析引入了第三个维度。基于立体成像和网格处理的系统,如GROWSCREEN 3D [17),三维成像和RootReader3D软件平台[18],或[19],开创了叶和根的显式3D分析,允许更精确的叶面积测量,并提取额外的体积数据。
迄今为止,文献明显以用于植物高通量表型的2D图像处理技术为主[6- - - - - -16].这些2D解决方案的主要限制是,当将可用数据从3D转到2D时,会丢失关键的空间和体积信息(例如厚度、弯曲、滚动、方向)。最近引入了基于显式3D重建的植物分析新工具[17- - - - - -19](与基于推断的3D分析相反[20.,21],自20世纪60年代以来被广泛使用)承诺在测量特征的准确性和耗尽性方面增加高通量研究的潜力,但现有的三维解决方案目前集中在特定的器官(例如叶子[17,19或词根[18]),以配合特定的图像采集系统[22],并且倾向于定性的(或应用的),而不是提供定量的信息和准确性估计。因此,显然需要基于日益明确的3D模型进行更广泛的植物分析,并对测量的可靠性进行质疑和定量评估。
在本文中,我们提出了一种新的基于网格的技术,用于植物航空部件的高通量三维分析。重点讨论了从双子叶作物棉花的三维网格中精确提取植物表型参数的可行性。在最初的研究中,网格是使用低成本的商业3D重建系统重建的[23].所提出的方法旨在对植物宏观表型进行非详尽的、准确的、横断面的(在固定时间点观察种群的代表性子集)和时间调查。这需要先进的功能,如植物网格形态分割[24,25],准确提取植物数据[26],以及植物器官的追踪。基于网格的方法在重构的植物网格上进行了测试[23,27]在四个时间点(即6×4 = 24个植物网格)对六种植物进行研究。
方法
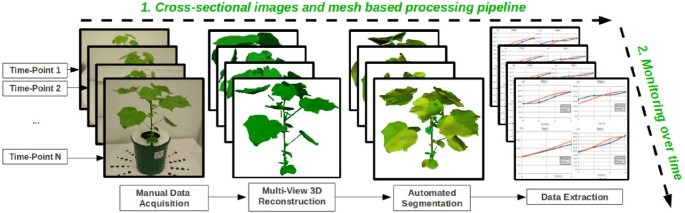
为了研究基于网格的处理管道用于植物三维分析的可行性,我们最初开发了图中所示的截面管道原型1.下面几节将简要介绍图像采集和植物网格重建步骤,并详细描述网格分割、时间表型分析和验证方案。
植物材料
原型研究包括获取和处理最初六组图像陆地棉植物研究分四个时间点进行。由X.S和S.B对每个植物和每个时间点进行人工测量,用于验证基于网格的表型数据估计的准确性和量化误差。前三个时间点涉及用卷尺测量主茎高、叶宽和叶长等侵入性(但非破坏性)参数。对于最后一个时间点,在破坏性收获后收集测量数据,以优化其精度。从主茎上切下叶柄和叶子,平铺在桌子上仔细测量。总的来说,人工收集了384个测量值(24个主茎高测量值,180个叶宽测量值和180个叶长测量值)。
植物数据采集与网格重建
一种与[12]用于从不同视角收集多个植物图像,使用高分辨率宾得K10单反相机与sigma 20-40mm非球面镜头。每个棉花花盆都放在一个旋转托盘的中心。在整个采集过程中,相机被固定在三脚架上。旋转托盘手动旋转,并在每个旋转角度拍照学位)。采集过程完成后,可获得64幅图像(每个植物和时间点)用于多视图三维重建。获得的植物图像示例如图所示1,图像分辨率为3872x2592像素(≃10像素)。
植物三维模型(网格)由高分辨率图像使用3DSOM(一种商业三维数字化软件)创建[23].构成重构网格的多边形数量在120000到270000之间波动。
采集和网格生成并不是本文的主要重点,但是我们承认其中涉及的“半自动化”步骤。自动图像采集平台[28]和网格重建算法(基于[29- - - - - -31])正在开发中,未来的实验将实现全自动化。
植物网格自动分割
不同植物器官的识别是执行基于网格的植物表型的关键阶段,并且已被证明是基于二维图像分析解决方案的问题[1].为了完成这项任务,我们开发了一种先进的网格分割算法,将植物网格划分为形态区域。
网格分割算法包括为属于同一区域的网格的所有点(称为顶点)分配一个唯一的值(称为标签)。一个表面网格是由三角形组成的,顶点通过它们的边连接在一起。如果两个顶点共用一个三角形的边,则它们被称为拓扑连接(邻居)。最后,顶点包含一个法向量,等于相邻三角形法向量的平均值。
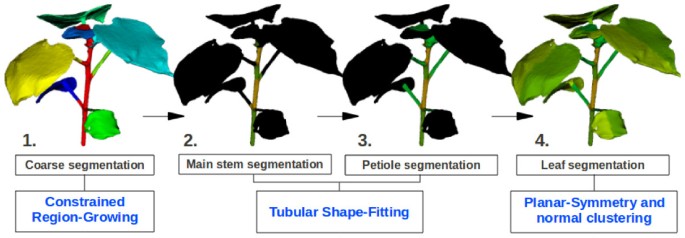
由于植物形态复杂且不规则,没有通用的网格分割算法[24,25能够准确且可靠地识别不同的植物部位(主茎、叶柄、叶片)。本文介绍了一种“混合”分割管道,克服了棉花植株之间的形态差异和由于遮挡(最常见的是缺失叶柄,因为它们被重建方案使用的图像中的叶子遮挡)造成的各种重建不一致。我们的自动分割管道,如图所示2,由4个连续步骤组成:粗分割、茎分割、叶柄分割和叶片分割。以下各段描述的所有操作都是全自动的,不需要任何人工输入[28].
步骤1:粗分割
第一步的目的是把植物分成n + 1粗区(附n=叶片数),一个对于主茎(区域米),n对叶柄和叶(区域)N我我= 1,…,n).这是通过区域增长算法来实现的[24,32].区域增长算法从一个种子点(基于应用程序定义的先前标准自动选择)开始,从一个邻居到另一个邻居逐渐增长一个区域,直到满足给定的标准。由于停止区域增长的标准是用户定义的,这种通用方法对于粗分割特别方便,但在寻求精确的区域划分时往往显示出局限性。
该方案首先定义一个粗区域米作为主杆通过拟合曲线cp从一端到另一端的主干,并分配给该区域米的给定平面半径内的所有顶点cp.剩余的顶点被分类到n地区N我使用区域增长算法。算法找到第一个还不属于任何区域的顶点(在开始时只定义了一个区域:米),将其用作种子点,并递归地将一个新区域生长到所有符合条件的拓扑邻居(创建第二个区域)N1).一个邻居,如果它不属于米或者任意一个区域N我已经创建。当没有符合条件的邻居时,区域停止增长,即所有邻居都被标记。该算法遍历网格的所有顶点,并增长一个新的区域N我每次它都会找到一个不属于任何区域的顶点米或N我已经创建(新的种子点)。该方案对于网格中的孔或分离的网格块等重建问题具有鲁棒性,因为顶点不需要连接到主网格以成为种子。这一过程的典型结果如图所示21。。
第二步:主茎分割
第二步分割基于原语拟合分割方法[33,34],目的是细化粗茎分割,并将茎划分为不同的节点间(使用之前提取的区域米).原始拟合算法包括在复杂网格中找到给定的形状(基于网格结构选择),并考虑注册形状内的所有顶点属于同一区域。在这项工作中,管形拟合算法包括寻找管参数,使点到表面的距离最小化到区域米.
该算法在曲线周围创建了一个管子cp(见前一节),并优化其半径,以紧固主阀杆周围的形状(见图)4。)。安装在最终管内的顶点被认为是主杆区域的一部分。与试管相邻的顶点(即叶柄和主茎之间的连接处)用于分蘖米进入不同的区域。一个杆间节点从一个结点到另一个结点(见图)4。)。典型的茎段如图所示22,4。。
步骤3:叶柄分割
叶柄也从每个区域的叶子中分割(并分开)N我(在分割的第一步创建)使用管状拟合。每个叶柄和相关的叶在区域N我,我们沿着叶柄插值一条曲线(使用顶点的局部质量中心),并在它周围建立一个管(见图中的红色管)4a / b)。筒部沿着叶柄延伸到叶的顶端。如果我们定义B我作为筒外最接近主茎(叶柄)的顶点,则筒内最接近主茎的所有顶点比B我属于叶柄区P我(见图4。b)。其他顶点自然属于叶区域l我.在缺少叶柄的情况下(通过与主茎的非拓扑连接检测到),跳过此步骤,并使用步骤4处理该区域。数字2.3表示叶柄分段后的典型植物网格。
步骤4:叶片分割
叶分割算法的目的是得到一个矢状面(左右部分)和横向(正面和背面:见图5.d)分割。它的设计对许多自然叶片形状变化(弯曲,随时间的变化)和由于三维重建期间的遮挡而导致的错误叶片重建(例如异常叶片厚度,叶片粘在一起)具有鲁棒性。这一阶段的高精度对于叶宽、叶长、叶面积和平均厚度的估计至关重要。所提出的解决方案是基于所有研究叶片的两个共同特性:对称性和顶点的正态向量分布(主要指向两个方向:远离叶片的正面或背面)。
对于矢状分割,基于二维对称的算法被发现是最稳健、准确和计算效率最高的。它是通过将叶片的顶点投影到以主茎轴为法线的平面上,并比较从主茎出发的矢量(cp)到顶点,向量从cp到考虑的顶点。顶点所在的区域取决于角的符号(α1而且α2在图4. c)。图中提供了这个过程的说明4. c。
横向分割涉及到使用由计算开始的普通聚类算法作为整个叶的平均法向量l我(将自然指向远离正面或背面)。第一次通过将叶顶点分为两个不同的区域(近轴或背轴),这取决于它们的法向量和形成的角度(高于或低于).然后我们重新计算仅使用属于两个创建区域之一的顶点的法向量,并使用更新的.该方案被重复,直到自然收敛发生(即。在两个迭代之间不更改)。
在三维重建中由于遮挡问题导致两片叶子合并在一起的情况下,算法检测到一个大得多的体积,分割区域l我分为两个区域,并对每个区域进行正常的叶片分割。为了创建这两个区域,算法会检测这些点f我,1而且f我, 2在这个地区,哪两个城市相距最远l我,计算质心fc我这两点中的一个,并使用所定义的平面作为分割平面fc我作为原点和归一化向量fc我来f我, 2是正常的。这一步之后的网格分割如图所示2。4。
感兴趣的表型参数
对于表型分析,重要的参数是主茎高、大小和倾角、叶柄长度和起裂角,以及叶宽、长度、面积和倾角。本节介绍了从分段植物网格中提取这些参数的过程,并特别关注叶片参数,这是植物所受胁迫水平的关键指标[2,3.].
干线
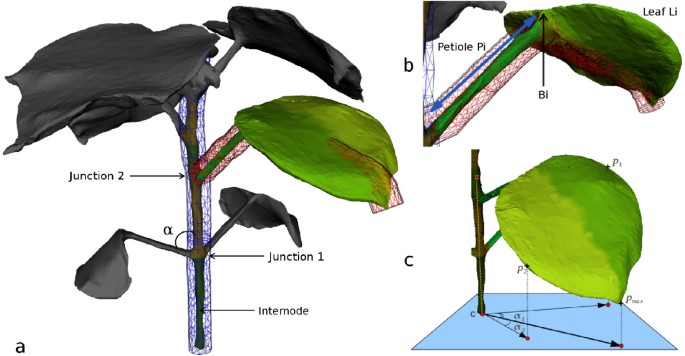
主杆高度可以表示为区域的最高顶点和最低顶点之间的高度差吗米.这两个顶点之间的归一化向量定义了主杆轴,该轴与坐标系上向量之间的角度给出了主杆的倾角。在这部作品中,主要的枝干长度定义为曲线的长度cp安装在主阀杆上。
叶柄
如果c我是否沿叶柄内插一条曲线P我(利用局部顶点质心),则叶柄的长度可表示为c我.此外,如果l我而且h我的点。c我是最接近的cp分别是最高的,然后是角度α主杆轴和矢量之间定义叶柄起始角(见α在图4。)。
叶片
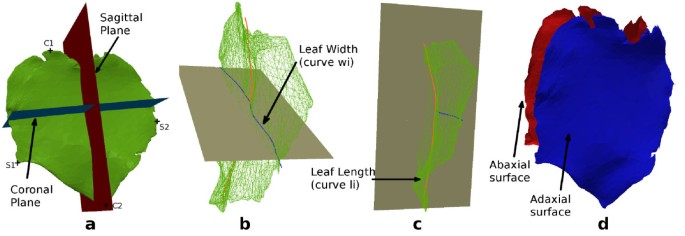
对于每个分段叶l我,我们定义lci作为叶子的质心,是向量的平均值lci的顶点正确的叶子的一部分,和当向量从lc我到叶子的顶端。让而且定义叶矢状面和冠状面(其中lc我而且平面的原点和法线是吗π我,x)如图所示5。。让年代我,1而且年代我, 2(分别地。C我,1而且C我, 2的每一边的点π我,1(分别地。π我, 2),使距离最大化π我,1(分别地。π我, 2),如图所示5。b / c。
估计叶宽(分别地。长度),我们计算曲线的长度w我(职责。l我)插值到叶片形状年代我,1来年代我, 2(分别地。C我,1来C我, 2)并投射到π我, 2(分别地。π我,1)(以除去额外的横向长度)。图中提供了说明5。b / c。投影到π我,1用作叶轴。这个轴和主茎轴之间的角度决定了叶片的倾角。叶面积可以通过平均正面和背面的面积来估计(见图)5.c),由组成它们的三角形的面积之和计算。叶片厚度可以通过平均正面每个顶点到背面最近顶点之间的距离来估计。
分析的加班时间
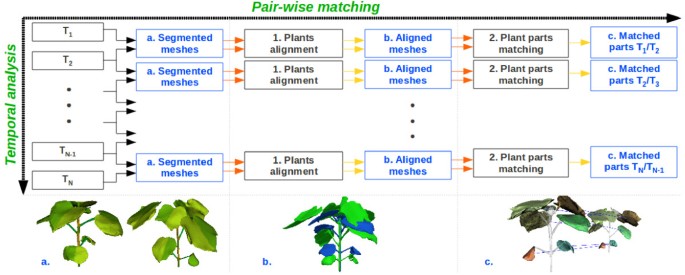
管道的这一步涉及监测估计的工厂参数随时间的变化。尽管这是茎高监测的一个简单过程,但时间叶柄和叶片参数分析需要一个有效的匹配算法,随着时间的推移跟踪不同的植物部分(由于生长条件的变化,叶片的方向和大小会随着时间的变化而变化,因此很难找到健壮的描述符)。
为了执行这个任务,我们开发了图中所示的管道3.这是基于植物器官位置在两个接近的成像日期之间变化不大的假设。我们应用相同的“成对匹配”算法(图中的横轴)3.)在所有可用的时间点(即匹配T1而且T2的,T2而且T3.,…TN−1而且TN.见图中纵轴3.),以获得叶片和叶柄的序列。该成对方案分为两个主要步骤对齐这两种植物和一种部分匹配算法。
植物对齐
位于Tx是否与工厂严格对齐Tx+ 1利用平移和绕其主杆轴旋转。平移是使用从植物中心出发的矢量进行的Tx(主茎区域的最低点)到植株的中心Tx+ 1.旋转是根据角度来执行的α使度规最小米α定义在式(1).在这个方程中,表示叶片的质心我,表示植物在时间点上的叶片数Tx,表示之间的三维欧氏距离而且.图中显示了一个对齐示例3.。b。
植物部件匹配
节间匹配
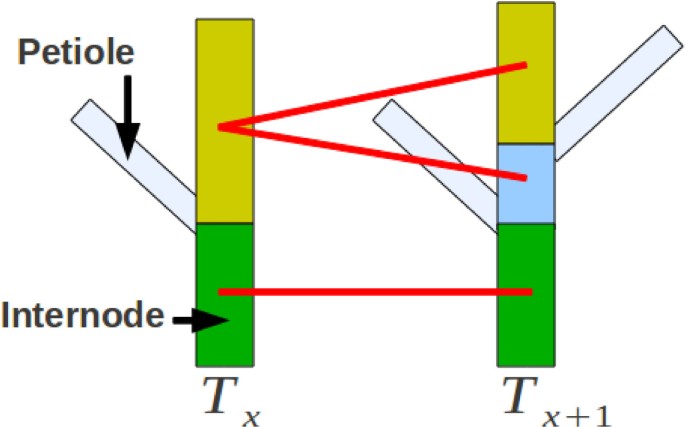
该步骤的目的是在两个时间点之间匹配植物的不同节点间。叶柄可能生长在两个时间点之间,从而在时间点上分裂植株的节间Tx分为两部分,即节间离植物的时间点Tx可以与植物的多个节间相匹配Tx+ 1.对于这两种植物,我们根据规范化的高度对节点间进行排序,检索它们的最低和最高边界,并在它们的边界之间有重叠时将它们匹配在一起。数字6显示了该过程的示意图。
叶片与叶柄匹配
使用两个对齐的植物,我们通过解决分配问题来匹配植物的不同叶子和叶柄。我们建立了一个邻接矩阵行和列),使得在给定位置(我j)在矩阵中,我们存储距离在叶片的质心之间我工厂的Tx还有那片叶子j工厂的Tx+ 1.由于植物现在是对齐的,只有当它们彼此属于给定的角度范围时,两片叶子才有资格进行成对对应,并且我们设置为当这个条件不满足时,它们在邻接矩阵中的距离。配对匹配使用简化版的匈牙利算法[35],使成对叶之间的距离之和最小化。与成对的叶片相连的叶柄同时成对。
在这一步之后,随着时间的推移,植物的形态部分被匹配。
验证方法
我们可以计算出相对误差平方差对于给定的自动测量一个我关于人工测量米我应用式(2)及(3.):
让年代一个= {年代一个1、……年代一个Ω},年代米= {年代米1、……年代mΩ}表示自动和手动主阀杆高度测量集(用Ω植物数量)。我们也W一个= {w一个1、……w一个Φ},W米= {w米1、……wmΦ}表示自动和手动叶宽测量集(用Φ总叶片数:180)。使用Eq. (2)及(3.),则可表示平均绝对百分比误差E年代,Ew,和均方根误差RMSE年代,RMSEw对主茎高和叶宽的测量采用:
类似的分析可以进行计算El而且RMSEl用于叶长测量。
这些误差可以使用上述的整个数据集计算,也可以使用从10%的异常值(最佳和最差相对误差的5%)中裁剪出来的数据集计算。此外,为了能够测试自动和手动测量之间的相关性,我们计算了平方皮尔逊积矩相关系数(R2) [36]和类内相关系数(ICC -双向随机单次测量)[37- - - - - -39].越接近R2ICC系数为1时,两次测量值之间的相关性越强。
结果
我们通过将我们的处理管道应用于初始人口为6陆地棉在4个时间点上研究的植物如下所示。
植物网格分割
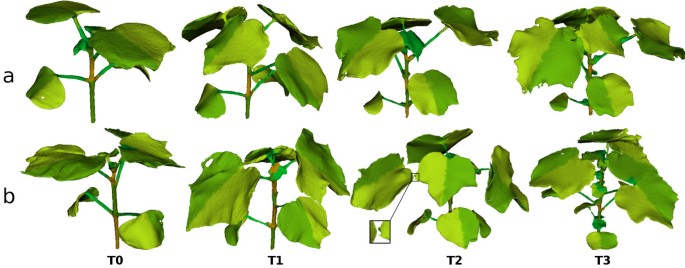
如图所示分割结果所示7时,分割管道表现良好,达到了对植物形态部分识别的目标预期。该算法已被证明对重建步骤中由遮挡引起的网格异常具有鲁棒性,包括网格中的孔和从主网格分离的植物部分(通常是缺少叶柄,参见图中的放大倍率)7b/T2)或粘在一起(见图7b / T3)。最终网格划分的精度受到三维重建质量的限制,如果叶片相对于主茎大量旋转,则可能出现叶片矢状分割的不规则性。
表型参数估计
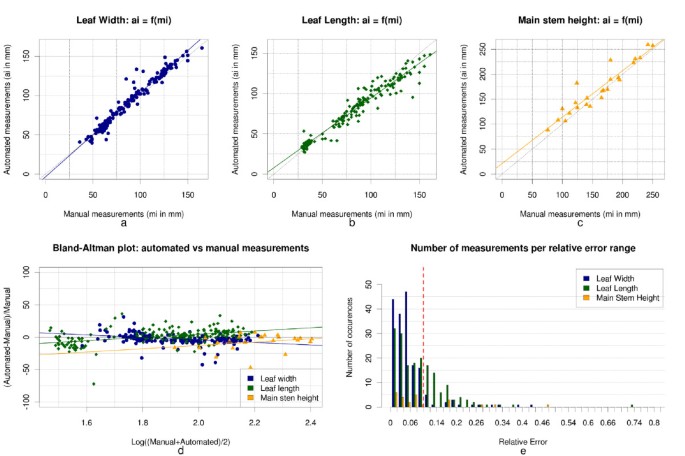
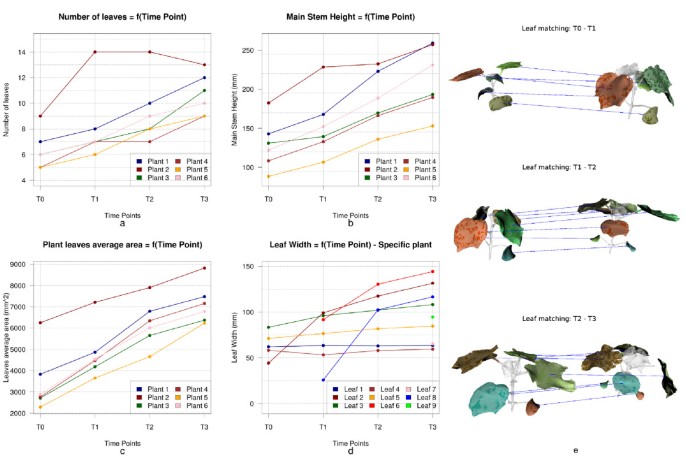
我们的方法允许我们对24个初始种群进行384个表型测量陆地棉植物网格(24个主要茎高测量,180个叶片宽度和长度测量)。总的来说,所描述的方法估计植物表型参数具有足够的准确性和可重复性,可用作人工或破坏性表型分析的替代品(表1)1).的平均绝对百分比误差E年代≃9.34%(15.9毫米,平均茎高170.9毫米),Ew≃5.75%(5.11毫米,平均叶宽88.9毫米)El≃8.78%(6.93 mm,平均叶长78.9 mm)测量主茎高,叶宽和叶长。均方根误差计算RMSE年代≃19.043毫米,RMSEw≃7.287 mm,和RMSEl≃9.707毫米。这些值提供了基于网格的测量和以毫米为单位的直接测量之间的平均差异。Bland-Altman图和相对误差分布,如图所示8.d/e,允许更彻底的误差分析,并表明,即使大多数测量是在[0 .d/e]的误差范围内执行的%10;%](见图中红色虚线8.e),分析中保留了许多异常值(Bland-Altman图上的垂直散射)。异常值的存在是由于网格分割的不精确和/或由于三维重建过程中遮挡造成的错误植物重建造成的。散点图和线性回归图如图所示8和。8.b允许欣赏基于网格和直接叶片测量之间的强相关性。绘制的点云落在稍微分散的线中,线性回归接近目标参考(即。y=x).的平方皮尔森相关和类内相关系数,集成电路Cw≃0.974,,集成电路Cl≃在叶宽和叶长测量值上计算的0.967在接近1时符合我们之前的强相关性陈述。最后,虽然图的情节8.c表示主茎高测量的点云更分散,相关系数为而且集成电路C年代≃0.941,这是我们研究可以接受的精度。
时序分析
植物的自动时间分析对于两个主要挑战相当稳健:植物随时间的生长,以及树叶随时间的拓扑结构和形状的变化。在95%的情况下,不同植物器官的正确匹配(缺失的叶柄被忽略)。图中提出了对超过4个时间点的工厂应用成对匹配管道所获得的结果的说明9社会事务部。当前匹配方案的一个依赖项是,需要准确识别器官才能进行匹配。
计算成本
自动化3D分析在一台配备英特尔酷睿2 Duo E8300 (2.83GHz)处理器的标准计算机上进行。网格分析的平均执行时间为4.9分钟,在四个时间点上对六种植物进行完整分析的总时间为29.3分钟(植物网格被抽取到70000个三角形,并且在标准加速技术之外没有算法优化)。表格2提供了我们算法的计算成本的完整分析。从表2和图9.a中,我们可以表示,叶片数量越高,执行分析的时间就会越长(由于重复的叶片分割和数据计算,例如Plant 2)。执行全基于网格的分析(不包括3D重建)所需的时间比任何手动方法都快,并且所执行的分析提供了关于数据随时间演变的额外信息。未来的工作将涉及并行算法的不同阶段(例如分割的第2步和第3步,叶子分割,或从Eq. (1),以及利用集群和云计算技术来访问更重要的计算资源。
额外的结果
与本文相关的网站提供了其他结果[见附加文件]1].
讨论
如图所示9。,9。b,9. c,9.d,对6的表型参数的时间演化进行了比较研究陆地棉对于植物,我们的方法可以对植物的表型性状进行精确的监测。通过开发一种用于植物表型的混合网格分割和分析方法,我们已经证明了基于时间网格的植物地上部分自动化分析是可行的(从时间广义植物分析到单个器官的进化)。
然而,我们最初的研究有一些局限性,应该承认,这将导致进一步的调查和发展。
到目前为止,试点研究在估计表型参数的耗竭性方面受到限制,但植物形态部分的明确3D重建和可靠识别允许估计大量植物生物学家感兴趣的参数,这些参数不容易通过现有软件平台从2D图像中提取(准确的叶面积和生物体积而不是投影面积,单个叶子的生长,器官随时间的定量,叶数/叶长,叶角)。随着生物学家需求的发展,更多的表型参数提取可以很容易地开发并整合到我们的管道中,允许重用现有的3D模型库,并有能力定制管道以适应新的性状识别和量化。植物结构是作物辐射利用效率的重要决定因素,在显式3D中分析这一特征,随着时间的推移,除了低通量之外,以前一直是一个棘手的问题[1].然而,我们应该承认,自20世纪60年代早期以来,基于推断的3D“重建”(即使用管状等形状的3D近似)的根的3D分析工具已经存在并被广泛使用[20.,21,40].
尽管该方法仅被测试过陆地棉预计该方法将广泛而容易地适用于其他双子叶作物,如油菜、番茄和具有简单结构的低分蘖单子叶作物,如玉米。该管道易于适应,操作符可以实现和组合,以增加算法的灵活性。通过在玉米上重复使用分割管道的前两个步骤(粗分割和茎分割)获得的初步结果(未发表),允许分离主茎、叶片和节点间,并允许直接计算玉米特定数据。由于水稻和小麦作为主要粮食作物的重要性,基于图像的植物表型学工具在草类中的应用具有很大的意义。我们需要对管道进行重大开发,以应对由于复杂结构和谷物作物中观察到的分蘖造成的堵塞。他们的调查将包括将最先进的重建和分割算法推向极限。
就表型参数的准确性而言,5 - 10%的误差(涉及叶片的5mm - 7mm范围)对于形态尺度表型是可以接受的,反映了人工测量固有的误差的量级以及在具有相同遗传组成的单株之间观察到的差异,并且足够低,可以区分发育过程中两个成像日期之间相关性状的变化(这是我们的研究目标)。对于平均绝对误差超过10%(或超过10mm范围,例如主阀杆测量)的测量,将涉及进一步的工作以提高精度(例如,主阀杆高度测量的平均偏置误差-系统高估/低估的特征)MBE年代≃9.8毫米,而MBEw≃−2.7毫米而且MBEl≃3.1毫米对于叶宽和叶长测量,需要对主茎高测量进行系统的高估)。最后,我们目前的目标是将测量误差降低到5%以下,我们相信这是可以实现的,我们可以在现有植物建模技术生成的幻影植物网格(具有确切的表型参数)上训练我们的算法[4,41].
虽然目前的研究重点是对商业3D重建产品生成的网格进行处理,但未来的主要工作将包括通过将可见光图像以外的数据纳入3D模型来改善植物结构和功能的数字化。除了收集多个视图几何图形的可见光摄像机,PlantScan,我们实验室最近开发的新筛选平台[28]配备了激光雷达(光探测和测距传感器)、红外摄像机和多波长摄像机。激光雷达相机允许重建精确的点云(精度为200微米),这将集成在我们的概率重建方案[29- - - - - -31],以提高目前限制形态分割和时间分析质量的重建植物网格的准确性。这些网格将覆盖热红外数据和多光谱图像数据,提供比色信息(用于化学成分和光合功能分析)。我们实验室预计每7分钟扫描一株植物,使得目前基于网格的方法(3D重建除外)适合于高通量双子叶植物分析。由于3DSOM重建合适的网格平均需要15分钟的处理时间,因此将特别关注所制定的重建方案的效率。
结论
在本文中,我们提出了一种基于混合网格的高通量植物表型学研究方法。提出的解决方案提供了先进的网格处理功能,包括植物网格形态分割、精确的植物空中部分表型参数估计、个体器官跟踪和数据监测。实验包括在最初的六株陆地棉植物上测试我们的加工管道,这些植物在四个时间点上进行了分析。
从本文中提出的定性和定量结果来看,我们认为开发基于网格的高分辨率和高通量植物表型学平台的方法是可行的,并且与目前使用少量2D图像的系统相比具有多种优势。所提出的混合网格分割允许识别所有测试植物的不同植物器官。表型参数估计算法允许检索诸如主茎高度和倾斜度、叶柄长度和起始角以及叶宽、长度、面积和倾斜度等测量值。通过将384个基于网格的测量结果与人工测量结果进行比较,我们观察到误差在5.75%至9.34%之间,相关性在0.887至0.974之间。时间器官追踪算法在95%的病例中成功地在时间点之间匹配了植物器官。最后,提出的分析方法平均只需要4.9分钟就可以分析四个时间点的植物。因此,基于网格的分析被认为是进行准确和高效的三维植物表型分析的合适手段。
可用性和需求
本文中介绍的不同操作符,以及最初的一组植物网格,可从PlantScan主页下载(Microsoft Windows 64位安装程序):[28].
参考文献
- 1.
弗班克RT,测试者M:表型组学-缓解表型瓶颈的技术。植物动态,2011,16 (12):635-10.1016/j.tplants.2011.09.005。
- 2.
Granier C, Tardieu F:响应环境变化的叶片扩张的多尺度表型:整体大于部分之和。植物细胞环境学报,2009,32 (9):1175-10.1111/j.1365-3040.2009.0195 .x。
- 3.
许志刚,刘志刚,王志刚,王志刚,王志刚:干旱胁迫下蓖麻叶片生长、细胞结构和库源转换的动态研究。J Exp Bot. 2000, 51 (350): 1515-10.1093/jexbot/51.350.1515。
- 4.
吴晓明,吴晓明,吴晓明,吴晓明。植物功能结构建模:一种新的多功能作物科学工具。J Exp学报,2010,61 (8):2101-10.1093/jxb/erp345。
- 5.
黄志强,李建平,李志强,等。植物表型数据采集、转化与分析。生物信息学,2009,:259。
- 6.
段磊,杨伟,黄超,刘强:基于机器视觉的水稻产量相关性状自动评价。植物学报,2011,7:44-10.1186/1746-4811-7-44。
- 7.
Granier C, aguirzabal L, Chenu K, Cookson S, Dauzat M, Hamard P, Thioux J, Rolland G, boucher - combaud S, Lebaudy A,等:拟南芥植物对土壤水分亏缺响应的可重复表型自动化平台PHENOPSIS允许对土壤水分亏缺低敏感性的亲本鉴定。中国植物学报,2006,26 (3):623-10.1111/j.1469-8137.2005.01609.x。
- 8.
Walter A, Scharr H, Gilmer F, Zierer R, Nagel K, Ernst M, Wiese A, Virnich O, Christ M, Uhlig B,等:通过GROWSCREEN可以量化幼苗对改变光照条件的生长适应动态:一种用于不同植物物种快速光学表型的设置和程序。植物学报,2007,34 (2):447-10.1111/j.1469-8137.2007.02002.x。
- 9.
Jansen M, Gilmer F, Biskup B, Nagel KA, Rascher U, Fischbach A, Briem S, Dreissen G, Tittmann S, Braun S, De Jaeger I, Metzlaff M, Schurr U, Scharr H, Walter A:通过GROWSCREEN FLUORO对叶片生长和叶绿素荧光同时进行表型分析,可以检测拟南芥和其他玫瑰丛植物的胁迫耐受性。植物学报,2009,36 (11):902-10.1071/FP09095。
- 10.
Bylesjö M, Segura V, Soolanayakanahally R, Rae A, Trygg J, Gustafsson P, Jansson S, Street N: LAMINA:快速量化叶片大小和形状参数的工具。中国生物医学工程学报,2008,28(4):344 - 344。
- 11.
Reuzeau C, Pen J, Frankard V, de Wolf J, Peerbolte R, Broekaert W:谷物增产基因的发现引擎。分子之物育中(Mol植物育种)。2005, 3: 7534。
- 12.
Hartmann A, Czauderna T, Hoffmann R, Stein N, Schreiber F: HTPheno:用于高通量植物表型的图像分析管道。中国生物医学工程学报,2011,29(4):344 - 344。
- 13.
杨伟,徐旭,段丽,罗强,陈松,曾松,刘强:基于X射线计算机断层扫描的水稻分蘖高通量测量。科学通报,2011,32(2):379 - 379。
- 14.
Naeem A, French A, Wells D, Pridmore T:根的高通量特征计数和测量。生物信息学,2011,27(9):1337-10.1093/生物信息学/btr126。
- 15.
杨晓明,张晓明,张晓明,等。基于PlaRoM的根生长动态、侧根形成、根结构和根毛发育的高通量表型分析。植物学报,2009,36 (11):938-10.1071/FP09167。
- 16.
Iyer-Pascuzzi A, Symonova O, Mileyko Y, Hao Y, Belcher H, Harer J, Weitz J, Benfey P:植物根系表型和性状自动排序的成像和分析平台。中国生物医学工程学报,2010,32(3):344 - 344。
- 17.
Biskup B, Scharr H, Fischbach A, wise - klinkenberg A, Schurr U, Walter A:用一种新的高通量三维成像方法分析离体叶片的Diel生长周期与完整叶片的Diel生长周期相同。植物学报,2009,49 (3):344 - 344 /pp.108.134486。
- 18.
Clark R, Maccurdy R, Jung J, Shaff J, McCouch S, Aneshansley D, Kochian L:三维根表型的新成像和软件平台。中国生物医学工程学报,2011,26(3):344 - 344。
- 19.
王慧,张伟,周刚,闫刚,Clinton N:基于图像的玉米三维几何结构参数反演。遥感学报,2009,30(20):5505-10.1080/01431160903130952。
- 20.
黄强,Stockman GC:广义管模型:从2D强度图像中识别3Delongated对象。CVPRIEEE;1993:104 - 109。
- 21.
黄强,李志强,王志强,王志强。植物根系结构的自动图像分析。模式识别,1992年。Vol.II。会议B:模式识别方法与系统,论文集。,第十一届iapr国际会议;1992:569 - 572。
- 22.
Nathalie W, Jean-Christophe P:拟南芥叶片的高对比度三维成像能够分析表皮和叶肉的细胞尺寸。植物学报,2010,6(17):1。
- 23.
Baumberg A, Lyons A, Taylor R: 3D soma 3D扫描的商业软件解决方案。图形模型,2005,67 (6):476-10.1016/j.gmod.2004.10.002。
- 24.
沙米尔A:网格分割技术的调查。计算机图形学论坛,2008,27 (6):1539-10.1111/j.1467-8659.2007.01103.x。
- 25.
Golovinskiy A, Funkhouser T:三维模型的一致性分割。计算图形(形状Modeli Int)。2009,33(3): 262。
- 26.
Cornelissen JHC, Lavorel S, Garnier E, Díaz S, Buchmann N, Gurvich DE, Reich PB, Steege HT, Morgan HD, Heijden MGaVD, Pausas JG, Poorter H:全球植物功能性状标准化和简单测量的协议手册。计算机工程学报,2003,24 (4):335-10.1071/BT02124。
- 27.
倪文杰,王文杰,王文杰。基于移动单视角相机的三维物体自动重建。《三维数字成像与建模》,1997年。程序。,International Conference on Recent Advancesin IEEE; 1999:173–180.
- 28.
- 29.
Franco J, Boyer E:使用空间占用网格的多视图剪影线索融合。《计算机视觉》,2005。ICCV 2005。第十届IEEE国际会议,第2卷;2005:1747 - 1753。
- 30.
Kolev K, Klodt M, Brox T, Cremers D:多视图三维重建中的连续全局优化。应用计算机学报,2009,34(1):1 - 3。
- 31.
Hosoi F, Omasa K:使用高分辨率便携式扫描激光雷达估算叶面积密度的个体树基于体素的三维建模。地球科学遥感,IEEE学报。2006, 44(12): 3610。
- 32.
Vieira M, Shimada K:基于区域生长的表面网格分割和光滑表面提取。计算辅助几何学报,2005,22 (8):771-10.1016/j.cagd.2005.03.006。
- 33.
Attene M, Falcidieno B, Spagnuolo M:基于拟合原语的分层网格分割。计算机应用,2006,22 (3):181-10.1007/s00371-006-0375-x。
- 34.
Mortara M, Patan´e G, Spagnuolo M, Falcidieno B, Rossignac J:水管工:一种将3D形状分解为管状原语和主体的多尺度方法。第九届ACM固体建模与应用研讨会论文集;2004:339 - 344。
- 35.
Kuhn H:分配问题的匈牙利方法。海军后勤问题,1995,2(1-2):83。
- 36.
Rodgers J, Nicewander W:看相关系数的13种方法。统计学家。1988,42(1):59。
- 37.
科赫G:类内相关系数。科学通报,1983,(4):472。
- 38.
Shrout P, Fleiss J:内部相关性:用于评估评分者的可靠性。心理公牛。1979,86(2):420。
- 39.
用类内相关系数来衡量信度。心理学R. 1966, 19: 3。
- 40.
Danjon F, Reubens B:木本根系三维结构的评估和分析,树木和土壤稳定性,资源获取和分配的方法和应用综述。土壤学报,2008,34(3):397 - 397。
- 41.
Pradal C, Dufour-Kowalski S, Boudon F, Fournier C, Godin C: OpenAlea:用于植物建模的可视化编程和基于组件的软件平台。植物学报,2008,35 (10):751-10.1071/FP08084。
确认
本文中描述的分析管道是作为联邦政府国家合作研究基础设施战略(NCRIS)下基础设施拨款的一部分而开发的。美联社得到了堪培拉澳大利亚首都特区政府资助的高分辨率植物表型中心奖学金的支持。作者感谢Francois Tardieu博士(INRA, Montpellier, FRANCE)对手稿的有益评论和周到的审查。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
XS、SB和RF分别对植物进行人工数据采集、三维重建和人工测量。AP和JF建立了自动图像和基于网格的分析管道(分割,数据提取,时间分析)。AP, JF和XS是本文的主要作者。所有作者都阅读并批准了最终的手稿。
电子辅助材料
12870 _2012_1062_moesm1_esm.zip
附加文件1:展示结果的网站。网站,其中包含将我们的方法应用于初始植物网格集所获得的结果。不同的结果以包含不同网页链接的表格形式呈现。不同时间点之间的分割和时间匹配结果以图像的形式提供。用我们的方法估计的表型参数以表格的形式提供。此外,包含所有基于网格和人工测量的电子表格可作为网页提供,并包含论文中提出的统计分析。(zip 17 mb)
权利和权限
本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用属性许可协议(http://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
帕普罗基,A,西罗,X,贝里,S。et al。一种基于网格处理的三维植物分析新技术。BMC植物生物学12,63(2012)。https://doi.org/10.1186/1471-2229-12-63
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-12-63
关键字
- 干线
- 叶宽度
- 叶柄长度
- 网格分割
- 表型参数