摘要
背景
在过去的十年里,苔藓小立碗藓已成为一种强大的工厂模型系统,适用于任何其他植物中的遗传操作。这种苔藓特别适用于植物偏振细胞生长研究,如在其原型相中,膨胀被限制在其细胞的尖端。基于花粉管和根毛研究,众所周知,尖端生长需要活性分泌和细胞组分的高偏振。但是,这些信息仍然缺失小立碗藓.要深入了解细胞器组织参与尖端增长的机制,必须确定苔藓细胞中细胞器的分布和动态。
结果
我们使用荧光蛋白融合来可视化和跟踪活原蛋白细胞中的高尔基体、线粒体和过氧化物酶体。利用叶绿素自荧光技术对叶绿体进行可视化跟踪。在原体细胞中,四个细胞器从顶细胞的顶端到亚顶细胞的基部呈梯度分布。高尔基体在茎叶和绿茎叶顶端的密度分别是基部的4.7倍和3.4倍。高尔基体主要集中在茎叶顶端,而叶绿体和过氧化物酶体则完全被排除在外。有趣的是,长得比氯藻快的梧桐,也比氯藻含有更多的高尔基体和更少的叶绿体。运动分析表明,原质体细胞器的运动持久性较低,平均瞬时速度为29 ~ 75 nm/s,比花粉管或根毛细胞器慢至少3个数量级。
结论
据我们所知,本研究报告了细胞器的第一次定量分析小立碗藓并对不同顶端生长细胞的细胞器分布和动态进行了比较,从而加深对植物极化细胞生长机制的认识。
背景
植物细胞具有各种各样的形状和形态,如拼图状的叶表皮细胞和长丝状的根毛。这种多样性是由于细胞生长的不同机制而成为可能的,在这种机制中细胞壁和质膜的延伸发生在一个受限区域,这需要细胞骨架和内膜系统的动态协调[1- - - - - -3.].例如,在经历偏振细胞生长的花粉管和根毛中,膨胀被限制在伸长细胞的尖端。苔藓小立碗藓是一种特别合适的植物模型系统,用于研究偏振细胞生长,不仅用于其对遗传研究的可扫描[4- - - - - -6]但也因为在其单倍性配方化合物期间,其原型通过特定类型的偏振生长膨胀,称为“尖端生长”[7].苔藓原丝是由两种类型的细长细胞的:chloronemata其高度液泡化,含有大量叶绿体和主要涉及光合作用,和caulonemata这更薄,时间越长,包含一个基底液泡和较少的叶绿体,并且在土地定植有牵连和营养获得[8,9].对不同种类的苔藓进行了超微结构分析葫芦藓Physcomitrium turbinatum, dark-grownCeratodon紫色和小立碗藓,表明氯根菌的细胞器分布均匀,而茎根菌的细胞质组织分化[10.- - - - - -13.].在最近的一项研究中,液泡的形态小立碗藓利用t-SNARE的GFP融合作为液泡膜标记对绿线虫进行了更详细的研究[14.].结果表明,顶端氯妥泡液中的真空具有高度动态和复杂的管状突起,而它们的结构在亚顶壳细胞中更简单。但是,我们目前关于细胞器的分布和动态的知识Physcomitrella目前的研究还非常有限,需要进一步的分析来评估细胞器组织在叶尖生长中的参与,以及这种组织是如何在苔藓原体中实现和维持的。
众多研究报道,花粉管和根毛,两个尖端生长植物细胞,显示其细胞质及其细胞器的结构和功能性舱室化,这被认为是对尖端生长至关重要的研究[15.- - - - - -19.].早期的研究报道了被子植物花粉管中细胞质的“带状”,但传统上用于这些超微结构研究的化学固定被发现会影响细胞器的分布[16.].20世纪90年代,快速冷冻固定和冷冻替代技术的应用,使其更具有代表性体内细胞质组织[20.- - - - - -22.].花粉管尖端的顶点极端几乎完全由通常被称为一个倒圆锥形的结构域高度能动囊泡。大细胞器在整个与线粒体和管状ER尤其集中在一个“空白区”侧翼富囊泡区域和在子顶端区域高尔基高尔基细胞的其余部分分布。质和大液泡占据大部分透明带后面的远端区域。德克森等。(1995)也进行了一些细胞器在烟草花粉管一个形态和定量分析[21.].他们发现,线粒体形成长度达2.5 μm的圆形或椭圆形结构,高尔基体的大小和形状均均匀(< 1 μm),并包含4至6个池。两种细胞器在柄中大多平行于管的纵轴方向,但在细胞质流动方向改变时表现出不同的方向。烟草花粉管的前40 μm含有~130个线粒体和~ 40个高尔基体[21.].类似的细胞质和细胞器极化分布已被描述在生长的根毛从不同的物种,如拟南芥,野豌豆或Medicago Truncatula.[15.,23.- - - - - -27.].也填充囊泡的顶点略小于花粉管,距离顶点小于10μm,然后富含40μm的细胞内细胞内的亚顶部和真空基底区域。
在90年代后期,在分子生物学,并与特定的细胞器官的酶或蛋白质居民荧光蛋白融合的发展进步允许单细胞器的活细胞中的可视化[28.].一套荧光细胞器标记现在在植物中可用,一个计算方法的结果,以确定每个细胞器的目标基序[29.- - - - - -31.].使用这些技术,几个独立的小组已经证实,从细胞器的花粉管和根毛分布的超微结构研究的意见。在这两种百合和烟草中,GFP融合至ER滞留基序HDEL标签一个复杂的互连网络,存在于整个花粉管与倒置锥体后面增强密度[19.,22.,32.].表达针对线粒体的GFP融合蛋白的烟草花粉管显示出与ER标记和标记个体相同的分布,短丝状结构,而百合花粉管和拟南芥根毛线粒体用荧光探针MitoTracker显示出一个不明确结构的分支网络[19.,22.,32.,33.].一组与不同的Rab蛋白融合的GFP,被用来特别可视化高尔基体,它在整个烟草花粉管中呈现出点状的模式,除了在倒置的圆锥体,以及在顶端积累的核内体和分泌囊泡[19.,32.].高尔基盘体在拟南芥根毛中的分布也被证实与花粉管中的分布相似[34.].过氧化物酶体靶向GFP标记的离散的,在烟草花粉管punctuted结构并且是从透明带缺席[19.,32.].荧光标记物的表达也被证明是一种更合适和强大的工具来调查活细胞中的细胞器动力学。例如,显示来自烟草的花粉管中的细胞器,其瞬时速度范围为0.5至1.5μm/ s [35.,36.].The instantaneous velocity of Golgi dictyosomes, mitochondria and peroxisomes measured in Arabidopsis root hairs was ~ 1 μm/s [34.,37.].
在这篇文章中,我们首次提供了细胞器的定量分析小立碗藓使用活细胞显微镜。结果表明,原质体中细胞器的分布具有极高的梯度,细胞器的运动持久性较低,平均瞬时速度在nm/s范围内。通过比较不同顶端生长植物细胞细胞器的分布和动态,旨在更好地了解细胞器组织对植物顶端生长的重要性。
结果
实验设计与分析
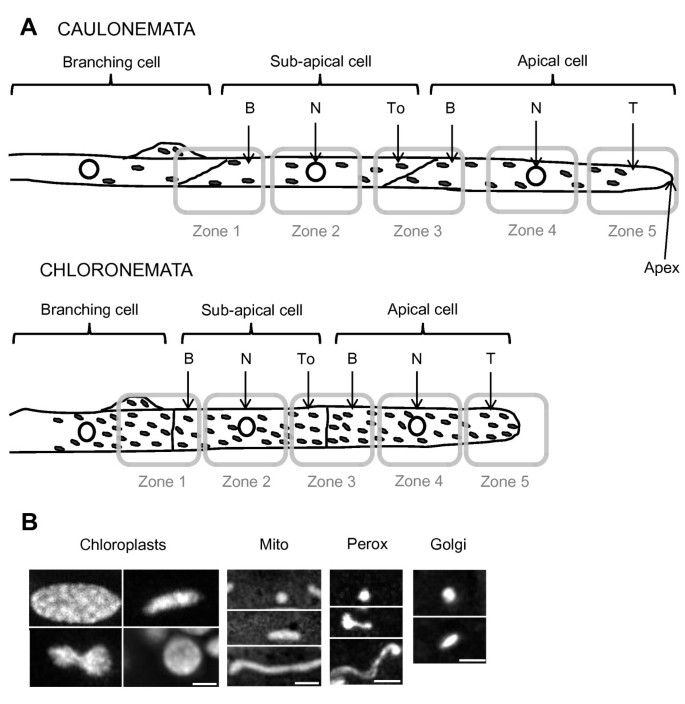
为了确定活苔藓原体细胞中细胞器的分布和动态,我们使用荧光蛋白融合技术可视化和跟踪高尔基体、线粒体和过氧化物酶体,以及叶绿体的叶绿素自荧光。为了保证测量结果的可重复性,我们选择拍摄一个星期的苔藓丝,其中从顶端的第三个细胞已经开始分枝。如图所示,沿着顶端和亚顶端原体细胞表达荧光细胞器标记的五个区域以顶端、核区域或细胞壁区域为中心1答:重要的是要注意,每个区域的长度为43至48μm,顶端和亚顶端电池的平均总长度为157.2 +/-34.7μm和116 +/-11μm,用于caulonemata,102.3对于氯豆类,+/-18.7μm和75.6 +/-10.9μm,表明成像整个细胞(或壳体的大部分细胞的大部分)。然而,由于细胞壁区域(3和1)包括两个细胞,我们将这些区域分成两个不同的区域进行定量分析,如图所示1答:我们首先进行研究的所有细胞器的形态分析;数字1B总结了苔藓细胞中遇到的不同细胞石形态。对于定量分析,在共聚焦成像之后,计算每个整个区域的体积,并且在图像处理和图像处理和分析之后,如方法中所述确定在每个区域中检测到的细胞器数。从这些数据中,每个区域计算细胞器密度。在定义每个细胞的每个细胞的平均体积和每个细胞器的每个细胞的平均密度之后,我们推断了每个细胞中存在的细胞器总数。
氯气属植物的叶绿体明显多于茎气属植物
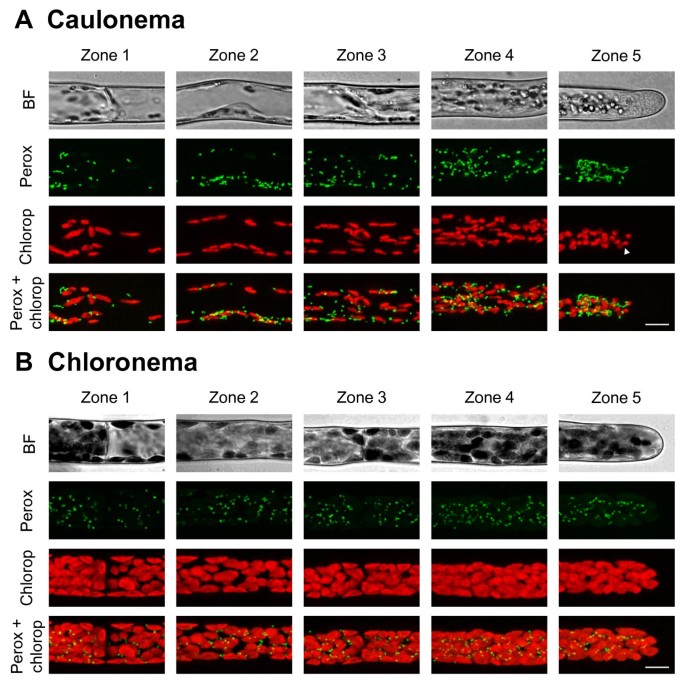
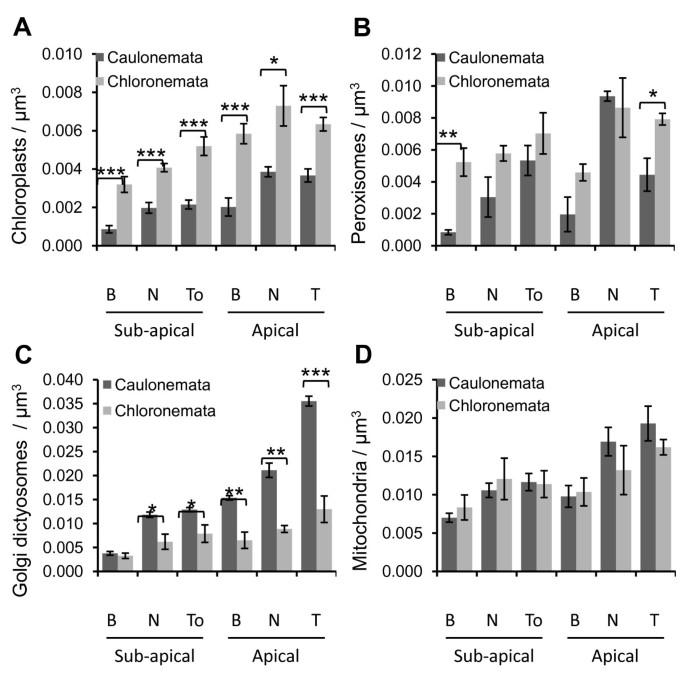
叶绿体和质体一般都是较大的细胞器,用光镜可以很容易地观察到。因此,叶绿体含量的差异常被用来作为区分富叶绿体和贫叶绿体的茎叶线虫的标准。然而,还需要对细胞器进行定量研究,以充分了解这两种细胞类型的不同功能,特别是它们如何实现和维持极化尖端生长。为了确定苔藓原体中叶绿体的分布,采用了在488 nm激光激发下具有红色荧光特性的叶绿素作为荧光标记。我们观察到,和其他组一样,叶绿体在氯藻中显示出一个大的卵形(图)2B3.B4b)[8].我们还确定它们的长度可达7 μm,宽度可达4 μm。与此相反,茎叶植物叶绿体的数量在形状和大小上表现出更多的多样性。在顶细胞中,它们多为圆形和小的(2-3 μm),在亚顶细胞中,它们的长度更长,可达4.5 μm(图)2一个3.一个4一种)。在取决于组织高等植物和取决于分化阶段其它藓类植物中观察到叶绿体形态的这种变化[8,9,38.].在addition, the distribution of chloroplasts is not homogeneous throughout the caulonemata, for they are absent from the extreme tip of the apical cell, 9 to 15 μm from the apex, and become peripheral in the sub-apical cells due to the voluminous vacuoles as shown in Figures 2一个3.一个4A.此外,我们还确定了氯藻的每个区域包含的叶绿体明显多于它们的caulonemata同源物(图5一种);我们估计,顶端和子根尖细胞含有146 +/- 36和82个+/- 15叶绿体,分别为chloronemata与11.8+/−24 and 52+/−18 for caulonemata (Means ± SD of 9 cells each). Despite these differences, chloroplasts are distributed in a gradient along both filaments, the chloroplast density being significantly higher at the tip of the apical cells than at the base of the sub-apical cells (Figures 23.45A,见其他文件1).的梯度也细胞内观察到。在从caulonemata顶端和子顶端细胞中,尖端或面向尖端区和核区域显示显著更高量的叶绿体比基部区域的(参见附加文件2).类似地,在氯藻中,顶端指向的区域包含的叶绿体明显多于亚顶端细胞的基部(见附加文件)3.).
细胞器密度小立碗藓原丝体。叶绿体密度(一个)、过氧化物酶体(B)、高尔基体(C)及线粒体(D在6个不同caulonemata和chloronemata与B的区域)检测:基础;n:核领域;到:面向尖端的区域;T:提示。结果表示为单元的数目的平均值进行分析(叶绿体,N= 9;过氧化物酶体,N= 3;高尔基高尔基体,N= 4茎叶和N= 3;线粒体,N= 6茎叶和N = 3 for chloronema). Error bars indicate the standard error of the mean (samples are statistically different with the following error probabilities: *P< 0.05;Arunachal Pradesh,P< 0.01;***P< 0.001,T.以及)。
过氧化血剂显示于MOSS Protonemata的叶绿体的类似分布
根据植物过氧化物酶体靶向信号(PTS)设计过氧化物酶体标记物[29.,39.,40],通过将PTS融合1 SKL到CFP(CFP-SKL)的C末端。Caulonemata和Chloronemata都含有单个细胞内各种尺寸和形状的过氧化物(图2).它们大多数为球形,直径在0.4 - 0.6 μm之间,管状延伸长度为1-2 μm,称为过氧化物[41.,经常在梧桐中观察到,偶而在氯桐中观察到。这些结果与拟南芥、烟草叶表皮细胞、洋葱表皮细胞和烟草花粉管的结果一致[19.,30.,41.,42.].However, in the tip area of the caulonemata, peroxisomes mostly appear as twisted filaments which can reach up to 8 μm in length and are excluded from the extreme tip of the cells as previously described for the chloroplasts (figure2一种)。我们注意到,过氧化物酶在与这两类细胞的叶绿体接近经常发现(数据未显示)。We determined that the extrapolated total number of peroxisomes in chloronemata is 159+/−35 for apical cells and 119+/−26 for sub-apical cells, and in caulonemata, 186+/−45 and 93+/−29 (Means ± SD of 3 cells each; figure5,请参阅附加文件4).至于叶绿体,过氧化物酶体在caulonemata细胞内分布在梯度。有在尖端区域中的显著更高的密度与核区和核内区与顶端细胞的基部,在顶端朝向的区域与子顶端单元的基础(参见附加文件2).然而,可以注意到,过氧化物酶体在顶端的密度是核区域的2.1倍。这是由于根尖茎鞘顶端和细胞核之间的区域含有丝状过氧化物酶体,这些过氧化物酶体的结构比被戳穿的更大,被视为一个单一的物体。当根尖细胞的顶端密度明显高于亚根尖细胞的底部时,沿着绿脓杆菌丝也可以检测到梯度1).
高尔基高尔基积聚在caulonemal顶端细胞的尖端
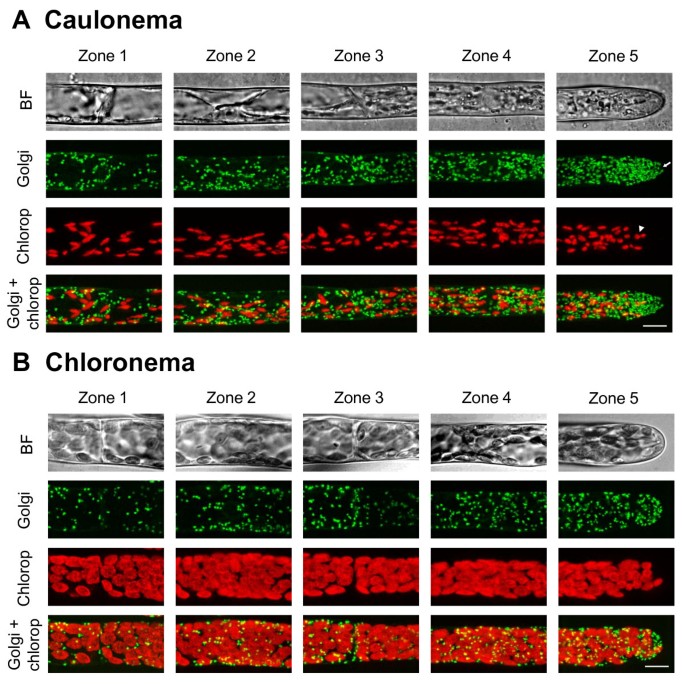
高尔基体分布于Physcomitrella通过将YFP编码序列与大豆α-1,2-甘露糖苷酶(YFP- man)的前49个氨基酸融合,研究了原核物质[30.,43.].一个ccording to their orientation in the cells, dictyosomes appear either as small round discs with a diameter ranging from 0.6 to 1.4 μm or as thin ellipses of about 1–1.5 μm in length (figure3.),这与在拟南芥叶表皮细胞和烟草花粉管中报道的结果一致[21.,30.,34.].定量分析显示,高尔基体在茎叶中呈明显的梯度分布,如图所示3.A和5C.根尖细胞顶端高尔基体密度比同一细胞核面积高1.7倍,比根尖亚细胞基底面积高9.4倍,差异极显著(图)5C,参见附加文件5额外的文件1额外的文件2).高尔基体在根尖细胞的顶端分布不均匀。它们尤其聚集在离顶端2-5 ~ 10-15 μm的区域(图)3.但令人惊讶的是,它们并没有像叶绿体和过氧化物酶体一样被排除在茎叶的顶端。偶见顶端一小块直径1-2 μm的无高尔基体的区域(见图箭头)3.A).在氯藻中观察到的梯度较小,与亚根尖细胞的基部相比,根尖细胞的顶端显示出明显更高的高尔基体密度(见附加文件)1).数字 3.和5C也证明caulonemata包含比chloronemata显著更高尔基高尔基。We estimated that apical and sub-apical cells contain respectively 850+/−64 and 289+/−15 (Means ± SD of 4 cells each) Golgi dictyosomes in caulonemata与213+/−64和115+/−44(平均值±SD分别为3个细胞)。
线粒体显示均匀分布,但原型的形态明显
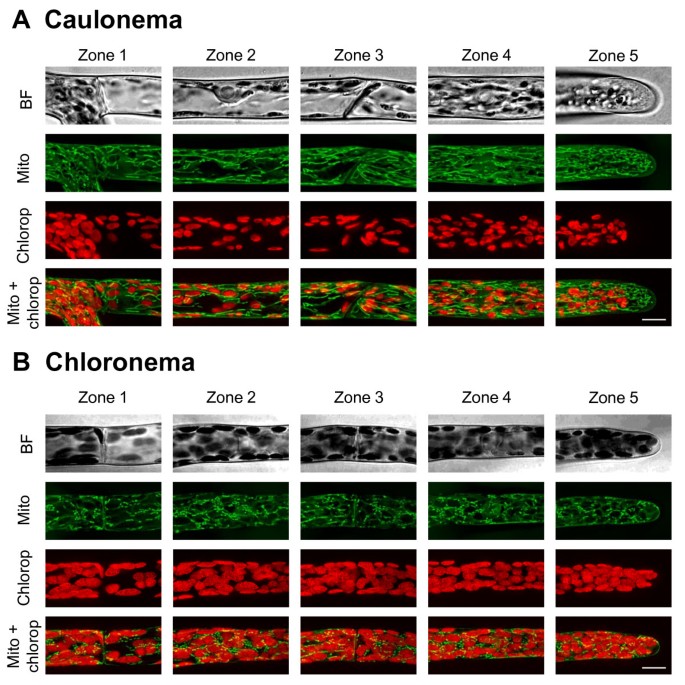
根据Kölher等人的研究,线粒体标记是通过结合酵母细胞色素c氧化酶IV ScCOX4的前29个氨基酸和mEGFP (mEGFP- cox)的编码序列而生成的。[44.和Nelson等人[30.].在选择本研究的所有六种Caulonemata中,大多数线粒体的大多数形成了5到10μm的香肠样结构,并且平行于电池轴线定向(图4一种)。Shorter filament-like structures and punctuted elements with a diameter of 0.5-1.2 μm were also observed in the apical cell (figure4此外,从茎叶顶端起至2-3 μm,线粒体均匀分布于整个茎叶。与之相反,氯藻几乎只表现出短香肠状结构和圆形元素(图4b)。在拟南芥表皮叶中还报道了线粒体的大小和形状的这种变化[30.],而它们在烟草花粉管中则较为均匀[19.,21.].虽然两种细胞都显示出不同的线粒体网络,但它们在每个选定区域的元素密度相似(图)5D,参见附加文件6).结果表明,龙骨根尖细胞中含有543+/−44个线粒体,亚根尖细胞中含有296+/−56个线粒体(平均±SD分别为6个细胞),氯龙骨细胞中含有299+/−60个线粒体,亚根尖细胞中含有210+/−33个线粒体(平均±SD分别为3个细胞)。这些结果也表明,与其他细胞器数据类似,在顶细胞中发现了更多的结构比亚顶细胞。因此,两个花丝的顶端细胞的顶端包含的密度明显高于亚顶端细胞的基部(见附加文件)1).
细胞器在苔藓原型中缓慢移动,低持久性
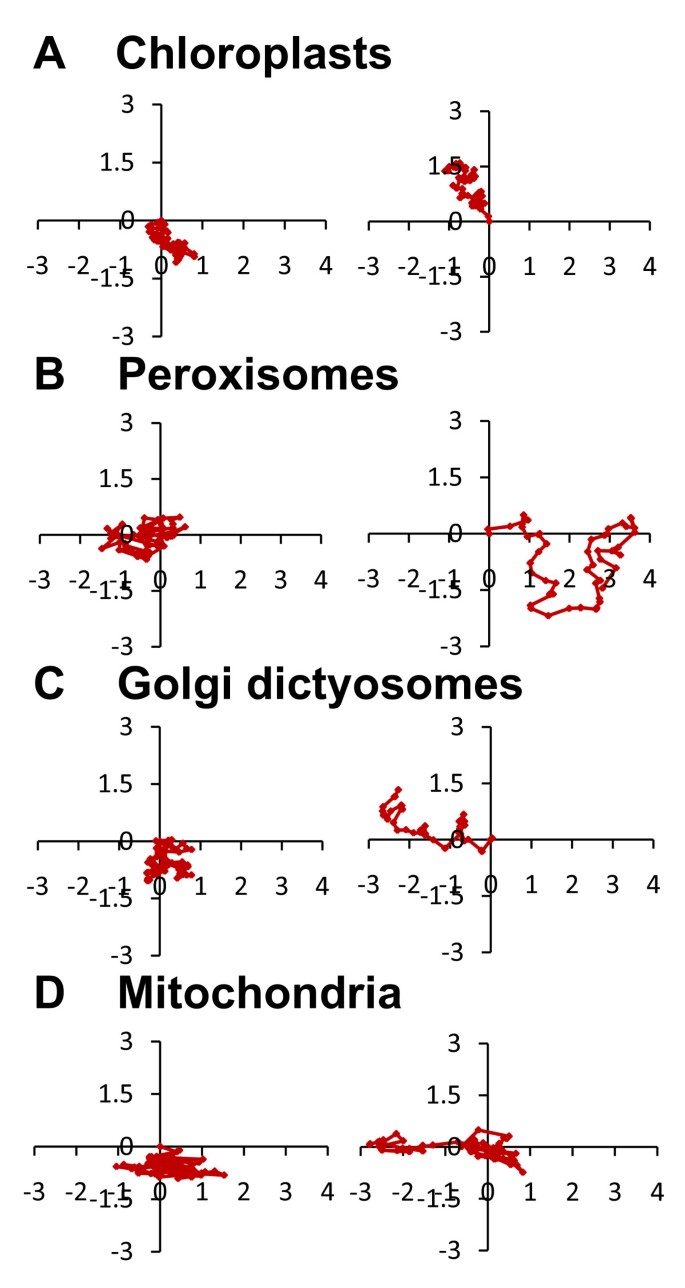
来了解体内细胞器的动态PhyscomitrellaCaulonema.T.a, their trajectories were monitored in a time series, every 5 s for 5 min (See Additional file7额外的文件8额外的文件9额外的文件10.),并检测以下三个参数:平均瞬时速度,这对应于5秒内行驶的距离即。最小的时间间隔;位移率,这代表了5分钟的最短距离即。在第一和最后的时间点,和持久性,这是比平均瞬时速度/位移速率之间。如表1,具有〜30nm / s的平均瞬时速度移动的叶绿体是最慢的细胞器,线粒体,具有〜75nm / s的最快状态;为线粒体记录的最大瞬时速度为90.6nm / s。然而,两个细胞器都显示出类似的位移率,这意味着它们在5分钟内行进相同的绝对距离。因此,叶绿体更持久地持续到线粒体,因为它们慢慢向朝向方向移动,而线粒体主要围绕相同的位置。最持久的细胞器是高尔基·德氏蛋白酶。即使它们平均瞬时速度在45nm / s处相当慢,它们也比在相同的时间内比其他细胞器进一步移动。如前所述,我们观察到,几种过氧化物酶体紧邻叶绿体,并且两个细胞器在苔藓细胞中显示出类似的分布(图2),因此,我们预期它们会有类似的动态。有趣的是,过氧化物酶体的运动不同于叶绿体;尽管他们移动的速度是前者的两倍,但他们却不那么持久。此外,每个细胞系细胞器的平均瞬时速度相对均匀,而位移速率有重要的变化。线粒体、高尔基体和过氧化物酶体的置换速率分别为1.2、1.3和2.4 nm/s和12.8、21.2和19 nm/s。偶尔观察到高尔基体、过氧化物酶体和线粒体的走走停停运动(见附加文件)8额外的文件9额外的文件10.).这种多样性可以从图中看出6并查看其他文件11.额外的文件12.额外的文件13.额外的文件14.,显示了本研究所追踪到的所有细胞器轨迹,与描述烟草花粉管中细胞器轨迹的数据一致[35.].
讨论
Caulonemata具有不同于chloronemata的特定的细胞器官的内容不同
尽管早在几十年前,人们就注意到caulonemata和chloronemata的细胞质组织存在差异[8,45.],以往的形态学和超微结构研究仅提供了亚细胞含量的定性信息。在本研究中,我们首次报道了植物模型中细胞器分布的定量分析小立碗藓.在活细胞上使用共聚焦激光扫描显微镜,我们在苔藓中建立和验证了叶绿体的荧光标记物,高尔基Dictyosomes,线粒体和过氧化物。我们展示了CaulOnemata和Chloronemata显示了特定的细胞器含量,这可能反映了两种细胞类型满足的不同功能。我们估计,根据该区域,Caulonemata含有比Chloronemata更多的Golgi dictyosomes更多的1.2至2.7倍(图5C)。Caulonemata生长和分裂的事实比氯豆类(19.87±2.18μmH-1vs. 5.85 ± 0.51 μm h-1, (7];7 h vs. 24 h, [8])与我们的结果一起,可能建议需要caulonemata增强运输和分泌的活性,以提供新的质膜和细胞壁组分。像在高等植物根毛,caulonemata被认为参与养分摄入量,一个函数,必要递送和几个转运和ATP酶的调节在质膜和与高尔基体的分拣蛋白和脂质的核心作用相一致在细胞表面的不同位置[46.].相比之下,我们估计,根据面积的不同,氯藻的叶绿体和过氧化物酶体的含量分别是粗氯藻的1.7到3.7倍和1.3到6.2倍(图)5一个5这与高光合活性是一致的。此外,我们观察到,在两种细胞类型中,过氧化物酶体经常接近叶绿体(数据未显示)。以前在拟南芥光合活性栅栏叶肉细胞中有相关报道[47.],而这两个细胞器之间的代谢和物理链路已经在高等植物几十年前证明[48.- - - - - -50.].综上所述,这些数据表明叶绿体和过氧化物酶体之间的交联代谢途径可能存在于苔藓和维管植物的共同祖先中。这将是未来研究的一个有趣的话题。
有趣的是,Caulonemata和Chloronemata含有类似的线粒体密度(图5d);然而,它们显示出非常不同的形态。与先前的报告,已知线粒体的形态和动力学众所周知,根据细胞类型,组织,种类和生理条件,显着变化。例如,表达与线粒体靶向序列融合的GFP的拟南芥细胞的eAbforcence图像表明,下胚轴细胞具有均匀直径(<1μm)的球形线粒体,血管组织具有香肠形和蜗杆状结构[51.].人们普遍认为,由融合和裂变事件驱动的线粒体形态动力学受到生物能学的调节,但其潜在机制尚不清楚[52.].早期的实验上证实分离的线粒体执行的过程中高能量电平(高ATP浓度),线粒体处于“正统”状态与中间电子致密膨胀基质和丝状嵴,而在低能级(低ATP浓度),线粒体处于“稠合”的状态用缩合的电子致密基质和扩张型嵴间空间[53.,54.].这些作者假设正统状态与丝状结构与具有碎片网络的冷凝状态相关联。与我们的观察结果一起,这些数据支持了在苔藓,展示香肠样结构的苔藓中的想法,其能量要求比氯妥粥样液,其包含更短的线粒体元素。这与一项研究一致,表明CaulOnemata的形成是通过高能量生长条件诱导的,而氯肠肿瘤的低能量生长条件刺激[55.].
细胞器在两个原丝中都有不对称的分布,而区隔化仅发生在顶端生长的茎线中
在两个原粒体长丝中,所有细胞器都以梯度的梯度分布到顶端电池(区域1)的底部到顶端电池(区域5)的尖端,梯度在Caulonemata(图)中更戏剧5).我们发现高尔基体最重要的变异是高尔基体,它在茎叶根尖细胞的顶端和亚根尖细胞的基部之间显示了9.4倍的差异(图)5C)。细胞器还表现出单个细胞内的不对称分布。例如,在尖端生长的CaulOnemata中,尖端(区域5)的Golgi Dictyosomes的密度分别比核(区域4)和基底(区域3)区域高1.7和2.3倍(图5C).对这种梯度的一种可能的解释是,远端区域包含大的液泡,这些液泡在顶端不存在或很少存在[8,9,14.,这可能会限制其他细胞器的胞内容量。此外,我们的定量分析表明,苔藓caulonemata(5区)的前43 μm包含的线粒体数量与烟草花粉管的前40 μm相似,但高尔基体多10倍[21.].从这些数据中产生的一个问题是,为什么苔藓顶端细胞在其顶端聚集细胞器?我们观察到在顶端的茎叶中发生了活跃的叶绿体分裂(见图中的箭头)2A和3.A)并且只偶尔发生在亚根尖细胞中。此外,已经很好地描述过氧化物酶体的分裂是一个三步过程,需要连续的延伸、收缩和裂变[56.].这显示非经典丝状形状过氧化物酶体(图2A)在根尖细胞中检测到,表明它们可以增殖和分裂。同样,在顶端细胞的顶端观察到线粒体碎裂(图)4一种)。这是与以下事实一致,即分裂在顶端细胞主要发生[8],可能提示细胞分裂前细胞器存在不对称增殖和分裂,以帮助维持每个子细胞内细胞器的数量不变。
它们不仅细胞器的不对称分布,而且顶端的细胞质被分隔开,因为叶绿体和过氧化物酶体完全被排除在顶端9-15 μm的区域之外。我们还发现在顶端有一个2-3 μm的无线粒体区,偶尔有一个1-2 μm的高尔基缺失球形区域(图)3.和4).基于超微结构研究,报告了从高等植物的花粉管和根毛,以及Caulonemata葫芦藓Physcomitrium turbinatum, dark-grownCeratodon紫色和小立碗藓在其顶端积聚了囊泡,我们可以假设这些无细胞器区也充满了囊泡[10.- - - - - -13.,20.,21.,23.].然而,从一种类型的尖端生长细胞到另一类的顶端细胞质组织存在高可变性,并且没有明确的透明区域的定义。例如,花粉管显示器为15至25μm透明区域,而根毛和苔藓植物的透明区小于10μm([10.- - - - - -13.,20.,21.,23.];这项研究)。有趣的是,不同物种花粉管之间的一些差异也被注意到了。例如,ER,和一些线粒体和高尔基高尔基偶见在从百合花粉管极端顶点的倒锥形,而这些细胞器是从该区域中在烟草完全排除[20.- - - - - -22.].这些数据提出了一个问题,即这种不对称分布是如何在茎尖生长的细胞中调控和维持的,尤其是在茎尖生长的细胞中小立碗藓.在花粉管,药物治疗,扰乱顶端f -肌动蛋白网络导致交付的抑制囊泡的细胞,这表明肌动蛋白丝出现在顶端的清除区区域可以作为筛来解决大量的分泌囊泡大的细胞器在花粉管17.].Vidali和他的同事报告说,茎叶生长的茎叶小立碗藓在根尖区也具有f -肌动蛋白皮层网络[57.,这在结构上似乎与烟草花粉管中观察到的密集网络或百合花粉管中纵向定向的短花丝皮层边缘不同,但可能具有相似的功能。例如,所有这些结构都是高度动态的,这些网络的动态可能是防止大型细胞器入侵细胞顶端的原因。事实上,氯藻表现出一种不同的肌动蛋白组织,在最顶端的质膜下形成一个帽,这可以解释为什么细胞器没有被排除在这些细胞的顶端。
除了皮质肌动蛋白,Caulonemata来自Physcomitrella也显示一个动态的f -肌动蛋白簇在顶点[57.].这将是有趣的,以确定此肌动蛋白焦点剥夺高尔基高尔基的小区域相匹配(参见图箭头3.),这也可能反映了囊泡运输监管机制。此外,微管也可以参与在维持细胞器分配Physcomitrella研究表明,低浓度(≤10-6M)米扎林诱导质体的顶端肿胀和迁移到顶端葫芦藓[58.].
在对比花粉管和根毛,其显示高度极化的细胞含量,认为对尖端生长所必需的[15.- - - - - -19.],chloronemata表现出它们的细胞质的非常轻微的偏振并且没有观察到细胞器的被排除在其尖端,但仍通过顶端生长扩大[7].因此,我们的研究结果支持这一想法,细胞器的划分可能不适合参与顶端生长的机制至关重要,但可能有助于实现更高的增长率。
茎尖生长的茎尖细胞器移动缓慢,持久性低
像其他苔藓种[9,则没有细胞质流入小立碗。几项研究都集中在原丝诱导photorelocation和空泡组织叶绿体运动[14.,59.,60.,但据我们所知,这项工作是第一份细胞器动力学的定量报告Physcomitrella.We showed that all organelles tracked move with instantaneous speeds ranging from 29 to 75 nm/s and displacement rates ranging from 4.8 and 8.3 nm/s in caulonemata. Similarly, Pressel et al. (2008) reported that chloroplasts were able to cover distances up to 20 μm in 1 to 6 h in the other moss species曲尾藓和Funaria hyrometrica,这等于0.9至5.6nm / s的位移率[9].相比之下,这些数值比花粉管或根毛细胞器慢三个数量级,因为高尔基体、线粒体和过氧化物酶体在这些顶端生长细胞中以μm/s的速度移动[34.- - - - - -37.].值得注意的是,在顶端生长的植物细胞中,生长速率和细胞质动态之间没有相关性,因为花粉管比根毛生长得快,其细胞质流动速率相似。另一个例子是苔藓和根毛的生长速度相似,但表现出不同的细胞质动力学。这与在百合和烟草花粉管中进行的研究一致,研究表明,生长和细胞质流动或分泌可以分离,而且生长强烈依赖于动态的肌动蛋白细胞骨架[61.,62.].
对细胞器轨迹的分析也表明,尽管它们移动缓慢,但它们可以显示出方向性和低持久性,这强烈表明它们很可能不是由布朗运动单独驱动的,而且细胞骨架可能参与了它们的运动。在来自高等植物顶端生长的细胞中,用影响肌动蛋白聚合的latrunculin-B和解聚微管的米扎林进行药物处理,发现内质网、液泡和线粒体运输是由肌动蛋白细胞骨架决定的[22.].最近,一种受光调节的肌动蛋白捆绑蛋白也被证明影响叶绿体运动[63.].此外,YFP融合蛋白与不同的肌球蛋白的尾部,发现该蛋白拟南芥和MYA myosinXI-J部分共定位与过氧化物酶体和分别与高尔基体和线粒体,[64.],来自拟南芥和烟草的肌球蛋白XI-F与质体相互作用[65.].发现六个拟南芥肌苷的表达,发现烟草中的高尔基和线粒体动力[66.].最后,最近对肌菌素XI的敲除突变体的分析证明,基于肌动蛋白的电动机对于血管植物中的血管植物中的疣状蛋白,线粒体,ER和过氧化物的运动至关重要[67.,68.].相比之下,人们对微管在植物细胞器运动中的作用知之甚少。在烟草花粉管中,基于微管的动力蛋白与高尔基体和线粒体共定位[69.,70], 然而,在体外运动分析表明,细胞器沿着微管轨迹的运动比细胞质流动慢得多[70,71.].因此,微管及其马达不被认为参与细胞器的运输,但有人提出它们可能微调花粉管中细胞器的位置[72.].在小立碗,有越来越多的证据支持细胞器运输主要受微管调节的想法。首先,基因组小立碗藓与拟南芥中的13个亚型相比,仅编码3个肌球蛋白XI同源物[73.,74.].二,肌素XI本地化在Caulonemata中Physcomitrella并没有显示出本研究中分析的细胞器的特定积累模式[73.,提示肌球蛋白XI与高尔基体、线粒体、叶绿体或过氧化物酶体无关。第三,在体外用百合、烟草和拟南芥纯化的肌凝蛋白进行的运动分析表明,这些马达沿着肌动蛋白丝以μm/s的速度运动[75.- - - - - -78.比苔藓的细胞器运动高出三个数量级。然而,驱动蛋白家族Physcomitrella包含60多个成员,与种子植物的成员相当[45.].此外,在体外运动分析表明,一方面花粉管细胞器沿微管运动,速度在200 ~ 300 nm/s之间[70,71.],而拟南芥和烟草的激肽沿着肌动蛋白丝的运动速度在130 - 400 nm/s之间,与苔藓的细胞器运动仅相差一个数量级[72.,79.,80].最后,微管抑制剂治疗氯仑肠细胞小立碗藓和葫芦藓被证明会影响动态的液压组织[14.plastids,Er和线粒体[9] 分别。一个人不能排除肌动蛋白细胞骨架在苔藓中细胞器运动中的可能作用,表明它显示与叶绿体相关的肌动蛋白长丝在叶绿体中进行重新组织[60.,但这种运动的确切机制仍不清楚。从苔藓细胞中纯化和表征肌凝蛋白和动力蛋白将需要回答是什么决定苔藓细胞器运动的问题。
结论
综上所述,我们发现粗茎线虫与绿茎线虫具有不同的特定的细胞器含量,这些特异性可能对它们各自的功能很重要。细胞器在原丝中也表现出不对称分布,但区隔化仅发生在顶端生长的茎形植物中。进一步的研究,特别是苔藓细胞分子马达的纯化和表征,将有助于阐明原细胞中细胞器组织是如何维持和调节的,以及细胞骨架的作用。我们的数据也提供了证据,与高等植物相比,顶端生长的茎叶植物的细胞器移动缓慢,持久性较低。
方法
培养条件
所有小立碗藓根据Vidali et al. [6].
对于共焦成像,小立碗藓按前面描述的方法培养[73.].简单地说,苔藓组织在25℃、光照周期为14 h (90 μmol m .)的条件下生长-2年代-1)和10小时的黑暗一个星期在一层薄薄的固体的三磷酸三氮介质在玻璃底皿。
的细胞器标记物稳定线代
所有表达载体通过多位点通道(Invitrogen)构建,目的载体由Dr Bezanilla好心提供,每个入口载体通过测序进行验证。
对于过氧化物酶体标记,从克隆px-ck中扩增出CFP的编码序列,没有终止密码子,与靶向信号类型1 SKL的过氧化物酶体融合cd3 - 977(麻烦由Nebenfür博士提供; [30.),用引物CACCATGGTGAGCAAGGGCGAGG和TTACAGCTTCGATCTCTTGTACAGC,将TOPO克隆到pENTR/D/TOPO载体(Invitrogen)中,通过LR反应转入表达载体pTH-Act1Gate。
为了创造高尔基标记,编码大豆α-1,2甘露糖苷酶前49个氨基酸的核苷酸序列[30.,43.从克隆G-YK中扩增cd3 - 965(麻烦由Nebenfür博士提供; [30.),用引物CACCATGGCTAGCGGGAGCAG和TTACTTGTACAGCTCGTCCATGC,将TOPO克隆到pENTR/D/TOPO载体(Invitrogen)中,通过LR反应转移到表达载体pTH-35SGate。
通过对酵母细胞色素c氧化酶IV ScCOX4前29个氨基酸编码序列的扩增设计线粒体标记[30.,44.从克隆山cd3 - 991(麻烦由Nebenfür博士提供; [30.]),使用以下底漆:
GGGGACAAGTTTGTACAAAAAAGCAGGCTTAATGCTTTCACTACGTCAATCTATAA和GGGGACAACTTTTGTATACAAAGTTGTGGGTTTTTGCTGAAGCAGATATC,并克隆到通过BP反应的供体载体pDONR 221 P1P5r(Invitrogen)中。所述mEGFP的编码序列克隆到通过BP反应的供体载体pDONR 221 P5P2(Invitrogen公司)[81].将两个构建体插入到目的地向量PTH-Uβ中通过LR反应。
如先前在Vidali等人所述进行的原生质体转化。(2007)和选择含有潮霉素的培养基上的所有行。
共聚焦成像
我们拍摄了一个星期的苔藓丝,其中从顶端的第三个细胞已经开始分枝。沿着表达荧光细胞器标记的根尖和亚根尖原质细胞划分出五个区域,分别位于顶端、核区或细胞壁区。每个区域用SP5共聚焦显微镜(Leica)成像,使用458、488和514 nm氩激光和二色滤光片分别显示CFP、mEGFP和YFP。激光功率设置为20%,458激光器进一步衰减为20%,488和514激光器进一步衰减为5%,以限制光漂白,并允许细胞在成像过程中继续生长。利用5%浓度的488激光对叶绿体进行叶绿素自荧光跟踪。所有图像均使用PlanApo 40 x油浸1.25数值孔径物镜采集。为了研究细胞器在整个细胞中的分布,我们获取了26到74个共聚焦切片(取决于细胞的体积),每个区域之间0.5 μm的距离,结果显示为最大的z投影。为了研究茎叶顶端细胞器的流动性,每隔5秒收集17片间隔1 μm的z堆,并拍摄电影(见附加文件)7额外的文件8额外的文件9额外的文件10.)显示为极大的z-投影。
图像分析
所有图像在ImageJ中进行处理,使用非锐化掩模增强跟踪的细胞器边缘,使用平滑函数降低颗粒度,并使用增强对比度函数对单个Z-stack中的每个切片的像素值进行归一化。由于表达线粒体标记的稳定线显示出非常高的背景,首先使用反褶积滤波器(ImageJ中的Iterative Deconvolve 3D插件)。对于每个区域,Z-stack内部的细胞器的量化是使用ImageJ中的对象计数器3D插件(参见附加文件)4额外的文件5额外的文件6),但人工计数的叶绿体除外。为了确定细胞器的动态,我们收集了表达高尔基体和过氧化物酶体荧光标记物的稳定细胞株的延时序列,通过SpotTracker2D插件对荧光强度的高斯拟合,使用半自动程序跟踪单个细胞器的质心,从而测量单个细胞器的速度。使用ImageJ的阈值函数对叶绿体进行手动跟踪。与以前主要呈圆形形态的细胞器不同,线粒体呈丝状,因此更难追踪。此外,线粒体群体过于密集,无法使用阈值功能。为了克服这些技术问题,编写了Matlab代码来确定每个跟踪线粒体丝的几个点的坐标,以代表其整体形状,并设计了第二代码来计算其相应的质心。这些跟踪工具可以让我们达到亚像素的分辨率。速度v由速度矢量的大小定义为v = ds/dt其中s是时间t之前的路径长度,表示物体独立于其方向移动的速度。位移率以第一个时间点和最后一个时间点之间的最短移动距离计算即。每隔5分钟[82].平均瞬时速度表示位移率在时间间隔接近0时的极限,计算为最小时间间隔内的移动距离,即。每隔5秒。持久性由平均瞬时速度/位移率的比值决定,并描述了细胞器轨迹的直线度。1表示细胞器在一个方向上沿直线运动,低于1表示细胞器在改变方向。持久性以前被称为进行性比率[35.]及曲流指数[82].结果显示在表1.附加文件中显示了每个跟踪细胞器的轨迹11.额外的文件12.额外的文件13.额外的文件14.,两个代表轨迹显示在图中6.
尾注
资金来源:wpi启动资金、国家科学基金会资助(IOS-1002837)。
参考文献
- 1。
Smith LG:植物细胞形状的细胞骨架控制:获得精细点。植物生态学报。2003,6:63-73。10.1016 / s1369 - 5266(02) 00012 - 2。
- 2。
Geitmann A,奥尔特加JKE:力学和植物细胞的生长建模。趋势植物SCI。2009年,14:467-478。10.1016 / j.tplants.2009.07.006。
- 3.
植物细胞成形:细胞质控制的新见解。植物生态学报。2009,12:735-744。10.1016 / j.pbi.2009.10.005。
- 4。
Schaefer DG,ZrÿdJ:患有损伤损伤的有效基因靶向损伤的基因。工厂J.997,11:1195-1206。10.1046 / J.1365-313x.1997.11061195.x。
- 5。
王志强,王志强,王志强,等。苔藓的RNA干扰。植物生理学报。2003,33(4):469 -474。10.1104 / pp.103.024901。
- 6。
Vidali L, Augustine RC, Kleinman KP, Bezanilla M: Profilin对于苔藓spyscomitrella patens的顶端生长至关重要。植物学报。2007,19(4):489 - 498。10.1105 / tpc.107.053413。
- 7。
Menand和B, Calder G, Dolan L:在苔藓中,氯细胞和caulonemitrella patens都是通过顶端生长而扩展的。中华医学杂志。2007,58:1843-1849。
- 8.
苔藓的发育、遗传学和分子生物学。Acta botanica sinica . 1998, 31(1): 1- 7。
- 9.
王志强,王志强,王志强:苔藓原体细胞分化的形态学和实验研究。植物学杂志。2008,102:227-245。10.1093 / aob / mcn080。
- 10。
Jensen LCW, Jensen CG: mosspyscomitrium turbinatum原质顶端细胞的精细结构。原生质。1984,122:1-10。10.1007 / BF01279432。
- 11.
植物冻融原体的皮质超微结构。原生质。1992,169:168-178。10.1007 / BF01323616。
- 12.
沃克LM,大袋FD:在角齿原丝的顶端细胞细胞组分分布超微结构分析。原生质。1995年,189:238-248。10.1007 / BF01280178。
- 13。
Tucker EB, Lee M, Alli S, Sookhdeo V, Wada M, Imaizumi T, Kasahara M, Hepler PK: UV-A在小physcomitrella patens中诱导两种钙波。植物营养与肥料学报。2005,32(4):429 - 434。10.1093 /卡式肺囊虫肺炎/ pci131。
- 14。
Oda Y, Hirata A, Sano T, Fujita T, Hiwatashi Y, Sato Y, Kadota A, Hasebe M, Hasezawa S:微管调节小泡的动态组织。植物营养与肥料学报。2009,30(4):531 - 534。10.1093 /卡式肺囊虫肺炎/ pcp031。
- 15.
Schnepf E:细胞极性。植物生理学杂志。1986,37:23-47。10.1146 / annurev.pp.37.060186.000323。
- 16。
引导MW、引导JM:花粉管顶端生长。叶绿醇。1989,111:323-358。10.1111 / j.1469-8137.1989.tb00697.x。
- 17。
高等植物的极化细胞生长。acta细胞工程学报,2001,17:159-187。10.1146 / annurev.cellbio.17.1.159。
- 18。
FeijóJA,Costa SS,Prado Am,Becker JD,Certal AC:由提示的信号传达。CurrOp植物BIOL。2004,7:589-598。10.1016 / J.PBI.2004.07.014。
- 19.
张AY,吴慧敏:花粉管的结构和功能区隔。中国生物医学工程学报。2007,58:75-82。
- 20。
王志强,王志强,王志强。长花百合花粉管的超微结构研究。原生质。1992,167:215-230。10.1007 / BF01403385。
- 21。
Derksen J,Rutten T,Lichtscheidl Ik,Win Ahn,Pierson Es,Rongen G:对烟草花粉管中有机细胞器分布的定量分析:对外尿量和内吞作用的影响。原生质。1995,188:267-276。10.1007 / BF01280379。
- 22。
百合花粉管中肌动蛋白细胞骨架的不同细胞器运动。Cell Motil Cytoskel. 2007, 64: 217-232。10.1002 / cm.20181。
- 23。
拟南芥根毛的生长和超微结构:rhd3突变改变液泡增大和根尖生长。植物学报。1997,201:209-218。10.1007 / BF01007706。
- 24。
黄芪根毛中脂壳寡糖结瘤因子通过纵向内质网和顶端小泡刺激细胞质极性。植物营养与肥料学报,2000,13(4):489 - 494。10.1094 / MPMI.2000.13.12.1385。
- 25。
根瘤因子对紫花苜蓿根毛发育和变形的细胞结构和细胞质流动的影响中国生物医学工程学报,2000,21(4):427 - 434。10.1007 / BF02524268。
- 26。
构建毛发:拟南芥根毛的顶端生长。中国生物医学工程学报。2002,31(4):429 - 434。10.1098 / rstb.2002.1092。
- 27。
Sieberer BJ, Timmers ACJ, Lhuissier FGP, Emons AMC:内质微管配置亚根尖细胞质,是快速生长的苜蓿截根毛所必需的。植物生理学报。2002,30(4):591 - 598。10.1104 / pp.004267。
- 28。
保持MA,Boulaflous A,Brandizzi F:用于植物endomembranes的分析基于荧光蛋白成像进展。植物理性。2008年,147:1469年至1481年。10.1104 / pp.108.120147。
- 29。
Reumann S:通过生物信息学分析说明过氧含量靶向信号1型和植物过氧缺血的2型。植物理性。2004,135:783-800。10.1104 / pp.103.035584。
- 30.
在拟南芥和其他植物中进行共定位研究的多色细胞器标记。植物学报,2007,51:1126-1136。10.1111 / j.1365 - 313 x.2007.03212.x。
- 31.
里希特S,沃U, Jürgens G:植物中的后高尔基交通。交通,2009,10:819-828。10.1111 / j.1600-0854.2009.00916.x。
- 32。
Rab11 gtpase调控的膜运输对烟草花粉管顶端聚焦生长至关重要。acta botanica sinica, 2017, 36(5): 772 - 772。10.1105 / tpc.105.033183。
- 33。
Zheng M, Beck M, Müller J, Chen T, Wang X, Wang F, Wang Q, Wang Y, Baluška F, Logan DC, Šamaj J, Lin J:肌动蛋白在拟南芥根毛细胞线粒体运动中的作用。公共科学图书馆。2009,4 (6):e5961-公共科学图书馆。10.1371 / journal.pone.0005961。
- 34。
Campanoni P, Sutter JU, Davis CS, Littlejohn GR, Blatt MR:一种转染根表皮的通用方法揭示了拟南芥根毛内体动力学。植物学报,2007,51:322-330。10.1111 / j.1365 - 313 x.2007.03139.x。
- 35。
德赢AH,皮尔森ES,德克森Y:在烟草花粉管细胞器轨迹的合理分析表明肌动球蛋白细胞骨架的特性。生物物理学J. 1999年,76:1648年至1658年。10.1016 / S0006-3495(99)77324-8。
- 36。
Cai G,Cresti M:花粉管中的细胞器运动:20年的故事。J Exp Bot。2009,60:495-508。10.1093 / JXB / ERN321。
- 37。
Prokhnevsky AI, Peremyslov VV, Dolja VV:四种XI类肌球蛋白在拟南芥生长、根毛伸长和细胞器运动中的重叠功能。中国科学(d辑:地球科学),2008,32(5):591 - 598。10.1073 / pnas.0810730105。
- 38。
Hanson Mr,Sattarzadeh A:缓解植物中塑体和血液的动态形态。植物细胞环境。2008,31:646-657。10.1111 / J.1365-3040.2007.01768.x。
- 39。
Gould SG, Keller GA, Subramani S:萤火虫荧光素酶羧基末端过氧化物酶体靶向信号的鉴定。中国生物医学工程杂志。10.1083 / jcb.105.6.2923。
- 40.
马伦RT,李MS,弗林CR,Trelease RN:多样化的氨基酸残基的类型1的过氧化物酶体靶向信号内起作用(对于附件残基的作用的影响的类型1的过氧化物酶体靶向信号的上游)。植物理性。1997年,115:881-889。10.1104 / pp.115.3.881。
- 41.
Baker A, Sparkes IA, Brown L-A, O’leary - steele C, Warriner SL:过氧化物酶体的生物发生和定位。生物化学学报。2010,38:807-816。10.1042 / BST0380807。
- 42.
CHUONG SDX,公园N-I,弗里曼MC,马伦RT,Muench的DG:与在植物细胞中的微管皮质的过氧化物酶体多功能蛋白相互作用。BMC细胞生物学。2005年,6:40-10.1186 / 1471-2121-6-40。
- 43.
Saint-Jore-Dupas C, Nebenführ A, Boulaflous A, Follet-Gueye M-L, Plasson C, Hawes C, Driouich A, Faye L, Gomord V: Plant N-glycan processing enzymes employ different targeting mechanisms for their spatial arrangement along the secretory pathway. Plant Cell. 2006, 18: 3182-3200. 10.1105/tpc.105.036400.
- 44。
Köhler RH, Zipfel WR, Webb WW, Hanson MR:绿色荧光蛋白作为观察植物体内线粒体的标记物。植物学报1997,11:613-621。10.1046 / j.1365 - 313 x.1997.11030613.x。
- 45。
贝草属M, Perroud P-F:在Annu植物中。36版。编辑Knight CD, Perroud PF, CoveDJ。约翰·威利父子公司;2009:143 - 166。
- 46。
NebenführA,施特赫林LA:手机工厂:在植物细胞高尔基体动态。趋势植物SCI。2001年,6:160-167。10.1016 / S1360-1385(01)01891-X。
- 47。
Oikawa K, Kasahara M, Kiyosue T, Kagawa T, Suetsugu N, Takahashi F, Kanegae T, Niwa Y, Kadota A, Wada M:叶绿体异常定位1是叶绿体正常定位的必要条件。acta botanica sinica(云南植物学报). 2003,29(5):593 - 598。10.1105 / tpc.016428。
- 48。
叶细胞的微体样细胞器。科学。1969,163:1353-1355。10.1126 / science.163.3873.1353。
- 49。
Kunz H-H,Scharnewski M,Feussner K,Feussner I,FlüggeU-I,Fulda M,Gierth M:ABC Transporter PXA1和过氧缩菌β-氧化对于在延长的黑暗期间拟南芥成熟叶片中的代谢至关重要。植物细胞。2009,21:2733-2749。10.1105 / TPC.108.064857。
- 50.
张志强,张志强,张志强,等。水分亏缺对细胞分裂素依赖的光呼吸和光合作用的保护。植物营养与肥料学报。2009,30(4):531 - 534。10.1104 / pp.109.139378。
- 51.
洛根DC,利弗CJ:线粒体靶向GFP亮点线粒体形状,大小和运动的异质性活植物细胞内。J Exp Bot。2000,51:865-871。10.1093 / jexbot / 51.346.865。
- 52.
线粒体形态和动力学的能量需求和生物能量调节。细胞生物学杂志。2010,21:558-565。10.1016 / j.semcdb.2009.12.006。
- 53.
Hackenbrock CR, Rehn TG, Weinbach EC, Lemasters JJ:完整腹水肿瘤细胞线粒体的氧化磷酸化和超微结构转化。中国生物医学工程杂志。10.1083 / jcb.51.1.123。
- 54.
Bereiter-Hahn J,Vöthm:活细胞线粒体的动态:Mitochondria的形状变化,脱臼,融合和裂变。Microsc Res技术。1994年,27:198-219。10.1002 / JEMT.1070270303。
- 55.
王志强,王志强,王志强:能量供应对小绒螯虾丝状体生长发育的影响。中国生物医学工程学报,2005,26(6):653-662。10.1093 / jxb / eri040。
- 56。
kaur n,胡j:过氧化物血清的动态:分裂和扩散的故事。CurrOp植物BIOL。2009,12:781-788。10.1016 / J.PBI.2009.08.001。
- 57。
Lifeact-mEGFP揭示了顶端生长植物细胞的动态顶端f -肌动蛋白网络。公共科学图书馆。2009,4 (5):e5744-10.1371/journal. pon.0005744。
- 58。
王志强,王志强,王志强,等。除草剂谷草素对水生植物细胞骨架和生长的影响。原生质。1988,142:55-67。10.1007 / BF01273226。
- 59。
笠原男,香川T,佐藤Y,Kiyosue T,和田L:Phototropins调解蓝色和红色光致叶绿体运动inPhyscomitrella藓。植物理性。2004年,135:1388年至1397年。10.1104 / pp.104.042705。
- 60.
Yamashita H, Sato Y, Kanegae T, Kagawa T, Wada M, Kadota植物营养学报。2010,33(4):457 - 468。
- 61.
肌动蛋白聚合对花粉管生长至关重要。中国生物医学工程学报。2001,12:2534-2545。
- 62.
Zerzour R,克勒格尔Ĵ,Geitmann一个:在花粉管生长极性与在细胞的机械性能空间受限的动态变化有关。发育生物学。2009年,334:437-446。10.1016 / j.ydbio.2009.07.044。
- 63.
Whippo CW,Khurana P,Davis Pa,Deblasio SL,Desloover D,Staiger CJ,Hangarter RP:Thrumin1是参与叶绿体运动性的轻型肌动蛋白捆绑蛋白。Curr Biol。2011,21:59-64。10.1016 / J.CUB.2010.11.059。
- 64.
Reisen D,Hanson Mr:六个YFP-肌球蛋白Xi-Teations与移动植物细胞细胞器的协会。BMC植物BIOL。2007,7:6-10.1186 / 1471-2229-7-6。
- 65.
与酵母肌凝蛋白液泡结合域同源的肌凝蛋白XI尾结构域与本烟草的质体和基质相互作用。植物学报。2009,2:1351-1358。10.1093 / mp / ssp094。
- 66.
Avisar D, Abu-Abied M, Belausov E, Sadot E, Hawes C, Sparkes IA: 17个拟南芥肌球蛋白家族成员参与高尔基体和其他细胞器运动的比较研究。植物生理学报。2009,30(4):457 - 461。10.1104 / pp.109.136853。
- 67.
Peremyslov VV,Prokhnevsky AI,Dolja VV:拟南芥中的开发,细胞扩张和F-Actin组织所必需的XI类肌瘤。植物细胞。2010年,22:1883-1897。10.1105 / TPC.110.076315。
- 68。
UEDA H,Yokota E,Kutsuna N,Shimada T,Tamura K,Shimmen T,Hasezawa S,Dolja VV,Hara-Nishimura I:肌肉蛋白依赖性内质网运动和植物细胞中的F-Actin组织。Proc Natl Acad Sci U S A. 2010,107:6894-6899。10.1073 / pnas.0911482107。
- 69。
魏升,刘斌,李Y:烟草花粉管的高尔基体驱动蛋白相关蛋白的分布。科学通报。2005年,50:2175年至2181年。
- 70。
Romagnoli S,Cai G,Faleri C,Yokota E,Shimmen T,Cresti M:微管和肌动蛋白厚度的电动机分布在花粉管线粒体上,并与其运动有不同的贡献。植物细胞生理。2007,48:345-361。
- 71。
体外实验证明花粉管细胞器利用运动蛋白相关的运动蛋白沿着微管运动。acta botanica sinica(云南植物学报),2003,30(5):531 - 534。10.1105 / tpc.005645。
- 72.
蔡刚:微管马达与花粉管生长-尚待解决的问题。中国生物医学工程学报。10.1007 / s00709 - 010 - 0214 - 9。
- 73.
Vidali L,Burkart GM,奥古斯丁RC,Kerdavid E,TüzelE,Bezanilla L:肌球蛋白XI为顶端生长inPhyscomitrella藓必不可少的。植物细胞。2010,22:1868年至1882年。10.1105 / tpc.109.073288。
- 74.
Peremyslov VV, Mockler TC, Filichkin SA, Fox SE, Jaiswal P, Makarova KS, Koonin EV, Dolja VV:植物中肌球蛋白基因家族的表达、剪接和进化。植物营养与肥料学报。2011,32(4):591 - 598。10.1104 / pp.110.170720。
- 75.
叶片E,Shimmen T:百合花植物植物肌蛋白的分离与表征。原生质。1994,177:153-162。10.1007 / bf01378989。
- 76.
横田,汤川康,武藤,索内贝,Shimmen T:烟草亮黄-2细胞中两种肌球蛋白的生化和免疫细胞化学特性。植物营养与肥料学报。1999,21(4):531 -534。10.1104 / pp.121.2.525。
- 77.
Tominaga M, Kojima H, Yokota E, Orii H, Nakamori R, Katayama E, Anson M, Shimmen T, Oiwa K:高等植物肌球蛋白XI在肌动蛋白上高速移动35nm步长。中国海洋大学学报(自然科学版),2003,22:1263-1272。10.1093 / emboj / cdg130。
- 78.
Hachikubo Y, Ito K, Schiefelbein J, Manstein DJ, Yamamoto K:重组拟南芥肌球蛋白XI, MYA1的酶活性和运动。植物营养与肥料学报。2007,31(4):491 - 497。10.1093 /卡式肺囊虫肺炎/ pcm054。
- 79.
Marcus Ai,Ambrose Jc,Blickley L,Hancock Wo,Cyr RJ:Arabidopsis ThanianaProtein,ATK1是一个负面的指导kinesin,它表现出非加工运动。细胞运动和细胞骨架。2002,52:144-150。10.1002 / cm.10045。
- 80.
诸C,迪克西特R:的拟南芥FRA1驱动蛋白节目单分子分析,这是一个功能性马达蛋白与异常高的持续合成能力。摩尔。植物。2011年,4:879-885。10.1093 / MP / ssr077。
- 81.
Vidali L, van Gisbergen PAC, Guérin C, Franco P, Li M, Burkart GM, Augustine RC, Blanchoin L, Bezanilla M:快速形成蛋白介导的肌动蛋白丝伸长对极化植物细胞生长至关重要。中国科学(d辑:地球科学),2009,32(6):591 - 598。
- 82。
斯帕克斯IA,Teanby NA,霍伊斯C:截短的肌球蛋白XI尾巴融合抑制过氧化物酶体,高尔基体和线粒体运动在烟草叶表皮细胞:用于下一代遗传工具。J Exp Bot。2008年,59:2499年至2512年。10.1093 / JXB / ern114。
致谢
我们感谢Vidali和Tüzel小组的所有成员的支持和讨论,感谢Victoria Huntress的技术支持,感谢Kaye Peterman的认真阅读。我们还感谢Magdalena Bezanilla博士和Andreas Nebenführ博士提供了质粒pTH-Act1Gate、pTH-35SGate、pTH-UbiGate和px-ckCD3-977,G-YKCD3-965,MT-RKcd3 - 991.
作者信息
隶属关系
通讯作者
额外的信息
作者的贡献
L.V.和F.F.进行了实验设置、苔藓细胞系开发、数据采集、分析和解释。E.T.和K.L.编写了用于数据分析的Matlab例程。所有作者都参与了手稿的起草。所有作者阅读并批准了最终的手稿。
电子辅料
12870 _2011_1038_moesm1_esm.ppt
附文件1:细丝内细胞器密度的统计分析。调整后的P值显示为拒绝等价的方法T.-测试;加粗的数值表示差异在0.05水平上有统计学意义。(PPT 439 KB)
12870_2011_1038_MOESM2_ESM.ppt
附加文件2:茎叶植物细胞器密度的统计分析。经调整的P值显示拒绝等价的均值方差分析;加粗的数值表示差异在0.05水平上有统计学意义。(PPT 451 KB)
12870_2011_1038_MOESM3_ESM.ppt
附加文件3:氯藻内细胞器密度的统计分析。经调整的P值显示拒绝等价的均值方差分析;加粗的数值表示差异在0.05水平上有统计学意义。(PPT 451 KB)
12870 _2011_1038_moesm4_esm.ppt
附加文件4:过氧化物酶体定量小立碗藓原丝体。通过表达CFP-SKL融合蛋白定量过氧化物酶体(Perox)的五种不同区域的caulonemata (A)和chloronemata (B)的荧光图像和imageo处理图像。图像显示为共焦切片的最大投影,其中每个细胞器呈现不同的颜色。比例尺10 μm。(PPT 246 KB)
12870 _2011_1038_moesm5_esm.ppt
附加文件5:高尔基体定量小立碗藓原丝体。荧光图像和在caulonemata(A)和chloronemata(B)的5个不同区域的ImageJ处理的图像表达YFP-曼融合蛋白量化高尔基高尔基(高尔基)。图像显示为共焦切片的最大投影,其中每个细胞器呈现不同的颜色。比例尺10 μm。(PPT 273 KB)
12870_2011_1038_moesm6_esm.ppt.
附加文件6:线粒体定量的小立碗藓原丝体。Caulonemata(A)(a)和氯豆酶(b)中的5个不同区域的荧光图像和Imagej处理图像,表达Megfp-Cox融合蛋白的氯肠肿瘤,以定量线粒体(Mito)。图像显示为共焦切片的最大投影,其中每个细胞器呈现不同的颜色。比例尺10 μm。(PPT 274 KB)
12870 _2011_1038_moesm7_esm.ppt
附加文件7:叶尖生长时叶绿体的运动小立碗藓caulonemata。每5 s间隔5分钟采集图像。比例尺:5 μm。(PPT 247 KB)
12870_2011_1038_moesm8_esm.ppt.
附加文件8:过氧化血剂在尖端生长的运动小立碗藓caulonemata。每5 s间隔5分钟采集图像。比例尺:5 μm。(PPT 103 KB)
12870_2011_1038_moesm9_esm.ppt.
附加文件9:高尔基体在顶端生长时的运动小立碗藓caulonemata。每5 s间隔5分钟采集图像。比例尺:5 μm。(PPT 122 KB)
12870_2011_1038_MOESM10_ESM.ppt
附加文件10:顶端生长中的线粒体运动小立碗藓caulonemata。每5 s间隔5分钟采集图像。比例尺:5 μm。(PPT 122 KB)
12870 _2011_1038_moesm11_esm.mov
附加文件11:叶尖生长中叶绿体的轨迹小立碗藓caulonemata。轨迹已经从其中图像是在5获取时间经过一系列构建?秒的间隔为5〜分钟。规模单元:µm。(MOV 178 KB)
12870 _2011_1038_moesm12_esm.mov
附加文件12:在尖端过氧化物酶体轨迹生长小立碗藓caulonemata。轨迹已经从其中图像是在5获取时间经过一系列构建?秒的间隔为5〜分钟。规模单元:µm。(MOV 532 KB)
12870_2011_1038_MOESM13_ESM.mov
高尔基体顶端生长的轨迹小立碗藓caulonemata。轨迹已经从其中图像是在5获取时间经过一系列构建?秒的间隔为5〜分钟。规模单元:µm。(MOV 376 KB)
12870 _2011_1038_moesm14_esm.mov
附加文件14:提示生长的线粒体轨迹小立碗藓caulonemata。轨迹已经从其中图像是在5获取时间经过一系列构建?秒的间隔为5〜分钟。规模单元:µm。(MOV 498 KB)
作者的原始提交的图像文件
权利和权限
开放访问本文在“生物资源”中央有限公司的许可下公布了这是一个开放式访问条款,分配根据创意公约归因许可证的条款(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
福特,F.,勒莫伊,K., Tüzel, E.。et al。植物细胞器分布与动态的定量分析小立碗藓protonemal细胞。BMC植物BIOL.12,70(2012)。https://doi.org/10.1186/1471-2229-12-70
已收到:
接受:
发表:
关键字
- 细胞器分配
- 细胞器动力学
- 顶端生长
- 小立碗藓