摘要
背景
我们研究了碳水化合物饥饿对强光适应反应的影响拟南芥双突变体在叶绿体光同化产物输出的昼夜路径上受到严重损害。磷酸三糖/磷酸转位器(TPT;tpt-2突变体)与(i)淀粉生物合成缺陷突变体(adg1-1, pgm1而且pgi1-1;adp -葡萄糖焦磷酸化酶、质体磷酸葡萄糖酶和磷酸葡萄糖异构酶的敲除)或(ii)淀粉动员(sex1-3,敲除葡聚糖水二激酶)以及(iii)麦芽糖从叶绿体输出(mex1-2).
结果
在弱光条件下生长时,所有的双突变体都能存活并且与野生型难以区分,但是-除了sex1-3 / tpt-2-在强光下生长时产生高叶绿素荧光(HCF)表型和生长迟缓。类囊体蛋白免疫印迹,Blue-Native凝胶电泳和叶绿素荧光发射分析在77开尔文adg1-1 / tpt-2双突变揭示了HCF与两个光系统中质体编码核心蛋白的特定减少有关(PSII成分细胞色素b除外)559),而核编码天线(lhc)则正常积累,但主要不附着在它们的光系统上。天线不耦合是暗适应植物HCF的主要原因。向高光生长的植物饲喂蔗糖或葡萄糖adg1-1 / tpt-2植物恢复了HCF-和生长表型。糖水平升高诱导葡萄糖-6-磷酸/磷酸易位体2 (GPT2)的表达,原则上可以弥补TPT的缺乏。在GPT2中有额外缺陷的三突变体(adg1-1 / tpt-2 / gpt2-1)在糖喂养反应中表现出相同的HCF-和生长表型的拯救adg1-1 / tpt-2这表明这种拯救独立于糖触发的GPT2诱导。
结论
我们认为胞浆碳水化合物的有效性调节植物对强光的适应答:芥.可以想象,在缺乏碳水化合物的植物中,叶绿体和细胞核之间在光合作用基因协调表达方面的强关系被修改了。因此,碳水化合物可能被认为是参与叶绿体到细胞核逆行信号传递的一种新成分,这方面将在未来的研究中得到解决。
背景
大部分CO2在卡尔文-本森循环中被同化,最终转化为碳水化合物。它们可以以短暂性淀粉的形式保留在叶绿体内,也可以从叶绿体中输出,并进一步通过韧皮部以蔗糖的形式运输,为根、花和发育中的种子等下沉组织提供碳和能量。叶绿体内包膜的磷酸三糖/磷酸转运器(TPT)是光同化物从基质输出的日间路径的主要界面[1].在光下输出的磷酸三糖被用作细胞质中蔗糖生物合成的前体。在光同化产物输出的夜间路径中,短暂性淀粉通过β-淀粉酶、异淀粉酶和歧化酶(DPE1)降解,生成麦芽糖和葡萄糖作为最终产物[2,3.].负责葡萄糖和麦芽糖输出的转运体已被鉴定,各自的突变体已被鉴定[4- - - - - -7].在细胞质中,麦芽糖通过DPE2进一步代谢[8,9],一种胞质杂聚糖[10]和胞质葡聚糖磷酸化酶(在答:芥PSH2)产生葡萄糖和葡萄糖-1-磷酸(Glc1P),它们进入进一步的代谢[11].
令人惊讶的是,一个答:芥敲除TPT突变体(tpt-1;相同的ape2, (光合作用对环境的适应;[12])缺乏明显的发育或生长表型[13],这主要是因为在光照下,降低的TPT转运能力可以通过增加淀粉的周转来弥补[13,14]如先前报导的反义TPT烟草植物[15].因此,蔗糖的生物合成可以通过光同化产物输出的夜间路径在光照下维持,即从麦芽糖和葡萄糖开始。引人注目的是tpt-1与adg1-1[16]或sex1-1[17],在adp葡萄糖磷酸化酶(AGPase)或葡聚糖水二激酶(GWD, [18]),虽然生长迟缓,但仍可存活,这表明残留的TPT活性允许植物存活[13].特别是adg1-1 / tpt-1双突变体表现出严重的生长和光合作用表型,使人联想到马铃薯植株,TPT和AGPase都受到反义抑制[19].的答:芥双突变体的特征是光合电子传递受损,叶绿体超微结构改变,如颗粒超堆叠,质体蛋白数量增加,在黑暗适应状态下的高Chl荧光(HCF),以及在光明和黑暗中氧化还原平衡的扰动[20.].有人提出,残留的TPT活性tpt-1等位基因允许存活adg1-1 / tpt-1双突变体[20.].
一个完全的突变体课程的基因(即。tpt-2)已被隔离和跨越不仅到adg1-1,但也进一步突变体缺陷的淀粉生物合成,其动员或输出淀粉降解产物麦芽糖从叶绿体。所有双突变体都是可活的,只有在强光条件下生长,而在弱光条件下不生长,才表现出明显的生长和/或光合作用表型。
在这里,我们重点研究了HCF表型的机制基础,以及可溶性糖在碳水化合物代谢受损突变体适应高光强度中的作用。HCF表型adg1-1 / tpt-1双突变等位基因只能部分解释为增加的氯蒸速率和伴随增强的质体醌池还原状态在黑暗中。这个概念主要是基于地面Chl-的额外增加一个荧光(Fo)在没有O2或者在应用没食子酸辛酯之后,它是质体局部替代氧化酶的抑制剂,是参与氯蒸作用的中心成分[20.].HCF表型的机制基础现已得到解决。它主要是由光收集复合物(LHCs)从它们的反应中心分离引起的。
可溶性糖和葡萄糖-6-磷酸/磷酸转位体2 (GPT2)在不同驯化反应中的作用adg1-1 / tpt-2通过向双突变体或an注入蔗糖或葡萄糖来解决对强光的反应adg1-1 / tpt-2 / gpt2-1三突变体。GPT2已被证明在转录和功能水平上被强烈诱导的突变体的叶片不能充分的淀粉生物合成,如adg1-1, pgm1或pgi1-2以及在adg1-1 / tpt-1[21].GPT2的诱导与突变体背景中可溶性糖的积累有关。我们的数据表明,可溶性糖是影响或改变植物对强光适应反应的关键因素adg1-1 / tpt-2GPT2不参与这种反应。
结果
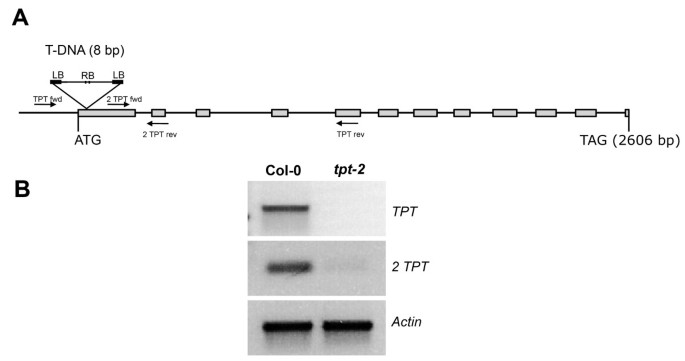
分离出一个敲除突变体课程的基因(tpt-2)和产生双突变体
的tpt-1该突变体(WS-2背景)携带T-DNA插入起始ATG上游24 bp的启动子区,显示残留的转录本课程的基因和大量的TPT运输活性高达野生型的16% [13,21].为了研究彻底淘汰的后果课程的基因答:芥,我们分离了tpt-2等位基因(Col-0背景;N573707;SALK_073707.54.25.x),在起始ATG下游8 bp处携带一个T-DNA插入点(图1).的tpt-2突变植株完全缺乏课程的特定转录本(图1 b),及P我输运量从2.94±0.35 nmol·g下降44%-1野生型的Fw为1.64±0.02 nmol·g-1弗兰克-威廉姆斯在tpt-2.3-PGA输运(3.07±0.41 nmol·g-1在野生型植物中未检测到Fw)tpt-2,证明tpt-2等位基因代表TPT的功能缺失突变体(以上数据表示n = 4次实验的平均值±SE)。为了同时阻断叶绿体的昼夜碳输出路径,植物采用了tpt-2已将突变体杂交成无淀粉或低淀粉突变体adg1-1[16),pgm1[22),pgi1-1[23]以及淀粉动员受损的突变体(sex1-3, (24])或从叶绿体输出麦芽糖(mex1-2, (5])。尽管TPT活性完全丧失,但所有双突变体均可存活。
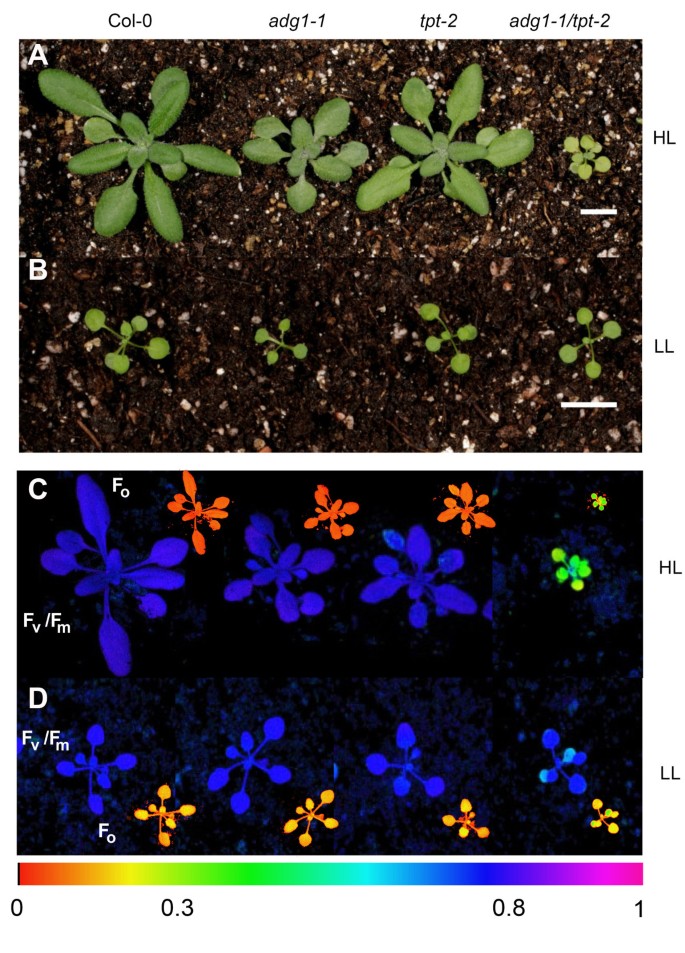
表型adg1-1 / tpt-2只有在强光条件下才会出现
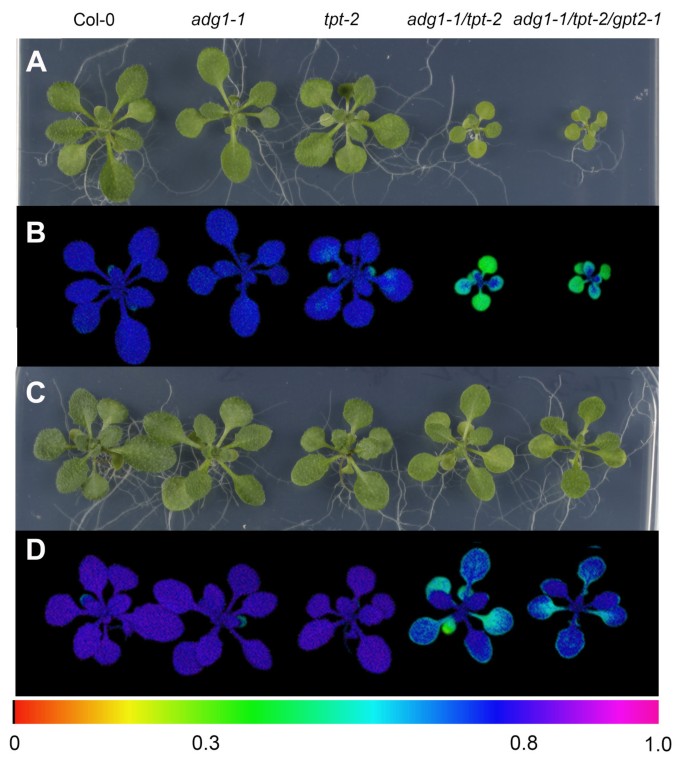
就像adg1-1 / tpt-1的adg1-1 / tpt-2双突变等位基因在营养生长中受阻,并在黑暗适应状态下显示HCF表型[20.].当双突变体植株在远高于50 ~ 70 μmol·m的光合光子通量密度条件下生长时,两种表型均出现-2·年代-1.PFD低于50 μmol·m时-2·年代-1,adg1-1 / tpt-2缺乏明显的表型。叶绿体碳输出的昼夜路径受损,破坏了基质和光合作用中的氧化还原平衡。两者都强烈依赖于植物生长过程中所经历的光强度。在此,我们比较了在弱光(LL)条件下(即PFD为30 μmol·m)生长的突变型和野生型植物的特性-2·年代-1PFD(即300 μmol·m)提高了10倍-2·年代-1),定义为高光条件。在LL环境中,所有的植物株系都显著变小(图2B)与HL相比(图2一)和adg1-1 / tpt-2在LL中生长缺乏任何明显的生长-或HCF表型(图2B和2D;表格1然而,在hl生长的植物中,双突变体的特征表型很明显(图2)2一个和2C).营养生长显著减少(图2A)和黑暗适应adg1-1 / tpt-2植物表现出地面荧光的特征性增加(Fo),反映在Fv/ F米从野生型或单突变株的0.8到双突变株的0.3左右(图2)2C,表1B).相反,ll - growingadg1-1 / tpt-2植株在发育过程中未能表现出HCF表型。与生长迟缓和HCF表型同时,只有hl生长的双突变株与野生型和单突变株相比,Chl-、类胡萝卜素-和蛋白质含量降低(表2)1B) The Chla / b野生型和单突变体的比值由3左右下降到hl型双突变体的2.1左右,ll型的比值也略低adg1-1 / tpt-2植物(表1一个)。
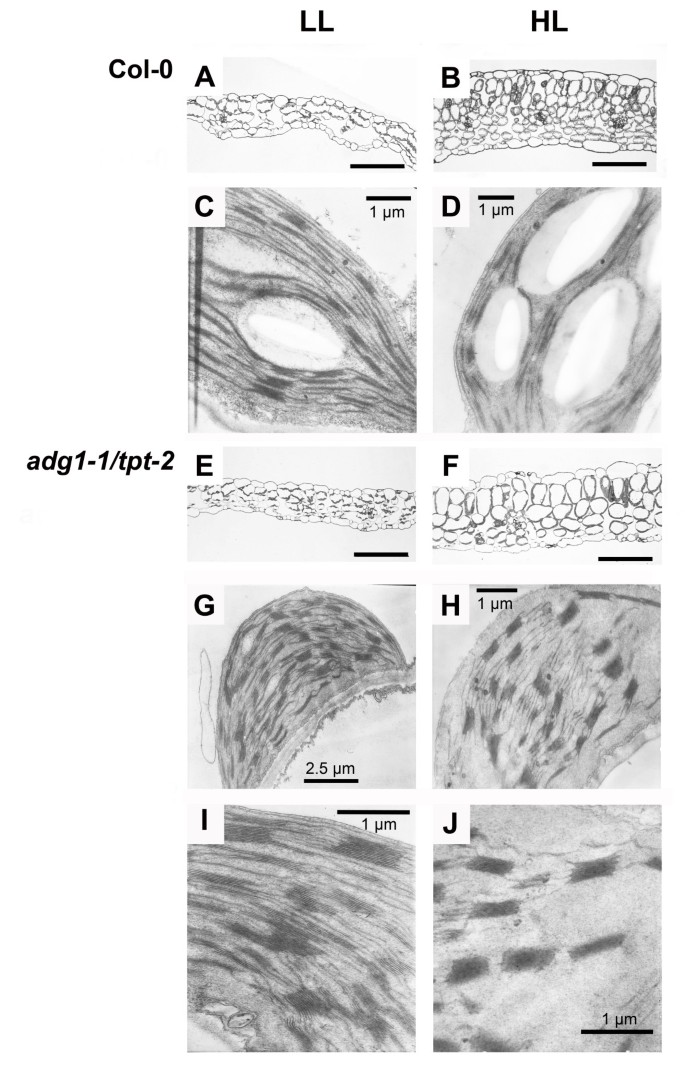
植物的生长和光合作用表型adg1-1 / tpt-2与野生型相比,伴随叶片解剖结构和叶绿体超微结构的改变(图3.).一般来说,hl生长的植物叶片较厚(图3.B和3.F)与LL中生长的植物相比(图3.一个和3.E).然而,与野生型相比,hl生长adg1-1 / tpt-2含有较少,但较大的叶肉细胞(图3.B和3.F)。
在叶绿体超微结构方面,野生型在ll条件下生长时表现出更多的颗粒堆(图3.C,平均每粒5.1层)与hl条件相比(图3.D;每粒平均3.9层)。引人注目的是,在叶绿体中的颗粒堆叠adg1-1 / tpt-2与hl种植的植物相比,LL种植的植物每粒的堆叠数甚至从6.7增加到8.3(图3.G3.J).附加文件1显示了LL-和HL-生长的野生型和双突变型植物之间“颗粒堆叠数类”分布的比较。在两种生长条件下都较轻adg1-1 / tpt-2与野生型的每粒最多9粒相比,hl种植的植物的“颗粒堆叠数类”分布更广,每粒最多17层。
综上所述,上述数据表明,在adg1-1 / tpt-2与野生型或单突变体植物相比,双突变体植物对HL的适当适应机制受到了损害。
在hl生长过程中,光合多蛋白复合物和超复合物的组成和丰度发生了强烈的变化adg1-1 / tpt-2植物
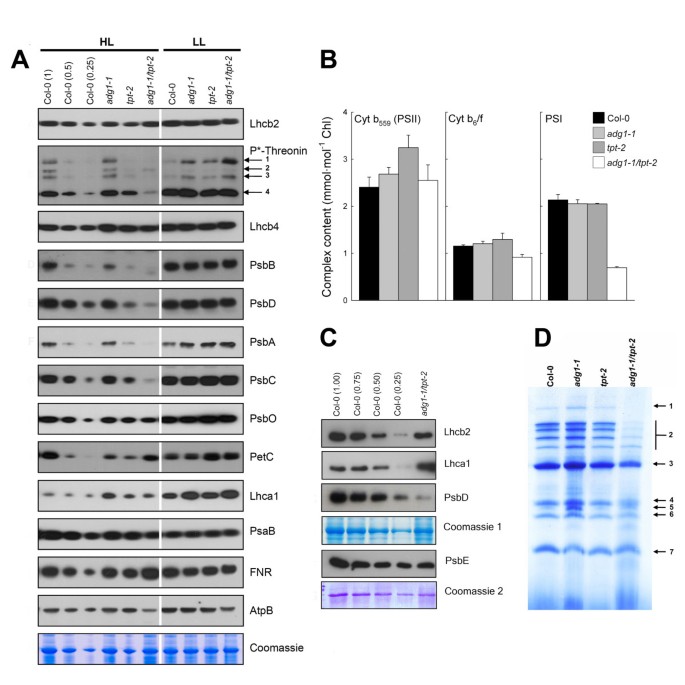
以HCF表型和增加的粒堆叠为例adg1-1 / tpt-1而且adg1-1 / tpt-2考虑到等位基因,我们通过免疫印迹分析研究了光合作用相关蛋白和相应的多端口蛋白复合物的积累(图4一个和4C)和Blue-Native PAGE(图4D)。HL-grownadg1-1 / tpt-2与野生型和单个突变体相比,植物PSII核心成分的丰度发生了显著变化。在双突变体中几乎检测不到质体编码的亚基PsbB (CP47)、PsbD (D2)、PsbA (D1)和PsbC (CP43),而psii相关的Lhcb蛋白以及氧进化复合体(OEC;PsbO)是一种核编码蛋白,没有受到影响。相比之下,当植物在LL环境下生长时,PSII核心蛋白含量为adg1-1 / tpt-2,野生型和单突变型植物非常相似(图4A) Cyt6与野生型相比,hl培养的双突变体和单突变体中/f复合组分PetC (Rieske蛋白)均降低(图4A).质体编码的PSI核心成分PsaB (P700载脂蛋白A2),与PsaA (P700载脂蛋白A1)一起参与从质体青苷到PSI受体侧的电子转移[25],在hl生长时减少了50-70%adg1-1 / tpt-2,但在单个突变体中均保持不变。与野生型相比,所有hl培养的突变系中核编码的Lhca1都增加了(图4此外,在hl条件下生长的双突变体中,同样是核编码的铁氧还蛋白:NADP还原酶(FNR)增加(图4A),而在HL-和ll -条件下,脂质体编码ATPase亚基AtpB的丰度略有下降adg1-1 / tpt-2.
类囊体蛋白的免疫印迹,PS功能组分的光谱测定,以及PS复合物的Blue-Native凝胶电泳分离.(A)从HL-和LL-生长的Col-0野生型叶片中分离总蛋白(约10 μg / lane)后,与光合作用相关的类囊体蛋白的免疫印迹adg1-1而且tpt-2单一突变体以及adg1-1 / tpt-2SDS-PAGE双突变体。注意hl生长蛋白的考马斯氏染色tpt-2相当于大约0.5倍而不是1倍的Col-0蛋白。P*-苏氨酸表示用磷酸化苏氨酸抗体孵育印迹后获得的信号。数字表示来自PsbC(1)、CaS(2)、PsbA/PsbD(3)和LhcbII(4)的信号。(B) PSII、PSI和cyt功能组分的光谱测定6/ f复杂。(C)在hl培养的野生型和PsbE中,PsbE与Lhcb2、Lhca1和PsbE的免疫印迹比较adg1-1 / tpt-2植物。(D) hl培养Col-0野生型类囊体蛋白的分离adg1-1而且tpt-2单一突变体以及adg1-1 / tpt-2蓝土凝胶上的双突变体。这些数字表示分离的类囊体的单个蛋白质组分,如NDH复合物(1,见附加文件)2:表S2)、PSII超复合物(2)、PSI超复合物/PSII二聚体(3)、atp酶(4)、PSII单体(5)、PSII/PsbC(6)、LHCII三聚体(7)
进一步分析了几种类囊体蛋白的磷酸化状态。Lhcb2, CP43, CaS(一种存在于间质类囊体中的钙敏感受体;[26]), D1/D2显著降低adg1-1 / tpt-2与野生型和单一突变型植物相比(图4A)。D1/D2磷酸化状态的降低与其整体蛋白含量的降低有很好的相关性,而Lhcb2的磷酸化状态在蛋白水平未受影响的情况下下降(图4一个)。
对孤立类囊体中光合电子传递链功能成分的光谱分析支持了免疫印迹获得的数据(图4B).只有hl培养的双突变体中PSI含量降低了50%以上,而与野生型相比,单突变体中PSI含量没有降低。这些数据与针对PSI核心成分PsaB的免疫印迹非常一致(图4A)氧化还原活性的Cyt6/f复合体在hl生长时降低adg1-1 / tpt-2与野生型和单一突变型植物相比。Cyt b的积累559PSII的基本结构成分,在hl生长的双突变植物中没有变化(图4B)尽管PSII核心组件整体减少。形成Cyt b α亚基的PsbE蛋白的免疫印迹559,支持Cyt b的光谱测定559.例如,与hl生长的PsbD相比,PsbE的减少要明显得多adg1-1 / tpt-2(图4C)。
PSII核心成分丰度受损和超复合物的形成adg1-1 / tpt-2从hl生长的植物中分离的类囊体蛋白在Blue-Native凝胶上的分离进一步支持。最引人注目的是,PSII和PSI超复合物以及PSII单体的丰度严重减少adg1-1 / tpt-2与野生型和单一突变体相比,而atp酶和LHCII三聚体(作为110 kDa的参考)不受影响(图4D).此外,高分子质量带1 (>1000 kDa)在双突变体中完全缺失。LC-MS/MS测定条带1的蛋白组成(附加文件)2).这与Peng等人早先的一份报告很吻合。[27],表明hl生长的NDH1-PSI超复合物不存在adg1-1 / tpt-2。
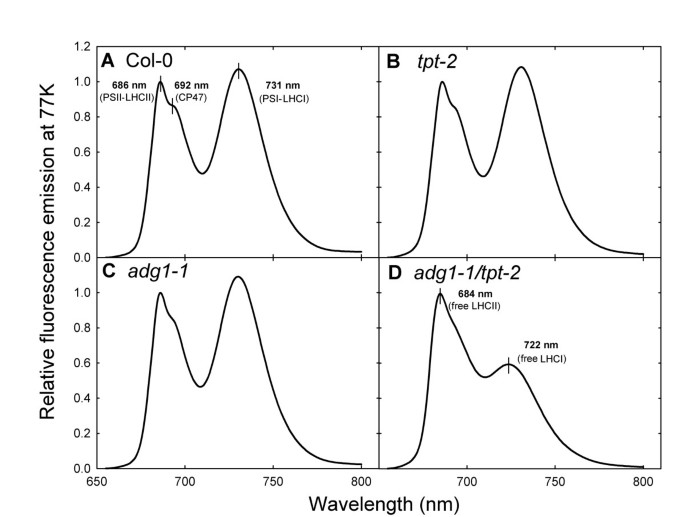
的背影,一个77开尔文的荧光发射揭示了大量游离的、高荧光的lhc从它们的光系统中解耦adg1-1 / tpt-2
低温Chl-一个孤立类囊体的荧光发射允许估计lhc与反应中心的功能耦合。而野生型和单一突变体的发射光谱几乎相同(图5一个来5C),得到的光谱有特征变化adg1-1 / tpt-2(图5D)野生型和单突变体PSII-LHCII在686 nm处发射最大,CP47在692 nm处发射一个肩峰。这些信号是典型的PSII-LHCII超复合物,具有高效的激子从外部天线转移到反应中心。然而,在双突变体中,最大发射从686 nm转移到684 nm,反映了一部分游离LHCII与PSII激子解耦。同样,野生型和单一突变体在731 nm处的发射最大值是典型的LHCI与PSI的强耦合。在双突变体中,发射最大值从731 nm转移到722 nm,这表明在705 ~ 725 nm之间存在大量未耦合的LHCI。这些数据表明Fo在adg1-1 / tpt-2双突变体是从lhc释放出来的,与它们的光系统不耦合。
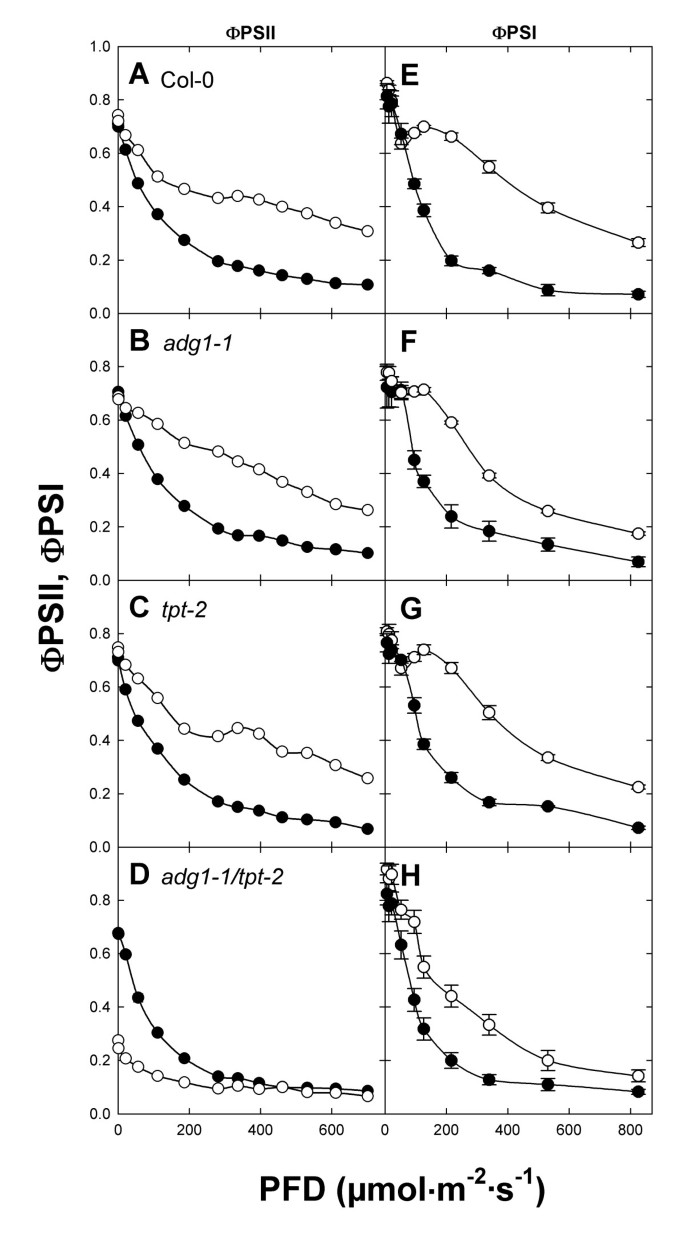
与hl生长的PSII相比,PSI的效率受到的影响较小adg1-1 / tpt-2植物
以前测定的光合作用参数adg1-1 / tpt-1PSII (ETRII)的电子传递率(ETR)较野生型或单一突变体降低近90% [13].考虑到这两个光系统的化学计量受到扰动,以及天线的很大一部分与它们的反应中心不耦合,我们比较了PSII和PSI电子转移的量子效率(即ΦPSII和ΦPSI),而不是导出的ETRII和ETRI。在LL和hl生长的野生型和单突变株中,ΦPSII和ΦPSI的光曲线相似(图2)6一个来6C和6E6G),但在adg1-1 / tpt-2双突变体(图6D和6H), PFD最高可达200 μmol·m-2·年代-1HL-生长的ΦPSII值低于ll生长的ΦPSII值adg1-1 / tpt-2植物(图6D),但在pfd大于200 μmol·m时,两条曲线收敛-2·年代-1ΦPSII的值与ll生长的野生型和单突变株的值相似。与ΦPSII对增加PFDs的响应相反,在整个PFDs应用范围内,HL-的ΦPSI值明显高于ll生长的双突变植物(图6H),表明在hl培养的双突变植株中,PSI的效率受到的影响小于PSII。
此外,PSI的供体位点限制(ΦND,即限制电子从cytb转移6/f复合物对PSI)增加adg1-1 / tpt-2而受体位点限制(ΦNA,即电子从PSI转移到NADP的限制)接近于零(附加文件)3.).当植物在LL中生长时,这两个参数在行间都不受影响。因此,在hl生长的双突变植物中,从PSII到PSI的电子转移受到损害,而PSI的效率不受受体位点限制。
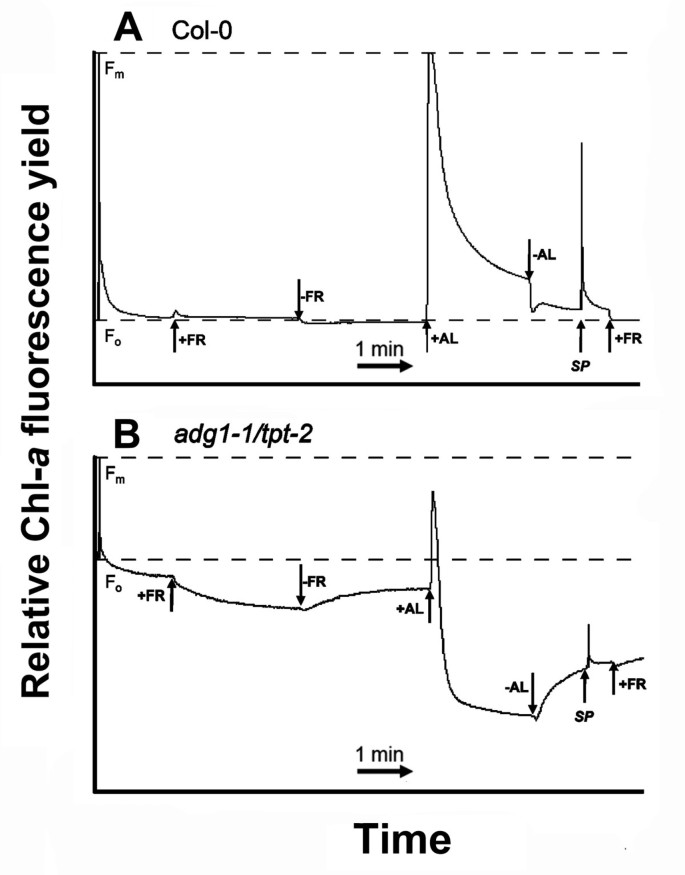
远红光和光化照明诱导HCF的非光化学猝灭adg1-1 / tpt-2
与PSII或PSI核心蛋白不相关的lhc部分导致Chl-的增加一个深色适应hl生长的荧光产量adg1-1 / tpt-2.为了分离增加的F的各个组成部分o在adg1-1 / tpt-2时间过程例程如图所示7应用了A。在测定F时o和F米时,用远红光(FR)照射植物,特异性地激发PSI(以完全氧化PSII受体位点),随后用光化光(AL)照射。的adg1-1 / tpt-2双突变体在FR存在时荧光产量缓慢下降,直到达到一个新的最低水平(图7B),而Fo在野生型中不受FR影响(图7A).可以想象,在双突变体中观察到的这部分猝灭是由于Q的再氧化一个.的荧光信号adg1-1 / tpt-2又慢慢地放松到原来的Fo在深色适应植物中观察到的值(图7B).应用强AL (PFD约为4000 μmol·m-2·年代-1的荧光信号adg1-1 / tpt-2迅速降至F以下o并达到最小值(Fo’),即在切断AL后(图7B)与F相似o在野生型植物中观察到(图7A),这表明这种剩余荧光是基于与剩余PSII核心组分相关的lhc,而与PSII不相关的lhc的荧光是非光化学淬灭的。与野生型相比,Fo在adg1-1 / tpt-2在变暗后再次增加,随后应用饱和光脉冲(SP)只引起荧光产量的小幅增加,这支持了游离LCHs的非光化学猝灭(NPQ)是AL中荧光产量下降的主要原因的观点。然而,尚不清楚是哪种机制导致F的下降o应用FR光后适应暗adg1-1 / tpt-2叶子。
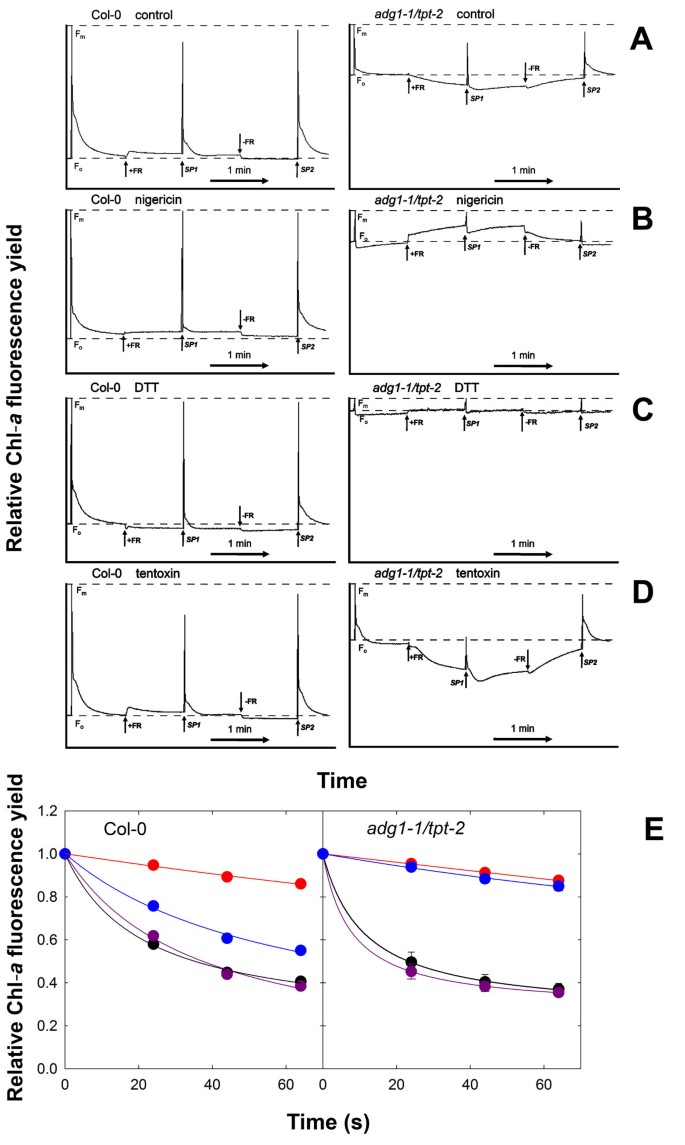
因此,我们研究了F的FR依赖性猝灭的机制基础o通过应用抑制剂,如尼日尔霉素(一种分散类囊体质子梯度的质子)、二硫苏糖醇(DTT;叶黄素循环的有效抑制剂)和藤毒素(类囊体atp酶的特定抑制剂)。与对照组相比(图8A)、尼日尔霉素的应用(图8B),数码地面电视更是如此(图8C)到适应深色的叶子adg1-1 / tpt-2导致Fo与此同时,Fv/ F米而在野生型中,这些参数不受抑制剂处理的影响。最引人注目的是,在FR照射下,Chl-一个荧光产率不减反增adg1-1 / tpt-2和F米和F米野生型和adg1-1 / tpt-2植物。F米在对照工厂的FR照明期间(图8A)是由于在类囊体膜上建立了质子梯度。非光化学能量猝灭(qE)由该质子梯度诱导的游离lhc被尼日尔霉素和DTT所消除(图8B和8C).相反,施用藤毒素导致Fv/ F米暗适应率adg1-1 / tpt-2叶片和更明显的Fo在FR光照射下(图8D),表明通过抑制类囊体atp酶在类囊体膜上建立了一个更陡的pH梯度,从而提高了qE.数字8E表示F随时间变化的响应米相对于F米PFD = 600 μmol·m-2·年代-1).乳酸菌素的应用抑制了qE同样在adg1-1 / tpt-2而施用DTT对q有较强的抑制作用E在adg1-1 / tpt-2在野生型中有一个中间效应。tentoxin的存在对q无显著影响E无论是在adg1-1 / tpt-2野生型也没有(图8E)。
尼日尔菌素、DTT和藤毒素对Chl-反应的影响一个适应黑暗的野生型和双突变型植物对远红光照明的荧光.用PAM 2100荧光计进行了时间过程实验,得到了Chl-的响应一个Col-0野生型或adg1-1 / tpt-2双突变植株在没有(对照,A)或存在黑豆霉素(B)、DTT (C)或藤毒素(D)的情况下朝向远红色(FR)照明。在测量之前,分离的叶片在0.05%乙醇(对照)或抑制剂溶液中在黑暗中孵育1小时。在实验过程中,5秒后施加饱和光脉冲(SP)以确定Fo和F米.在箭头指示的地方,FR被打开(+)或关闭(-)。SP表示饱和光脉冲的应用。(E)尼日尔霉素(红圈)、DTT(蓝圈)或tentoxin(紫圈)对最大Chl-衰变的影响一个荧光收率(F米')在col0和adg1-1 / tpt-2在PDF为600 μmol·m的AL光照下的植物-2·年代-1与对照组(黑圈)相比。的数据adg1-1 / tpt-2为n = 3个独立实验的均值±SE
最后,关于adg1-1 / tpt-1, O的剥夺2在暗适应状态下,Fo大约10%的adg1-1 / tpt-2等位基因,但不是在野生型植物中。剩余的Fo可在FR光照下迅速淬灭,表明Q一个在无O的情况下,通过PSI形成质体醌池2(附加文件4).
叶片中可溶性糖的含量受到严重损害,而不是能量状态adg1-1 / tpt-2在光期
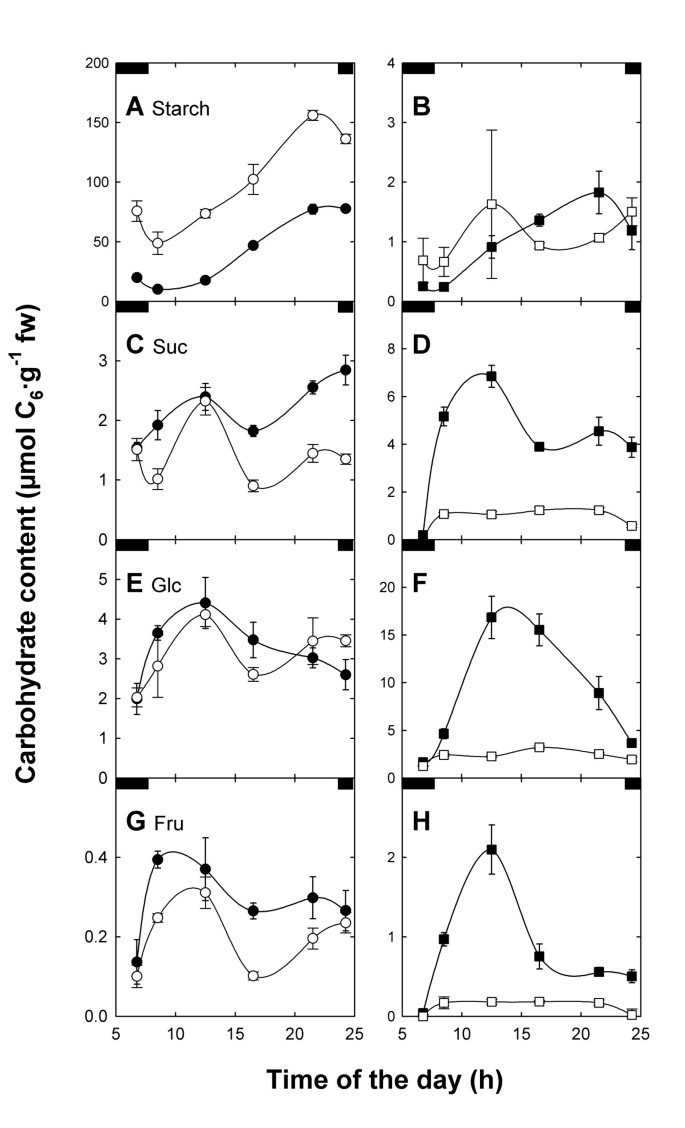
在光照下限制TP输出或淀粉生物合成不足导致淀粉或可溶性糖的积累[13,21].因此,从叶绿体输出光同化物的白天和夜间路径的阻断应该会导致叶片碳水化合物代谢的严重扰动adg1-1 / tpt-2双突变体。数字9显示在hl生长的一天中,淀粉和可溶性碳水化合物(蔗糖[Suc],葡萄糖[Glc]和果糖[Fru])含量的变化adg1-1 / tpt-2与野生型和单一突变型植物相比。除了缺乏产生大量的短暂性淀粉(图9一个和9B),adg1-1 / tpt-2无法在白天产生大量的可溶性碳水化合物(图9D, F和9H).因此,双突变体代表一种缺乏碳水化合物的植物。相比之下,adg1-1单突变体积累可溶性糖,最显著的是Glc(图9D).此外,两种食物中仍可检测到少量淀粉adg1-1和双突变体(图9B)tpt-1[13),tpt-2与野生型相比,等位基因在光照期间表现出较高的淀粉水平(图9A)。此外,tpt-2在光照下的前4-5小时内,Suc含量瞬时累积,随后Suc含量下降,直到光照期结束(图9C)。adg1-1单个突变体在一天的过程中也表现出类似的可溶性糖的短暂积累(图9D, F和9H),反映了HL中蔗糖生物合成酶的反馈调控机制很可能存在限制。当植物在LL中生长时,线条之间的游离糖水平基本不受影响(表2)2一个)。
尽管植物间碳水化合物含量波动很大,而且hl生长严重迟缓adg1-1 / tpt-2,在LL-和hl -条件下,不同株系的腺苷酸ATP、ADP和AMP含量基本保持不变2B和2C).与ll条件相比,HL条件下所有植株的ATP、ADP和AMP含量平均提高了5-、6-和12倍。然而,考虑到能量电荷(EC)作为腺苷酸池稳态的衡量标准,LL和hl种植的植物之间只有很小的差异。在所有株系中,LL的EC(0.82 ~ 0.83)略高于HL的EC(0.76 ~ 0.80)。因此,能量缺乏似乎不是观察到的hl生长和光合作用表型的原因adg1-1 / tpt-2.
糖的喂养挽救生长和HCF表型adg1-1 / tpt-2植物独立于诱导GPT2
碳水化合物饥饿adg1-1 / tpt-2与HL条件下的生长发育和HCF表型相关。因此,研究了外源糖对hl生长的野生型和双突变型植物的驯化反应的影响。两者,生长和HCF表型adg1-1 / tpt-2在添加50 mM Suc的MS培养基上生长时,可以挽救植株(图10C和10D)或50 mM Glc(未显示)与未喂食对照组相比(图10一个和10B). HCF表型的拯救adg1-1 / tpt-2在50 mM蔗糖条件下,Fv/ F米比值,ΦPSII, Chl含量和Chla / b比率(表3.).上述参数几乎恢复到野生型水平。苏培养的双突变植物的恢复伴随着D2蛋白(PsbD)丰度的大幅增加和Lhcb2和PsbA/PsbD磷酸化状态的适度增强(附加文件)5),表明在adg1-1 / tpt-2可能是影响HL适应的主要原因。相比之下,在长时间的黑暗中(即48小时)饲喂Suc未能挽救HCF表型adg1-1 / tpt-2(没有显示)。
我们最近证明了GPT2在转录和功能水平上的诱导与淀粉生物合成缺陷突变体叶片中糖的积累相关[21].这种通过包膜运输磷酸化中间体的额外能力可能弥补TPT活性的损失。事实上,在Suc喂食后,增加了10倍GPT2转录丰度(qRT-PCR测定)adg1-1 / tpt-2相比之下,野生型只检测到1.4倍。因此,在Suc的存在下,双突变体的表型恢复可能完全基于GPT2的诱导。为了验证这一假设,我们生成了一个纯合子adg1-1 / tpt-2 / gpt2-1三突变体,表型上与adg1-1 / tpt-2双突变体(图10一个和10B).引人注目的是,三突变体也可以通过Suc喂食获救(图10C和10D).这一观察表明,GPT2在HL的驯化反应中明显不发挥关键作用adg1-1 / tpt-2在Suc进料时。
在叶绿体碳输出的昼夜路径上的一般阻断导致HCF和生长表型相似adg1-1 / tpt-2
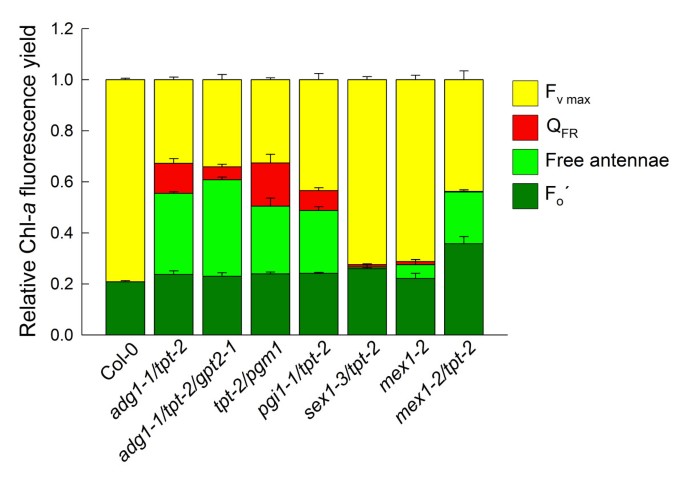
特征生长和HCF表型不局限于adg1-1 / tpt-2,但在TPT结合淀粉生物合成的其他步骤(如磷酸葡萄糖异构酶)受损的双突变体中也很明显。pgi1-1)或磷酸葡萄糖转换酶(pgm1),即pgi1-1 / tpt-2而且tpt-2 / pgm1双突变体(附加文件6这样的)。adg1-1 / tpt-2,这些双突变体在LL(附加文件)中生长时缺乏任何明显的表型6A)高淀粉突变体mex1-2 / tpt-2麦芽糖转运蛋白和TPT均受损,也表现出类似的表型adg1-1 / tpt-2(附加文件6B).然而,这种表型的相似性本身并不是基于高淀粉水平,因为sex1-3 / tpt-2双突变体(附加文件6C),在GWD蛋白和TPT中受损,不显示明显的HCF表型。Chl-的比较一个线间荧光特征显示,除sex1-3 / tpt-2,所有其他双突变体均显示F升高o,以及对AL照明的类似响应,即荧光猝灭低于Fo然后在黑暗中缓慢恢复(图中未显示)。然而,FoFR光照均不存在sex1-3 / tpt-2而且mex1-2 / tpt-2。
个体荧光类对总荧光产率的相对贡献,即Fo与它们的光系统耦合或不耦合的lhc以及F的部分发射o通过FR照明和最大可变荧光(F米)总结于图中11并以Chl-为基础一个荧光时程实验与图中所示相似7.在Adg1-1 /tpt-2, Adg1-1 /tpt-2/gpt2-1, tpt-2/pgm1而且mex1-2 / tpt-2F米与野生型相比严重减少了sex1-3 / tpt-2双突变体,而自由天线的荧光增强,这表明在hl条件下,严重限制叶片碳水化合物代谢促进PSII完整性的大量损失。当施加非常高强度的AL (PFD = 4000 μmol·m)后,研究结果表明-2·年代-1) Fo’(即与光系统相关的天线的荧光发射),除了mex1-2 / tpt-2与野生型相比,在所有品系中都非常相似。在后者的双突变体Fo比野生型高1.75倍。此外,在所有无淀粉或低淀粉双突变体中,很大一部分HCF可以被FR光猝灭,最有可能是通过激发能量的热耗散。相比之下,FR光对HCF没有影响mex1-2 / tpt-2。
讨论
在本报告中,我们研究了叶片碳水化合物代谢受到强烈扰动的植物的驯化反应。我们研究的主要结果可以总结如下:(i)在光同化物输出的昼夜路径中受损的双突变体仍然可行,(ii)只有在HL中生长的突变植物才会生长和HCF表型,而在ll中几乎不存在。(iii) HL的生长导致参与光合电子传递的类囊体蛋白的组成发生严重变化,最显著的特征是两个光系统中质体编码的核心成分减少,导致不耦合的、高荧光核编码的PSII和PSI天线含量增加。PSII和PSI反应中心的丢失导致Chl含量的减少和Chl的下降a / b比例adg1-1 / tpt-2.(iv)饲喂可溶性糖(如Suc或Glc)可挽救黄颡鱼的生长和HCF表型adg1-1 / tpt-2双突变体adg1-1 / tpt-2 / gpt2-1表明糖信号参与了碳水化合物匮乏植物HL驯化的改变或替代NADPH和ATP消耗代谢途径的增强。此外,GPT2在糖触发的突变体表型拯救中并不是一个关键角色。
残余TPT活性或诱导GPT2双突变体在光同化物质输出的昼夜路径中受损,不是导致其存活的原因吗
淀粉生物合成的阻碍和光同化产物输出的日间路径导致植物生长迟缓和HCF表型(即HCF表型)。Adg1-1 /tpt-2, tpt-2/pgm1, pgi1-1/tpt-2).之前有人提出,在的背景下,残留的TPT活性(与野生型相比可高达16%)adg1-1 / tpt-1[21]可能允许这种双突变等位基因存活[13,20.].在新成立的adg1-1 / tpt-2双突变体,完全缺乏课程的-特定的成绩单和TPT运输活动,我们可以清楚地证明TPT不是生存所必需的。很可能其他磷酸盐易位子的诱导可以弥补TPT的缺失。例如,两者之一A. thaliana GPT基因(即。GPT2)在淀粉生物合成缺陷的突变体叶片中诱导(如adg1-1, pgm1而且pgi1-2)以及adg1-1 / tpt-1双突变体[21].有人提出GPT2是HL适应的重要组成部分答:芥[28].在野生型植物中两者都有GPT基因不是(GPT2)或仅弱(GPT1)在光自养组织中表达[29].由于GPT蛋白除了能转运Glc6P外还能转运TPs [30.],叶绿体中功能性GPT的存在将缓解TPT输出光同化产物的限制。在。的帮助下adg1-1 / tpt-2 / gpt2-1我们可以证明GPT2与双突变体的存活无关。然而,可以想象的是,一小部分TPs可以通过木酮糖5-P (Xu5P)/磷酸盐转运器(XPT, At5g17630;[31]),根据电子荧光蛋白浏览器,在自养和异养组织中表达A. thaliana (http://www.bar.utoronto.ca/efp/cgi-bin/efpWeb.cgi;[32])。除了对Xu5P的比输运能力外,XPT还接受TP,而不接受3-PGA作为带有K的底物米生理范围内的值(即0.4 mM;[31])。然而,没有迹象表明XPT材料基因在双突变背景下上调(未发表数据)。未来的实验必须澄清adg1-1 / tpt-2 gpt2-1 / xpt材料四倍突变体仍然存活。
的HCF表型adg1-1 / tpt-2是由PSII和PSI核心蛋白减少导致的天线不耦合引起的
突变体在叶绿体碳输出的昼夜路径上受损。Adg1-1 /tpt-2, tpt-2/pgm1, pgi1-1/tpt-2)在HL中生长时产生HCF表型。高Fo荧光产率在Fo这些荧光变化模式让人联想到PSII突变体[33],例如PSII稳定性有缺陷[34或它的装配,如lpa1[35),lpa2[36],或最近在类囊体蛋白PAM68中[37].根据77 K的荧光发射光谱和免疫印迹分析,我们可以证明HCF是hl生长的主要成分adg1-1 / tpt-2减少最显著的蛋白是两个光系统的质体编码核心蛋白(D1, D2, CP43, CP47, P700载脂蛋白A2), Cyt b除外559类囊体atp酶(AtpB)的β亚基,而其lhc或其他核编码蛋白如PsbO或PetC (Rieske)的含量基本不变,甚至增加(FNR)。自由天线是高度荧光的[38,39]并产生所观察到的HCF表型。
由于活性氧的不可避免的形成,PSII不断受到破坏,特别是在hl条件下[40].D1和D2表现出较高的蛋白质周转,因为它们受到PSII光抑制(由[41- - - - - -43])。在adg1-1 / tpt-2双突变植物暴露于hl条件下,PSII核心蛋白的分解速率可能超过它们的速率新创合成。此外,PSI在adg1-1 / tpt-2下降与PSII一致。PSI含量降低的依据尚不清楚。通常情况下,PSI含量在PSII光抑制反应中不受影响[44,45].
引人注目的是,大量的Cyt b559,尽管D1或D2严重下降,PSII的质体编码成分仍然很高。通常,Cyt b的含量559与叶绿体中其他PSII核心蛋白密切相关,游离Cyt b559不会累积。在PSII光抑制的情况下,Cyt b559与PSII反应中心的其余部分平行降解[46].然而,游离Cyt b559例如,在去黄化过程中PSII组装之前,在黄化质体中观察到[47,48或在HCF突变体的筛选中,特别是在PSII中受影响的那些[33].最近有人提出Cyt b559作为质体喹诺酮氧化酶[49].仍有待确定是否游离Cyt b559还具有光保护功能。引人注目的是缺乏Cyt b559而不是增加的Cyt b559丰度在烟草突变体中导致类似的HCF表型,这被解释为质体醌池的过度减少[49,50].同样,烟草植株的HCF表型在CO中保持和光照较长时间2自由空气[51]或甜菜属缺铁的植物[52]归因于PSII受体位点的减少。
我们最近提出HCF表型观察adg1-1 / tpt-1双突变体也可能与Q的还原态增加有关一个和黑暗中的质体醌池[20.].考虑到O2没食子酸辛酯(OG)抑制参与氯蒸作用的叶绿体替代氧化酶(PTOX)进一步提高Fo在双突变体中,但在野生型中没有。剩余的氯一个荧光产量可以很容易地通过应用FR光淬灭,这表明确实存在于PSII受体位点的电子通过PSI被有效地去除。同样,O2也观察到FR照明的剥夺和额外荧光产量的快速下降adg1-1 / tpt-2双突变等位基因(见附加文件4).如果这些过剩的HCF是基于氯蒸作用[53], NDH1可能不会参与电子转移,因为NDH1- psi超复合物缺失adg1-1 / tpt-2(图4D、附加文件2).然而,HCF的主要部分在这两个Adg1-1 /tpt-1和Adg1-1 /tpt-2等位基因不受FR光照的影响(对比图7B,和[20.]),并由与它们的光系统解耦的大型强子对撞机发射。
激发能的热耗散导致HCF在F以下猝灭o
非光化学猝灭(NPQ)保护光系统(特别是PSII)免受PSII天线中增加的热耗散引起的过度兴奋[54,55],这需要类囊体腔的酸化,lhc的质子化[56])及PsbS [57]和可操作的叶黄素循环,例如[58].这些机制被认为可以改变PSII天线蛋白和PsbS的构象[59- - - - - -61],导致天线内激发态Chl分子的寿命下降([62,63]),从而导致更大概率的热耗散,而不是激励转移到反应中心。
在这里,我们提供了证据,自由lhc的荧光可以被光化光和甚至在FR光下的热耗散猝灭。在FR光照下缓慢的荧光衰减动力学(以分钟为尺度)及其在黑暗中缓慢的恢复表明LHC蛋白的构象变化。时间常数在45秒的范围内,正如在adg1-1 / tpt-2(比较图7B)是这种构象变化的典型特征[64].此外,在双突变背景下,原胞菌尼日尔霉素和叶黄素周期抑制剂DTT的应用显著降低了NPQ。引人注目的是,在黑豆霉素和DTT的存在下,在FR光作用下HCF的猝灭完全被取消,而在tentoxin(一种类囊体atp酶的特异性抑制剂)的存在下,HCF呈增加趋势(对比图8).FR光处理对适应黑暗的野生型叶片Chl-的影响不大一个荧光。从这些观察中,我们得出结论,FR照明能够产生质子梯度,这可能是由于PSI周围的循环电子传输(CET),这导致了一些自由天线的NPQ。
有趣的是,除了mex1-2 / tpt-2双突变体Fo在具有相似HCF表型的所有突变系中,AL的高PFDs光照下的值几乎相同。因此,剩余的荧光产率可能反映了lhc的发射与它们的光系统在功能上耦合。相比之下,轻度HCF表型在mex1-2 / tpt-2双突变体可能是基于叶绿体的机械损伤,最近已证明mex1单身,dpe1 / mex1[6]或tpt-2 / mex1双突变体[7].
类囊体蛋白磷酸化状态的减弱是否导致了颗粒的过度堆积adg1-1 /课程双突变体?
植物可以通过状态转换来适应波动的光[65],在低光强度下占主导地位,涉及特定激酶对PSII天线的可逆磷酸化/去磷酸化(STN7;[66,67])和磷酸酶(TAP38, [68,69])。这导致磷酸化PSII天线与PSII核心的解耦,以及与PSI的横向移动和关联。通过这种机制,激发能量在光系统之间的分布可以适应植物的需要[70].此外,STN8激酶负责PSII核心蛋白的磷酸化,如D1 [66,71]从而参与PSII的修复周期[43,72,73]光抑制后。在这里,我们可以证明,在hl生长中,Lhcb2以及PsbC、CaS和PsbA/PsbD的磷酸化状态严重减弱adg1-1 / tpt-2与野生植物相比。虽然PsbC和PsbA/PsbD的磷酸化状态下降与它们的总含量下降有很好的相关性,但Lhcb2的丰度在中未受影响adg1-1 / tpt-2因此会导致大量的非磷酸化PSII天线。磷酸化的PSII核心蛋白含量的降低与Lhcb2磷酸化的降低相结合,将与颗粒堆叠的增加相一致adg1-1 / tpt-2.在实验中还观察到一种改进的粒子堆叠现象stn8而且stn7突变体(74,75].此外,像adg1-1 / tpt-1而且adg1-1 / tpt-2等位基因,在ll条件下生长的植物[76- - - - - -78]或有利于激发PSI的轻质[79表现出颗粒堆积的增加。双突变体中PSII受体位点的氧化程度是否触发了颗粒堆叠的程度仍有待解决。
糖的外部供应挽救生长和HCF表型adg1-1 / tpt-2
外源的Suc或Glc可以挽救植物的生长表型adg1-1 / tpt-2.这并不奇怪,因为双突变体既不能积累淀粉,也不能积累大量可溶性糖。因此,给缺乏碳水化合物的植物喂食糖,应该为营养生长提供足够的碳前体。然而,双突变体HCF表型的挽救不能简单地用碳骨架作为ATP生物合成的额外能量来源来解释。在光照下,LL-和hl -生长的突变型和野生型植物的能量电荷(EC)基本保持不变,这表明ATP的限制(例如PSII修复周期)并不是HCF表型或观察到的生长迟缓的主要原因。引人注目的是,在没有光的情况下,糖的喂养并不能有效地缓解HCF表型adg1-1 / tpt-2(没有显示)。可以想象,可溶性糖的缺乏或极低水平阻断了适当的驯化反应所需的信号通路。因此,糖信号,即通过己糖激酶(80]可能直接或间接参与了这种反应,而GPT2参与了糖依赖的拯救adg1-1 / tpt-2可以排除生长和HCF表型,因为在a中没有GPT2时也发生了类似的拯救dg1-1 / tpt-2 / gpt2-1三突变体。此外,糖的应用或变化的光环境改变了叶肉的代谢特征,这本身可能被认为是一种信号[81,82].Glc(或Suc)除了作为信号分子的作用外,还可能增强叶绿体内作为NADPH和ATP接收器的代谢序列,如光合作用机制的生物合成或新生脂肪酸的生物合成,从而缓解光抑制。
结论
在这里,我们证明限制碳水化合物会影响对HL的适应答:芥.可以想象,叶绿体和细胞核之间关于光合作用基因协调表达的强关系被修改了。这可以通过光合复合体的质体编码亚基的严重抑制和核编码成分(如lhc和氧进化复合体的亚基)的不变积累来证明。在hl暴露过程中,叶绿体信号向核/细胞质系统的产生和/或传输可能发生强烈改变adg1-1 / tpt-2与野生型或单一突变体相比。因此,adg1-1 / tpt-2双突变体可能成为未来研究逆行信号原理的一个很好的工具,这对核和质体编码的光合作用基因的协调表达至关重要。这方面将通过转录组学和代谢组学方法来解决。此外,应该考虑到质体编码基因的转录和翻译([40,83,84]以及类囊体膜内光系统的组装部分由核编码因子控制[85,86].
方法
植物材料和生长条件
的种子答:芥从诺丁汉拟南芥种群中心(Nottingham Arabidopsis Stock Centre, NASC)获得Ws-2、Col-0和Ler生态型。此外,还使用了以下在所示基因中有缺陷的突变系:gpt2-1(At1g61800;[29]),adg1-1(At5g48300;[16]),sex1-3(At1g10760;[24]),pgm1(At5g51820;(22),pgi1-1(At4g24620;[23)),mex1-2(At5g17520;[5])。
植物在生长柜(Percival, CLF Plant Climatics GmBH, Wertingen, Germany, model ar - 36l3 /HIL)中在土壤上发芽和生长约4周,光照/黑暗周期为16小时/8小时,昼夜温度为22°C/18°C,相对湿度为40%。生长柜的三层每层都装有14根荧光管(欧司朗L18W/840),可以调暗到所需的PFD。HL和LL的光合活性PFD调节为300 μmol·m-2·年代-1或30 μmol·m-2·年代-1并由LI- cor LI 250光度计每周控制一次。在上述HL条件下,种子在无菌的1/2 Murashige-Skoog (MS)琼脂或添加50 mM Suc或50 mM Glc的1/2 MS琼脂上发芽生长4周后,进行外源碳水化合物的饲养实验。
隔离tpt-2突变等位基因和双突变体的产生
突变系N573707 (SALK_073707.54.25.;使用g_tpt-2引物结合T-DNA边界引物(附加文件)对基因组DNA进行标准PCR筛选7).结果PCR产物测序和T-DNA插入课程的验证了起始ATG下游8 bp的基因(At5g46110)。分离的纯合子tpt-2突变株体积较小,因此回交为Col-0野生型。只有F2群体中携带该基因的植株得到进一步繁殖tpt-2等位基因纯合,与Col-0相比没有任何生长迟缓。的tpt-2变种人的界线被越过了Adg1-1, pgm1, pgi1-1, sex1-3而且mex1-2.对纯合单突变体的未成熟花进行阉割和人工异花授粉。十字架Tpt-2 × adg1-1, pgi1-1,性1-3,mex1-2,并使用adg1-1, pgi1-1,mex1-2作为女性家长。为了十字架pgm1×tpt-2的tpt-2以植物为母本。将双突变体进行杂交,得到缺乏TPT、ADG和GPT2的三重突变体adg1-1 / tpt-2来adg1-1 / gpt2-1[21].在光照期结束或长时间黑暗期结束时,通过碘染色对杂交后代进行无淀粉或淀粉过量表型的筛选,并进行T-DNA插入。所用引物参见附加文件7.
蛋白质分离和免疫印迹分析
在光照4小时后,直接在Percival生长室中,在LL-和hl -条件下进行蛋白质分离和随后的免疫印迹分析。叶片总蛋白提取方法如[87].蛋白质提取物中10 μg经12.5% sds -聚丙烯酰胺凝胶电泳(PAGE)分离,并在聚偏氟乙烯(PVDF)膜(Bio-Rad)上电印迹。这些膜在含有阻断溶液的酪蛋白中孵育一夜,并用Agrisera (Vännäs,瑞典)提供的对抗光合作用相关蛋白的一抗进行检测。二抗,即辣根过氧化物酶缀合物(Sigma, St. Louis,密苏里州),在SuperSignal West底物(Thermo Fisher Scientific)存在的情况下,通过化学发光将蛋白质暴露在薄膜(CL-XPosure, Thermo Scientific)。为了检测磷酸化蛋白,一种特殊的磷酸苏氨酸抗体(Cell signaling, Beverly, Massachusetts)被用作一抗。由于酪蛋白是高度磷酸化的,所以阻塞液中酪蛋白被BSA取代。
类囊体膜和蓝源page的分离
类囊体膜的原生分离根据[88]提取介质中加入10mm NaF。膜蛋白用2% n-十二基-β- d -麦芽糖溶解在增溶缓冲液中(50 mM Bis-Tris [pH 7.0], 750 mM 6-氨基戊酸;5 mM EDTA [pH 7.0];50mm NaCl)。样品在市售的连续3-12%的天然双三丙烯酰胺凝胶(Invitrogen)上分离,如[89]并用考马斯胶G染色[90].为了鉴定蛋白质超复合物,在一维上通过BN-PAGE分离的蛋白质在二维上通过SDS-PAGE进一步分离,根据[41].
蛋白质的质谱分析
为了进一步分离和鉴定bn -凝胶上的蛋白质超复合物,切除单个蛋白质带,进行胰蛋白酶消化,通过纳米液相色谱分离肽段(Proxeon, Odense, Dänemark),通过电喷雾电离(ESI)电离,并用串联质谱检测和碎片化(HCT Ultra ETD II, Bruker Daltonik,不莱梅)。得到的质量谱和片段谱与NCBInr数据库(答:芥),并由吉祥物(Matrixscience;[91]的显著性水平为(P< 0.05),质量公差±0.3 Da。
RNA提取和qRT-PCR
RNA按照[92].经脱氧核糖核酸酶(DNA-free DNase, Ambion)处理后,用Bioscript逆转录酶(Bioline)合成oligo(dt)引物的总RNA cDNA。GPT2通过SYBR Green PCR Master Mix (Applied Biosystems)结合7300序列检测系统(Applied Biosystems)进行定量RT-PCR分析转录本丰度。相对转录本数量用AAC进行量化t方法(93].作为对照,泛素C (UBC, At5g25760)根据[94].基因特异性引物参见附加文件7.
代谢物的决心
从冷冻叶片材料中分离淀粉和可溶性糖,根据[16]并用耦合酶法测定[95]在Spectrafluor Plus平板阅读器(TECAN,瑞士)的吸光模式下。在测定高周转率的代谢物(如核苷酸)时,应注意立即在液体N中淬灭叶片样品中的代谢2在用LL或HL照明时。用高氯酸从约100毫克的叶子材料中提取核苷酸。用氯乙醛衍生化后,用高效液相色谱法(Dionex Ultimate LC 3000)分离并定量其余的乙烯腺苷核苷酸,描述如下[96].
色素和蛋白质含量的测定
植物材料在液氮中研磨,与光合作用有关的色素在100%丙酮中提取。Chl含量和Chl含量a / b比率在80%丙酮中进行测定,计算方法如[97].在480 nm波长下测定总类胡萝卜素,用公式Car = E计算其含量480+ 0.144·E663- 0.638·E645.为了测量总蛋白含量,植物材料在50 mM Hepes-NaOH (pH 7.0)中提取,存在0.1% Triton-X-100。蛋白质含量的测定方法见[98].
TPT运输活动的确定
对提取的膜蛋白进行重组后测定TPT转运活性答:芥将叶片制成人造脂质体,按[99]使用放射性标记32P我作为计数器交换基板。
在活的有机体内确定PSII和PSI性能
用Chl-测定PSII的性能一个用脉冲振幅调制荧光计成像- pam或PAM-2100 (Walz, Effeltrich,德国)进行荧光测量。由“饱和脉冲法”确定的单个荧光参数根据[One hundred.].在抑制剂研究中,切除的叶片在含有6.5 μM tentoxin、100 μM尼日尔霉素[101]或3毫米数码地面电视[102= 0.01% (v/v)乙醇。作为对照,叶片在0.01% (v/v)乙醇溶液中孵育。
PSI的性能由波长为830 nm - 870 nm的光诱导吸收变化决定[103双pam (Walz, Effeltrich, Germany)。通过FR光和饱和光脉冲(SP)的应用,PSI可以完全氧化,生成P米值,它类似于F米PSII。在光化光(AL)照明时,PSI的还原状态取决于PFD以及受体或供体位点的限制。在光照下仍可氧化的PSI (P米’)可通过在AL照明时使用SPs来确定。PSI的性能来源于三个量子效率ΦNA(受体位点限制),ΦND(供体位点限制)和ΦPSI(电子输运)。这三个参数的和等于1。电子传递的量子效率定义为ΦPSI = 1 - ΦND - ΦNA。
类囊体膜的分离,光合复合物和Chl-的定量一个77 K荧光发射分析
类囊体膜根据[104].Cyt b的含量559,通常可用于量化PSII和Cyt b6/f配合物由Cyt b的不同吸收信号测定559, f和b6.类囊体相当于50 μg Chl·ml-1在低盐介质中堆垛,以改善样品的光学性质[105].所有细胞色素都被加入1mm的铁氰化钾(+III)氧化,随后加入10mm的抗坏血酸钠和二亚硫酸钠还原,导致Cyt f的还原和Cyt b的高电位形式559(抗坏血酸-铁氰化物差谱)和Cyt b6以及低电位形式的Cyt b559,分别。在每个氧化还原电位下,用配备正面光电倍增管的V-550分光光度计(Jasco GmbH, Groß-Umstadt, Germany)在575 - 540 nm波长之间测量吸收光谱。光谱带宽为1 nm,扫描速度为100 nm·min-1.使用参考光谱和不同消光系数对差分吸收光谱进行反卷积,如[105].PSII含量由Cyt b的高、低电位差吸收信号之和计算559[106].通过对磷的光致吸收变化,测定氧化还原活性PSI的含量700, PSI反应中心Chl-一个二聚体。分离出相当于50 μg Chl·ml的类囊体-1以0.2% (w/v) n-十二基-β- d -麦芽糖苷为溶剂,100 μM百草枯为电子受体,10 mM抗坏血酸钠为电子给体。P700在饱和光脉冲(2000 μmol光子·m-2·年代-1红灯,持续时间200毫秒)。在PC-P中使用Dual-PAM仪器(Walz, Effeltrich, Germany)进行测量700版本(107].
的背影,一个在77 K条件下,测定了分离出的相当于10 μg Chl·ml的类囊体的荧光发射光谱-1使用F-6500荧光计(Jasco GmbH, Groß-Umstadt,德国)。样品在430nm波长(10nm带宽)激发。在带宽为1 nm,扫描速度为200 nm的条件下,记录了655 ~ 800 nm的发射光谱。10个光谱被平均,以增加信噪比,并校正光电倍增管的仪器响应。
透射电子显微镜
将发育完全的叶片快速固定在2%戊二醛50mm磷酸盐缓冲液(pH 7.2)中。用丙酮取代水,然后用Spurr-media取代丙酮[108].在此过程中,样品进行后固定,并与2%四氧化锇和1%醋酸铀酰进行对比。聚合的Spurr嵌入样品在超微生物分析仪上用玻璃刀切割mt - 600(RMC, Tuson, USA),并安装在涂层铜栅格上。用柠檬酸铅和醋酸铀酰对超薄切片染色后,在EM10电子显微镜下观察(Carl Zeis,耶拿,德国)。
实验数据的统计评价
数据以所示独立测量次数的平均值±标准误差(SE)表示。使用韦尔奇检验分析了两个数据集之间的显著差异,该检验允许假设适用高斯分布的两组测量之间存在不相等的相对误差[109].使用Excel中实现的方差分析分析两个以上数据集之间的显著差异。作为显著差异通过方差分析的数据集被提交到事后Tukey-Kramer检验,该检验允许比较不相等的样本量,并发现哪些平均值彼此显著不同[110Tukey-Kramer测试使用xlstat在Excel中实现。数据绘图使用SigmaPlot8.0 For Windows (SPSS Inc.)。
参考文献
- 1.
Fliege R, Flügge UI, Werdan K, Heldt HW:菠菜叶绿体包膜中无机磷酸盐、3-磷酸甘油酸和三磷酸的特异性转运。生物化学学报,1998,27(2):332 - 332。10.1016 / 0005 - 2728(78) 90045 - 2。
- 2.
Weise SE, Weber AP, Sharkey TD:麦芽糖是夜间叶绿体输出碳的主要形式。植物学报,2004,29(4):344 - 344。10.1007 / s00425 - 003 - 1128 - y。
- 3.
蔡文杰,李志刚,李志刚:植物淀粉的代谢、进化与生物技术改造。植物学报,2010,29(4):344 - 344。10.1146 / annurev - arplant - 042809 - 112301。
- 4.
Weber A, Servaites JC, Geiger DR, Kofler H, Hille D, Gröner F, Hebbeker U, Flügge UI:一种塑料葡萄糖易位器的鉴定、纯化和分子克隆。植物科学学报,2000,29(4):457 - 457。
- 5.
Niittylä T, Messerli G, Trevisan M,陈j, Smith AM, Zeeman SC:一种未知的麦芽糖转运蛋白,对叶片淀粉降解至关重要。科学通报,2004,30(3):344 - 344。10.1126 / science.1091811。
- 6.
Stettler M, Eicke S, Mettler T, Messerli G, Hörtensteiner S, Zeeman SC:阻断拟南芥叶片淀粉分解产物代谢引发叶绿体降解。植物学报,2009,29(2):344 - 344。10.1093 / mp / ssp093。
- 7.
赵MH,林h,申德华,全JS, Bhoo SH, Park YI, Hahn TR:叶绿体淀粉降解产物输出的可塑性葡萄糖易位器的作用拟南芥.环境科学学报,2011,29(3):344 - 344。10.1111 / j.1469-8137.2010.03580.x。
- 8.
Lu Y, Sharkey TD:淀粉酶在光合细胞细胞液中麦芽糖代谢中的作用。植物学报,2004,29(3):366 - 366。10.1007 / s00425 - 003 - 1127 - z。
- 9.
Lu Y, Sharkey TD:麦芽糖在短暂性淀粉分解中的重要性。植物细胞环境学报,2006,29:353-366。10.1111 / j.1365-3040.2005.01480.x。
- 10.
Fettke J, Nunes-Nesi A, Alpers J, Szkop M, Fernie AR, Steup M:淀粉相关杂聚糖的结构特征和生化性质的改变。中国生物医学工程学报,2008,29(4):344 - 344。10.1104 / pp.108.127969。
- 11.
费特克J, Eckermann N, Kötting O, Ritte G, Steup M:新型淀粉相关酶和碳水化合物。细胞摩尔生物学(嘈杂-大)。2007, 52(增刊):883-904。
- 12.
Walters RG, Shepard F, Rogers JJM, Rolfe SA, Horton P:植物突变体的鉴定拟南芥光合作用不适应光环境的。植物科学学报,2003,31(4):472-481。10.1104 / pp.015479。
- 13.
Schneider A, Häusler RE, Kolukisaoglu U, Kunze R, van der Graaff E, Schwacke R, Catoni E, Desimone M, Flügge UI: An拟南芥叶绿体磷酸三糖/磷酸易位基因的敲除突变体只在淀粉合成时受到严重损害,而不是淀粉动员被取消。植物学报,2002,32:685-699。10.1046 / j.1365 - 313 x.2002.01460.x。
- 14.
王晓明,王晓明,王晓明,等。拟南芥中磷酸三糖易位基因缺失的突变体揭示了光照下淀粉分解的代谢调控。植物科学学报,2004,26(3):344 - 344。10.1104 / pp.104.040469。
- 15.
Häusler RE, Schlieben NH, Schulz B, Flügge UI:转基因烟草淀粉转化和葡萄糖转运对磷酸三酯/磷酸转位子活性的补偿。植物学报,1998,20(4):366- 366。10.1007 / s004250050268。
- 16.
林丽萍,李志强,李志强,李志强,等:一株无淀粉突变体的分离与鉴定拟南芥(l)Heynh缺乏adp葡萄糖焦磷酸化酶活性。中国农业科学,2004,26(4):457 - 457。10.1104 / pp.86.4.1131。
- 17.
李志刚,李志刚,李志刚,李志刚,李志刚。拟南芥淀粉降解基因的克隆与鉴定。中国农业科学,2004,27(3):457 - 457。10.1104 / pp.95.4.1181。
- 18.
Ritte G, Lloyd JR, Eckermann N, Rottmann A, Kossmann J, Steup M:淀粉相关R1蛋白是一种α -葡聚糖,水二激酶。美国国家科学研究院。2002, 29(4): 366 - 366。10.1073 / pnas.062053099。
- 19.
Hattenbach A, Müller-Röber B, Nast G, Heineke D:反义抑制adp -葡萄糖焦磷酸化酶和磷酸三糖易位修饰马铃薯叶片碳水化合物分配。中国农业科学,2004,27(4):457 - 457。
- 20.
Häusler RE, Geimer S, Kunz HH, Schmitz J, Dörmann P, Bell K, Hetfeld S, Guballa, Flügge UI:在淀粉生物合成和叶绿体每日碳输出存在缺陷的情况下,拟南芥双突变体如何存活。植物科学学报,2009,29(3):344 - 344。10.1104 / pp.108.128124。
- 21.
Kunz HH, Häusler RE, Fettke J, Herbst K, Niewiedomski P, Gierth M, Bell M, Steup M, Flügge UI, Schneider A:糖- 6-磷酸/磷酸易位子在植物营养组织中的作用拟南芥淀粉生物合成受损的突变体。植物学报,2010,12(增刊1):115-128。
- 22.
Kofler H, Häusler RE, Schulz B, Groner F, Flügge UI, Weber A:拟南芥质体磷酸葡萄糖转换酶新突变等位基因的分子特征及其与野生型cDNA的互补。中国生物医学工程学报,2000,29(3):344 - 344。10.1007 / PL00008698。
- 23.
于涛,吕伟林,王明明,陈娟:拟南芥质体磷酸葡萄糖异构酶突变对叶片淀粉合成和花起始的影响。植物科学进展,2003,23(3):319-326。10.1104 / pp.123.1.319。
- 24.
Yu TS, Kofler H, Häusler RE, Hille D, Flügge UI, Zeeman SC, Smith AM, Kossmann J, Lloyd J, Ritte G:拟南芥sex1突变体在R1蛋白(植物淀粉降解的一般调节因子)中存在缺陷,而在叶绿体己糖转运体中没有缺陷。植物细胞学报,2001,13:1907-1918。
- 25.
Sommer F, Drepper F, Hippler M: PsaB的管状螺旋l在叶绿体色素或细胞色素c6的识别和快速电子转移到光系统I中是必不可少的衣藻reinhardtii.中国生物医学工程学报,2002,27(3):344 - 344。10.1074 / jbc.M110633200。
- 26.
Vainonen JP, Sakuragi Y, Stael S, Tikkanen M, Allahverdiyeva Y, Paakkarinen V, Aro E, Suorsa M, Scheller HV, Vener AV, Aro EM: ca的光调控,一种新型类囊体膜磷蛋白拟南芥.中华民国学报,2008,27(1):1 - 7。10.1111 / j.1742-4658.2008.06335.x。
- 27.
彭玲,杨福高,藤原M, Takami T, Shikanai T:拟南芥NAD(P)H脱氢酶的高效运作需要光系统I通过小LHCI形成超复合体。植物学报,2009,21:3623-3640。10.1105 / tpc.109.068791。
- 28.
Athanasiou K, Dyson BC, Webster RE, Johnson GN:光合作用的动态驯化提高植物在变化环境中的适应性。中国生物医学工程学报,2010,27(3):366- 366。10.1104 / pp.109.149351。
- 29.
Niewiadomski P, Knappe S, Geimer S, Fischer K, Schulz B, Unte US, Rosso MG, Ache P, Flügge UI, Schneider A:拟南芥可塑性葡萄糖6-磷酸转运子GPT1对花粉成熟和胚囊发育至关重要。中国生物医学工程学报,2005,17:760-775。10.1105 / tpc.104.029124。
- 30.
Kammerer B, Fischer K, Hilpert B, Schubert S, Gutensohn M, Weber A, Flügge UI:来自异养组织的质体中碳转运体的分子特征:葡萄糖6-磷酸/磷酸反转运体。植物学报,1998,30(4):344 - 344。
- 31.
Eicks M, Maurino V, Knappe S, Flügge UI, Fischer K:磷酸戊糖转运子是植物细胞质和磷酸戊糖转运途径之间的一种链接。中国生物医学工程学报,2002,29(4):344 - 344。10.1104 / pp.010576。
- 32.
Winter D, Vinegar B, Nahal H, Ammar R, Wilson GV, Provart NJ:用于探索和分析大规模生物数据集的“电子荧光象形文字”浏览器。PLoS ONE。2007, 2: e718-10.1371/journal.pone.0000718。
- 33.
Meurer J, meerhoff K, Westhoff P:高叶绿素荧光突变体的分离拟南芥并通过光谱学,免疫印迹和北方杂交对其进行了表征。植物学报,1996,32(3):366 - 366。10.1007 / BF00620055。
- 34.
Meurer J, Plücken H, Kowallik KV, Westhoff P:原核起源的核编码蛋白对光系统II的稳定性至关重要拟南芥.中国生物工程学报,1998,30(4):366 - 366。10.1093 / emboj / 17.18.5286。
- 35.
彭玲,马娟,迟伟,郭娟,朱松,卢强,陆超,张磊:低PSII累加1参与了光系统II的高效组装拟南芥.植物学报,2006,18:955-969。10.1105 / tpc.105.037689。
- 36.
马娟,彭磊,郭娟,卢强,陆超,张磊:LPA2是光系统II高效组装的必要条件拟南芥.中国生物医学工程学报,2007,29(3):349 - 349。10.1105 / tpc.107.050526。
- 37.
Armbruster U, Zühlke J, Rengstl B, Kreller R, Makarenko E, Rühle T, Schünemann D, Jahns P, Weisshaar B, Nickelsen J, Leister D:拟南芥类囊体蛋白PAM68是D1高效生物发生和光系统II组装所必需的。中国生物医学工程学报,2010,26(3):344 - 344。10.1105 / tpc.110.077453。
- 38.
Yamane Y, Kashino Y, Koike H, Satoh K:荧光增强Fo高等植物高温处理对光系统II反应中心的水平和可逆抑制作用。光子学报,1997,33(4):457 - 457。10.1023 /: 1005884717655。
- 39.
Barros T, Royant A, Standfuss J, Dreuw A, Kühlbrandt W:植物光收集复合物的晶体结构表现出活跃的能量传输状态。环境科学学报,2009,28:298-306。10.1038 / emboj.2008.276。
- 40.
Rochaix JD:光合复合物的组装。中国生物医学工程学报,2011,27(3):344 - 344。10.1104 / pp.110.169839。
- 41.
阿罗EM, Suorsa M, Rokka A, Allahverdiyeva Y, Paakkarinen V, Saleem A, Battchikova N, Rintamäki E:光系统动力学II:类囊体蛋白复合物的蛋白质组学方法。应用物理学报,2005,26(3):347-356。
- 42.
Tyystjärvi E:光系统II的光抑制和含氧锰簇源的光损伤。化学工程学报,2008,27(2):361-376。10.1016 / j.ccr.2007.08.021。
- 43.
李文杰,李志刚,李志刚,李志刚,李志刚:光系统组装与修复研究进展。学报学报,2010,36(3):344 - 344。10.1093 / aob / mcq059。
- 44.
可见光诱导光合作用的光抑制。植物物理学报,1984,35:14-44。
- 45.
光系统的光抑制I:植物低温敏感性的生理意义。植物生理学报,1996,27(3):344 - 344。
- 46.
Ortega JM, Roncel M, Losada M:光系统II反应中心光抑制过程中细胞色素b559的光诱导降解。中国农业科学,1999,30(4):344 - 344。10.1016 / s0014 - 5793 (99) 01128 - x。
- 47.
Müller B, Eichacker LA: D1前体在单体PSII反应中心前体复合物中的组装先于Chl a引发的大麦叶绿体中反应中心II的积累。植物科学学报,1999,29(3):349 - 349。
- 48.
Kanervo E, Singh M, Suorsa M, Paakkarinen V, Aro E, Battchikova N, Aro EM:豌豆叶绿体向叶绿体转变过程中蛋白复合物和单克隆蛋白的表达(Pisum一).植物生理学报,2008,49:396-410。10.1093 /卡式肺囊虫肺炎/ pcn016。
- 49.
王晓明,郭晓明,王晓明,王晓明,王晓明。细胞色素b559作为质体喹诺醇氧化酶的研究进展。中国生物医学工程学报,2010,38(3):344 - 344。10.1111 / j.1399-3054.2009.01312.x。
- 50.
Bondarava N, De Pascalis L, Al-Babili S, Goussias C, Golecki JR, Beyer P, Bock R, kriger - liszkay A:细胞色素b的证据559在黑暗中调节还原质体醌的氧化。中国生物医学工程学报,2003,27(3):344 - 344。10.1074 / jbc.M212842200。
- 51.
杜灿,冯文华,李志强,李志强2饥饿对烟草光合电子传递链的影响。光电工程学报,2004,29(2):344 - 344。10.1023 /: 1012917428003。
- 52.
Belkhodja R, Morales F, Quilez R, Lopez-Millan AF, Abadia A, Abadia J:缺铁导致叶绿素荧光变化,原因是光系统II受体侧黑暗减少。光子学报,1998,26(3):344 - 344。10.1023 /: 1006039917599。
- 53.
吕默欧,李志刚,李志刚,李志刚。光合作用与植物胁迫响应过程中的氯蒸散发和循环电子流动。植物细胞环境学报,2007,30:1041-1051。10.1111 / j.1365-3040.2007.01675.x。
- 54.
霍顿P,沃尔特斯R,鲁班AV:绿色植物的光收获调控。植物化学学报,2004,27(4):357 - 357。10.1146 / annurev.arplant.47.1.655。
- 55.
Holt NE, Fleming GR, Niyogi KK:对绿色植物非光化学猝灭机制的理解。生物化学,2004,43:8281-8289。10.1021 / bi0494020。
- 56.
Walters RG, Ruban AV, Horton P:高等植物捕光配合物LHCIIa和LHCIIc在能量耗散抑制过程中被双环己基碳二亚胺结合。生物化学学报,2004,26(3):344 - 344。10.1111 / j.1432-1033.1994.01063.x。
- 57.
李鹏飞,李建平,李建平,李建平,李建平,李建平,李建平,李建平,李建平,李建平,李建平,李建平,李建平,李建平,李建平,李建平,李建平:PsbS蛋白对类囊体腔内pH值的感知与光合光捕获的调控有关。中国生物医学工程学报,2004,29(4):457 - 457。10.1074 / jbc.M402461200。
- 58.
杨建平,张志刚,张志刚:紫黄素循环的机制与调控:天线蛋白和膜脂的作用。生物化学学报,2009,1787:3-14。10.1016 / j.bbabio.2008.09.013。
- 59.
Bergantino E, Segalla, Brunetta A, Teardo E, Rigoni F, Giacometti GM, Szabò I:光系统PsbS亚基中光和ph依赖的结构变化II。美国国家科学研究院。2003, 30(4): 457 - 457。10.1073 / pnas.2533072100。
- 60.
安志强,陈志强,陈志强,陈志强,陈志强,陈志强。植物天线蛋白中电荷转移态调控光吸收的研究进展。科学通报,2008,32(3):344 - 344。10.1126 / science.1154800。
- 61.
Betterle N, Ballottari M, Zorzan S, de Bianchi S, Cazzaniga S, Dall'Osto L, Morosinotto T, Bassi R:天线异质低聚物的光诱导解离是非光化学猝灭诱导。中国生物医学工程学报,2009,26(4):457 - 457。10.1074 / jbc.M808625200。
- 62.
Gilmore AM, Hazlett TL, Govindjee:光系统II叶绿素a荧光的叶黄素周期依赖性猝灭:具有短荧光寿命的猝灭复合体的形成。光系统II叶绿素a荧光的黄叶素周期依赖性猝灭:形成具有短荧光寿命的猝灭复合体。美国国家科学研究院。1995, 32(3): 377 - 377。10.1073 / pnas.92.6.2273。
- 63.
光系统II中叶黄素周期依赖的非光化学猝灭:从拟南芥L.缺乏紫黄质深氧化酶活性和/或叶黄素的突变体。光子学报,2001,29(3):344 - 344。10.1023 /: 1010657000548。
- 64.
王志强,王志强,王志强,等:叶绿素荧光非光化学猝灭的动力学分析。2.孤立的光收集复合体。生物化学,2001,40:9902-9908。10.1021 / bi0103718。
- 65.
杨晓明,王晓明,王晓明,等。叶绿素a/b结合蛋白氧化还原依赖性磷酸化对光合驯化的影响。中国农业科学,2008,27(3):344 - 344。10.1111 / j.1742-4658.2008.06262.x。
- 66.
Bonardi V, Pesaresi P, Becker T, Schleiff E, Wagner R, Pfannschmidt T, Jahns P, Leister D:光系统II核心磷酸化和光合驯化需要两种不同的蛋白激酶。自然科学学报,2005,37(4):339 - 339。10.1038 / nature04016。
- 67.
Bellafiore S, Barneche F, Peltier G, Rochaix JD:状态转换和光适应需要叶绿体类囊体蛋白激酶STN 7。自然科学学报,2005,29(3):344 - 344。10.1038 / nature03286。
- 68.
李丽娟,李丽娟,李丽娟,等。质体蛋白磷酸酶TAP38在LHCII去磷酸化和类囊体电子流动中的作用。公共科学图书馆,2010,8:e1000288-10.1371/journal.pbio.1000288。
- 69.
Shapiguzov A, Ingelsson B, Samol I, Andres C, Kessler F, Rochaix JD, Vener AV, Goldschmidt-Clermont M: PPH1磷酸酶特异性参与拟南芥LHCII去磷酸化和状态转变。美国国家科学研究院。2010, 37(4): 457 - 457。10.1073 / pnas.0913810107。
- 70.
Lemeille S, Rochaix JD:类囊体信号通路十字路口的状态转换。光子学报,2010,30(3):344 - 344。10.1007 / s11120 - 010 - 9538 - 8。
- 71.
Pesaresi P, Pribil M, Wunder T, Leister D:开花植物类囊体可逆蛋白磷酸化的动态:STN7, STN8和TAP38的作用。生物化学学报,2010,27(3):357 - 357。
- 72.
Tikkanen M, Nurmi M, Kangasjärvi S, Aro EM:核心蛋白磷酸化促进光损伤光系统II在强光下的修复。中国生物工程学报,2008,27(3):344 - 344。10.1016 / j.bbabio.2008.08.004。
- 73.
Goral TK, Johnson MP, Brain AP, Kirchhoff H, Ruban AV, Mullineaux CW:可视化高等植物类囊体膜中叶绿素蛋白的流动性和分布:光抑制和蛋白质磷酸化的影响。植物学报,2010,29(3):344 - 344。
- 74.
Fristedt R, Willig A, Granath P, Crèvecoeur M, Rochaix JD, Vener AV:光合系统II的磷酸化调控拟南芥光合膜的功能性宏观折叠。植物科学学报,2009,29(3):349 - 349。10.1105 / tpc.109.069435。
- 75.
傅士德,格拉纳特,维纳AV:植物光合膜功能堆叠的蛋白质磷酸化阈值。公共科学学报,2010,5:e10963-10.1371/journal.pone.0010963。
- 76.
李海涛,李志刚,李志刚,李志刚,李志刚。叶绿素蛋白水平和叶绿素结构对高光和弱光条件的适应性。中华自然科学学报,2004,27(3):344 - 344。
- 77.
Lichtenthaler HK, Burgstahler R, Buschmann C, Meier D, Prenzel U, Schonthal A:强光和强光胁迫对光合装置组成、功能和结构的影响。胁迫对光合作用的影响。编著:Marcelle R, H. Clijsters H, Van Poucke M. 1983,海牙,Martinus Nijhoff/Dr。W. Junk出版社,353-370。
- 78.
李志强,李志强。类囊体结构与功能的分子识别。植物科学进展,2001,6:317-326。10.1016 / s1360 - 1385(01) 02010 - 6。
- 79.
Wagner R, Dietzel L, Bräutigam K, Fischer W, Pfannschmidt T:对波动光质量的长期响应是支持植物生存的重要而独特的光适应机制拟南芥在弱光条件下。植物学报,2008,28(3):344 - 344。10.1007 / s00425 - 008 - 0760 - y。
- 80.
李志刚,李志刚,李志刚:植物的糖感和46信号机制研究进展。植物学报,2006,29(3):344 - 344。10.1146 / annurev.arplant.57.032905.105441。
- 81.
Bräutigam K, Dietzel L, Kleine T, Ströher E, Wormuth D, Dietz KJ, Radke D, Wirtz M, Hell Rd, Dörmann P, Nunes-Nesi A, Schauer N, Fernie AR, Oliver SN, Geigenberger P, Leister D, Pfannschmidt T:动态质体氧化还原信号整合基因表达和代谢,诱导拟南芥光合驯化中的不同代谢状态。植物学报,2009,21:2715-2732。10.1105 / tpc.108.062018。
- 82.
Pfannschmidt T:质体逆行信号——一个真正的“质体因子”还是仅仅是代谢物信号?植物科学进展,2010,15:427-435。10.1016 / j.tplants.2010.05.009。
- 83.
Barkan A, Goldschmidt-Clermont M:核基因参与叶绿体基因表达。生物化学学报,2000,42(3):559-572。10.1016 / s0300 - 9084(00) 00602 - 7。
- 84.
Eberhard S, Finazzi G, Wollman FA:光合作用动力学。科学通报,2008,42:463-515。10.1146 / annurev.genet.42.110807.091452。
- 85.
Bellafiore S, Ferris P, Naver H, Gohre V, Rochaix JD: Albino3的丢失导致光收集系统的特异性损耗。植物学报,2002,30(4):344 - 344。10.1105 / tpc.003442。
- 86.
Sundberg E, Slagter JG, Fridborg I, Cleary SP, Robinson C, Coupland G: ALBINO3是拟南芥叶绿体分化所必需的核基因,编码一种叶绿体蛋白,该蛋白与存在于细菌膜和酵母线粒体中的蛋白质具有同源性。植物科学学报,1997,19(4):457 - 457。
- 87.
英国Laemmli:在T4噬菌体头部组装过程中结构蛋白的切割。自然学报,1997,27(3):366 - 366。10.1038 / 227680 a0。
- 88.
Bassi R, dal Belin Peruffo A, Barbato R, Ghisi R:玉米束鞘和叶肉细胞类囊体叶绿素蛋白复合物和多肽组成的差异。中国生物医学工程学报,1998,26(4):589-595。10.1111 / j.1432-1033.1985.tb08692.x。
- 89.
Schägger H, von Jagow G:蓝色原生电泳分离酶活性形式的膜蛋白复合物。中国生物医学杂志,1997,19(3):344 - 344。10.1016 / 0003 - 2697 (91) 90094 - a。
- 90.
姜东,徐敏,姜春:考马斯亮蓝在十二烷基硫酸钠-聚丙烯酰胺凝胶电泳中检测蛋白质的研究。化学学报,2002,23:1511-1512。
- 91.
Perkins DN, Pappin DJ, Creasy DM, Cottrell JS:基于质谱数据搜索序列数据库的概率蛋白质鉴定。电泳,1999,20:3551-3567。10.1002 / (SICI) 1522 - 2683 (19991201) 18 < 3551:: AID-ELPS3551 > 3.0.CO; 2。
- 92.
王志强,王志强,王志强,等:植物组织中RNA分离方法的改进。中国生物化学杂志,1997,27(3):344 - 344。10.1016 / 0003 - 2697(87) 90086 - 8。
- 93.
Ramakers C, Ruijter JM, Deprez RHL, Moorman AFM:实时定量聚合酶链反应(PCR)数据无假设分析。神经科学的信件。2003, 32(3): 344 - 344。10.1016 / s0304 - 3940(02) 01423 - 4。
- 94.
Czechowski T, Stitt M, Altmann T, Udvardi MK, Scheible WR:拟南芥转录规范化优势内参基因的全基因组鉴定和检测。植物学报,2005,39(1):1 - 5。10.1104 / pp.105.063743。
- 95.
斯蒂特M,利利RMC, Gerhardt R, Heldt H:植物叶片特定细胞和亚细胞区室代谢产物水平的测定。方法生物化学学报,1998,18(4):518-552。
- 96.
Haink G, Deussen A:液相色谱法分析腺苷化合物。中国生物医学工程学报,2003,27(3):349 - 349。10.1016 / s1570 - 0232(02) 00752 - 3。
- 97.
Arnon DI:分离的叶绿体中的铜酶。多酚氧化酶在甜菜属.植物物理学报,1999,24:1-15。10.1104 / pp.24.1.1。
- 98.
Schaffner W, Weissmann C:一种快速、灵敏、特异性的测定稀溶液中蛋白质的方法。生物化学学报,2003,26(4):357 - 357。10.1016 / 0003 - 2697(73) 90217 - 0。
- 99.
Flügge U, Weber A:一种快速测量植物组织匀浆中细胞器特异性底物运输的方法。植物学报,1994,29(3):344 - 344。10.1007 / BF01101676。
- One hundred.
Schreiber U, Schliwa U, Bilger W:用一种新型调制荧光计连续记录叶绿素荧光猝灭的光化学和非光化学。光子学报,1986,10:51-62。10.1007 / BF00024185。
- 101.
Quick P, Scheibe R, Stitt M:利用tentoxin和nigicin研究ΔpH对菠菜叶片能量耗散和电子传递控制的可能贡献。生物化学学报,1988,39(4):344 - 344。
- 102.
Gamon JA, Field CB, Bilger W, Bjiirkman O, Fredeen AL, Pefiuelas J:向日葵叶片和冠层叶黄素循环和叶绿素荧光的遥感研究。生态学报,1999,15(3):344 - 344。10.1007 / BF00317336。
- 103.
Klughammer C, Schreiber U:一种改进的方法,使用饱和光脉冲,通过P700测定光系统I的量子产额+-吸光度在830 nm处发生变化。植物学报,1994,29(3):344 - 344。10.1007 / BF01089043。
- 104.
Schöttler MA, Kirchhoff H, Weis E:叶绿体色素苷调节烟草光合电子传递对碳代谢的作用。植物科学学报,2004,26(4):366 - 366。10.1104 / pp.104.052324。
- 105.
王志强,王志强,王志强:类囊体膜的分子结构:质体醌的脂质扩散空间。生物化学,2002,41:4872-4882。10.1021 / bi011650y。
- 106.
Lamkemeyer P, Laxa M, Collin V, Li W, Finkemeier I, Schöttler MA, Holtkamp V, Tognetti VB, Issakidis-Bourguet E, Kandlbinder A, Weis E, Miginiac-Maslow M, Dietz KJ:过氧化物还蛋白Q的拟南芥附着在类囊体上,在光合作用中起作用。植物学报,2006,30(4):344 - 344。10.1111 / j.1365 - 313 x.2006.02665.x。
- 107.
Schöttler MA, Flügel C, Thiele W, Bock R:敲除叶绿体编码的PetL亚基导致细胞色素b稳定性降低和叶龄依赖性损失加速6f复杂。中国生物医学工程学报,2007,28(3):357 - 357。
- 108.
Spurr AR:用于电子显微镜的低粘度环氧树脂包埋介质。中国生物医学工程学报,2004,26(3):344 - 344。10.1016 / s0022 - 5320(69) 90033 - 1。
- 109.
Welch BL:当涉及到几个不同的总体方差时,“学生”问题的泛化。生物计量学,2004,34:28-35。
- 110.
Ludbrook J:更新了多个比较程序。中华药物学杂志,1998,25:332 - 332。10.1111 / j.1440-1681.1998.tb02179.x。
确认
我们要感谢Deutsche Forschungsgemeinschaft在研究单元804“植物逆行信号”的框架下资助这个项目。此外,我们还要感谢波恩大学Brigitte Buchen博士在TEM方面提供的额外帮助。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
JS对这项工作的主要部分做出了贡献,如PS测量(PAM 2100, DUAL-PAM,成像PAM),免疫印迹,Blue-Native凝胶电泳,碳水化合物测定,TEM样品的制备以及突变体和双突变体植物的分子表征。MAS在77 K下对分离的类囊体进行了Chl荧光测量,并对类囊体电子传递组分进行了光谱测定。用SK法测定腺苷酸。SG参与了TEM分析。AS最初分离了tpt-2突变并建立了纯合子系。TK进行方差分析,DL协助类囊体蛋白的免疫印迹分析。KB对多种突变植物进行杂交,建立了双突变系和三突变系。UIF和REH构思了该项目,并参与了研究的设计和协调。所有作者都阅读并批准了最终的手稿。
电子辅助材料
在LL-和HL-生长的野生型和双突变型植物中“颗粒堆叠数类”的分布。
附加文件1:在TEM图像上确定了33 ~ 105个单个颗粒的堆叠数量,每行有2 ~ 3个叶绿体,并将每个颗粒分为2 ~ 17个堆叠.每一类的数量表示为所计数的总粒数的百分比。从(A) 105, (B) 77, (C) 75和(D) 33个LL-和hl -生长Col-0的单个颗粒(A, B)或(D)中计算出颗粒堆栈号的分布adg1-1 / tpt-2(c, d). (pdf 1mb)
>1000 kDa超复合物的蛋白质组成。
附加文件2:通过Blue-Native PAGE从野生型植物中分离出类囊体蛋白。切出相应的蛋白带,LC/MS2进一步分析。离子分数表示-10·Log(P),其中P是观测到的匹配是随机事件的概率。离子分数>38表示同源性或广泛同源性(P< 0.05)。以星号标记的蛋白质表示假定的NDH超复合体的新亚基(比较[27])。(pdf 9kb)
用HL-和ll -生长的野生型和突变型植物确定了PSI的受体和供体位点限制的轻依赖性。
附加文件3:受体(蓝圈,ΦNA)或供体位点(红圈,ΦND) HL-和ll -生长Col-0野生型(A, E)的量子效率限制,adg1-1(B, F)和tpt-2(C, G)单突变体以及adg1-1 / tpt-2(D, H)光饱和曲线双突变株。该数据代表12个独立测量值的平均值±SE。(pdf 2mb)
O的影响
附加文件4:2Chl-上的剥夺一个荧光。的背影,一个hl生长的Col-0和adg1-1 / tpt-2双突变株用空气冲洗,即在21% O的存在下冲洗2(A, B),或N2,即没有O2(C, D)在一个封闭的有机玻璃室内。在箭头指示的地方,FR照明被打开(+FR)或关闭(-FR)。SP表示脉冲持续时间为0.8秒的饱和光的应用。(PDF 548kb)
蔗糖喂养的野生型和野生型类囊体蛋白的免疫印迹
附加文件5:adg1-1 / tpt-2与未喂食的对照组相比。从hl生长的Col-0和Col-0中分离10 μg总蛋白后,对光合作用相关蛋白进行免疫印迹adg1-1 / tpt-2SDS-PAGE双突变体。植物在不存在(MS)或存在50 mM Suc的情况下生长。P*-苏氨酸表示用磷酸苏氨酸抗体孵育印迹后获得的信号。这些数字表示来自PsbC (1), CaS (2), PsbA/PsbD(3)和LhcbII(4)的信号。(PDF 1mb)
表型与Chl-
附加文件6:一个野生型和突变型植物的荧光图像。资料描述:表型外观和调制Chl-一个荧光假彩色图像的Fv/ F米在HL或LL中培养4周的相同品系的比例。(一)pgi1-1, pgm1, pgi1-/tpt-2, tpt-2/pgm1, (B)mex1-2 mex1-2 / tpt-2, (C)Sex1-3和Sex1-3 /tpt-2.颜色刻度表示F的数值v/ F米比率。(pdf 3mb)
12870 _2011_1006_moesm7_esm.pdf
附加文件7:寡核苷酸引物。用于通过PCR或RT-PCR或qRT-PCR (RL)鉴定T-DNA突变体的引物。(pdf 7kb)
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
Schmitz, J., Schöttler, m.a., Krueger, S.;et al。叶片碳水化合物代谢缺陷损害了对强光的适应,并导致高叶绿素荧光表型拟南芥.BMC植物生物学12,8(2012)。https://doi.org/10.1186/1471-2229-12-8
收到了:
接受:
发表:
关键字
- 双突变体
- 淀粉生物合成
- PSII光抑制
- Tentoxin
- 双突变植物