摘要
背景
的拟南芥基因抹刀(SPT),编码bHLH转录因子,最初被鉴定为在雌蕊发育中的作用。SPT是所有心皮边缘组织包括花柱、柱头、中隔和传导道的生长发育所必需的。从那时起,它被证明在发育过程中具有多向作用,包括限制叶原基的分生区域和子叶的扩张。虽然SPT在根中表达,其在该器官中的作用尚未被研究。
结果
胚胎和根发育分析表明,缺失SPT功能导致胚胎和胚胎后干细胞壁龛中静止中心大小的增加。此外,由于分裂的增加,根分生组织的大小更大,这导致较长的主根。spt突变体还表现出其他多效发育表型,包括花多、节间短和花期延长。基因和分子分析表明SPT与赤霉素酸平行调节细胞增殖,并影响生长素的积累或运输。
结论
我们的数据表明SPT在拟南芥整个孢子体生长过程中都有控制生长的功能,但除了心皮发育期间外,对细胞命运的决定没有必要。SPT在根系发育过程中独立于赤霉素的作用,但可能在调节生长素的运输或积累中发挥作用。我们的数据表明SPT在控制根的生长中起作用,类似于它在地上组织中的作用。
背景
的主根拟南芥具有简单而一致的细胞类型组织[1].根沿近-远轴分为三个不同的组织区。最远端的区域是细胞分裂区或分生区。细胞延伸区恰好发生在分裂区附近,细胞分化区或成熟区是最靠近分裂区的地方[2].在根尖分生组织(RAM)中,干细胞围绕着一组四个有丝分裂活性较低的细胞,称为静态中心(QC;[1])。QC与其周围的四种类型的干细胞(小柱干细胞、表皮/侧根冠干细胞、皮层/内胚层干细胞和血管干细胞)一起形成干细胞生态位[3.].RAM是在胚胎发生过程中建立的。在拟南芥中,受精卵不对称分裂,形成顶端和基底子细胞。顶端子细胞的三轮定型细胞分裂产生胚胎的顶端和中心区域,而基底细胞的横向分裂产生约6-9个细胞,构成胚外胚柄。胚柄最上面的细胞成为垂体细胞,垂体细胞横向分裂成上下垂体细胞。上垂体细胞形成QC,下垂体细胞形成小柱干细胞和中央根冠。RAM的其余部分来自根尖细胞的衍生物[3.- - - - - -5].
一个复杂的转录因子网络调节根干细胞生态位的规范。AP2/ERF转录因子编码基因PLETHORA1 (PLT1)而且PLT2在基础胚胎早期对生长素的反应中转录,并且是QC鉴定和干细胞维持所必需的[6].异位胚胎表达PLT1而且PLT2可诱导RAM的形成,包括QC和初始细胞[6].的PLT基因以梯度表达,在干细胞小生境中表达量最大,促进干细胞的鉴定和维持。低水平促进干细胞子细胞的有丝分裂活性,低水平促进细胞分化[7].两个GRAS家族转录因子,shorroot (SHR)和稻草人(SCR),在根中调节径向模式和干细胞生态位规范[8,9].月对于皮层/内胚层首字母的周鞘分裂和内胚层的规范都是必要的[10- - - - - -13].可控硅皮质/内胚层初始子细胞的外周不对称分裂和QC识别的细胞自主需要[9,14,15].
的刮刀(SPT)该基因编码一种基本的螺旋-环-螺旋(bHLH)转录因子,最初被认为在心皮器官发生中起作用[16].SPT心皮边缘的发育和增殖以及心皮边缘衍生组织的发育所必需的[16,17].SPT与bhlh编码基因密切相关是部分冗余的恶魔岛(ALC)在果实发育过程中,除了雌蕊发育过程中的边缘组织外,还指定阀缘组织的形成。这些蛋白质可以异二聚SPT补体开裂缺陷会在吗酒精度如果表达得当,则为突变体,尽管反之则不成立[18].除了与ALC相互作用外,SPT还与另一bHLH蛋白INDEHISCENT (IND)在心皮边缘和果瓣规范上发生基因和物理相互作用,这些转录因子可与共同靶基因协同结合[19].SPT和IND蛋白调控发育中的心皮顶端区域生长素的积累,对心皮边缘的规范起重要作用。这至少部分是由于它们直接调控编码AGC3蛋白激酶家族成员的两个基因的表达(PID而且WAG2),磷酸化并控制PIN生长素外排载体的活性[19].
虽然SPT在花的发育中得到了最广泛的研究,它已被证明参与了种子萌发以及叶子和子叶的发育[20.- - - - - -23].SPT也已被证明调节植物生长抑制以应对凉爽的白天温度[22),spt突变体由于细胞数量的增加和叶片原基分生区域的扩大而具有较大的叶片[21]和更大的子叶,这是由于细胞扩张的增加[23].与其广泛的功能相一致,SPT在营养组织和生殖组织的增殖区域均有表达,包括根[16,24].
在这里,我们调查的作用SPT在根的生长中。spt由于细胞增殖的增加,突变体有较长的初生根。对这些突变体的RAM检查显示,QC大小增加,正如细胞分裂标记所测量的初始细胞中的细胞分裂一样pCYCB1; 1::格斯.增加的QC大小出现在胚和额外的分裂继续在根的发展。损失的影响SPT对根生长的作用独立于GA,但与GA有一些共同的目标。spt突变体在根尖处生长素最大值较大。分析突变体对外源生长素和生长素转运抑制剂的反应表明,生长素转运可能发生改变。控制生长素的转运可能是一种常见的机制SPT调节植物的生长。我们的结果揭示了……的重要性SPT在RAM大小控制的调节中。
结果
SPT是植物发育的多个方面所必需的吗
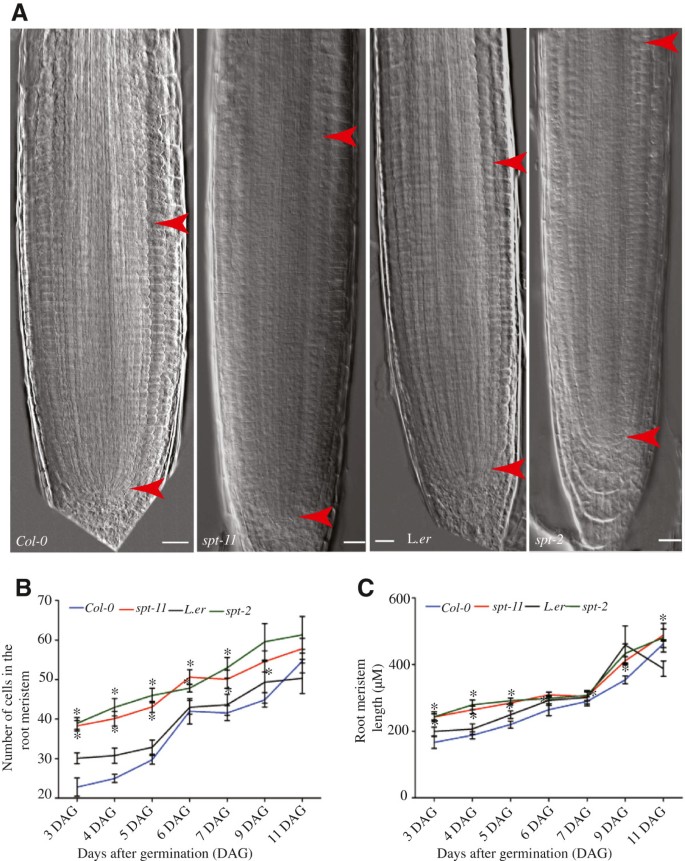
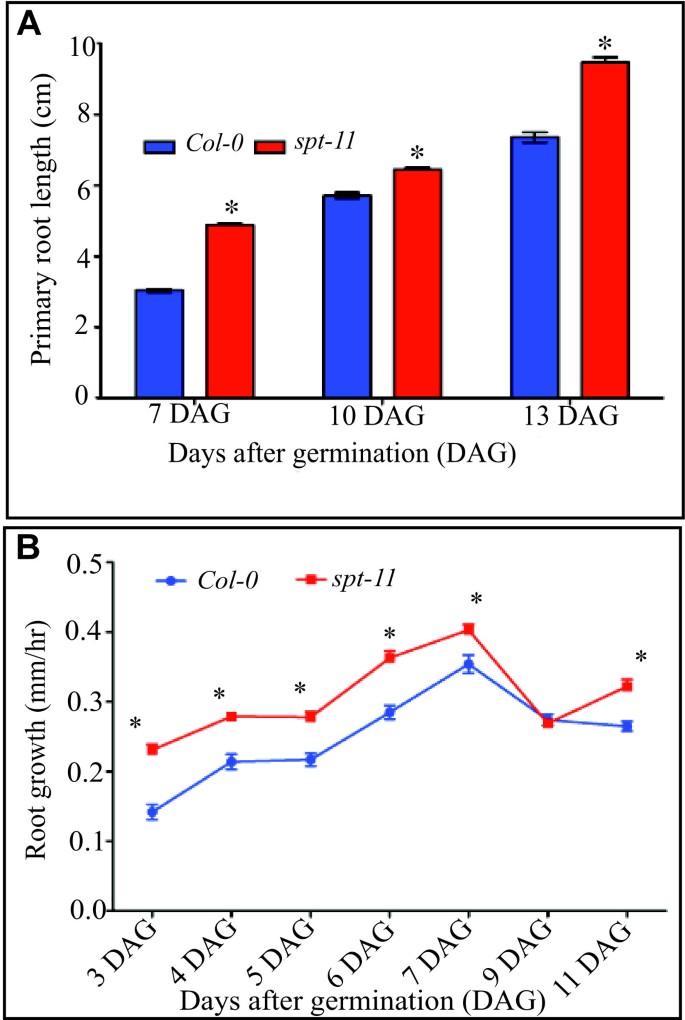
尽管分析SPT它的功能仅限于芽,SPT也在根目录中表示(附加文件1;[24])。为了分析的可能功能SPT的根分生组织spt-2而且spt-11将突变体与它们各自的野生型(Landsbergerecta(左.呃)和Columbia-0 (Col-0).在我们观察期间,两者都是spt-2而且spt-11具有较长的根分生组织(定义为根皮层中QC和第一个伸长细胞之间的区域;[25]),无论是从细胞数量还是从长度(图1).G2-M标记的表达也得到了类似的结果CYCB1; 1::格斯[26被观察到.spt-11与野生型相比,根分生组织有更大区域的细胞表达这一标记(附加文件2),并且有更多的细胞表达该标记(Col-0平均每根41.3个细胞,而Col-0平均每根35.2个细胞(n = 15株幼苗)。的主根长度spt-11植物比野生型长(图2).类似的趋势出现在spt-2(数据未列示);然而,由于根在垂直琼脂板上倾向于倾斜和卷曲生长。呃背景(27,这使得根的测量更加困难,这一背景没有得到广泛的分析。无论是野生型还是野生型,初生根生长速率在7 DAG时升高,在9 DAG时下降spt-11突变体,虽然生长速度快spt-11根显著高于Col-0(图2 b).
我们还检查了其他生长参数spt突变体来决定这个基因的功能是如何多效的。这两个spt-2而且spt-11植物比野生型高,花更多。然而,这些植物的节间较短(表1).spt-11植株开花时间早于Col-0,以开花的天数和叶子的数量来衡量1).相比之下,spt-2植株开花时间明显晚于L.呃,建议加入特定修饰语的SPT函数可能存在。另外,开花时间的差异可能是由于植物的性质SPT等位基因。spt-11是由插入Ds引起的敲除等位基因[21),而spt-2其结果是由于碱基结构域内的精氨酸转变为赖氨酸的错义突变,这种改变已被证明可以取消其他bHLH蛋白中的DNA结合[16].等位基因性质的差异可能是导致开花时间差异的原因,除了品系背景之外。
SPT控制胚胎和胚胎后干细胞壁龛静止中心的大小
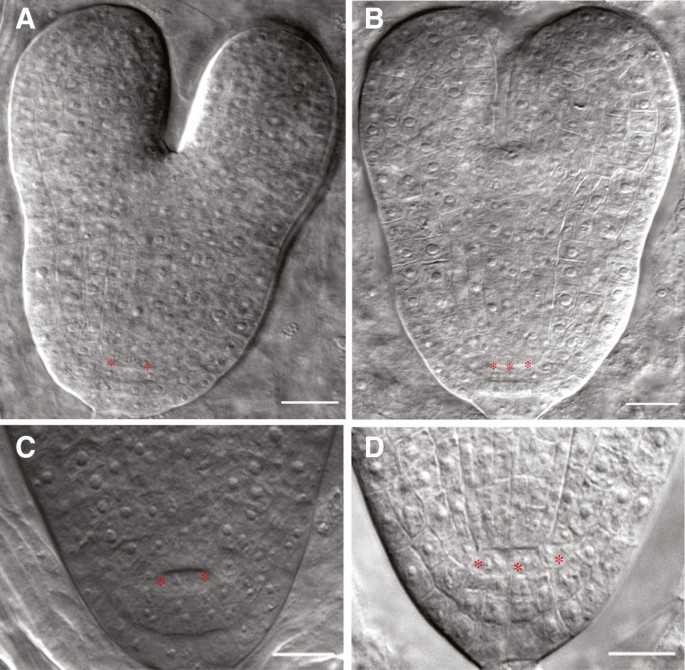
我们研究了干细胞的组织和数量spt胚胎期和胚胎后阶段的突变体。我们对胚胎的观察表明,野生型和野生型之间QC祖细胞的数量没有差异(数据未显示)spt-11中QC单元数为spt-11在心脏晚期开始的胚胎发育后期,与Col-0不同(图3 b在野生型中,90%的胚胎(n = 30)在鱼雷期和成熟胚期都有4个QC细胞,其余10%有6个QC细胞。在spt-11胚胎中,鱼雷期(n = 35)和成熟期(n = 35)分别只有57%和51.5%的胚胎有4个细胞,43%和38.5%的胚胎有6个细胞。的趋势spt-2相似(56%观察到的根在QC中有6个或更多的细胞(n = 35));然而,L。呃也倾向于QC中有4个以上的细胞(40%的观察到的根有6个或6个以上的细胞(n = 35))。
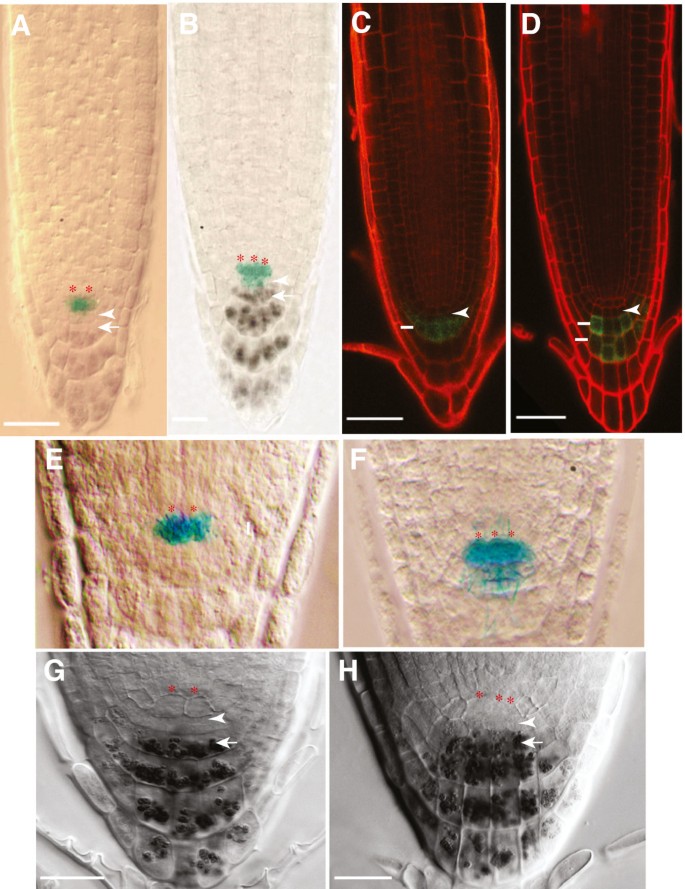
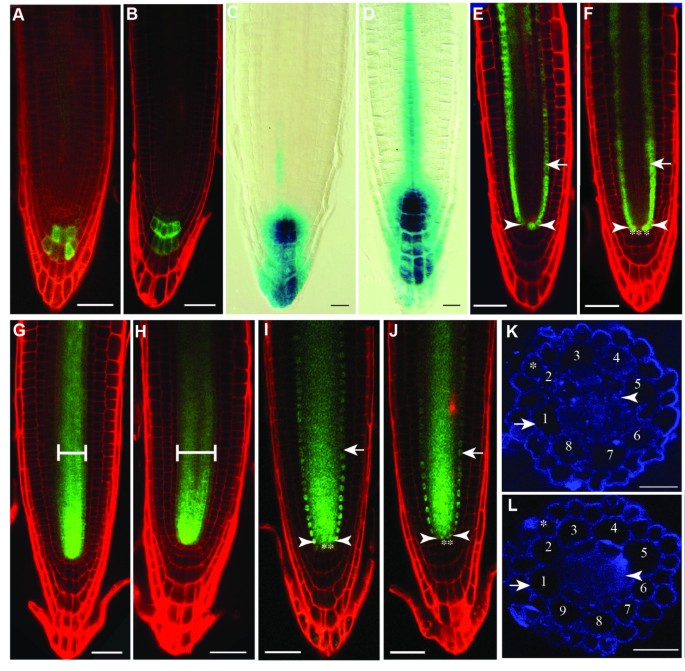
胚胎后,通过根尖双染色研究GUS表达的干细胞组织,由qc特异性启动子陷阱驱动,QC25[28],并对根冠细胞进行淀粉染色。spt-11与野生型一样,具有单柱状干细胞层,根冠分化正常(图4 bF).然而,spt-11与野生型相比,QC的根尖中有更多的细胞(图4 b, F).在野生型中,81%的观察到的幼苗(n = 32)有4个标记为QC25而其他19%的QC中有6个细胞。在spt-11仅30%的观察苗(n = 51)有4个细胞显示QC25在QC中,38%有6个细胞,30%有8个细胞,2%有10个细胞。QC中细胞数量的增加反映在更广泛的QC(跨越两个以上细胞)以及具有不止一层细胞的QC中。低水平的GUS染色由QC25(与QC特异性GUS染色相比较)在小柱干细胞层也观察到spt-11根尖4 f).符合QC25结果:小柱特异性增强子诱捕Q1630:绿色荧光蛋白还揭示了单柱状干细胞层的存在spt-11(图4 d).淀粉染色也用于检查RAM组织spt-2和L。呃(图4 gH).与spt-11结果,spt-2根有单层小柱干细胞,但有额外的QC细胞(图4 h).这表明SPT在胚胎和胚胎后阶段,这种功能有助于控制QC中的细胞数量,但对远端分生组织没有作用。
QC尺寸,但没有改变图案spt-11。5根DAG根显微照片。(一个,C,E) Col-0。(B,D,F)spt-11.(一个,B)表达QC25:格斯(蓝色)在QC和淀粉在分化小柱。红色星号表示QC细胞,箭头表示根冠首字母,箭头表示第一排小柱细胞。(C,D)小柱标记的表达QC1630:绿色荧光蛋白在丙啶碘染色的根中。箭头表示根冠初始细胞,线条表示染色的小柱细胞层。(E,F) A和B中所示的根的特写,以突出的表达QC25::格斯。红色星号表示QC单元格。(G,H) 5个DAG根淀粉染色显微照片。(G) L。呃.(H)spt-2.红色星号出现在QC中的单元格上方。箭头表示根冠淀粉染色。箭头表示小柱和表皮/侧根冠细胞。比例尺为100 μm。
的损失SPT功能导致在根尖处生长素的最大值更大,但不破坏根的形态
生长素积聚在远端根原基,是QC和干细胞规范所必需的[29].之前已经证明spt-2极性生长素转运抑制剂n -1-萘酞酸(NPA)的应用部分挽救了雌蕊表型,这表明其作用可能是SPT控制生长素的转运[30.],大概是通过对表达的控制WAG2而且PID[19].检测生长素的分布或运输是否发生改变spt突变体中,我们观察了生长素外排载体的表达PIN4[31和生长素反应记者DR5::格斯,用于可视化生长素反应最大值[32].的PIN4p: PIN4-GFP而且DR5:格斯转基因被引入spt-11背景通过交叉。PIN4-GFP以非极性的方式在QC区域和周围细胞中积累(图5).这种表达模式与Friml等人所记录的相似。31];然而,据报道,野生型PIN4-GFP的积累模式存在显著差异[33- - - - - -35].然而,在我们的手中,这种表达在词根[的这个区域最为明显。36].spt-11两者的表达范围更广吗PIN4(图5 b),DR5:格斯(图5 d),表明生长素最大值更大或生长素敏感性增加,这可能导致这些植物的QC和RAM更大。
的损失SPT功能改变生长素的积累,但不破坏根的形态。(A、B5根DAG根共聚焦显微照片,碘化丙啶染色表达PIN4p: PIN4-GFP.(一个) Col-0。(B)spt-11.(C, D) 5个DAG根表达的显微图DR5:格斯.(C) Col-0。(D)spt-11.(E-J碘化丙啶染色5根DAG根共聚焦显微照片。(E, F)pSCRp:绿色荧光蛋白表达式。箭头表示内胚层细胞,星号表示QC细胞,箭头表示血管首字母。(E) Col-0。(F)spt-11.(G H)pSHR:绿色荧光蛋白表达式。括号内的区域是石碑。(G) Col-0。(H)spt-11.(i j)pSHR: SHR-GFP表达式。箭头表示内胚层细胞,星号表示QC细胞,箭头表示血管首字母。(我) Col-0。(J)spt-11.(K, L)荧光增白剂染色7根DAG主根徒手横截面。星号表示表皮细胞层。箭头表示皮层细胞层。箭头表示内胚层细胞。皮层细胞在直径周围编号。(K) Col-0。(l)spt-11.A-B和D-J中的比例尺为100 μm。B-C和K-L中的比例尺为50 μm。
以确定是否损失SPT功能影响生长素的敏感性和/或转运,我们测试了其敏感性spt-11幼苗根系生长对合成生长素1-萘乙酸(NAA)和生长素转运抑制剂NPA的影响。抑制spt-11NAA处理的根系生长与Col-0处理的根系生长无显著差异(表2)2),表明对外源生长素的敏感性在这一遗传背景下没有改变。相比之下,spt-11与野生型相比,NPA显著地抑制了根的生长,尽管在较高水平的NPA施用下,差异可以忽略不计(表2)3.).较强的DR5:格斯Maxima在spt-11背景,结合增加的灵敏度spt-11施用NPA后根系的生长支持了SPT可能直接或间接调节生长素极性转运的假设。
根干细胞生态位规范和径向模式部分受到两个转录因子SHR和SCR的调控[8- - - - - -10,37].自spt-11QC中有更多的细胞(图3.,4),我们看的表情可控硅而且月看看它们是否被打乱了。pSCR:绿色荧光蛋白表达于内胚层、内胚层/皮层首字母和QC(图5 e;[38]),而pSHR:绿色荧光蛋白在恒星细胞中表达(图5克;[10])和pSHR: SHR-GFP在星状组织、内胚层细胞层、内胚层/皮层首字母和QC中表达(图5我;[11])。这些基因的表达域均未见差异spt-11与野生型幼苗相比(图5 f, H, J),表示SPT不调节干细胞的小生境定位或径向模式。
SPT已在血管组织中检测到表达[39].为了检查是否SPT有无在血管发育中起作用的元素,我们观察了两种血管标志物的表达。增强子陷阱J0121:绿色荧光蛋白在木质部相关的中柱鞘细胞中特异性表达(附加文件3.一个;[40)和马克笔CoYMV::绿色荧光蛋白在韧皮部伴生细胞中特异性表达(附加文件3.C;[41])。这些标记的表达spt-11类似于野类型表达式模式(附加文件3.B, D,暗示损失spt不会破坏血管系统的分化。我们还观察了根的径向组织是否受到影响spt-11.Col-0根皮层细胞层有8个细胞(图5 k;N = 15株;>20节/苗)如先前报告[1),而spt-11根皮层细胞层有9个细胞(图5 l;N = 15株;>20节/株),可能反映了根分生组织细胞分裂的增加。然而,根的整体组织不受影响。
SPT与GA在根中的作用平行
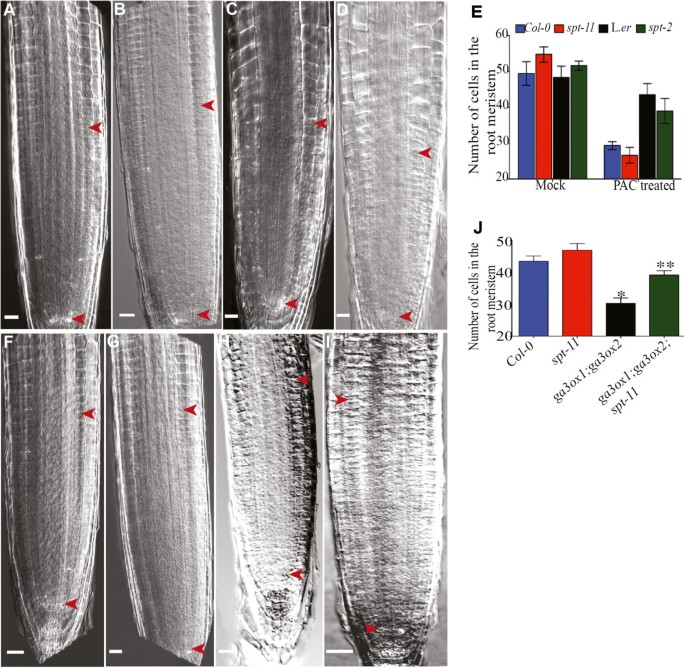
已知GA在调节RAM大小方面发挥作用[42,43),SPT与GA生物合成的调控和GA信号传导有关[20.,23]并显示与GA通路平行作用[23].然而,根中GA和SPT之间的关系尚不清楚。以确定是否spt突变体对降低水平的GA有反应,我们将幼苗暴露在GA生物合成抑制剂多洛布唑(PAC)中,并检查了对分生组织大小的影响。正如预期的那样,暴露于PAC后,野生型的分生组织大小减小(图6 b, E). PAC也降低了小鼠的分生组织大小spt突变体(图6 d有趣的是,L.对PAC的反应。呃根不是很粗壮spt-2对该抑制剂的反应大于L。呃(图6 e).先前已经证明L。呃在子叶中GA反应饱和,尽管它在这些器官中对PAC表现出强劲的反应[23].l呃可能增加了根中的GA水平,以缓冲其对GA生物合成抑制剂的反应。
SPT与根中的GA起加性作用。(模拟) 8个DAG根显微照片。箭头表示细胞增殖区。(A、B)模拟处理。(C, D) PAC处理。(A、C) Col-0。(B, D)spt-11.(E)模拟苗和PAC处理苗的RAM细胞数。误差条表示标准误差。这些值是三个独立实验的平均值(n = 15/重复)。(外:我)代表性的7棵DAG幼苗显微照片。箭头表示细胞增殖区。(F) Col-0。(G)spt-11.(H)ga3ox1-2;ga3ox2-1.(我)ga3ox1-2;ga3ox2-1;spt-11.(J内存单元号(n = 15)。星号和双星号表示与野生型和有显著不同的值ga3ox1-2;ga3ox2-1,分别。比例尺为100 μm。
进一步考察两者之间的关系SPT-介导细胞增殖和GA,我们交叉了spt-11而且spt-2在适当的遗传背景下,突变体变为GA生物合成突变体,ga3ox1-2;ga3ox2-1[44),ga1-3[45),分别。对7日龄的Col-0幼苗进行根分生组织大小检测;spt-11, ga3ox1-2;ga3ox2-1还有三突变体ga3ox1-2;ga3ox2-1;spt-11.双突变体ga3ox1-2;ga3ox2-1具有较短的RAM,如前所述(图6小时J;[42]),而spt-11在所有分析的基因型中RAM最长(图6克, J).三重突变体ga3ox1-2;ga3ox2-1;spt-11RAM明显大于双突变体ga3ox1-2;ga3ox2-1,但RAM比spt-11(图6我, J),加性表型。这个三突变体和ga1-3;spt-2分析了双突变体的其他发育差异。ga3ox1-2;ga3ox2-1;spt-11植物和ga1-3;spt-2与它们的亲本相比,植物是中等高度(附加文件)4而且5).三突变体开花时间明显早于ga3ox1-2;ga3ox2-1植物,具有显著较高的花和节间数量,显著较长的节间和显著较高(附加文件5),表明的损失SPT功能可以部分补偿植物中较低的GA水平。但是,三突变株都不等同于spt-11也不是野生型植物。这种加性表型表明SPT和GA的作用途径是平行的。的果实表型spt-11仍然保留在ga3ox1-2;ga3ox2-1;spt-11植物(数据未显示),表明GA在心尖发育中没有功能或SPT在这种情况下,是GA的下游。
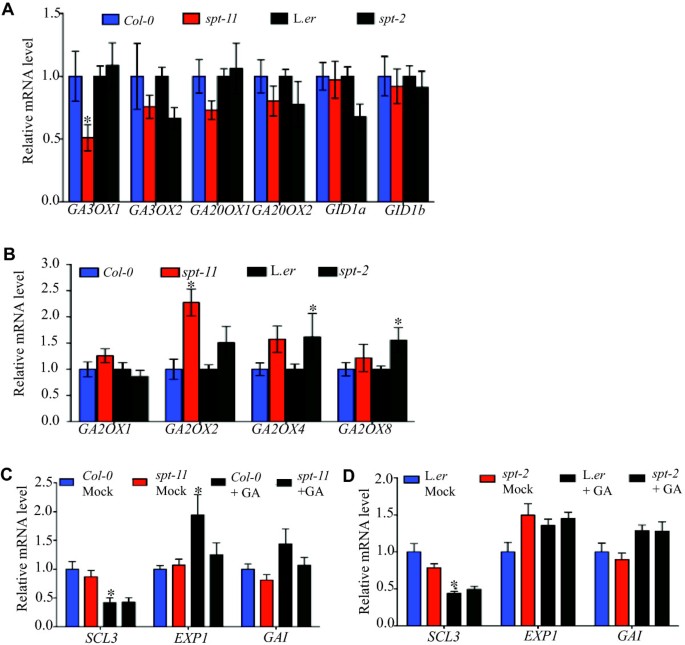
内源性赤霉素水平由赤霉素生物合成和分解代谢/失活共同调节。ga20 -氧化酶和ga3 -氧化酶均由多基因家族编码,并催化GA生物合成途径的最后步骤[46].这些基因在缺乏ga的背景下表达水平较高,在施用生物活性气体后表达水平下降[47- - - - - -51].内源性GA水平受代谢失活调控,而ga2氧化酶是催化这种反应的最佳表征酶[51,52].相对于GA生物合成基因的表达,GA2-OXIDASE应用GA后水平上升[52- - - - - -54].编码可溶性GA受体的基因,GID1a而且GID1b,经GA处理后,其表达下降[52,55],是拟南芥中GA水平的另一个标记。我们检测了这些基因的一个子集在7天大的幼苗中的表达sptqPCR分析突变体及其野生型。在分析的GA生物合成基因中,只有一个(GA3ox1)与野生型相比有显著变化,仅在spt-11,在那里它被减少了(图7一个).在检测的GA失活途径基因中,转录水平为GA2ox2显著高于spt-11而且GA2ox4而且GAox8的转录水平较高spt-2(图7 b).突变体中GA受体的表达没有明显变化(图7一个).因此,在基因表达中没有一致的变化,这将表明GA水平或信号在前列腺癌中发生改变spt背景。
由于上述表达结果不确定,我们检测了下游几个ga反应基因的表达:稻草人3 (scl3),在GA反应中下调,以及EXPANSIN1 (EXP1)而且赤霉素不敏感(丐帮了),两者均通过GA [56].与之前的报道一致,外源GA在L中并没有显著增加GA诱导的基因表达。呃背景(图7 d;[23])。在未施用GA的情况下,基因表达无显著性差异SCL3,EXP1或时至今日之间的spt-11或spt-2野生型(图7 cD).应用遗传算法后,显著增加EXP1在野生型中未见表达spt-11(图7 c),也许暗示了这一点SPT有助于调节该基因。然而,与GA生物合成和分解代谢基因的情况相似,没有看到GA响应基因表达的一致模式。
讨论
之前的研究表明SPT拟南芥气生部分不同器官的功能,包括子叶[23],叶子[21], gynoecium [16,17,57],水果[18,19]和种子的发芽[20.].在这项研究中,我们已经证明了SPT也在根中起作用,它的作用是限制RAM大小和根长度。功能丧失spt突变体有更大的细胞分裂区(图1),它比野生型包含更多的分裂细胞(附加文件2);这导致了较高的生长速度在根和较长的主根。在成体植物中,花序茎明显长于野生型,并产生更多的花(表1).之前有研究表明spt-11由于细胞数量的增加,植物的叶面积更大[21]和子叶的大小,这是由于细胞扩张的增加[23].综合来看,这些数据表明SPT在拟南芥的许多器官中抑制细胞增殖和扩张。
两者的QC尺寸都增加了spt-2而且spt-11根,通过形态学和分子标记进行分析。在野生型背景下,QC平均由四个有丝分裂活性低于周围初始细胞的细胞组成[1].然而,spt突变体QC中的细胞数量增加,通常是三到四个细胞,而不是两个,有时有两层QC细胞(图3.,4).在胚胎中,QC尺寸的增加是明显的,从大约鱼雷阶段开始(图3.).spt-11胚胎的QC中可以有多达6个细胞,并且在根的发育过程中,大小会继续增加,因为观察到根中有多达10个QC细胞。增加QC的大小和根分区的根的大小spt突变体中叶片分生区大小的增加与突变体相似spt突变体(21],表明其中的分子途径SPT这两个器官的功能可能相似。
SPT表达与生长素含量高的区域相关[16,24],暗示了两者之间的关系SPT和生长素。的SPT启动子中还含有多个生长素反应元件(AREs),提示生长素反应因子(ARFs)可能直接调控其表达。然而,先前的研究表明,突变这些元素并不会改变a的表达SPT记者(24].中所见的RAM大小的增加spt突变体与生长素外排载体的表达范围更广相关PIN4和一个更强的生长素最大值,如图所示DR5:格斯表达式(图5).这可能是由于生长素运输的变化,如在发育中的心皮所见spt突变体(19,30.],结果显示对NPA的敏感度增加spt-11根(表3.).spt应用生长素转运抑制剂NPA可挽救心皮缺损[30.,57],表明SPT活性可能会影响生长素的转运,这与它对调节PIN外排载体的蛋白激酶的调节是一致的[19].然而,在根中,spt-11突变体对NPA的应用高度敏感(表3.),而在心皮中,它的应用改善了由于丧失而引起的发育缺陷SPT.一个可能的解释是心皮和根尖生长素运输的差异。心皮的发育依赖于沿雌蕊顶端-基部轴的生长素梯度,生长素最高水平出现在顶端。然而,根的发育和生长取决于根尖-基部的生长素梯度,其浓度在QC区域最高(通过原韧皮部细胞的极性运输产生),以及生长素在根冠横向流动的重定向,随后它又流向梢部(通过侧根冠和表皮细胞)[58].任何这些生长素运输途径的中断都会影响根的生长和发育[34,59].因此,与在心皮中的作用相比,NPA在根尖上的应用可能会导致生长素流动和积累的更复杂的变化。SPT不仅可以调节根尖-基底的生长素转运,还可以调节生长素重定向通路。
我们的数据与其他研究芽器官的小组报告的数据相似[23],表明SPT与GA并行调节RAM大小和根长。人们早就知道生长素与赤霉素之间、生长素转运与赤霉素之间存在着串扰。最近的研究表明,缺乏ga的植物积累较少的PIN生长素转运蛋白,尽管PIN4的积累没有被评估,这与生长素转运较少相关[60].因此,有可能是GA含量或信号的变化spt突变体可能导致根尖生长素积累的变化。显然,需要更多的工作来确定GA,生长素和SPT.
如上所述,SPT对种子萌发、子叶扩张、叶片大小和雌蕊发育有重要作用。我们的工作将该基因的功能扩展到根中,在不影响根成熟区整体根组织或分化的情况下调节分生区细胞增殖。这与的作用类似SPT在叶片生长控制中,它似乎通过限制叶片基部分生带的大小而不改变叶片形态或细胞类型而起作用[21].这与损失的影响相反SPT在花中,雌蕊中细胞增殖较少,导致雌蕊较短,柱头、花柱和传导束组织有缺陷[17].然而,由于SPT可能通过调节心皮和根中的生长素运输起作用,这些器官对细胞增殖的不同影响可能是由于生长素反应的差异。
SPT编码bHLH蛋白[16]已被证明是一种转录激活剂[61].bHLH蛋白以二聚体或大阶蛋白复合物的形式起作用。SPT属于bHLH因子的一个亚分支([62]/亚族15的[63])。这个小组有14个成员酒精度基因,部分冗余与SPT[18,64),两者关系最为密切。这些蛋白质可以彼此异二聚[18];然而,酒精度在根中表达不高(genevarcheator;[65,66])。此外,PIF/PIL bHLH蛋白属于这一分支,它与光敏色素相互作用,并包含一个在SPT或ALC中没有发现的phyb结合域[63,67].SPT在基因上有相互作用PIL5在种子萌发期间[20.]和PIL5调节GA反应性[68].SPT也与PIF6在雌蕊发育期间[57],这表明它可能能够与这些基因的产物一起调节基因表达。然而,这些基因的根表达量较低(genev调查者;[65,66])。SPT还与bHLH转录因子的HECATE家族成员异二聚[69].这些基因的缺失会导致心皮缺陷spt突变体,它们以重叠的模式表达SPT在心皮中,但在根中不表达。此外,SPT与心皮和果实中的IND相互作用,在那里它可能与DNA合作结合蛋白质[19];目前尚不清楚该基因是否在根中表达。
到目前为止,还没有发现bHLH蛋白与根中的SPT相互作用,已知的相互作用子也不知道是否在该器官中表达,但至少有三个编码bHLH转录因子的基因在根生长控制中具有活性。寂寞公路(lhw)调节产生根维管柱细胞的干细胞池的大小[40],而UPBEAT1 (UPB1)通过调节过氧化物酶的表达,调节细胞分裂区与延伸区之间活性氧的平衡,调节分化的开始[70].这两个因子的表达式与的部分重叠SPT.此外,MYC2已被证明是必要的茉莉素介导的抑制根生长通过直接抑制表达PLT1而且PLT2[71].检查SPT在根中的结合伙伴,并鉴定该器官中的靶基因,将为深入了解其分子途径提供重要依据SPT行为。
结论
SPT之前已被证明可以调节拟南芥几种地上器官的生长。SPT还调节根中的增殖,控制RAM的大小和QC中的细胞数量。然而,根的组织和根细胞类型的分化没有改变,尽管产生了额外的细胞。SPT调节生长平行于GA和通过修改生长素的积累在QC区域,可能通过调节生长素运输。
方法
植物材料和生长条件
的spt-2等位基因在L.呃背景,并已在前面描述[17].的spt-11等位基因是Col-0背景中的T-DNA插入线,此前已被描述[21]和来自WISCDSLOX集合[72].研究中使用的其他突变体的种子也有描述:ga1-3[45),ga3ox1-3;ga3ox2-1[44].双突变体ga1-3;spt-2是由纯合子交叉产生的吗ga1-3和纯合子spt-2植物,并允许F1进行自我受精。三重突变体ga3ox1-3;ga3ox2-1;spt-11是由纯合子交叉产生的吗ga3ox1-3;ga3ox2-1植物和纯合子spt-11植物,并允许F1进行自我受精。通过PCR分型分离F2群体,鉴定出双突变体和三突变体。生成spt-11含有标记系的突变体,纯合子spt-11植物被交叉到线(附加文件6),并允许F1进行自我受精。F3在含抗生素培养基上生长后,通过PCR分型鉴定突变体,以选择转基因。
拟南芥种子在4℃低温处理3 d后,在Fafard 2混合土(Fafard)上进行长日(16h, 80 μmol m)发芽生长-2年代-1)的辐照度,无论是在受控的生长室(Enconair Ecological chambers Inc., Manitoba, Canada),还是在22°C,相对湿度为60%的下灌生长室。
所有对幼苗进行的测定所使用的种子均按先前所述消毒[73],置于Murashige & Skoog (MS)培养基上(Research Products International Corporation, Mt. Prospect, IL),含有1%植物琼脂的培养皿或半转基因培养皿上(一半浓度MS盐,1%蔗糖,0.8%植物琼脂,pH 5.7)。4°C黑暗中培养5天。然后将培养皿移至CU-36L生长室(Percival Scientific Inc., Perry, IA),垂直放置并在上述长时间条件下生长,除非特别注明。
PCR基因分型
采用基因组DNA PCR分型鉴定突变体。基因组DNA如前所述从花序和叶片中提取[73].引物序列见附加文件7用于各种突变体基因分型的组合在附加文件中列出8.
表型分析
为了分析突变体和野生型的各种发育表型,植物在长日照条件下生长。将不同基因型的种子按随机分组设计播种于方形细胞或花盆中。种子发芽后,除每个细胞或花盆中一株外,其余全部拔除。
如前所述,对几种空中表型进行了分析[73].开花期叶片数被定义为第一朵花开放时的叶片数。为了分析根系表型,植物被种植在垂直方向的板上。对于本研究中对幼苗进行的所有测量,在室内孵化的第一天被视为第0天。从3 DAG到11 DAG,在不同的萌发天数(DAG)收集幼苗进行分析。为了用显微镜观察根,幼苗被固定在乙醇和乙酸(9:1)中过夜。在显微镜载玻片上用水合氯醛(80克水合氯醛,20毫升水和10毫升甘油)清除根,用尼康Eclipse 90i上的微分干涉对比(DIC)光学显微镜分析20分钟。使用附带的尼康相机拍摄照片,并使用NIS elements Advanced Research 3.0版软件进行分析。每个基因型选用15株幼苗进行根分生组织大小测定。根分生组织的大小测量为皮层细胞层中QC和第一个伸长细胞之间的细胞数量,如所述[25],并使用Prism (http://www.graphpad.com/prism/;GraphPad Software, La Jolla, CA)。结果采用双样本学生t检验进行统计分析。分生区长度以微米为单位测量,从QC到根皮层细胞层中的第一个伸长细胞,如所述[25].结果分析和显示如上所示。
为了确定PAC (PhytoTechnology Laboratories, Shawnee Mission, KS)对根系生长的影响,幼苗在发芽4天后从一半转基因板转移到含有10μM PAC的一半转基因板或含有甲醇的一半转基因板。幼苗在培养箱中生长96小时,然后按上述方法分析其根分生组织大小。
每种基因型每重复30株,每重复3次,测定平均初级根长。在7、10和13 DAG时进行测量。从2 DAG开始,每天在砧板背面的初根尖端画一条线,测量初根生长速度。两个标记之间的距离是用尺子测量的。使用两个时间点之间的长度来获得每小时的生长速率(长度单位为mm/24小时)。
为了观察根的细胞组织,5天大的根按照“快速制备植物根横切面”(http://www.mcdb.lsa.umich.edu/labs/schiefel/protocols.html).横切面垂直于根的长度,从根尖开始,向根的底部移动。根切片转移到含有荧光增白剂28 (FB 28 Sigma-Aldrich, St. Louis, MO)溶于水的培养皿中。切片染色10分钟,使用尼康Eclipse 90i显微镜进行紫外荧光显微镜检查。每个基因型检查15个幼苗,每个幼苗至少分析20个切片。
为了在显微镜下观察胚胎,从发育中的果实中收集了含有不同发育阶段胚胎的种子,并按照前面所述的方法进行处理[36].在尼康Eclipse 90i上用DIC光学仪器观察胚胎。使用附带的尼康相机拍摄照片,并使用NIS elements Advanced Research 3.0版软件进行分析。
基因表达研究
检查SPT7 DAG L在根中的表达。呃收集在板上生长的幼苗,并在-80℃下储存。根据说明,使用RNeasy Plant Mini Kit (Qiagen, Valencia, CA)从两个生物重复中提取总RNA。在RNA纯化过程中,采用无rnase - DNase (Qiagen)对RNA进行柱状处理,并在溶液中再次用DNase处理RNA。使用500ng RNA作为模板,cDNA合成和PCR使用SuperScript III一步RT-PCR系统(Invitrogen by Life Technologies)进行SPT而且肌动蛋白-特定引物(附加文件7).实时PCR分析使用Blue Print First Strand cDNA Synthesis Kit (Takara Bio Inc., Otsu, Shiga, Japan),以1 μg总RNA为模板生成cDNA。在CFX96™实时PCR检测系统(BioRad)上提取0.5 μl cDNA,用iQ™SYBR Green Supermix (BioRad)进行实时PCR (qPCR)反应。参考基因,At1g13320,对qPCR数据进行归一化[74].qPCR数据用CFX96软件分析,用Prism软件制图。qPCR引物使用QuantPrime Q-PCR引物设计工具设计(附加文件)7而且9;http://www.quantprime.de;[75])。
GA反应基因的基因表达研究,在7 DAG时采集幼苗,进行上述处理。每个基因型由3个生物学重复表示。在22°C恒光培养箱中,用50 μM的GA或mock处理7日龄的幼苗,在MS液体培养基(1X MS盐、1X Gamborg’s B5维生素、3%蔗糖(pH 5.7)中处理3小时。为了定量GA生物合成和代谢基因,进行了3次生物重复和2次技术重复。参考基因,At1g13320,将GA生物合成代谢基因的qPCR数据归一化,另一个参比基因,At4g33380,对GA反应基因的qPCR数据进行归一化[74].引物设计如上所述。使用GA生物合成、分解代谢和受体基因的非参数Wilcoxon秩和检验以及GA反应基因的2向方差分析对结果进行统计分析[76,77].
ß-葡萄糖醛酸酶和淀粉染色
的表达QC25:格斯如前所述进行检查[36].照片使用尼康数码视DS-5M相机与尼康SMZ800解剖或尼康Eclipse E200复合显微镜进行拍摄。用gus染色的5日龄幼苗观察小柱根冠细胞中淀粉颗粒的积累。淀粉粒染色参照[78]在1%的卢戈尔溶液中冲洗3分钟,用水冲洗,水合氯醛清除,并在尼康Eclipse 90i显微镜上使用诺玛斯基光学照相。
共焦显微镜
用共聚焦激光显微镜观察绿色荧光蛋白(GFP)标记的各种细胞特异性标记物的表达。用碘化丙啶标记胚和根各阶段细胞壁,按[36尼康D-Eclipse C1si共焦相机。
NAA和NPA测定
NAA和NPA测定按[79].简单地说,col0和spt-11在不同浓度NAA(0、1、20、40、60、80和100 nM)或NPA(0、0.1、0.5、1和2 μM)的MS培养基上播种。种子被冷处理两天,然后垂直生长如上所述。8日龄苗根长测量方法如上所述。给出了三个独立实验的平均数据,每个实验每个基因型至少分析了20个幼苗。
缩写
- 内存:
-
根顶端分生组织
- 质量控制:
-
静止中心
- PLT1:
-
Plethora1
- PLT2:
-
Plethora2
- 月:
-
Shortroot
- 可控硅:
-
稻草人
- SPT:
-
抹刀
- 酒精度:
-
阿尔卡特拉斯岛
- 印第安纳州:
-
果皮不裂的
- NPA:
-
Naphthylphthalmic酸
- 乙酰天冬氨酸:
-
1-naphthaleneacetic酸
- 遗传算法:
-
赤霉酸
- PAC:
-
Paclobutrozol
- l . er:
-
兰茨贝格erecta
- Col-0:
-
Columbia-0
- SCL3:
-
衣衫褴褛的3放到
- EXP1:
-
Expansin1
- 盖:
-
赤霉素不敏感。
参考文献
王晓明,王晓明,王晓明,等:拟南芥根系细胞组织的研究。发展。1993,119(1):71-84。
石川浩,李文明:植物根系发育的特化区。植物营养学报,2004,27(3):357 - 357。
Scheres B, Wolkenfelt H, Willemsen V,等:拟南芥初生根和根分生组织首字母的胚胎起源。《发展与发展》,1994,30(4):344 - 344。
Mansfield SG, Briarty LG:拟南芥早期胚胎发生。2胚胎发育中的胚胎中国机械工程学报,2001,29(4):366 - 366。10.1139 / b91 - 063。
劳克斯T,尤尔根斯G:胚胎发生:生命的新开始。植物生理学报,1997,19(3):379 - 379。10.1105 / tpc.9.7.989。
Aida M, Beis D, Heidstra R,等:过量基因介导拟南芥根干细胞生态位的模式化。中国生物医学工程学报,2004,29(3):344 - 344。10.1016 / j.cell.2004.09.018。
王晓明,王晓明,王晓明,等:拟南芥根系发育过程中过量蛋白质的调控作用。自然科学,2007,44(1):1 - 4。10.1038 / nature06206。
Benfey PN, Linstead PJ, Roberts K,等:拟南芥根发育的四个突变体显著改变根形态建成。发展。1993,119(1):57-70。
Di Laurenzio L, Wysocka-Diller J, Malamy JE,等:稻草人基因调节不对称细胞分裂,这对产生径向组织的拟南芥根至关重要。细胞学报,1996,86(3):423-433。10.1016 / s0092 - 8674(00) 80115 - 4。
杨晓明,杨晓明,杨晓明,等:拟南芥短根基因通过径向信号通路控制根系的径向模式。细胞科学,2000,101:555-567。10.1016 / s0092 - 8674 (00) 80865 - x。
中岛浩,孙晓明,王晓明,王晓明,等:植物根形态中转录因子SHR的细胞间运动研究。自然科学,2001,29(1):1 - 7。10.1038 / 35095061。
崔海平,李建平,陈晓明,等:植物SHR运动的一种进化保守机制定义了单层内胚层。科学通报,2007,29(3):344 - 344。10.1126 / science.1139531。
李志强,李志强,等:拟南芥SHORT-ROOT发育途径的全基因组分析。公共科学图书馆,2006,4 (5):e143-10.1371/journal.pbio.0040143。
Sabatini S, Heidstra R, Wildwater M, Scheres B:稻草人参与拟南芥根分生组织中干细胞生态位的定位。基因开发,2003,17(3):354-358。10.1101 / gad.252503。
王晓明,李晓明,王晓明,等:拟南芥稻草人在非对称细胞分裂中的作用。基因开发,2004,18(16):1964-1969。10.1101 / gad.305504。
Heisler MG, Atkinson A, Bylstra YH,等:SPATULA是一种控制拟南芥心皮边缘组织发育的基因,编码bHLH蛋白。发展,2001,128(7):1089-1098。
Alvarez J, Smyth DR:蟹爪和刮刀,两个拟南芥基因控制心皮发育与AGAMOUS平行。中国农业科学,1999,26(3):457 - 457。
Groszmann M, Paicu T, Alvarez JP,等:SPATULA和ALCATRAZ是拟南芥雌蕊和果实发育所需的部分冗余和功能分化bHLH基因。植物学报,2011,29(5):344 - 344。10.1111 / j.1365 - 313 x.2011.04732.x。
张晓明,张晓明,张晓明,等:拟南芥种子萌发过程中瓣缘组织和心皮组织的相互作用及其对种子扩散的影响。植物细胞学报,2011,23(10):3641-3653。10.1105 / tpc.111.090944。
彭菲德,张志刚,张志刚,等:低温和光照对bHLH转录因子SPATULA调控种子萌发的影响。动物学报,2005,15(22):1998-2006。10.1016 / j.cub.2005.11.010。
Ichihashi Y, Horiguchi G, Gleissberg S, Tsukaya H: bHLH转录因子SPATULA控制拟南芥终叶大小。植物生理学报,2010,31(2):339 - 339。10.1093 /卡式肺囊虫肺炎/ pcp184。
Sidaway-Lee K, Josse EM, Brown A,等:SPATULA链接白天温度和植物生长速率。动物学报,2010,20(16):1493-1497。10.1016 / j.cub.2010.07.028。
张志刚,张志刚,张志刚,等:拟南芥幼苗生长发育过程中刮刀对幼苗生长的抑制作用。植物细胞学报,2011,23(4):1337-1351。10.1105 / tpc.110.082594。
Groszmann M, Bylstra Y, Lampugnani ER, Smyth DR: SPATULA基因在拟南芥心皮发育、幼苗萌发和侧器官生长中的组织特异性表达调控。实验学报,2010,61(5):1495-1508。10.1093 / jxb / erq015。
张志刚,张志刚,张志刚,等:赤霉素信号通路对拟南芥细胞增殖的调控作用。动物学报,2009,19(14):1188-1193。10.1016 / j.cub.2009.05.059。
结肠癌- carmona A, You R, Haimovitch-Gal T, Doerner P:技术进步:用不稳定的周期蛋白- gus融合蛋白进行有丝分裂活性的时空分析。植物学报,1999,20(4):503-508。10.1046 / j.1365 - 313 x.1999.00620.x。
Rutherford R, Masson PH:拟南芥sku突变苗在根生长载体中表现出严重的表面依赖改变。植物科学进展,2004,27(4):379 - 379。10.1104 / pp.111.4.987。
杨晓明,王晓明,王晓明,等:农杆菌介导拟南芥基因转移的研究进展。中华科学技术研究院学报,2003,26(3):344 - 344。
王晓明,王晓明,王晓明,等:拟南芥根系形态和极性的生长素依赖性远端组织者研究。光子学报,1999,29(5):463-472。10.1016 / s0092 - 8674(00) 81535 - 4。
李志刚,李志刚,李志刚。拟南芥雌芽形态发生过程中生长素和ETTIN的表达。发展,2000,127(18):3877-3888。
王晓明,王晓明,王晓明,等:AtPIN4介导拟南芥生长素梯度和根系形态的变化。光子学报,2002,28(5):661-673。10.1016 / s0092 - 8674(02) 00656 - 6。
倪达,王丽娟,丁春华,徐志华:拟南芥胚胎发生和种子萌发过程中生长素的分布和转运。地球科学进展,2001,11(4):273-278。10.1038 / sj.cr.7290096。
Lucas M, Swarup R, Paponov IA,等:短根调控拟南芥初生根、侧根和不定根发育。中国生物医学工程学报,2011,27(1):344 - 344。10.1104 / pp.110.165126。
Vieten A, Vanneste S, Wisniewska J,等:PIN蛋白的功能冗余伴随着生长素依赖性的PIN表达交叉调控。中国科学进展。2005,32(6):528 - 528。10.1242 / dev.02027。
Peer WA, Bandyopadhyay A, Blakeslee JJ,等:拟南芥黄酮类突变体生长素外排促进蛋白PIN家族的表达变化和蛋白定位。植物细胞学报,2004,16(7):1898-1911。10.1105 / tpc.021501。
Teotia S, Lamb RS: RCD1和SRO1在拟南芥中维持分生命运是必要的。实验学报,2011,62(3):1271-1284。10.1093 / jxb / erq363。
杨晓明,杨晓明,杨晓明,等:稻草人功能的分子分析揭示了根和茎的径向模式机制。发展。2000,127(3):595-603。
Malamy JE, Benfey PN:利用快速系统评估稻草人表达在拟南芥根中的表达。植物学报,1997,12(4):957-963。10.1046 / j.1365 - 313 x.1997.12040957.x。
Brady SM, Orlando DA, Lee JY,等:一个高分辨率的根时空地图揭示显性表达模式。科学通报,2007,29(6):528 - 528。10.1126 / science.1146265。
Ohashi-Ito K, Bergmann DC: LONESOME HIGHWAY对拟南芥根维管初始群体的调控。科学进展,2007,34(6):389 - 397。10.1242 / dev.006296。
松田勇,梁刚,朱勇,等:黄斑驳病毒启动子在转基因烟草多器官中驱动伴生细胞特异性基因表达。中国生物医学工程学报,2002,22(1):1-5。
Ubeda-Tomas S, Federici F, Casimiro I,等:赤霉素信号通路控制拟南芥根分生组织大小。动物学报,2009,19(14):1194-1199。10.1016 / j.cub.2009.06.023。
胡晓明,张晓明,张晓明,等:拟南芥根生长对赤霉素/DELLA信号通路的影响。细胞生物学杂志,2008,10(5):625-628。10.1038 / ncb1726。
杨晓明,杨晓明,杨晓明,等:赤霉素3-氧化酶在拟南芥发育中的作用。植物学报,2006,45(5):804-818。10.1111 / j.1365 - 313 x.2005.02642.x。
张春华,孙春平,张春华,孙春平:拟南芥赤霉素合成基因GA1的发育调控。植物学报,1997,12(1):9-19。10.1046 / j.1365 - 313 x.1997.12010009.x。
山口S:赤霉素代谢及其调控。植物学报,2008,29(4):344 - 344。10.1146 / annurev.arplant.59.032607.092804。
蒋洪辉,黄毅,古德曼HM:拟南芥GA4基因座的分离。中国生物医学工程学报,1995,7(2):195-201。
Matsushita, Furumoto T, Ishida S, Takahashi Y: AtGA3ox1编码GA3 -氧化酶负反馈所必需的AT-hook蛋白AGF1。植物科学进展,2007,29(3):344 - 344。10.1104 / pp.106.093542。
杨晓明,李志强,李志强,等:拟南芥中赤霉素20-氧化酶cDNA克隆的分离与表达。植物营养学报,2004,27(3):379 - 379。10.1104 / pp.108.3.1049。
徐玉玲,李玲,Gage DA, Zeevaart JA:拟南芥GA5表达的反馈调控及赤霉素代谢工程。植物细胞学报,1999,11(5):927-936。
Yamaguchi S, Sun T, Kawaide H, Kamiya Y:拟南芥GA2基因座编码赤霉素生物合成的T -kaurene合成酶。植物营养学报,2004,18(4):344 - 344。10.1104 / pp.116.4.1271。
Rieu I, Eriksson S, Powers SJ,等:C19-GA 2-氧化是拟南芥赤霉素失活的主要途径。植物细胞学报,2008,20(9):2420-2436。10.1105 / tpc.108.058818。
杨晓明,张晓明,张晓明,等:赤霉素20氧化酶基因表达对拟南芥赤霉素产量和植株发育的影响。植物学报,1999,17(5):547-556。10.1046 / j.1365 - 313 x.1999.00410.x。
汤建平,李建平,李建平:赤霉素2-氧化酶的分子克隆与功能表达。美国国家科学研究院。1999, 26(4): 489 - 497。10.1073 / pnas.96.8.4698。
王晓明,王晓明,王晓明,等:拟南芥GID1赤霉素受体的遗传特性及功能分析。植物细胞学报,2006,18(12):3399-3414。10.1105 / tpc.106.047415。
杨晓明,杨晓明,张晓明,等:赤霉素在拟南芥种子萌发过程中的合成及其对赤霉素活性的影响。植物学报,2003,15(7):1591-1604。10.1105 / tpc.011650。
傅建平,李志刚,李志刚,等:光敏色素B调控雌蕊形成与转录因子SPATULA的关系。植物信号行为学学报,2011,6(4):471-476。10.4161 / psb.6.4.14496。
王丽娟,徐娟,王晓明,等:植物生长素基因在植物体内的定位研究。科学通报,2006,29(4):344 - 344。
潘杰,陈瑞,李志刚,李志刚:光在拟南芥生长素外排载体PIN2的胞内分布中起着重要作用。公共科学学报,2008,3 (1):e1510-10.1371/journal. pone.net .0001510。
Willige BC, Isono E, Richter R,等:赤霉素调控拟南芥生长素转运依赖生长发育的pin -形成丰度。植物细胞学报,2011,23(6):2184-2195。10.1105 / tpc.111.086355。
郭志刚,张志刚,张志刚,等。拟南芥心皮和果实发育过程中bHLH转录因子SPATULA的功能域研究。植物学报,2008,55(1):40-52。10.1111 / j.1365 - 313 x.2008.03469.x。
Heim MA, Jakoby M, Werber M,等:植物中基本螺旋-环-螺旋转录因子家族:蛋白质结构和功能多样性的全基因组研究。分子生物学杂志,2003,20(5):735-747。10.1093 / molbev / msg088。
tolido - ortiz G, Huq E, Quail PH:拟南芥基本/螺旋-环-螺旋转录因子家族。植物细胞学报,2003,15(8):1749-1770。10.1105 / tpc.013839。
Rajani S, Sundaresan V:拟南芥myc/bHLH基因ALCATRAZ使果实开裂的细胞分离。动物学报,2001,11(24):1914-1922。10.1016 / s0960 - 9822(01) 00593 - 0。
齐默尔曼,刘海燕,王晓明,王晓明:基于基因研究的基因表达分析与网络发现。植物科学进展,2005,10(9):407-409。10.1016 / j.tplants.2005.07.003。
Zimmermann P, Hirsch-Hoffmann M, Hennig L, Gruissem W:基因研究者。拟南芥微阵列数据库和分析工具箱。植物科学进展,2004,26(1):1- 6。10.1104 / pp.104.046367。
Ni M, Tepperman JM, Quail PH: PIF3是一种新型的碱性螺旋-环-螺旋蛋白,是正常光诱导信号转导所必需的光敏色素相互作用因子。细胞科学学报,1998,95(5):657-667。10.1016 / s0092 - 8674(00) 81636 - 0。
Oh E, Yamaguchi S, Hu J,等:PIL5是一种与光敏色素相互作用的bHLH蛋白,通过直接与GAI和RGA启动子结合来调控赤霉素的反应性。植物细胞学报,2007,19(4):1192-1208。10.1105 / tpc.107.050153。
Gremski K, Ditta G, Yanofsky MF: HECATE基因调控拟南芥雌性生殖道发育。发展,2007,134(20):3593-3601。10.1242 / dev.011510。
Tsukagoshi H, Busch W, Benfey PN: ROS的转录调控控制了根从增殖到分化的转变。光子学报,2010,34(4):344 - 344。10.1016 / j.cell.2010.10.020。
陈强,孙娟,翟强,等:拟南芥根干细胞生态位调控中基本螺旋-环-螺旋转录因子MYC2直接抑制过多表达。植物细胞学报,2011,23(9):3335-3352。10.1105 / tpc.111.089870。
Woody ST, Austin-Phillips S, Amasino RM, Krysan PJ: WiscDsLox T-DNA收集:通过使用改进的高通量T-DNA测序管道生成的拟南芥群落资源。植物保护学报,2007,29(1):379 - 379。10.1007 / s10265 - 006 - 0048 - x。
Teotia S, Lamb RS:副同源基因自由基诱导细胞死亡1和SIMILAR TO RCD ONE1在拟南芥发育过程中具有部分冗余功能。植物学报,2009,31(1):379 - 379。10.1104 / pp.109.142786。
Czechowski T, Stitt M, Altmann T,等:拟南芥转录归一化的优势内参基因的全基因组鉴定和检测。植物学报,2005,39(1):1 - 5。10.1104 / pp.105.063743。
Arvidsson S, Kwasniewski M, Riano-Pachon DM, Mueller-Roeber B: qantprime -一种可靠的高通量定量PCR引物设计的灵活工具。中国生物医学工程学报,2008,29(4):465-10.1186。
Yuan JS, Reed A, Chen F, Stewart CN Jr:实时PCR数据的统计分析。中国生物医学工程学报,2006,29(4):457 - 457。
葛妮R, Garcia P, Foissac S:整合学白皮书。对qPCR数据进行统计分析。Tres Cantos:整合学,2009。1 - 9。
Willemsen V, Wolkenfelt H, de Vrieze G,等:拟南芥胚胎中霍比特基因是根分生组织形成所必需的。发展,1998,125(3):521-531。
王艳,林文华,陈霞,薛宏文:拟南芥5PTase13通过调控囊泡转运在根向地性中的作用。地球科学进展,2009,29(3):344 - 344。10.1038 / cr.2009.105。
确认
这项工作部分得到了美国国家科学基金会(MCD-0418891)对RSL的资助和俄亥俄州立大学的资助。作者感谢Patrice Hamel博士、JC Jang博士和Iris Meier博士(俄亥俄州立大学)和Lamb实验室成员对手稿的有益建议,以及Rachel Edwards的技术援助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
SM和RSL构思并设计了实验。SM完成了大部分实验并分析了数据。RSL对根系进行NAA、NPA实验和RT-PCR。SM和RSL撰写了这篇论文。所有作者都阅读并批准了最终的手稿。
电子辅助材料
12870 _2012_1199_moesm1_esm.pdf
附加文件1:SPT用根表示。RT-PCR检测L。呃7 DAG苗根(7 DAG)。显示了两个独立的生物重复。SPTProduct在左边肌动蛋白产品在右边。(A)样本1。(B)样本2。(pdf 64kb)
12870 _2012_1199_moesm3_esm.pdf
附加文件3:血管细胞的命运没有改变spt-11突变体。用丙碘染色的5个DAG根显微照片。(A, B)木质部相关中柱鞘标记的表达J0121:绿色荧光蛋白.(C, D)伴细胞标记物的表达CoYMV:绿色荧光蛋白.(A, C) Col-0。(B, D)spt-11.(pdf 113kb)
12870 _2012_1199_moesm4_esm.tiff
附加文件4:SPT与GA起加性作用。成年植物的照片。(A) Col-0代表,spt-11,ga3ox1-2;ga3ox2-1,ga3ox1-2;ga3ox2-1;spt-11 / +而且ga3ox1-2;ga3ox2-1;spt-11植物。(B)代表L.呃,spt-2,ga1-3,ga1-3;spt-2 / +而且ga1-3;spt-2植物。(tiff格式8mb)
权利和权限
本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用属性许可协议(http://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
bHLH转录因子SPATULA通过控制根分生组织的大小来调节根的生长。BMC植物生物学13日,1(2013)。https://doi.org/10.1186/1471-2229-13-1
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-13-1
关键字
- 生长素运输
- 干细胞生态位
- 根顶端分生组织
- bHLH蛋白质
- 皮层细胞层