抽象的
背景
典型丝裂原活化蛋白激酶(MAPK)信号通路在植物正常生长发育过程中起着至关重要的作用。这种连接上游信号和下游靶点的途径被认为是线性的,大多以MAPKKK开始,以MAPK结束。
结果
在这里,我们报告了两种米帕克,OSMPK20-4和OSMPK3之间的新互动,暗示了通路的复杂性,而不是单个步骤的线性。通过酵母双杂化分析发现OSMPK20-4和OSMPK3之间的相互作用进行了确认在足底通过共免疫沉淀和荧光共振能量转移(FRET)测定。相互作用是特异性的并且是无关的磷酸化。结果表明OSMPK20-4与OSMPK3之间的交互在基础植物防御中的作用。
结论
目前的新工作显示了两种植物MAPK, OsMPK20-4和OsMPK3之间的物理相互作用,这是对典型MAPK级联法则的偏离,从而打开了MAPK信号转导的一个新维度。
背景
丝裂原活化蛋白激酶(MAPK)信号级联除了协调正常的生长发育线索外,在授予无梗植物抗性方面也起着重要的作用。它是一种主要的和进化保守的信号级联,可能源自动物erk相关谱系[1].一个典型的MAP激酶通路至少由一个三层线性磷酸化模块组成,即MAPKKK-MAPKK-MAPK,它将不同的发育和防御信号连接到适当的转录反应。MAPKs在一个保守的T-E-Y或T-D-Y基序上被上游MAPKKs磷酸化,从而导致它们的激活[2].活化映射的下游底物包括细胞质和细胞核中的转录因子,酶或其他蛋白质[3.].序列拟南芥MAPK底物含有丝氨酸或苏氨酸,然后含有脯氨酸[S / TP],被认为是MAPK磷酸化的最小共识基序[4.].
关于植物映射的主要插图来自eudicot植物拟南芥其中包含20个Mapks分为四组A-D [5.].A,B和C组具有“Tey”图案,而组D在子域之间包含“TDY”主题,Mapks的特征在vii-viii之间,[6.].研究最广泛的A组MAPKs来自拟南芥,Atmpk3和Atmpk6是植物天生免疫的中央正介质[7.那8.]除了灌注植物,用于随后的感染[9.].B组MAPK,ATMPK4充当植物系统获得的负稳压器[10].拟南芥MAPKs也被认为控制基本的生理和发育过程,包括乙烯生物合成和信号转导[11-13],气孔发展和反应[14那15,皮层微管功能[16胚珠发育[17使衰老[18].
有关Mapk基因家族的信息,其在经济上重要的谷物稻米上的功能和调节(奥雅萨苜蓿)与其型号销售厂相比仍然很少拟南芥.水稻有15个MAPKs (OsMPKs),分子量从42-79 kDa不等,具有保守的蛋白激酶I-XI结构域和TEY或TDY基序的激活t环[5.].有趣的是,稻米有更多的含有Dy Mapks(10名成员)的Ty Motif,而不是与Tey Motif(5个成员)相反拟南芥Mapks。与Tey亚组的Osmapks相比,Tye亚组中的Osmapks在激活循环附近的额外氨基酸插入有三到四个额外的氨基酸插入。属于Tey子组的OsMapks具有C-Terminal常见的对接(CD)域,其作为MapKks的停靠站点,而TDY子组的成员则缺少该CD域,但具有相对较长的C终端区域[19].
在水稻中的15个OsMAPKs中,到目前为止只有少数得到了鉴定。例如,OsMPK3(以前命名为OsBIMK1, OsMAP1, OsMSRMK2, OsMAPK2或OsMPK5)和OsMPK7(以前命名为OsMAPK4, OsMSRMK3)被证明是由各种生物和非生物胁迫诱导的[20.-24].同样,发现OSMPK17-1(OSBWMK1),OSMPK6(OSMAPK6,OSSIPK)和OSMPK4(OSMPK2)涉及植物防御响应[25-27].
OSMPK20-4(Acc)。不。DQ826425.1)(原名OsWJUMK、OsMPK8和OsMPKG1)是水稻重要的MAPK成员之一,编码一个569氨基酸长蛋白[28].OSMPK20-4由N末端激酶域(KD)和异常长的C末端扩展区域组成,但缺少公共对接(CD)域。与大多数其他植物MAPKS不同,OSMPK20-4的KD区域携带TDY磷酸化图案而不是TEY,这是MAPK激活所必需的序列。OSMPK20-4已被归类为D组MAPK,并与ATMPK20共享最高相似性[5.那19].的OSMPK20-4在未经处理的健康叶片中具有强大基础水平表达的基因,在挑战伤口,茉莉酸(JA),水杨酸(SA),乙烯(ET),NaCl和蔗糖时保持不变。表述通过脱硅酸(ABA),H略微上调2O.2但受重金属和低温(12°C)影响更大。然而,OsMPK20在37°C和UV-C照射下表达下调[28].OsMPK20也被外源aba治疗和诱导诱导Magnaporthe Grisea.感染并与宿主细胞死亡有关[19].涉及D族地图的D族D族Mapks的大多数研究已经限于mRNA表达水平,并且没有发现相互作用的蛋白质。
在本研究中,我们对OsMPK20-4进行酵母双杂交分析,以找出其相互作用伙伴,以进一步了解水稻MAPK通路。与MAPK途径的线性性质相反,OsMPK3 (a组MAPK的成员)在酵母双杂交筛选中被发现是OsMPK20-4的相互作用伙伴。进一步体外和在足底实验证实了相互作用的特异性。有趣的是,蛋白质都被证明可以增强烟草中的植物免疫假单胞菌含油pv。Tabaci.感染。还观察到两种蛋白质在感染时在气孔防护细胞中定位在气孔防御中可能的作用。目前的工作显示OSMPK20-4和OSMPK3之间的物理交互打开了MAPK信令研究的新维度。
结果
OSMPK20-4在酵母中与OSMPK3交互
酵母双杂交(Y2H)筛冷处理(4°C)奥雅萨苜蓿最初进行cDNA文库以鉴定可以与OSMPK20-4相互作用的蛋白质。筛选约4×10后6.以OsMPK20-4为诱饵,鉴定出11个阳性克隆。序列分析表明,其中一个克隆编码一个OsMAPK,后来鉴定为OsMPK3。随后,从酵母AD(激活域)和BD(结合域)载体中分离得到OsMPK3全长cDNA克隆。通过在OsMPK20-4和OsMPK3全长克隆之间进行一对一的蛋白-蛋白相互作用验证了这种相互作用。在OsMPK20-4和OsMPK3之间交换载体后也观察到相互作用(图)1一种)。
OSMPK20-4与OSMPK3对酵母双杂交筛选的相互作用。(一种)记者酵母菌株AH109与编码列出的基因构建体的重组PGBKT7和PGADT7共转化。在SD [-LE-TRP]上选择了转化体,双重辍学(DDO)介质,并在SD [-TRP-LEU-ADE-HIS]四分代辍学(QDO)介质上检查交互。(B)β-半乳糖苷酶测定显示Lacz.以ONPG为底物的报告基因表达。用上述结构转化的AH109报告菌株在液体培养中加入ONPG检测β-半乳糖苷酶活性,并在OD = 420 nm处读取吸光度。pGADT7载体中SV40大T抗原与pGBKT7载体中p53共转化的AH109在所有实验中均作为蛋白相互作用的阳性对照。
由于OSMPK3和OSMPK20-4相互作用在营养选择介质( - 地,-HIS,-LEU,-TRP)以及MEL1报告基因表达中,通过使用ONPG作为底物证实LAC Z报告基因表达。AH109与OSMPK3和OSMPK20-4的酵母菌菌株产生高β-半乳糖苷酶活性,而其他转化体与OSMPK3或OSMPK20-4的组合和空AD或BD载体的组合具有低或可忽略量的β-半乳糖苷酶活性,与阳性相互作用(图1b)。
OsMPK20-4和OsMPK3之间的交互是特定的
为了证明OSMPK20-4和OSMPK3之间的相互作用是特异性的,对于OSMPK20-4和OSMPK3分别对OSMPK20-4和OSMPK3分别对OSMPK3和OSMPK20-4的系统闭合构件进行靶向α和OSMPK3。OSMPK20-4的近亲包括OSMPK20-2和OSMPK17-1,所有组D Mapks以及OSMPK3分别包括OSMPK6和OSMPK4分别[5.].将AD载体中的OsMPK20-4、OsMPK20-2和OsMPK17-1的全长克隆与BD载体中的OsMPK3进行Y2H分析。同样,将AD载体中的OsMPK3、OsMPK4和OsMPK6的全长克隆与BD载体中的OsMPK20-4进行Y2H检测。在这两种情况下,只有OsMPK20-4和OsMPK3在AD或BD载体上的组合在营养选择培养基(-ade, -his, -leu, -trp)上显示了生长,反映了相互作用的特异性(图)2,a-b)。
OsMPK20-4和OsMPK3相互作用的特异性。(一种)报告酵母株AH109与重组菌共转化OSMPK20-4pGBKT7的近亲osmpk3.包含OSMPK4.和OSMPK6.在pGADT7。(B)PGBKT7中的OSMPK3转换为AH109以及OSMPK20-4的近亲,包括OSMPK17-1和OSMPK20-2。在SD [-LE-TRP] DDO介质上选择转化体,并在SD [-TRP-LEU-ADE-HIS] QDO媒体上进行交互。(C)与OSMPK3有效交互需要全长OSMPK20-4。AH109酵母报道株与OSMPK20-4的缺失构建体共转化,OSMPK20-4kd.含有前358个氨基酸和OsMPK20-4CT在AD和BD载体中含有211个氨基酸的长C末端区域。在DDO上选择转化体,并在QDO上检查相互作用。AH109在PGADT7载体中用SV40大T抗原进行转化,PGBKT7载体中的P53在所有实验中都有阳性对照。
组D Mapks缺少C终端公共对接(CD)域,其作为用于MAPKKS的对接站点,而是具有相对较长的C终端区域[19].问下一个问题是OSMPK20-4的相对长的C-终端域是否负责与OSMPK3的交互。为此,C末端211氨基酸长拉伸OSMPK20-4(OSMPK20-4CT)在AD和BD载体中克隆并在靶向Y2H测定中使用OSMPK3。还含有激酶结构域的前358个氨基酸的OSMPK20-4的一部分(OSMPK20-4kd.),但缺少211个氨基酸的c端尾也在AD和BD载体中克隆,并用于Y2H研究中与OsMPK3相互作用。在这两种情况下都没有观察到相互作用或非常弱的相互作用,这表明相互作用不仅仅是由c端氨基酸长拉伸介导的,而且需要完整的OsMPK20-4来进行有效的相互作用(图)2C)。
OsMPK20-4与OsMPK3交互的确认在足底免疫共沉淀法和FRET法
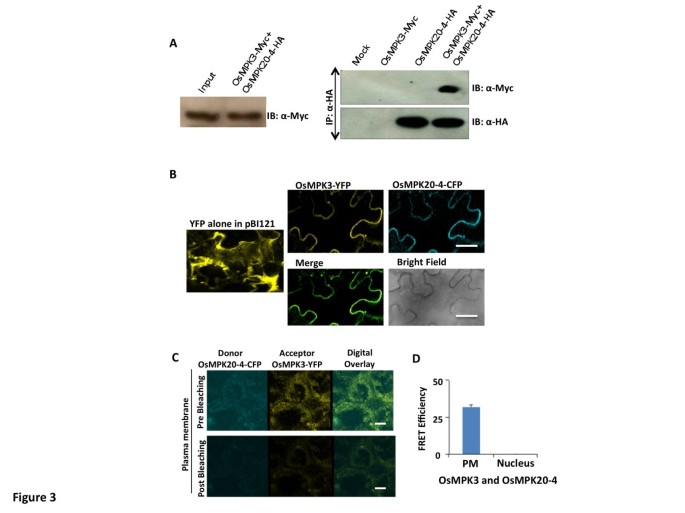
为了进一步确认OsMPK20-4和OsMPK3之间的相互作用,我们进行了共免疫沉淀(Co-IP)实验。pCAMBIA1302二元载体中MYC标记的OsMPK3和HA标记的OsMPK20-4分别独立或1:1组合瞬时转化尼科尼亚塔哈瓦姆由agro-infiltration叶子。48小时后在足底检查了各自成绩单的表达(附加文件)1)和分离的蛋白质用于共同IP测定。用免疫印迹(IB)检查用作输入对照的蛋白质的表达分别用抗myc和抗HA抗体标记为OSMPK3和OSMPK20-4(附加文件2).使用抗HA抗体随后使用抗C-MYC抗体进行抗HA抗体进行分离的蛋白质的免疫沉淀。OSMPK3仅在用OSMPK20-4-HA和OSMPK3-MYC(1:1)中的共转化的叶组织蛋白的抗HA免疫沉淀物中检测到反转化的叶片组织(1:1)反映两种蛋白质的相互作用(图3.一种)。
在足底OSMPK20-4与OSMPK3的交互。(一种)HA标记OSMPK20-4和MYC标记的OSMPK3蛋白单独转换或在烟叶中一起转换,用于共免疫沉淀实验。来自PCAMBIA1302空载体渗透叶的蛋白质用作阴性对照(模拟)。使用抗C-MYC和抗HA抗体进行抗HA抗体进行第一IP(免疫沉淀),然后进行沉淀蛋白的免疫印迹(IB)。使用基于HRP的化学发光基板开发IBS。(B)使用YFP标记OSMPK3和CFP标记的OSMPK20-4蛋白进行亚细胞共定位研究。使用YFP和CFP滤光器(Leica Aobs System),观察到瞬时转化的烟叶中所指示的标记蛋白的定位。条=20μm。(C)标记蛋白质的荧光共振能量传递测定进行烟草叶片48小时的瞬态转化柱。青色和黄色是分别代表CYP和YFP的伪颜色。共聚焦显微镜(TCS SP5; Leica)拍摄的图片。条=20μm。(D)在PM(血浆膜)和核(N = 3)中观察到的褶皱效率(%)。
通过使用农业渗透法通过瞬时变换在烟叶中在烟叶中进行OSMPK20-4和OSMPK3的亚细胞定位和随后的共定位。用CFP和OSMPK3标记的OSMPK20-4标记为PBI121中克隆的YFP标记为二进制向量系统瞬时转换为尼科尼亚塔哈瓦姆通过农业渗透的方法。在确认各自成绩单的存在之后(附加文件)1),在适当的吸光度过滤器下在共聚焦激光扫描显微镜下观察叶子以检查荧光标记蛋白的定位。发现蛋白质在细胞的外周上共定位,并且在合并图像时荧光信号都完全叠加(图3.b)。进行荧光共振能量转移受体漂白(FRET-AB)方法以获得在足底OSMPK3和OSMPK20-4互动的证据。携带CFP标签的OSMPK3的重组构建载体和OSMPK20-4通过农业渗透瞬时转化为烟叶。进一步分析细胞用于FRET-AB分析。发现OSMPK3与OSMPK 20-4互动在足底主要在等离子体膜(图3.C和3.D)。
OsMPK20-4和OsMPK3不是相互磷酸化的靶点
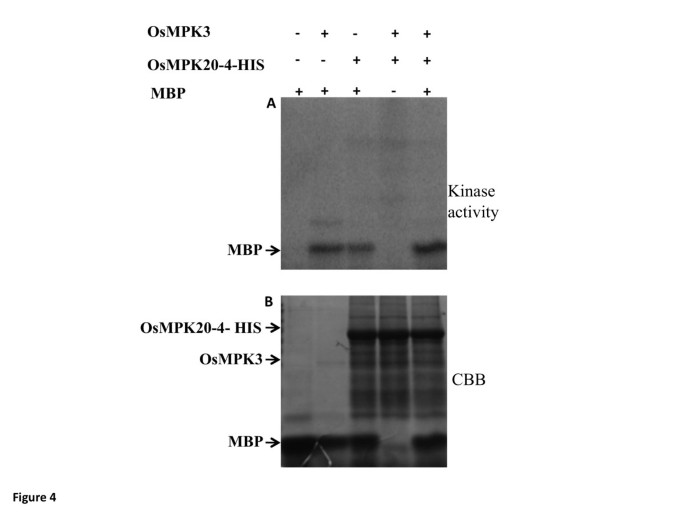
OsMPK20-4和OsMPK3分别有三个和一个假定的[S/TP]站点(来源:NetPhosK。1 web server),被认为是MAPK磷酸化的最小共识基序[4.].因此,寻求进一步检查两种蛋白质之间的相互作用,然后是磷酸化事件。要解决问题,细胞表达无标签OSMPK3(附加文件3.A)和他标记的OsMPK20-4(附加文件3.b)用于一个体外在含有放射性标记的激酶缓冲液存在下的激酶测定[γ-32P] ATP。尽管这两种蛋白都能独立磷酸化髓鞘碱性蛋白(MBP,一种MAPKs的人工底物),但它们不能相互磷酸化,这表明相互作用可能不会导致任何一种蛋白的磷酸化(图)4.).有趣的是,当在测定中将两种OSMPK3和OSMPK20-4包括在一起时,观察到MBP的相对强烈的磷酸化。
OsMPK20-4和OsMPK3相互作用在植物防御中具有协同作用
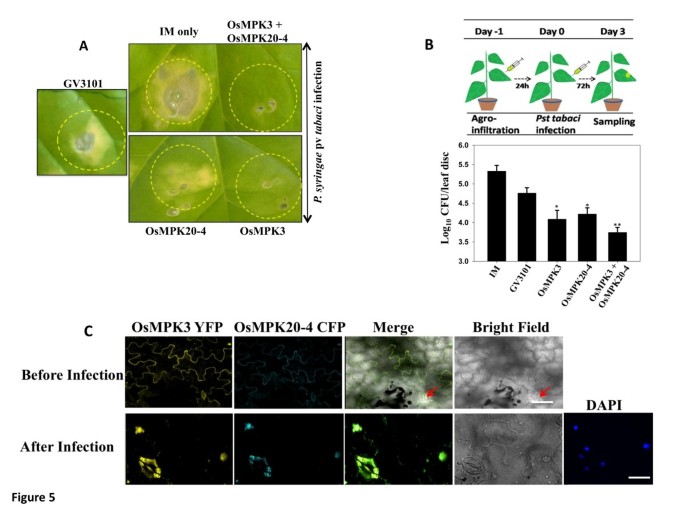
以前已经证实,水稻OsMPK3参与抗病反应[20.]和osmpk20-4引起的Magnaporthe Grisea.感染并与宿主细胞死亡有关[19].在某些生物挑战下,在水稻中存在osmpk3和OSMPK20-4的相关基因表达(附加文件4.)反映这些蛋白质在植物防御中的一致作用。因此,我们试图研究两种蛋白质的相互作用是否会影响植物中感染。为此,烟草叶子瞬时转化为OSMPK20-4 / OSMPK3.单独或组合,并受到挑战假单胞菌含油pv。烟。72小时后,叶子表达OSMPK20-4那osmpk3.或两者都显示出与模拟处理的叶片相比对细菌感染的抗性增加(图5.A).对照,叶片被独立渗透农杆菌菌株GV3101只携带空载体和渗透培养基。此外,菌落计数显示,与单个蛋白相比,同时表达OsMPK20-4和OsMPK3的叶片表现出更多的抗病性(图)5.B).观察表明,这两个相互作用的蛋白质以一致的方式提供抗病反应。
OSMPK20-4和OSMPK3在植物防御中具有作用。(一种)OSMPK20-4和OSMPK3都为疾病提供抵抗力。用嘲笑(仅限im)渗透烟草叶子,农杆菌菌株GV3101,OSMPK20-4-HA和OSMPK3-MYC在1:1的比例中受到挑战p .两光伏Tabaci.(od.6000.1)接种24小时后感染。感染72小时后拍照。(B)OSMPK20-4和OSMPK3在植物防御中发挥协同作用。根据示意图(上图)确定OSMPK20-4-HA和OSMPK3-MYC感应电阻,以及p .两光伏Tabaci.被绘制为Log CFU /叶片(下图)。进行了三个独立的实验,并显示了代表性的图。t测试P.值:* <0.05,** <0.01。(C)OsMPK20-4和OsMPK3相互作用在气孔防御中起作用。上图显示了之前显示的蛋白质的定位p .两光伏Tabaci.感染。下图显示了感染24小时后,水稻MAPKs突然转移到细胞核和气孔保卫细胞中。照片采用共聚焦激光扫描显微镜(徕卡AOBS系统)拍摄。条=20μm。
CFP标记的OSMPK20-4和YFP标记OSMPK3的荧光显微镜显示出蛋白质的外周定位。但有趣的是通过初步的图像分析,发现OSMPK20-4和OSMPK3都从细胞周边接受瞬态易位到核和气孔保护细胞假单胞菌含油pv。Tabaci.感染(图5.C)。这反映了OSMPK20-4和OSMPK3除了作为一般植物压力的关键球员,可能在气孔防御中具有作用。
讨论
在这项研究中,我们报告了发现两种水稻激活蛋白激酶OSMPK20-4和OSMPK3之间的新型相互作用。尽管MAPK与上游MAPK激酶和下游衬底的相互作用是众所周知的,但是在物理上彼此相互作用的两种植物麦卡克茨的先前存在的先前报道。此发现为已复杂的工厂MAPK信令级联增加了一个更为有趣的维度。OSMPK20-4是相对较少研究的难以捉摸的成员之一,但是一个非常重要的米马克信号传导组件。OSMPK20-4,D米MAPK初始表征为oswjumk [28]在各种非生物胁迫中。观察到由寒冷和重金属应力诱导但不是通过伤害或茉莉酸(因此名称W.哎呀j芹菜酸你ninduced.mAPK.inase)。另一项研究发现,OsMPK20-4在稻瘟病菌感染后高表达[19].在寻求寻找OSMPK20-4的互动伴侣时,我们进行了酵母双杂交(Y2H)筛选并确定OSMPK3作为潜在的互动伙伴(图1一种)。发现相互作用是特异性的,因为它们都不是与彼此相互作用(图2A-B)。还证实,参与上游激酶相互作用的OSMPK20-4(组DAMAK的特征)的异常长的C末端部分,不仅仅涉及与OSMPK3的相互作用(图2C)。验证了OSMPK20-4和OSMPK3的交互在足底CoIP检测,然后是FRET检测(图3.).较早前两个烟草MAPKs, WIPK (拟南芥Ortholog Atmpk3)和Sipk(拟南芥AtMPK6)在功能上相互作用Phytophthora.感染(29,但没有两个mapk之间直接物理交互作用的报道。SIPK被鉴定为参与调控WIPK基因表达的激酶,这为MAPKs可能在调控植物防御反应中相互作用提供了间接线索。
蛋白质局部化在细胞的周边,这与所做的观察结果一致拟南芥AtMPK3, OsMPK3的同源物[30.].Singh等人[31在他们的报告中观察到,OSMPK3(命名为OSMPK5)在核和细胞质中都是本地化的。在这种情况下,OSMPK3本地化的差异似乎是由于生物系统的差异和所用的实验程序。在这些研究中使用不同的表达系统可能是蛋白质定位差异的另一个原因。众所周知,根据细胞的生理状态和它们与[的蛋白质的性质,MAP激酶遵循动态模式。30.那32那33].但不能排除由于使用35S启动子驱动蛋白表达,导致过表达,导致两种蛋白的共定位和相互作用。这两种蛋白的共同定位是根据植物CDPKs中两种单独荧光信号的合并推断出来的[34].有趣的是,正面褶皱测定表明在足底仅在血浆膜中观察到两种蛋白质的相互作用和FRET效率。因此,它可以得出结论,两种蛋白质对细胞周边相互作用。还知道OMTK1(oXidative强调激活mAPtriple -kinase1)来自Alfalfa的Mapkkk通过绑定和选择性地激活苜蓿MAPK,MMK3和激活H中的功能来播放MAPK脚手架作用2O.2-诱导植物细胞死亡[35].还可以推测OSMPK20-4作为结合和随后激活OSMPK3的脚手架蛋白。
在水稻MPSS数据库中,生物胁迫下存在OsMPK20-4和OsMPK3的相关基因表达,提示它们在生物胁迫中的协同作用(附加文件)4.).OSMPK20-4-HA和OSMPK3-MYC在烟草叶中的瞬态转换单独显示出显着的减少p .两pv。Tabaci.细菌计数验证歌曲和古德曼的观察结果[20.]对于OSMPK3(图5.).结果与显示PR基因表达和广谱疾病抵抗的osmpk3(早期命名为OSMAPK5)的osmpk3(早期命名为OSMAPK5)的较早观察结果矛盾22].然而,最近据据报道,奥姆普克3积极调节JA信号通路和植物对大米中咀嚼食草动物的抗性[36[还,对WIPK和SIPK基因的正规调节Pseudomonas Cichorii.- 显示了细菌病原体尼古利亚娜·宾夕法尼亚州[37].在植物中损害对病原体的抵抗力沉默。由于OSMPK3是WIPK的正直,OSMPK3的瞬时表达可能导致抗病原体的抗性增加,因此在烟草防御反应中的积极作用。OSMKK4-OSMPK3 / OSMPK6级联也显示出稻米防御反应的正面和负调节[38].我们的数据表明,这两种相互作用的蛋白质以一种协调的方式提供对疾病的抵抗反应p .两.
众所周知,植物映射在响应生物和非生物应激时展示其本地化的动态变化[33].细胞核和气孔防护细胞是用于感染的潜在作战机制的两个重要部位[39].臭氧处理诱导易位拟南芥ATMPK3和PEP-13(Phytophthora.SPP。Elicitor)治疗欧芹细胞诱导PCMPK6进入细胞核的易位和积累[30.那32].拟南芥AtmPK3和异统G蛋白,已知GPA1在ABA介导的气孔闭合期间在平行信号通路中起作用[15].除了在气孔保护细胞运动中具有作用外,ATMPK3还通过气孔激活预防细菌感染。同意上述观察结果,观察到osmpk20-4和osmpk3在感染时转化为细胞核和气孔防护细胞。两种蛋白质的并发运动反映了它们在产生气孔防御反应时的相互作用的作用。OSMPK3和ATMPK3的功能是保守的,而OSMPK20-4充当易位增强蛋白。
结论
在本研究中,已经报道了两种MAPKS,OSMPK20-4和OSMPK3之间的新颖相互作用。相互作用是磷酸化独立性,需要全长蛋白质以获得有效的相互作用。对细菌病原体的协调植物防御反应需要相互作用,假单胞菌含油并且也被认为在气孔防御中发挥作用。总的来说,将此新链接添加到已经复杂的MAPK途径中可以进一步导致了解各种生理反应背后的实际信号机制。
方法
酵母双杂交筛选
根据制造商的指导(Invitrogen,UK),将总RNA从暴露于冷应激(4°C)暴露于冷应激(4°C)的两周大米植物2小时。使用Bd Smart III寡核苷酸和Cds III引物根据制造商的指示(Clontech)进行第一链cDNA合成。使用具有5'和3'PCR引物的LD-PCR进行第二链合成和扩增。用BD色氨酸纺丝体TE-400柱纯化扩增的双链cDNA。通过CoTransforming酵母AH109菌株产生GAL4 AD融合库,具有BD智能DSCDNA和SMAI线性化PGADT7-REC载体。诱饵由框架内克隆制作OSMPK20-4在pGBKT7载体(Clontech)中形成OsMPK20-4 GAL4 BD融合蛋白。现在酵母报告菌AH109与dscDNA, pGADT7-Rec和pGBKT7-共转化OSMPK20-4根据生产说明书(克隆技术),用PEG/LiAc方法检测质粒。在30°C的SD-trp-leu (DDO,双退学培养基)中生长24小时后,菌落随后被镀到SD-trp-leu-ade-his培养基(四倍退学培养基(QDO))上。基于HIS3、ADE2和MEL1报告基因在QDO培养基上的表达选择正互作。将所有阳性菌落进行筛选分析。阳性克隆经DNA测序确认。
全长基因OSMPK20-4和osmpk3.,在PGADT7和PGBKT7载体(CLONTECH)中克隆的框架克隆并在AH109酵母菌中转化,在30℃下在QDO培养基中选择一个至一个相互作用。
通过监测β-半乳糖苷酶测定法进行LacZ通过向液体培养物加入液体培养物直接对营养选择板的报告基因表达,其根据制造商的说明书(Clontech)快速冻结/解冻。作为β-半乳糖苷酶在培养基中积累,它将ONPG水解至邻硝基苯酚,其在420nm下分光光度测定。
全长克隆OSMPK17-1那OSMPK20-2那OSMPK4.和OSMPK6.被克隆到PGAdt7矢量(Clontech)和Cot转录osmpk3.要么OSMPK20-4在PGBKT7向量(CLONTECH)中成酵母AH109,在30°C时在QDO上选择。
的质粒pGBKT7:OSMPK20-4kd.和pGBKT7:OSMPK20-4CT生成的氨基端激酶域subcloning OsMPK20-4(氨基酸1 - 358)和c端地区(氨基酸359 - 569)到EcoRI / BamHI酵母pGBKT7 pGADT7场所向量(Clontech),插入克隆在坐标系与酵母GAL4 dna结合域和激活域的转录监管机构分别。本研究中使用的所有引物清单见附加文件5..
Co-immunoprecipitation化验
对于共免疫沉淀,通过在PGADT7和PGBKT7向量(CLONTECH)中,用框架克隆用N末端HA和MYC标签标记OSMPK20-4和OSMPK3。通过PGADT7和PGBKT7向量扩增OSMPK20-4-HA和OSMPK3-MYC标签,使用PGBKT7向量和两种附加标签使用引物OSMPK3-MYC-PCMF和OSMPK3-MYC-PCMR为MYC标签和OSMPK20-4-HA-PCMF引入HA标签的OSMPK20-4-HA-PCMR(附加文件5.).盒式磁带转入pCAMBIA 1302二进制载体系统。二元载体转化为农杆菌应变GV3101。融合蛋白在尼科尼亚塔哈瓦姆叶使用农杆菌瞬态渗透方法[35].通过使用50mM Hepes-KOH(pH7.5),5mM EDTA,5mM EGTA,1mM DTT,10mM NA分离蛋白质在48小时后分离蛋白质后3.签证官4., 10 mM NaF, 50 mM β-甘油磷酸,1 mM PMSF, 10% (v/v)甘油,0.1% Nonidet P-40, 2.5% PVPP和蛋白酶抑制剂鸡尾酒(Sigma)。用抗ha抗体对提取的蛋白进行免疫沉淀(IP),再用抗c- myc抗体对沉淀的蛋白进行免疫印迹。200 μg蛋白与2 μg抗ha抗体(Santa Cruz Biotechnology)孵育,4°C孵育4 - 6小时。然后加入40 mg ProteinA Sepharose™6mb珠(GE Healthcare),并在4°C恒温过夜。洗涤后的珠子在10% SDS-PAGE上直接分离,然后转移到Hybond™-C额外膜(Amersham)。用抗c- myc一抗(1:50 000稀释)(Santa Cruz Biotechnology)和抗小鼠山羊二抗(1:10000稀释)孵育该膜。膜是用Immobilon™Western Chemiluminescent HRP substrate (Millipore)开发的。
共定位测定和荧光共振能量转移分析
OSMPK20-4和osmpk3.在PECFP-N1和PEYFP-N1载体(CLONTECH)中克隆的框架中克隆,以产生C末端CFP和YFP荧光融合蛋白(附加文件中提到的引物序列5.).盒子也被克隆到PBI121二元载体(Clontech)中。二元载体转化为农杆菌应变GV3101。融合蛋白在尼科尼亚塔哈瓦姆通过农杆菌瞬变渗透方法留下[40使用无针皮下注射器。72h后,在共聚焦扫描显微镜(Leica TCS SP2 AOBS系统)下,使用CFP和YFP滤镜对叶盘和24h后的原生质体进行观察。YFP和CFP分别采用514 nm和435 nm的氩激光激发,527 nm和475 nm的发光。在荧光光谱分析中,叶片在瞬变后24小时和48小时后进行观察。FRET实验按照制造商的说明进行,同时记录三个以上电池的FRET效率[41].荧光蛋白(CFP)的激发波长为458 nm,发射波长为465 ~ 505 nm,而YFP的激发波长为512 nm,发射波长为525 ~ 600 nm。记录CFP和YFP蛋白的荧光检测结果。共聚焦显微镜(TCS SP5;(徕卡)用于FRET实验。
体外磷酸化检测
OSMPK20-4在PET21C(+)表达载体(Novagen)中克隆的框架克隆,得到C末端他的标签,并转变为称职大肠杆菌BL21细胞。用1 mM IPTG诱导蛋白,并将其溶解于上清液中肠易激综合症™buffer kit (G Biosciences, USA)。蛋白由QIAexpressionist™蛋白纯化系统(Qiagen)使用Ni-NTA琼脂糖珠纯化。另一方面,osmpk3.克隆到pPAL7表达载体(Biorad)中进行无标记蛋白生产。用1 mM IPTG诱导蛋白,用Profinity eXact™蛋白纯化系统(Biorad)纯化。体外如所述进行激酶测定[42略作修改。简而言之,将5μg样品与反应缓冲液混合,得到含有25mM Tris-Cl(pH7.5)的15μl的最终体积,10mM MgCl2, 5毫米锰cl2,1mM DTT,1mMβ-甘油磷酸,1μmNA3.签证官4.MBP为0.5 mg/ml, ATP为25 μM, γ- c为1 μCi32p] ATP。通过加入10μL2×SDS样品缓冲液30分钟后停止在30℃下孵育。将样品在95℃下煮沸5分钟,然后在12%SDS-PAGE凝胶上分离。使用磷成像仪(台风,磷光体储存系统)可视化激酶活动。
烟草渗透和感染研究
尼科尼亚塔哈瓦姆植物在25°C、14小时光照周期的温室中生长。四到六周的老植株被用来农杆菌介导的瞬态转变。简单地说,农杆菌携带不同结构的菌株GV3101在28℃的YEB培养基(酵母提取物1 g/l、牛肉提取物5 g/l、蛋白胨5 g/l、蔗糖5 g/l和MgSO)中过夜4.0.491克/升;用NaOH的最终pH 7.0),具有适当的抗生素。通过离心(4000g)收集细胞,重新悬浮到OD6001.0在渗透介质中(10 mm MES pH 5.7,10 mm mgcl2和150 μM乙酰丁香酮),用无针注射器渗透到完全膨胀的叶片中。24小时后假单胞菌含油光伏Tabaci.感染在重叠初始的区域农杆菌浸润。通过50mg / L四环素的LB培养基在28℃下在28℃下进行细菌淋巴肿,离心并调节到OD6000.1在10毫米氯化镁2.
在感染72小时后进行细菌菌落计数测定。评估细菌种群,三个10毫米2叶盘从接种区收获,并在1ml 10 mM氯化镁中研磨2,稀释并镀以确定日志10如上所述的CFU /叶片43略作修改。简单地说,经过注射器浸润,3个10毫米2将叶片接地在管中,并用50mg / L四环素发现100μl三倍的连续稀释液。电镀后菌落计数48小时。
缩写
- 阿巴:
-
脱盐酸
- 广告:
-
激活域
- BD:
-
绑定域
- CD领域:
-
公共对接领域
- CFP:
-
青色荧光蛋白
- CO-IP:
-
Coimmunoprecipipitation.
- DDO:
-
双辍学
- 烦恼:
-
荧光共振能量转移
- JA:
-
茉莉酸
- 地图:
-
丝裂原活化蛋白激酶
- MBP:
-
髓鞘碱性蛋白质
- ONPG:
-
邻硝基苯基-β-半乳糖糖苷
- oswjumk:
-
奥雅萨苜蓿茉莉酸非诱导MAP激酶
- QDO:
-
四肢掉了出来
- SA:
-
水杨酸
- Y2H:
-
酵母双杂交
- yfp:
-
黄色荧光蛋白。
参考
- 1.
植物丝裂原活化蛋白激酶信号转导。植物生态学报,2010,31(6):649 -649。10.1146 / annurev - arplant - 042809 - 112252。
- 2.
Sinha Ak,Jaggi M,Raghuram B,Tuteja N:非生物胁迫下植物中的丝裂原激活蛋白激酶信号传导。植物信号表现。2011,6:196-203。10.4161 / psb.6.2.14701。
- 3.
艾利斯,安德里亚森,B:收敛性和特异性拟南芥Mapk Nexus。趋势植物SCI。2010,15:106-113。
- 4.
Sharrocks AD,Yang Sh,Galanis A:对接结构域和底物特异性测定地图激酶。趋势Biochem SCI。2000,25:448-453。10.1016 / s0968-0004(00)01627-3。
- 5.
Hamel LP, Nicole MC, Sritubtim S, morrency MJ, Ellis M, Ehlting J, Beaudoin N, Barbazuk B, Klessig D, Lee J, Martin G, Mundy J, Ohashi Y, Scheel D, Sheen J, Xing T, Zhang S, Seguin A, Ellis BE:古老的信号:植物MAPK和MAPKK基因家族的比较基因组学。植物科学进展,2006,11:192-198。10.1016 / j.tplants.2006.02.007。
- 6.
MAPK组:植物中的丝裂原激活蛋白激酶级联:一种新的命名法。趋势植物SCI。2002,7:301-308。10.1016 / S1360-1385(02)02302-6。
- 7.
Asai T, Tena G, Plotnikova J, Willmann MR, Chiu WL, Gomez-Gomez L, Boller T, Ausubel FM, Sheen J: MAP激酶信号级联拟南芥先天免疫。自然学报,2002,415:977-983。10.1038 / 415977。
- 8.
毛克,萌X,刘y,陈z,陈z,张某:两种病原体响应映射的腕骨转录因子的磷酸化驱动植物嗜血素生物合成拟南芥.植物细胞。2011,23:1639-1653。10.1105 / TPC.111.084996。
- 9。
Beckers GJ,Jaskiewicz M,Liu Y,Underwood WR,He Sy,Zhang S,Conrath U:偶极活性蛋白激酶3和6是必需的应力反应的全引发拟南芥蒂利亚纳.acta botanica sinica, 2009, 31(4): 457 - 462。10.1105 / tpc.108.062158。
- 10.
Petersen M,Brodersen P,Naested H,Andreasson E,Lindhart U,Johansen B,Nielsen HB,Lacy M,Austin MJ,Parker JE,Sharma Sb,Klessig DF,Martiensen R,Mattsson O,Jensen Ab,Mundy J:拟南芥Map激酶4负调控系统性获得性抗性。细胞。2000,103:1111-1120。10.1016 / s0092 - 8674(00) 00213 - 0。
- 11.
刘志强,赵永华,熊勇,辛京:分岔MAPK级联对EIN3核的双重控制2H4.信令。自然。2008,451:789-795。10.1038 / Nature06543。
- 12.
Bethke G,Unthan T,Uhrig JF,Pöschly,胃肠AA,Scheel D,Lee J:FLG22从Map激酶6中调节乙烯响应因子底物的释放拟南芥蒂利亚纳通过乙烯信号。美国国家科学院学报。2009年,106:8067 - 8072。10.1073 / pnas.0810206106。
- 13.
Zhang S:1-氨基环丙烷-1-羧酸合成酶MPK6的磷酸化,一种应力响应丝裂原活化蛋白激酶,诱导乙烯生物合成rabridopis..植物细胞。2004,16:3386-3399。10.1105 / TPC.104.026609。
- 14.
兰帕德GR,马卡利斯特CA,伯格曼DC:拟南芥气孔启动由MAPK介导的BHLH介导的调节控制。科学。2008,322:1113-1116。10.1126 / Science.1162263。
- 15.
Gudesblat GE,IUSEM ND,Morris PC:保护细胞特异性抑制拟南芥MPK3表达导致异常的气孔响应对脱落酸和过氧化氢。新植物。2007,173:713-721。10.1111 / J.1469-8137.2006.01953.x。
- 16.
Walia A,Lee Js,Wastiensy G,Ellis B:拟南芥丝裂原活化蛋白激酶MPK18介导皮质微管功能在植物细胞中。工厂J. 2009,59:565-575。10.1111 / J.1365-313x.2009.03895.x。
- 17.
王H,Liu Y,Bruffett K,Lee J,Hause G,Walker JC,Zhang S:MPK3中MPK3中的HAPLO不足,突变背景揭示了这两张Mapks的新功能拟南芥胚珠发育。植物细胞。2008,20:602-613。10.1105 / TPC.108.058032。
- 18.
Miao Y, Laun TM, Smykowski A, Zentgraf U:拟南芥Mekk1可以缩短切割:它可以直接与衰老相关的Wrky53转录因子进行蛋白质水平,可以与其启动子结合。植物mol biol。2007,65:63-76。10.1007 / s11103-007-9198-z。
- 19。
杨勇:水稻MAP激酶基因家族的分子分析Magnaporthe Grisea.感染。植物营养与肥料学报,2006,19(4):531 - 534。10.1094 / mpmi - 19 - 0530。
- 20。
水稻mapkinase基因OsBIMK1的克隆及表达分析。植物学报。2002,32(4):457 - 461。10.1007 / s00425 - 002 - 0794 - 5。
- 21。
Agrawal GK, Rakwal R, Iwahashi H:新型水稻的分离(奥雅萨苜蓿多胁迫反应型MAP激酶基因OsMSRMK2,其mRNA在环境提示下快速积累。生物化学学报。2002,29(4):497 - 503。10.1016 / s0006 - 291 x(02) 00571 - 5。
- 22.
Xiong L,Yang Y:水稻中的抗病和非生物胁迫耐受性通过脱钙酸诱导丝裂解剂活化蛋白激酶反向调节。植物细胞。2003,15:745-759。10.1105 / TPC.008714。
- 23.
温建强,黄建平,伊迈:两种新的丝裂原激活蛋白信号元件OsMEK1和OsMAP1参与水稻中低温信号通路。植物生理学报。2002,29(4):491 - 498。10.1104 / pp.006072。
- 24.
FU SF,Chou Wc,Huang Dd,Huang HJ:水稻丝裂解虫活化蛋白激酶基因的转录调节,osmapk4.,是对环境压力的反应。植物营养与肥料学报。2002,29(4):459 - 463。10.1093 /卡式肺囊虫肺炎/ pcf111。
- 25.
他C,Fong Sht,Yang D,Wang GL:BWMK1,通过真菌感染和水稻机械伤口诱导的新型地图激酶。Mol植物微生物相互作用。1999,12:1064-1073。10.1094 / mpmi.1999.12.12.1064。
- 26.
Lieberherr D,Thao NP,Nakashima A,UMEMURA K,Kawasaki T,Shimamoto K:由水稻中的小GTPAse OSRAC1和异映酰胺G-蛋白调节鞘脂素诱导丝裂解剂激活蛋白激酶。植物理性。2005,138:1644-1652。10.1104 / pp.104.057414。
- 27.
Kurusu T,Yagala T,Miyao A,Hirochika H,Kuchitsu K:识别推定的电压门控CA2+作为Elicitor诱导的过敏细胞死亡和丝裂剂激活蛋白激酶激活的频道作为水稻的关键调节器。工厂J. 2005,42:798-809。10.1111 / J.1365-313x.2005.02415.x。
- 28.
Agrawal GK, Agrawal SK, Shibato J, Iwahashi H, Rakwal R:新型水稻MAPK激酶OsMSRMK3和OsWJUMK1参与不同的环境胁迫和发育调控。中国生物化学学报。2003,30(3):457 - 461。10.1016 / s0006 - 291 x(02) 02868 - 1。
- 29.
Liu Y, Jin H, Yang KY, Kim CY, Baker B, Zhang S:烟草防御信号传导过程中两种丝裂原激活蛋白激酶的相互作用。Plant J. 2003, 34: 149-160。10.1046 / j.1365 - 313 x.2003.01709.x。
- 30。
AHLFORS R,MacioSzek V,Rudd J,Broschém,Schlichting r,Scheel d,kangasjärvij:延长激素独立于偶极活性蛋白激酶的核易位拟南芥蒂利亚纳在臭氧接触。植物学报,2004,40:512-522。10.1111 / j.1365 - 313 x.2004.02229.x。
- 31。
Singh R,Lee M,Lee J,Choi J,Park Jh,Kim EH,Yoo Rh,Cho J,Jeon J,Rakwal R,Agrawal GK,Moon JS,JWA N:米丝丝丝染蛋白激活蛋白激酶互乱蛋白酶分析使用酵母双混合系统。植物理性。2012,160:477-487。10.1104 / pp.112.200071。
- 32。
Lee J,Rudd JJ,MacioSzek VK,Scheel D:Mapk级联组件定位的动态变化控制致病性相关(公关)在欧芹先天免疫过程中的基因表达。中国生物医学工程学报。2004,27(3):434 - 434。10.1074 / jbc.M401099200。
- 33。
Raina SK,Wankhede DP,Jaggi M,Singh P,Jalmi Sk,Raghuram B,Sheikh Ah,Sinha Ak:CrMPK3,来自Catharanthus Roseus的丝裂原活化蛋白激酶及其在胁迫诱导的单萜类吲哚生物碱中的可能作用。BMC植物BIOL。2012,12:134-10.1186 / 1471-2229-12-134。
- 34.
Mehlmer N,Wurzinger B,Stael S,Hofmann-Rodrigues D,Csaszar E,Pfister B,Bayer R,Teige M:CA.2+-Dependent蛋白激酶CPK3是MAPK无关的盐应激适应所必需的拟南芥.工厂J.2010,63:484-498。10.1111 / J.1365-313x.2010.04257.x。
- 35.
Nakagami H,Kiegerl S,Hirt H:OMTK1,一种新颖的MAPKKK,通过直接MAPK交互通道氧化应力信号。J Biol Chem。2004,279:26959-26966。10.1074 / JBC.M312662200。
- 36.
王Q,剑才H,张T,张G,Lou Y:OSMPK3积极调节JA信号通路和植物抵抗水稻中的咀嚼食草动物。植物细胞批准。2013,32(7):1075-1084。10.1007 / s00299-013-1389-2。
- 37.
Sharma PC,ITO A,Shimizu T,Terauchi R,Kamouns,Saitoh H:Wipk和SiPK基因的病毒诱导的沉默降低了对细菌病原体的抗性,但对INF1诱导的过敏反应(HR)没有影响尼古利亚娜·宾夕法尼亚州.Mol Gen Genomics。2003,269:583-591。10.1007 / s00438-003-0872-9。
- 38.
Kishi-Kaboshi M, Okada K, Kurimoto L, Murakami S, Umezawa T, Shibuya N, Yamane H, Miyao A, Takatsuji H, Takahashi A, Hirochika H:一种水稻真菌mamp响应的MAPK级联调节代谢流以抑制微生物代谢产物的合成。植物学报,2010,63:599-612。10.1111 / j.1365 - 313 x.2010.04264.x。
- 39.
何锡文:植物气孔功能对细菌入侵的影响。细胞。2006,126:969-980。10.1016 / j.cell.2006.06.054。
- 40。
关键词:番茄矮缩病毒,p19蛋白,基因沉默,瞬时表达植物学报,2003,33:949-956。10.1046 / j.1365 - 313 x.2003.01676.x。
- 41。
Giri J,Vij S,Dansana PK,Tyagi AK:含有应力相关蛋白(SAP1 / 11)的水稻A20 / AN1锌 - 手指和受体样细胞质激酶(OSRCCK253)通过A20锌 - 手指相互作用并赋予非生物应力耐受性在转基因拟南芥植物中。新植物。2011年,191:721-732。10.1111 / J.1469-8137.2011.03740.x。
- 42。
Rao KP, Vani G, Kumar K, Wankhede DP, Misra M, Gupta M, Sinha AK:砷胁迫激活水稻根和叶中的MAP激酶。中国生物化学学报。2011,32(6):593 - 598。10.1016 / j.abb.2010.11.006。
- 43。
Anderson JC, Pascuzzi PE, Xiao F, Sessa G, Martin GB:宿主介导的III型效应因子AvrPto的磷酸化促进假单胞菌毒物和番茄中的失汗。植物细胞。2006,18:502-514。10.1105 / TPC.105.036590。
确认
作者承认奥地利格拉茨大学T. Roitch教授提供假单胞菌含油pv。Tabaci.压力。感谢NIPGR共聚焦显微镜设备提供的技术帮助。AHS和PS感谢印度科学和工业研究理事会;BR和SKJ感谢印度生物技术部门;DPW感谢大学资助委员会和印度国家植物基因组研究所的资助。这项工作得到了印度新德里生物技术系国家植物基因组研究所的核心资助。
作者信息
隶属关系
通讯作者
附加信息
利益争夺
两位作者宣称他们没有相互竞争的利益。
作者的贡献
AHS进行了所有实验,并写了稿件的第一个草案。AHS和AKS分析了数据。SKJ表达无标签的OSMPK3蛋白,并帮助AHS在病原体感染分析中。RR和DPW在AD和BD酵母载体中克隆了各种MAPK基因。PS进行了FRET测定。rr,skj,dpw和ps参加了稿件的写作。AKS构思了这个想法,监督了该项目并编写了稿件的最终草案。所有作者阅读并认可的终稿。
电子补充材料
瞬时转化基因在
附加文件1:尼科尼亚塔哈瓦姆树叶。为了确认在烟叶中的农业渗透基因构建体的表达,使用OSMPK3和OSMPK20-4特异性引物进行渗透区域的CDNA制剂的半定量RT PCR。(JPEG 488 KB)
瞬时转化的OSMPK3-MYC和OSMPK20-4-HA标记基因的蛋白质表达
附加文件2:抽烟者tabaccum。使用抗C-MYC抗体和抗HA抗体后48小时后进行免疫印迹(IB)。将相同的提取物用作图中所示的数据的输入3.A. (jpeg241kb)
OSMPK3和OSMPK20-4的细菌表达及纯化。
附加文件3:一种,OSMPK3在PPAL7(BiORAD)中克隆,转化和诱导BL21细胞中1mm IPTG,最后纯化标签B.,OSMPK20-4被克隆到PET21C表达载体(NOVAGEN)中,转化为BL21细胞,诱导1mM IPTG并使用Ni NTA琼脂糖珠(QIAGEN)纯化。(JPEG 48 KB)
水稻MPSS数据库显示生物胁迫下OsMPK20-4和OsMPK3的相关表达。
附加文件4:在60天成熟的水稻叶片、根和分生组织中,观察到两种OsMAPKs基因的相关表达M. Greisea.感染。9LA, 9LC, 9LD象征成熟叶片上的感染。9ME象征分生组织,9RO和9RR象征成熟的根。同样,FLA和FLB代表f1杂种成熟叶片,FRO和FRR代表f1杂种成熟根系的侵染反应。来源:http://mpss.udel.edu/in9311/mpss_index.php..(JPEG 32 KB)
作者为图像提交的原始文件
权利和权限
开放获取本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0.)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
谢赫,A.H.,Raghuram,B.,Jalmi,S.K.等等。两种水稻丝裂原激活蛋白激酶的相互作用及植物防御中可能作用。BMC植物杂志13,121(2013)。https://doi.org/10.1186/1471-2229-13-121
已收到:
公认:
发表:
关键词
- MAP激酶
- 蛋白质 - 蛋白质相互作用
- 假单胞菌皂苷PV。Tabaci.
- 米
- 酵母双杂交测定