摘要
背景
纹理是面包小麦最重要的特征之一(小麦l .)。Puroindoline-D1基因在控制面包小麦籽粒质地方面起着主要作用,并与面包小麦的碾磨和加工品质密切相关。
结果
采用一系列诊断性分子标记和dCAPS标记进行鉴定Pina-D1而且Pinb-D1gydF4y2Ba来自不同地理位置的493个小麦品种。引物行走策略用于在DNA水平上表征PINA-null等位基因。结果表明,中国地方民族共有12个不同的民族Puroindoline-D1等位基因组合的多样性最高,而CIMMYT小麦品种包含3个不同的等位基因组合Puroindoline-D1等位基因组合在五个国家的小麦品种中表现出最低的多样性。两个小说Pina-D1等位基因,指定Pina-D1s有4422个bp的缺失Pina-D1u有6460bp的缺失哈(硬度)位点,在DNA水平上采用引物行走策略进行鉴定,并进行相应的分子标记Pina-N3而且Pina-N4是为了直接鉴别Pina-D1s而且Pina-D1u等位基因。的关联分析Puroindoline-D1籽粒结构等位基因表明小麦品种具有Pina-null / Pinb-null等位基因,具有大约33 kb的删除哈在本研究中使用的不同基因型中,基因座的SKCS硬度指数最高。此外,PINA-null等位基因的小麦品种SKCS硬度指数显著高于普通小麦品种Pinb-D1b而且Pinb-D1p等位基因。
结论
分子特性Puroindoline-D1对来自5个地理区域的面包小麦品种的等位基因进行了研究,发现了两个新的等位基因-Pina-D1s而且Pina-D1u.为这两个等位基因开发了分子标记。的关联分析Puroindoline-D1带PINA-null等位基因的品种具有较高的SKCS硬度指数。本研究可为改良小麦品质提供有用的信息,并对控制面包小麦籽粒质地的分子和遗传过程有更深入的了解。
背景
谷物质地是决定面包小麦最终用途的最重要特性之一(小麦l .)。众所周知,晶粒的织构主要是由哈(硬度)在5D染色体的短臂上,即使哈在面包小麦同源第5组染色体上鉴定了位点[1].相比之下哈在5AS和5BS染色体上的基因座哈5DS染色体上的基因座有三个特殊的基因-Puroindoline一(Pina-D1),Puroindoline b(Pinb-D1gydF4y2Ba),颗粒柔软蛋白(Gsp-1).Puroindoline基因已被证明在调节面包小麦的籽粒质地方面起着关键作用[2- - - - - -4].然而,所采用的机制Puroindoline软化胚乳的基因仍然未知。此外,Gsp-1基因在决定晶粒织构方面没有显著作用[5,6].
的Pina-D1而且Pinb-D1gydF4y2Ba基因被证明编码小麦胚乳特有的脂质结合蛋白,具有独特的富含色氨酸的结构域,这被认为是小麦胚乳的强亲和力的原因Puroindoline-D1从蛋白质到极性脂质。的Puroindoline-D1除了四倍体之外,几乎所有的小麦及其二倍体祖先以及相关物种中都发现了基因小麦属植物物种(7].两个野生型Pina-D1而且Pinb-D1gydF4y2Ba等位基因产生软胚乳,而突变Pina-D1或Pinb-D1gydF4y2Ba面包小麦胚乳硬化的结果[8- - - - - -10].自从第一次报道突变Puroindoline-D1在面包小麦[2],许多自然突变Pina-D1而且Pinb-D1gydF4y2Ba基因已经被发现(即Pina-D1b~t而且Pinb-D1b~交流等位基因(见[11- - - - - -13)))。所有这些突变在面包小麦中产生硬胚乳Puroindoline-D1等位基因也与小麦品质的差异有关[14- - - - - -16].在大多数地理区域,面包小麦品种与Pinb-D1b等位基因在面包小麦中占主导地位,但也有一些例外,例如PINA缺失是CIMMYT(国际玉米和小麦改良中心)面包小麦品种中最常见的等位基因[17),Pinb-D1p在中国长地栽培品种中普遍存在[18,19].此外,PINA-null等位基因的品种胚乳比PINA-null等位基因的品种胚乳坚硬Pinb-D1b[14,18,20.- - - - - -22],从铣削的角度来看,前者可能不太可取。最近,一群新奇的Pinb-2变量描述如下Pinb类基因[23- - - - - -25]证明了不能显著促进晶粒软化时,与Puroindoline-D1基因(26,27]也与Mohler等人调查的一些质量特征没有密切联系。[28].
六倍体小麦有29 kb的小哈D基因组中的基因座比其二倍体供体的基因座要高Ae。tauschii,主要是由于转座因子插入和不合法重组导致的两次大缺失(Chantret et al. [1])。这是可能的,一个大的删除Pina-D1b等位基因发生在DD基因组之后Ae。tauschii进化成面包小麦的AABBDD基因组。与野生型相比Pina-D1b等位基因有15380 -bp的缺失,包含大部分的Pina-D1编码区[29].的Pina-D1r有一个10,415 bp的删除包含整个碧娜编码区,并在中国和日本本土种中均有发现[30.,31].两个相应的分子标记(Pina-N1而且Pina-N2),它们跨越了删除,是为了直接识别Pina-D1b而且Pina-D1r等位基因。
中国是世界上最大的面包小麦生产国和消费国,也是面包小麦的二级产地中心,拥有高度多样化的小麦种质资源。在中国十个农业生态区中,覆盖河南省在内的8个省的黄淮小麦产区是最大、最重要的小麦产区,占全国小麦总收获面积的45%,小麦总产量的48% [32].同时,黄淮流域是中国面包小麦的次要产地中心之一,在该地区收集或开发了大量地方品种,其中一些品种在提高小麦产量方面发挥了重要作用。此外,为了提高小麦的遗传多样性,避免种质同质化,从国外(如国际小麦改良中心、澳大利亚、美国和欧洲)引进或交换了大量国际种质资源用于本地区小麦育种。本研究的主要目的是调查Puroindoline-D1为了进一步研究PINA-null等位基因的分子机制,并为小麦育种提供一种基于pcr的分子标记方法。
方法
植物材料
以204个中国地方小麦品种、104个CIMMYT品种、88个澳大利亚品种、53个智利品种和44个荷兰品种为研究对象,对493个面包小麦品种和先进品系进行了SKCS (Single Kernel Characterization System)硬度和硬度的鉴定Puroindoline-D1基因。这些品种或先进系是河南农业大学种子库从世界各地交换或引进的,具有某些或多项优良农艺性状,在黄淮地区小麦育种中被广泛应用。本研究调查的所有品种均于2009-10和2010-11种植季在河南农业大学郑州科研教育中心种植,在当地使用中国土种配套网的管理措施下生长良好。我们根据每个品种的成熟度在不同的阶段进行收割,以确保每个品种都完全成熟。
7个近等基因系(NILs)具有不同的Puroindoline-D1等位基因(Pina-D1b,Pinb-D1b,Pinb-D1c,Pinb-D1d,Pinb-D1e,Pinb-D1f而且Pinb-D1g),由中国农业科学院夏先春教授提供,于2011-2012种植季分别在郑州和周口种植,用于进一步考察Puroindoline-D1籽粒纹理上的等位基因。这些品系是在华盛顿普尔曼的USDA-ARS西部小麦质量实验室开发的。NILs是由拥有独特基因的供体双亲杂交而成Puroindoline一而且Puroindoline b基因单倍型为软白春小麦品种Alpowa的雄性。进行了7次回交,使每个NIL的一般谱系为:Alpowa/供体亲本//7*Alpowa [33].
根据制造商的操作程序(Perten Instruments North America Inc., Springfield, IL),用Perten单核表征系统(SKCS) 4100测量所有小麦品种和高级品系的籽粒硬度指数。利用SKCS硬度数据的平均值、标准差(SD)和分布将品种分为“软”、“混合”和“硬”类型。
DNA提取及PCR参数
按照Chen等人的方法,分别从三粒粉粒中提取所调查的每个硬小麦品种的基因组DNA。[24].来自幼苗的基因组DNA用于标记物发育或引物行走策略[18].PCR扩增在PTC-200 Peltier Thermocycler或ABI 9700中进行,反应浓度为25 μl, 100 ng基因组DNA,每个引物10 pmol,每个dNTP混合物200 μM, 1×TaqDNA聚合酶反应缓冲液,1.5 μM MgCl2, 0.5个单位TaqDNA聚合酶。循环条件为94°C持续5分钟,然后在94°C持续50秒,50°C至65°C持续50秒的35个循环(引物特定退火温度,见表)1), 72°C保温1分钟,72°C保温10分钟。所有PCR产物经1.5%琼脂糖凝胶电泳分离,并用溴化乙锭染色,并在紫外光下观察。
基因分型的Puroindoline-D1面包小麦中的等位基因
随机选取5个软质小麦品种进行直接测序碧娜而且Pinb引物组Pina-D和Pinb-D的基因(表1)因为它们都应该是野生型的Puroindoline-D1基因,即。Pina-D1a / Pinb-D1a.我们从这项研究中删除了所有的混合小麦品种,因为它们可能包含一个以上的基因型。17,34].
对于基于SKCS分类的硬小麦品种,我们首先用引物组Pina-D(含整Pina-D1编码区)和pin - d(含整Pinb-D1gydF4y2Ba编码区1的期望片段,即第一组Pina-D1而且Pinb-D1gydF4y2Ba,第二组只有预期Pinb-D1gydF4y2Ba片段和第三组没有任何预期的片段Pina-D1而且Pinb-D1gydF4y2Ba基因。在第一组中Pinb-D1b该等位基因最初由一对对等引物Pinb-D1b1和Pinb-D1b2鉴定[3.].Pinb-D引物组扩增的PCR产物经限制性内切酶酶切PvuII而且Pf1MI用以识别Pinb-D1c而且Pinb-D1p分别采用Lillemo和Morris [9]和李等人。[19].对于该组其他品种,用Pina-D和Pinb-D引物扩增的PCR产物由中国诺赛基因工程有限公司(http://www.sinogenomax.com/)和基因型通过与已知的任何一种进行比对来确认Puroindoline-D1等位基因或NCBI爆炸网站(http://blast.ncbi.nlm.nih.gov/).
在II和III组中,我们之前开发的Pina-N1和Pina-N2标记[29,30.]首先被用来识别Pina-D1b而且Pina-D1r引物行走策略分别使用等位基因和其他剩余品种。
dCAPS标记的研制
虽然Pina-D1l而且Pina-D1n等位基因是在以前的研究中发现的[8,18,30.],则不存在有效的检测标记。这促使我们建立了dCAPS(衍生裂解扩增多态性序列)技术作为检测方法。两组引物用于扩增品种中含有SNPs的片段Pina-D1l或Pina-D1n等位基因设计使用dCAPS Finder 2.0 (http://helix.wustl.edu/dcaps/dcaps.html)软件,连同适当的酶[35].限制酶巴厘岛而且BsrDI直接消化BalI_Pina-D1l和BsrDI_Pina-D1n引物组扩增的PCR产物(表1),分别用于检测Pina-D1l而且Pina-D1n等位基因。具有176 bp和124 bp消化片段的品种属于Pina-D1n而且Pina-D1l分别等位基因。
引物行走策略
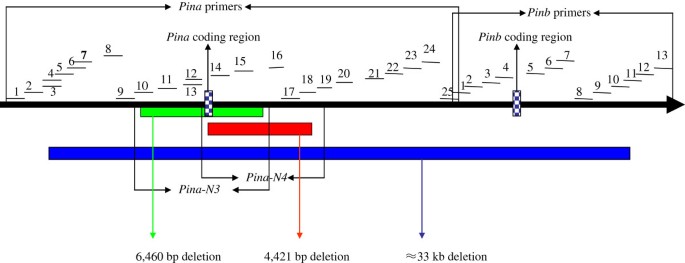
的序列Ha-5D利用NCBI的基因座(CT009735)设计基因特异性引物碧娜而且Pinb再次编码区域Ha-5A(CT009586)和Ha-5B(CT009585)位点。总共38对引物集,横跨大约40 kb的区域(表1)设计在- 10,386 bp之间(参考碧娜基因)+ 11447 bp(参照该基因的ATG)Pinb基因)为引物行走策略,以说明缺乏引物的栽培品种的分子机制碧娜基因或两者兼有碧娜而且Pinb基因(图1).根据PCR扩增失败或成功的情况,推导出每个缺失片段的大小和位置,设计出跨越估计缺失片段的新引物,直接扩增待测样品(见图中示意图)2).对扩增成功的PCR产物进行测序,得到缺失的准确大小和位置。
序列的排序和比对
利用快速DNA提取试剂盒从凝胶中纯化目标片段™(豆类,http://www.takara.com.cn/).然后将产物连接到pGEM-T Easy载体中并转化为Escherchia杆菌DH-5α压力。利用质粒快速分离试剂盒提取菌落PCR检测到目标片段的质粒™(Biodev-tech公司,http://biodevtech.tech-food.com/).每个样本的5个克隆均由中国诺赛基因组有限公司测序。
使用DNAMAN Version 6.0对序列进行分析和多次比对,并使用Chromas Version 1.4.5和FinchTV Version 1.4.0对图形数据进行分析,以验证测序结果的可靠性。
统计分析
采用SPSS (Statistical Product and Service Solutions) 19软件与LSR (least significant ranges)多重比较以及Excel 2003软件计算SKCS硬度指数的平均值和标准差,并检验各指标间的统计学意义Puroindoline-Dl等位基因。
结果
的分布Puroindoline-D1五个国家面包小麦品种的等位基因
根据SKCS硬度指数和分布,在调查的493个小麦品种和优良品系中,分别有139个和354个被划分为软基因型和硬基因型。139个软质小麦品种被认为具有野生型Puroindoline-D1单体型(Pina-D1a / Pinb-D1a) [4,11- - - - - -13].这表明,在调查的中国地方品种和墨西哥、澳大利亚、智利和荷兰品种中,硬小麦占主导地位,而软小麦在调查的中国地方品种中也有较高的分布,占39%。
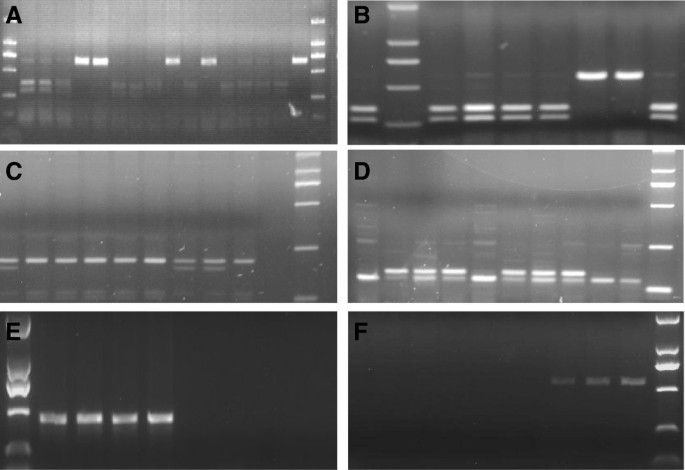
本研究中所有354种硬小麦都进行了基因分型Puroindoline-D1等位基因。等位基因特异性引物PCR扩增,限制性内切酶消化结果PvuII而且Pf1MI测序结果表明,354个硬小麦品种中有105个、4个和47个品种具有该基因Pinb-D1b,Pinb-D1c而且Pinb-D1p等位基因(图2一个,2分别B)。基于我们之前开发的分子标记的检测[29,30.],属129个,属21个Pina-D1b而且Pina-D1r分别等位基因。对于其余48个品种,我们尝试扩增其编码区碧娜而且Pinb引物为Pina-D和Pinb-D的基因(表1).然后我们对所有的碧娜而且Pinb扩增片段完整的15个品种的基因。与报道序列的比对结果Puroindoline-Dl等位基因分别为3、4、6、1、1个品种Pina-D1l,Pina-D1n,Pinb-D1d,Pinb-D1q而且Pinb-D1t分别等位基因。开发了两种新的dCAPS标记用于识别Pina-D1l而且Pina-D1n等位基因(图2C,2D),以便在将来有效地检测它们,因为它们经常出现在中国的地方。限制性内切酶巴厘岛而且BsrDI用来消化引物扩增的PCR产物巴厘岛-Pina-D1l和BsrDI-Pina-D1n(表1),以侦测Pina-D1l而且Pinb-D1n分别等位基因。
小说发现Puroindoline-D1等位基因
为了进一步阐明其余33个品种中两者缺位的分子机制碧娜或碧娜&Pinb,一系列引物(表1)的编码区碧娜而且Pinb基因。基于引物行走策略,我们发现在两个中国地方品种大红莽和葫芦头中,引物组通过Pina-1 ~ Pina-13和Pina-19 ~ Pina-25可以获得扩增子,而通过Pina-14 ~ Pina-18则没有扩增出预期片段(表2)2).一种新的分子标记Pina-N3开发了跨越缺失片段来鉴定该新等位基因,然后在这两个品种中成功扩增了440 bp的片段(图2E). 440 bp片段测序结果显示,在+371 - 4792 bp有4422 bp缺失(参考ATG of碧娜)与大红芒和葫芦头的差异有显著性哈中国春5DS染色体序列(NCBI号:CT009735)。该突变有4422 bp的缺失碧娜基因可以被指定为Pina-D1s(表3.),根据2007年《小麦基因目录增刊》的命名方法[36,37]、Morris和Behave [13]和Behave和Morris [11,12].此外,新的标记Pina-N3被用来识别Pina-D1s结果表明,28个中国地方品种具有等位基因Pina-D1s等位基因,这表明Pina-D1s在调查的中国地方品种的硬小麦中普遍存在。
但利用新标记筛选后,仍有4个品种剩余Pina-N3,即一个长地品种Zuantoubaike碧娜基因和3个地方品种玉麦、常瑶麦和杨青科均缺失碧娜而且Pinb基因。引物步行策略的结果表明,引物组Pina-1 ~ Pina-9、Pina-16 ~ Pina-25均能扩增出目标片段,而引物组Pina-10 ~ Pina-15未扩增出目标片段2).一种新的分子标记Pina-N4开发了跨越缺失片段对该新等位基因进行鉴定,并在钻头贝克中成功获得了524bp的片段,而在其他品种中无法扩增目标条带(图2F). 524 bp片段的测序结果显示,从−4435 bp到2024,缺失6460 bp(参考ATG of the碧娜),当与哈中国春5DS染色体序列(NCBI号:CT009735)。该突变有6460 bp的缺失碧娜基因可以被指定为Pina-D1u(表3.)按上述命名法。
4个栽培品种无碧娜而且Pinb荷兰小麦品种Pcatan和中国地方品种玉麦、长瑶麦和杨青科的基因只有Pina-1 ~ 3和Pinb-9 ~ Pinb-13引物组才能获得预期的片段大小。因此,一个大约33 kb的删除片段包含碧娜而且Pinb与其他地方的编码区相比,可以推断出这三个地方的编码区哈中国春5DS染色体序列(表3.,图1).然而,由于与基因的高度相似,没有获得跨越这一大缺失的用于指定新等位基因位置的有效标记哈即使设计了几个跨越该缺失的引物集,也可以在该区域找到A和B基因组的位点。该突变含有一个≈33 kb的缺失碧娜而且Pinb编码区域被临时指定为Pina-null / Pinb-null由于删减较多同时相关碧娜而且Pinb基因。在以往的报告中[6,45],部分栽培品种已发现缺乏碧娜而且Pinb编码区域,指定Pina-D1k莫里斯及巴韦[13].然而,Pina-null / Pinb-null在本研究中仍用于描述该等位基因,因为尚不清楚上述四个品种在DNA水平上是否与Pina-D1k等位基因。
的分布Puroindoline-D1等位基因及其与籽粒质地的关系
在不同国家的硬栽培品种中,中国地方品种的多样性最高Puroindoline-D1基因,并拥有11种Puroindoline-D1硬小麦地方品种的等位基因(表4).CIMMYT硬质小麦,只由两种组成Puroindoline-D1等位基因的多样性在四个受调查国家中最低Pina-D1b占主导地位,高达94.6%,这与以往的研究一致[14,17].在澳大利亚和荷兰的小麦品种中,Pinb-D1b以高比例为主,分别为73.6%和56.7%。在智利,Pina-D1b而且Pinb-D1b在硬小麦品种中几乎均匀分布。令人惊讶的是,6个品种中有4个具有稀缺等位基因Pinb-D1d显示相对优越的加工质量[15]在荷兰被发现。Pinb-D1p只在中国地方人种中发现并普遍存在(表4).值得注意的是,根据5个籽粒的结果,一个中国地方品种白老来变具有双突变基因型Pina-D1r / Pinb-D1p其SKCS硬度指数为73.2。
在本研究中,我们将所有调查的中国地方品种分为两组,并引入品种进行相关性分析Puroindoline-D1由于二者在农艺性状上存在明显差异,具有粒状结构的等位基因。对中国地方品种和引种品种的SKCS硬度指数进行了2年平均比较,尽管在已有报道的基础上,籽粒质地具有80%以上的高遗传力,但不同基因型间的差异显著。在中国地方品种中,栽培品种具有Pina-null / Pinb-null等位基因具有最高的SKCS硬度指数在几个基因型(表5).因为两者缺一不可Pina-D1而且Pinb-D1gydF4y2Ba这些品种具有与硬粒小麦相似的纹理,同时具有极高的SKCS硬度指数。三种类型Pina-D1导致PINA蛋白缺失的突变在SKCS硬度上无显著差异,但SKCS硬度均显著高于PINA蛋白缺失的突变Pinb-D1b基因型(表5).在引进品种中,PINA-null和PINB-D1c基因型的SKCS硬度明显高于PINB-D1b和PINB-D1d基因型,这与Morris等的结果一致。[10],表明PINB-D1c基因型的SKCS硬度显著高于PINB-D1b基因型。
为了进一步研究的影响Puroindoline-D1等位基因在籽粒纹理上获得干净的联想Puroindoline-D1等位基因与SKCS硬度在基因组中不受其他位点影响,7个近等基因系具有不同Puroindoline-D1用等位基因比较它们的SKCS硬度指数(表5).结果表明,在七个不同的硬基因型中,PINA-null基因型具有最高的SKCS硬度,而PINB-D1b和PINB-D1d基因型具有最低的SKCS硬度5).这些结果与上述中国地方品种和引种小麦品种的结果一致。
讨论
纹理,这主要是由控制Puroindoline-D15DS染色体上的基因,对面包小麦的碾磨和加工品质有重要影响(小麦l .)。这两种基因都有突变Pina-D1或Pinb-D1gydF4y2Ba根据许多研究发现,等位基因导致面包小麦胚乳坚硬Puroindoline-D1等位基因。然而,以前在面包小麦中发现的大多数突变都是由一种单核苷酸多态性(SNP)引起的Pinb-D1gydF4y2Ba或Pina-D1基因。在这项研究中,我们发现不同的突变发生在哈面包小麦的基因座,以大缺失的形式出现,包括全部或部分缺失Pina-D1编码区,导致PINA-null等位基因。从长远来看,缺乏一个直接的标记来识别PINA-null等位基因导致我们开发了一个Pina-N1检测标记Pina-D1b等位基因(29].
以前最常用的检测方法Pina-D1b等位基因是用来检测PINA蛋白是否存在的,但是这种方法不能在DNA水平上识别PINA-null等位基因的状态。因此,几乎所有的PINA-null等位基因都被考虑为Pina-D1b等位基因(17,18,39,46].然而,我们的研究结果表明,PINA-null等位基因在DNA水平上具有完全不同的分子特征。PINA-null (Pina-D1b等位基因是CIMMYT面包小麦品种中最普遍的基因型[14,17].在本研究中,所有被调查的CIMMYT小麦的PINA-null等位基因都显示具有Pina-D1b等位基因。四种分子标记(Pina-N1而且Pina-N2我们之前开发的;Pina-N3而且Pina-N4在本研究中)将有助于直接和有效地鉴定面包小麦品种的pina缺失等位基因。
到目前为止,有很多Pina-D1而且Pinb-D1gydF4y2Ba等位基因已在世界各地不同地理位置的面包小麦品种中鉴定出来。在不同国家或地区中,中国的面包小麦种质资源在籽粒质地基因型上似乎较为多样化Puroindoline-D1等位基因(10,17,18,47因为几乎所有的Puroindoline-D1以前在中国以外的国家或地区报道过的等位基因在中国小麦品种中也有发现Puroindoline-D1到目前为止,等位基因似乎是中国小麦品种所特有的。Pinb-D1p,Pinb-D1q,Pinb-D1t,Pinb-D1u,Pinb-D1v,Pinb-D1w,Pinb-D1x,Pinb-D1aa,Pinb-D1ac,Pina-D1m,Pina-D1n,Pina-D1p,Pina-D1q, Pina-D1r等。18,20.,34,41,42,44].在本研究中,中国地方种也表现出最高的多样性Puroindoline-D1五个不同国家小麦品种间的等位基因。由于PINA-null等位基因,这可能是由六倍体小麦进化而来Ae。tauschii[30.,31], PINA-null等位基因的分子机制已通过已知分子标记或引物行走策略得到阐明。发现Pina-D1v而且Pina-D1u显示五种类型的PINA-null等位基因(Pina-D1b,Pina-D1s,Pina-D1r,Pina-D1v而且Pina-D1u)有不同的删除位点,这表明这些删除可能是独立发生的。根据以往的报告[1,7,10,22]和最近的工作Puroindoline-D1基因在Ae。tauschii(个人与华盛顿州立大学Craig F. Morris交流),上述五种情况Pina-D1等位基因在Ae。tauschii到目前为止,建议大幅度删去上面的内容Pina-D1等位基因可能发生在六倍体小麦的形成过程中。有趣的是,所有来自CIMMYT、澳大利亚、荷兰和智利的PINA-null等位基因的小麦品种都被进一步鉴定为Pina-D1b等位基因,而PINA-null等位基因的中国地方人种具有4个不同的等位基因Pina-D1s,Pina-D1r,Pina-D1v而且Pina-D1u,这可能是因为中国是世界上六倍体小麦的二次起源中心。
黄淮流域是中国最大、最重要的小麦产区,对国家粮食安全保障负有重要责任。然而,在过去十年中,该地区的小麦产量和质量并没有显著改善。一个潜在的原因主要是因为现代小麦品种的狭窄遗传基础严重阻碍了小麦产量的维持和提高,这是由于遗传均匀的品种在潜在的新的生物和非生物胁迫下迅速脆弱。为了改善这一现状,大量外来小麦种质被引进到中国黄淮小麦产区。尽管我们之前已经报道了黄淮小麦产区的小麦品种Puroindoline-D1等位基因(30.],本研究主要针对黄淮小麦产区育种过程中正在或曾经是核心亲本的地方品种和引种品种进行调查。Chen等人以前使用的栽培品种[30.]主要为历史品种和现代品种,本研究排除了我们之前使用的所有品种。因此,在当前和以往的[30.]的研究可以更全面地了解小麦种质资源,特别是考虑到黄淮小麦产区的籽粒质地,为小麦育种提供潜在的亲本。
结论
在本研究中,分子表征Puroindoline-D1对来自5个地理区域的面包小麦品种进行了等位基因研究。两个新的等位基因Pina-D1s而且Pina-D1u在Pina-D1利用引物游走策略在DNA水平上对基因座进行了鉴定,并建立了相应的分子标记对这两个等位基因进行了直接鉴定。的关联分析Puroindoline-D1籽粒结构等位基因表明小麦品种具有Pina-null / Pinb-null在不同基因型中,PINA-null等位基因的SKCS硬度指数最高,且无PINA-null等位基因的小麦品种SKCS硬度指数显著高于无PINA-null等位基因的小麦品种Pinb-D1b而且Pinb-D1p等位基因。
缩写
- SKCS:
-
单核表征系统
- 哈:
-
硬度
- Pina-D1:
-
Puroindoline d1
- Pinb-D1:
-
Puroindoline b-D1
- Gsp-1:
-
颗粒柔软蛋白
- 国际玉米和小麦改良中心:
-
国际玉米和小麦改良中心
- dCAPS:
-
衍生裂解扩增多态性序列
- 聚合酶链反应:
-
聚合酶链反应
- SNP:
-
单核苷酸多态性
- 零:
-
Near-isogenic线。
参考文献
- 1.
Chantret N, Salse J, Sabot F, Rahman S, Bellec A, Laubin B, Dubois I, Dossat C, Sourdille P, joudreyer P, Gautier MF, Cattolico L, Bechert M, Aubourg S, Weissenbach J, Caboche M, Bernard M, Leroy P, Chalhoub:形成进化事件的分子基础硬度二倍体和多倍体小麦品种的基因座(小麦属植物而且山羊草属).植物学报,2005,17:1033-1045。10.1105 / tpc.104.029181。
- 2.
吉鲁MJ,莫里斯CF:嘌呤吲哚林b的甘氨酸到丝氨酸的变化与小麦籽粒硬度和低水平的淀粉表面脆性有关。应用理论,1997,32(3):357 - 364。10.1007 / s001220050636。
- 3.
王晓明,王晓明,王晓明,等。小麦籽粒硬度的研究进展。华北农学报,1998,29(3):366 - 366。10.1073 / pnas.95.11.6262。
- 4.
purroindolines:小麦籽粒硬度的分子遗传基础。中国生物医学工程学报,2002,23(3):344 - 344。
- 5.
Gollan P, Smith K, Bhave M: Gsp-1基因在小麦中是一个多基因家族,表现出序列多样性和保护性的独特组合。粮食科学,2007,45:184-198。10.1016 / j.jcs.2006.07.011。
- 6.
小麦籽粒硬度相关基因的替换和缺失及其对籽粒质地的影响。作物科学,2002,42:1812-1817。10.2135 / cropsci2002.1812。
- 7.
Gautier MF, Cosson P, Guirao A, Alary R, Joudrier P:嘌呤吲哚林基因在二倍体祖先小麦及其近缘种中高度保守,而在四倍体中不存在小麦属植物物种。中国植物科学,2000,29(4):344 - 344。10.1016 / s0168 - 9452(99) 00258 - 7。
- 8.
王志强,王志强,王志强,等:缺乏嘌呤吲哚林的小麦品种遗传生化分析。中国农业科学,2004,18(3):457 - 457。10.1007 / s00122 - 004 - 1854 - y。
- 9.
Lillemo M, Morris CF:嘌呤吲哚林b的亮氨酸到脯氨酸突变经常出现在北欧的硬小麦中。应用理论,2000,100:1100-1107。10.1007 / s001220051392。
- 10.
Morris CF, Lillemo M, Simeone MC, Giroux MJ, Babb SL, Kimberlee KK:具有历史意义的北美春小麦和冬小麦中嘌呤吲哚胺粒硬度基因型的流行率。作物科学,2001,41:218-228。10.2135 / cropsci2001.411218x。
- 11.
Bhave M, Morris CF:嘌呤吲哚胺的分子遗传学及其相关基因:小麦和其他草类的等位基因多样性。中国生物医学工程学报,2008,26(3):344 - 344。10.1007 / s11103 - 007 - 9263 - 7。
- 12.
Bhave M, Morris CF:嘌呤吲哚胺及其相关基因的分子遗传学:表达调控、膜结合特性及应用。中国生物医学工程学报,2008,26(3):344 - 344。10.1007 / s11103 - 007 - 9264 - 6。
- 13.
Morris CF, Bhave M: d基因组嘌呤吲哚啉等位基因命名与当前DNA序列数据的和解。粮食科学,2008,48:277-287。10.1016 / j.jcs.2007.09.012。
- 14.
陈峰,何志华,陈丹生,张春林,夏晓春:嘌呤吲哚啉等位基因对普通春小麦碾磨、馒头、面条和平底面包的影响。粮食科学,2007,45:59-66。10.1016 / j.jcs.2006.06.006。
- 15.
马达元,张勇,夏晓春,何志华:不同嘌哚林b等位基因的普通小麦近等基因系的磨粉品质和中国生白面品质。粮食科学,2009,50:126-130。10.1016 / j.jcs.2009.03.006。
- 16.
Martin JM, Frohberg RC, Morris CF, Talbert LE, Giroux MJ:硬红春小麦碾磨和面包烘烤性状与嘌哚啉序列类型相关。作物科学,2001,41:228-234。10.2135 / cropsci2001.411228x。
- 17.
陈峰,夏晓春,陈芳,William M, Peña RJ, Trethowan R,何振华:CIMMYT面包小麦嘌呤吲胺粒硬度等位基因的研究。粮食科学,2006,44:86-92。10.1016 / j.jcs.2006.03.004。
- 18.
陈峰,何志辉,夏晓春,夏丽青,张晓霞,Lillemo M, Morris CF:中国地方品种和历史品种嘌呤吲哚啉a和b等位基因的分子生化特征。应用理论与实践,2006,29(4):344 - 344。10.1007 / s00122 - 005 - 0095 - z。
- 19.
李光宇,何志华,李雷默,孙庆霞,夏晓春:水稻等位基因变异的分子特征碧娜而且Pinb山东小麦地方品种、历史品种和现在品种的遗传位点。粮食科学,2008,47:510-517。10.1016 / j.jcs.2007.06.003。
- 20.
常超,张惠萍,徐娟,李文华,刘广峰,尤明松,李碧:利用改良变性PAGE技术鉴定小麦嘌呤吲哚胺基因的等位变异。《自然科学》,2006,29(3):344 - 344。10.1007 / s10681 - 006 - 9204 - 6。
- 21.
Giroux MJ, Talbert L, Habernicht DK, Lanning S, Hemphill A, Martin JM:硬红春小麦嘌呤吲哚啉序列类型与籽粒硬度的关系。作物科学,2000,40:370-374。10.2135 / cropsci2000.402370x。
- 22.
莫里斯CF,马萨AN:嘌呤吲哚林基因型美国国家标准与技术研究所参考物质8441,小麦硬度。中国农业科学,2003,30(4):344 - 344。10.1094 / CCHEM.2003.80.6.674。
- 23.
陈飞,比彻B,莫里斯CF:物理映射和一个新的变体Puroindoline b - 2小麦中的基因。应用理论与实践,2010,30(1):1 -7。10.1007 / s00122 - 009 - 1195 - y。
- 24.
陈峰,徐海霞,张飞,夏晓春,何志辉,王德伟,董志东,詹克辉,程晓霞,崔德强:硬粒小麦嘌呤吲哚林b-2基因的物理定位及一个新变异的分子特征(小麦属植物turgiduml .)。生物学报,2011,28:153-161。10.1007 / s11032 - 010 - 9469 - 2。
- 25.
王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明。小麦中嘌呤吲哚啉b基因的遗传定位。粮食科学,2008,48:722-728。10.1016 / j.jcs.2008.03.007。
- 26.
陈峰,张永飞,程晓霞,Morris CF,徐海霞,董志东,詹克勤,崔德强:中国科学院科学院Puroindoline b-B2面包小麦籽粒性状、产量组成和旗叶大小的变异(小麦L.)中国黄河和淮河流域的品种。粮食科学,2010,52:247-253。10.1016 / j.jcs.2010.06.001。
- 27.
耿HW, Beecher BS, He Z, Kiszonas AM, Morris CF: Puroindoline D1和b-2变异在美国太平洋西北小麦育种种质资源库中的流行及其与籽粒质地的关系。应用理论与实践,2012,29(1):1 - 7。10.1007 / s00122 - 011 - 1784 - 4。
- 28.
Mohler V, Schmolke M, Paladey E, Seling S, Hartl L: Puroindoline- d1和Puroindoline- b-2位点与欧洲冬小麦13个品质性状的关联分析(小麦l .)。作物学报,2012,56:623-628。10.1016 / j.jcs.2012.06.010。
- 29.
陈峰,张永飞,Morris CF,何志华,夏晓春,崔德强:分子特征分析puroindoline a-D1b面包小麦STS标记的基因型及开发(小麦l .)。粮食科学,2010,52:80-82。10.1016 / j.jcs.2010.03.006。
- 30.
陈峰,张飞,夏晓春,董志东,崔德强:黄淮地区面包小麦嘌呤吲哚林等位基因的分布及无PINA蛋白的嘌呤吲哚林a等位基因的发现。生物学报,2012,29:371-378。10.1007 / s11032 - 011 - 9553 - 2。
- 31.
池田田,丛华,铃木田,高中凯:亚洲普通小麦品种Pina零突变的鉴定。粮食科学,2010,51:235-237。10.1016 / j.jcs.2010.01.012。
- 32.
庄QS:中国小麦改良与系谱分析。北京:中国农业出版社,1-681。中文:2003。
- 33.
Morris CF, King GE:硬核嘌呤吲哚啉等位基因近等基因系六倍体小麦遗传种质的登记。植物学报,2008,2:67-68。10.3198 / jpr2007.02.0099crgs。
- 34.
陈峰,何志华,夏晓春,Lillemo M, Morris CF:中国冬小麦品种京东11号的嘌呤吲哚林b新突变。谷物学报,2005,42:267-269。10.1016 / j.jcs.2005.03.004。
- 35.
Neff MM, Neff JD, Chory J, Pepper AE: dCAPS,一种简单的单核苷酸多态性遗传分析技术:实验应用拟南芥遗传学。植物学报,1998,14:387-392。10.1046 / j.1365 - 313 x.1998.00124.x。
- 36.
McIntosh RA, Dubcovsky J, Rogers WJ, Morris C, Appels R,夏晓c:小麦基因符号目录:2009增刊。2009年,网上发表于:http://wheat.pw.usda.gov/ggpages/wgc/2009upd.html
- 37.
McIntosh RA, Devos KM, Dubcovsky J, Rogers WJ, Morris CF, Appels R, Anderson OD:小麦基因符号目录:2007增刊。2007年,网上发表于:http://wheat.pw.usda.gov/ggpages/wgc/2007upd.html
- 38.
Ramalingam A, Palombo EA, Bhave M:小麦Pinb-2基因是一个多基因家族,具有丰富的序列多样性和重要的变异。粮食科学,2012,56:171-180。10.1016 / j.jcs.2012.02.006。
- 39.
夏丽琴,陈峰,何志华,陈小明,Morris CF:中国冬小麦嘌呤吲哚林等位基因的发生。谷物化学,2005,82:38-43。10.1094 / cc - 82 - 0038。
- 40.
王志刚,王志刚,王志刚,王志刚。印度小麦品种Hyb65和Ni5439嘌呤吲哚林b基因的突变。植物生物化学学报,2005,14:45-48。10.1007 / BF03263224。
- 41.
陈峰,余玉霞,何志华,夏晓春:一个新的嘌呤吲哚林等位基因在云南特有小麦中的流行度(小麦。Yunnanense王)。中国生物科学,2007,29(3):344 - 344。10.1007 / s10681 - 006 - 9347 - 5。
- 42.
王军,孙建忠,刘大栋,杨伟力,王德伟,童亚平,张爱明:分析碧娜而且Pinb对中国小麦种质资源微核心种质的等位基因进行了研究,并鉴定出一个新的等位基因Pinb等位基因。粮食科学,2008,48:836-842。10.1016 / j.jcs.2008.06.005。
- 43.
王晓明,王晓明,王晓明,王晓明:小麦嘌呤吲哚啉等位基因的多态性及其对小麦品种的影响。中国农业科学,2008,29(3):379 - 379。
- 44.
王玲,李光元,夏晓春,何志华,穆佩萍:分子特征碧娜而且Pinb新疆地方小麦品种与商品小麦品种的等位基因变异。生态学报,2008,29(4):344 - 344。10.1007 / s10681 - 008 - 9706 - 5。
- 45.
池田TM, Ohnishi N, Nagamine T, Oda S, Hisatomi T, Yano H:小麦品种嘌呤吲哚啉新基因型及其蛋白产物的鉴定。粮食科学,2005,41:1-6。10.1016 / j.jcs.2004.10.002。
- 46.
阿亚拉M, Guzmán C, Alvarez J, Peña R:墨西哥小麦地方品种嘌呤吲哚林基因的遗传多样性特征。中国生态学报,2013,29(3):344 - 344。10.1007 / s10681 - 012 - 0773 - 2。
- 47.
甘蔗K, Spackman M, Eagles H: purroindoline基因及其对南澳大利亚小麦品种籽粒品质性状的影响。德国农业科学,2004,29(4):349 - 349。10.1071 / AR03108。
确认
本项目由国家自然科学基金(31370031、31000708)和973项目(2014CB138105、2009CB118300)资助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
FC和DC设计并准备了手稿。HL和FC进行表型和基因型鉴定,并参与引物行走策略。所有作者都阅读并批准了最终的手稿。
陈峰、李欢欢对这项工作也有同样的贡献。
权利和权限
本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用属性许可协议(http://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
陈峰,李华,崔东Puroindoline-D1来自五个国家的面包小麦基因(小麦l .)。BMC植物生物学13,125(2013)。https://doi.org/10.1186/1471-2229-13-125
收到了:
接受:
发表:
关键字
- 面包小麦(小麦l .)
- Puroindoline-D1基因
- 谷物纹理
- 底漆走
- 功能标记