摘要
背景
AGO (Argonaute)蛋白是RNA诱导沉默复合体(RISC)中转录调控或/和转录后调控的核心元件,参与植物发育过程和病毒防御,在小RNA的引导下抑制靶基因表达。此前,据透露,15推定前番茄基因组中的基因。
结果
在目前的研究中,15个检测到SlAGO基因,只SlAGO4C和SlAGO15在番茄的根、茎、叶、芽、花和果实中,经30次PCR均未检出。SlAGO7在果实早期(-2 dpa、0 dpa和4 dpa)均可检测到,但在花后6 d采集的果实中显著下调。此外,SlAGO5只能在生殖组织和SlAGO4D特别在水果中检测到。根据miRNA数据库的爆炸结果,3SlAGO基因与miR168 (SlAGO1A和SlAGO1B)或miR403 (SlAGO2A).5 ' RACE (fast amplification of cDNA ends)图谱用于检测cDNA的3 '裂解产物SlAGO信使rna。此外,还检测了SlAGO蛋白的亚细胞定位。结果表明,大多数SlAGO蛋白定位于细胞核和细胞质。重要的是,我们观察到了AGO蛋白的核膜定位。此外,突变的miR168互补位点SlAGO1A导致SlAGO1A的定位扩大,表明miR168调控了SlAGO1A的定位。
结论
我们的结果有助于证明这些新分离的潜在作用前在番茄发育过程中,证明了家族间的保守关系前这些基因和mirna可能在番茄发育和病毒防御中发挥重要作用。
背景
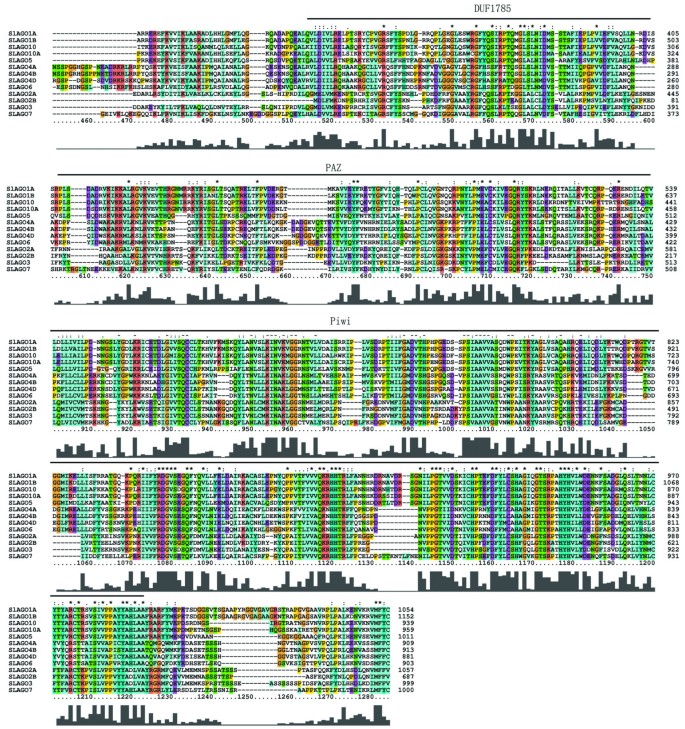
小rna调控了许多植物的发育和生理过程,包括器官极性、miRNA通路、叶和花的发育[1- - - - - -5]。真核生物产生了microRNA (miRNA)、小干扰rna (siRNA)、PIWI相互作用rna (piRNAs)、scanrna和21u - rna,这些小rna与AGO、PIWI和3组蛋白等AGO家族成员相关,发挥生物学功能[6- - - - - -9]。AGO蛋白在mirna的引导下,在互补位点识别靶基因,通过切割靶mrna抑制基因翻译,同时与mrna的帽状结构结合,在某些情况下通过RNA引导的DNA甲基化抑制基因转录[10- - - - - -14]。典型AGO蛋白包含可变n端结构域、识别小rna 3 '端的保守c端PAZ结构域、与小rna 5 '磷酸结合的MID(中间)结构域,以及携带Asp-Asp-His (DDH)基序作为活性位点的PIWI结构域,其核酸内切酶活性类似RNaseH [6,7,15- - - - - -17]。
每种AGO蛋白通过结合小rna和直接转录调控或/和转录后调控靶基因来发挥不同的生物学功能。例如,ago4样蛋白与24nt小rna结合使DNA甲基化[12,13]。ago1样蛋白裂解靶mRNA或/并抑制mirna引导的编码过程[18]。由RNA依赖的RNA聚合酶(RdRP)以病毒RNA为模板合成的双链病毒RNA产生的sirna引导ago2样蛋白抵抗病毒感染[j]。19]。AGO7miR390通过识别TAS3初级转录物中miR390的两个互补位点,复合物定向合成了反式作用3 (TAS3)。此外,TAS3还调节ARF2,ARF3和ARF4转录(20.,21]。AGO1和AGO10都在干细胞分化中发挥作用。在茎尖分生组织(SAM)发育过程中,AGO10作为miR165/miR166的锁定物,而miR165/miR166与AGO1共同抑制SAM的维持[j]。22,23]。
植物AGO蛋白的亚细胞定位有助于研究人员了解RNA诱导基因沉默的机制。AtAGO1、AtAGO2、AtAGO4和AtAGO5在细胞质和细胞核中检测到定位信号[24- - - - - -27]。在检测到的AGO蛋白中,目前已经明确了AtAGO4的定位。与24 nt sirna、Pol-IVa、RNA依赖性RNA POLYMERASE2 (RDR2)和Dicer-like 3 (DCL3)一起,AGO4共定位于核Cajal-bodies,即小核核糖核蛋白(snRNP)复合物成熟的位点[28]。AGO4也定位于第二类核体,称为ab -小体,其中也含有参与rna定向DNA甲基化的其他蛋白质[26]。最近的研究表明,与siRNA的结合促进了AGO4重新分布到细胞核中[24]。尽管如此,关于AGO蛋白的定位仍有许多未揭示的问题。
AGO蛋白作为RISC的核心元件,在病毒防御中起着重要作用。AtAGO2和atag1突变对病毒感染过敏[19,29]。有趣的是,AGO1和AGO2都受到miRNA的调控。MiR168被认为是AGO1的反馈调节因子,而AGO2被认为是miR403的靶基因[5,29- - - - - -32]。另一方面,植物病毒基因组通过编码RISC抑制因子来对抗植物病毒防御系统。例如,黄瓜花叶病毒编码的2b可抑制AGO1的裂解活性[33];极化病毒F-box蛋白P0降解AGO1 [j]34];P21结合miRNA/miRNA*和siRNA双链抑制活性RISC的形成小核糖核酸P19能够通过调节内源性miR168水平抑制AGO1 mRNA的翻译能力,从而减弱AGO1蛋白的抗病毒功能[35,36]。由于病毒抑制物发展出了打破AGO2依赖的植物防御系统的策略,以及miR403以AGO2的形式调控AGO2的推测机制miR403Harvey提出,在植物与植物病毒相互作用中,AGO1和AGO2分别代表rna介导的防御和反防御的第一层和第二层[19]。
最近发现AGO蛋白参与了生殖调节。一个前基因(MEL1)在水稻孢子发生过程中,对减数分裂前有丝分裂和减数分裂的进行至关重要[37]。突变的ago9诱导多个配子细胞分化,导致多个配子发生[38和缺乏ago104导致在没有减数分裂的情况下产生活配子[39]。
番茄是肉质果实发育的模式植物。然而,关于AGO蛋白对番茄果实形成和发育的影响的研究报道甚少。事实上,在番茄中过表达P0导致SlAGO1A和SlAGO1B的减少显著地改变了小叶、花瓣和花药的根化[40]。然而,小rna的功能方式仍然未知。在我们的学习中,考试前基因在番茄果实形成和发育过程中的表达模式将有助于了解其潜在作用前果实发育中的基因。同时,AGO蛋白的定位也揭示了小rna在番茄中发挥作用的潜在途径。此外,验证之间的关系前基因和miRNAs之间的保守调控,在番茄中的功能尚不清楚。
结果
SlAGOs的基因组分布、基因结构、分离及系统发育分析
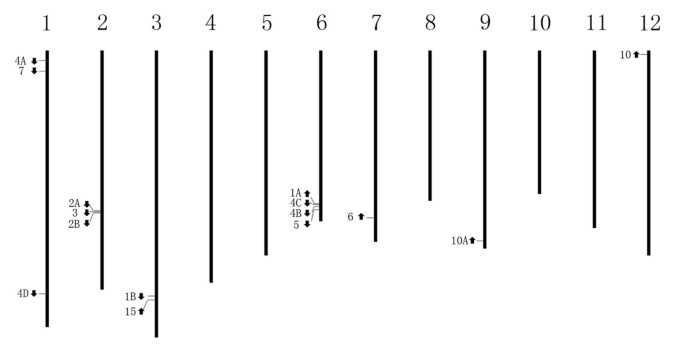
染色体的位置和方向15SlAGO通过对番茄WGS染色体的BLASTN分析,对基因进行了确定和验证(图2)1、附加文件1) [41]。SlAGO番茄家族基因位于1号染色体(SlAGO4A,SlAGO7,SlAGO4D)、第2号染色体(SlAGO2A,SlAGO3,SlAGO2B)、第3号染色体(SlAGO1B,SlAGO15)、第6号染色体(SlAGO1A,SlAGO4C,SlAGO4B,SlAGO5)、第7号染色体(SlAGO6)、第9号染色体(SlAGO10A),第12号染色体(SlAGO10),但都不是SlAGO基因分布在4、5、8、10和11号染色体上。(图1和附加文件1).有趣的是,番茄基因组的克隆序列之间只有2096 bpSlAGO3和SlAGO2B的基因组序列之间也发现了这种短间隙AtAGO2和AtAGO3。类似的方案被用于确定外显子的位置SlAGO基因。的外显子数SlAGOs基因范围从23 (SlAGO10)至3 (SlAGO2B和SlAGO3),请参见附加文件1。
采用3 ' RACE或5 ' RACE对预测的cDNA或EST序列进行验证。15日预测SlAGO基因被定位在番茄基因组中,只有13个SlAGO基因cd克隆;SlAGO1A,SlAGO1B,SlAGO2A,SlAGO2B,SlAGO3,SlAGO4A,SlAGO4B,SlAGO4D,SlAGO5,SlAGO6,SlAGO7,SlAGO10,SlAGO10A。测序后的cdna长度从2691 bp (SlAGO4D)至3729 bp (SlAGO1B),请参阅附加文件中的结果2。用于克隆的RNASlAGO基因是从开花番茄和结果番茄的整个植株中简单提取的混合物。
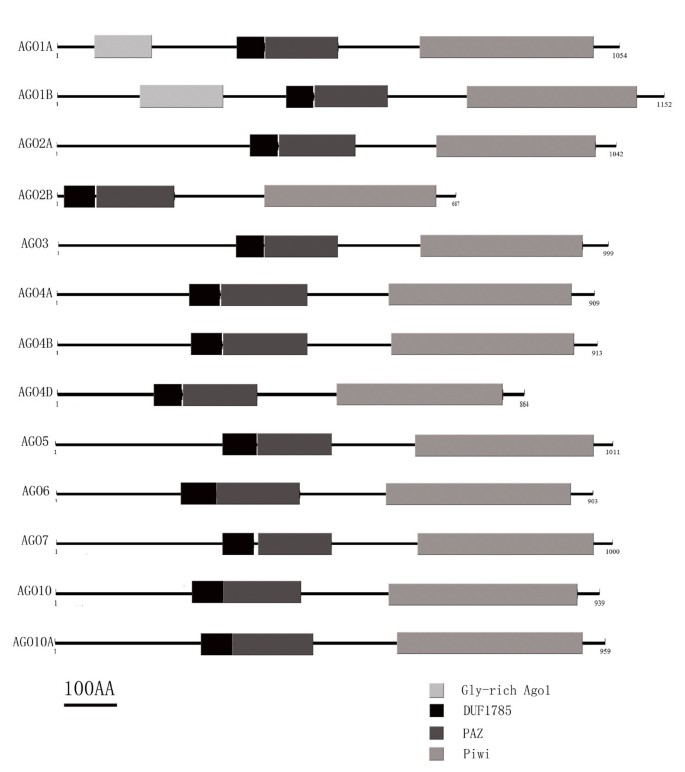
利用primer 5.0软件在不同的开放阅读框(open reading frame, ORF)中生成SlAGOs的多肽序列,并利用Pfam finder在线工具(http://pfam.sanger.ac.uk/search).的ORF长度SlAGO基因范围从2064bp (SlAGO2B)至3459 bp (SlAGO1B),编码的多肽从687 aa到1152 aa不等(附加文件)3.).SlAGO蛋白的所有多肽都含有DUF1785、PAZ和Piwi结构域,而富含gly的AGO1结构域仅在ORF中发现SlAGO1A和SlAGO1B(图2).在SlAGO1A、SlAGO1B、slagoo2、SlAGO3、SlAGO5多肽的N端发现了较高的G和Q比值,并分析了N端区域的G-Q百分比。SlAGO1A的335 aa N端为15.2% G和9.5% Q, SlAGO1B的436 aa N端为17.9% G和14.9% Q, SlAGO2A的374 aa N端为16% G和9.6% Q, SlAGO5的312 aa N端为12.8% G和6.1% Q(附加文件)4).
有趣的是,虽然2995 bpSlAGO2B在我们的工作中扩增了cDNA,在ORF中只发现了编码DUF1785, PAZ和Piwi结构域的2064 bp,在5 '端序列中出现了7个停止信号(图1)3.).三个独立的克隆SlAGO10A测序得到3160 bp的SlAGO10A被放大,但在预测ORF编码997 aa的594 aa位置出现一个停止信号。将预测的cDNA与测序的cDNA进行比对。在cDNA序列中发现了一个额外的序列“tagttgttttgcaacctctttctctttttttccttgtccttctttcaggtcgatgtttgttaaagacacgaagacgattgacctttgctcctgtgcgttatgctgacagg”,位于第9号染色体63891277 ~ 63891165号外显子SlAGO10A基因组序列(ch9: 63895090-63888840)。但该停止信号被选择性拼接在EST序列[SGN:SGN- u604148]中,该序列与预测的cDNA 100%匹配SlAGO10A。一个SlAGO10A2[NCBI: JX467717]根据我们的结果和SGN-U604148生成备选剪接cDNA。的赛跑结果SlAGO2A一个克隆的SlAGO2Acd显示一个额外的“GCCGGCAGAGGTGGAGGTAACC”定位于SL2.40ch02: 33782189-33782210,一个额外的“TTTTGCTGTGAACTGGTCTGACGG”定位于SL2.40ch02: 33785522-33785545,分别编码为“AGRGGGN”(22 aa ~ 28 aa)和“FAVNWSDG”(314 aa ~ 322 aa)。然而,这两个片段在另一个克隆中未被检测到SlAGO2A2[NCBI: JX493012],均位于N端变量域。
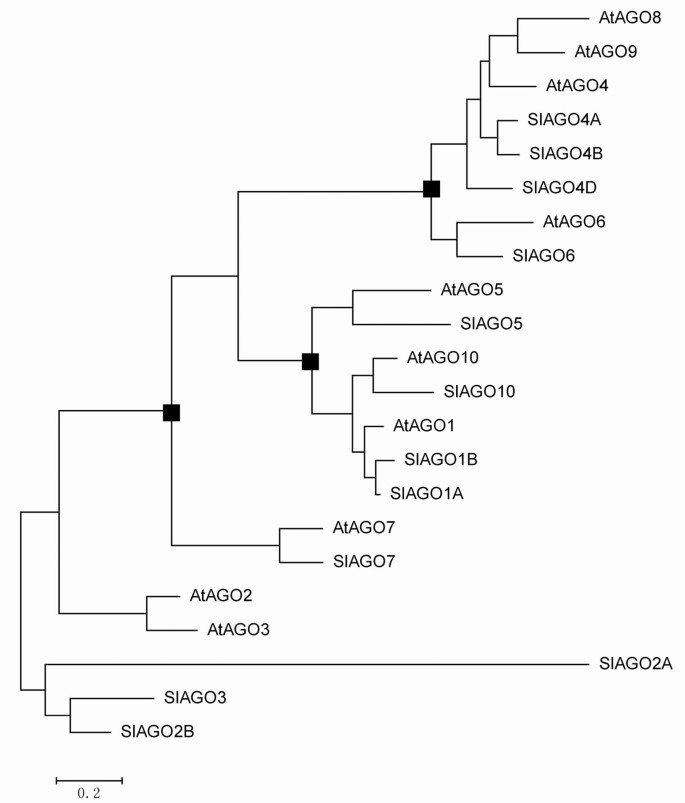
通过对克隆的12个蛋白的全长序列比对,建立了系统发育树SlAGO基因(SlAGO10A不能产生补体蛋白)和10AtAGO基因(29]。系统发育分析表明,12个SlAGO蛋白可分为3个主要分支,这些分支与植物中的SlAGO蛋白相似拟南芥(类atago1、类atago4、类atago2,见图4).AtAGO1-like枝包括SlAGO1A、SlAGO1B、SlAGO5、SlAGO10;AtAGO4-like枝包括SlAGO4A、SlAGO4B、SlAGO4D、SlAGO6;atago2样枝包括SlAGO2A、SlAGO2B、SlAGO3和SlAGO7(图2)4).有趣的是,被归类为AtAGO1或AtAGO4分支的SlAGO蛋白至少有20个外显子,而被归类为AtAGO2分支的SlAGO蛋白只有5到3个外显子(附加文件)1).附加文件介绍了多肽的序列信息、基因组分布、基因结构和多重比对2,数据1,2和3.分别。
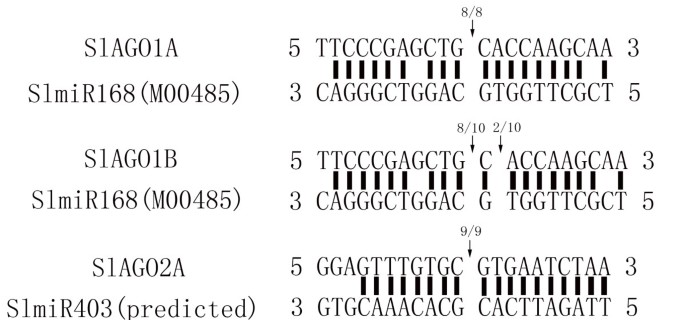
SlAGO1A、SlAGO1B和SlAGO2A是保守miRNA的靶基因
13个克隆SlAGOscDNA序列和2预测cDNASlAGO4C,SlAGO15在番茄推定miRNA数据库和miRBase中保守的植物miRNA中进行blast分析[42- - - - - -44]。SlAGO1A和SlAGO1B与成熟的SlmiR168互补[TFGD: M00485]SlAGO2A与成熟的AtmiR403互补。在番茄基因组中发现了推测的pre-SlmiR403,并通过RNA Folder version 1.11(附加文件)对其结构进行了折叠5和附加文件6).利用5′RACE检测互补序列与miRNAs的切割位点。8 / 8的阳性克隆显示裂解位点位于miR168的第10 ~ 11 nt;8 / 10阳性克隆的切割位点定位于miR168的第10 ~ 11 nt;9 / 9个阳性克隆显示切割位点位于miR403的第10 ~ 11个nt之间(图)5).
SlAGOs蛋白定位于细胞质和细胞核
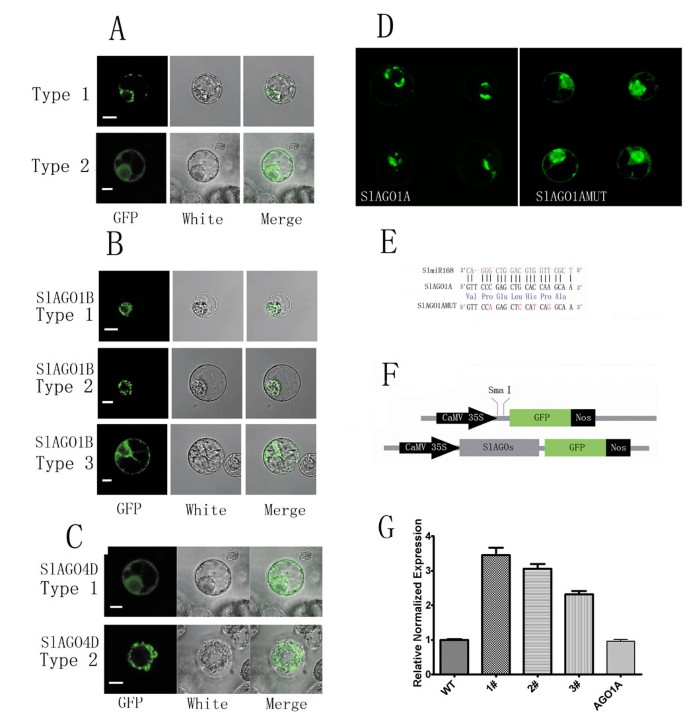
构建CaMV:SlAGOs- gfp载体,将其转化为BY2原生质体,观察SlAGOs的亚细胞定位。一般来说,SlAGOs有两种亚细胞定位类型:1型包括SlAGO1A、SlAGO5和SlAGO10,定位于核膜和细胞膜;2型包括SlAGO2A、SlAGO3、SlAGO4A、SlAGO4B和SlAGO6,扩展到细胞质和细胞核(图2)6A、附加文件7,8和9).有趣的是,SlAGO1B定位于细胞核(图2)6B,类型1),到细胞质(图6B, 2型)或两者都向细胞质和细胞核转移(图2)6B, 3型)和定位于细胞质和细胞核的SlAGO4D(图6C, 1型)或定位于核周围(图6C, Type 2)。SlAGO1A定位于原子核周围的斑点结构(图2)6D)。此外,SlAGO1A在miR168互补位点突变的亚细胞定位在不改变SlAGO1A多肽序列的情况下扩展到细胞核和细胞质,而不仅仅是像SlAGO1A的亚细胞定位那样在细胞核周围斑点结构(图1)6D,图6E)。
SlAGO蛋白在BY2原生质体中的亚细胞定位。将携带CaMV 35S:SlAGOs-GFP标签的质粒转化到BY2细胞中。(一)SlAGO蛋白的两种定位类型。1型定位于细胞质膜和细胞核;2型定位于细胞质和细胞核。更多SlAGO蛋白的定位在附加文件中列出7。(B)AGO1B在不同细胞中的亚细胞定位不同。1型局限于细胞核;2型定位于核膜;3型定位于细胞质和细胞核。(C)AGO4D在不同细胞中的亚细胞定位不同。1型定位于细胞质和细胞核;2型定位于细胞核内的环状结构。(D)AGO1A和AGO1AMUT的亚细胞定位。(E)SlAGO1A与成熟SlmiR168互补序列的位点突变策略。AGO1AMUT序列中的红色字母代表突变位点。蓝色字母是开放阅读框中编码的氨基酸。(F)SlAGOs重组策略:绿色荧光蛋白。刻度表示5 μm。(G)电阻试验SlAGO1AMUT在转基因植物中。1#、2#、3#为单株转基因植株SlAGO1AMUT;SlAGO1A是转基因植物SlAGO1A;WT为野生型微tom。
附加文件8:SlAGOs的1型定位,定位于细胞核和细胞膜。(mp4 436kb)
附加文件9:SlAGOs定位于细胞核和细胞质的2型定位。(mp4 111 kb)
的不同表达模式SlAGO基因
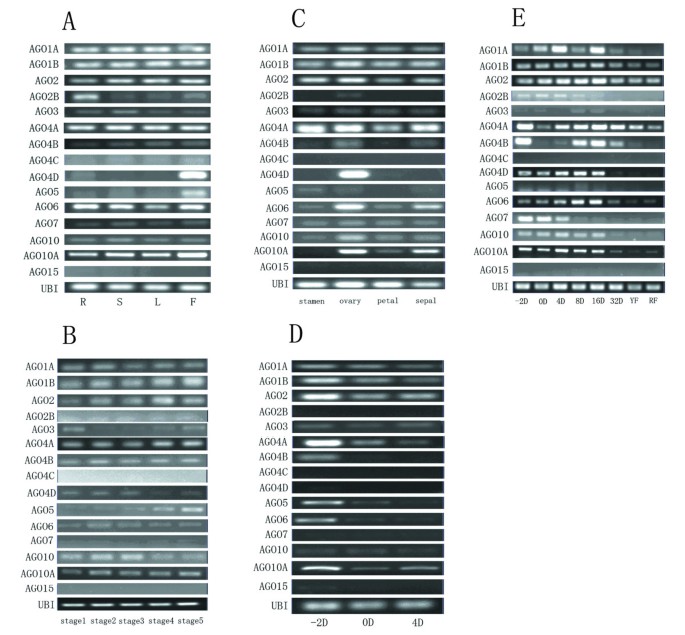
以前,的表达模式SlAGOs在芽、根、花、绿果和红果混合物中检测到SlAGO4C, SlAGO4D和SlAGO15无法检测到[45]。在我们的研究中,SlAGO4C和SlAGO15在收集的任何组织中都检测不到,但在完整的cd中SlAGO4D都被克隆了SlAGO4D可在花和果实发育早期检测到。的表达模式SlAGO在根、茎、叶和花中检测到基因。因此,SlAGO1A, SlAGO1B, SlAGO2A, SlAGO2B, SlAGO3, SlAGO4A, SlAGO4B, SlAGO6, SlAGO7, SlAGO10和SlAGO10A在四个器官中都能检测到,而SlAGO4D和SlAGO5只能在花中检测到(图7一个)。
PCR分析SlAGO番茄的基因。(一)的表达模式SlAGO不同器官的基因。R, S, L, F代表从开花的番茄上收集的根,茎,叶和花。(B)的表达模式SlAGO芽发育过程中的基因。根据芽的长度将芽分为5个发育阶段,从第1阶段到第5阶段。第1阶段是指不超过1毫米;第2阶段代表2至3mm,第3阶段代表4至5mm,第4阶段代表6至7mm,第5阶段代表8至9mm。(C)的表达模式前番茄花不同器官的基因。采集开花植物的雄蕊、雌蕊、花瓣和萼片。(D)番茄的表达模式前雄蕊发育过程中的基因。-2D、0D、4D分别为花前2天、花当天、花后4天采集的雄蕊。(E)的表达模式SlAGO番茄果实发育过程中的基因。-2D为开花前2天采集的果实;0D、4D、8D、16D、32D分别代表开花后0、4、8、16、32天收获的果实;YF代表黄色水果,RF代表红色水果。Ubi3作为标准表达水平的内参基因,每个引物进行30个PCR循环。
根据花蕾长度,将花蕾分为5个阶段:花蕾长度不超过1mm时为1期,花蕾长度为2 ~ 3mm时为2 ~ 5mm,花蕾长度为4 ~ 5mm时为4 ~ 7mm,花蕾长度为8 ~ 9mm时为5期。SlAGO4C和SlAGO15在任何收集的阶段中都无法检测到SlAGO5在芽发育过程中表达逐渐增强;SlAGO7只能在花蕾的第4和第5阶段检测到(图7B)。
花分为雄蕊、子房、花瓣和萼片。SlAGO1A, SlAGO1B, slagoo2, SlAGO3, SlAGO4A, SlAGO4B, SlAGO6, SlAGO7, SlAGO10和SlAGO10A在所有四个部分都可以检测到,但是SlAGO6和SlAGO10A在子房内显著高于花的其他部位。SlAGO2B和SlAGO4D可以在子房中检测到,但在花的其他部位没有(图7C)。
分别于花前2 d (-2 dpa)、花后第1 d (0 dpa)和花后4 d (4 dpa)采集雄蕊。SlAGO2B, SlAGO4C, SlAGO4D, SlAGO15当进行30个PCR循环时,在这些收集的任何阶段都无法检测到。SlAGO1A, SlAGO1B, slagoo2, SlAGO3, SlAGO4A, SlAGO5, SlAGO6, SlAGO10和SlAGO10A在雄蕊发育的三个阶段均能检测到,而SlAGO4B可以在-2 dpa雄蕊中检测到(图7D)。
为了理解SlAGO分别在开花前2天(-2 dpa)、开花第一天(0 dpa)、花后4天(4 dpa)、花后8天(8 dpa)、花后16天(16 dpa)、花后32天(32 dpa)、花后45天(黄果,YF)和花后50天(红果,RF)收获果实。SlAGO1A, SlAGO1B, SlAGO2A, SlAGO2B, SlAGO4A, SlAGO4D, SlAGO6, SlAGO10和SlAGO10A在所有采集阶段均可检测到。的表达SlAGO4A和SlAGO4B在-2 dpa果显著高于0 dpa果,但在4 dpa果逐渐上调,在16 dpa果达到峰值,随后在32 dpa果、黄果和红果下调。SlAGO4D和SlAGO6具有相似的表达模式SlAGO4A和SlAGO4B,但SlAGO4A和SlAGO4B在0 dpa果实中表达强烈。稍微表示SlAGO5在8 dpa果和16 dpa果中均检测到。有趣的表达模式在SlAGO7该基因在-2 dpa果实中表达量高,在0 dpa果实和4 dpa果实中表达量略有下降,但在4 dpa后的各检测阶段表达量急剧下降(图2)7E)。
讨论
在真核生物中,AGO蛋白是保守的基因家族,是已知的通过抑制靶基因表达来调控发育进程的小rna调控通路的核心部分[13,18]。例如,AGO1和AGO10在miR165/miR166的指导下调控茎尖分生组织[22];AGO7在TAS3的指导下影响发育时间和模式[20.,46]。在这项研究中,13个克隆SlAGO有12个基因产生了完整的蛋白质,而SlAGO10A在预测ORF中有一个停止信号。通过系统发育分析,将12个SlAGOs蛋白和10个AtAGO蛋白划分为3个支系(图2)4) [29]。每个人SlAGO基因中有同源基因拟南芥,表明SlAGO基因在番茄中可能有类似的功能AtAGO基因在拟南芥。
SlAGO1A和SlAGO1B同源性为88.0%,但SlAGO1A和SlAGO1B可能在番茄发育过程中发挥不同的作用。SlAGO1B的N端多出101个GQ-rich序列,且SlAGO1B中Q的百分比远高于SlAGO1A (14.9%:9.5%)4).的表达SlAGO1A与……不同吗SlAGO1B在果实中,4 dpa和16 dpa果实的表达量远高于其他果实发育阶段SlAGO1B在所有检测到的组织中都发生了明显的变化(图2)7E). SlAGO1A定位于细胞核周围的斑点(图6E),但SlAGO1B定位于细胞核(图2)6B,类型1),到细胞质(图6B, 2型)或两者都向细胞质和细胞核转移(图2)6B,类型3)。不同的亚细胞位置和表达模式显示2AGO1-like基因在番茄中的作用可能不同。
众所周知,miRNAs同时引导AGOs调控靶基因AtAGO1受miR168和AtAGO2分别受miR403调控[5,29- - - - - -32]。在拟南芥, Co-IP实验发现AGO1与miR168和miR403结合[NCBI:GSE22252], AGO2也与miR168结合[5,22,47],证明多个AGO蛋白通过miR168和参与了AGO1蛋白的转录后调控AGO2miR403可能以AGO1的形式调控mRNAmiR403复杂。此外,miR168和miR403是保守的microrna,在番茄(http://bioinformatics.cau.edu.cn/cgi-bin/PMRD/expression/probe_detail_3.cgi?page=1).在我们的研究中,SlAGO1A和SlAGO1B被miR168切割,而SlAGO2A被miR403切割。我们的发现证明了miR168与AGO1、miR403及AGO2保存在番茄中。不像miR168的反馈控制AGO1对植物正常发育很重要,mir403介导的AGO2仍然未知[5,30.,31]。然而,最近的研究可能会揭示miR403与AGO2。miR168和miR403在植物接收病毒感染信号时均下调ago1和ago2在植物与植物-病毒相互作用中,AGO1和AGO2是rna介导的防御和反防御的第一层和第二层[19,29,48,49]。基于这些事实,提出miR403、miR168与AGO2、ag1在病毒防御中的生物学功能之间关系的假设:
AGO蛋白作为RISC的关键元件,在病毒感染过程中被上调表达,而过表达会导致植物发育障碍[5,45]。因此,调控AGO蛋白在这两种条件下保持适当的数量对病毒防御和植物发育至关重要。病毒采用依赖AGO蛋白的策略干扰RNA诱导的基因沉默。目前已确定的病毒抑制RNA诱导沉默过程有四种策略:2b干扰AGO蛋白的激活位点;P19和P21抑制RISC的形成vsiRNAP19诱导miR168积累,抑制AGO1的表达;极性病毒F-box蛋白P0可以结合AGO1并降解AGO1以抑制RNA诱导的病毒基因沉默[33- - - - - -35,50]。这些策略表明AGO蛋白在RNA诱导的沉默依赖防御系统中的重要性,无论病毒采用何种策略,植物中AGO蛋白的上调对于病毒防御的成功至关重要。
在病毒感染过程中,miR168在早期下调,在后期上调[48]。miR168的表达表明了以下调控途径:在病毒感染初期,miR168下调,AGOsmiR168复合体随之减少。作为缺失的转录后抑制因子,AGO1蛋白开始积累,对病毒感染的防御主要由AGO1完成vsiRNA。在后期,miR168上调,AGO1miR168和AGO2miR168作为反馈调节维持适合植物发育的AGO1蛋白。但当AGO1受到抑制时,AGO1的积累miR403低于正常情况下,因此在病毒感染期间miR403下调,因为AGO可以保护结合miRNAs [30.,49]。然后,由于AGO2的抑制减少,AGO2积累起来miR403,因此病毒rna被AGO2消灭vsiRNAs。
最近,AtAGO9和ZmAGO104,它们是同源的AtAGO4,被发现有能力抑制生殖细胞的体细胞命运[38,39]。在目前的工作中,13前克隆了相关基因,检测了其在雄蕊和果实不同器官和发育阶段的表达模式。反转“V”字风格的表达模式SlAGO4A, SlAGO4B, SlAGO4D, SlAGO6在果实发育中被发现。有趣的是,这些SlAGO基因被分为AtAGO4可能在番茄果实发育中起类似作用的进化支AtAGO9和ZmAGO104是吗,尤其是候选人SlAGO4D具体表现在水果中。
在米饭中,AtAGO1-like基因MEL1生殖器官中的表达调节减数前生殖细胞的细胞分裂[37]。在番茄里,有5个SlAGO基因属于AGO1进化枝(SlAGO1A, SlAGO1B, SlAGO5, SlAGO10和SlAGO10A).在五SlAGO1-like的基因,SlAGO5在花和果实中表达,其表达模式与MEL1,表明SlAGO5可能对番茄生殖器官的形成起调节作用。
果实发育过程中独特的表达模式表明SlAGO7可能参与果实的形成。有证据可以证明潜在的途径。首先,发现AtAGO7参与了trans-acting 3由miR390指示,和AtARF2, AtARF3, AtARF4均受第3号技术事务规例[20.,46]。第二,AtARF3和AtARF4有调节器官不对称的能力。此外,突变表型arf3被限制在花中[51]。其三,过表达miR-ARF干扰ARF2,ARF3和ARF4,导致花柱异常短,绿色柱头加厚[52]。SlAGO7在-2 dpa果实中表达量极高,在8 dpa后的果实中表达量急剧下降SlAGO7哪个是同源的AtAGO7可能调控早期果实形成,很可能是通过指导TAS 3的合成来维持适当的表达ARF2, ARFA3和ARF4。
AGO蛋白的定位有助于了解小rna的产生机制及其功能。AtAGO1定位于细胞核和细胞质,并观察到一个大的核质信号[27]。发现AtAGO2、AtAGO5和AtAGO4定位于细胞质和细胞核[24- - - - - -26]。在我们的研究中,检测到10个SlAGOs的亚细胞定位。SlAGO1A、SlAGO5和SlAGO10定位于核膜和细胞膜(图2)6SlAGO2、SlAGO3、SlAGO4A和SlAGO4B定位于细胞质和细胞核。有趣的是,与其他类似agago1的基因不同,SlAGO1A在番茄中的定位似乎仅限于细胞核周围的特定结构(图1)6D),其功能和机制尚不清楚。在番茄中定位ago1样基因表明了AGO的潜力microrna /核在翻译开始之前,在mrna转运出细胞核时监测目标mrna。
为了在miR168失去控制的模拟条件下检查定位,我们使用了在miR168互补位点携带4个点突变的SlAGO1AMUT。SlAGO1AMUT的定位扩展到细胞核和细胞质(图2)6D和图6E),表明miR168可能调控SlAGO1A的定位。近年来,研究发现AGO4的细胞核定位可以通过与小rna的结合来确定[24]。不同的是,AGO1在d -小体中可以与双链RNA (DsRNA)结合域蛋白Hyponastic Leaves1 (HYL1)结合,表明形成了成熟的miRNA,与AGO1相似microrna的配合物在核内偶联[27]。在我们的研究中,SlAGO1A: GFP和SlAGO1B: GFP在细胞核内的荧光不强(图2)6B和图6D)。但SlAGO1AMUT向细胞核扩展的定位表明SlAGO1A蛋白的定位受到miR168的反馈调节。由于sirna和mirna分别来自细胞质和细胞核,当miR168下调后,SlAGO1A蛋白被转运到细胞质和细胞核中,从而加速SlAGO1A的形成核/ microrna的复杂。然后,通过SlAGO1A监测目标基因的合适蛋白表达核/ microrna的复杂。
结论
在这项研究中,13SlAGO克隆了基因,并检测了它们在番茄果实发育中的表达模式。在番茄中发现并鉴定了SlAGO基因与mirna之间的保守关系。此外,我们还观察到了SlAGO蛋白的定位和miR168对SlAGO1A定位的调控。在番茄中,AGO蛋白的鉴定和表征将有助于研究通过RISC途径对果实形成和发育的转录和转录后调控。
方法
搜索前基因
据推测有15个前基因在番茄基因组中的持续存在[45]。15个潜力SlAGO通过多次数据库搜索验证了基因。利用SGN番茄组合wgs、BAC和单基因序列数据库进行BLASTN和TBLASTN检测先前鉴定的AGO蛋白;使用BLASTN和TBLASTN获取电位前来自番茄WGS染色体数据库(sl2.40)的番茄家族基因(http://solgenomics.net/tools/blast/index.pl) [41]。综合所有搜索结果,有15个可能前从目前可用的基因组数据库中鉴定出基因。在搜索了前基因,生物信息学工具,如FGENESH (http://linux1.softberry.com/berry.phtml?topic=fgenesh&group=programs&subgroup=gfind)被用来分析和预测那些未知的SlAGOs和NCBI的BLASTX (http://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastx&BLAST_PROGRAMS=blastx&PAGE_TYPE=BlastSearch&SHOW_DEFAULTS=on&LINK_LOC=blasthome)来识别功能域。预计的cDNA序列为15个前将3′UTR和5′UTR分别分离约500 bp,用EST数据库进行blast,得到3′UTR和5′UTR序列的数据(另附文件)2).
克隆SlAGO基因
根据预测cd或EST序列设计引物克隆全cd或分别进行5′RACE/3′RACE产物的克隆前(其他文件)10和11).使用TRIZOL试剂(德国Invitrogen公司),按照制造商的说明,从开花番茄和结果番茄的组织中提取总RNA。dna处理后,进行35次PCR扩增Ubi3使用处理过的rna作为模板,不应检测到片段。第一条cDNA链使用RevertAid™first strand cDNA Synthesis Kit (Fermentas, Thermo SCIENTIFIC, USA)按照生产流程生成。全长13页SlAGOs采用基于Slc4.0(附加文件1).3 ' RACE和5 ' RACE使用3 ' -Full RACE Core Set Ver.2.0和5 ' -Full RACE Kit (TAKARA, JAPAN),使用根据cdna测序结果设计的引物。片段克隆到pEasy-blunt载体(Transgene, China)上,3个阳性克隆通过Genscript (China)进行测序。
多序列比对及系统发育分析
使用primer 5.0和ExPASY Proteomic Server (http://web.expasy.org/translate/).采用ClustalX(2.0.10)软件进行多序列比对,采用MEGA5 (UPGMA)软件进行系统发育分析。序列加入编号在附加文件中列出3.和附加文件12。
的表达分析SlAGO基因
植物材料采自温室内温控栽培的微型tom植株。从开花的番茄植株上采集了根、茎、叶和花。花前2 d采-2 dpa果,花后1、4、8、16、32 d采0、4、8、16、32 dpa果。黄色和红色的水果根据它们的颜色分别被捡起来。每一次采集来自10株植物并彻底混合。
RNA提取和逆转录如前所述。采用PCR检测各基因的表达情况SlAGO使用附加文件中列出的引物对11,根据每个序列的3′端序列进行设计SlAGO基因。将稀释10倍的cDNA (1 μL)样品,在PCR机(bio-RAD)中以最终体积为25 μL,含有12.5 μL PCR master Mixture (Comwell, China)的PCR仪(bio-RAD)中进行PCR,程序设置为95℃加热4 min,然后在95℃、58℃和72℃分别加热30 s,循环30次。PCR分别重复3次。为了使每个反应中呈现的cDNA总量标准化Ubi3作为内源性对照,共扩增基因。
之间的关系SlAGOs和microrna的
确定两者之间的关系SlAGO基因和小RNA, BLAST检索番茄小RNA数据库(http://ted.bti.cornell.edu/cgi-bin/TFGD/sRNA/target.cgi)及miRBase (http://www.mirbase.org/)用13个序列的cDNA序列进行分析前并预测了另外2个基因的cDNA序列前基因。采用5 ' RACE作图来确定的切片位置前与mirna互补的mrna。用T4 RNA连接酶(Fermentas, Thermo, USA)连接适配器后,对用于检测3 '裂解产物5 ' RACE定位的cDNA进行反向转录。根据每个GSP引物的Tm进行PCR(附加文件)13),这是在成熟miRNA序列互补位点的预测3 '产物上设计的。适配器和连接器购自Takara (Takara 5 RACE KIT,日本)。PCR产物与pEasy-blunt载体连接,每个产物8 ~ 9个阳性克隆进行测序。
位点突变AGO1A重组PCR
根据SlmiR168序列的互补位点SlAGO1AmRNA, 4个碱基突变引物(AGO1AMUT-F和AGO1AMUT-R),附加文件11)被设计用来放大突变AGO1AMUT。AGO1A-F和AGOMUT-R为短片段扩增,AGO1AMUT-F和AGO1A-R为长片段扩增。然后将每个1 μL纯化的突变片段混合扩增全长AGO1AMUT。这抵抗碎片和原始SlAGO1A在CaMV-35S启动子驱动下构建plp-100,然后用农杆菌属。对miR168的抗性SlAGO1AMUT在三株转基因植株上分别用引物qSlAGO1A-cutting-F: GTGGAATAGCCCCTCAACAGTC和qSlAGO1A-cutting-R: TTGGTTCAGGTGGCTGAGATG进行检测,以UBI作为标准基因进行归一化(图6G)。
slago - gfp融合蛋白的亚细胞定位
的编码序列SlAGO在花椰菜花叶病毒35S启动子和野碱合成酶(nos)终止子的转录调控下,将基因以C端与绿色荧光蛋白(GFP)框架内融合的方式克隆到pGreen载体中表达。53]。悬浮培养烟草的原生质体(烟草)制备by -2细胞,按照Abel和Sheen描述的方法进行PEG转化,观察SlAGO蛋白的细胞定位(http://molbio.mgh.harvard.edu/sheenweb/protocols_reg.html) [54,55]。收集6 ~ 8 d的BY2细胞2g, 3500 rpm离心15 min,用Tris-MES缓冲液洗涤2次;酶处理在Tris-MES缓冲液中,37°C处理1 h,用1% caylase、0.2% pectylyase Y-23和1% BSA消化。原生质体经尼龙过滤,W5缓冲液洗涤,重新悬浮于MMg缓冲液中,在显微镜下计数,调整至终浓度约为1 × 106毫升1。0.2 mL原生质悬液中分别转染50 μg的三文鱼共有精子载体DNA、30 μg的35S:SlAGOs-GFP和40% PEG 1 h, 1000 rpm离心8 min, W5悬浮,25℃孵育至少16 h。用共聚焦显微镜分析GFP荧光。每个SlAGOs-GFP瞬时表达被照亮的细胞超过4个。
参考文献
- 1.
Aukerman MJ, Sakai H . MicroRNA及其aptala2样靶基因对开花时间和花器官特性的调控。植物细胞,2003,15(11):2730-2741。10.1105 / tpc.016238。
- 2.
叶文杰,叶文杰,叶文杰,叶文杰,叶文杰,叶文杰。拟南芥种子种子种子中HD-ZIP和KANADI基因的克隆。CB。2003,13(20): 1768-1774。
- 3.
彭丽娟,张建军,张建军,张建军,张建军,张建军,张建军,等。植物叶片形态发育的microrna调控。自然科学学报,2003,25(6):557 - 563。10.1038 / nature01958。
- 4.
谢志,Kasschau KD, Carrington JC: microrna介导的拟南芥Dicer-Like1 mRNA降解的负反馈调控。CB。2003, 13(9): 784-789。
- 5.
Vaucheret H, Vazquez F, Crete P, Bartel DP: ARGONAUTE1在miRNA通路中的作用及其对miRNA通路的调控对植物发育至关重要。基因发育,2004,18(10):1187-1197。10.1101 / gad.1201404。
- 6.
托利亚·NH,约书亚·托尔·L:《切片机》和《角斗士》。生物化学学报,2007,31(1):36-43。10.1038 / nchembio848。
- 7.
王晓东,王晓东,王晓东,等。Argonaute蛋白在RNA沉默中的作用。中华细胞生物学杂志,2008,9(1):22-32。10.1038 / nrm2321。
- 8.
Yigit E, Batista PJ, Bei Y, Pang KM, Chen CC, Tolia NH, Joshua-Tor L, Mitani S, Simard MJ, Mello CC:秀丽隐杆线虫Argonaute家族的序列分析Cell. 2006, 127(4): 747-757。10.1016 / j.cell.2006.09.033。
- 9.
Vaucheret H:植物ARGONAUTES。植物科学进展,2008,13(7):350-358。10.1016 / j.tplants.2008.04.007。
- 10.
Kiriakidou M, Tan GS, Lamprinaki S, De planel - saguer M, Nelson PT, Mourelatos Z:人类Ago2 mRNA m7G帽结合样基序抑制翻译。细胞学报,2007,29(6):1141-1151。10.1016 / j.cell.2007.05.016。
- 11.
郑鑫,朱军,Kapoor A,朱建军:拟南芥AGO6在siRNA积累、DNA甲基化和转录基因沉默中的作用。中华微生物学杂志,2007,26(6):1691-1701。10.1038 / sj.emboj.7601603。
- 12.
祁颖,何霞,王晓军,Kohany O, Jurka J, Hannon GJ: ARGONAUTE4在rna定向DNA甲基化中的催化和非催化作用。自然,2006,43(7):1008-1012。10.1038 / nature05198。
- 13.
Zilberman D, Cao X, Johansen LK, Xie Z, Carrington JC, Jacobsen SE:拟南芥ARGONAUTE4在rna定向DNA甲基化中的作用。CB。2004,14(13): 1214-1220。
- 14.
Fagard M, Boutet S, Morel JB, Bellini C, Vaucheret H: AGO1、QDE-2和RDE-1是植物转录后基因沉默、真菌抑制和动物RNA干扰的相关蛋白。科学通报,2000,37(2):1 - 6。10.1073 / pnas.200217597。
- 15.
Rivas FV, Tolia NH, Song JJ, Aragon JP, Liu J, Hannon GJ, Joshua-Tor L:纯化Argonaute2和siRNA形成重组人RISC。中华生物医学工程学报,2005,31(4):349 -349。10.1038 / nsmb918。
- 16.
Hall TM: argonaute蛋白的结构和功能。结构,2005,13(10):1403-1408。10.1016 / j.str.2005.08.005。
- 17.
刘建军,刘建军,刘建军,等。真核Argonaute蛋白MID结构域的结构分析。EMBO报告。2010, 11(7): 522-527。10.1038 / embor.2010.81。
- 18.
Baumberger N, Baulcombe DC:拟南芥ARGONAUTE1是一种选择性招募microrna和短干扰RNA的RNA切割器。中国科学:自然科学版,2005,32(3):11928-11933。10.1073 / pnas.0505461102。
- 19.
Harvey JJ, Lewsey MG, Patel K, Westwood J, Heimstadt S, Carr JP, Baulcombe DC: AGO2在植物抗病防御中的作用。PloS one。2011, 6 (1): e14639-10.1371/journal.pone.0014639。
- 20.
Montgomery TA, Howell MD, Cuperus JT, Li D, Hansen JE, Alexander AL, Chapman EJ, Fahlgren N, Allen E, Carrington JC: ARGONAUTE7-miR390相互作用和双重功能在TAS3反式siRNA形成中的特异性。细胞学报,2008,33(1):128-141。10.1016 / j.cell.2008.02.033。
- 21.
Marin E, Jouannet V, Herz A, Lokerse AS, Weijers D, Vaucheret H, Nussaume L, Crespi MD, Maizel A: miR390,拟南芥TAS3 tasirna及其生长素应答因子靶标定义了侧根生长的自调控网络。植物细胞,2010,22(4):1104-1117。10.1105 / tpc.109.072553。
- 22.
朱慧,胡峰,王锐,周霞,施世胜,刘立文,Barefoot A, Dickman M,张晓:拟南芥根尖分生组织发育调控miR166/165的基因表达。中国生物医学工程学报,2011,35(2):444 - 444。10.1016 / j.cell.2011.03.024。
- 23.
季莉,刘霞,闫军,王伟,于慕仁,金玉杰,丁婷婷,刘健,崔旭,郑波,等:ARGONAUTE10和ARGONAUTE1通过两个microrna调控拟南芥花干细胞的终止。科学通报,2011,7 (3):e1001358-10.1371/journal.pgen.1001358。
- 24.
叶锐,王伟,易涛,刘超,吴勇,石川明,周霞,齐勇:拟南芥ARGONAUTE4/siRNA复合物的细胞质组装和选择性核输入。鼹鼠细胞,2012,46(6):859-870。10.1016 / j.molcel.2012.04.013。
- 25.
Takeda A, Iwasaki S, Watanabe T, Utsumi M, Watanabe Y: argonaute蛋白从小RNA双链中选择引导链的机制不同。植物生理学报,2008,49(4):493-500。10.1093 /卡式肺囊虫肺炎/ pcn043。
- 26.
李春芳,韩德胜,宋丽,Fedoroff N, Lagrange T, Jacobsen SE:拟南芥中ARGONAUTE4在多个核体中的动态调控。科学通报,2008,4 (2):e27-10.1371/journal.pgen.0040027。
- 27.
方毅,张德龙:拟南芥活体植物microRNA生物发生蛋白的核切割体鉴定。CB。2007, 17(9): 818-823。
- 28.
Li CF, Pontes O, El-Shami M, Henderson IR, Bernatavichute YV, Chan SW, Lagrange T, Pikaard CS, Jacobsen SE:拟南芥中含有argonaute4的核加工中心与Cajal体的共定位。细胞学报,2006,26(1):93-106。10.1016 / j.cell.2006.05.032。
- 29.
莫瑞杰,高东,陈晓明,陈晓明,陈晓明,陈晓明,陈晓明,陈晓明,陈晓明,陈晓明,陈晓明,等。ag1基因转录后基因沉默与病毒抗性研究。植物细胞,2002,14(3):629-639。10.1105 / tpc.010358。
- 30.
Vaucheret H, Mallory AC, Bartel DP: agone1的稳态需要MIR168和agone1的共同表达以及agone1对MIR168的优先稳定。鼹鼠细胞,2006,22(1):129-136。10.1016 / j.molcel.2006.03.011。
- 31.
李春华,李春华,李春华,李春华,王春华,王春华,王春华,等。十字花科植物MIR168亲缘关系的研究进展。中国生物医学工程学报,2009,39(9):662 - 666。
- 32.
罗文杰,李文杰,李文杰,等。植物microRNA的研究进展。生物医学工程学报,2006,7(10):1052-1058。10.1038 / sj.embor.7400806。
- 33.
张欣,袁玉华,裴勇,林顺生,Tuschl T, Patel DJ, chunh:黄瓜花叶病毒编码的2b抑制因子对拟南芥Argonaute1裂解活性的抑制作用。地球科学进展,2006,20(3):3255-3268。10.1101 / gad.1495506。
- 34.
引用本文:Bortolamiol D, Pazhouhandeh M, Marrocco K, Genschik P, Ziegler-Graff V: Polerovirus F box protein P0靶向ARGONAUTE1抑制RNA沉默。CB。2007, 17(18): 1615-1621。
- 35.
李建军,陈建军,陈建军,陈建军,等。病毒RNA沉默抑制因子对microRNA信号通路的抑制作用。通用发展,2004,18(10):1179-1186。10.1101 / gad.1201204。
- 36.
Varallyay E, Valoczi A, Agyi A, Burgyan J, Havelda Z:植物病毒介导的miR168的诱导与ARGONAUTE1的积累有关。生物医学工程学报,2010,29(20):3507-3519。10.1038 / emboj.2010.215。
- 37.
noonomura K, Morohoshi A, Nakano M, Eiguchi M, Miyao A, Hirochika H, Kurata N: ARGONAUTE家族生殖细胞特异性基因对水稻减数分裂过程中有丝分裂和减数分裂进程至关重要。植物细胞,2007,19(8):2583-2594。10.1105 / tpc.107.053199。
- 38.
Olmedo-Monfil V, Duran-Figueroa N, Arteaga-Vazquez M, Demesa-Arevalo E, Autran D, Grimanelli D, Slotkin RK, Martienssen RA, Vielle-Calzada JP:小RNA途径对拟南芥雌性配子形成的调控。自然科学,2010,44(7):628-632。10.1038 / nature08828。
- 39.
李建军,李建军,李建军,李建军,李建军,李建军,等。小麦ARGONAUTE蛋白缺乏对玉米的影响。植物学报,2011,23(2):443-458。10.1105 / tpc.110.079020。
- 40.
韩德曼A, Kravchik M,等:p0介导的ARGONAUTE失稳对番茄发育的影响。植物学报,2013,37(1):363-377。10.1007 / s00425 - 012 - 1778 - 8。
- 41.
TTG联盟:番茄基因组序列提供了对肉质果实进化的见解。自然科学,2012,45(7):635-641。10.1038 / nature11119。
- 42.
李建军,杨建军,杨建军,杨建军,等。番茄小分子rna的克隆与鉴定。植物学报,2007,26(3):779 - 779。10.1007 / s00425 - 007 - 0518 - y。
- 43.
Itaya A, Bundschuh R, Archual AJ, young JG, Fei Z,戴旭,赵培平,唐勇,Nelson RS,丁斌:番茄果实和叶片发育中的小rna。生物化学与生物物理学报。中国机械工程,2008(2):99-107。10.1016 / j.bbagrm.2007.09.003。
- 44.
Moxon S, Jing R, Szittya G, Schwach F, Rusholme Pilcher RL, Moulton V, Dalmay T:番茄短rna深度测序鉴定果实成熟相关基因。生物医学工程学报,2008,18(10):1602-1609。10.1101 / gr.080127.108。
- 45.
白敏,杨国光,陈文涛,毛志成,康红霞,陈海华,杨永华,谢碧:番茄Dicer-like、Argonaute和RNA依赖性RNA聚合酶基因家族的全基因组鉴定及其对病毒感染和非生物胁迫的表达分析。生物医学工程学报,2012,31(1):52-62。10.1016 / j.gene.2012.02.009。
- 46.
Fahlgren N, Montgomery TA, Howell MD, Allen E, Dvorak SK, Alexander AL, Carrington JC:生长素反应因子3通过TAS3 TA - sirna调控影响拟南芥发育时间和模式。CB。2006, 16(9): 939-944。
- 47.
Cuperus JT, Carbonell A, Fahlgren N, Garcia-Ruiz H, Burke RT, Takeda A, Sullivan CM, Gilbert SD, Montgomery TA, Carrington JC: 22-nt miRNAs在拟南芥靶转录物中触发rdr6依赖性siRNA生物发生的独特功能。中华生物医学杂志,2010,17(8):997-1003。10.1038 / nsmb.1866。
- 48.
Bazzini AA, manacda CA, Tohge T, Conti G, Rodriguez MC, Nunes-Nesi A, Villanueva S, Fernie AR, Carrari F, Asurmendi S: TMV感染植物的代谢和miRNA分析揭示了双期时间变化。科学通报,2011,6 (12):e28466-10.1371/journal.pone.0028466。
- 49.
王晓明,王晓明,王晓明,等。马铃薯纺锤体块茎类病毒(PSTVd)侵染番茄植株mirna和小rna的鉴定。生物化学,2010,31(12):1379-1390。
- 50.
pazhouhanddeh M, Dieterle M, Marrocco K, Lechner E, Berry B, Brault V, Hemmer O, Kretsch T, Richards KE, Genschik P,等:多极病毒蛋白P0的F-box-like结构域在沉默抑制功能中的作用。科学通报,2006,35(6):394 - 394。10.1073 / pnas.0510784103。
- 51.
张晓明,张晓明,张晓明,等。植物生长素反应因子对拟南芥器官不对称的影响。植物细胞,2005,17(11):2899-2910。10.1105 / tpc.105.034876。
- 52.
Alvarez JP, Pekker I, Goldshmidt A, Blum E, Amsellem Z, Eshed Y:内源和合成的microrna刺激多靶点的同步,有效和局部调控。植物细胞,2006,18(5):1134-1151。10.1105 / tpc.105.040725。
- 53.
刘建军,刘建军,刘建军,等。一种新型农杆菌介导植物转化的Ti载体。植物化学学报,2002,32(6):819-832。10.1023 /: 1006496308160。
- 54.
拟南芥叶片原生质体的瞬时转化:一个研究基因表达的多功能实验系统。植物学报,1994,5(3):421-427。10.1111 / j.1365 - 313 x.1994.00421.x。
- 55.
玉米和拟南芥叶肉原生质体的信号转导。植物生理学报,2001,27(4):1466-1475。10.1104 / pp.010820。
致谢
国家高技术研究发展计划项目(2012AA101702)、国家基础研究计划项目(2013CB127101)、国家自然科学基金项目(31071798,31272166)、重庆市科学技术委员会项目(2011BA1024)和中央高校基本科研业务费专项资金(项目编号:2012AA101702)资助。CDJXS10231118)。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明没有利益冲突。
作者的贡献
ZQX, ZGL和YWY设计了这项研究。ZQX从数据库中收集数据集并对数据进行分析,然后编写论文初稿。本研究使用的ZQX和WH构建载体。ZQX、NT和XYW补充了BY2瞬态转变和观测部分。所有作者都阅读并批准了最终的手稿。
电子补充资料
染色体的定位和外显子-内含子定位
附加文件1:SlAGO基因。(doc 32kb)
13个克隆的基本信息
附加文件2:SlAGO基因。(doc 44kb)
12870 _2013_1343_moesm11_esm.doc
附加文件11:用于miRNA切片位点3 ' RACE, 5 ' RACE或5 ' RACE定位的引物确认。(doc 48kb)
NCBI的接入号
附加文件12:AtAGO基因。(doc 31kb)
用于PCR检测各基因表达的引物
附加文件13:SlAGO番茄组织中的基因。(doc 44kb)
权利和权限
开放获取本文由BioMed Central Ltd.授权发表。这是一篇开放获取的文章,在知识共享署名许可(https://creativecommons.org/licenses/by/2.0),允许在任何媒体上不受限制地使用、分发和复制,前提是正确引用原创作品。
关于本文
引用本文
献忠,杨,杨,黄伟。et al。植物的分子克隆与特性SlAGO家庭在番茄。BMC Plant Biol13日,126(2013)。https://doi.org/10.1186/1471-2229-13-126
收到了:
接受:
发表:
关键字
- 前
- microrna的
- RISC
- 亚细胞定位
- 病毒防御