摘要
背景
纤维素是植物细胞壁的重要组成部分,约占植物总生物量的40%,但对其合成机制的了解仍不清楚。纤维素合成酶A (CESA)蛋白是在质膜上合成纤维素的玫瑰花形复合体的催化亚基。拟南芥和大米(栽培稻)次生壁中国极限运动协会功能缺失突变体茎弱,细胞壁不规则或薄。
结果
在这里,我们确定了次级墙的候选者中国极限运动协会年代Brachypodium distachyon具有类似氨基酸序列和表达的答:芥,即CESA4/7/8。对功能描述BdCESA4而且BdCESA7在美国,我们使用人工microRNA结构产生了功能缺失突变体,专门针对玉米(玉米)泛素启动子。转基因的存在减少了BdCESA4而且BdCESA7转录本丰度、茎面积、木质部和纤维的细胞壁厚度以及细胞壁中结晶纤维素的含量。
结论
这些结果说明BdCESA4而且BdCESA7起关键作用b . distachyon次生细胞壁生物合成。
背景
随着化石燃料的持续消耗,人类在寻找可再生能源方面面临着日益严峻的挑战。虽然从植物中提取的生物质含有可观的能量,但要作为运输燃料,它必须通过化学或生物液化,这是一种经济的转变。想要取得成功,不仅需要化学技术的进步,比如更好的催化剂,还需要改良植物作为原料。作为一种理想的投入,草受到了相当多的关注,因为某些品种生长密度很大,是多年生的,几乎不需要任何肥料或灌溉[1].但是它们的体型、寿命和基因组的复杂性使得这些物种很难进行研究和繁殖。
对于草类的研究,无论是作为生物燃料的来源还是任何其他特定于草类的问题,一个新兴的模型是Brachypodium distachyon。本种与谷类和温带草有密切的亲缘关系,大小与拟南芥并且有相同的世代时间。研究b . distachyon受益于快速发展的社区资源,如完全测序的基因组、突变集(包括化学衍生和序列索引DNA插入)以及高效的转化和交叉协议[2- - - - - -5].生物燃料研究尤其值得注意,b . distachyon具有与其他草类(如小麦)相似的细胞壁成分(氚aestavum),大麦(大麦芽),芒草(6- - - - - -8].由于细胞壁几乎构成了将生物量转化为生物燃料的全部输入,这种相似性,以及这种小草的遗传属性,强调了它作为与草相关的生物质作物研究的模型的适用性。
在细胞壁内,纤维素作为优化的目标是突出的。纤维素是所有单壁成分中含量最多的,它完全由葡萄糖构成,葡萄糖是一种易于驾驭的富含能量的分子。纤维素包括在质膜上合成的(1-4)β-连接葡萄糖的长聚合物,并与微纤维横向结合。由于葡萄糖残基的结构,氢键在链内和链间以很高的密度形成,这种密度使纤维素的弹性模量可与钢相媲美,但使其结构不受化学或酶降解的影响。
在质膜内,合成纤维素的结构称为“末端复合体”[9- - - - - -11].在陆生植物及相关绿藻中,在电子显微镜下看到的末端复合体由六个具有六边形对称的亚基组成,称为“莲座”[12].玫瑰结的主要成分是纤维素合成酶A (CESA)蛋白。这些蛋白质属于过程糖基转移酶家族2,被认为是聚合葡萄糖链的催化亚基。在被子植物中,CESAs通常由一个大约十个成员的小基因家族组成[13,14].
CESA蛋白的鉴定及其功能的鉴定很大程度上得益于基因的易变性答:芥。从这项工作中,我们发现某些CESA蛋白合成初级细胞壁,而其他蛋白合成次级细胞壁[15,16].此外,一个给定的细胞似乎必须表达三种不同的CESA蛋白,以产生最佳水平的纤维素。对于次生细胞壁,基于塌陷木质部细胞的筛选导致了几个识别不规则的木质部(irx)行,其中三行,irx5,irx3,irx1,分别在AtCESA4, 7和8处的港湾病变[17- - - - - -19].这些基因在相似的细胞类型中以相似的水平表达,从而支持了非冗余的假设,而缺失突变体具有难以区分的表型,包括茎弱、木质部塌陷和缺乏纤维素的次生细胞壁薄。
三组主要负责次生细胞壁纤维素合成的CESA基因的鉴定已经得到了包括草类在内的其他系统的支持。首先,AtCESA4、7和8在某些被子植物物种中分别由一个序列表示,同源的关系比同源的关系更密切(即不同物种的CESA4之间比单个物种的CESA4、7和8之间更相似)[13,20.,21].第二,在草类中,大麦的一种变种,脆弱的茎2成熟植株茎脆和纤维素含量低的原因是大麦中AtCESA4同源物的病变[22].另外,“脆茎水稻中的突变体(栽培稻)已经被映射到AtCEA4、7和8的三个同源基因上,这些突变体同样具有类似的表型,包括中度侏儒症、更薄和更弱的秆以及纤维素含量减少[23].然而,目前尚不清楚为什么需要三种不同的蛋白质,也不知道哪一种功能丧失表型直接源于蛋白质的丢失,而哪一种是累积效应的结果。
这里我们描述中国极限运动协会基因家族在b . distachyon借助基因表达谱和系统发育。此外,通过对特定人造microRNA结构产生的突变体进行功能表征,对候选次级CESAs进行了详细分析。
结果
Brachypodium distachyon中国极限运动协会基因家族
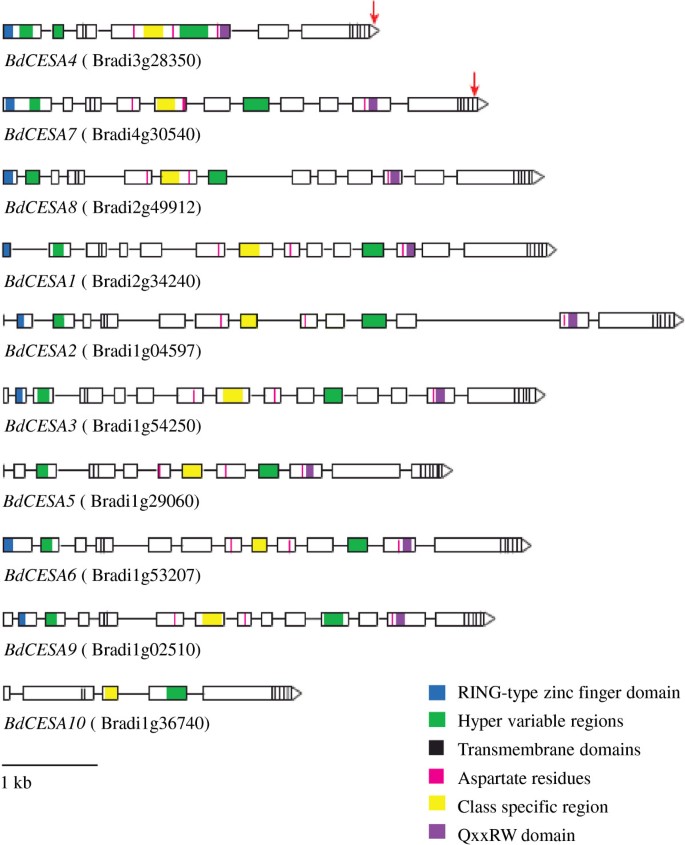
在b . distachyon就像在答:芥与水稻相比,CESA家族由10个基因组成(图1).它们的基因组序列在3045 - 7601 bp之间,有5 - 14个外显子,形成2331 - 3279 bp(776 - 1092个氨基酸)的编码区。氨基酸序列比较显示bdesa蛋白之间有广泛的相似性,具有CESA蛋白家族特有的保守结构特征[13,14].所有10个bdesa蛋白都包含8个跨膜结构域和2个高可变区。除了BdCESA10外,它们都具有葡萄糖转移酶D,D,D,QxxRW的特征基序,这是结合UDP-Glucose所必需的。除BdCESA5和10外,其余蛋白均含有环型锌指结构域,其中有8个胱氨酸残基作为CESA蛋白的特征。尽管BdCESA10被归类为CESA,但它很短,缺少环型锌指基序、第一个超可变区的一部分,以及QxxRW基序的两个保守的天冬氨酸残基。对于OsCESA11和高粱(高粱二色的) Sb10g023430,尽管如此,它们都被认为是CESA家族的一部分[24].
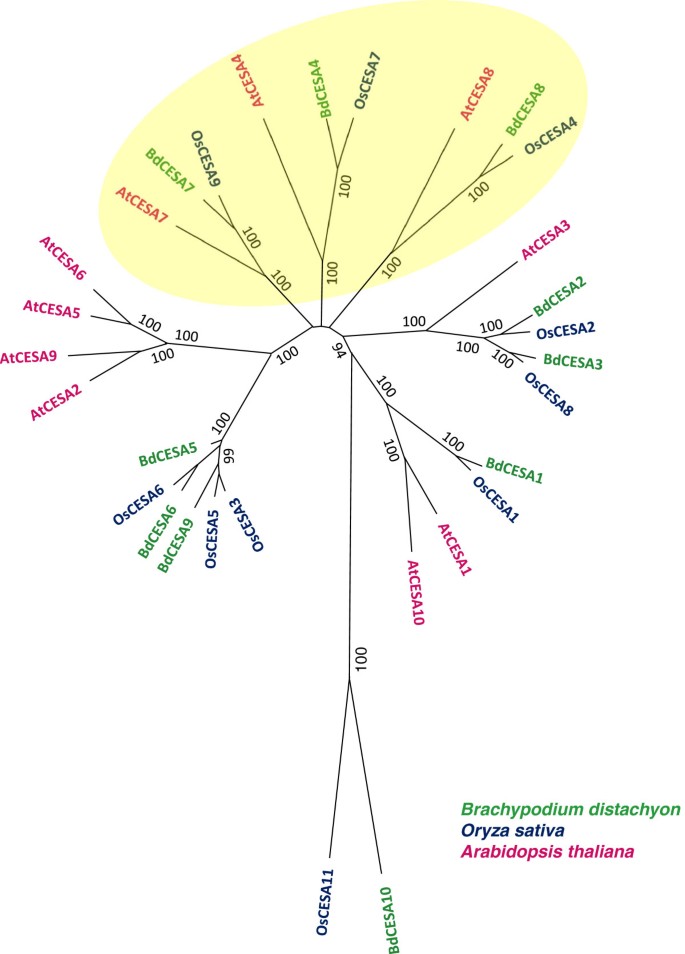
根据氨基酸序列,十种bdesa蛋白可分为相当完善的系统发育组(图2).这在与次级细胞壁相关的蛋白质中表现得最为明显。Brachypodium distachyon有三个序列与其他物种的次生细胞壁CESAs特征高度相似。我们给这些基因编号BdCESA4,BdCESA7,BdCESA8根据他们在答:芥。注意,公布的编号不同于大米。虽然三个次级CESA分支在每个物种中都有一个成员,但与原代细胞壁相关的CESAs并没有完全的一对一关系。例如,b . distachyon在CESA1分支中只有一个序列,而答:芥有两个。相比之下,b . distachyon在CESA3分支中有两个序列,而答:芥只有一个。有趣的是,这两个b . distachyon而且答:芥都有几个CESA6分支的成员,但这些重复似乎是在两个物种分化后在每个谱系中形成的。根据序列和保守结构域,BdCESA10似乎是与其他CESA蛋白最不相似的。然而,对纤维素合成酶a蛋白和纤维素合成酶样蛋白进行了系统发育分析答:芥、大米和b . distachyon发现BdCESA10与其他CESA蛋白具有明显的相似性1:图S1)。在可能的情况下,我们给b . distachyon以其近亲命名的基因答:芥。
鉴于我们对次生细胞壁的兴趣,我们检查了b . distachyon次级细胞壁序列在更大的深度(附加文件2:图S2)。在富含胱氨酸的环型锌指结构域中,第二和第三个胱氨酸之间的间距不同。BdCESA4有15个氨基酸,而BdCESA7有一个氨基酸插入,BdCESA8有8个氨基酸缺失。这种间隔变化显然以前没有报道过答:芥中国极限运动协会。然而,与BdCESA8同源的水稻次生CESA也表现出同样的8个氨基酸缺失[23].环型锌指结构域是位于n端第一部分的CESA蛋白的显著特征,被认为与CESA蛋白二聚有关[10,11].
Brachypodium distachyon次生细胞壁CESA基因表达
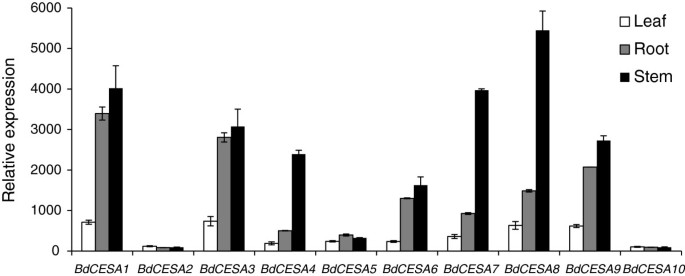
分析中国极限运动协会基因表达,我们用全基因组平铺阵列分析转录本,聚焦于有望在次级细胞壁合成中富集的器官。为了获得RNA,当花序从旗叶中出现时,就采集叶和茎,而根则从7天大的幼苗中采集。此外,为了尽量减少由于昼夜节律引起的转录物丰度变化,RNA从24小时内六个不同昼夜节律点收集的材料中收集。在这三个器官中,BdCESA2而且10表达在基本的背景水平和BdCESA5略高(图3.).与初级细胞壁相关的四个基因,BdCESA1 3,6,9,在根和茎中均有高表达。另一方面,与次生细胞壁相关的基因在根中的表达水平远低于茎,在三种器官类型中,其表达比例与次生细胞壁含量大致一致(附加文件3.:表S1)。
推测次生细胞壁CESA转录本的定位
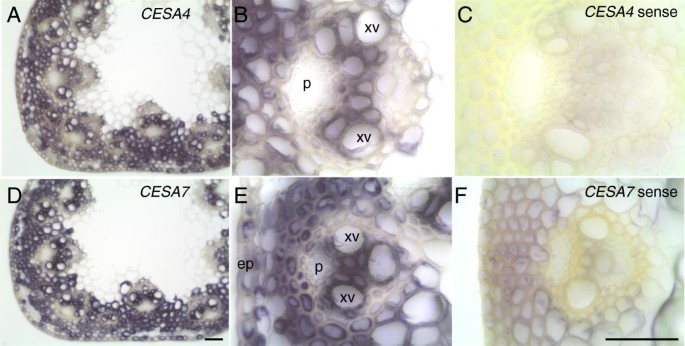
为了定位转录本,我们使用了RNA原位茎上的杂交(图4).将茎固定,用振动器切片,用标记的感觉探针和反感觉探针杂交。在颜色发育过程中,阳性杂交主要发生在反义探针探测的部分。与次级细胞壁合成的作用一致,每个探针的杂交在维管束和周围的机械细胞(包括厚壁组织纤维和表皮)中都很强。髓实质中基本检测不到杂交,其细胞壁增厚有限。这些结果加强了BdCESA4而且BdCESA7作为次生细胞壁相关的CESAs。
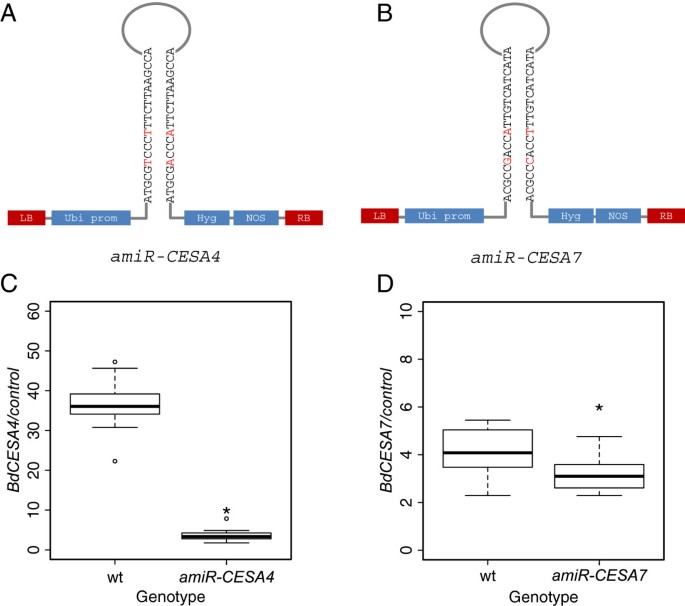
靶向BdCESA4和BdCESA7的人工微rna
为了检测BdCESA4和7的功能,我们试图通过人工microRNAs (阿米尔).大米microRNA,osaMIR528,被修改为专门针对两者BdCESA4或BdCESA7(图5A, B).每个修饰的microRNA预计只针对一个基因。的amiR-CESA4构建靶向核苷酸3106 ~ 3126,它们位于最后一个跨膜结构域后的最后一个外显子上;相比之下,amiR-CESA7靶向核苷酸3028至3048,位于第七和第八跨膜结构域之间的最后外显子(图1).为了表征这些结构的疗效,我们测量了T3.一代植物。对于每个结构,来自三到四个独立转化事件的家族的3到5个个体通过逆转录酶定量PCR (RT-QPCR)进行分析。当花序刚从旗叶上冒出来时,茎就被收获了,在发育的相同时间点。两种人工microRNA结构都显著降低了相应靶标的转录物丰度(图5C, D)。具体地说,BdCESA4减少了9.5倍BdCESA7减少了1.5倍。两种转基因均未检测到降低BdCESA8而且amiR-CESA7没有引起明显的下降BdCESA4;然而,amiR-CESA4的表达略有下降BdCESA7(附加文件4:图S3)。
BdCESA4和BdCESA7敲除线和茎的结构
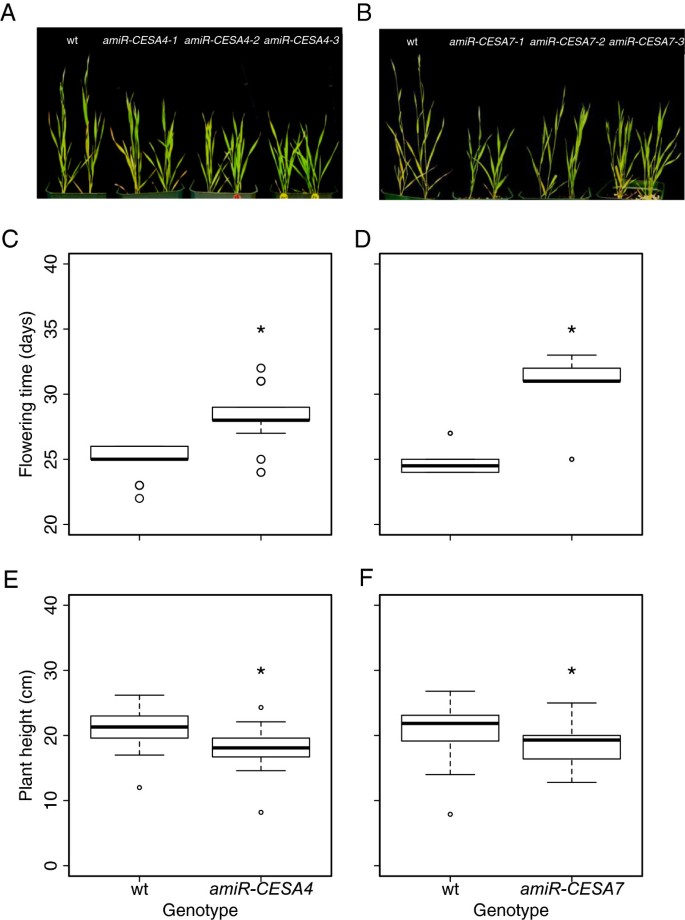
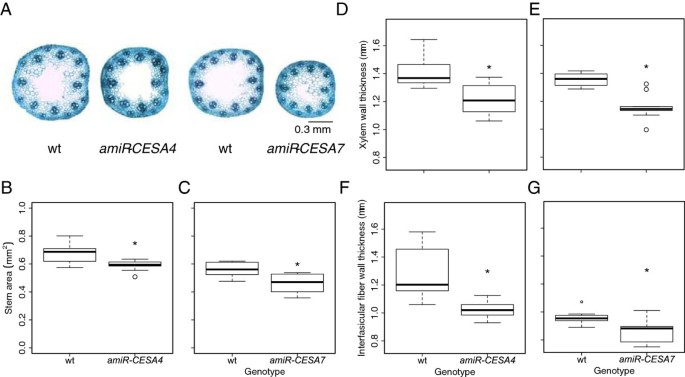
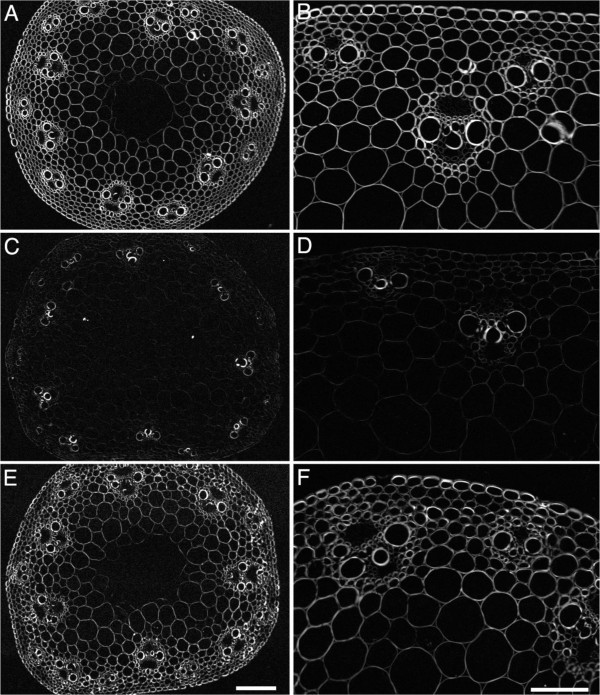
的BdCESA敲除系在身高上有轻微但显著的下降,并且在花序出现上有延迟6).为了研究解剖结构的变化,我们首先检查了mRNA水平测定的同一植物的节间形态。由于转基因系生长在不同的时间,每次比较都包括一个野生型对照,这些对照之间的差异大概反映了生长条件的差异。用多色碱性染料甲苯胺蓝染色,用光学显微镜成像。甲苯胺蓝染色细胞壁聚合物-多糖紫蓝色和木质化细胞壁绿松石-允许区分细胞类型。人造的microRNA结构对维管束的整体形状和排列几乎没有影响(图7A).同样,无论是内环还是外环,维管束数量的基因型之间没有显著差异(数据未显示)。虽然解剖结构的变化很小或没有,但茎粗似乎减少了,与植株高度的降低一致。茎面积的测量显示了适度的减少,但两者都是显著的amiR-CESA4而且amiRCESA7(图7B, C)。
整个植物表型。(A, B)野生型花序出现时的植物。代表植物的野生型和三个独立的株系用于每个结构。(C, D)天至花序出苗。(E, F)成熟的株高。对每个结构分析了来自三个独立系的20到30个个体。箱形图和意义如图所示5。
茎解剖学。(一)甲苯胺蓝染色横切面。(B, C)茎区。细胞壁厚度(D, E)后生木质部和(F, G)维管束间的纤维。首先从发育相当的植株中收集节间,在花序浸透时进行分析。分析了来自三个独立系的三到五个个体。箱形图和意义如图所示5。
为了检验人工构建的microRNA对细胞壁结构的影响,我们测量了甲苯胺蓝染色切片的细胞壁厚度。对于这两种靶点,构造物都适度减少了细胞壁的厚度,但显著减少(图7d)。木质部和束间纤维的减少类似。这一观察结果与次生表型一致中国极限运动协会其他草种的突变体特征[22,23,25].
BdCESA4和BdCESA7的敲除率及结晶纤维素含量
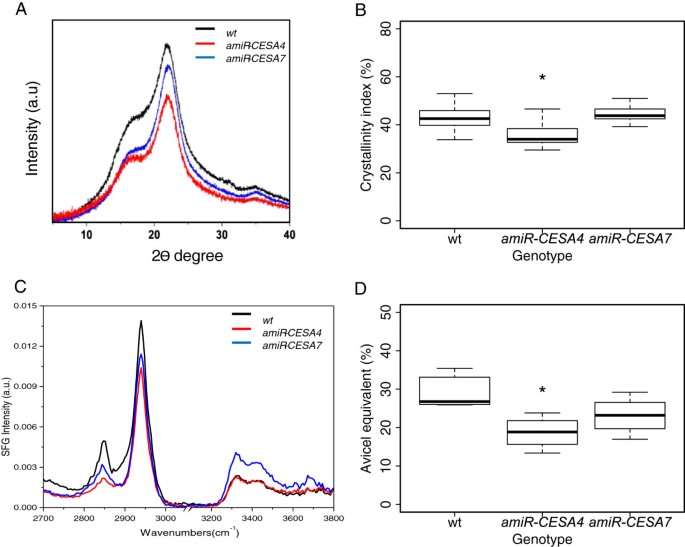
茎的缩小和细胞壁的变薄表明细胞壁结构可能发生了变化。分析完全衰老和均质化的茎组织。首先,用x射线粉末衍射法测定晶体纤维素含量,使用图中分析的相同个体6而且7,两个野生型样本汇集在一起。在几乎所有的测量角度上,转基因基因型的衍射图样强度都较低amiR-CESA4比以前更强大amiR-CESA7(图8A).如方法中所述,为了评估纤维素的结晶度,我们通过所谓的“无定形减法”计算结晶度指数(图1)8B).结晶度指数证实了衍射图案的视觉印象,即纤维素结晶度显著降低amiR-CESA4。
纤维素结晶度的光谱分析。(一)x射线粉末衍射剖面。(B)结晶度指数由使用非晶态纤维素减法的衍射剖面推导而来。(C)Sum-frequency-generation振动光谱。(D)纤维素结晶度由与Avicel光谱比较得到。对每个转基因基因分析来自三个独立品系的8到12个个体。箱形图和意义如图所示5。
其次,我们通过和频率产生(SFG)振动光谱来评估晶体纤维素的含量[26].在该方法中,样品被532 nm的可见光激光脉冲和频率可调的红外激光脉冲同时照射。在反射光和散射光中,有两种光子的频率是两个输入激光频率的和,可以分别过滤和记录。由于对称性要求,这种频率累加可以由晶体纤维素引起,而不是由非晶态非晶态细胞壁成分引起[26].在这个分析中,线是同时生长的。在光谱中,有三个突出的峰表明晶体纤维素Iβ:即2850 cm-1归因于对称CH2拉伸,2944厘米-1归因于不对称CH2拉伸,3320厘米-1归因于链内氢键羟基拉伸(图8C) (26,27].以高结晶度的Iβ型纤维素Avicel为标准,强度为2944 cm-1可用于通过先前确定的校准曲线估算结晶纤维素量[27].2944厘米处录得的烈度比较-1表明,在低温条件下,avicel当量晶体纤维素含量有降低的趋势amiR-CESA7显著降低了amiR-CESA4(图8D).这些结果与x射线衍射的结果相当。
为了在细胞尺度上检查纤维素的结晶度,我们使用偏振光显微镜对植物一次性生长,也用于和频率产生光谱学。正如方法中所描述的,我们的显微镜是基于圆偏振光的,允许对比度与垂直于显微镜光轴的平面内的晶体方向无关,并生成强度与双折射延迟成正比的图像(图9).正如预期的那样,由于纤维素的普遍存在,野生型的所有细胞壁都有延迟,其中表皮、上皮部和维管鞘细胞特别强(图9A, B)。相反,在茎的细胞壁amiR-CESA4弱智(图9C, D)。虽然延迟会随着细胞壁厚度的增加而减小,但延迟的减小幅度远大于细胞壁厚度的减小幅度。同样,与野生型相比,细胞壁amiR-CESA7有较少的智力障碍(图9E, F)。然而,对于这种基因型,减少是适度的,在可能归因于细胞壁更薄的范围内。这些结果,连同衍射和光谱学的结果,证实了还原表达BdCESA4减少次生细胞壁中结晶纤维素的数量。
讨论
为b . distachyon这显然是第一个详细研究中国极限运动协会基因家族和功能特征BdCESAS参与次生细胞壁合成。CESA家族成员的最佳特征是答:芥,它们在原细胞壁或次生细胞壁中扮演纤维素合成的角色。其他维管植物也有类似的基因家族结构[13].的b . distachyon中国极限运动协会基因家族包括无特征的草特异性CESA分支(BdCESA10),它已经在迄今为止测序的所有草的基因组中被识别出来,以及之前描述的所有其他分支[13,24,28].
利用氨基酸序列,将10个bdesa基因分为两组:一级和二级。三个次级CESA分支都包含一个答:芥蛋白质和一个单一的大米蛋白质,它们都有功能特征[17,18,23].合适的是,这些分支中都存在一个单一的bdesa蛋白,这表明它们在1.4 - 1.5亿年前的单子叶和单子叶分化时期就没有扩张过[29].这对于初生cesa是不同的,它们在优生子和单生子之间有不同的扩张。在CESA1和CESA3分支中有不同数量的蛋白质答:芥,b . distachyon而CESA6枝则分化为独立的多子叶枝和单子叶枝,分别称为CESA6A和CESA6B [13].在三个二级中b . distachyon中国极限运动协会,BdCESA8是最具分歧的,就像那个支系成员(OsCESA4)在大米中[23].此外,BdCESA8而且OsCESA4两者都缺乏第一个RING型锌指基序中的8个氨基酸。然而,答:芥CESA8两者都不缺乏这8种氨基酸,也没有明显的差异。
证实从系统发育推论,次生表达BdCESAs通常在茎中富集,茎中次生细胞壁丰富,转录本在茎维管组织和周围的机械组织包括亚表皮细胞层中特别丰富,这些组织都是次生细胞壁的组成部分。这与在水稻、玉米、答:芥,和大麦(19,24,30.,31].有趣的是,在大麦茎的发育过程中,HvCESA8表达量是对照组的两倍HvCESA4(31],也在这里观察了BdCESA8而且BdCESA4。综上所述,我们得出这样的结论BdCESA4,7,而且8为次生细胞壁编码纤维素合酶催化亚基。
据我们所知,这是第一个关于人工微rna介导的基因沉默的报道b . distachyon。我们描述了生成的功能丢失线BdCESA4或BdCESA7形态学和纤维素结晶度的变化。虽然这些品系在花序出现上有微小但显著的延迟和身高的降低,但整个植株的形态与野生型植株相似。同样,开花延迟和身高降低在观察答:芥irx3突变体和在水稻中脆茎突变体(25,32].茎的切片显示,敲除系的茎节间横截面积有小而显著的减少,这种减少与在水稻中观察到的类似脆茎突变体和大麦脆弱的茎2(23,33].
的失函数线BdCESA4而且7木质部和厚壁细胞壁较野生型略薄。细胞壁变薄是由次生细胞壁纤维素合成的缺陷引起的,在次生细胞壁中观察到的结果是一致的中国极限运动协会突变体(22,23,25].在答:芥,继发性的定义表型中国极限运动协会突变体不规则或木质部塌陷[17,18].然而,这里的木质部轮廓似乎是规则的,就像在次生木质部一样中国极限运动协会水稻的突变体[23].这些差异可能反映了优生和单生在木质部张力或细胞壁组成上的差异,而不是蛋白质功能上的差异[34,35].
纤维素是由β(1-4)连接的葡萄糖分子组成的线性葡聚糖聚合物。36个这样的葡聚糖链预计会形成纤维素微纤维[36].微纤维之间的氢键使多个纤维素链结晶在一起,提供维持植物细胞壁刚性所必需的物理特性。结晶度也使纤维素易于定量。我们利用光谱技术(x射线衍射和和频率产生)和偏光显微镜来评估纤维素在功能丧失线中的地位。
为amiR-CESA7突变体的结晶度在光谱上没有明显下降,双折射延迟的轻微下降可能反映了细胞壁变薄。考虑到BdCESA7表达量减少了不到两倍,一般野生型纤维素的地位也许并不出乎意料。相比之下,amiR-CESA4从衍射和光谱的方法来看,突变体大大降低了延迟性和显著降低了结晶度。对这些数据最简单的解释是,这一细胞壁的纤维素含量比野生型的细胞壁要少。一种微妙的解释是,在这一生产线合成的纤维素含有更多的缺陷,如非晶态区域,或含有比通常葡萄糖链数量(如36个)更少的微原纤维。这些选择很难区分。尽管如此,在晶体纤维素的数量或质量的显著下降在这一行匹配近10倍的减少BdCESA4表达式。这一结果表明BdCESA4至少部分非冗余,值得注意的是,两者的表达式都不是BdCESA7也不8被提升是为了获得补偿。
结论
有趣的是,尽管这两个品系在被破坏的强度和随之而来的纤维素损失方面存在差异,但植株的形态缺陷却是相似和适度的。这意味着CESA活性的微小下降足以影响植物,可能通过类似于上述的反馈系统答:芥调用忒修斯(37],但这种植物渐进式的更大变化并不一定伴随着CESA活性的更大下降。在这方面,观察BdCESA4完全丧失功能突变体的表型将是有趣的。
方法
植物材料与生长
Brachypodium distachyon(l)行Bd 21-3贯穿始终。种子在6°C的潮湿纸巾中浸泡7天,种植在盆栽混合物(#2;康拉德Fafard Inc .)Agawam, MA),并在20°C生长室中生长,光照20小时,黑暗4小时,通量为220 μmol。米2。年代-1且相对湿度~68%。平板种植时,种子去皮,用水浸泡2 h,摇匀。然后用70%乙醇处理20 s,用无菌水冲洗,在室温下用1.3% NaClO浸泡4 min,同时摇晃。种子随后用无菌水冲洗三次,并在4°C的黑暗环境中保存至少2天,在无菌的有滤纸的培养皿中。幼苗在0.5强度MS培养基上生长7天,pH值调整为5.8,加入KOH并含有0.7%琼脂(Difco“Bacto琼脂”)。
的识别纤维素合酶一基因
完整的,翻译的氨基酸序列的十个答:芥在Phytozome v8.0数据库的BLASTP和NCBI数据库中使用CESA蛋白和纤维素合成酶样家族成员作为查询,进行同源性鉴定b . distachyonCESA基因和鉴定蛋白的命名依据答:芥同行,在可能的情况下。使用ClustalW程序进行多个序列比对,使用MEGA5软件采用邻居连接方法生成系统发育树,包含1000个自举排列[38].
转录本丰度的测量
在微阵列分析中,叶和茎与根使用了不同的生长状态。对于叶和茎,在发芽和生长后大约30天,当花序开始从旗叶中出现时,收集总叶和茎。用弯尖探针从茎中分离出叶片。将从第二叶结点到花序下方节间的节和节间冷冻在液氮中。对于根,将7天大的整株幼苗快速冷冻在液氮中,然后将根剪下放入无菌培养管中。对于所有器官,材料在一天中采集6次(生理时间2、6、10、14、18和22小时)。每个时间点分别解剖3株植物,每种组织类型分别解剖3份。样品保存在液氮或−80°C中,直到RNA提取。组织用臼和杵在液氮中研磨。根据制造商的说明使用试剂盒(Plant RNaeasy, Qiagen, Valencia, CA)提取RNA。 For hybridization, cDNA probes were synthesized using a kit (WT Ambion Santa Clara, CA).
探头应用于b . distachyonBradiAR1b520742全基因组平片阵列(Affymetrix, Santa Clara, CA)。该序列包含约650万个独特的25聚寡核苷酸特征,包括正链和反链序列。整个基因组序列在每个阵列特征之间平均有30个碱基;160万个特征对应于外显子和内含子,490万个特征对应于基因模型之间(Todd Mockler, Donald Danforth植物科学中心,个人交流)。大约~95%(~ 26670)的基因至少有5个相应的外显子阵列特征,从这些特征计算出每个基因模型的汇总值。使用gcRMA计算probset值[39].
为了从转基因植株中获取RNA,在花序刚刚从旗叶可见的同一发育阶段收集茎。将最高茎的第一、第二、第三节及节间冷冻于液氮中,均质后按上述方法提取RNA。
RT-QPCR中,使用无rnase - DNase I (Qiagen)进行柱上DNA消化。第一条cDNA由1 μg总RNA使用Superscript III逆转录酶和oligo dT引物合成(Invitrogen, Grand Island, NY)。样品用无RNase水(Qiagen)稀释3倍,每个cDNA样品取1 μL进行RT-QPCR,用GapDH引物检测基因组DNA污染情况。使用QuantiFast SYBR Green PCR Kit (Qiagen),用20 μL反应体积和1 μL稀释的cDNA进行三次定量PCR反应。这些反应是在Eppendorff Realplex中进行的2Mastercycler使用以下条件:95°C 2分钟,然后进行40个循环,95°C 15秒,60°C 15秒,68°C 20秒。作为正常化的参考基因,BdUBC18(泛素结合酶18)和Bd5g25870(属于核激素受体结合类)使用[40].qPCR引物设计使用QuantiPrime引物设计工具[41].
RNA原位杂交
核糖核酸原位采用先前描述的方法进行杂交[42,43].简单地说,3 '结束BdCESA4而且BdCESA7克隆到pGEM-T Easy载体中,并使用试剂盒(DIG标记试剂盒,Roche, Indianapolis, IN)作为模板生成标记感和反感ribo探针。3周龄的茎段在−80℃冷冻,并在4%多聚甲醛/乙醇:乙酸(3:1)中固定在4℃过夜[44].固定组织用4%琼脂糖包裹,用振动器切片。用镊子从琼脂糖中取出切片,在磷酸盐缓冲盐水(PBS;33毫米Na2HPO41.8 mM NaH2阿宝4和140 mM NaCl, pH 7.2),在含有3.7% (v/v)甲醛和2mg /mL甘氨酸的PBS中室温固定20分钟。切片在PBS中洗涤,分级乙醇系列脱水,在65°C与混合溶液预杂交1 h,混合溶液由20X SSC (3M NaCl, 0.3M Na柠檬酸钠)含有20% SDS, 3.7%甲酰胺和10 mg/mL酵母tRNA在depc处理过的水中组成。然后用dig标记的sense和反义探针在65°C下杂交过夜,并用一系列含SSC和SDS的溶液洗涤。Anti-DIG碱性磷酸酶fab fragment (Roche)在1:1000的稀释条件下使用,在4℃下孵育过夜。在0.1 M Tris (pH值9.5),0.1 M NaCl中,用硝基蓝四唑和5-溴-4-氯-3-吲哚基-磷酸盐(Roche)检测碱性磷酸酶,并用连接在尼康eclipse 200显微镜上的PixeLINK相机成像。
人工微构造
人工microRNA序列设计在Web microRNA Designer平台(http://wmd3.weigelworld.org)基于JGIb . distachyon基因组注释1.0版本[5].的amiR-CESA4构建了杂化能为−37.74 kcal/mol的靶标AAGGGACCCATTCTTAAGCCAamiR-CESA7构建杂化能为−37.37 kcal/mol的靶标ACGCCCACCATTGTCATCATC。构建物由pNW55质粒工程,以取代本地水稻microRNA前体的靶向区域osaMIR528(45].MicroRNA靶用PCR扩增5:表S2)根据Warthmann等人。[45克隆到pENTR/D-TOPO (Invitrogen)。序列确认的克隆与目标载体pOL001的修改版本进行重组[46, pOL001-ubigate-ori1和转化成Agrobaterium农应变AGL1通过电穿孔。
植物转化
根据Vogel等人的说法,进行了转化。[47].简单地说,从6到7周的植物中收集种子并去胶。用含0.01% Triton-X100的1.3% NaClO溶液表面消毒种子4分钟。分离胚胎,无菌条件下置于愈伤组织起始培养基上。愈伤组织在分离后的第4周和第6周进行两次继代培养。七周大的愈伤组织浸没在农悬浮5分钟,在滤纸上晾干。接下来,在22°C、黑暗的干燥滤纸上共同培养三天。共培养后,将愈伤组织转移到含有40 mg/L湿霉素和200 mg/L timentin的选择平板上,在28°C的黑暗环境中培养四周。选择后,将愈伤组织转移到Linsmaier和Skoog培养基中,在28°C恒定光照下再生,然后转移到Murashige和Skoog培养基中,在相同条件下生根。接下来,它们被移植到土壤中,像上面描述的那样生长。
基因组DNA提取和基因分型
Csaikl等人从叶片中提取基因组DNA。[48稍作修改。简单地说,将叶片冷冻在液氮中,并在球磨机(MM400, Retsch, Newtown, PA)中使用3.2毫米直径的不锈钢金属球(Biospec Products, Bartlesville, OK)进行研磨。研磨样品在DNA提取缓冲液(100 mM NaCl, 50 mM Tris, 25 mM EDTA, 1% SDS, 10 mM 2-巯基乙醇)中65℃孵育10分钟。接下来,加入5 M乙酸钾,在冰上孵育20分钟,离心10分钟。将上清与异丙醇混合,以最大速度离心10分钟,然后用70%乙醇洗涤DNA。将成球的DNA重悬在1X TE中,并使用分光光度计(NanoDrop 1000, Themo Scientific, Waltham, MA)测量样品的完整性。以提取的基因组DNA为模板,采用PCR方法对螺旋霉素位点进行基因分型;98°C初始变性2分钟,经过30个循环,98°C 30 s, 59°C 30 s, 72°C 55 s,最终在72°C延伸7 min。PCR证实阳性转化菌用于后续实验。
光学显微镜
为了进行组织化学分析,用刀片手工切片茎,用0.002%甲苯胺蓝在水中染色30 s。染色切片用水固定,在Eclipse E200MV R显微镜(尼康)下观察,并使用PixeLINK 3mp相机成像。图像在4倍放大倍率下捕获,并用ImageJ (http://rsb.info.nih.gov/ij/).在20倍放大下捕获的图像用于测量细胞壁厚度。
偏光显微镜下,节间节段固定在2%戊二醛50mm Na中2阿宝4缓冲液(pH值7.2)在室温下至少保存2小时,然后用标准技术处理并嵌入斯珀尔树脂中。半薄片(0.5 μm)在超显微刀上切割,安装在浸渍油中,并通过配备LC-PolScope (CRI Cambridge MA)的显微镜观察,如前所述[49].简单地说,该仪器使用圆偏振光和计算机控制的液晶补偿器获得四张具有已知补偿器设置的图像,并从中计算出第五张图像,其中每个像素的强度与双折射延迟成正比,以及第六张图像(这里不使用),其中每个像素的强度表示晶体光轴在样品平面内的方向[50].观察每个基因型的几个部分,所示图像具有代表性。
x射线衍射剖面和和频率产生振动谱
如Ruland等人所述,x射线衍射和结晶度指数的计算。[51稍作修改。如上所述,完全衰老的茎被磨碎用于基因组DNA提取。在X 'Pert Pro粉末X射线衍射仪(PANanalytical BV, The Netherlands)上使用Kα1 (λ = 1.5406 Å)和Kα2 (λ = 1.5444 Å)的CuKα辐射在45 kV和45 mA下进行衍射分析。在5 ~ 50˚范围内,通过0.0167步获得衍射剖面,每步耗时66 s。结晶度指数使用非晶减法计算,该方法通过从平行测量的木聚糖(Aldrich)获得的衍射剖面中减去非晶贡献来确定结晶度。在木聚糖剖面上应用比例因子以避免减去剖面的负值。每组分析8到12个人。如前所述,进行了和频振动谱分析[26].从完全衰老的植株上切除完整的第一个节间,每组包含4到6个个体,每个茎有10个测量值。结晶纤维素的含量通过比较2944 cm来估计-1样品的强度与艾维塞尔的强度之比,如前所述[27].
统计分析
每次测量,从三到四个不同的T3.每个转基因的家族。学生的t-测试在R中执行(v 2.15.0)。重要性被设定为P< 0.05。不同的独立转基因株系之间没有观察到明显的差异,因此被汇集起来。
支持数据的可用性
微阵列原始数据(CEL文件)已存入PLEXdb[加入号:BD3] [52].
参考文献
Heaton EA, Flavell RB, Mascia PN, Thomas SR, Dohleman FG, Long SP:草本能源作物的发展:近期进展和未来展望。生物工程学报,2008,19:202-10.1016/j.copbio.2008.05.001。
Brkljacic J, Grotewold E, Scholl R, Mockler T, Garvin DF, Vain P, Brutnell T, Sibout R, Bevan M, Budak H,等:短柄禾本科植物的模型:今天和未来。植物生理学报,2011,33(1):1 - 4。10.1104 / pp.111.179531。
Bragg JN, Wu J, Gordon SP, Guttman ME, Thilmony R, Lazo GR, Gu YQ, Vogel JP:西部区域研究中心短距离植物T-DNA插入突变体的生成与鉴定。PLoS ONE。2012, 7 (9): e41916-10.1371/journal.pone.0041916。
d'Yvoire MB, Bouchabke-Coussa O, Voorend W, Antelme S, Cézard L, Legée F, Lebris P, Legay S, Whitehead C, mc昆-梅森SJ,等:破坏肉桂醇脱氢酶1基因(BdCAD1)导致改变木质化和改善糖化Brachypodium distachyon。植物学报,2012,29(3):366 - 366。
国际短柄草计划:模式草的基因组测序和分析Brachypodium distachyon。自然学报,2010,43(6):763-768。10.1038 / nature08747。
李文华,李文华,李文华。糖化过程分析Brachypodium distachyon温和水解条件下的茎。生物技术生物燃料。2008,1:15-10.1186/1754-6834-1-15。
Christensen U, Alonso-Simon A, Scheller HV, Willats WGT, Harholt J:植物幼苗初代细胞壁的表征Brachypodium distachyon-温带牧草的潜在模式植物。植物化学学报,2010,71(1):62-69。10.1016 / j.phytochem.2009.09.019。
吉隆F、布歇B、杰姆F、罗伯特P、卡门纳B、巴伦C、拉尔C、杜马斯P、索尔尼尔L:Brachypodium distachyon籽粒:胚乳细胞壁的特征。中国生物医学工程学报,2011,32(3):371 - 371。10.1093 / jxb / erq332。
高等植物中的纤维素合成。中国生物医学工程学报,2006,22:53-10.1146/annurev.cellbio.22.022206.160206。
在离体的叶肉细胞中,莲座从高尔基体到质膜的运输Zinnia线虫悬浮培养中气管细胞分化过程。中国生物医学工程学报,2004,24(3):369 - 369。
木村春,王晓燕,王晓燕,崔新军,林德CR, Brown RM:维管植物莲座结末端纤维素合成复合物的免疫金标记豇豆属活动。植物科学学报,2004,25 (3):366 - 366
多布林MS,库雷克I,雅各布-威尔克D,德尔默DP:植物中纤维素的生物合成:从基因到莲座。植物生理学报,2002,38(4):369 - 369 / 369。
Carroll A, Specht C:通过对纤维素合成酶家族序列的全面研究来了解植物纤维素合成酶。植物科学进展,2011,2:5-
尹亚波,黄建林,徐勇:植物和藻类全序列纤维素合成酶超家族。植物工程学报,2009,29(3):379 - 379。10.1186 / 1471-2229-9-99。
Desprez T, Juraniec M, Crowell EF, Jouy H, Pochylova Z, Parcy F, Hofte H, Gonneau M, Vernhettes S:拟南芥初生细胞壁合成中纤维素合成酶复合体的组织。中国生物工程学报,2007,29(5):573 - 573。10.1073 / pnas.0706569104。
Persson S, Paredez A, Carroll A, Palsdottir H, Doblin M, Poindexter P, Khitrov N, Auer M, Somerville CR:拟南芥细胞壁纤维素合成酶复合体中三个独特成分的遗传证据。中国生物工程学报,2007,29(4):366 - 366。10.1073 / pnas.0706592104。
Taylor NG, Scheible WR, Cutler S, Somerville CR, Turner SR:拟南芥木质3不规则位点编码二级细胞壁合成所需的纤维素合成酶。植物科学学报,1999,29 (4):366 - 366
Taylor NG, Laurie S, Turner SR:拟南芥中纤维素合成需要多个纤维素合酶催化亚基。植物学报,2000,12(12):2529-2540。
NG Taylor, Howells RM, Huttly AK, Vickers K, Turner SR:三种不同的CesA蛋白在纤维素合成中的相互作用。中国生物工程学报,2003,30(4):359 - 359。10.1073 / pnas.0337628100。
李安,夏涛,徐伟,陈涛,李旭,范杰,王锐,冯松,王赟,王波,等:纤维素生产中4种CESA特异性异构体的综合分析陆地棉而且海岛棉。植物生态学报,2013,37(6):1585-1597。10.1007 / s00425 - 013 - 1868 - 2。
宋东,沈娟,李玲:杨木木质部分化过程中纤维素合成酶复合体的特征。植物生态学报,2010,29(3):369 - 369。10.1111 / j.1469-8137.2010.03315.x。
Burton RA, Ma G, Baumann U, Harvey AJ, Shirley NJ, Taylor J, Pettolino F, Bacic A, Beatty M, Simmons CR,等:定制的基因表达微阵列揭示了脆茎表型fs2大麦中含有一种逆转录元素HvCesA4纤维素合成酶基因。植物生理学报,2010,26(4):378 - 378。10.1104 / pp.110.158329。
Tanaka K, Murata K, Yamazaki M, Onosato K, Miyao A, Hirochika H:三个不同的水稻纤维素合成酶催化亚基基因需要在次生壁中合成纤维素。植物生理学报,2003,33(1):369 - 369。10.1104 / pp.103.022442。
王亮,郭凯,李颖,涂艳,胡红,王斌,崔旭,彭琳:基因表达谱分析与基因整合分析中国极限运动协会/CSL在水稻总科。植物工程学报,2010,10(1):282-10.1186/1471-2229-10-282。
张斌,邓亮,钱强,熊刚,曾东,李锐,郭亮,李娟,周勇:水稻CESA4跨膜结构域的错义突变影响质膜蛋白丰度,导致细胞壁生物合成异常。植物生物学杂志,2009,41(4):369 - 371。
Barnette AL, Bradley LC, Veres BD, Schreiner EP, Park YB, Park J, Park S, Kim SH:用和频率产生(SFG)振动光谱法选择性检测植物细胞壁中的晶体纤维素。生物大分子学报,2011,12(7):2434-2439。10.1021 / bm200518n。
Barnette AL, Lee C, Bradley LC, Schreiner EP, Park YB, Shin H, Cosgrove DJ, Park S, Kim SH:用和频率产生(SFG)振动光谱法定量木质纤维素生物质中的晶体纤维素,并与其他分析方法进行比较。高分子材料学报,2012,29(3):369 - 369。10.1016 / j.carbpol.2012.04.014。
Paterson AH, Bowers JE, Bruggmann R, Dubchak I, Grimwood J, Gundlach H, Haberer G, Hellsten U, Mitros T, Poliakov A,等:高粱双色基因组与草的多样性。自然学报,2009,457(729):551-556。10.1038 / nature07723。
周淑梅,张春春,陈慧玲,李文华:用全叶绿体基因组定年单双子代分化和核心单双子代起源。中华分子生物学杂志,2004,32(4):424-441。10.1007 / s00239 - 003 - 2564 - 9。
Appenzeller L, Doblin M, Barreiro R, Wang H, Niu X, Kollipara K, Carrigan L, Tomes D, Chapman M, Dhugga KS:玉米纤维素合成:纤维素合成酶的分离与表达分析(中国极限运动协会)基因家族。纤维素学报,2004,11(3):287-299。
Burton RA, Shirley NJ, King BJ, Harvey AJ, Fincher GB:大麦CesA基因家族(大麦芽):转录本定量分析发现两组共表达基因。植物生理学报,2004,34(4):394 - 394。10.1104 / pp.103.032904。
Turner SR, Somerville CR:拟南芥木质部塌陷表型鉴定出次生细胞壁缺乏纤维素沉积的突变体。植物生态学报,2004,22(5):369 - 371。
大久保A、樱井N、仓赖石S、武田K:大麦秆脆性(大麦芽L.)突变体是由细胞壁中纤维素分子数量减少引起的。植物生理学报,2001,27(2):369 - 369。10.1104 / pp.97.2.509。
沃格尔:草细胞壁的独特之处。植物学报,2008,11(3):301-307。10.1016 / j.pbi.2008.03.002。
草次生细胞壁生物合成的转录调控:追赶拟南芥。植物科学进展,2012,3:74-
纤维素在高等植物中的生物合成和沉积。植物学报,2008,32(2):349 - 359。10.1111 / j.1469-8137.2008.02385.x。
Hématy K, Sado P-E, Van Tuinen A, Rochange S, Desnos T, Balzergue S, Pelletier S, Renou J-P, Höfte H:受体样激酶介导拟南芥细胞对纤维素合成的抑制作用。植物生物学杂志,2007,17(11):922-931。10.1016 / j.cub.2007.05.018。
Tamura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S: MEGA5:使用最大似然、进化距离和最大简约法的分子进化遗传学分析。分子生物学与病原学杂志,2011,28(10):2731-2739。10.1093 / molbev / msr121。
Wu Z, Irizarry RA, Gentleman R, Martinez-Murillo F, Spencer F:基于模型的寡核苷酸表达阵列背景调整。中国农业科学,2004,29(4):369 - 369。10.1198 / 016214504000000683。
洪淑艳,徐鹏,杨明生,向峰,朴锦明:利用实时荧光定量PCR技术,探索短柄草基因表达研究的有效内参基因。植物生物学杂志,2008,8(1):112-10.1186/1471-2229-8-112。
Arvidsson S, Kwasniewski M, Riano-Pachon D, muller - roeber B: QuantPrime是一种用于定量PCR高通量引物设计的灵活工具。中国生物医学工程学报,2008,29(1):465-10.1186/1471-2105-9-465。
蒋维林,蔡春杰,李晓明,李晓明,等:不同底物抑制作用下4-香豆酸辅酶A连接酶在白杨地震中的作用。植物生理学报,2004,28(2):378 - 378。10.1104 / pp.010603。
高艳艳,哈丁沙,蔡春杰:两种苯丙氨酸解氨酶基因在地震白杨凝集单宁细胞和木质化细胞中的差异表达。植物生理学报,2004,25(2):366 - 366。10.1104 / pp.006262。
Harrington M, Hong E, Fasanmi O, Brewster R: cadherin介导的粘连调节后体形成。BMC开发生物学,2007,7 (1):130-10.1186/1471-213X-7-130。
陈红,陈晓燕,陈晓燕,陈晓燕,陈晓燕,陈晓燕。利用人工mirna对水稻高特异性基因进行沉默。PLoS ONE。2008,3 (3): e1829-10.1371/journal.pone.0001829。
Vogel J, Garvin D, Leong O, Hayden D:农杆菌属模型草的-介导转化和自交系发育Brachypodium distachyon。植物生态学报,2006,29(2):369 - 369。
Vogel J, Hill T:高效农杆菌属介导的变换Brachypodium distachyon近交系Bd21-3。植物学报,2008,27(3):471-478。10.1007 / s00299 - 007 - 0472 - y。
Csaikl UM, Bastian H, Brettschneider R, Gauch S, Meir A, Schauerte M, Scholz F, Sperisen C, Vornam B, Ziegenhagen B:不同DNA提取方案的比较分析:一种用于遗传评价和系统发育研究的快速、通用的高质量植物DNA的最大制备方法。植物生物学杂志,1998,16(1):69-86。10.1023 /: 1007428009556。
Baskin TI, Beemster GTS, Judy-March JE, Marga F:拟南芥根中皮层微管的紊乱刺激切向扩张,降低细胞间纤维素微纤维排列的均匀性。植物生理学报,2004,25 (3):369 - 369 /pp. 369 - 369。
奥登堡R,梅G:带精密万能补偿器的新型偏振光显微镜。中国生物医学工程学报,1995,30(2):369 - 369。10.1111 / j.1365-2818.1995.tb03669.x。
Ruland W: x射线测定结晶度和扩散无序散射。晶体学报,1961,14:1180-1185。10.1107 / S0365110X61003429。
Dash S, Van Hemert J, Hong L, Wise RP, Dickerson JA: PLEXdb:植物和植物病原基因表达资源。核酸学报,2011,40:D1194-D1201。
确认
该研究得到了美国能源部基础能源科学办公室化学科学、地球科学和生物科学部的支持,通过授予TIB的de - gf - 03er15421和能源部科学办公室(BER)授予SPH的DE-FG02-08ER64700DE。纤维素结晶度的光谱分析得到了木质纤维素结构和形成中心的支持,该中心是由美国能源部、科学办公室和基础能源科学办公室资助的能源前沿研究中心,资助编号为DE-SC0001090。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们没有竞争利益。
作者的贡献
PP, KO, SH设计了该研究。PP、DM、KO、MH、KH、KK、SK、TB进行了实验。PP、KH、KK、SK、SH对数据进行了分析。PP、TB、SH撰写了手稿。所有作者阅读并批准了最终稿件。
电子辅料
12870 _2013_1345_moesm1_esm.pptx
附加文件1:图S1:系统发育分析答:芥,b . distachyon和水稻CESA超家族氨基酸序列。采用1000个自举排列的邻居连接方法构建了一个一致的系统发育。CESA分支被说明为扩展子树,CSL分支被说明为压缩子树。(PPTX 84 KB)
12870 _2013_1345_moesm2_esm.pptx
附加文件2:图S2:对准b . distachyon三个次级细胞壁CESA氨基酸序列。上方的蓝线显示环型锌指基序,蓝色突出显示胱氨酸残基。上面的绿线显示了两个高变量区域。粉色突出了三个推测具有催化作用的天冬氨酸残基,紫色突出了QxxRW基序。上面的黄线表示植物特异性区域,上面的黑线表示八个假定的跨膜区域。(PPTX 336 KB)
12870 _2013_1345_moesm3_esm.pptx
附加文件3:表S1:相对转录物丰度的比率中国极限运动协会s在根(R),叶(L)和茎(s)组织中。(PPTX 49 KB)
12870 _2013_1345_moesm4_esm.pptx
附加文件4:图S3:所选非目标的相对表达式BdCESA基因。RT-QPCR检测转录本丰度。这些盒子包含了来自三到四个独立转基因系的三到五个个体的数据。茎组织在花序刚从旗叶上冒出来的同一发育阶段采集。箱形图和意义如图所示5。(PPTX 329 KB)
权利和权限
开放获取本文由BioMed Central Ltd.授权发布。这是一篇开放获取文章,根据创作共用授权协议(https://creativecommons.org/licenses/by/2.0),它允许在任何媒体上不受限制地使用、分发和复制,只要原著被恰当地引用。
关于这篇文章
引用这篇文章
汉达库姆布拉,p.p.,马托斯,地方检察官,奥斯蒙特,K.S.et al。摄动的短枝二烯子纤维素合成酶A4或7导致细胞壁异常。BMC植物杂志13日,131(2013)。https://doi.org/10.1186/1471-2229-13-131
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-13-131
关键字
- 人工微
- Brachypodium distachyon
- 结晶度
- 次生细胞壁
- Sum-frequency-generation振动光谱
- 木质部