摘要
背景
翻译控制肿瘤蛋白(TCTP)是动物王国中一种众所周知的蛋白,被证明是一种Ca2+一种结合蛋白,在许多不同的细胞过程中具有重要功能(例如,防止应激和凋亡,细胞生长,细胞周期进程和微管组织)。然而,对植物中的TCTP知之甚少。植物TCTPs的转录本和蛋白质水平被各种胁迫条件(如冷、盐、干旱、铝和病原体感染)所改变拟南芥TCTP (AtTCTP)被认为是重要的生长调节剂。本研究的目的是进一步表征植物TCTP与其在动物中的主要功能之一:防止细胞死亡。
结果
我们在植物中使用了两种不同的程序性细胞死亡(PCD)激活剂:哺乳动物促凋亡蛋白BAX和tunicamycin,后者是糖基化抑制剂和未折叠蛋白反应(UPR)的触发器。在两项研究中,AtTCTP的过表达显著降低了烟草叶盘细胞的死亡。一个45Ca覆盖试验表明,AtTCTP为Ca2+-结合蛋白和定位实验揭示了AtTCTP-GFP在细胞内的分布拟南芥幼苗。
结论
本研究首次揭示了植物TCTP的细胞保护作用。此外,我们还发现了AtTCTP与Ca结合的能力2+以及它在细胞内的细胞质分布。如果将这些结果结合起来,可以假设两种假定的作用模式:1)AtTCTP作为Ca2+通过减少胞质钙来防止PCD2+和动物的水平一样。2) AtTCTP可以直接或间接地与细胞死亡机制的其他胞质或膜结合蛋白相互作用,从而抑制细胞死亡进程。由于在植物中未发现动物抗凋亡机制的同源蛋白,功能同源物也有待阐明,未来的工作将提供更多的见解。
背景
翻译控制肿瘤蛋白(TCTP)是20多年前发现的,在所有真核生物中普遍表达。序列分析显示该蛋白高度保守,与其他已知蛋白无同源性(见[1])。结构分析美国非洲酒tcp揭示了与Mss4/Dss4超家族的相似之处[2].已知Mss4/Dss4蛋白与无核苷酸(GDP/GTP-free)形式的小gtp酶结合,即所谓的Rab蛋白。到目前为止,许多研究都将TCTP与多种细胞过程(如细胞生长、细胞周期进程、微管组织、离子稳态、抗应激和凋亡)联系起来,包括一些相互作用蛋白(如微管蛋白、Na+/ K+- atp酶和polo激酶;在[1])。
到目前为止,人们对植物的TCTPs知之甚少。1997年进行的第一次研究将TCTP与根帽细胞分裂联系起来Pisum一[3.].其他研究跟进并揭示了植物TCTP转录物或蛋白质水平在不同胁迫条件下的变化,如冷、光、盐、缺水、铝或盐胁迫农杆菌属中介转化[4- - - - - -8].此外,TCTP水平对病原体感染的反应下降[9- - - - - -11],并可能参与韧皮部蛋白质的长距离运动[12].已知TCTPs的序列比较揭示了许多不同植物物种的同源形式[13].非植物序列的TCTPs通常由一个拷贝基因编码,而植物有几个不同的拷贝基因TCTPcdna,指向一个以上的TCTP编码基因[14].拟南芥拥有两个TCTP基因At3g16640和At5g05540。基因座At5g05540被认为是一个没有功能的假基因,因为在各种组织中缺乏表达。尽管如此,在其他植物中,不同的TCTPs可能存在专门化[13].的第一个功能表征答:芥TCTP (AtTCTP, At3g16640)于2008年发表,在有丝分裂活跃组织中表达水平升高。TCTP基因敲除植株显示出雄性配子体表型,花粉管生长受损,阻碍了纯合子系的产生。AtTCTP沉默导致细胞大小减小、营养生长减慢和根发育改变。此外,AtTCTP还影响侧根的形成和生长素的动态平衡。蛋白质比对表明,在所有已知的蛋白-蛋白相互作用位点中,GTPase结合位点是动植物中唯一保守的区域[13].证实了AtTCTP与植物Rab家族小gtp酶的不同成员(AtRAB4A、AtRAB4b、AtRABF1和AtRABF2b)的相互作用,并声称AtTCTP作为有丝分裂生长的正调节因子,与动物具有共同的功能[15].另一项研究表明,AtTCTP过表达能够赋予植物耐旱性拟南芥aba通过TCTP/微管相互作用介导的气孔关闭,在钙的存在下增强。TCTP的微管结合是植物、动物和酵母TCTP的另一个共同功能[16,17].
在迄今观察到的所有生物体中,TCTP与钙密切相关。Ca2+-结合能力最初是在1992年由Haghighat和Ruben研究的锥虫属brucei[18].哺乳动物TCTP的表达在转录和转录后水平受到钙的调控,提示TCTP在钙稳态中的作用[19].从那时起,几个小组利用放射性物质研究这个课题45Ca2+钙同位素2+覆层分析以进一步表征不同的TCTPs [20.- - - - - -24].哺乳动物的tcp被假定为Ca2+隔离,防止胞质钙2+水平超过凋亡信号阈值,从而保护细胞免受钙2+-依赖性程序性细胞死亡[24].
本研究为植物TCTP的鉴定提供了进一步的信息。我们分析了Ca2+-结合能力拟南芥并显示该蛋白对程序性细胞死亡诱导剂的作用在活的有机体内。
结果
AtTCTP对bax诱导的细胞死亡的影响
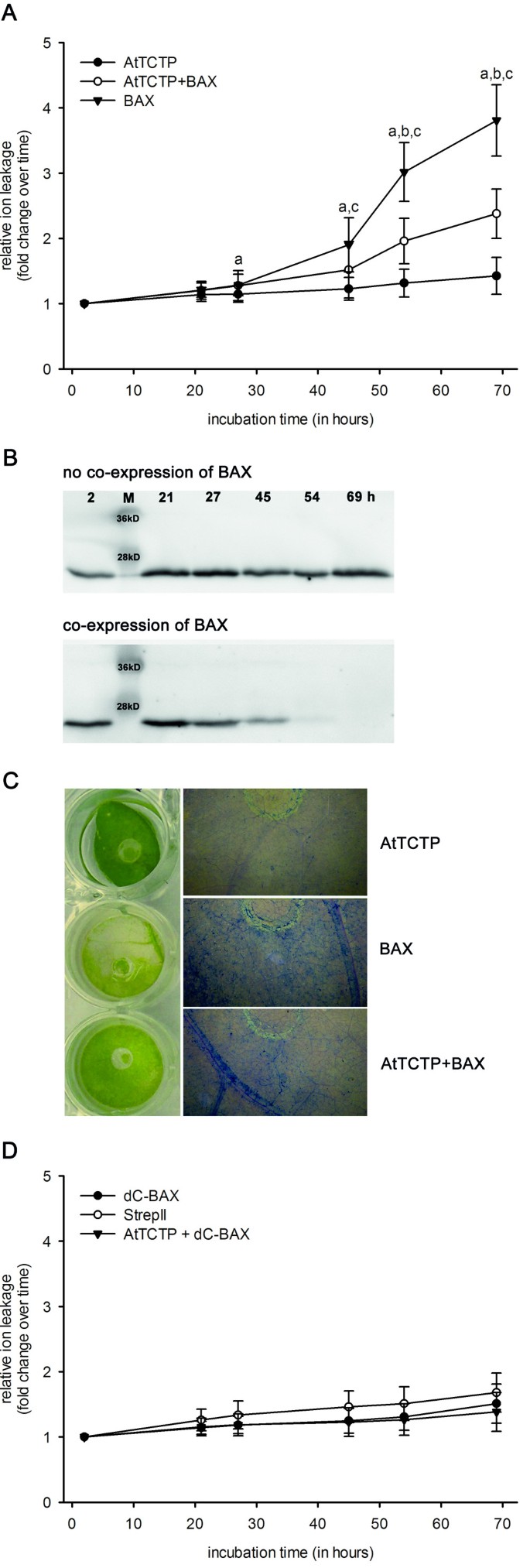
在烟叶中测试了AtTCTP对小鼠Bcl-2家族成员BAX的促凋亡作用的影响(图2)1).中的瞬态表达式n benthamiana是通过根癌土壤杆菌测定相对离子泄漏量,定量细胞死亡。细胞毒性小鼠的表达伯灵顿2 μM地塞米松对漂浮转化烟叶片进行诱导。AtTCTP由CaMV 35S启动子组成性表达。诱导BAX表达28 h后,离子泄漏量逐渐增加,直至诱导69 h后实验结束。AtTCTP的共表达可显著降低BAX介导的细胞死亡。采用方差分析进行统计分析(P > 0.05),结果见图1A.使用Western blot分析观察AtTCTP随时间的表达。如图所示1B,在没有BAX的情况下,AtTCTP的表达量保持稳定,而BAX的共表达导致AtTCTP随着时间的推移缓慢下降。如图左面板所示1表达BAX的C、BAX叶片在2 μM DEX上孵育69 h后呈现明显的黄化迹象,而过表达AtTCTP的叶片则无明显的黄化迹象。BAX和AtTCTP的共同表达导致了轻度的椎间盘褪绿。台盼蓝染色用于显示叶盘内的死细胞,提供了类似的结果(图右侧的面板)1C)。过表达BAX的组织死亡细胞数量最多,其次是BAX和AtTCTP共表达组织,过表达AtTCTP的叶盘几乎没有死亡细胞。对照实验采用叶盘漂浮在2 μM地塞米松上,表达非凋亡ΔC-BAX(见[25]),或无融合蛋白的StrepII-tag,或ΔC-BAX与AtTCTP的组合如图所示1D.与全长BAX相比,截断形式(ΔC-BAX)缺乏线粒体靶向所需的c端跨膜区域。因此,ΔC-BAX不能引起细胞死亡(比较[25])。对照组间无统计学差异(方差分析)。
TCTP对BAX诱导细胞死亡的影响。细胞死亡定量n benthamiana叶片瞬间过表达拟南芥(AtTCTP)和/或伯灵顿。一个为相对于时间点T计算的离子泄漏量02 μM地塞米松(DEX)诱导BAX表达。采用方差分析(P <0.05),表示如下:一个BAX vs. AtTCTP;bAtTCTP + BAX vs. AtTCTPcAtTCTP + BAX vs. BAX。B图中为表达AtTCTP的叶片随时间变化的western blot分析(如下时间点:叶片漂浮2、21、27、45、54和69小时);AtTCTP无(上表)和(下表)共表达伯灵顿。C在含2 μM DEX的溶液中漂浮69小时(左侧面板),显示表达AtTCTP、BAX或两者的烟叶盘。右侧图显示表达BAX和/或AtTCTP的叶盘死细胞的台盼蓝染色。D显示了对照实验:响应ΔC-BAX, StrepII-tag的相对离子泄漏测量,或响应2 μM DEX的ΔC-BAX + AtTCTP的共表达。方差分析计算无统计学显著性差异。
AtTCTP对tunicamycin诱导的细胞死亡的影响
探讨了tunicamycin对烟叶AtTCTP过表达的影响。n benthamiana叶片瞬间表达AtTCTP被检查。用相对离子泄漏定量细胞死亡。Tunicamycin是一种众所周知的诱导未折叠蛋白反应的工具,这反过来又能够启动程序性细胞死亡。数字2显示了植物TCTP对tunicamycin诱导的细胞死亡的影响。
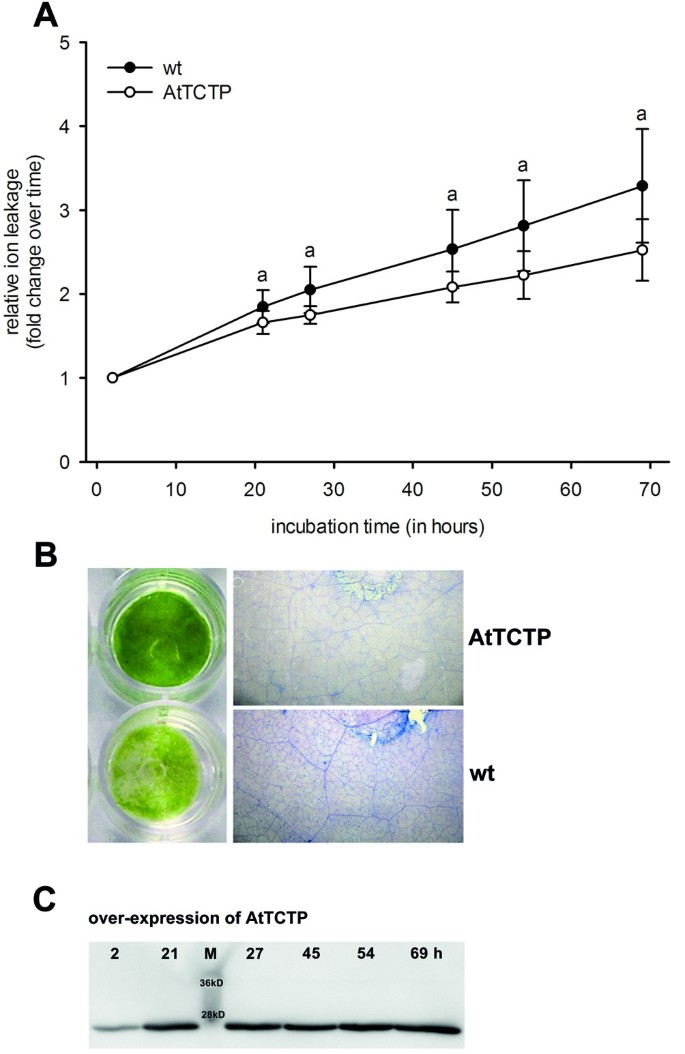
AtTCTP对tunicamycin诱导细胞死亡的影响。烟草叶片瞬时过表达细胞死亡定量研究TCTP的拟南芥(AtTCTP)。一个浓度为2.5 μg·ml时出现离子泄漏-1tunicamycin,相对时间点T计算0。采用方差分析(P <0.05;一个表示wildtype (wt) vs. AtTCTP over-expression)。左边的面板B在2.5 μg·ml浓度下显示烟叶盘-1Tunicamycin 69小时,要么过度表达AtTCTP野生型烟草(wt)。右图为叶盘死细胞的台盼蓝染色。C图中显示了表达AtTCTP的叶片随时间(叶片漂浮2、21、27、45、54和69小时)的western blot分析。
叶盘漂浮于2.5 μg·ml-1Tunicamycin治疗69小时后,从治疗后21小时开始,相对离子泄漏稳步增加。采用方差分析进行统计学分析(P > 0.05),证实AtTCTP蛋白显著降低了tunicamycin诱导的离子泄漏(见图)1一)。2B为tunicamycin孵育69小时后的烟草叶盘。表达AtTCTP的椎间盘未见黄化迹象(图2)2B,左图),而野生型叶盘显示明显的黄化迹象。台盼蓝染色用于观察叶盘内的死细胞。图右侧的面板2B为悬浮在2.5 μg·ml上的染色叶盘-1Tunicamycin注射69小时。与野生型相比,AtTCTP过表达明显减少了台盼蓝染色细胞的数量。western blot检测AtTCTP表达情况:western blot检测显示,在整个实验过程中,AtTCTP表达保持不变(见图)2C)。
Ca2+-绑定AtTCTP
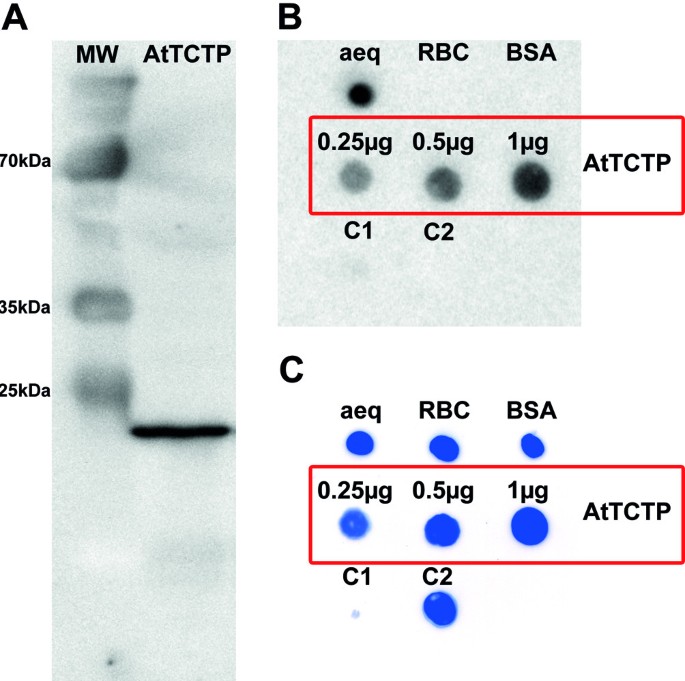
为了检测钙的结合特性,我们从烟草(n benthamiana,见图3.A),后面跟着A45钙覆盖试验。数字3.B和C显示各0.25 μg的对照蛋白点在活化的PVDF膜上。Aequorin,有三个ef -hand表示Ca2+阳性对照采用-结合法。以核酮糖-1,5-二磷酸羧化酶/加氧酶(RuBisCO)和牛血清白蛋白(BSA)作为Ca阴性对照2+结合蛋白质。两个对照组用于可视化假阳性Ca2+-binding:一方面观察StrepII-tag与钙的结合能力,另一方面观察纯化过程中可能发生的蛋白质污染。对照1 (C1)为纯化的烟草粗提取物10 μl洗脱液,不表达strepii标记蛋白。对照2 (C2)显示0.25 μg strepii标记,非Ca2+结合蛋白激酶答:芥,证明StrepII-tag不与Ca结合2+。正如预期的那样,这些阴性对照都没有与放射性标记的钙结合。然而,如图所示3.B、AtTCTP绑定到45Ca2+。检测不同剂量的AtTCTP-StrepII,分别在PVDF膜上斑点0.25、0.5、1 μg蛋白,显示Ca升高2+绑定。后45Ca覆盖法,斑点蛋白用考马斯亮蓝染色(见图)3.C)。
45重组AtTCTP的Ca覆盖试验。Ca2+-结合试验使用放射性标记钙和重组AtTCTP。一个图中为重组strepii标记的AtTCTP (MW =蛋白标记物,AtTCTP =重组AtTCTP- strepii;重要的标记带大小已注明)。B显示了45Ca覆盖法测定了AtTCTP、aequorin (aeq)、RuBisCo (RBC)、牛血清白蛋白(BSA),对照C1 (10 μl纯化粗提物,不表达StrepII-tag蛋白)和C2(非Ca)2+绑定,StrepII-tagged答:芥蛋白激酶)。C显示3B中使用的PVDF膜的考马斯亮蓝染色。如果没有不同的指示,每种蛋白质被标记0.25 μg45钙覆盖试验。
中AtTCTP的本地化拟南芥
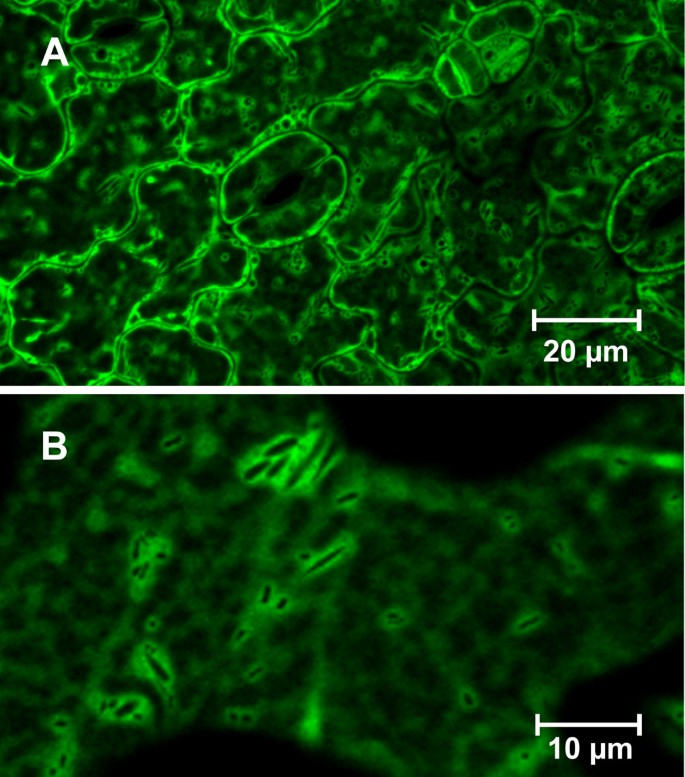
稳定地转化,7到8天答:芥幼苗表达AtTCTP:绿色荧光蛋白在CaMV 35S启动子控制下,研究了AtTCTP的细胞定位。叶片表皮细胞中AtTCTP-GFP呈胞质分布(见图)4A, B)。在tunicamycin和BAX实验中测试了AtTCTP- gfp的功能,揭示了与AtTCTP相同的细胞保护功能(见附加文件)1:图S1)。因此,假定AtTCTP-GFP是功能性的。
讨论
TCTP在所有真核生物中都很保守,并被描述为参与许多不同的细胞功能(例如细胞生长,细胞周期进程和对各种应激因子的保护)。虽然目前TCTP已被很好地表征,但其作用机制仍有待阐明(见[1])。哺乳动物中TCTP的功能之一是防止细胞凋亡,这一功能在植物中尚未发现。本研究利用两种已知的植物细胞死亡诱导剂:BAX蛋白和UPR诱导剂衣霉素,研究了AtTCTP对植物程序性细胞死亡的影响。
哺乳动物BAX是Bcl-2家族的促凋亡成员,参与PCD的寡聚化启动,并与线粒体外膜直接结合,从而形成离子传导通道,使大分子和其他代谢物(如细胞色素c)得以通过。此外,BAX被证明可以诱导内质网Ca的立即耗尽2+通过整合到内质网膜,导致钙2+外排、线粒体致敏和诱导细胞凋亡[26].在动物中,BAX的促凋亡活性被抗凋亡的Bcl-2和Bcl-X蛋白阻断[27].尽管这些蛋白在动物内质网和线粒体介导的PCD中起着关键作用,但在植物中没有检测到同源蛋白。尽管如此,BAX的过表达是一种成熟的PCD诱导工具在足底[25],并发现功能性BAX抑制蛋白拟南芥: AtBI-1 (答:芥BAX抑制蛋白1 [25,28])。AtBI-1的其他几个同源蛋白在答:芥并被归类为一个新的基因家族,称为ABR (atbi相关蛋白),参见[29])。所有这些研究都表明,bax介导的PCD途径可能与动物和植物相似。
由于TCTP在不同的生物体中显示出抗凋亡的作用,我们测试了植物TCTP对bax诱导的烟草细胞死亡的影响。如图所示1结果表明,过表达AtTCTP明显抑制BAX的促凋亡作用,其表现为离子泄漏水平降低、黄化程度降低、死细胞数量减少。在共表达AtTCTP和BAX的叶片中,AtTCTP含量的减少很可能是由于死亡和垂死细胞数量的增加而不能再表达AtTCTP(比较图2)1B, C)。在哺乳动物中推测BAX和TCTP的作用模式:TCTP被描述为拮抗BAX的促凋亡作用,但没有直接相互作用。同源二聚体TCTP被认为与Bcl-2家族的抗凋亡成员Mcl1和Bcl-xL结合。该复合物锚定在线粒体外膜并分离BAX同型二聚体,从而关闭其促凋亡作用[30.].我们的研究结果表明,AtTCTP对哺乳动物bax诱导的PCD具有抗凋亡作用在足底由于植物蛋白已被发现具有与哺乳动物Bcl-2家族蛋白相似的功能,因此可以假设AtTCTP的作用方式与哺乳动物TCTP相似。遗憾的是,Mcl1和Bcl-xL在植物中没有同源蛋白,功能同源物仍有待阐明。
为了进一步研究AtTCTP在植物细胞死亡中的作用,我们探索了另一种细胞质Ca2+和pcd诱导剂,叫做衣霉素。Tunicamycin由同源核苷类抗生素的混合物组成,抑制内质网中的蛋白质糖基化,导致折叠不准确的蛋白质积累[31].如果这种蛋白质错误折叠过度或持续,它能够诱导所谓的未折叠蛋白反应(UPR),这是一种在所有真核生物中保守的细胞应激反应,注定要重建正常的细胞功能。UPR被认为可以阻止蛋白质合成并激活导致多肽折叠蛋白(如结合蛋白(BiP)、蛋白二硫异构酶(PDI)、钙网蛋白和钙连蛋白)增加的信号通路。如果UPR不能在一定时间内恢复细胞功能,则启动PCD [32,33].在哺乳动物中,用三种不同的细胞质钙在mRNA和蛋白水平上观察了tunicamycin和TCTP的相互作用2+升高剂:tunicamycin, thapsigarin和离子载体A23187。tunicamycin不影响TCTP mRNA水平,而thapsignargin和离子载体A23187诱导TCTP mRNA水平上调。蛋白水平也得到了类似的结果:通常TCTP蛋白水平在胞质Ca的作用下下调2+升高,但tunicamycin没有反应。此外,在哺乳动物细胞培养中,TCTP过表达可抑制tunicamycin诱导细胞死亡的作用。根据这些结果,可以假设直接Ca2+耗竭-由thapsigargin和A23187引起-选择性地激活除UPR以外的信号通路[19,34].由于tunicamycin既不改变TCTP的mRNA水平,也不改变TCTP的蛋白水平,TCTP对tunicamycin诱导的应激的影响可以被认为标志着细胞中现有TCTP水平的直接影响。在我们的研究中,与过表达AtTCTP的烟草组织相比,tunicamycin显著增加了野生型细胞的死亡,如图所示2。此外,过表达AtTCTP的叶盘在tunicamycin上漂浮69 h后,台盼蓝染色显示无萎黄现象,死细胞数量较少,可见AtTCTP的抗凋亡作用。
由于本研究中使用的两种应激源(BAX和tunicamycin)都已知会升高细胞内钙2+级别,而tcp被描述为Ca2+非植物生物中的-结合蛋白(例如[20.- - - - - -24]),我们测试了植物TCTP与钙结合的能力。使用一个45Ca覆盖试验表明,AtTCTP是一种Ca2+-结合蛋白(见图)3.).TCTP与钙结合的确切作用方式仍有待阐明。而在本研究中作为阳性对照的黄酮素中,含有ef -hand作为典型的Ca2+-结合基序,TCTP不属于已知的Ca家族2+-结合蛋白[21].即使在Ca内部2+人类TCTP -结合区由30个氨基酸组成,6个氨基酸残基中只有3个在人类和植物TCTP之间保守。如果将这30个氨基酸的不同TCTP序列与人类、酵母、黑腹果蝇,答:芥,只有一个谷氨酸残基是保守的,这单独是不可能使强Ca2+绑定。这表明不同的生物已经发展出多种途径来建立钙2+-在进化过程中结合它们的TCTPs。
为了研究AtTCTP的细胞定位在活的有机体内,我们用稳定变换答:芥表达AtTCTP-GFP的幼苗。如图所示4, AtTCTP-GFP显示细胞质分布。哺乳动物主要存在于细胞质和细胞核中在活的有机体内,尽管它被描述为一种在线粒体中起作用的蛋白质[35].在酵母中,哺乳动物TCTP同源基因Mmi1p被证明在氧化应激下从细胞质转移到线粒体,但与其他TCTP不同的是,Mmi1p被描述为具有促凋亡作用[17].由于TCTP具有亲水性,不含疏水跨膜结构域或其他细胞器定位信号,因此其抗凋亡功能很可能是通过猝灭胞质Ca来实现的2+,从而抑制PCD信号,或通过与内质网和线粒体膜上的其他蛋白质相互作用。
结论
本研究首次显示了植物翻译控制肿瘤蛋白的程序性细胞死亡抑制作用。拟南芥TCTP分别显著降低tunicamycin诱导的细胞死亡和BAX蛋白的表达。此外,我们还证明了AtTCTP是Ca2+-结合蛋白位于细胞质中。
如果PCD信号在小区内传递,则Ca2+从内部储存(如内质网和线粒体)释放。因为AtTCTP是一个有效的Ca2+-结合蛋白和位于细胞质内,可以假设两种作用模式:一方面,AtTCTP可以被认为是细胞质内的Ca2+通过减少胞质钙来阻止进一步的PCD信号传导2+的水平。哺乳动物的TCTP也有类似的作用模式[24].Bommer及其同事的研究部分支持了清道夫理论,将TCTP与Ca作用下的细胞保护功能联系起来2+-诱发应力[34].另一方面,TCTP被描述为动物抗凋亡机制中不同蛋白(BAX、Bcl-xL和Mcl-1)的直接或间接相互作用伙伴[30.,36,37].一般来说,植物也可以这样认为,但到目前为止,在植物中还没有发现同源的相互作用蛋白,功能同源物也有待阐明。
方法
向量构造
为了生成AtTCTP (At3g16640;GenBank: AEE75847.1)和AtTCTP-GFP表达载体AtTCTP和AtTCTP:绿色荧光蛋白连接到Gateway兼容载体pXCSG上,该载体含有花椰菜花叶病毒的组成型35S启动子和c端strepii标签[38],产生pXCSG-AtTCTP和pXCSG -AtTCTP:绿色荧光蛋白。因此,提取总RNA拟南芥根据制造商的说明书(Sigma)使用tri试剂。通过RNase-free DNA酶处理(Fermentas, #EN0521)去除残留的基因组DNA,并根据供应商方案使用1 μg总RNA、固定寡核苷酸(d)T引物混合物和M-MuLV逆转录酶(Fermentas, RevertAid #EP0441)合成第一链cDNA。以下引物采用两步设计方案attB-AtTCTP和attB-AtTCTP:绿色荧光蛋白使用Phusion高保真DNA聚合酶(Thermo Scientific, #F530S): attb1适配器:5 ' -GGGGACAAGTTTGTACAAAAAAGCAGGCTTC-3 ';attB2-adapter: 5“-GGGGACCACTTTGTACAAGAAAGCTGGGT-3”;attB1-AtTCTP: 5“-AAAAAGCAGGCTTCATGTTGGTGTACCAAGATCT-3”;attB2-AtTCTP: 5“-GAAAGCTGGGTCGCACTTGACCTCCTTCA-3”;attB2-GFP: 5“-GAAAGCTGGGTGGCCTCGTCCATCTG-3”。使用Invitrogen公司的Gateway BP和LR Clonase®Mix II进行Gateway克隆。
Maki kawai yamada博士提供了BAX的dexamethason (DEX)诱导表达载体(GenBank: NP_031553.1;向量:pTA7002 -伯灵顿)和ΔCBax (pTA7002-ΔCBax)在[25].
植物栽培
泰利服装(拟南芥,生态型哥伦比亚;NASC, #N60000)在标准施肥土壤(ED73型)上生长,在16小时光照和8小时黑暗的生长室中分层至少20小时。光照阶段温度设置为23℃,暗期温度设置为20℃,湿度设置为60%。烟草(烟草benthamiana)种子以同样的方式生长,但没有分层。
答:芥种子表面消毒(2.5%次氯酸钠),在MS琼脂板(0.5× MS强度,1%植酸盐,0.5%蔗糖)上生长,生长室光照16小时/黑暗8小时,温度为20°C。为了研究tunicamycin诱导的胁迫,将幼苗置于ms板上,喷施2.5 μg·ml-1衣霉素。
烟草叶片瞬时转染
烟草叶片瞬时转染(烟草benthamiana)的操作如下:农(株GV3101)接种于添加适当抗生素(pXCSG载体:50 μg·ml)的YEB培养基中-1卡那霉素,25 μg·ml-1庆大霉素,100 μg·ml-1羧苄青霉素;P19抑制因子50 μg·ml-1卡那霉素25 μg·ml-1庆大霉素;pTA7002载体:50 μg·ml-1卡那霉素),并在28°C连续震荡下生长至指数后期。离心收集细菌(6,000×g, 5 min, RT);将颗粒重悬于5ml浸润缓冲液(10 mM MES-KOH pH 5.6, 10 mM MgCl)中2150 μM乙酰丁香酮)。用光度法测定菌悬液的浓度(OD)600);混合悬浮液调整最终浓度:OD600= 0.5农杆菌属携带AtTCTP、AtTCTP- gfp、BAX、ΔCBAX或StrepII表达质粒;OD600P19抑制因子= 0.25。这些悬浮液在室温下连续摇晃孵育2小时,然后使用1毫升无针注射器浸润到四周的烟叶中。在进一步处理中,为了准确识别浸润部位,用笔标记浸润的叶区。为了表达蛋白质,将植物置于生长室中(光照8小时,黑暗16小时;上述温度及湿度)[38,39].
细胞死亡定量:相对离子渗漏和台盼蓝染色
为了量化烟草中的细胞死亡,我们使用了[40,41].简而言之,烟草被瞬时转染,如上所述。用直径为8mm的叶片冲孔机冲孔叶片之前,让植株表达蛋白24小时。测定叶片鲜重(以克为单位),每个叶片立即浮于1毫升含有地塞米松或tunicamycin(均溶于DMSO)的蒸馏水上,放置于24孔组织培养板的孔中。对照条件为不添加任何添加剂的二甲基亚砜。顶盖防止蒸发,将板置于发光场(16小时光照,8小时黑暗;23°C)。采用电导率仪(Horiba B-173,日本)测定浮液电导率(μS·cm)-1),分别在叶盘冲孔和漂浮后2、4、6、21、27、45、54、69小时。由于圆盘冲击造成的损伤导致电导率在漂浮的前两个小时内缓慢但可测量的增加,因此两小时后的电导率取T0价值。相对离子泄漏用[40].比较结果的相对离子泄漏值,并使用方差分析(ANOVA)评估有统计学意义的差异。
台盼蓝染色按[42].染色后用甘油(50%,v/v)洗涤,置于透明信封中,使用佳能PowerShot S40相机和徕卡MZFLIII双筒望远镜拍摄。
Western blot分析
为了进行Western blot分析,冷冻叶片使用球磨机(30 Hz)均质,并添加提取缓冲液(100 mM HEPES (pH 8.0), 100 mM NaCl, 5 mM EDTA (pH 8.0), 5 mM DTT, 0.5% Triton X-100, 100 μg·ml)-1抗生物素蛋白)。提取液用手摇晃,在冰上融化时剧烈地旋转。提取液解冻后加入1体积sds -样品缓冲液,95℃孵育5分钟,置于冰上备用。用SDS-PAGE分离蛋白质,并将其印迹到PVDF膜上。非特异性蛋白结合位点用TBST- bsa (1%, w/v)阻断60分钟,然后在TBST中清洗4步(每次5分钟)。在添加2 μg·μl的TBST中孵育10 min-1抗生物素蛋白。将Strep actin碱性磷酸酶偶联物(IBA BioTAGnology, Göttingen)以1:50 000的稀释率直接加入含有亲和素的TBST中,再孵育60分钟。四步清洗去除未结合的偶联物(每次5分钟)。信号检测使用CDP-Star®试剂(New England Biolabs, Frankfurt, Germany)根据制造商的说明完成,化学发光检测使用LAS-3000 mini (Fujifilm, d
重组AtTCTP的纯化
瞬时转染后的烟叶(n benthamiana)表达AtTCTP-StrepII 3天。从叶子上切下标记区域,用灰浆和雌蕊在液氮中研磨。提取缓冲液加入100 mM HEPES (pH 8.0), 100 mM NaCl, 5 mM EDTA (pH 8.0), 5 mM DTT, 0.5% Triton X-100, 100 μg·ml-1在冰上解冻时,将其和提取物大力混合几次。解冻后,提取液在冰上再孵育10分钟,然后进行两个离心步骤(15,000×g, 10分钟,4°C),以使细胞碎片成球。剩余的上清液通过两层miracloth (Calbiochem/Merck, Darmstadt, Germany)过滤以去除任何残留颗粒。粗提物采用strep - tactical®Macro Prep 50%悬浊液(IBA Göttingen,德国)分批纯化strep - tactical。所有纯化步骤均在4°C下进行。在装载粗提物之前,树脂在至少2柱体积的萃取缓冲液中在旋转轮上平衡20分钟。将平衡后的树脂离心(500×g, 2分钟),去除上清,然后装上粗提物,然后在旋转轮上孵育10分钟。样品离心(500×g, 2 min),再次去除上清,用10柱体积的洗涤缓冲液洗涤树脂4 ~ 5次,每次10 min,在旋转轮上(洗涤缓冲液:100 mM HEPES (pH 8.0), 100 mM NaCl, 0.5 mM EDTA (pH 8.0), 2 mM DTT, 0.005% Trition X-100)。在Eppendorf Thermomixer (1,000 rpm)的3.75柱体积洗脱缓冲液中(洗脱缓冲液:添加10 mM去硫代生物素的洗涤缓冲液),通过strep - tacn®树脂在室温下洗脱2次(每次5分钟)。洗脱的体积混合,加入20%甘油保存(- 20°C)。
45钙覆盖试验
Ca2+-使用45[43].以Aequorin为阳性对照;核酮糖-1,5-二磷酸羧化酶/加氧酶(RuBisCO),纯化自芸苔属植物拉伯无性系种群。学报)和牛血清白蛋白(BSA)作为Ca的阴性对照2+结合蛋白质。用于StrepII-tag Ca检测2+-结合能力的strepii标记,非Ca2+结合蛋白激酶答:芥在描述的AtTCTP-StrepII条件下表达和纯化。此外,为了确定背景蛋白污染,对烟叶粗提取物进行了纯化和检测。每个0.25 μg的蛋白被标记在活化的PVDF膜上(如果图中没有不同的表示)3.),对应于物质的大致量:aequorin = 12 pmol, RuBisCo = 14 pmol, BSA = 3.8 pmol, strepii标记的蛋白激酶= 3.8 pmol, AtTCTP-StrepII = 12 pmol (0.25 μg)。
缩写
- TCTP:
-
翻译控制的肿瘤蛋白
- 呃:
-
内质网
- 纤毛运动:
-
细胞程序性死亡
- 敏捷:
-
地塞米松
- UPR:
-
未折叠蛋白反应
- 迪拜国际资本:
-
差示干涉对比显微术。
参考文献
Bommer UA, Thiele BJ:翻译控制肿瘤蛋白(TCTP)。中国生物医学工程学报,2004,35(3):379-385。10.1016 / s1357 - 2725(03) 00213 - 9。
Thaw P, Baxter NJ, Hounslow AM, Price C, Waltho JP, Craven CJ: TCTP结构与鸟嘌呤无核苷酸伴侣蛋白的意外关系。生物工程学报,2001,31(2):701-704。10.1038/90415。
吴洪辉,郝思明,等。植物根冠有丝分裂相关基因的克隆及定位Pisum一[j] .植物生理学报,1997,35(5):1045-1051。10.1023 /: 1005930625920。
叶晓明,王晓明,王晓明,等。铝诱导大豆耐铝和耐铝基因表达的比较。[J] .生物工程学报,2009,35(4):745- 756。10.1093 / jxb / erg302。
李建勇,李大东:利用基因表达序列分析技术揭示冷胁迫下拟南芥花粉基因表达的变化。植物生理学报,2003,32(2):517-529。10.1104 / pp.103.020511。
王晓明,王晓明,王晓明,等。黑暗诱导的翻译控制肿瘤蛋白(TCTP)同源基因的积累。植物生理学报,1998,39(3):357-360。10.1093 / oxfordjournals.pcp.a029377。
韦娜,姜浩,Doerge RW, Gelvin SB: T-DNA和Vir蛋白在植物细胞中的转移根癌土壤杆菌诱导介导转化的宿主基因表达,抑制宿主防御基因表达。植物学报,2003,35(5):369 - 369。
Vincent D, Ergul A, Bohlman MC, Tattersall EA, Tillett RL, Wheatley MD, Woolsey R, Quilici DR, Joets J, Schlauch K,等:蛋白质组学分析揭示了葡萄l .简历。霞多丽和cv。赤霞珠及其对缺水和盐度的反应。[J] .实验学报,2007,58(5):1873-1892。10.1093 / jxb / erm012。
asciio - ibanez JT, Sozzani R, Lee TJ, Chu TM, Wolfinger RD, Cella R, Hanley-Bowdoin L:拟南芥基因表达的全球分析揭示了双病毒感染过程中影响病原体反应和细胞周期的复杂变化。植物生理学报,2009,32(4):436-454。10.1104 / pp.108.121038。
李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军。拟南芥植物光合特性的研究进展。植物生理学报,2008,35(4):554 - 557。10.1104 / pp.107.111286。
Jones AM, Thomas V, Bennett MH, Mansfield J, Grant M:拟南芥防御蛋白组的修饰发生在对接种的显著转录变化之前两。植物生理学报,2006,32(2):693 - 698。10.1104 / pp.106.086231。
青木K,苏井N,藤木S, Dohmae N, yoneura -Sakakibara K,藤原T, Hayashi H, Yamaya T, Sakakibara H:韧皮部蛋白的目的地选择长距离运动。植物学报,2005,17:1801-1814。10.1105 / tpc.105.031419。
王晓明,王晓明,王晓明,等。肿瘤翻译控制蛋白(TCTP)的研究进展拟南芥。植物学报,2008,29(2):349 - 349。10.1105 / tpc.108.061010。
王晓明,王晓明,王晓明,等。人与兔翻译控制肿瘤蛋白(TCTP)编码基因的表达及加工伪基因。中国生物医学工程学报,2009,26(2):573 - 581。10.1046 / j.1432-1327.2000.01609.x。
Brioudes F, Thierry AM, Chambrier P, Mollereau B, Bendahmane M:翻译控制肿瘤蛋白是一种保守的动物和植物有丝分裂生长整合子。中国科学:科学通报,2010,31(1):389 - 389。10.1073 / pnas.1007926107。
金艳梅,韩玉娟,黄玉娟,李世生,申英英,金世义,金智:aba诱导的肿瘤蛋白基因AtTCTP的过表达增强拟南芥的抗旱性。生物质化学工程,2012,33(3):617-626。10.1007 / s10059 - 012 - 0080 - 8。
Rinnerthaler M, Jarolim S, Heeren G, Palle E, Perju S, Klinger H, Bogengruber E, Madeo F, Braun RJ, breitenbachh - koller L,等:翻译控制肿瘤蛋白(TCTP)的酵母同源物MMI1 (YKL056c, TMA19)具有凋亡功能,可与微管和线粒体相互作用。生物化学学报,2006,17(7):631-638。10.1016 / j.bbabio.2006.05.022。
王志强,王志强,王志强,等。新型钙结合蛋白的分离纯化锥虫属brucei: 22、24和38千道尔顿蛋白质的性质。中华寄生虫病杂志,2002,31(2):391 - 391。10.1016 / 0166 - 6851 (92) 90205 - x。
徐A, Bellamy AR, Taylor JA:钙在转录和转录后水平调控翻译控制肿瘤蛋白的表达。生物化学学报,1999,32(3):683-689。
张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军。电泳。1997,18:150-155。10.1002 / elps.1150180127。
李建军,李建军,李建军。肿瘤蛋白钙结合位点的鉴定。中国医药杂志,2000,23:633-636。10.1007 / BF02975253。
饶建平,陈丽,Gnanasekar M, Ramaswamy K:一种钙结合组胺释放蛋白的克隆及特性分析曼氏裂体吸虫。生物化学学报,2002,27(2):398 - 398。10.1074 / jbc.M204114200。
Arcuri F, Papa S, Carducci A, Romagnoli R, Liberatori S, Riparbelli MG, Sanchez JC, Tosi P, del Vecchio MT:翻译控制肿瘤蛋白(TCTP)在人前列腺和前列腺癌细胞中的表达、分布和钙结合活性。中华医学杂志,2004,30(6):391 - 391。10.1002 / pros.20054。
Graidist P, Yazawa M, Tonganunt M, Nakatomi A, Lin CC, Chang JY, Phongdara, fuise K: Fortilin结合Ca2+并阻断Ca2+−依赖性细胞凋亡。中国生物医学工程学报,2009,31(2):391 - 391。10.1042 / BJ20070679。
王晓明,王晓明,王晓明,等。拟南芥Bax抑制剂-1 (AtBI-1)的表达可下调Bax诱导的植物细胞凋亡。[j] .中国科学:自然科学,2001,31(2):559 - 563。10.1073 / pnas.211423998。
杨建军,陈建军,陈建军,陈建军,陈建军,等。Bax和Bak对细胞凋亡的影响2+商店。生物化学学报,2002,27(7):9219-9225。10.1074 / jbc.M106817200。
Ferri KF, Kroemer G:线粒体-自杀细胞器。生物学报。2001,23:111-115。10.1002 / 1521 - 1878 (200102) 23:2 < 111:: AID-BIES1016 > 3.0.CO; 2 y。
王晓明,王晓明,王晓明,等。拟南芥Bax抑制剂-1对内质网应激诱导的程序性细胞死亡的影响。植物信号学报,2008,35(3):564-566。10.4161 / psb.3.8.5709。
李晓明,李晓明,李晓明,等。细胞程序性死亡、线粒体和植物超敏反应。自然科学,2001,11:848-853。10.1038 / 35081184。
李建军,李建军,李建军,李建军,等。TCTP对细胞凋亡的抑制作用。细胞死亡学报,2008,15:1211-1220。10.1038 / cdd.2008.18。
天然和合成糖基化抑制剂。《糖生物学精要》第2版编辑:Varki A, Cummings RD, Esko JD, Freeze HH, Stanley P, Bertozzi CR, Hart GW, Etzler ME。冷泉港(纽约):冷泉港实验室出版社;1999.
植物内质网对未折叠蛋白的细胞反应。中国生物医学工程学报,2007,27(2):1152-1171。10.1111 / j.1742-4658.2007.05664.x。
植物内质网质量控制和未折叠蛋白反应的研究进展。交通学报,2008,9:1581-1588。10.1111 / j.1600-0854.2008.00780.x。
Bommer UA, Heng C, Perrin A, Dash P, Lobov S, Elia A, Clemens MJ:翻译控制肿瘤蛋白(TCTP)和双链rna依赖蛋白激酶(PKR)在细胞应激反应中的作用。中华肿瘤杂志,2010,29:763-773。10.1038 / onc.2009.380。
张东,李峰,Weidner D, mjoyan ZH, Fujise K:骨髓细胞白血病1蛋白(MCL1)与Fortilin的物理和功能相互作用。MCL1作为福替林伴侣的潜在作用。生物化学学报,2002,27(2):344 - 344。10.1074 / jbc.M207413200。
李志强,李志强,李志强,等。翻译控制肿瘤蛋白(TCTP)在细胞凋亡、增殖和肿瘤发生中的生物学作用。生物医学工程学报,2012,32 (1):491 - 491
徐春华,李建平,李建平,等。内质网应激对细胞生存和死亡的影响。[J] .临床医学杂志,2005,31(2):556 - 564。10.1172 / JCI26373。
李建军,李建军,李建军,李建军,等:利用StrepII抗原表位对植物材料进行快速分离纯化。植物生理学报,2004,25(5):357 - 357。10.1007 / s11103 - 004 - 0501 - y。
王晓明,王晓明,王晓明,等。大豆和拟南芥中尿囊酸酯酰胺水解酶的鉴定、生化特性和亚细胞定位。植物生理学报,2008,35(4):418- 418。
杨建军,杨建军,杨建军,等。细胞死亡抑制因子Bcl-x(L)和Ced-9对烟草细胞死亡的影响。中国生物医学工程学报,1999,9:775-778。10.1016 / s0960 - 9822(99) 80341 - 8。
Yoshinaga K, Arimura SI, Hirata A, Niwa Y, Yun DJ, Tsutsumi N, uchiiya H, kawai yamada M:哺乳动物Bax通过细胞器破坏引发植物细胞死亡。植物学报,2005,24(4):448 - 448。10.1007 / s00299 - 005 - 0948 - 6。
拟南芥突变体的表型分析:台盼蓝染色对真菌、卵菌和死植物细胞的影响。拟南芥:实验室手册。编辑:Weigel D, Glazebrook J. 2002,冷泉港:冷泉港实验室出版社,86-87。
马国山,李春华,李春华,等。钙结合蛋白的检测45十二烷基硫酸钠凝胶电泳后硝酸纤维素膜的钙自显影。中国生物医学工程学报,2004,25(5):511-519。
致谢
我们感谢Maki kawai yamada博士提供的BAX表达载体(pTA7002- BAX, pTA7002-ΔCBax)和Ute C. Vothknecht教授提供的测量设备45Ca2+绑定。JR得到了萨尔茨堡大学“基金会Förderungsgesellschaft”的资助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们没有竞争利益。
作者的贡献
MCH进行了实验研究(除45Ca覆盖试验)包括统计分析,参与载体设计,显微研究,并起草手稿。JR参与了分子克隆和显微研究,创造了过表达蛋白答:芥植物。AMG参与了实验研究。NM执行了45钙覆盖试验。RT和MCH计划了这项研究。RT参与了设计和协调,并帮助起草了稿件。所有作者都阅读并批准了最终的手稿。
电子补充资料
12870 _2012_1339_moesm1_esm.pdf
附加文件1:图S1: AtTCTP-GFP对BAX或tunicamycin诱导的细胞死亡的影响。数据描述:在tunicamycin和BAX实验中证实AtTCTP-GFP的功能性。烟草叶片瞬时过表达AtTCTP或AtTCTP- gfp的细胞死亡定量。一个和B显示相对于时间点T计算的离子泄漏0对2 μM地塞米松(DEX)诱导BAX表达的响应一个),或2.5 μg·ml-1衣霉素(B).采用方差分析(P <0.05),表示如下一个:一个表示BAX过表达(BAX)与BAX和AtTCTP均过表达(AtTCTP + BAX);b表示BAX过表达(BAX)与BAX和AtTCTP-GFP均过表达(AtTCTP-GFP + BAX);为B:表示野生型(wt)与AtTCTP过表达(AtTCTP);b表示AtTCTP-GFP野生型(wt)与过表达型(AtTCTP-GFP)。(pdf 57kb)
权利和权限
本文由BioMed Central Ltd.授权发表。这是一篇基于知识共享署名许可(http://creativecommons.org/licenses/by/2.0),允许在任何媒体上不受限制地使用、分发和复制,前提是正确引用原创作品。
关于本文
引用本文
Hoepflinger, m.c., Reitsamer, J., Geretschlaeger, A.M.et al。翻译控制肿瘤蛋白(TCTP)对植物细胞程序性死亡的影响。BMC Plant Biol13日,135(2013)。https://doi.org/10.1186/1471-2229-13-135
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-13-135
关键字
- TCTP
- 细胞程序性死亡
- 伯灵顿
- 衣霉素
- 未折叠蛋白反应
- 钙
- 内质网
- 线粒体