摘要
背景
我们已经确定了夏南瓜南瓜的一种疗法,这与一个不完整的andromonoecy相关,即女性进入双性恋的花朵。鉴于该和其他葫芦科的andromonoecy是由雌花中的乙烯生产的降低引起的,果实的相关定期发育建议乙烯参与水果套装和早期果实发育。
结果
本研究比较了单性结实(Cavili)和非单性结实(Tosca)两个品种授粉和未授粉子房/果实中13个乙烯生物合成和信号转导基因的表达及乙烯产量。后者未授粉的子房在花后3天出现乙烯生物合成和乙烯信号转导基因的诱导,并伴随果实败育和衰老的开始。授粉花和Cavili花的坐果和早期果实发育与低乙烯生物合成和信号转导有关,这也解释了单性果基因型中部分雄雄性的存在。子房中乙烯产量的降低与Cavili自交后代的孤雌结实和部分雄蕊异种共生。此外,乙烯的诱导(乙烯利处理)降低了Cavili单性结实两性花的百分比,而乙烯生物合成或反应的抑制(AVG和STS处理)不仅诱导了雄雄生殖,而且还诱导了两个品种的单性结实发育。
结论
结果表明,减少西葫芦花中乙烯的生成或信号传递能够诱导坐果和早果发育,因此乙烯在坐果和早果发育中起着积极的作用。生长素和TIBA处理在诱导坐果和早果发育的同时,也抑制了乙烯的产生和乙烯生物合成及反应基因的表达。建立了乙烯与生长素相互作用的模型,探讨了乙烯与生长素相互作用对西葫芦结实和果实早期发育的控制作用。
背景
尽管其分子简单,乙烯调节了许多发育和生理过程[1,2,包括叶和花的脱落,更年期果实的成熟以及生物和非生物胁迫。在物种中葫芦科家族乙烯控制性表现,是性表现型的主要决定因素[3.- - - - - -5].因此,乙烯的生物合成基因CmACS7和Csacs2.甜瓜和黄瓜分别调节雄蕊的雄性雄性雄性雄蕊的血清发育,它们的功能突变丧失导致女性转化为双性恋花卉,因此将单一的转化为仙一的异常品种[5- - - - - -7].在葫芦塔辣椒,乙烯还规范了单种式品种的性表达,控制既有预象和女性花的数量[4,5,8,9].事实上,乙烯生产(AVG)或感知(STS)的阻塞剂的应用能够延迟女性开花并减少每株植物的女性花朵数量,也可以诱导女性转化为双性恋花[4].同样,西葫芦的雌花在整个发育和成熟过程中产生的乙烯比雄花多得多[4].
授粉和受精后,坐果和果实发育依赖于赤霉素(GAs)、生长素和细胞分裂素等激素促进的细胞分裂和膨胀[10.- - - - - -12.].植物素是水果集的决定因素,正如突变体或转基因素的研究所证明的那样东盟地区论坛要么IAA / AUX.番茄中的多尾家族拟南芥[10.- - - - - -12.].然而,它们似乎与嗜酸甘油有关的嗜酸盐素,其能够触发果实发育而不发生毒素信号传导基因[13.,14.].在葫芦科家庭,水果集和发展主要依赖于养奉[15.].植物素的应用诱导黄瓜治疗季甲运动水果套装及发育[16.],尽管细胞分裂素的应用也会激活水果中的细胞分裂[17.],而油菜素内酯增加坐果率[10.,18.].在西葫芦中,生长素也被证明是诱导单性果发育的最有效的激素[19.]而这种成长调节剂通常用于促进这种蔬菜作物的温室生产中的水果集和生长。
乙烯已与授粉后花器官衰老和脱落有关。授粉在卵巢和花瓣中诱导乙烯产生,并且该乙烯似乎负责协调卵巢生长和花瓣衰老[20.- - - - - -23].乙烯在水果套装中的含义并未深入研究了几年前。最近的研究表明了早期胚珠堕胎和尺寸之间的互连拟南芥乙烯突变体(24].同时,授粉和赤霉素处理可在番茄坐果后立即下调乙烯生物合成和信号基因[12.,22].
自C. Pepo.形态型西葫芦有较大的下子房(花期约6-8厘米长),是研究坐果和果实早期发育的理想种。我们最近观察到,在西葫芦雌花中减少乙烯不仅可以促进雄蕊的发育,将雌花转化为两性花,而且在没有授粉和受精的情况下,还可以诱导单性果的发育[25].对于在高温条件下种植的夏南瓜壁南瓜的某种品种也是如此[25].为研究乙烯在西葫芦南瓜的水果套装和早期果实发育中的作用,本文比较了乙烯的生产和乙烯生物合成的表达和乙烯生物合成的表达和授粉和未加长的卵巢卵巢之间的响应基因,以及丘脑和西葫芦南瓜的非普通苷类品种。此外,我们分析了果实生长率以及乙烯生产以及乙烯基因的表达,响应于养羊酸和胫骨治疗。结果表明,乙烯直接参与该物种的水果套装和早期果实发育。这两种发育过程需要在授粉后几天内乙烯生产和信号传导,并且授粉和施肥的丧失伴随着开花后3天的乙烯生物合成和信号传导,伴随着果实流产。
结果
乙烯在西葫芦坐果和果实早期发育中的作用已被采用不同的方法。首先,我们测定了非单性结实品种托斯卡(Tosca)授粉和未授粉子房和果实中13个乙烯生物合成和信号转导基因的表达。其次,我们比较了两个单性结实品种(托斯卡和卡维利)果实中乙烯产量和乙烯基因的表达情况。最后,以这两个品种为研究对象,研究乙烯与生长素之间的串扰对这些发育过程的控制作用。
西葫芦授粉和未授粉子房/果实中乙烯的产生和基因表达
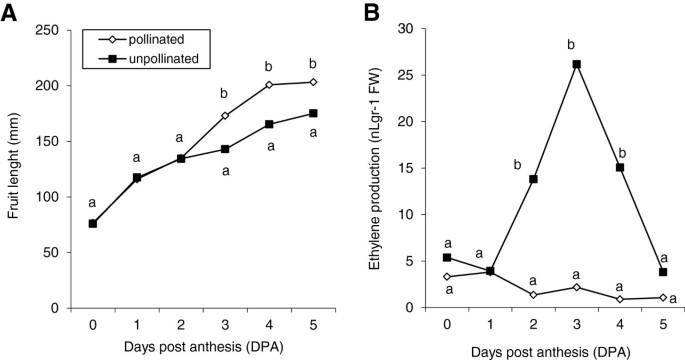
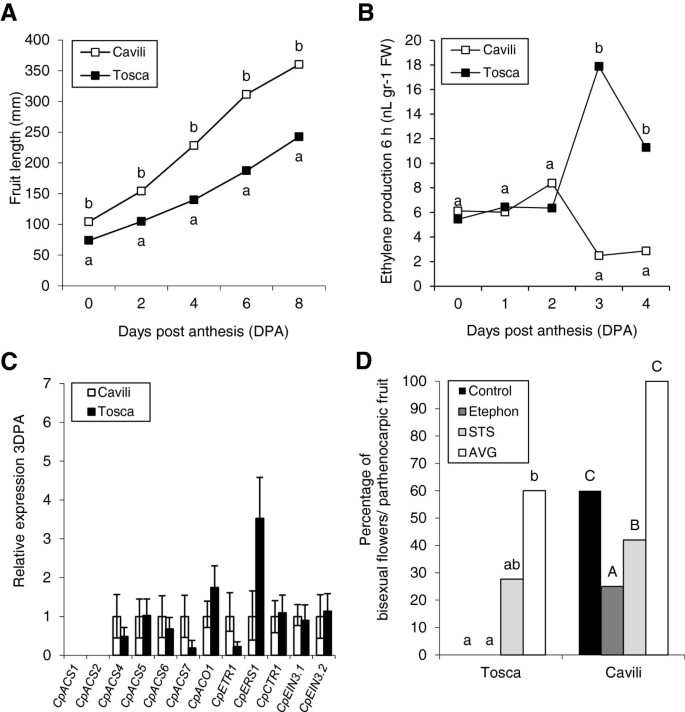
已经表明,许多西葫芦品种的果实可以在没有授粉和激素应用的情况下开始它们的生长。实际上,在非幼儿症的CV中。TOSCA授粉和未加长的水果的生长速率对于前三天非常相似(图1A),这突出了该物种的自然单性结实。然而,在第三天之后,大多数未授粉的果实流产了,其中一些果实的生长速度明显慢于授粉的果实(图3)1A).在前5 DPA中,授粉果实和未授粉果实产生乙烯的情况非常不同(图5)1b)。虽然乙烯产量在授粉水果中略微下降,但在未加长的水果中,它急剧增加3 dpa(图1b)。这些结果表明,在3dPa发生的未加长速度的生长速率降低与水果中的乙烯爆发相关,并且果实生长的维持可能需要低水平的乙烯。
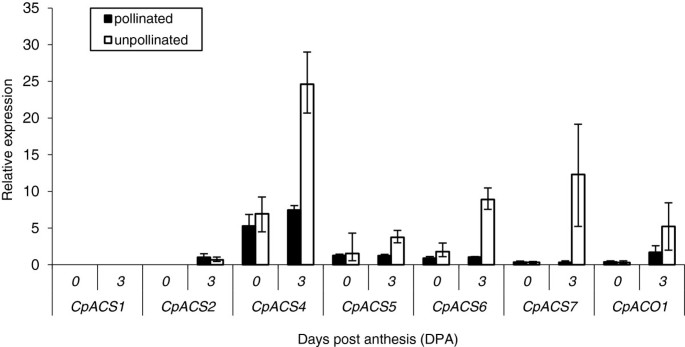
为了检测在坐果和早期果实发育过程中调控乙烯生物合成的基因,我们分析了6个基因的表达ACS基因和一个华基因C. Pepo.(附加文件1:表S1,图2).CPACS1是第一批吗ACS从植物中分离的基因[3.];CPACS2., 和CpACS4到CPACS6.是来自不同壁球组织的新一代cDNA的新一代测序(NGS)鉴定了四种未成年人[26];可以在Cucurbigene.net];和CPACS7.和CpACO1已被PCR策略分离与退化的引物(未发表)。通过在开花(0 dPA)和3 dPA(图形)通过QPCR研究表达(图2).CPACS1在此期间没有表达(图2).开花时,其他6个基因的表达量都很低,除CpACS4,这可以解释乙烯的基本生产。在授粉的果实中,这种基本表达维持在3dpa(图)2).尽管如此,在未加长的水果中的表达五ACS基因和CpACO1在3 dpa上上调。观察到最高的感应CpACS4,CPACS6.和CPACS7.(图2),这似乎是此时产生乙烯的主要基因。
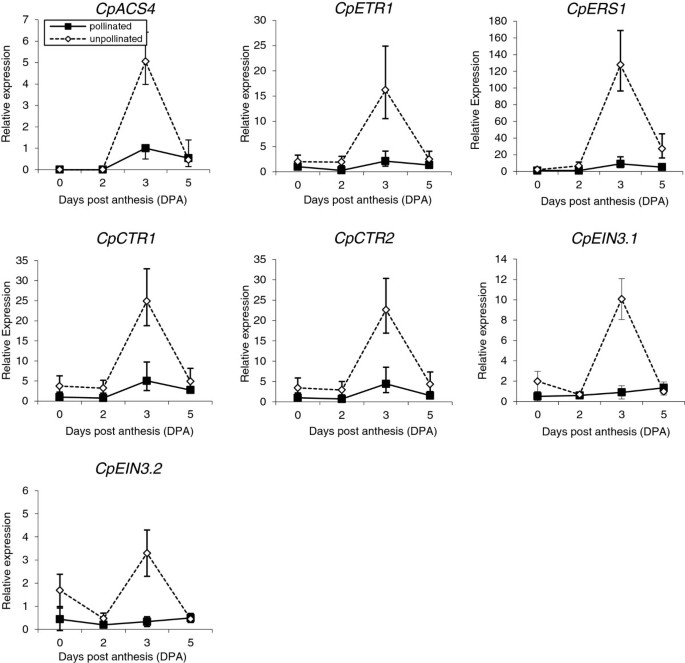
为了确定乙烯在坐果和果实早期发育中作用的分子机制,我们还研究了6个额外的乙烯感知和信号传递基因在5 DPA授粉和未授粉果实中的相对表达。的发生CpACSs和CpACO1,其他与乙烯感知有关的基因,如CPETR1.和CpERS1,以及乙烯信号(CpCTR1,CpCTR2,CpEIN3.1和CpEIN3.2),也显示了类似于乙烯生产的表达谱(图3.).在授粉的水果中,早期发育期间表达水平仍然很低,而在非授粉的水果中,所有感知和反应基因在3 dPA下显着上调(图3.),符合乙烯高峰和果实生长的流产(图1).
乙烯在西葫芦的坐果和早期果实发育中起着积极的作用
为了确定授粉果实和未授粉果实在3dpa时产生乙烯的差异是否是坐果或败果的结果,或者更确切地说是参与坐果和发育的信号,我们比较了单性结实品种和非单性结实品种以及单性结实品种衍生的分离群体中乙烯的产生和信号转导,确定了乙烯释放和阻断剂对坐果和早期果实发育的影响。
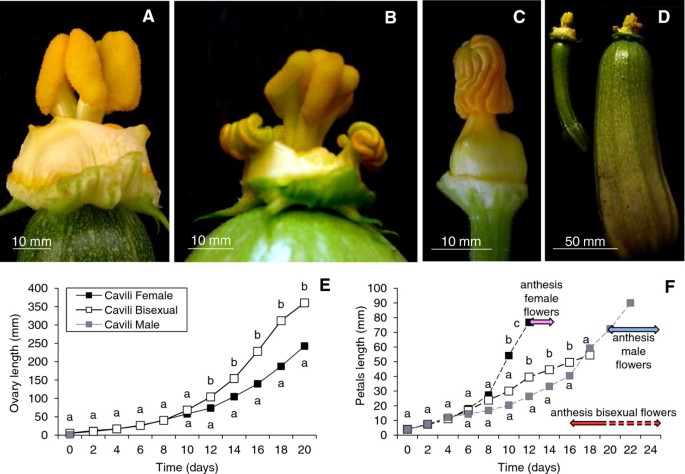
杂交品种Cavili能够在没有授粉或激素处理的情况下培育出商业大小的单性结实的果实[25].该品种的单性结实与不完全雄花生殖有关,即部分雌花转化为两性花,花器官成熟延迟(图)4).这种品种的卵巢花朵可以分为没有稳定性发展的女性花朵(图4a)或双性恋花朵显示一定程度的雄蕊发育(图4b),但从未达到雄性花的雄蕊的大小(图4C).在发育的同一阶段,两性花总是表现出更高的子房和果实大小(图4D).我们比较了雌性和两性花的子房/果实的纵向生长速率,从花蕾长度约4毫米开始,共22天4雌花开花后第12天两性花的子房长度生长速度与雌花的子房长度生长速度偏离(图2)4此时,两性花的花瓣还未成熟并闭合,但它们的子房继续以比雌花快得多的速度生长。两性花的许多子房在开花期前达到了商品大小。事实上,许多两性花在24天的研究中并没有开花,而在另一些花中,由于花瓣的生长速度较低,雌性花的开花时间推迟了(图)4F)。这些结果表明,该品种的疗法不仅与雄蕊发育不同时,而且具有较低的花瓣生长速度,延迟了花瓣和开花的成熟。鉴于男性花朵需要两倍,只要女性成熟和达到开花(图4F),两性花成熟的延迟很可能与它们的雄性化有关,即雄蕊的存在。
为了评估疗效和部分andromonoecy是否具有相同的遗传调节,我们通过F1杂交瓦维的自授粉来表现出衍生的F2群体,其为两个特征进行分离。在F2代中发现了两个特征之间的完整CoSetgation。共有95株植物,23株是完全单一的,只生产女性花卉,而72则部分andromonOnious,并产生女性和双性恋的花朵(表1).虽然后者的双性恋花朵的数量从20%变化到100%,但它们所有开发成稗子果实,甚至在花序前达到商业大小(表1).3:1分离比(χ2 = 0,014, p value = 0,91) indicated that the partial andromonoecy and parthenocarpy of Cavili appears to be controlled by at least one dominant gene.
众所周知,西葫芦中的性别测定和雌花成熟在花发育的最早阶段受乙烯调节[4,8,9].因此,Cavili的卧间可以是女性花中乙烯减少的结果。我们发现未加压的野鸭/果实在花分脉后立即在几天内产生显着更少的乙烯(图5b)。在25只雌性和25种衍生自野集的F2群体的卵巢中,还测量了乙烯的生产。结果表明,双性恋花液中果实的较高生长速率Colegrated,在3dPa在卵巢中显着降低乙烯产生(表1).
所有分析ACS基因,包括CpACS4,CPACS6.和CPACS7.在3DPA上,Cavili和Tosca未受精卵的子房中表达量无显著差异,Cavili的表达量更高(图)5C).只有表达CpACO1而Cavili则更低(图5C).因此,单性结实品种Cavili未授粉子房中观察到的乙烯产量减少似乎不是在转录水平上被调节的。对于乙烯感知和反应基因,只有转录本CpERS1在Cavili中显示出较低的成绩单积累(图5C),表明单性结实品种对乙烯的感知也可能发生改变。
为了证实雌花发育过程中乙烯产量的减少是否足以诱导西葫芦子房的单性结实发育,我们测定了乙烯释放剂和阻断剂对早期果实发育的影响。对照Tosca植株不产生两性单性果花,而Cavili植株产生60%(图6)5D和附加文件2:图S1)。乙烯利的施用显著降低了Cavili单性结实两性花的产量,而乙烯阻断剂STS和AVG的施用不仅增加了Cavili单性结实两性花的产量,而且也增加了Tosca单性结实两性花的产量(图)5D和附加文件2:图S1)。这些结果表明,乙烯积极参与西葫芦南瓜的水果套装和早期果实发育,实际上,夏南基的发展雌花中的乙烯生物合成或信号传导不仅可以抑制雄蕊,促进女性的转换进入双性恋的花,还要诱导疗法的疗效。
生长素对果实生长速率、乙烯生物合成和信号转导的影响
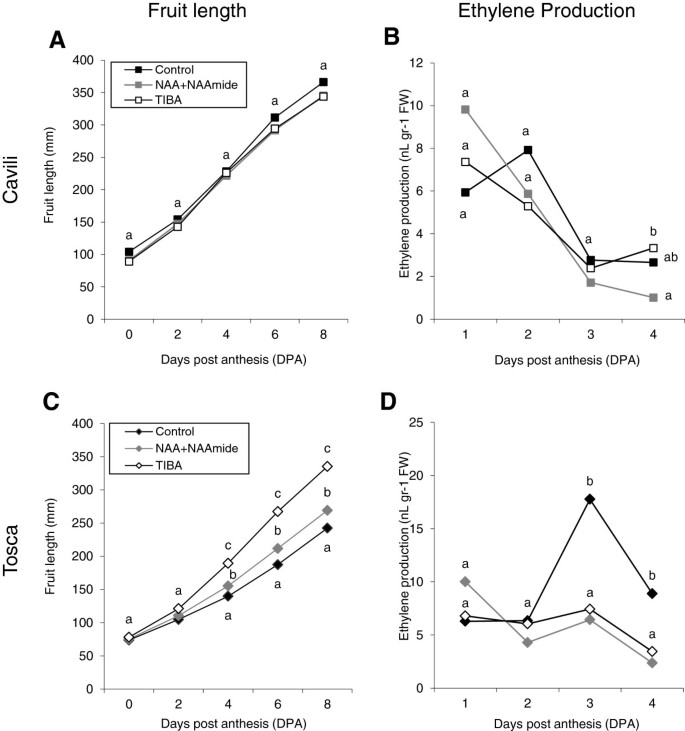
众所周知,毒素和TIBA的外部施用,后者是一种肿瘤炎极地传输的抑制剂,可以诱导不同物种的果实组和早期果实生长。在西葫芦中,合成菌素通常用于刺激淡季温室生产中果的疗效。我们研究了NAA + NaaMide和TIBA(在卵巢中的出色中的应用)对栽培品种Cavili和Tosca的果实发育和乙烯生产的影响。在疗神CV。Cavili既不能够改变水果的纵向生长速度(图6A),表明该品种的子房可能具有高浓度的生长素。然而,在非单性结实的果实中。托斯卡两种处理都促进了果实的纵向生长,尽管TIBA比NAA + NAAmide更有效(图)6C).对照和处理果实的乙烯产量与果实早期生长速率呈负相关。在Cavili中,乙烯在前4 DPA处理过程中逐渐减少(图2)4B),而在Tosca中,3dpa诱导的果实只有未授粉的对照果实,其生长速度最低,最终流产(图3)6D)。
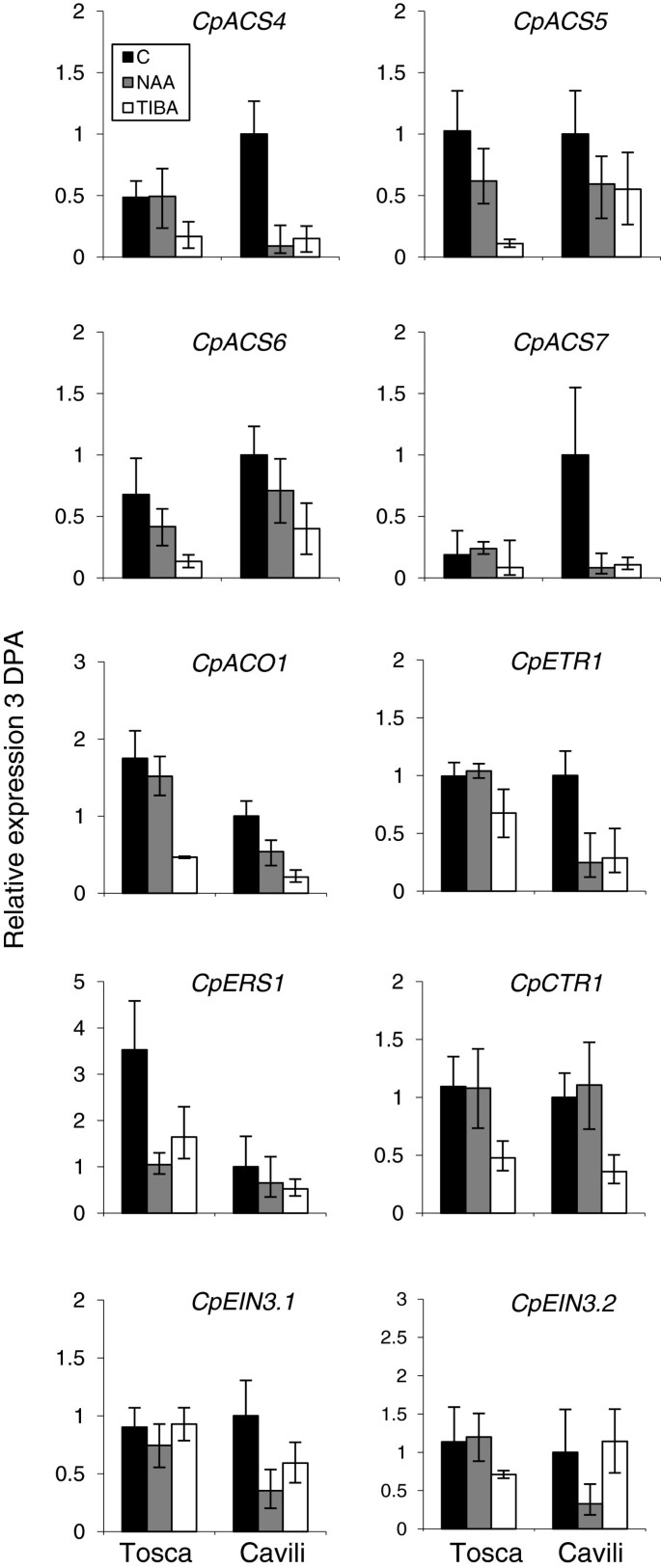
在3 DPA条件下研究了NAA和TIBA对乙烯基因表达的影响,结果表明,授粉果实和未授粉果实、孤雌果和非孤雌果的乙烯产量存在显著差异。根据乙烯生产数据,ACS和华基因在3dpa的托斯卡和豚鼠的果实中,在Na和Tiba中下调(图7),表明植物素在开花后立即在水果中产生负面调节乙烯的生产。TIBA处理比用NAA + NaAMide治疗更有效地减少乙烯生物合成基因的表达(图7).而且,下调CpACS4和CPACS7.在未授粉的果实中,在开花期后的几天内对乙烯产生贡献最大的基因比观察到的高CpACS5,CPACS6.和CpACO1(图7).乙烯受体的表达CPETR1.在Tosca和Cavili的对照卵巢中相似,并且在Cavili和Tosca的TIBA治疗中显著降低。另一个受体基因的表达CpERS1在非单性结实品种Tosca中含量较高,而在该品种中NAA和TIBA均下调(图7).乙烯反应基因,表达CpCTR1在两个品种中也被TIBA下调(图7),但不是NAA;虽然荷尔蒙治疗没有显着改变表达CpEIN3.1和CpEIN3.2在托斯卡(图7),在Cavili Naa下调两者的表达,而TIBA只会降低前者的表达。总之,许多分析的乙烯生物合成,感知和信号基因被NAA和TIBA下调,两种治疗方法是在开花前立即诱导西葫芦果实的生长速率。
讨论
水果套和早期果实发展与乙烯生物合成和信号基因的下调相关
来自13个基因的乙烯生产和表达数据,覆盖乙烯生物合成和信号转导途径C. Pepo.研究表明,该物种非单性结实基因型的授粉损失伴随着乙烯生物合成和3 DPA子房信号转导的急剧增加。对于5也是如此ACS- 状基因显示卵巢中表达(其中一种分析的基因,CPACS1在这个开发时显示卵巢中没有表达)和CpACO1,以及两种乙烯受体(CPETR1.和CpERS1), 二CTR1- 麦基基因(CpCTR1和CpCTR2)和两个EIN3.- 麦基基因(CpEIN3.1和CpEIN3.2).这种乙烯信号在花期后的几天在子房中传递,导致生长下降,最终导致果实流产。另一方面,授粉的花在开花后的几天内,在果实中维持非常低水平的乙烯生物合成和信号转导,伴随着果实的坐果和发育。这种低乙烯信号也在西葫芦品种Cavili的孤雌结实果实中观察到,以及Cavili的分离自交后代的孤雌结实植株中观察到。总体而言,这些数据表明,花后几天子房乙烯产量与坐果和生长呈负相关。
虽然乙烯在坐果和早期果实发育中的作用尚未深入研究,但已有报道称,AVG、STS或1-甲基环丙烯(1-MCP)的外部处理抑制乙烯的产生或反应,可诱导梨的坐果[27], 芒果 [28], 普通话 [29),而拟南芥[24),等等。此外,对番茄的转录组分析表明,在单性果、授粉和GA中,许多乙烯基因在3DPA上表达下调3.乙烯在番茄果座和发育中的作用[12.,22,30.].在本文中,我们证明了乙烯生物合成抑制(AVG处理)或响应(STS处理)足以诱导孤雌结实和非孤雌结实品种在没有授粉的情况下果实的结实和早期发育。因此,我们的数据不仅表明乙烯的低产量/信号传递与坐果之间存在明显的相关性,而且还表明乙烯直接参与坐果和早期果实发育。
乙烯基因在番茄花开花期子房中高度表达,在单性结实基因型中表现尤为明显[12.]但是它们在水果套后下调,这表明乙烯作为抗氧化素的拮抗剂,在水果套装中,预防授粉和施肥前的果实发育成水果[22].在西葫芦中,乙烯生物合成和信号基因在花的发育和成熟直到开花的心皮中被诱导,但在开花的乙烯生产水平低于番茄[未发表的结果,[9].因此,西葫芦授粉子房在开花期后维持乙烯产量(或略有下降)以及乙烯生物合成和信号转导途径基因的表达。开花后番茄和西葫芦心皮乙烯基因表达的差异可能与番茄和西葫芦早期果实发育的差异有关。事实上,番茄果实不启动它的发展直到授粉和受精发生,而在西葫芦我们发现,卵巢的授粉和unpollinated花朵成长以同样的速度在第一次3分区,这一点后,只有当unpollinated水果减少了增长和最终流产。因此,似乎果实早期发育需要低水平的乙烯生物合成和信号传递,而这一水平在西葫芦子房开花时已经足够低了,但在番茄开花后的头几天里它必须减少。单性结实的Cavili果实的乙烯产量低于非单性结实的cv。此外,Cavili F2代雄蕊异种共分离、单性结实和低子房乙烯产量也支持这一结论。
3 DPA诱导西葫芦卵巢乙烯生物合成和信号基因表达,可能参与了未受精卵巢的流产和衰老。在西葫芦中,我们观察到子房和果实的发育在授粉和受精发生之前就开始了,如果不诱导乙烯,果实就会继续发育。授粉/受精和单性结实都可能抑制子房3 DPA中乙烯生物合成和信号通路的诱导。乙烯可以诱导豌豆子房的衰老拟南芥.乙烯作用抑制剂STS和2,5-降冰片二烯处理可延缓子房衰老,延长未授粉心皮对GAs反应的生长时间[31.].卵巢对GAs反应的丧失也与其衰老和胚珠衰老的发生有关拟南芥[24],暗示卵子在促进竞争中促进水果时发挥着关键作用拟南芥未受精卵。胚珠中产生的乙烯似乎控制胚珠寿命和卵巢/水果的命运[32.].虽然我们不知道西葫芦中产生乙烯的子房组织,但在3dpa时,未受精子房的生长减少,这与胚珠开始衰老的时间一致拟南芥和豌豆[24,31.],并与乙烯生物合成和信号基因的诱导。因此,很可能胚珠衰老也是西葫芦整个子房衰老的信号。
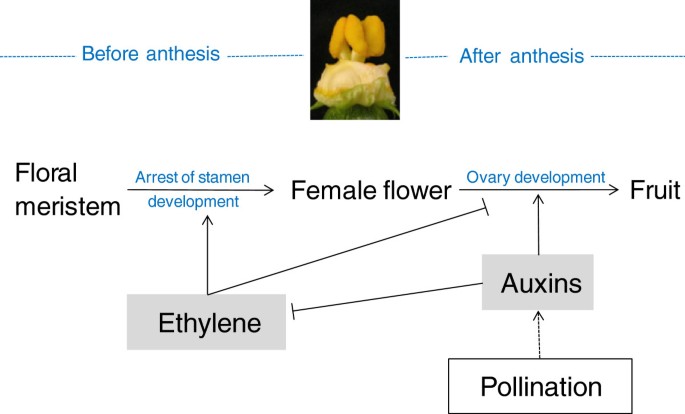
西葫芦果实发育早期阶段的乙烯生物合成和信号传导的低水平可与诱导毒素的诱导,不同植物系统中的果实主要调节器之一[25,33.].结果表明,生长素和TIBA在花期的应用促进了非单性果系未受精子房的生长。与此同时,乙烯产量减少,许多乙烯生物合成和信号转导基因下调。然而,Cavili的卵巢对生长素和TIBA没有反应,这表明该品种的单性结实可能是由卵巢中这种激素的内部水平的增加引起的,正如在其他物种中报道的[16.,34.- - - - - -36.].生长素抑制了3dpa条件下两个品种的乙烯诱导,这也与开花后果实中许多乙烯生物合成和信号转导基因的下调有关。综上所述,这些数据表明,在西葫芦从花到果实的转变过程中,子房中的生长素可以阻止乙烯的生物合成和信号传递,模拟授粉和施肥过程,促进坐果和生长(图)8).众所周知,乙烯和植物素可以协同作用,以控制某些生长和发育过程,例如根伸长率和根毛形成,而且还拮抗其他方法,例如缺杆伸长率[37.].正如我们所展示的,乙烯和生长素在控制坐果和早期果实发育时起拮抗作用(图8).这两种激素的相声在控制子房的这一发育过程C. Pepo.在乙烯生物合成水平发挥作用(生长素下调ACS基因和CpACO1)和乙烯反应(养肝下调乙烯受体基因,和CTR.-和ein3样基因)。这两种重要的植物生长调节剂具有广泛而复杂的相互作用[38.].生长素通过调控乙烯的转录来调控乙烯的生物合成ACS在不同的植物系统中[39.,40,但乙烯也调节根分生组织生长素的生物合成拟南芥[41.,42.].
乙烯产量的减少和/或反应诱导西葫芦孤雌结实
单性果的发育。Cavili与雌花雄蕊的发育有关,即雌花向两性花的转化。考虑到乙烯是瓜类植物性别决定的主要调节器,这些数据表明乙烯参与了这种单性结实。雌蕊中乙烯生物合成的减少,与乙烯生物合成基因功能突变的丢失有关CmACS7和Csacs2.,负责分别将女性转化为甜瓜和黄瓜的双性声花[6,7].我们已经证明了单性结实cv。Cavili产生的乙烯比非单性结实的cv少。孤雌结实与雄雄生殖共分离,降低了Cavili自交后代的乙烯产量。此外,乙烯阻断剂在生物合成(AVG)或反应(STS)水平的应用,诱导了雌花向两性单性果花的转化C. Pepo.而乙烯利处理降低了两性花的数量,从而降低了单性果的发育(图5).由于这些两性花的果实发育发生在花冠仍然闭合时,因此没有授粉/受精(图4和5),乙烯产量的降低可能足以诱导西葫芦单性果的发育。因此,Cavili的单性结实可能是由花后雌花的乙烯产量减少或反应引起的。乙烯生物合成或反应的减少可能是由生长素的增加引起的,这也可以解释单性果的生长。然而,考虑到乙烯也可以调节生长素的生物合成拟南芥[41.,42.,不能排除乙烯在果实定座和早期发育过程中对生长素的生物合成起负调控作用。
单性果子房中乙烯产量的减少不受转录水平的调控,因为我们已经证明了ACS基因在野集和托斯卡之间不会改变,或者在分析的一些基因中甚至更高,甚至是vavili,例如CPACS7..因此,花后几天Cavili子房中乙烯产量的下调似乎是在转录后水平上调控的。最近的发现表明转录后调控是控制的一个重要方面ACS而ACS蛋白c端保守区域的磷酸化在调控其周转中起着至关重要的作用[43.- - - - - -46.].
另一方面,乙烯也参与了西葫芦雌花的成熟和开孔,这些花的乙烯产量较高,使得花冠成熟和开放的速度比雄花快[4].降低乙烯生产和/或患者的雌性花芽中的反应可能不仅可能延迟花瓣的成熟,如我们在双性恋花中所观察到的那样,但在没有授粉的情况下,还抑制了3 dPA的乙烯诱导。由于花尚未开放,因此卵巢遵循正常的发展,达到正常水果的大小,但在尚未达到开花的未成熟的花上。从这个角度来看,水果集不能被认为是从浮粉和施用后的完全发育的花中的卵巢静态条件的积极过渡,而是在授粉和施肥后的积极代谢条件,而是正常编程模式的卵巢发育。授粉/施肥可防止过滤剂后的乙烯生物合成和信号传导,允许水果正常发展。然而,在没有授粉和施肥的情况下,诱导乙烯信号,促进水果发育的流产。
方法
植物、培养条件和处理方法
杂交品种Cavili和Tosca的植株,以及Cavili自交产生的F2分离代,在Almería(西班牙)的一个温室中在相同的条件下种植,遵循当地标准的植物营养和病虫害控制商业做法。
研究了两个品种开花后0、1、2、3、4和5 d授粉和未授粉子房和果实中乙烯的产生和乙烯基因的表达。生长素的参与发展的水果和乙烯生产由治疗卵巢的每一朵花开花0.5毫升的0.8%的合成生长素萘乙酸,组成1-naphthalene乙酸(NAA, 0.45%)和1-naphthaleneacetamide(乙酰天冬氨酸酰胺,1.2%),或1毫米triiodobenzoic酸(三碘苯甲酸),生长素极性运输的抑制剂。这些处理对早期果实发育、乙烯产生和乙烯基因表达的影响在花期后的几天内被确定在子房/果实。
确定乙烯的影响在性别决定和单性结实,两个品种的顶端芽对待每三天总共三个星期200 ppm乙烯利,1毫米aminoethoxyvinylglycine (AVG),乙烯生物合成的抑制剂,或0.25银硫代硫酸盐(STS),抑制乙烯反应的人。测定了单性结实部分雌雄同株品种Cavili和非单性结实雌雄同株品种Tosca的对照和处理植株的果实生长速率和性表达。
为了比较果实生长和乙烯生产在授粉和非授粉的水果之间,从开花到5 dPa测量十二个卵巢/果实的长度和直径。同时在不同DPA收获卵巢/果实,并在4个卵巢/水果的4次重复上测量乙烯生产。为此目的,在相同的发育阶段的三个卵巢/果实封闭在密封容器中6小时,通过气相色谱法测定产生的乙烯[4,8].在装有火焰离子化检测器(FID)的VARIAN 3900气相色谱仪中,每个样品的乙烯生产重复四次。用同样的方法比较了NAA和TIBA处理的子房果实生长速率和乙烯产量。隔离F2人群Cavili水果大小和乙烯生产测量只在开花期和3个分区,但使用25为每个花表现型复制,同时来自23个雌雄同株的non-parthenocarpic F2植物和最少50部分雄全同株的parthenocarpic F2植物。
定量RT-PCR表达分析
基因表达分析在每个样品中的三种复制中进行。每份复制是从3个不同卵巢/水果中独立提取总RNA的结果。根据该方案进行RNA提取物Aurum总RNA迷你套件(Biorad)。用酶切法去除RNA样品中残留的DNARQ1 RNAse游离dna酶(Promega)。在合成cDNA之前,我们用引物进行PCR扩增,验证RNA和cDNA样品中DNA的缺失CpACS27,一种在原始阶段或果实中在卵巢中表达的基因C. Pepo.(未发表的结果)。然后使用600 ng总RNA合成cDNAiScript RT-qPCR的反转录Supermix(Biorad)。通过使用定量RT-PCR评估基因的表达Rotorgenethermocycler(试剂盒)Power SYBR Green PCR Master Mix(qiagen)。附加文件1表S1显示了本文分析的不同基因,包括其序列的登录数,用于q-PCR的相应引物以及它们在甜瓜和黄瓜中可能的同源性[47.,48.].从每个基因的3 '非编码区设计q-PCR引物Primer Express v 2.0(应用生物系统)软件。为了避免可能的交叉扩增,在任何Q-PCR实验之前,在琼脂糖凝胶中测试每对引物的PCR产物的大小,并测序。定量RT-PCR反应在60℃下在95℃和20s处的40个20 s的40个循环组成。这是如此,但是最后还在95℃下扩增5 s,在61℃下扩增30 s,共扩增40个周期。
各基因的相对表达量由比较Ct (循环阈值)方法使用c .瓠果18岁核糖体RNA和施基因作为内部标准。为了使用这种方法,我们首先证明了无论模板cDNA的数量如何,每个扩增子的扩增效率大致相同。给定样本ΔCt(目的基因Ct -参比基因Ct)相对于cDNA序列稀释的斜率绝对值必须小于0.1。然后使用公式2计算每个基因相对于校准样品的相对表达量-ΔΔCt,其中ΔΔCt为每个样品的ΔCt与校验器样品的ΔCt之间的差值。
统计分析
采用Statgraphics Plus v 5.1软件进行p <0.05的简单方差分析和因子方差分析(ANOVA),并用Fisher最小显著差异(LSD)法对两组均值进行比较。为了应用这些统计技术,变量必须服从正态分布。当正态性假设不成立时,对变量进行变换。
缩写
- ACC:
-
1-aminocyclopropane-1-carboxylic酸
- ACO:
-
ACC氧化酶
- ACS:
-
Acc合酶
- DPA:
-
黄花木后天数
- 气体:
-
吉布林斯
- 1-MCP:
-
1 - Methylcyclopropene
- STS:
-
银thiosuphate
- AVG:
-
Aminoethoxyvinylglycine
- 乙酰天冬氨酸:
-
1-naphthalene醋酸
- TIBA:
-
三碘苯甲酸
- CTR:
-
本构三重反应
- ers:
-
乙烯反应传感器
- ETR:
-
乙烯受体
- EIN3:
-
乙烯insensitive3。
参考文献
- 1。
Abeles FB, Morgan PW,《植物生物学中的乙烯》第二版。加州:学术出版社:1992。
- 2.
京晶:乙烯和水果成熟。植物生长规律学报,2007,26:143-159。10.1007 / s00344 - 007 - 9002 - y。
- 3.
瓜类植物性激素表达调控的生化研究。葫芦科植物的生物学及利用。编辑:Bates DM, Robinson RW。伊萨卡-纽约:康奈尔大学出版社:1990,269-280。
- 4.
李志刚,李志刚,李志刚,等:乙烯和油菜素内酯在油菜有性表达和花发育中的作用葫芦塔辣椒.植物营养学报。2011,65:213-221。10.1007 / s10725 - 011 - 9589 - 7。
- 5。
Manzano S,MartínezC,Megíasz,gómezp,garrido d,jamilena m:乙烯生物合成和信号传导在从男性到女性开花的跨自重要葫芦塔辣椒.植物营养学报,2013,29(6):657 - 662。http://dx.doi.org/10.1007/s00344-013-9344-6.
- 6。
Boualem A, Fergany M, Fernandez R, Troadec, Martin A, Morin H, Sari MA, Collin F, Flowers JM, Pitrat M, puruganan MD, Dogimont C, Bendahmane A:乙烯生物合成酶的保守突变导致瓜类雌雄同体。中国科学(d辑):地球科学(英文版)。10.1126 / science.1159023。
- 7.
Boualem A, Troadec C, Kovalski I, Sari MA, Perl-Treves R, Bendahmane A:一种保守的乙烯生物合成酶导致雌雄同体Cucumis物种。Plos一个。2009,4:E6144。10.1371 / journal.pone.0006144。
- 8.
Manzano S, Martínez C, Domínguez V, Avalos E, Garrido D, Gómez P, Jamilena M:一个降低乙烯敏感性和雄性性的主要基因葫芦塔辣椒.植物生长规律学报,2010,29:73-80。10.1007 / s00344 - 009 - 9116 - 5。
- 9.
Manzano S,MartínezC,gómezp,garrido d,jamilena m:两个ctr1样基因的克隆和表征葫芦塔辣椒:在男性和女性花卉发展中调节他们的表达。性植物团体。2010,23:301-313。10.1007 / s00497-010-0140-1。
- 10。
傅FQ,毛泽东,施克,周耶,asami t,yu Jq:芸苔类固醇在黄瓜早期果实发育中的作用。J Exp Bot。2008,59:2299-2308。10.1093 / JXB / ERN093。
- 11.
Orzáezd,granell a:DNA碎片在Carpel衰老期间受乙烯调节Pisum sativum..植物学报,1997,11:137-144。10.1046 / j.1365 - 313 x.1997.11010137.x。
- 12.
植物生长素在果实分化中的作用。植物科学进展。2007,12:327-329。10.1016 / j.tplants.2007.06.011。
- 13.
De Jong M,Mariani C,Vriezen WH:植物素和吉布林素在番茄果实套装中的作用。J Exp Bot。2009,60:1523-1532。10.1093 / JXB / ERP094。
- 14。
1-氨基环丙烷-1-羧酸合酶Cucurbita:中的纯化、属性、表达式大肠杆菌,通过DNA序列分析确定一级结构。中国生物医学工程学报。
- 15.
Wang H,Schauer N,Usadel B,Frassp,Zouine M,Hernould M,LatchéA,Pech J,Fernie AR,Bouzayena M:监管特征潜在的授粉依赖性独立于独立的番茄果实组,揭示了转录物和初级代谢物分析。植物细胞。2009,21:1428-1452。10.1105 / TPC.108.060830。
- 16。
引用本文:Kim IS, Okubo H, Fujieda K:内源IAA水平与黄瓜单性结实的关系(Cucumis巨大成功l .)。SCI Hortic。1992年,52:1-8。10.1016 / 0304-4238(92)90002-T。
- 17.
李Y,yu J,Ye Q,朱Z,uco z:Cycd3的表达通过授粉和卵巢中的授粉和N-(2-氯-4-吡啶基)-N'-苯基脲瞬时增加Lagenaria leucantha.中国生物医学工程学报,2003,21(4):457 - 461。10.1093 / jxb / erg124。
- 18.
油菜素内酯在农业中的应用。油菜素类:植物固醇类激素。编辑:Sakurai A, Yokota T, Clouse SD。东京:施普林格Verlag 1999,223-241。
- 19.
阮y,帕特里克·吉尔,布孜米,奥罗西奥S,Fernie Ar:种子和水果套装的分子调节。趋势植物SCI。2012,17:656-665。10.1016 / J.Plants.2012.06.005。
- 20。
番茄早熟果实发育的调控机制。植物营养与肥料学报。2003,31(4):491 - 497。10.1104 / pp.010132。
- 21。
Larsen PB,Woltering EJ,Woodson WR:授粉后花卉中的乙烯和Interogan信号传导。与其他组织互动的植物信号。由:Raskin I,Schulzt J. Rockville,马里兰州:美国植物学会生理学家:1993,171-181。
- 22。
谢东,Doležal K, Schlereth A, Jürgens G, Alonso JM: taa1介导的生长素生物合成对激素交互作用和植物发育至关重要。细胞。2008,133:177-191。10.1016 / j.cell.2008.01.047。
- 23。
Wang S, Tiwari SB, Hagen G, Guilfoyle TJ:生长素响应因子7在突变拟南芥叶肉原生质体中恢复生长素响应基因的表达。植物学报。2005,17:1979-1993。10.1105 / tpc.105.031096。
- 24.
在拟南芥中,乙烯通过调节胚珠衰老和ga介导的果座而参与雌蕊命运。植物营养与肥料学报。2011,11:84。10.1186 / 1471-2229-11-84。
- 25.
Peñarandaa,payan mc,garrido d,gómezp,jamilena m:西葫芦南瓜的附加花卉的生产与女性花的成熟的逮捕相关。j hortic sci biotech。2007,82:579-584。
- 26。
Blanca J,CañizaresJ,Roig C,Ziarsolo P,Nuez F,Picób:转录组特征和高吞吐量SSR和SNPS发现葫芦塔辣椒(葫芦科)。基因组学杂志。2011,12:104。10.1186 / 1471-2164-12-104。
- 27。
Dussi MC, Sosa D, Calvo G:保留tm对梨品种Williams和Packham’s Triumph果实成熟度和坐果的影响。Acta photonica sinica, 2002,32(6): 741 - 741。
- 28。
通过细胞内生长素消耗抑制极性生长素转运抑制剂向管状细胞分化。植物营养与肥料学报。2005,26(4):429 - 434。10.1093 /卡式肺囊虫肺炎/ pci217。
- 29.
ObreroÁ,Die JV,RománB,GómezP,Nadal S,González-Verdejo CI:西葫芦基因表达研究的参考基因选择(葫芦塔辣椒)使用qpcr。JAgric Food Chem。2011,59:5402-5411。10.1021 / JF200689R。
- 30.
关键词:番茄,子房,转录组,座果,激素植物生态学报,2008,29(6):591 - 598。
- 31。
Olimpieri, Siligato F, Caccia R, Soressi GP, Mazzucato A, Mariotti L, Ceccarelli N:番茄授粉或孤雌果等位基因驱动的坐果是由转录调控的赤霉素生物合成介导的。植物学报。2007,26:877-888。10.1007 / s00425 - 007 - 0533 - z。
- 32。
Carbonell-Bejerano P,Urbez C,Carbonell J,Granell A,Perez-Amador MA:施肥的发展计划触发拟南芥雌蕊的部分果实发育和衰老过程。植物理性。2010,154:163-172。10.1104 / pp.110.160044。
- 33。
Ozga Ja,Reinecke DM:水果开发中的荷尔蒙互动。J工厂增长调节。2003,22:73-81。10.1007 / s00344-003-0024-9。
- 34。
Goetz M, Hooper LC, Johnson SD, Rodrigues JCM, Vivian-Smith A, Koltunow AM:生长素反应因子8的异常形式的表达刺激拟南芥和番茄的单性结实。植物营养与肥料学报。2007,31(4):451 - 457。10.1104 / pp.107.104174。
- 35。
Sanz M: Fitorreguladores para calabacín。草业科学。1995,33:46-48。
- 36.
Serrani JC,Carrera E,Ruiz-Rivero O,Gallego-Giraldo L,Peres Lep,García-MartínezJL:抑制卵巢或从顶端拍摄的植物素运输诱导由吉布林林介导的番茄中的占疗效果实。植物理性。2010,153:851-862。10.1104 / pp.110.155424。
- 37.
Martin A,Treadec C,Boualem A,Rajab M,Fernandez R,Morin H,Pitrat M,Dogimont C,Bendahmane A:转座子诱导的表观遗传变化导致甜瓜中的性别测定。NAT。2009,461:1135-1138。10.1038 / Nature08498。
- 38。
Serrani JC,Ruiz-Rivero O,Fos M,García-MartínezJL:番茄中的植物素诱导的水果套是吉伯林林的一部分介导。工厂J. 2008,56:922-934。10.1111 / J.1365-313x.2008.03654.x。
- 39。
Argueso CT,Hansen M,Kieber JJ:乙烯生物合成的调节。J工厂增长调节。2007,26:92-105。10.1007 / s00344-007-0013-5。
- 40。
Woltering EJ,Ten拥有A,Larsen PB,Woodson WR:乙烯生物合成基因和器官在花发育过程中的信号传导。植物繁殖的分子与细胞方面。编辑:Scott RJ,Stead AD。剑桥,英国:剑桥大学出版社:1994,285-307。
- 41。
Serrani JC,SanjuánR,Ruiz-Rivero O,Fos M,García-MartínezJL:吉布雷林果实套装和番茄生长的调节。植物理性。2007,145:246-257。10.1104 / pp.107.098335。
- 42。
乙烯信号传导和反应:不同的调控模块相遇之处。植物生态学报。2009,12:548-555。10.1016 / j.pbi.2009.07.009。
- 43。
Chae HS,Faure F,Kieber JJ:EtO1,EtO2和EtO3突变和细胞蛋白治疗通过增加ACS蛋白的稳定性来增加拟南芥中的乙烯生物合成。植物细胞。2003,15:545-559。10.1105 / TPC.006882。
- 44。
Chae HS, Kieber J: Eto Brute?ACS周转在乙烯生物合成中的作用。植物科学进展,2005,10:291-296。10.1016 / j.tplants.2005.04.006。
- 45。
关键词:拟南芥,氨基环丙烷-1-羧酸合成酶,胁迫应答,丝裂原激活蛋白激酶植物营养与肥料学报。2004,16(4):489 - 498。10.1105 / tpc.104.026609。
- 46。
Stepanova AN, Hoyt JM, Hamilton AA, Alonso JM:乙烯和生长素之间的联系,揭示了两个根特异性乙烯不敏感突变体的特性。acta botanica sinica, 2017, 36(5): 772 - 772。10.1105 / tpc.105.033365。
- 47。
Garcia-Mas J,Benjak A,Sanseverino W,Bourgeois M,Mir G,GonžalezVM,Heakaff E,Camara F,Coozzuto L,Rowy E,Alioto T,Capella-GutieŕrezS,Blancae J,CañizaresJ,Ziarsolo P,Gonzalez-ibeas d,rodriǵuez-moreno l,droege m,du l,alvarez-tejado m,洛伦特 - 盖尔多斯b,melećm,杨l,翁y,纳瓦罗a,marques-bonet t,aranda ma,nuez f,picób,Gabaldońt,罗马克,桂皮r,casacuberta jm,aruùp,puigdomenech p:甜瓜的基因组(Cucumis梅洛l .)。中国科学(d辑:地球科学),2012,32(4):591 - 598。10.1073 / pnas.1205415109。
- 48.
Esteras C,GómezP,Monforte Aj,Blanca J,Vicente-dóleran,roig c,nuez f,picób:高通量snp基因分型葫芦塔辣椒用于地图结构和定量特质基因座映射。BMC基因组学。2012,13:80.101186 / 1471-2164-13-80。
致谢
这项工作得到了授予AGL2008-05619-C02-02 / ALI和AGL2011-30568-C02-02 / ALI的支持,部分由ERDF(欧洲区域发展基金)和西班牙科学和创新部资助,并授予CVI-02617,由ERDF和Consejeríadenovación,CIENCIA Y EMPRESA,西班牙Junta deAndalucía的资助。厘米。和Z.M.承认来自西班牙MEC的FPU计划奖学金。星由Grant Pta2011-479 - 来自西班牙科学和创新部资助。
作者信息
隶属关系
通讯作者
额外的信息
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
作者的贡献
CM产生植物材料并进行了大部分实验。SM监督QPCR实验和ZM也为他们做出了贡献。BP提供了ACS基因序列和生成的附加文件1S1:表。DG和BP修改了文件。MJ协调了这项研究并起草了手稿。所有作者阅读并批准了最终的手稿。
电子辅料
12870_2013_1351_moesm2_esm.pdf.
图S1:乙烯利和乙烯抑制剂AVG和STS处理对品种Tosca (A)和Cavili (B)性表达和单性结实的影响。
作者的原始提交的图像文件
下面是作者提交的原始图片文件的链接。
权利和权限
开放获取本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0.),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
Martínez, C., Manzano, S., Megías, Z.。et al。乙烯生物合成和信号通路在西葫芦结实和早期果实发育中的参与(葫芦塔辣椒l .)。BMC植物BIOL.13,139(2013)。https://doi.org/10.1186/1471-2229-13-139
已收到:
接受:
发表:
关键字
- 葫芦塔辣椒
- 水果套装
- Parthenocarpy.
- 乙烯
- 基因表达
- 生长素