摘要
背景
植物细胞壁是一种复杂的动态结构,在协调植物组织的定向生长中起着至关重要的作用。在模型植物中花序茎的快速伸长拟南芥伴随着细胞壁结构和化学的根本变化,但对潜在机制的分析和所涉及的基因的鉴定一直受到沿发育茎精确采样离散发育状态的困难的阻碍。
结果
通过为单个扩展的拟南芥茎秆创建茎秆生长运动学剖面,我们已经能够收获和收集发育匹配的组织样本,并使用这些样本对茎秆生长的四个不同阶段的全局转录谱进行比较分析:伸长率增加期、生长速率最大点、茎秆生长停止点和完全成熟的茎秆。由此产生的图谱确定了许多基因,这些基因的表达在茎组织通过这些确定的生长转变时受到影响,包括新的位点和早期研究中确定的基因。特别值得注意的是,在茎生长停止区域与次生细胞壁沉积相关的高活性基因的优势,以及在完全成熟的茎中与防御和应激反应相关的基因的优势。
结论
利用生长运动学分析方法创建的组织样本,可以沿着拟南芥花序茎的扩展生长连续体精确定位,为此类组织的转录本分析建立了新标准。由此产生的表达谱确定了大量基因的表达首次与细胞壁的快速延伸和随后的强化相关,从而为对植物生物量积累相关基因发现感兴趣的植物生物学家提供了重要的新资源。
背景
定向(各向异性)细胞壁扩张是大多数植物发育过程中不可分割的一部分,它促进了正确的细胞和器官形态发生所必需的结构变化。最初的扩张生长阶段,既需要添加新的细胞外聚合物,也需要重塑原代细胞壁中的现有成分,通常由细胞壁增厚和硬化过程来完成,以创建二级细胞壁,增强器官的结构完整性,但也限制进一步的壁扩展。这些顺序过程需要高度动态的、特定环境的细胞壁构建、重建和强化协调,以便以空间定义的方式利用膨胀压力的潜在驱动力(综述于[1,2])。与这种发育复杂性相一致的是,拟南芥中至少有1000个基因已被证明与细胞壁合成和重塑有关[3.].
在拟南芥中与细胞壁扩张和/或次级细胞壁形成相关的基因表达模式已在几项研究中进行了分析,以鉴定参与基因并了解其产物的生物学作用[4- - - - - -8].例如,为了专门研究细胞扩张过程,转录谱已经与正在经历快速细胞伸长而没有显著细胞分裂的拟南芥幼苗下胚轴中的蛋白质积累谱进行了比较[9].文字记录分析也进行了在体外培养百日草叶肉细胞[10,11]和拟南芥传代细胞[12]这些细胞被诱导转分化为管状元件样细胞,这一过程伴随着在原始初生细胞壁上沉积独特的次生细胞壁增厚。在另一种方法中,公共微阵列数据的大规模相关分析使在网上确定表达与拟南芥纤维素合成酶特定成员表达高度一致的基因(中国极限运动协会)被认为主要参与初级或次级细胞壁生物形成的基因家族[13].
拟南芥花序茎为这类基因发现研究提供了一个有吸引力的实验系统,因为它为分析提供了更大量的组织,而且它的组织结构在抽苔之前就基本建立了,这意味着茎的扩张主要是细胞伸长的产物,而不是分裂。然而,随着其组成细胞从早期各向异性扩张生长到生长停止,最后到细胞壁强化,生长茎也呈现出沿器官的连续发育状态。与细胞扩张活性的这些变化相结合的是与组成茎的离散组织的分化和成熟相关的其他变化。
为了准确监测伴随这些不同茎生长转变的基因表达变化或转录编程,必须对可证实与特定发育阶段相关的茎组织进行取样和收集。许多花序茎分析研究试图比较特定发育阶段之间发生的全球转录变化[4,5,7,14],但所采用的实验策略通常比较来自多种植物视觉选择区域的组织,并在两个未经测试的假设下运行:1)茎被取样的聚集植物都有相似的发育比例,2)收获植物的取样指南,来自于对一组不同植物的破坏性分析,准确地将茎的束间纤维的木质化外观等特征联系在一起[4]有特定的生长发育阶段。与这些假设相反,最近对单个拟南芥植物扩展花序茎的生长运动学分析表明,不同植物的茎生长特征实际上存在很大差异,即使在基因同质群体中也是如此[15].因此,从间接选择和收获的茎区获得的数据可能与与特定生长阶段相关的细胞壁扩展或修饰事件所涉及的过程的发生相关性相对较低。
在本研究中,如Hall和Ellis(2012)所述,我们将生长运动学分析(GKP)应用于一系列单独的拟南芥花序茎[15],并使用所得到的生长速率剖面来生成汇总的茎组织样本,这些样本准确地代表了沿着细胞壁扩张发育连续体的四个离散的生长阶段。我们使用基于gkp的采样,期望减少与以往研究中使用的间接采样策略相关的生物噪声,从而提高转录谱分析的敏感性(检测实际差异表达的能力)和准确性。在这些gkp匹配的茎样本中,基于微阵列的整体转录丰度评估使我们能够生成转录组数据集,这些数据集可以在细胞壁扩张性能(相对元素生长速率)的有效发育背景下有信心定位。由此产生的基因表达谱显示了许多早先与初级或次级细胞壁合成有关的基因的参与,但它们也强调了一系列独特基因的表达变化,这些基因在细胞壁成熟或茎扩张中的作用尚未得到评估。
结果
阶段特异性转录组分析
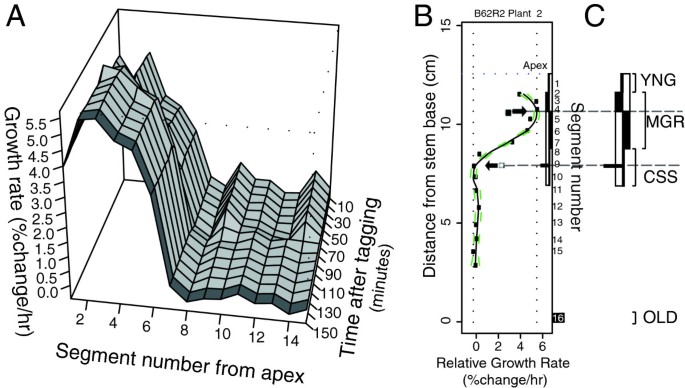
为了在细胞壁扩展连续体中准确定位转录本谱,我们使用生长运动学谱来建立从一系列单株植物中收获的连续茎段的相对元素生长速率(REGRs) [15].这些剖面使我们能够确定每一种样本植物的三个发育阶段:1)组织开始分化,定向细胞生长初始化的顶端区域(称为“年轻”或YNG), 2)茎定向生长最快的区域(称为“最大生长速率”或MGR), 3)伸长生长结束的区域(称为“停止”或CSS)。因此,这些阶段都是由多个聚合段组成的样本表示的,每个片段都是从以特定的gkp鉴定的生长阶段为中心的茎位置采集的。组织选择方案概述在图中1A-C,而本研究中使用的所有植物的生长运动学剖面在附加文件中提供1:图S1。为了便于我们的数据与花序茎中其他转录组研究的结果进行比较,我们还从每个花序茎的基部收集了一段(称为“成熟”或OLD),并将其汇总用于我们的转录谱分析。
代表性的生长剖面和收获。一个)相对伸长增长率(每小时变化百分比,垂直轴)相对于段数(由光学标记标签定义)从顶点向下的代表性表面图,在10分钟间隔成像周期的持续时间内。较深的灰色阴影,最近的剖面表示收获前的最后10分钟间隔,在右侧散点图中有更详细的描述。B)生长速率(每小时长度变化百分比)对特定段的茎基距离的对应散点图。分段编号从植株顶部开始,一直到右侧边缘。LOWESS回归曲线遵循该植物在给定10'区间内的生长速度数据的最佳拟合。绿色虚线表示LOWESS回归曲线的65%置信区间。闭框/箭头表示与回归曲线(段5)的最大生长速率相匹配的茎杆位置,绘制为最右边的垂直虚线,而开框/箭头表示茎杆顶部以下的第一个位置,此时生长速率降为零(段10)。C)根据LOWESS曲线,收获区分为幼龄区(YNG)、最大生长速率区(MGR)、停止区(CSS)和茎基区(OLD)。zone的建立方法请参见。参见附加文件1:完整的34个生长运动学剖面图S1。
为了最大限度地提高统计能力和分析的灵活性,我们的实验直接共杂交了所有发育阶段样本的成对组合(“完全析因”实验设计),并使用了“混合效应模型”分析[16]在六个生物重复的基础上比较四个发育阶段,每个重复都来自34个随机分配的植物。
不同阶段之间差异表达的检查
本研究的目标是确定在不同生长阶段花序茎中表达差异最大的基因,因为这些基因被认为是伴随转录重编程的最活跃的位点。本实验基于混合效应模型的分析在四个阶段之间产生了六种可能的成对比较,完整的统计分析在附加文件中给出2,3.而且4:表S1。
为了进行详细的分析,我们在这里将重点放在三个生长阶段的比较(YNG-MGR、MGR-CSS和CSS-OLD)上,并检查平均值(log)之间的算术差异2)每个基因的信号强度。虽然在这些比较中,不同阶段之间有多达4635个基因表达差异(q值<0.05),但我们只讨论了40个最大的基因表达差异,这些基因表达差异以传统的折叠变化比和对数形式表示2对于YNG/MGR,它们的推导比率,以及假发现校正的双样本t检验分数(q值)的统计显著性测量(表1而且2),经理/CSS(表格3.而且4)和CSS/OLD(表5而且6)比较。由于我们应用了严格的过滤标准(见表中的图例),这些列表应该主要由在每个相关的生长过渡期间转录本丰度被激进地调节的基因组成。为了寻找这些短名单、上调和下调基因之间潜在的功能关系,研究了它们的注释、基因本体(GO)赋值和可能的启动子基序富集。使用“AtCoeCis”网络工具确定相对于全基因组平均值的GO术语富集[17],报告富集(折叠变化),统计显著性(p值),以及每个短列表中被分配到特定GO术语的基因的比例(“分数”)(附加文件5:表S2,附加文件6:表S3,附加文件7:表S4)。
为了在达到最大伸长率之前确定茎转录组的状态,对茎顶部1厘米的片段(去除花)进行基因表达谱分析,然后将该YNG转录谱与代表gkp鉴定的最大生长速率(MGR)阶段的片段生成的谱进行比较。表中列出了在YNG期样本中相对于MGR期(阳性折叠变化值)表现出高转录副本数的40个基因,或者在MGR期样本中相对于YNG期(阴性折叠变化值)表现出高转录副本数的40个基因1而且2在yng显性基因集中,4个基因中有两个基因上调最多延伸系数1-alpha基因家族[18) (EF-1 -αA2 (At1g07930),EF-1 -αA3 (At1g07940))。这种与活性蛋白合成的关联也反映在这一组的GO术语富集分析中(附加文件)5:表S2),表示>在含有“translation”的GO术语中富集80倍。在这个“yng上调”列表中还发现了与信号相关的基因(RLK902[19];CLE16 (CLAVATA3同系物)[20.];LOX2[21];At1g62950,一种LRR蛋白激酶),以及转录因子(ZF-HD类AtHB33;NAC063).由CLE基因产物衍生的多肽介导的细胞间通信,与同源受体激酶共同作用,代表了帮助指导植物发育的复杂信号网络的一部分[22].虽然已知的细胞壁相关基因在“yng上调”列表中并没有显著的过度代表,但一个基因编码一种假定的葡聚糖内do-β(1→3)-葡萄糖苷酶(At4g14080) [23比MGR阶段上调了15倍。
尽管细胞壁的扩张在YNG期和MGR期组织中都有发生,但在后者中,其产物对快速扩张有独特要求的基因应该相对高表达。相对于YNG, MGR组织中最强烈的差异上调(约40倍)基因是过氧化物酶(PER64),之前曾有报道称,在茎秆中对机械负荷的响应会上调[24].拟南芥过氧化物酶基因家族很大,其成员在细胞代谢中发挥多种作用,包括调节活性氧的积累[25]以及芳香族代谢物的氧化偶联作用,如用作木质素聚合物前体的单木质素[26,27].的表达式PER64在拟南芥中已被证明集中在原生木质部[28],其中有图案的次生细胞壁增厚的木质化有助于血管延伸期间细胞壁的稳定,这种空间特异性与强PER64在MGR组织中的表达。
MGR上调的列表还包含几个与原代细胞壁形成和重建更直接相关的基因,包括木葡聚糖内转糖基化酶/水解酶MERISTEM-5(MERI5B / XTH24),一种推测为果胶酶(At1g80170),两种阿拉伯半乳聚糖蛋白(AGP12, AGP13)和MYB转录因子(MYB61),最近已被证明有助于细胞壁的合成和植物碳分配的调节[29- - - - - -32].此外,一些编码与植物激素信号相关的蛋白质的基因在MGR组织中表达更高,包括一种推定的ACC氧化酶,ga反应迷你锌指1(MIF1) [33]和另一种基因GASA6(At1g74670)据报对ga有反应[34].
将MGR阶段基因表达模式与在更成熟的CSS阶段观察到的基因表达模式进行比较,通过将它们在快速扩张的MGR组织中的表现与在细胞壁扩张停止的CSS组织中的表现进行比较,可以从另一个角度了解那些与活跃的茎扩张最相关的基因。有趣的是,20个基因的表达是“更高的MGR相对于CSS”(表3.)并不是由已知与细胞壁合成或修饰相关的基因所引导,而是由主要乳胶蛋白423(MLP423),是BET V1类过敏原的一员,表现出与来自各种植物物种的ABA和应激反应蛋白的序列同源性(EMBL-EBI数据库信息)。MLP423伴随着两个大的(108个成员)gdsl型脂肪酶同源基因家族的成员,以及其他与脂质代谢/运输相关的基因,但已知直接参与细胞壁合成的基因很少,如果有的话。这一特征表明,“相对于CSS的MGR更高”列表中的基因主要是那些在细胞从快速各向异性扩张过渡到成熟过程中表达相对强烈降低的基因。
“CSS相对于MGR更高”基因列表(表4),另一方面,有望捕获那些对重新编程做出重大贡献的基因,这些重新编程与过渡到细胞壁稳定和硬化阶段有关。与这一预测一致,该列表主要由与非扩张壁形成相关的基因组成,包括所有三个被认为在二次细胞壁生物合成过程中参与纤维素微纤维沉积的纤维素合成酶基因(CESA4 / IRX5,CESA7 / IRX3,CESA8 / IRX1) [14,35- - - - - -37),而几丁质酶样蛋白2(CTL2) [38]其功能丧失突变体显示纤维素生物合成缺陷[39].木聚糖生物合成/修饰所需的基因也有很强的代表性,包括a葡萄糖醛酸脱羧酶3/ ux3[40为木聚糖主干合成提供udp -木糖,不规则木质部9(IRX9) [41),易碎纤维8(FRA8) [42]其编码蛋白构建并扩展了葡萄糖醛酸基木聚糖聚合物,以及两个木聚糖修饰基因:一个木葡聚糖特异性内转糖基化酶/水解酶19 (XTH19) [43),而还原性壁乙酰化1 (rwa1)[44].其他细胞壁修饰基因,包括两种果胶酯酶(At2g43050,At2g45220),其中一个是列表中差异表达最强的基因。这些果胶去甲基化酶在MGR→CSS转变列表中的突出地位与当前植物细胞壁硬化的模型一致,在该模型中,果胶甲基化水平的降低导致钙离子交联和细胞壁硬化的增强[45- - - - - -48].
除了其编码产物影响细胞壁多糖生物合成的基因外,该列表还包括不规则木质部12(IRX12 / LAC4).漆酶被认为有助于木质素在次生壁中的聚合LAC4先前的研究表明,该表达在拟南芥茎的木纤维和束间纤维中是特异性的。木质素的沉积在很大程度上不受影响lac4功能丧失突变体,但在lac4 / lac17双重功能丧失突变体[49].值得注意的是,我们观察到的表达无显著性差异LAC17CSS和MGR阶段的差异(1.3倍差异,CSS/MGR)。总的来说,这个列表中的20个基因中有9个也出现在一组“木质部特异性”拟南芥基因中,这些基因是通过分析公共数据集确定的[50],这与CSS组织中木质部纤维和管状元件在茎扩张停止后细胞壁硬化的代谢承诺一致。
虽然生长运动学数据不能沿着发育连续统精确定位茎的基部(生长运动学剖面只能根据其膨胀速率区分茎区域),但从以前的微观分析中可以清楚地看出[4,51在本研究中研究的10-15厘米高的哥伦比亚植株中,OLD期组织显示出器官生长和细胞壁成熟的高级阶段。基于我们目前对茎成熟过程的理解,CSS和OLD样本预计分别包含积极参与次级细胞壁形成和强化的早期和后期阶段的组织。表5而且6分别给出20个表达为“CSS相对于OLD更高”的基因和20个表达为“OLD相对于CSS更高”的基因。
在CSS中显示相对于旧样本的高表达式发芽样蛋白3 (ger3 / glp3)(At5g20630),发芽样蛋白1 (ger1 / glp1)(At1g72610).GER3也出现在MGR组织中比CSS中高表达的基因列表中(表2)3.),表示该成员的表达式蒙古包在茎成熟过程中,基因家族呈急剧下降的趋势。虽然GLP1和3的具体发育作用尚未被确定,但GER蛋白是一种与植物抗病性和ROS调节广泛相关的异体糖蛋白,特别是在谷物中[52].有趣的是,另一个拟南芥GER同源物(GLP10,At3G62020),先前发现其表达与次级细胞壁相关高度相关中国极限运动协会(CesA4, 7及8)的公共微阵列数据集的回归分析[13],在我们的研究中,在CSS和OLD阶段也表现出升高的表达(附加文件2,3.而且4:表S1)。
在细胞壁成熟的早期阶段也高度表达的是两种果胶酸裂解酶(聚半乳糖醛酸酶),At3g07010而且At3g15720,以前与细胞分离有关[53),而ALPHA-XYLOSIDASE 1 / AXY3(At1g68560),一种外糖化酶,专门作用于非集中的木葡聚糖[54],是外质体木葡聚糖修饰所必需的[55].其他几个上调的基因与细胞壁过程的联系不太明显,但其编码蛋白的功能可能与该基因组GO术语富集分析中“膨胀压力”的过度表现有关(附加文件)7:表S4)。
相对于CSS组织,OLD组织中表达最高的基因列表(表2)6)的研究结果尤其引人注目:8个高度上调的基因中有6个编码植物防御素(PLANT DEFENSIN, PDF)蛋白,这是一种富含半胱氨酸的小肽,与广泛分布在真核生物中的抗微生物肽同源[56].由于CSS和OLD组织都是在几秒钟内收获的,因此不太可能存在人为的损伤诱导基因诱导模式。相反,这种典型的“防御”基因的产物的积累可能是花序茎正常成熟的一个组成部分,也许反映了在受精和种子传播成功完成之前,对这些组织的保护承诺。
相对较少的细胞壁特异性基因出现在“在OLD中高于在CSS中”的短名单中,除了伸展蛋白3 / RSH还有另一种富含脯氨酸的类延伸蛋白家族蛋白质。EXT3/RSH通过形成EXTENSIN蛋白支架,交联其他细胞壁成分,从而促进细胞壁硬化,在细胞壁沉积中发挥重要作用[57,58].OLD期相对于CSS期上调最多的基因是叶绿体定位基因脂肪酸还原酶6 (far6).类似的FAR6表达升高模式早前在茎基部表皮的微阵列分析中观察到[59]以及从成熟拟南芥Col-0植株基部收获的茎段[6].陪同FAR6在这个高表达的基因列表中,有一个蜡合酶同源物(At5g22490),这种共现模式与完全成熟茎中的表皮细胞一致,它们积极合成角质层聚酯网络和相关的蜡基质。在CSS到OLD过渡列表中显式的细胞壁相关基因的适度表达意味着CSS和OLD阶段组织在次级细胞壁形成过程方面具有相当相似的转录谱,并且在茎组织中细胞壁强化的代谢承诺在主动延伸停止后没有显着变化。
分期特异性,全基因组共表达分析
虽然对比离散生长阶段的差异基因表达数据集为特定发育转变的生物学基础提供了初步的见解,但通过考虑所有样本发育阶段的转录本丰度,也可以揭示基因产物之间的潜在功能关系。其基本原理是,基因在一个阶段共表达,并在更广泛的发育范围内表现出类似的关联模式,可能代表了参与特定生物过程的基因子集。
本研究中使用的“混合效应模型”方法允许我们从双通道阵列生成发育阶段“估计值”,它可以表示为一个阶段转录丰度的平均折叠变化值(生物重复= 6),相对于整个实验中假设的平均值为零。需要注意的是,这些“估计”可以用与日志相同的统计能力进行计算2表中报告的差异表达率1,2,3.,4,5,6.这种处理提供了一种更直观的可视化基因表达轨迹的方法,并为正式的共表达分析提供了基础。与每个共表达集(聚类)相关的基因在全基因组数据集(附加文件)的可过滤列中识别2,3.而且4:表S1),其AGI代码也在附加文件中单独列出8:表S5,方便查阅。
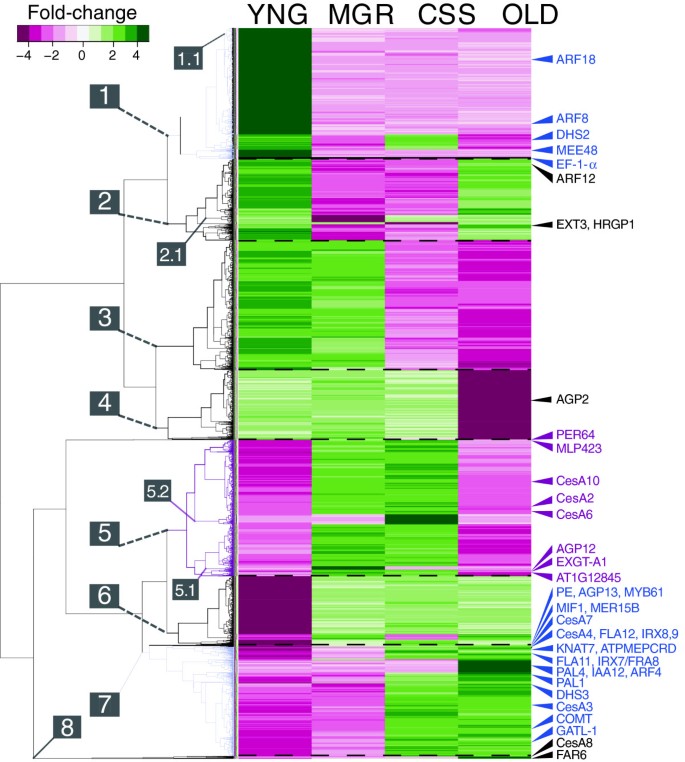
对均值与各阶段基因均值差异最大的4635个基因进行分层分裂聚类(q值<0.05)(图2),从而筛选出绝大多数(22 294)在茎伸长过程中表达变化不大的基因。4635个基因属于8个主要的共表达簇,表现出不同的发育轨迹。除了集群2(图22),仅在YNG和OLD阶段表现出表达升高,主要簇内的基因表现出与离散发育阶段相关的单一转录丰度峰值,伴随着该峰值之前和/或之后所有集合的低表达。因此,每个共表达集(簇)似乎都有一个唯一定义的发育窗口,其中相关基因起作用,并且簇在花序茎的伸长和成熟过程中依次参与。有趣的是,虽然大多数簇(1-7)包含至少400多个基因,但簇8(簇5-7的外组)只包含茎基部(OLD)上调的基因,只有16个基因。
4635个差异表达基因层次聚类(q值<0.05)。根据细胞壁扩张阶段之间的相对表达,如图所示1;植株顶部1厘米(YNG),最大生长速率(MGR),伸长停止(CSS)和主茎在莲座丛的基部(OLD)。插图;11级比色折叠变化量表。集群(1-8)和特定阶段的子集群(1.1,2.1,5.1,5.2)被编号以供后续检查。与细胞壁过程相关的代表性基因的位置已在右侧边缘标出(在“结果”和/或“讨论”中描述)。PE=果胶酯酶,At2g45220。
为了测试这些集群中基因的功能相关性,我们检查了几个子集群中的基因本体富集,这些子集群表现出特定于单个发育阶段的协调上调或下调的显著模式(图2;子簇1.1、2.1、5.1、5.2和簇8)。尽管这些子簇的平均“估计”的箱形图清楚地表明了这些共表达集相对于其他阶段同步上调或下调的程度(附加文件9:图S2),基因本体分析显示,在这些共表达基因子集中只有适度的GO术语富集(附加文件10:图S3,附加文件11:表S6),表明尽管各亚簇的基因表达模式相同,但各亚簇中的基因并没有表现出明显的功能相关性。
讨论
虽然基因表达谱以前已经应用于拟南芥的扩展花序茎,但这些研究都受到各种限制,阻碍了我们准确地将所得到的表达谱与所取样组织的发育状态相匹配的能力。为了解决这个问题,我们使用了生长运动学剖面(GKP)来建立每个被采样的植物,每个茎节所代表的生长延伸的精确状态。总的来说,这些部分跨越了茎的生长和成熟状态,它们也代表了细胞壁发育的连续体。因此,在gkp引导下,沿着连续体(例如,延伸生长停止的点)对与离散区域相关的切片进行池化,可以生成基因表达谱与特定发育状态一致的组织样本。
虽然生长的茎是一个由多个组织组成的复杂器官,但所有这些细胞类型的共同点是它们的细胞壁沿生长轴协调和最初快速的各向异性扩张。这种扩张最终会停止,因为一些组织的壁,最明显的是维管组织和支撑纤维,被不可扩展的次级壁层加强。因此,虽然在这些样本中探测的生物过程并不局限于细胞壁扩张/修饰,但后一种过程可以预期将主导伴随茎及其组成组织成熟的更广泛的转录变化。
“年轻”阶段的组织显示出复杂的转录谱
本研究中采样的YNG期捕获了拟南芥茎的顶部1厘米,因此包含了一个发育复杂的区域,其中包括茎尖分生组织和多达20个在收获前开花和/或角果的短节间。由于多个组织发育轨迹在YNG样本中启动,与MGR期相比,细胞壁形成/修饰过程不主导YNG期组织的基因表达谱就不足为奇了。有趣的是,上调MEE48endo -β(1→3)葡糖苷酶(图2)先前被鉴定为花药特异性基因,其功能涉及花粉外壁形成过程中的胼胝质降解[23].由于在取样时,所有的花组织都被故意从YNG组织中移除,MEE48必须在发育中发挥额外的作用。突出的MEE48在YNG转录组中的表达可能与胞质分裂期间胼胝质水解对新细胞板结构发育的重要性有关[60],这一过程在顶端分生组织中积极进行。
快速组织延伸与独特的转录特征相关
YNG/MGR比较和MGR/CSS比较基因列表都提供了以最大速率(MGR)进行延伸生长的细胞中上调的基因的观点。与赤霉素酸(GA)介导的伸长相关的基因在MGR阶段显著表达,这与已知的赤霉素酸作为定向细胞生长的效应因子的作用一致[61].氧化还原相关的富含半胱氨酸的信号肽,ga刺激拟南芥4(GASA4) [62],相对于CSS, MGR上调了3.4倍(表3.),而ga反应转录因子,迷你锌指1(MIF1) [33],在MGR期相对于YNG期上调12倍。功能丧失MIF1基因座导致对GA无反应和花序茎矮化[33].MERISTEM-5(MERI5B,XTH24;At4g30270)编码2族木葡聚糖内转糖基化酶/水解酶[63],一组促进半纤维素重构的蛋白质,使纤维素微原纤维在各向异性细胞壁扩张过程中分离和“蠕变”[1].MERI5B相对于YNG组织,MGR的表达也升高MIF1所研究的所有发育阶段(图2).除了显示共表达,MIF1而且MERI5B与阿拉伯半乳聚糖蛋白共簇,AGP13,以及MYB61转录因子在一组中表现出峰值表达的时间稍晚,在停止的开始(图2,集群7)。
相比之下XTH24,另一种表达XTH,内基葡聚糖转移酶a1(EXGT-A1),是正常细胞壁扩张所必需的[64]仅限于MGR阶段(图2群集5),在那里它与AGP家族的另一个成员聚集在一起,AGP12>在MGR期的表达较YNG期高6倍。另外5个AGPs (Agp14 21 22 24而且FLA13)在MGR期相对于YNG期显著上调(q值<0.05)(附加文件2,3.而且4:表S1),表明一组agp可能有助于在MGR阶段快速扩张细胞的独特结构动力学。
“停止”阶段基因表达由次级细胞壁过程主导
相对于MGR阶段,CSS阶段上调最多的20个基因候选名单的组成(表2)4)尤其引人注目,因为有13个似乎在功能上与次级细胞壁生物合成有关。同样值得注意的是,该列表中的人群完全不同于那些在CSS组织中相对于OLD组织中表达占主导地位的基因,这表明这些基因的表达随着细胞扩张放缓而升高,然后在随后的茎成熟中保持升高。
这些细胞壁相关基因的核心是三种纤维素合成酶,它们对次生细胞壁的形成至关重要[13,35].CESA8被认为与CESA4和CESA7属于同一种多蛋白生物合成复合体[65],它们对次生细胞壁合成也有类似的贡献[35],尽管它们在CESA复合体中的相对比例仍然未知。在我们的共表达分析中,CESA8集群不同于CESA4而且CESA7,主要是由于的表达日益升高CESA8在OLD组织样本中(图2的表达式,聚类8)CESA4而且CESA7(图2,集群6)从CSS到OLD阶段没有显著变化。由于这三种CESA蛋白的相对稳定性和周转率是未知的,这些基因表达的差异并不一定与质膜中它们同源蛋白的预测丰度冲突。也有可能纤维素合酶复合物中与次生细胞壁相关的CESAs的相对比例在整个次生细胞壁形成期间并不保持固定。
根据定义,只有原代细胞壁能够扩张。66],并且这种扩张的绝大部分将发生在本研究中采样的停止点之上。因此,我们预计与原代细胞壁形成相关的纤维素合成酶基因(特别是CESA1 3而且6)在YNG期和MGR期相对于CSS期和OLD期表达上调。相反,CESA1和6在戒烟前和戒烟后阶段的表达没有显著差异CESA3在CSS和OLD阶段实际上比在YNG和MGR阶段表达得更高(图2,其他文件2,3.而且4:表S1)。这不是一个孤立的例子的行为CESA3基因;高及韩(2004)[6]早些时候观察到升高CESA3在完全成熟的拟南芥Col-0茎(>高25 cm)基部相对于未成熟茎(高5和10 cm)基部表达,而CESA1和CESA6的表达随着茎成熟而下降。Ehltinget al。(2005) (4]也检测出较高水平的CESA3在兰氏10厘米茎中点表达erecta(左呃)植株比这些植株茎上3厘米处的植株高。另一项研究发现,而AtCESA4 7而且8在成熟的Col-0茎中上调,没有一个典型的“原代细胞壁”CESA基因(Cesa1, 3,6)出现在活跃伸长组织中显著上调的CESAs列表中[5],可能是由于CESA1、3和6在后期非伸长阶段持续表达所致。在本研究中,CESA6,一般认为这对原代细胞壁的纤维素沉积很重要[13,在MGR和CSS阶段组织中表达上调最多(图2, Cluster 5),与CESA2(以前与径向细胞壁强化有关[65])及与CESA10.
总的来说,这些数据表明,植物细胞中特定纤维素合成酶的部署并不遵循与积极伸长组织(即初生细胞壁合成)或后伸长组织(即次生细胞壁合成)的独家关联模式。相反,更多样化的共发生细胞壁形成/修饰过程可能会招募CESA和CESA- like家族成员的不同子集,用于特定的发育编程(例如束间纤维的侵入性生长)。
另一个强有力的迹象表明,CSS组织样本准确地捕捉了从初级到次级细胞壁形成的转变,是在“CSS中较高”的基因列表中存在一组与葡萄糖醛酸larabinoxylans(“木聚糖”)的积累具体相关的基因,包括木糖合成酶3,FRA8,IRX9,RWA1,XTH19而且GUX1[67)(图2,聚类7)。其他木聚糖相关基因(木糖合成酶6;XTR4;BXL1;BXL2;EXGT-A1;XTH18)在CSS组织(附加文件2,3.而且4:表S1),但未能进入CSS中比OLD中表达更高的“前20”基因短名单。
二级细胞壁发育的一个可能的阳性调节因子,MYB61转录因子基因,在CSS阶段也强烈上调(图2S7)。MYB61被认为促进细胞壁木质化[31],更具体地说,调节三个细胞壁相关基因编码KNAT7转录因子,木质素生物合成酶咖啡酰辅酶o甲基转移酶7,果胶甲基酯酶(At2g45220) [29].虽然我们的表达数据证实MYB61与次生细胞壁的形成有关,但这种参与可能受到其他因素的制约,因为MYB61活性也与植物中广泛的生物过程有关,包括种皮粘液的产生[32],气孔关闭[30.],以及光合产物分配的多效性控制[29].
阿拉伯半乳聚糖蛋白(AGP)是一类在细胞壁发育中可能发挥结构和/或信号作用的蛋白聚糖。事实上,许多AGP家族成员在次级细胞壁形成开始时表现出明显的表达调制(其他文件)2,3.而且4:表S1)。例如,的表达式AGP18,一种富含赖氨酸、gpi锚定亚家族的成员,包括AGP17和AGP19,在OLD阶段相对于MGR阶段下调,并且功能丧失agp18突变体具有缩短的花序茎[68],提示AGP18可能在促进细胞壁扩张中发挥作用。AGP12的表达也随着停止的开始而显著下降(附加文件)2,3.而且4:表S1),与类似的功能关联一致。
FASCICLIN-LIKE 8(FLA8),在OLD阶段相对于MGR阶段(附加文件2,3.而且4:表S1)。FLA8 / AGP8属于含有束素结构域的agp亚家族,通常具有糖基磷脂酰肌醇(GPI)锚定[69].杨树的同系物AtFLA8与分化木质部的表达相比,在张力木中表达显著上调,而在对立木中表达不明显,在杨树茎中表达上调。70].AGP21在OLD阶段相对于MGR阶段也出现显著上调(附加文件2,3.而且4:表S1)。有趣的是,AGP21,在顺序上与AGP12而且AGP14[71],在转录因子沉默后下调约4倍花青素的生产(PAP1 / MYB75),与木纤维和束间纤维的细胞壁厚度增加相一致[72].因此,大型AGP家族的成员似乎在功能上出现了分歧,这部分通过它们表达的时空调节的差异来揭示[63].
保护和强化是老茎组织的特征
10-15厘米的哥伦比亚植物茎基部(旧组织样本)含有高度对比的组织,包括位于束间区厚壁、高度木质化纤维附近的活的光合活性细胞,这些细胞可能处于程序性细胞死亡的晚期阶段。
然而,一般来说,与次级细胞壁合成相关的基因在茎下部的这一区域最为活跃(图2;簇2、6、7和8)。有趣的是,CESA8,出现在聚类8中,在这一阶段表现出最高的表达水平木葡聚糖内转糖基酶/水解酶18 (xth18).这一表达数据与其他将木葡聚糖沉积与继发细胞壁合成晚期联系起来的结果一致。例如,观察到在棉纤维壁延伸停止后,木葡聚糖仍会继续掺入棉纤维[73], PttXET16活性与杨树次生脉管系统有关[74].
在纤维次生细胞壁成熟的最后阶段,多糖基质通常被苯丙类聚合物、木质素浸渍(综述于[75])。一些基因的产物与莽草酸和苯丙酸途径以及木质化相关,在这个数据集中表现出相应的表达模式,尽管它们聚类的差异表明它们表达时间的微妙差异(图2).例如,PAL1的成员苯丙氨酸解氨酶(pal)基因家族,其活性是苯丙氨酸分配到苯丙类代谢所必需的,在CSS和OLD期均高表达,与3-脱氧- d -阿拉伯-七聚磷酸酯合成酶3 (dhs3)它调节了莽草酯途径中碳的摄入。最大表达量PAL4,另一方面,发生在OLD阶段,这表明不同的PAL家族成员可能发挥着不同的作用。
结论
我们之前确定的茎生长运动学剖面在植物间的巨大差异[15]清楚地表明,在早期的研究中,来自多种植物的茎被汇集起来以创建生物复制样本,不可避免地会影响它们在伸长发育环境中准确定位细胞变化的能力。相比之下,我们的gkp引导的基因表达数据集与当前细胞壁生物学知识的一致性,为这种方法捕获发育阶段特定信息的能力提供了强有力的证据。同时,在我们的数据集中,这些已知的参与者伴随着许多目前未知的生物功能的基因,这使得它们成为进一步研究植物细胞扩张和由植物生物量组成的富含纤维素的细胞壁沉积过程的高优先级候选人。
方法
植物生长,生长运动剖面和采样
按照Hall & Ellis(2012)的描述进行植物生长和成像[15],使用应用纸质标签作为生长运动剖面的合成光学标记。标记和成像的植物在下午1点到3点之间(在16hL:8hD的情况下,白天周期发生在早上6点到晚上10点之间)以20分钟的间隔收割。茎段(~ 1cm)立即在液氮中快速冷冻,并沉积到0.2 mL PCR管中,−80°C保存。随后,在生长运动学分析数据的基础上对片段进行了汇总(见附加文件)1:图S1)和实验设计目标,如图所示1.
RNA加工
用预冷的研钵和研杵在液氮中均质整个茎段(根据生长运动剖面等效性聚合)。然后将冷冻粉末转移到1.5 mL微量离心管中,称重并与TRIzol™试剂(cat#15596-026, Invitrogen)混合(每100 mg组织1 mL TRIzol),旋转并在室温下孵育5分钟。加入氯仿(每1ml TRIzol加入0.2 mL),旋涡15秒,室温孵卵1分钟,4℃15000 g离心10分钟。水相转移到新鲜的无rnase管中,然后与等体积的异丙醇结合,在冰上孵育20分钟。核糖核酸总计15000 g离心成球10分钟,用1 mL 75%乙醇在不含rnase的水中洗涤成球。颗粒干燥5分钟后,颗粒重悬于25 μL不含rnase的水中,冰孵育1小时。每次再悬液用1/10体积(~2 μL) 10X DNAse I缓冲液和1 μL 10X DNAse I (from RNAqueous®Micro kit;cat#AM1931, Ambion)在37℃下孵育20分钟,然后加入2 μL DNAse灭活试剂(也来自RNAqueous®Micro kit),在室温下孵育2分钟。样品在13000 g下离心1.5分钟,上清液转移到无rnase管中,并在−80°C保存。
逆转录和标记
每个生物复制大约需要20 μg RNA总计用2 ug寡聚(dT)引物(cat#18418-012, 0.5 ug/ul, Invitrogen)在22.5 μL体积的rna -引物混合物中孵育,70℃变性10分钟。制备反应混合物:每个样品含有9 μL 5X First Strand缓冲液(上标II, Invitrogen, cat#18064-014), 0.1 mM dATP (cat#10216-108, Invitrogen)、dCTP (cat#10217-016, Invitrogen)、dGTP (cat#10218-014,Invitrogen)各0.23 μL, dTTP (cat#10219-012, Invitrogen),总反应混合物体积为18.5 μL。该反应混合物与18.5 μL rna -引物混合物和1.5 μL (1.5 mol /μL)的合适的菁染料混合;Cy5-dUTP (cat#45-000-740,费雪)或Cy3-dUTP (cat#45-000-738,费雪)。42°C孵育2分钟后,加入1 uL 40U/uL RNAase Inhibitor (cat#10777-019, 40U/uL, Invitrogen)和1.2 uL 200 U/μL Superscript II (cat#18064-014,200 U/uL, Invitrogen),最终体积为45 μL,在42°C孵育2.5小时,然后用0.5 M NaH/50 mM EDTA在65°C灭活15分钟。反应用7.1 uL 1 M Tris-HCl (pH7.5)中和。在阵列杂交之前,使用Amicon 0.5-Ultra 30 kDa过滤器(cat#UFC503096, Millipore)离心过滤清洗样品中未标记的探针。
阵列杂交
对于转录本分析,我们使用了定制的双通道微阵列,标记了26 929个70-mer寡核苷酸,这些寡核苷酸最初是在“拟南芥信息资源”(TAIR)“5”发布的拟南芥基因组的基础上合成的(http://www.Arabidopsis.org),基因注释随后更新至目前的基因组版本(TAIR10) [76].微阵列载玻片首先在50°C 2X SSC的Coplin瓶中孵育20分钟,然后分别使用Advawash AV400机器(Advalytix/Beckman-Coulter)用0.2X SSC和ddH2O在室温下洗涤5分钟和3分钟。然后将3DNA Array 350试剂盒(cat#W300130, Genisphere) 7瓶中1X甲酰胺基杂交缓冲液(预加热至80°C)添加到每张载片和Slidebooster (Advalytix/Beckman-Coulter)杂交室中预先放置的m系列提升滑片(cat#48382-251, VWR)之间的间隙中,随后在50°C下超声孵育1 - 1.5小时(功率=15,脉冲=1秒'开启',9秒'关闭')。然后将载玻片在2X SSC (0.2% SDS)中在65℃下洗涤15分钟,然后在2X SSC和0.2X SSC中分别在室温中洗涤10分钟,并在Advatubes (cat# OAX05216, Advalytix/Beckman-Coulter)中以700 rpm的速度离心至干燥。等量标记的Cy3和Cy5混合物(各12.5 μL)与25 μL 2X甲酰胺缓冲液(Vial 7, 3DNA Array350试剂盒)结合,并将50 μL杂交混合物添加到42°C预热载玻片和预先放置的m系列提升载玻片之间的间隙中。然后将载玻片在42°C下超声孵育16-18小时(功率=15,脉冲=1秒“开启”,9秒“关闭”)。杂交后清洗在弱光照下进行,42°C 2X SSC (0.2% SDS)清洗15分钟,然后在室温下分别用2X SSC和0.2 2X SSC清洗15分钟,然后在700 rpm下离心至干燥。玻片存放在避光干燥室中,直至荧光扫描。
微阵列扫描和斑点定量
杂交阵列用ScanArray Express HT (perkins - elmer)扫描仪和相关软件进行扫描,Cy3用543 nm激光照射,Cy5用633 m激光荧光。在95-100%的范围内,对每一张幻灯片分别调整激光功率,使~1-2%的斑点探针(假设为阳性对照)产生饱和信号。PMT增益范围为60-95%,为每张幻灯片设置,使光点周围的子网格区域的荧光强度不超过400(16位灰度)。将阵列扫描的TIFF图像导入Imagene (Biodiscovery Software),粗略放置网格模板,然后应用“自动调整”功能,以每个点为基础最适合子网格,允许斑点大小在15-20 μm之间变化。在随后的分析中,从斑点区域计算的中位数像素强度被用来表示斑点强度。
微阵列数据分析
数据分析是在统计编程环境R (cran.r project.org/)中使用自定义脚本和贡献的包进行的。为了去除局部背景噪声,使用自定义脚本从每个阵列元素中减去48个子网格中每个子网格中最暗的5%的点的平均信号强度,然后将方差稳定归一化(VSN)应用于每个通道,以归一化方差在点强度上的非线性[77使用' vsn '函数(' vsn '包,Bioconductor)。然后将归一化强度拟合到混合效应模型[16]使用' lme '函数(' nlme '包),并且数组元素的所有成对微分表达式都被计算为log2治疗级别强度之间的强度差值。相关的显著性度量(相对于零假设的p值,log2差异等于零),使用基于标准q值计算的自定义脚本对错误发现率进行校正[78],并将“估计值”计算为日志2每个治疗类别的强度差与所有治疗类别的平均值(归一化为零)。相关的显著性度量(相对于log的零假设的p值2差异= 0)也校正了如上所述的错误发现率。原始数据和输出数据与补充数据中的TAIR10注释一起导出2,3.而且4:表S1)。对于分层聚类,使用“diana”函数(“聚类”包)从过滤后的数据集中计算不相似矩阵,并使用“dendro”函数(“聚类”包)渲染为树状图。热图是使用“热图”生成的。2'函数('gplots'包)。
支持数据的可用性
基因注释,原始表达数据,统计分析,平均差异,平均估计,和基因分类为全基因组提供附加文件2,3.而且4:表S1,并按照MIAME约定存放在ArrayExpress中[79],作为加入e - mex -3525。
参考文献
植物初生细胞壁的组装和扩大。中国生物医学工程学报,1997,26(4):457 - 457。10.1146 / annurev.cellbio.13.1.171。
薛晓明,李志强,李志强:植物细胞形态发生过程中细胞骨架和细胞壁系统的动态协调。动物学报,2009,19:R800-11。10.1016 / j.cub.2009.07.056。
Somerville CR, Bauer S, Brininstool G, Facette M, Hamann T, Milne J, Osborne E, Paredez A, Persson S, Raab T, Vorwerk S, Youngs H:了解植物细胞壁的系统方法。科学通报,2004,36(4):344 - 344。10.1126 / science.1102765。
Ehlting J, Mattheus N, Aeschliman DS, Li E, Hamberger B, Cullis IF, Zhuang J, Kaneda M, Mansfield SD, Samuels L, Ritland K, Ellis BE, Bohlmann J, Douglas CJ: primary stem的全球抄本分析拟南芥鉴定木质素生物合成中缺失环节的候选基因和纤维分化的转录调控因子。植物学报,2005,29(4):344 - 344。10.1111 / j.1365 - 313 x.2005.02403.x。
Imoto K, Yokoyama R, Nishitani K:细胞壁修饰相关基因的综合方法拟南芥.植物分子生物学,2005,58(2):177-192。10.1007 / s11103 - 005 - 5344 - 7。
Ko J, Han KH:拟南芥全转录组分析确定了二次生长过程中协调调控的特征。植物分子生物学,2004,55(3):433-453。10.1007 / s11103 - 004 - 1051 - z。
Minic Z, Jamet E, San-Clemente H, Pelletier S, Renou JP, Rihouey C, Okinyo DP, Proux C, Lerouge P, Jouanin L:拟南芥发育茎的转录组分析:细胞壁基因的特写。植物学报,2009,9(1):6-10.1186/1471-2229-9-6。
吴珊珊,朴珊珊,韩浩:植物次生生长的转录调控拟南芥.应用物理学报,2003,29(3):379 - 379。10.1093 / jxb / erg304。
李志刚,李志刚,李志刚,李志刚,李志刚拟南芥延长细胞:转录组学补充蛋白质组学。BMC基因组学杂志,2009,10(1):505-10.1186/1471-2164-10-505。
杨晓明,王晓明,王晓明,王晓明,王晓明,王晓明。百日草叶肉细胞管状元件形成过程中细胞壁相关基因的差异表达。植物化学学报,2001,47(1-2):221-238。
Demura T, Tashiro G, Horiguchi G, Kishimoto N, Kubo M, Matsuoka N, Minami A, Nagata-Hiwatashi M, Nakamura K, Okamura Y, Sassa N, Suzuki S, Yazaki J, Kikuchi S, Fukuda H:叶肉细胞向木质部细胞转分化过程中基因表达程序的综合微阵列分析。美国国家科学研究院。2002, 99(24): 15794-15799。10.1073 / pnas.232590499。
ohasi - ito K, Oda Y, Fukuda H:拟南芥脉管相关的NAC-DOMAIN6直接调控木质部分化过程中程序性细胞死亡和次生壁形成的基因。植物细胞学报,2010,22(10):3461-3473。10.1105 / tpc.110.075036。
王晓明,王晓明,王晓明,王晓明。基于微阵列数据集的纤维素合成基因筛选。美国国家科学研究院。2005, 32(3): 344 - 344。10.1073 / pnas.0503392102。
Brown DM, Zeef LAH, Ellis J, Goodacre R, Turner SR:利用表达谱和逆向遗传学鉴定拟南芥次级细胞壁形成的新基因。植物学报,2005,17(8):2281-2295。10.1105 / tpc.105.031542。
Hall HC, Ellis BE:基于拟南芥花序茎生长运动学剖面的发育等效组织采样。环境科学学报,2012,29(1):379 - 379。10.1111 / j.1469-8137.2012.04060.x。
Tempelman RJ:评估基于混合效应模型的两种彩色微阵列平台的备选实验设计的统计精度、功率和稳健性。中华免疫杂志,2005,30(4):344 - 344。
范德波,K, Quimbaya M, Casneuf T, De Veylder L, Van De Peer Y:拟南芥转录控制的研究进展独联体-调控元件和共表达网络。植物营养学报,2009,30(2):339 - 344。10.1104 / pp.109.136028。
Axelos M, Bardet C, Liboz T, Le Van Thai A, Curie C, Lescure B:基因家族编码拟南芥翻译伸长因子EF-1 α的克隆、表征及表达。中国生物医学工程学报,1998,26(3):344 - 344。
Tarutani Y, Morimoto T, Sasaki A, Yasuda M, Nakashita H, Yoshida S, Yamaguchi I, Suzuki Y:两种高度同源受体样激酶基因RLK902和RKL1的分子特征拟南芥.生物工程学报,2004,29(3):344 - 344。10.1271 / bbb.68.1935。
公鸡JM,麦考密克S:一个与CLAVATA3同源的大型基因家族。植物学报,2001,26(3):349 - 349。10.1104 / pp.126.3.939。
Bell E, Creelman RA, Mullet JE:拟南芥创伤诱导茉莉酸积累需要叶绿体脂氧合酶。自然科学进展,2004,19(3):379 - 379。10.1073 / pnas.92.19.8675。
Jun J, Fiume E, Roeder AHK,孟L, Sharma VK, Osmont KS, Baker C, Ha CM, Meyerowitz EM, Feldman LJ, Fletcher JC:拟南芥CLE多肽信号基因表达及过表达活性的综合分析。中国生物医学工程学报,2010,34(4):344 - 344。10.1104 / pp.110.163683。
Dobritsa AA, Geanconteri A, Shrestha J, Carlson A, Kooyers N, Coerper D, Urbanczyk-Wochniak E, Bench BJ, Sumner LW, Swanson R, Preuss D:拟南芥花粉外壁产生相关基因的大规模基因筛选。中国生物医学工程学报,2011,27(2):344 - 344。10.1104 / pp.111.179523。
小泉K,横山R, Nishitani K:机械负荷诱导一组基因转录物的上调,涉及在支持组织的次级壁形成拟南芥.植物学报,2009,29(3):349 - 349。10.1007 / s10265 - 009 - 0251 - 7。
Apel K, Hirt H:活性氧:代谢,氧化应激和信号转导。植物学报,2004,29(3):344 - 344。10.1146 / annurev.arplant.55.031903.141701。
王志刚,王志刚,王志刚:木质素生物合成。植物学报,2003,34(4):519-546。10.1146 / annurev.arplant.54.031902.134938。
王志刚,王志刚,王志刚,王志刚。木质素的生物合成及其结构研究。中国生物医学工程学报,2010,29(3):344 - 344。10.1104 / pp.110.155119。
王晓明,王晓明,王晓明,等。拟南芥维管束过度生长基因的鉴定。植物生理学报,2008,49(3):457-468。10.1093 /卡式肺囊虫肺炎/ pcn023。
Romano JM, Dubos C, Prouse MB, Wilkins O, Hong H, Poole M, Kang K, Li E, Douglas CJ, Western TL, Mansfield SD, Campbell MM: AtMYB61,一种r2a3 - myb转录因子,通过一个小基因网络作为一个多效调控因子。植物保护学报,2012,29(4):344 - 344。10.1111 / j.1469-8137.2012.04201.x。
梁杨,杜博斯C,杜德IC, Holroyd GH, Hetherington AM, Campbell MM: R2R3-MYB转录因子AtMYB61调控植物气孔孔径拟南芥.动物学报,2005,15(13):1201-1206。10.1016 / j.cub.2005.06.041。
Newman LJ, Perazza DE, Juda L, Campbell MM: R2R3-MYB, AtMYB61在紫杉醇异位木质化和暗光形态发生成分中的作用det3突变表型。植物学报,2004,37(2):239-250。10.1046 / j.1365 - 313 x.2003.01953.x。
Penfield S, Meissner RC, Shoue DA, Carpita NC, Bevan MW:拟南芥种皮中黏液沉积和挤压需要MYB61。植物细胞学报,2001,13(12):2777-2791。
胡玮,马红:一个新的锌指基因MIF1的鉴定:参与拟南芥发育的多种激素调控。植物学报,2006,45(3):339 - 344。10.1111 / j.1365 - 313 x.2005.02626.x。
林萍,彭梅兰,张娟,杨志刚,张娟:拟南芥串联锌指蛋白AtTZF1对ABA和ga介导的生长、胁迫和基因表达的影响。植物学报,2011,26(2):344 - 344。10.1111 / j.1365 - 313 x.2010.04419.x。
王志强,王志强,王志强:木质部发育过程中纤维素合酶复合物定位的控制。植物细胞学报,2003,15(8):1740-1748。10.1105 / tpc.012815。
Hamann T, Osborne E, Young HL, Misson J, Nussaum L, Somerville CR:拟南芥CESA和CSL基因的整体表达分析。纤维素。2004,11:279-286。
Holland N, Holland D, Helentjaris T, Dhugga KS, Xoconostle-Cazares B, Delmer DP:植物纤维素合成酶(CesA)基因家族的比较分析。中国生物医学工程学报,2000,29(4):332 - 332。10.1104 / pp.123.4.1313。
胡思敏,马志刚,李晓霞,李晓霞,李晓霞,李晓霞,李志刚,李晓霞:几丁质酶样蛋白AtCTL2基因突变对拟南芥木质素积累的影响。中国植物学报,2010,37(4):357 - 357。10.1016 / j.jplph.2009.12.001。
Sánchez-Rodríguez C, Bauer S, Hématy K, Saxe F, Ibanez AB, Vodermaier V, Konlechner C, Sampathkumar A, Rüggeberg M, Aichinger E, Neumetzler L, Burgert I, Somerville C, Hauser M, Persson S:几丁质酶- like1 /POM-POM1及其同源物CTL2是葡聚糖相互作用蛋白,对拟南芥纤维素生物合成很重要。植物细胞学报,2012,24(2):589-607。10.1105 / tpc.111.094672。
彭丽丽,张志刚,张志刚,等。磷酸-磷酸-木糖的生物合成研究Uxs2.植物学报,2005,221(4):538-548。10.1007 / s00425 - 004 - 1471 - 7。
Wu A, Hörnblad E, Voxeur A, Gerber L, Rihouey C, Lerouge P, Marchant A:拟南芥IRX9/IRX9-L和IRX14/IRX14-L糖基转移酶基因分析揭示了半纤维素葡萄糖醛酸聚糖生物合成的关键贡献。中国生物医学工程学报,2010,32(2):344 - 344。10.1104 / pp.110.154971。
李春,滕强,黄伟,钟荣,叶震:拟南芥F8H糖基转移酶是fr8的一个功能副产物,参与葡萄糖醛基氧基聚糖的生物合成。植物生理学报,2009,30(4):344 - 344。10.1093 /卡式肺囊虫肺炎/ pcp025。
Maris A, Kaewthai N, Eklöf JM, Miller JG, Brumer H, Fry SC, Verbelen J, Vissenberg K: 5种重组木葡聚糖内转葡萄糖酶/水解酶(XTH)蛋白酶学性质的差异拟南芥.实验学报,2011,62(1):261-271。10.1093 / jxb / erq263。
李春,滕强,钟荣,叶铮:拟南芥的4个REDUCED WALL ACETYLATION基因在含次生壁细胞中表达,木聚糖乙酰化需要它们。中国生物医学工程学报,2011,29(4):457 - 457。10.1093 /卡式肺囊虫肺炎/ pcr075。
Derbyshire P, McCann MC, Roberts K:拟南芥下胚轴限制细胞伸长与平均果胶酯化水平降低有关。中国生物医学工程学报,2007,7:31-10.1186/1471-2229-7-31。
Hongo S, Sato K, Yokoyama R, Nishitani K: PECTIN melesterase35对原壁的脱甲基酯作用为拟南芥茎提供了机械支持。植物细胞学报,2012,24(6):2624-34。10.1105 / tpc.112.099325。
金JB, Carpita NC:玉米胚囊层伸长过程中细胞壁多糖醛酸酯化的变化。中国农业科学,2002,23(4):457 - 457。10.1104 / pp.98.2.646。
李文杰,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚。果胶甲酯酶对杨木细胞生长的抑制作用。植物科学学报,2008,29(3):344 - 344。
Berthet S, Demont-Caulet N, Pollet B, Bidzinski P, Cézard L, Le Bris P, Borrega N, Hervé J, Blondet E, Balzergue S, Lapierre C, Jouanin L: LACCASE4和17的破坏导致组织特异性的木质素化改变拟南芥茎。植物细胞学报,2011,23(3):1124-1137。10.1105 / tpc.110.082792。
高军,韩凯,张建平:植物次生木质部发育基因的比较转录组分析拟南芥.中国生物医学工程学报,2006,26(6):517-531。10.1007 / s00438 - 006 - 0157 - 1。
高娟,韩凯,杨娟:拟南芥体重诱导的二次生长及其转录表型。植物科学进展,2004,26(2):379 - 379。10.1104 / pp.104.038844。
Manosalva PM, Bruce M, Leach JE:水稻14-3-3蛋白(GF14e)对细胞死亡和抗病性有负面影响。植物学报,2011,29(5):357 - 357。10.1111 / j.1365 - 313 x.2011.04728.x。
孙L, van Nocker S:基因启动子活性分析果胶裂解酶(pll)拟南芥细胞分离中的基因家族。中国生物医学工程学报,2010,10(1):152-10.1186/1471-2229-10-152。
Sampedro J, Pardo B, Gianzo C, Guitián E, Revilla G, Zarra I:拟南芥缺乏α-木葡聚糖活性改变木葡聚糖组成并导致生长缺陷。植物学报,2010,34(3):344 - 344。10.1104 / pp.110.163212。
Günl M,保利M:AXY3编码一种α-木葡聚糖酶,该酶影响拟南芥植物细胞壁中半纤维素木葡聚糖的结构和可及性。植物学报,2011,33(4):379 - 379。10.1007 / s00425 - 010 - 1330 - 7。
Thomma B, Cammue B, Thevissen K:植物防御素。植物学报,2002,26(3):344 - 344。10.1007 / s00425 - 002 - 0902 - 6。
Rapaport H:界面上有序的肽集合。超氨酚化学,2006,18(5):445-454。10.1080 / 10610270600665905。
Cannon MC, Terneus K, Hall Q, Tan L, Wang Y, Wegenhart BL, Chen L, Lamport DTA, Chen Y, Kieliszewski MJ:植物细胞壁的自组装需要扩展支架。自然科学进展,2008,29(6):528 - 528。10.1073 / pnas.0711980105。
Suh MC, Samuels AL, Jetter R, Kunst L, Pollard M, Ohlrogge J, Beisson F:拟南芥茎表皮表皮脂质组成、表面结构及基因表达。植物科学进展,2005,29(4):344 - 344。10.1104 / pp.105.070805。
陈霞,金娟:高等植物胼胝质的合成。植物信号行为学报,2009,4(6):489-492。10.4161 / psb.4.6.8359。
Schwechheimer C:了解赤霉素的信号——我们已经做到了吗?植物学报,2008,11(1):9-15。10.1016 / j.pbi.2007.10.011。
Rubinovich L, Weiss D:拟南芥富半胱氨酸蛋白GASA4促进GA反应,并在细菌和植物中表现出氧化还原活性在足底.植物学报,2010,32(6):344 - 344。10.1111 / j.1365 - 313 x.2010.04390.x。
Rose JKC, Braam J, Fry SC, Nishitani K:参与木葡聚糖内转糖基化和内水解的XTH酶家族:当前观点和新的统一命名法。植物生理学报,2002,43(12):1421-1435。10.1093 /卡式肺囊虫肺炎/ pcf171。
Akamatsu T, Hanzawa Y, Ohtake Y, Takahashi T, Nishitani K, Komeda Y:拟南芥内基葡聚糖转移酶基因在突变体中的表达。植物营养学报,2004,27(3):344 - 344。10.1104 / pp.121.3.715。
李文杰,李文杰,李文杰。拟南芥纤维素合成酶的研究进展。分子植物学报,2011,4(2):199-211。10.1093 / mp / ssq079。
McNeil M, Darvill AG, Fry SC, Albersheim P:植物初生细胞壁的结构和功能。生物化学学报,2004,29(1):344 - 344。10.1146 / annurev.bi.53.070184.003205。
A,车床R, Persson S:木聚糖合成的最新进展。植物学报,2012,5(4):769-771。10.1093 / mp / sss049。
杨娟,Sardar HS, McGovern KR,张勇,Showalter AM:拟南芥中富含赖氨酸的阿拉伯半乳聚糖蛋白对植物生长发育,包括细胞分裂和扩张至关重要。植物学报,2007,49(4):629-640。10.1111 / j.1365 - 313 x.2006.02985.x。
MacMillan CP, Mansfield SD, Stachurski ZH, Evans R, Southerton SG:拟南芥和桉树茎干生物力学和细胞壁结构的研究。植物学报,2010,29(3):344 - 344。10.1111 / j.1365 - 313 x.2010.04181.x。
Lafarguette F, Leplé J, Déjardin A, Laurans F, Costa G, Lesage-Descauses M, Pilate G:杨树束素样阿拉伯半乳聚糖蛋白基因在张力木材中高表达。环境科学学报,2004,26(1):1 - 7。10.1111 / j.1469-8137.2004.01175.x。
Ito S, Suzuki Y, Miyamoto K, Ueda J, Yamaguchi I: AtFLA11,一种束素样阿拉伯半乳糖蛋白,特异性定位于厚壁组织细胞。中国生物工程学报,2005,29(3):344 - 344。10.1271 / bbb.69.1963。
Bhargava A, Mansfield SD, Hall HC, Douglas CJ, Ellis B: MYB75在拟南芥花序茎次生细胞壁形成调控中的作用植物学报,2010,34(3):344 - 344。10.1104 / pp.110.162735。
Tokumoto H, Wakabayashi K, Kamisaka S, Hoson T:棉纤维发育过程中基质多糖糖组成和分子质量分布的变化。植物生理学报,2002,43(4):411-418。10.1093 /卡式肺囊虫肺炎/ pcf048。
Bourquin V, Nishikubo N, Abe H, Brumer H, Denman S, Eklund M, Christiernin M, Teeri TT, Sundberg B, Mellerowicz EJ:木葡聚糖内转糖基酶在维管组织次生细胞壁形成过程中的作用。植物学报,2002,14(12):3073-3088。10.1105 / tpc.007773。
汉弗莱斯JM,查普C:重写木质素路线图。植物学报,2002,5(3):224-229。10.1016 / s1369 - 5266(02) 00257 - 1。
Douglas CJ, Ehlting J:拟南芥全基因组长微阵列:农业和林业的强大基因发现工具。转基因植物学报,2005,14:551-561。10.1007 / s11248 - 005 - 8926 - x。
胡贝尔W,冯Heydebreck A, Sultmann H, Poustka A, Vingron M:方差稳定在微阵列数据校准和微分表达式量化中的应用。生物信息学,2002,18(增刊1):S96-S104。10.1093 /生物信息学/ 18. suppl_1.s96。
Storey J:关于错误发现率的直接方法。皇家统计学会杂志:B辑(统计方法学)。2002, 34(4): 479-10.1111 - 1467。
Brazma A, Hingamp P, Quackenbush J, Sherlock G, Spellman P, Stoeckert C, Aach J, Ansorge W, Ball CA, Causton HC, Gaasterland T, Glenisson P, Holstege FC, Kim IF, Markowitz V, Matese JC, Parkinson H, Robinson A, Sarkans U, Schulze-Kremer S, Stewart J, Taylor R, Vilo J, Vingron M:关于微阵列实验(MIAME)的最小信息-面向微阵列数据标准。王文杰,2001,29:365-371。10.1038 / ng1201 - 365。
确认
我们要感谢与Jürgen Ehlting博士(维多利亚大学)关于微阵列设计和应用以及花序茎取样挑战的宝贵讨论。我们非常感谢Anne Haegert和Stéphane Le Bihan博士在杰克贝尔前列腺中心,温哥华,为微阵列打印和质量控制。如果没有迈克尔·史密斯实验室、英属哥伦比亚大学的资源,以及加拿大基因组和加拿大自然科学与工程研究委员会的财政支持,这个项目是不可能实现的。最后,我们感谢Rick White (SCARL, University of British Columbia)的统计咨询。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明没有利益竞争。
作者的贡献
Hardy Hall进行了微阵列实验和数据分析。哈代·霍尔和布莱恩·埃利斯都参与了实验的构想和设计,以及起草手稿。两位作者都已阅读并批准了最终稿。
电子辅助材料
12870 _2012_1264_moesm1_esm.pdf
附加文件1:图S1:相对伸长率的表面图和lowess预测的生长运动学剖面(n=34)。绘制如Hall & Ellis(2012)所述,除了表面图的分段是从下往上编号。植物按独立生长和观察的批次按柱排列。(pdf 2mb)
12870 _2012_1264_moesm2_esm.xlsx
附加文件2:表S1第1部分:所有基因特定数组元素的原始、处理数据、TAIR10注释和聚类信息。列标题说明请参阅文件的第一个选项卡。(xlsx14mb)
12870 _2012_1264_moesm3_esm.xlsx
附加文件3:表S1第2部分:所有基因特定数组元素的原始、处理数据、TAIR10注释和聚类信息。列标题说明请参阅文件的第一个选项卡。(xlsx7mb)
12870 _2012_1264_moesm4_esm.xlsx
附加文件4:表S1第3部分:所有基因特定数组元素的原始、处理数据、TAIR10注释和聚类信息。列标题说明请参阅文件的第一个选项卡。(xlsx13mb)
12870 _2012_1264_moesm5_esm.xlsx
附加文件5:表S2: ATCOECIS报告了在YNG期和MGR期之间差异最大的基因本体(GO)术语的富集(q-value<4.7E-02)。基因列表中出现一次以上的GO项按富集p值显著性排序(<0.05)。只有在输入集中包含两个或两个以上基因并且与背景频率(在全基因组中)相比显示富集的GO项被报告(括号中表示的基因数量)。Score表示输入基因中标注GO项的比例。“术语出现次数”列表示AtCoeCis结果中所有表达式类别中每个GO术语同时出现的次数(最左边一列)。(xlsx47 kb)
12870 _2012_1264_moesm6_esm.xlsx
附加文件6:表S3: ATCOECIS报告了基因本体(GO)术语在MGR和CSS阶段之间最显著的差异(q-value<6.72E-02)。基因列表中出现一次以上的GO项按富集p值显著性排序(<0.05)。只有在输入集中包含两个或两个以上基因并且与背景频率(在全基因组中)相比显示富集的GO项被报告(括号中表示的基因数量)。[转到方法;p值的计算采用超几何分布[17].Score表示输入基因中标注GO项的比例。“术语出现次数”列表示AtCoeCis结果中每个GO术语在所有表达式类别中同时出现的次数(最左边一列)。(xlsx45kb)
12870 _2012_1264_moesm7_esm.xlsx
附加文件7:表S4: ATCOECIS报告了CSS和OLD阶段之间最显著差异的基因本体(GO)术语的富集(q-value<4.9E-02)。基因列表中出现一次以上的GO项按照富集p值显著性(<0.3)排序。只有在输入集中包含两个或两个以上基因并且与背景频率(在全基因组中)相比显示富集的GO项被报告(括号中表示的基因数量)。Score表示输入基因中标注GO项的比例。“术语出现次数”列表示AtCoeCis结果中每个GO术语在所有表达式类别中同时出现的次数(最左边一列)。(xlsx48kb)
12870 _2012_1264_moesm8_esm.xlsx
附加文件8:表S5:图中指定的簇中每个基因的拟南芥基因指数(AGI)代码列表2.(xlsx13kb)
12870 _2012_1264_moesm10_esm.pdf
附加文件10:图S3:图中描述的聚类的基因本体(GO) SLIM术语富集分析2.A)三个GO SLIM类别中每个类别的箱状图描述了所有聚类中术语富集的分布,表示为相对于全基因组中丰度的折叠变化;“细胞成分”、“分子功能”和“生物过程”。方框限定上下四分位数,黑色水平条表示中值,胡须表示95%置信区间,圆圈表示上下2.5个百分位数的异常值。B)在三个GO SLIM类别中每个聚类中显示术语丰富的barplot;条形图的颜色分配如图“A”所示。在“生物过程”barplot图的底部标明了每个聚类中所包含的基因(获取)的数量。(pdf 49kb)
12870 _2012_1264_moesm11_esm.xlsx
附加文件11:表S6: ATCOECIS报告显示特定阶段表达的[子]基因簇的基因本体(GO)术语的丰富。根据p值(<0.05)排序,在基因列表中出现一次以上的最显著过代表GO术语前10名。只有在输入集中包含两个或两个以上基因并且与背景频率(在全基因组中)相比显示富集的GO项被报告(括号中表示的基因数量)。Score表示输入基因中标注GO项的比例。“术语出现次数”列表示AtCoeCis结果中所有表达式类别中每个GO术语同时出现的次数(最左边一列)。(xlsx45kb)
权利和权限
本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用属性许可协议(http://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
霍尔,H.,埃利斯,B.扩展拟南芥茎细胞壁成熟过程中的转录编程。BMC植物生物学13,14(2013)。https://doi.org/10.1186/1471-2229-13-14
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-13-14
关键字
- 细胞壁
- 各向异性
- 生长运动学剖面
- 转录组
- 微阵列
- 拟南芥
- 花序梗