摘要
背景
MicroRNAs (miRNAs)是一类通过mRNA降解或翻译抑制来下调靶基因的调控小rna (regulatory small RNAs, sRNAs)。许多植物miRNAs已经被鉴定出来。越来越多的证据表明它们在植物发育过程中起着至关重要的作用。在全球重要的小麦作物中(小麦L.),谷物形成的过程决定了产量和最终使用质量。然而,mirna介导的粮食生产发育调控机制知之甚少。在这里,我们应用高通量sRNA测序和全基因组挖掘来识别可能参与小麦籽粒发育调控的mirna。
结果
从授粉(DAP)后5、15、25和30天采样的发育中的谷物中生成4个sRNA文库并进行测序。通过综合分析,我们鉴定出605个miRNAs(代表540个家族),其中86个可能参与了籽粒灌浆的控制。此外,还鉴定出268个新的miRNAs(182个家族),其中18个也可能与成熟过程有关。我们的目标预测表明,104个籽粒灌浆相关miRNAs可能针对一组参与各种生物过程的小麦基因,包括碳水化合物和蛋白质的代谢、转录、细胞转运、细胞组织和生物发生、应激反应、信号转导和植物激素信号。总之,这些结果表明,小麦籽粒填充的发育步骤与mirna介导的基因调控网络相关。
结论
我们从小麦中鉴定出605个保守mirna和268个新mirna。其中,104种可能与调节灌浆有关。我们的数据集为研究mirna介导的谷物调控机制提供了有用的资源,我们的结果表明,在决定谷物产量和面粉质量的关键阶段,mirna有助于这种调控。
背景
植物内源性小rna (sRNAs),如microRNAs (miRNAs)和短干扰rna (siRNAs),于2002年首次被报道[1,2].从那时起,我们对这些调控分子的认识有了很大的提高[3.].植物miRNAs是一类由非编码、不完全互补(茎环)RNA前体产生的短(~21-nt) sRNAs [4],可被RNA聚合酶II转录[5].目前已知的大多数植物miRNAs是通过大小选择克隆和测序确定的[5- - - - - -7].最近开发的高通量测序策略极大地扩展了miRNA克隆覆盖的深度[8,9].除了模式物种,更多的sRNAs已从水稻等作物植物中鉴定出来[10- - - - - -12],玉米[13,14]和小麦[15,16].对植物miRNAs的研究表明,这组调控分子在许多生物过程中起着至关重要的作用,例如,一般植物发育[17,18]以及对环境信号的反应[10,19- - - - - -21].此外,植物miRNAs及其在植物发育中的作用已被广泛回顾[3.,22].
种子产生是高等植物生命周期中独特的过渡过程,是亲代和子代孢子体世代之间的物理联系[23].在种子成熟过程中,mirna在基因调控中的作用可能和在其他组织中一样重要[24- - - - - -26].数以百万计的短序列读取已经产生的下一代测序技术,使该技术明确适用于分析mirna。由于高通量测序,研究人员已经能够在水稻种子中识别出保守的和新的mirna [7,11],玉米[27],大麦[28),而芸苔属植物显著[29].它们在这些物种中的存在表明,mirna介导的负调控在种子发育过程中起着至关重要的作用。
六倍体小麦是最有价值的谷类作物之一,占全球所有耕地的17%,提供全球人类消耗的约55%的碳水化合物[30.].除了作为食物来源外,这些谷物还被用作牲畜饲料和工业原料,主要利用胚乳储备的淀粉和蛋白质,这些淀粉和蛋白质约占成熟种子的80% [31].因此,小麦的生长过程直接决定了最终产品的产量和质量。为了改善这些性状,研究人员必须对调节植物生长过程中这些步骤的机制有一个敏锐的分子理解。由于对mirna介导的小麦籽粒发育调控知之甚少,我们的研究采用高通量测序来表征潜在参与的mirna。
结果
干物质积累与成熟籽粒外观
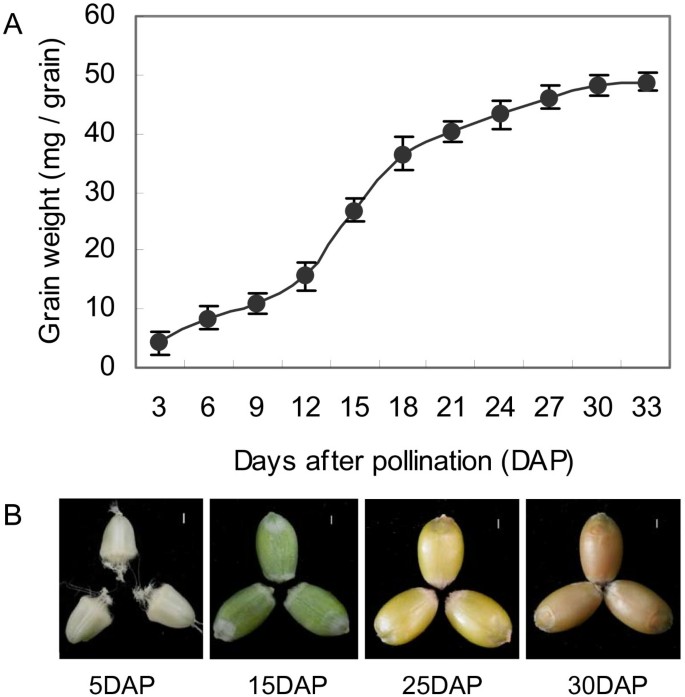
为了评价小麦籽粒的发育过程,我们监测了干物质在这些组织中积累的模式。在这里,种子重量在授粉后12 - 18天(DAP)急剧增加,并持续上升至30天(图)1A).基于我们观察到的模式,我们继续主要关注15 - 25 DAP之间的活动,这是籽粒灌浆的关键时期,以及在5 DAP和30 DAP取样的籽粒,以便我们可以比较该形成阶段开始和结束附近miRNAs的表达谱。图中显示了这些时间点上正在发育的颖果的大小和外观1B。
发育中的谷物中srna的深度测序
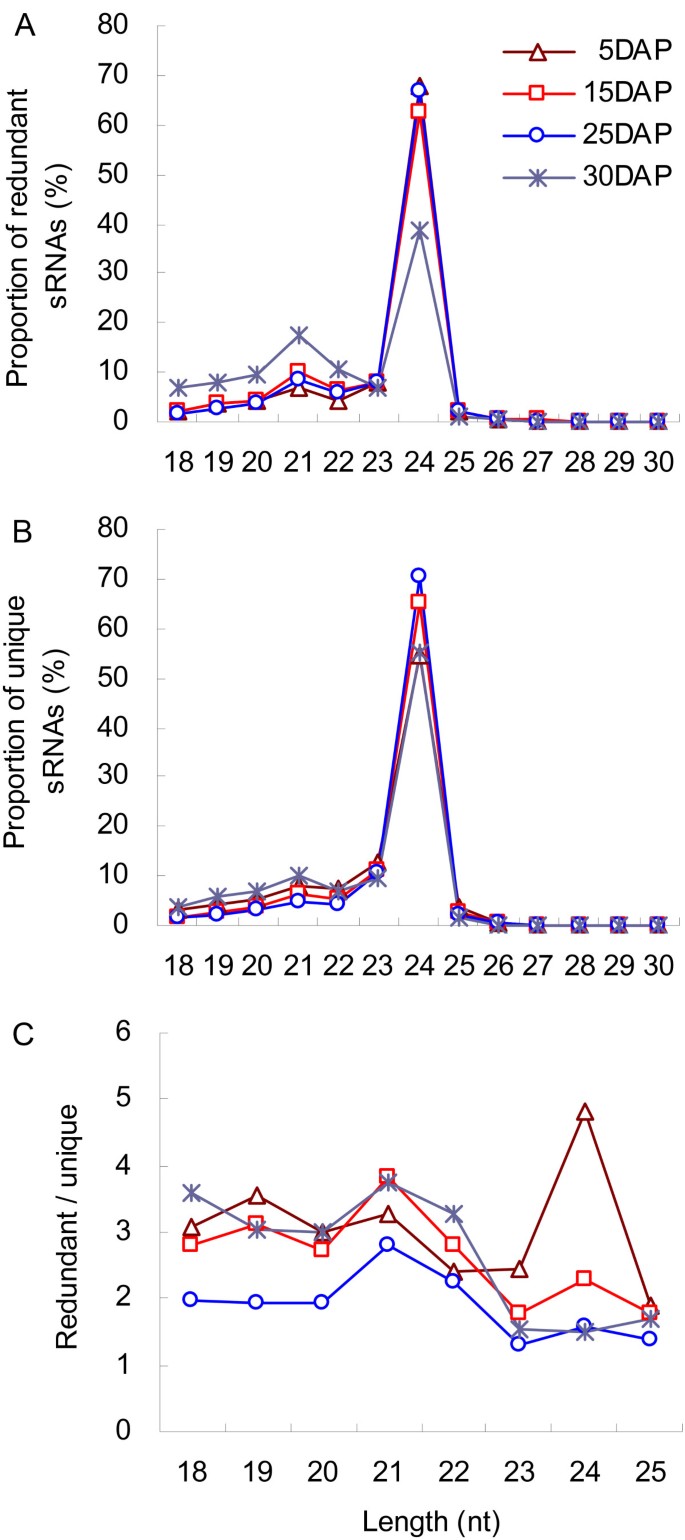
为了研究mirna的富集,我们从四个日期的发育中的小麦样本中生成了四个文库。通过Illumina基因组分析仪测序后,我们删除了低质量的reads和损坏的适配器序列(reads <18 nt或>30 nt长)。总的来说,我们获得了13,525,513个读取(3,492,987个惟一),代表5个DAP, 14,460,398个读取(6,015,357个惟一),15,310,251个读取(9,243,757个惟一),以及13,282,907个读取(6,200,456个惟一),代表15个DAP。我们对大小分布的评估表明,大约98%的检测到的sRNAs长度为18 - 25 nt, 24 nt的sRNAs在所有阶段都很普遍,而长度为21 nt的sRNAs则较少2A).进一步的分析表明,在5、15和25个DAP颗粒的文库中,不同尺寸类的冗余sRNAs分布非常相似。我们发现有趣的是,在30个DAP颗粒中,24 nt冗余sRNAs的丰度显著降低,而18 nt至22 nt的比例明显增加(图2A).唯一srna在所有四个库中的分布模式相似(图2B).冗余和唯一sRNAs的分布模式表明,在种子发育过程中,sRNAs的丰度存在波动。因此,我们基于冗余/唯一的比值评估了它们在18 - 25 nt之间的相对丰度,发现表达通常会随着时间的推移而改变(图2C). 25个DAP样本中大多数sRNA大小的转录水平明显下降。这对于逐渐被抑制的24-nt sRNAs尤其如此。典型的异色siRNAs长度为24 nt,这些结果表明sirna介导的基因调控可能参与了颗粒形成的控制。
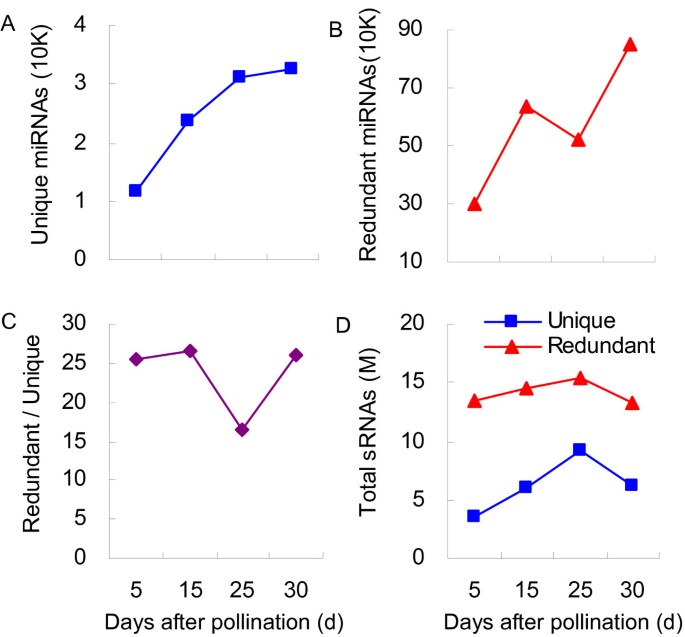
为了进行注释,我们使用sRNA数据集查询存放在NCBI GenBank (http://www.ncbi.nlm.nih.gov), Rfam数据库[32],以及miRBase (http://www.mirbase.org/).然后将它们分为七类:miRNA, rRNA, siRNA, snRNA, snoRNA, tRNA,以及那些检测到但没有注释的(附加文件)1).随着灌浆过程的继续,唯一mirna的数量逐渐增加(图3.A),暗示mirna介导的基因沉默参与发育调控。此外,在25dap时,miRNAs的总reads相对较低(图3.B),导致该时间点的mirna比例(冗余/唯一)较低(图3.C).小rna在25 DAP文库中比其他文库中更丰富(图3.D),表明miRNA表达在成熟后期普遍下调。
保守miRNAs在发育中的籽粒中有差异表达
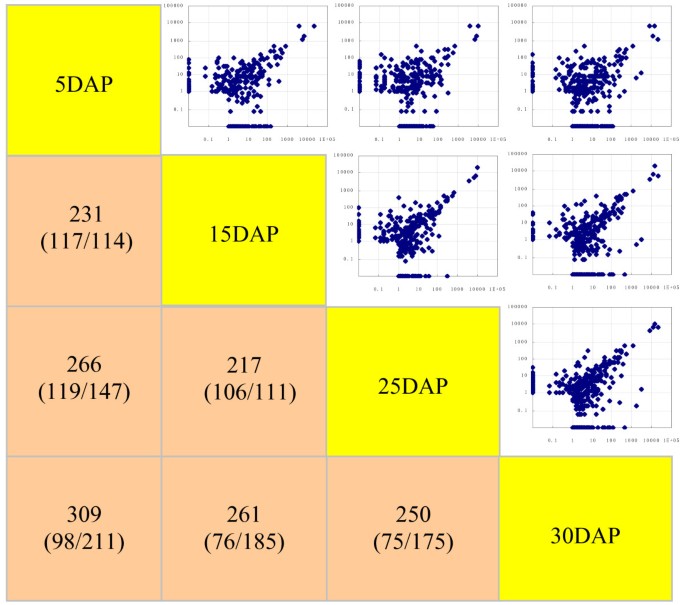
为了识别发育中的籽粒中保守的mirna,我们将这些sRNA序列与miRBase中已知的来自植物的成熟mirna进行比对。总共鉴定出605个miRNAs,代表540个家族2).总的来说,我们发现424个保守mirna(382个家族)存在差异表达(p-values <0.05)随时间变化(附加文件3.).他们的散点图显示了颗粒形成阶段的相似性,以及从5dap到30dap的miRNA表达谱之间的广泛关系(图4).然而,从这次检查中可以明显看出一些差异。与5 DAP的值相比,231、266和309个miRNAs显著上调或下调(p分别在15 DAP、25 DAP和30 DAP时<0.05)。随着时间的推移,上调的mirna数量可能逐渐增加(分别在15dap、25dap和30dap时为114、147和211),这表明mirna介导的抑制机制参与了这种发育调控。
与灌浆有关的保守miRNAs
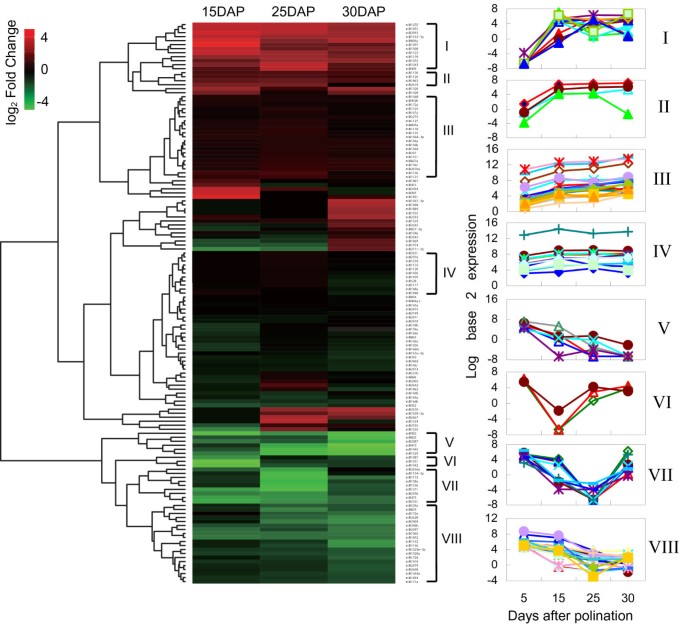
在这424个差异表达的mirna中,284个mirna的表达较低,即TPMs少于20个的mirna(每百万转录本)。在我们的研究中,我们选择了140个miRNAs(125个家族)在发育中的颗粒中高表达(至少在四个检测阶段中TPM≥20)(附加文件)3.).为了找到共同的表达模式,我们从5个DAP的基线出发,基于表达的折叠变化进行了分层聚类。总之,86个mirna可以被分为8个簇(图5,附加文件4),我们认为这可能与调节谷物灌浆有关。
保守miRNAs的前4个簇(I-IV)通常包括在灌浆过程中上调的miRNAs。簇I和簇II包含16个miRNAs,在5dap时表达量非常低,但在15dap时表达量大幅增加,在30dap时大多数miRNAs的表达量保持较高。考虑到15dap和25dap是胚乳发育过程中复杂基因调控网络参与的关键阶段,我们得出结论,簇I和簇II中显著诱导的候选miRNA可能具有重要的调控作用。簇III中miRNAs的表达随着时间的推移逐渐增加。例如,miR167a、miR156a和miR156c相当丰富,在5个DAP位点的表达水平分别为1825.73、845.74和212.12 TPM(额外文件4).虽然在15 DAP时仅上调了几倍,但由于其基础更丰富,调控效果更强。簇IV有11个miRNAs仅轻微上调。其中,8个表达较高,TPM值在15 DAP和25 DAP时为>100。例如,miR168a的TPMs在5 DAP时为7509.36,在15 DAP时为21776.72。
4个miRNAs簇显示出抑制,包括在簇v中迅速下调的6个成员。例如,尽管miR473在5 DAP时高表达(TPM = 150.97),但在25 DAP时其水平下降至0.13 TPM,并且在30 DAP颗粒中检测不到(额外文件)4).聚类VI和聚类VII分别包含3个和9个miRNAs,这些miRNAs在15 DAP和/或25 DAP时均被显著抑制。最后,簇VIII有20个成员,包括miR2628和miR1146,随着时间的推移逐渐被抑制。
在小麦中鉴定出新的miRNAs
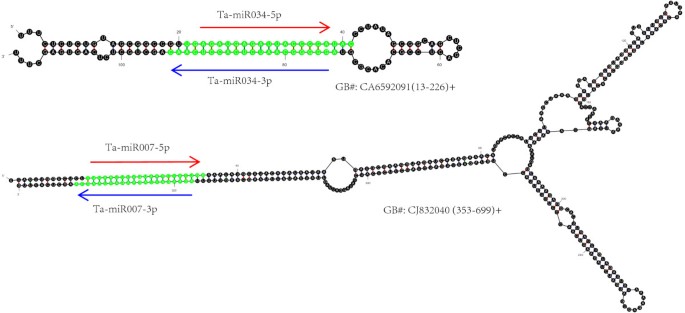
根据其前体的发夹结构特征预测了新的mirna,这与其他内源性sRNAs不同[33,34].共有268个假定的新mirna(182个家族)被鉴定出来(附加文件5,附加文件6).其中,至少有24个在发育籽粒中表达较高(TPM≥10)(表2)1).我们感兴趣地了解到Ta-miR034-3p和Ta-miR034-5p是同一茎环中的互补序列同源(图6).此外,Ta-miR007-5p和Ta-miR007-3p也位于小麦EST (gb#: CJ832040)的茎环中。
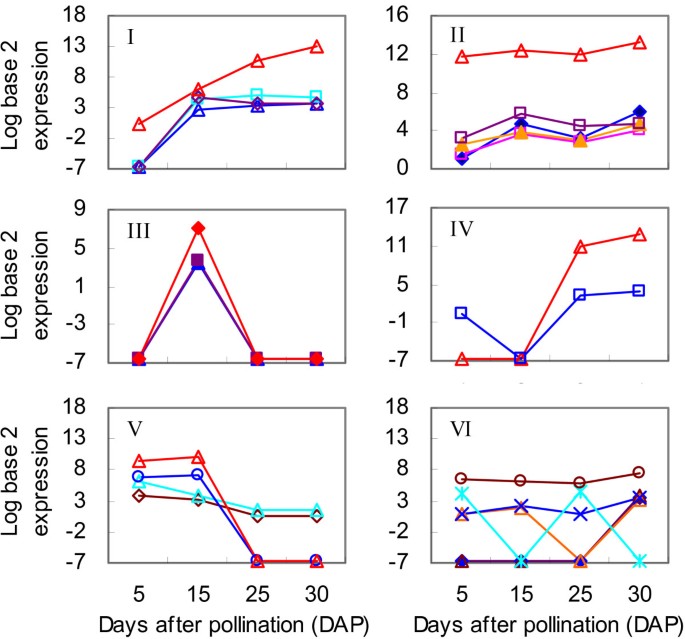
进一步的分析显示,这24个高表达的新型miRNAs可以被分为簇I到簇VI(图7、表1).簇I包含4个miRNAs,它们在15dap时表达量急剧上升,并在灌浆过程中保持在较高水平。例如,Ta-miR021-1-5p随着时间的推移而强烈上调,在30 DAP达到峰值(TPM = 7480.74)。簇II中的5个miRNAs在15、25和30 DAP时的表达明显高于在5 DAP时的表达水平。
小麦籽粒发育过程中簇I到簇VI中新型mirna的表达模式表达丰度归一化为log以2为底的数值。I-VI,表中所示的集群1.
在聚类III中,Ta-miR042-3p、Ta-miR107-2-3p和Ta-miR106-5p在15dap时高表达,但在其他任何发育阶段均不表达。相比之下,聚类IV中的Ta-miR051-3p和Ta-miR154-5p在25和30 DAP时显著上调。在簇V中,四种新的miRNAs随着时间下调。Ta-miR068-5p和Ta-miR057-1-3p在发育中的籽粒中逐渐被抑制,而Ta-miR007-5p和Ta-miR007-3p在5和15 DAP时高表达,但在25和30 DAP时不表达。这18个来自簇I到簇V的新miRNAs的上调和下调的对比表明了它们重要的调控作用。
最后,簇VI中包含的新miRNAs要么仅在30dap(接近填充期完成)表达,要么其转录本丰度随时间波动。因此,它们的活动似乎与这种类型的发育调节无关。例外的是Ta-miR034-5p,也在聚类VI中,它在所有采样时间点都表现出强烈的表达。
发育中的颗粒中mirna的验证
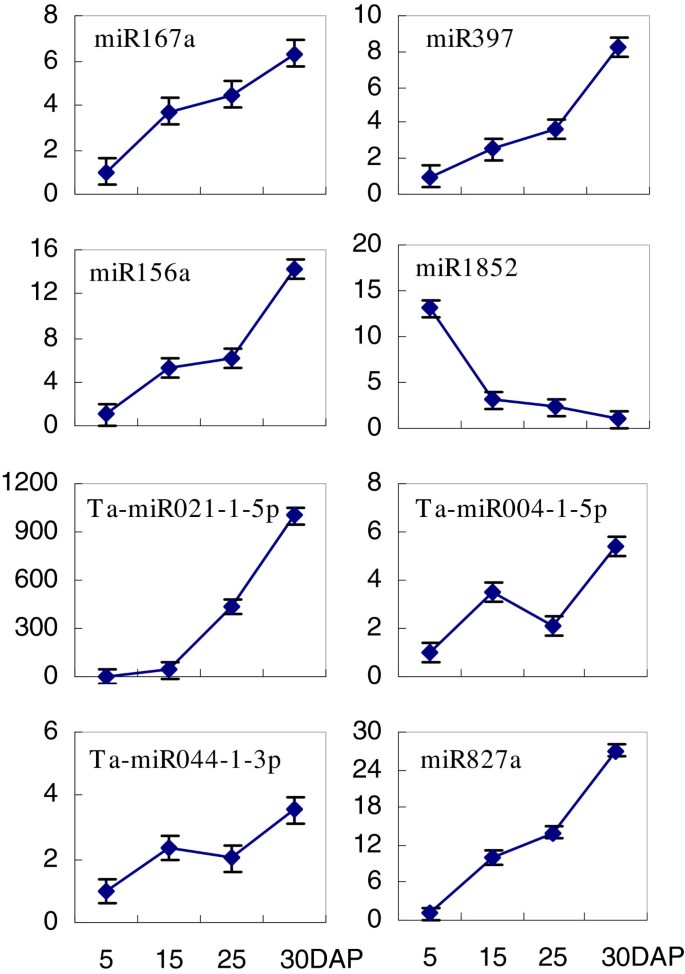
我们进行了实时定量PCR (qRT-PCR)来验证通过高通量测序鉴定的mirna的表达模式。根据深度测序确定的发育调控表达模式,我们选择了8个mirna进行检测。其中miR167a、miR397、miR156a、Ta-miR021-1-5p、Ta-miR004-1-5p、Ta-miR044-1-3p和miR827a预计会被诱导,而miR1852预计会被抑制。事实上,miR167a、miR397、miR156a、Ta-miR004-1-5p、Ta-miR044-1-3p和miR827a在15 DAP和25 DAP时均显著上调,并在30 DAP时达到峰值(图8).它们的表达谱与高通量测序确定的表达谱非常相似(图5,7).尽管Ta-miR021-1-5p随时间上调而miR1852下调,但其表达改变的程度并不像高通量测序所证明的那样显著(附加文件)4、表1).这些反应可能受到其他sRNAs相对丰度的影响。然而,我们的qRT-PCR结果与我们从高通量测序中获得的数据基本一致,从而表明有可能通过小麦的深度测序创建一组籽粒灌浆相关的miRNAs。
8种mirna在发育中的谷物表达模式的验证。DAP,授粉后几天。miRNA表达数据归一化为内源性肌动蛋白(GB #: AB181991]。与5dap时的水平相比,数值以折叠变化(平均值±标准差)表示。表格1在发育中的小麦籽粒中高度表达的新型miRNAs。
颗粒填充相关miRNAs的靶标
86个颗粒填充相关的保守miRNAs的潜在靶标(附加文件)4),以及24种高表达的新型miRNAs(表1),并使用小麦(小麦)单基因文库,DFCI基因索引;版本12),以及psRNATarget程序(http://plantgrn.noble.org/psRNATarget/) [35].对于那些保守的和新颖的miRNAs,所有预测的靶标都显示在附加文件中7和附加文件8.利用NCBI BLAST分析对这些靶基因进行功能标注,发现这些籽粒灌浆相关miRNAs可能靶向多个小麦基因,包括转录因子、参与膜转运的蛋白、泛素介导的蛋白水解、碳水化合物代谢、胁迫响应、信号转导和植物激素信号。
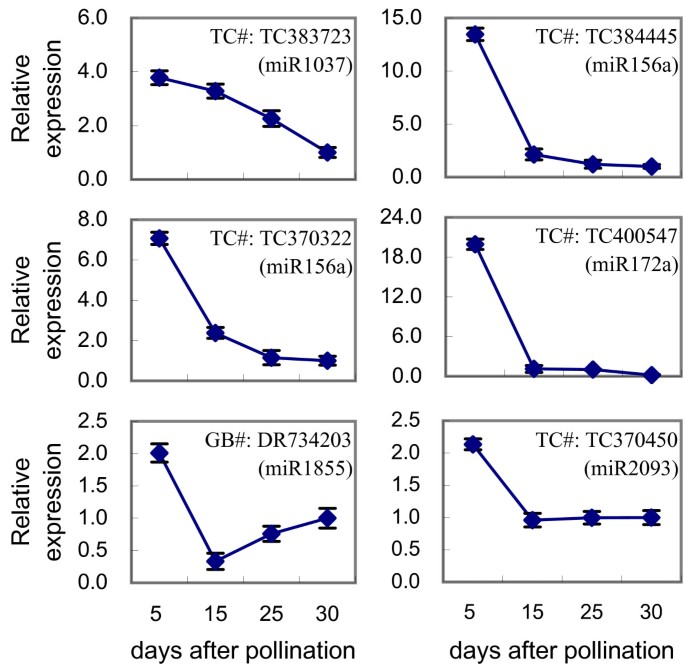
为了验证籽粒灌浆相关miRNAs潜在靶点的表达模式,我们选取了6个随着籽粒发育显著上调的候选miRNAs靶基因(TC383723、TC384445、TC370322、TC400547、DR734203和TC370450),进行基因特异性qRT-PCR。表达分析表明,所有检测到的靶基因在灌浆过程中均出现了强烈的下调9),它们与其相应miRNAs的表达谱呈负相关(附加文件4).这些结果表明,mirna在小麦籽粒灌浆发育过程中起着重要的调控作用。
所选miRNA靶标的表达模式。从DFCI小麦基因索引(http://compbio.dfci.harvard.edu/cgi-bin/tgi/gimain.pl?gudb=wheat) (TC#)或GenBank (GB#)显示。括号中标出了相应的mirna。数据被归一化为内生数据肌动蛋白(GB #: AB181991]。
讨论
对于大多数真核细胞,mirna是一类参与基因调控的调控rna。在植物中,一些miRNAs在各种发育过程中起着至关重要的作用,如控制根和茎的结构、从营养期到生殖期的过渡以及叶和花的形态发生[22,28].在小麦中,在聚集的组织样本(叶子、根和穗)以及受胁迫的叶子中检测到43个miRNAs [15,36].在这里,我们鉴定了540个保守miRNA家族和182个新miRNA家族,其中许多在小麦籽粒灌浆过程中存在差异表达。尽管关于miRNA在植物中的功能的知识越来越多,但只有高度保守的miRNA,如miR156和miR172,在作物物种中被研究过。例如,水稻中的miR156调控SPL (Squamosa Promoter-binding protein-Like,鳞状启动子结合蛋白样蛋白),从而促进穗部分枝和提高籽粒产量[37].同样地,miR172调控水稻、玉米和大麦中参与控制花器官特性的ap2样基因[38- - - - - -40].在灌浆过程中,这两种miRNAs在我们的小麦籽粒中均显著上调并高水平表达。我们还预测了miR156和miR172的几个新的潜在靶点,如myb相关蛋白(tc#: TC370322)和淀粉负调控因子RSR1 (GB#: CA486144)。
谷物成熟的过程对其产量和面粉质量有很大影响。淀粉胚乳是人类营养的最大贡献者,它的形成经历几个阶段[40].在小麦中,授粉后约14 d出现了一个主要的过渡点,基本上标志着胚乳细胞分裂的结束和这些细胞中籽粒填充的开始(即淀粉和面筋蛋白的沉积)[31,40].大约28天后,储存储量的沉积减少,颗粒开始干燥。为了研究小麦中mirna介导的调控机制,特别是那些与籽粒灌浆有关的调控机制,我们使用高通量测序在5、15、25和30 DAP进行分析,并鉴定出许多与籽粒灌浆相关的mirna(附加文件)5和表1),在晶粒形成过程中显著上调或下调。在这项研究中发现的几种与谷物灌浆相关的miRNAs之前也在其他谷物种子中检测到。例如,miR156a、miR167d、miR168a和miR172a在大麦籽粒中显著上调[28].此外,这些miRNAs(除miR172a外)在发育中的玉米种子中也高表达[41]和米[7,11].因此,所有这些数据都表明,mirna在谷类作物的籽粒发育过程中起着至关重要的调控作用。
靶点预测表明,本研究鉴定的籽粒灌浆相关miRNAs可能靶向一组小麦基因,这些基因参与多种生物过程,包括碳水化合物代谢、蛋白质代谢、发育过程、转录、转运、细胞组织和生物发生、应激反应、信号转导和植物激素信号(附加文件)4和表1).在这些预测的靶点中,一些可能参与调节淀粉积累或颗粒形成。例如,miR1855的潜在靶点磷酸三糖易位蛋白(TPT)是在细胞膜内发现的一种完整的膜蛋白拟南芥叶绿体(42].在那里,它负责输出光合作用过程中产生的所有碳水化合物。抑制TPT导致该物种淀粉合成的增加。此外,磷酸甘油酸激酶(miR1037的一个潜在靶点)可能通过一系列反应参与调节淀粉和蔗糖之间的碳分配[43].此外,miR172可能靶向AP2结构域转录因子CA486144和CA626451,前者是淀粉生成的负调控因子,淀粉生成在籽粒灌浆中期被抑制[44].扩展素基因TC418521是miR1137的潜在靶标,该基因在早期晶粒膨胀时高度富集,但后来被抑制,这意味着扩展素的水平可能是决定晶粒尺寸的一个因素[45].值得注意的是,miR1042可能靶向一种PLAC8家族蛋白(TC383018),该蛋白在玉米中调节细胞数量和影响器官大小[46].snf1相关蛋白激酶调节亚基β -1 (TC371426)是miR1211的潜在靶标,在控制高等植物基因表达和碳水化合物代谢的信号转导级联中起着至关重要的作用[47].它在大麦中的对应物被认为在谷物灌浆过程中调节贮藏产物的积累[48].DRG1 (TC386119)是Ta-miR128-5p的一个潜在靶点,可能对调节囊泡运输或处理储存蛋白质的酶的活性至关重要[49].最后,Ta-miR004-1-5p可能抑制蔗糖-磷酸合酶,这与淀粉的积累呈负相关[50].总的来说,我们的研究结果表明,mirna介导的机制在小麦籽粒发育的调节中起作用。
结论
我们鉴定了104个与小麦籽粒灌浆相关的miRNAs(86个保守的,18个新发现的),它们的潜在靶点涉及多种生物过程,如碳水化合物和蛋白质代谢、一般植物发育、转录、细胞转运、细胞组织和生物发生、胁迫响应、信号转导和植物激素信号。这些miRNA介导的网络在小麦籽粒成熟过程中起着至关重要的作用,我们的miRNA数据是未来专注于谷物作物籽粒发育控制的分子研究的宝贵资源。
方法
植物材料
小麦种子(小麦l .简历。玉麦18)水浸泡24 h后转移至冷室(4°C,暗处)。春化4周后,盆栽种植,在自然光照的植物温室(25°C/20°C日夜)中培养。发育中的籽粒在3 ~ 33dap从穗的中间四行收获。每个试验包含100粒,共3个重复。样品立即在液氮中冷冻,并保存在−80°C。
总RNA分离
总RNA按照制造商说明书使用TRIzol试剂(Invitrogen, Carlsbad, CA, USA)提取。在核酸沉淀之前,进行两次额外的氯仿洗涤。用1%的琼脂糖凝胶,用溴化乙锭染色,测定RNA的初步完整性。所有RNA样品都用ND 1000分光光度计(Nanodrop)进行定量和检测,以确定是否受到蛋白质(A260 nm/A280 nm比值)或试剂(A260 nm/A230 nm比值)的污染。所有样品的RNA完整性编号(RIN)为>8,由2100 Bioanalyzer (Agilent Technologies)测定。
sRNA文库构建及深度测序
从发育中的小麦籽粒中提取的总rna,分别在5、15、25和30 DAP下,在15% tbe -尿素变性PAGE凝胶上通过电泳分离纯化。对应18- 30个核苷酸条带的sRNA区域被切除并恢复。然后将这些sRNAs用T4 RNA连接酶连接5 '和3 ' RNA适配器。在每一步中,它们的长度在提纯之前都要经过验证。通过Super-Script II逆转录酶(Invitrogen)将连接的sRNAs转录成cDNA。我们用引物进行pcr扩增,引物退火到适配器的末端。扩增的cDNA构建物也被纯化和回收。cDNA文库的最终质量通过2100 Bioanalyzer检测其大小、纯度和浓度来保证。使用中国深圳北京基因组研究所的Illumina基因组分析仪对4个文库(每个采样时间点一个文库)进行测序。
测序数据分析
使用PHRED和CROSS MATCH程序执行原始序列的自动基调用和矢量移除[51,52].任何低质量的读取以及没有连接到任何其他序列的带有适配器污染的读取都将被丢弃。剩下的高质量序列被修剪掉它们的适配器序列;仅对18 nt和30 nt之间的序列进行了进一步分析。干净的reads被映射到通过SOAP2从NCBI获得的所有小麦EST序列。http://soap.genomics.org.cn/).它们与已知的miRNA前体(http://www.mirbase.org/)以确定有多少鉴定出的mirna存在。其余序列用于Rfam数据库的BLASTN搜索(http://rfam.sanger.ac.uk/)去除大部分非sirna和非mirna序列。通过对NCBI的小麦EST数据库进行BLASTN搜索,确定了其余序列的假定起源。蛋白质编码EST序列被移除,其余与sRNA序列完全匹配的非编码候选EST被用于Mireap (http://sourceforge.net/projects/mireap)基于Meyers等人描述的关键标准。[33].前体的二级结构由Mfold web服务器预测(http://mfold.rna.albany.edu/?q=mfold/RNA-Folding-Form) [53].
基于深度测序数据的mirna表达分析
mirna的频率按照每百万转录本的表达(TPM)进行归一化。对于每个样本,TPM =(实际miRNA计数/清洁reads总数)× 106.在15、25和30 DAP与5 DAP时miRNA表达的折叠变化计算为折叠变化= log base 2(治疗/对照),其中5 DAP作为对照。所有p-值根据以下公式确定:
潜在miRNA靶点的预测和注释
通过使用最丰富的miRNA变体对psRNATarget的TAGI数据库进行查询,对假定目标进行预测。http://plantgrn.noble.org/psRNATarget/) [35].应用以下默认参数:最大期望值,3;目标可达性-允许最大能量解成对目标站点(UPE), 25;目标可达性分析的目标地点周围侧翼长度,上游17 bp,下游13 bp;以及导致翻译抑制的中心错配范围,9至11 nt。为了获得更好的潜在靶点注释,我们在NCBI数据库中对其序列进行BLAST搜索。
表达miRNAs及其靶标的验证
我们通过5个保守的小麦mirna——miR167a、miR397、miR156a、miR1852和miR827a——以及3个新mirna——Ta-miR021-2-5p、Ta-miR004-1-5p和Ta-miR044-1-3p验证了表达模式。A One Step PrimeScript®miRNA cDNA Synthesis Kit (Perfect Real Time;采用TaKaRa)进行RT反应。将温度程序调整为在37℃下运行60 min,在85℃下运行5 s,然后在4℃下运行。对于每个miRNA,进行三次生物重复。qRT-PCR在Bio-Rad IQ5实时PCR检测系统上进行。每个反应包括2 μL稀释RT反应产物,1.0 μL引物(正向和反向),12.5 μL SYBR®Premix Ex Taq™(Perfect Real Time;TaKaRa)、8.5 μL无核酸酶水。反应在96孔板中在95°C下孵育30秒,然后在95°C下孵育5秒,60°C下孵育30秒,72°C下孵育30秒,循环40次。所有反应对每个样品进行3个重复。 The肌动蛋白基因(GB#: AB181991)为内源对照。我们还选取了籽粒灌浆诱导miR1037、miR156a、miR172a、miR1855和miR2093的6个靶基因TC383723、TC384445、TC370322、TC400547、TC370450和DR734203,通过qRT-PCR验证其在发育籽粒中的表达谱。所有引物都列在附加文件中9.
缩写
- 衣冠楚楚的:
-
授粉后几天
- microrna:
-
小分子核糖核酸
- 存在:
-
定量逆转录聚合酶链反应
- siRNAs:
-
Short-interfering rna
- TPM:
-
百万分之数。
参考文献
- 1.
王晓明,王晓明,王晓明,王晓明:植物内源性小rna与沉默相关的研究进展。植物细胞学报,2002,14(7):1605-1619。10.1105 / tpc.003210。
- 2.
Mette MF, Van der Winden J, Matzke M, Matzke AJ:拟南芥转座因子家族的短rna鉴定。植物营养学报,2002,26(1):1 -9。10.1104 / pp.007047。
- 3.
陈鑫:发育中的小rna——来自植物的见解。中国生物医学工程学报,2012,22(4):361-367。10.1016 / j.gde.2012.04.004。
- 4.
Jones-Rhoades MW, Bartel DP, Bartel B: MicroRNAS及其在植物中的调控作用。植物学报,2006,29(4):344 - 344。10.1146 / annurev.arplant.57.032905.105218。
- 5.
谢喆,孙晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明。拟南芥MIRNA基因表达的研究进展。中国生物医学工程学报,2005,38(4):344 - 344。10.1104 / pp.105.062943。
- 6.
Reinhart BJ, Weinstein EG, Rhoades MW, Bartel B, Bartel DP:植物中的MicroRNAs。基因开发,2002,16(13):1616-1626。10.1101 / gad.1004402。
- 7.
彭涛,吕强,张娟,李娟,杜勇,赵强:水稻上下小穗microrna的差异表达。应用实验学报,2012,32(4):344 - 344。
- 8.
陆超,Tej SS, Luo S, Haudenschild CD, Meyers BC, Green PJ:转录组中小RNA成分的解析。科学通报,2005,29(4):344 - 344。10.1126 / science.1114112。
- 9.
陈雪:小rna——基因组的秘密与惊喜。植物学报,2010,36(6):344 - 344。10.1111 / j.1365 - 313 x.2009.04089.x。
- 10.
孙嘉荣,周晓霞,郑勇,张伟,朱建军:利用高通量测序鉴定水稻新mirna和候选mirna。中国生物医学工程学报,2008,8:25-10.1186/1471-2229-8-25。
- 11.
薛丽娟,张俊杰,薛华文:水稻种子中mirna的鉴定及表达谱。中国生物医学工程学报,2009,37(3):916-930。10.1093 / nar / gkn998。
- 12.
王俊峰,周辉,陈永强,罗庆军,曲丽兰:水稻20种microrna的鉴定。中国生物医学工程学报,2004,32(5):1688-1695。10.1093 / nar / gkh332。
- 13.
翟玲,刘震,邹霞,姜艳,邱峰,郑勇,张震:玉米冠根长期内涝响应microRNA的全基因组鉴定与分析。中国生物医学工程学报,2012,47(2):379 - 379。
- 14.
丁东,王勇,韩敏,付忠,李伟,刘震,胡勇,唐娟:玉米种子萌发过程中杂种优势的MicroRNA转录组分析。公共科学学报,2012,7 (6):e39578-10.1371/journal.pone.0039578。
- 15.
姚勇,郭刚,倪震,孙强,杜军,朱建科,孙强:小麦microrna的克隆与鉴定。中国生物医学工程学报,2007,8 (6):R96-10.1186/gb-2007-8-6 r96。
- 16.
辛敏,王艳,姚艳,宋娜,胡志,秦东,谢超,彭辉,倪震,孙强:基于微阵列分析和SBS测序的小麦长链非蛋白编码rna的鉴定与鉴定。植物学报,2011,11(1):61-10.1186/1471-2229-11-61。
- 17.
陈欣:拟南芥花发育中作为APETALA2翻译抑制因子的microRNA。科学通报,2004,29(3):344 - 344。10.1126 / science.1088060。
- 18.
张勇,陆肯等:拟南芥新miRNA的鉴定及miRNA依赖性基因表达的发育转移。公共科学学报,2010,5 (4):e10157-10.1371/journal.pone.0010157。
- 19.
藤井红,邱廷杰,林思,翁凯,朱建军:拟南芥磷饥饿应答中的一个miRNA。动物学报,2005,15(22):2038-2043。10.1016 / j.cub.2005.10.016。
- 20.
刘PP, Montgomery TA, Fahlgren N, Kasschau KD, Nonogaki H, Carrington JC: microRNA160抑制生长素反应因子10对种子萌发和萌发后阶段的影响。植物学报,2007,26(1):344 - 344。10.1111 / j.1365 - 313 x.2007.03218.x。
- 21.
沙安,陈勇,巴红,单志,张旭,吴旭,邱东,陈松,周旭:大豆MicroRNAs对磷缺乏的反应。植物学报,2012,55(4):268-280。10.1007 / s12374 - 011 - 0255 - 4。
- 22.
陈鑫:小rna及其在植物发育中的作用。细胞发育生物学,2009,25:21-44。10.1146 / annurev.cellbio.042308.113417。
- 23.
倪忠,吴玲,孙强:玉米种子发育早期异施与自施籽粒基因表达差异。中国植物科学,2005,44(1):1 - 8。10.1016 / j.plantsci.2004.07.011。
- 24.
Martin RC, Liu PP, Goloviznina NA, Nonogaki H: MicroRNA,种子和达尔文?miRNA在种子生物学和植物胁迫反应中的不同功能。应用实验学报,2010,61(9):2229-2234。10.1093 / jxb / erq063。
- 25.
刘鹏鹏,刘鹏鹏,野ogaki H:种子中MicroRNAs的检测技术及其潜在应用。植物学报,2006,84(2):189-198。10.1139 / b05 - 141。
- 26.
李志刚,蔡新华:ABA诱导miR159调控拟南芥种子萌发过程中两种MYB因子转录水平。植物学报,2007,49(4):592-606。10.1111 / j.1365 - 313 x.2006.02980.x。
- 27.
李东,王磊,刘霞,崔东,陈涛,张慧,蒋超,徐超,李鹏,李松,等:玉米种子小rna深度测序结果显示,玉米种子干燥和吸收种子中存在不同的microRNA。公共科学学报,2013,8 (1):e55107-10.1371/journal.pone.0055107。
- 28.
李志刚,李志刚,李志刚,李志刚。大麦种子早期发育过程中miRNA的调控。中国生物医学工程学报,2012,12:120-10.1186/1471-2229-12-120。
- 29.
赵燕婷,王敏,付世祥,杨文伟,齐志强,王新军:油菜两个品种的小RNA分析发现了具有产油和发育相关表达的microrna和新的小RNA分类。中国生物医学工程学报,2011,29(2):344 - 344。
- 30.
Gill BS, Appels R, Botha-Oberholster AM, Buell CR, Bennetzen JL, Chalhoub, Chumley F, Dvorak J, Iwanaga M, Keller B,等:小麦基因组测序研讨会报告:国际小麦基因组研究联盟。中国生物医学工程学报,2004,18(2):344 - 344。10.1534 / genetics.104.034769。
- 31.
万勇,李志刚,王志刚,王志刚,王志刚,等:六倍体小麦籽粒发育的转录组分析。中国生物医学工程学报,2008,29(4):344 - 344。
- 32.
griffith - jones S, Saini HK, Van Dongen S, Enright AJ: miRBase: microRNA基因组学的工具。核酸决议2008,36(数据库issue): D154-D158。
- 33.
Meyers BC, Axtell MJ, Bartel B, Bartel DP, Baulcombe D, Bowman JL,曹X, Carrington JC,陈霞,Green PJ,等:植物MicroRNAs的注释标准。植物细胞学报,2008,20(12):3186-3190。10.1105 / tpc.108.064311。
- 34.
Ambros V, Bartel B, Bartel DP, Burge CB, Carrington JC, Chen X, Dreyfuss G, Eddy SR, Griffiths-Jones S, Marshall M,等:microRNA注释的统一系统。RNA。2003, 9(3): 277-279。10.1261 / rna.2183803。
- 35.
代X,赵PX: psRNATarget:植物小RNA靶标分析服务器。核酸决议2011,39 (Web服务器issue): W155-W159。
- 36.
辛敏,王勇,姚勇,谢超,彭华,倪震,孙强:不同microrna对小麦白粉病感染和热胁迫的响应。中国生物医学工程学报,2010,30(4):344 - 344。
- 37.
Miura K, Ikeda M, Matsubara A, Song XJ, Ito M, Asano K, Matsuoka M, Kitano H, Ashikari M: OsSPL14促进水稻穗部分枝,提高籽粒产量。植物学报,2010,42(6):545-549。10.1038 / ng.592。
- 38.
Lauter N, Kampani A, Carlson S, Goebel M, Moose SP: microRNA172下调glossy15促进玉米营养相变自然科学进展,2005,26(3):344 - 344。10.1073 / pnas.0503927102。
- 39.
Nair SK, Wang N, Turuspekov Y, Pourkheirandish M, Sinsuwongwat S, Chen G, Sameri M, Tagiri A, Honda I, Watanabe Y,等:抑制microrna引导的HvAP2 mRNA切割对大麦闭花性开花的影响。中国科学:自然科学,2009,26(3):344 - 344。
- 40.
朱qh, Helliwell CA: miR172对开花时间和花型的调控。实验学报,2011,62(2):487-495。10.1093 / jxb / erq295。
- 41.
康敏,赵强,朱东,于娟:玉米种子发育过程中microrna表达的研究。中国生物医学工程学报,2012,31(4):366 - 366。
- 42.
王晓明,王晓明,王晓明,等。拟南芥中磷酸三糖易位基因缺失的突变体揭示了光照下淀粉分解的代谢调控。植物科学进展,2004,26(2):379 - 379。10.1104 / pp.104.040469。
- 43.
Shah N, Bradbeer JW:磷酸甘油酸激酶的叶绿体和胞质同工酶在一系列植物物种中的发生。植物学报,1994,19(2):344 - 344。
- 44.
康广志,徐伟,刘国强,彭小强,郭廷青:小麦胚乳淀粉合成基因转录及转录因子RSR1的综合分析。中国生物工程学报,2013,56(2):115-122。10.1139 / gen - 2012 - 0146。
- 45.
Lizana XC, Riegel R, Gomez LD, Herrera J, Isla A, McQueen-Mason SJ, Calderini DF:扩张素表达与小麦(Triticum aestivum L.)粒度动态相关。实验研究学报,2010,61(4):1147-1157。10.1093 / jxb / erp380。
- 46.
郭敏,马鲁培,邹娟,陈晓明,陈晓明,陈晓明,陈晓明,陈晓明。玉米细胞数量调控因子1对植株和器官大小的影响:玉米产量和杂种优势的意义。植物细胞学报,2010,22(4):1057-1073。10.1105 / tpc.109.073676。
- 47.
Martinez-Barajas E, Delatte T, Schluepmann H, De Jong GJ, Somsen GW, Nunes C, Primavesi LF, Coello P, Mitchell RA, Paul MJ:小麦籽粒发育以海藻糖6-磷酸积累显著为特征:组织分布及其与snf1相关蛋白Kinase1活性的关系。中国生物医学工程学报,2011,26(1):373-381。10.1104 / pp.111.174524。
- 48.
Sreenivasulu N, Radchuk V, Strickert M, Miersch O, Weschke W, Wobus U:基因表达模式揭示了控制细胞程序性死亡和ABA调控成熟的组织特异性信号网络。植物学报,2006,44(2):366 - 366。10.1111 / j.1365 - 313 x.2006.02789.x。
- 49.
Etheridge N, Trusov Y, Verbelen JP, Botella JR:植物中一种新的gtp结合蛋白ATDRG1的特征。植物分子生物学,1999,39(6):1113-1126。10.1023 /: 1006137221259。
- 50.
Kerr PS, Huber SC, Israel DW: n源对大豆叶片蔗糖磷酸合酶、淀粉形成和全株生长的影响。植物营养学报,2004,27(2):344 - 344。10.1104 / pp.75.2.483。
- 51.
孙卡罗,朱建军:拟南芥中新型的胁迫调控microrna和其他小rna。植物细胞学报,2004,16(8):2001-2019。10.1105 / tpc.104.022830。
- 52.
孙嘉玲,朱建科,朱建科,孙志刚:水稻microrna的克隆与鉴定。植物细胞学报,2005,17(5):1397-1411。10.1105 / tpc.105.031682。
- 53.
Zuker M: Mfold网络服务器,用于核酸折叠和杂交预测。中国生物医学工程学报,2003,31(13):3406-3415。10.1093 / nar / gkg595。
确认
国家自然科学基金(31071410、30971771)资助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
FM进行了生物信息学分析和miRNA验证。HL和KW参与了植物材料的制备、深度测序和miRNA靶标的表征。LL和SW参与了miRNA靶标的表达分析。YZ参加了统计分析。FM、JY、YL共同设计并准备稿件。所有作者都阅读并批准了最终的手稿。
刘浩、王克涛对这项工作做出了同样的贡献。
电子辅助材料
12870 _2013_1371_moesm1_esm.doc
附加文件1:srna的注释和分发。列出了四个文库中在5、15、25和30 DAP发育的小麦籽粒中检测到的所有sRNAs的分类。(doc 86 kb)
12870 _2013_1371_moesm2_esm.xls
附加文件2:发育中的小麦籽粒中鉴定出保守的miRNAs。列出了所有检测到的保守miRNAs的序列和丰度。(xl117kb)
12870 _2013_1371_moesm3_esm.xls
附加文件3:保守的miRNAs在籽粒发育过程中差异表达。列出差异表达mirna的序列、丰度以及表达变化的比例。(xl199kb)
12870 _2013_1371_moesm4_esm.xls
附加文件4:保守miRNAs可能与籽粒灌浆有关。列出了86个可能参与控制籽粒灌浆的保守miRNAs的序列、丰度和靶标描述。(xls 41 kb)
12870 _2013_1371_moesm5_esm.xls
附加文件5:在发育中的颗粒中鉴定出新的miRNAs。列出了新miRNAs的序列、丰度和前体。(xls143kb)
24个高表达的新型mirna的二级结构。
附加文件6:24种高表达新型miRNAs的二级结构。表中展示了新型mirna的茎环结构1.(pdf 331 kb)
籽粒填充调控保守miRNAs的预测靶标和注释。
附加文件7:列出了簇I到簇VIII中保守miRNAs的目标和注释,如图所示5.(xls29kb)
预测新miRNAs的靶点。
附加文件8:列出了发育颗粒中高表达的24个miRNAs的靶标和注释,见表1.(xl60kb)
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
孟,F.,刘,H.,王,K。et al。小麦籽粒中的发育相关microRNAs (小麦l .)。BMC植物生物学13日,140(2013)。https://doi.org/10.1186/1471-2229-13-140
收到了:
接受:
发表:
关键字
- 微
- 粮食发展
- 小麦(小麦l .)