摘要
背景
玉米粗缩病(MRDD)是一种毁灭性的病毒性病害,在世界范围内造成相当大的产量损失。引起MRDD的病毒主要有三种毒株,包括欧洲的玉米粗矮病毒、南美洲的Mal de Río Cuarto病毒和东亚的水稻黑条纹矮病毒。这些病毒病原体属于这个属斐济病毒属在家里一种.对MRDD的抗性是一种复杂的性状,涉及许多数量性状位点(QTL)。减少这些病毒造成的产量损失的主要方法是培育和部署具有抗性的玉米杂交品种。
结果
在50个异种近交系(hif)中,24个在不同年份和地点对MRDD表现出一致的反应,其中9个耐药,15个敏感。我们对24例hif进行了性状标记关联分析,发现6个染色体区域被推测与MRDD耐药相关。然后我们进行了QTL分析,发现了一个主要的抗性QTL,qMrdd1在第8号染色体上。通过对自花授粉回交家族进行重组衍生的后代检测,我们精细地绘制了基因图谱qMrdd1位点在1.2 mb的区域,两侧有标记M103-4和M105-3。的qMrdd1基因座以隐性方式作用,使疾病严重程度指数(DSI)降低24.2 ~ 39.3%。基因效应qMrdd1使用另一个F6MRDD抗性分离的重组自交系(RIL)群体中存在两个基因型qMrdd1基因座的DSI值差异显著。
结论
的qMrdd1基因座是一个主要的抗性QTL,以隐性方式增强玉米对MRDD的抗性。我们映射qMrdd1到一个1.2 mb的区域,这将使qMrdd1并减少与mrdd相关的作物损失。
背景
玉米粗矮秆病(MRDD)是一种病毒性疾病,在欧洲、东亚和南美造成大量产量损失。1- - - - - -4]。MRDD于1954年在中国(南疆和甘肃西部)被发现,并在过去二十年中对玉米生产造成严重威胁,特别是在黄淮海平原。5]。2008年至2011年间,MRDD影响了300多万公顷2每年的收成。在受影响地区,产量损失一般超过30%,在严重感染地区可达到100% [6]。引起MRDD的病毒属于该属斐济病毒属在家里一种但不同大陆之间的病毒株各不相同。MRDD是由欧洲的玉米粗矮病毒,南美洲的Mal de Río Cuarto病毒和东亚的水稻黑条矮病毒引起的[7]。这些病毒通过飞虱昆虫媒介以持久的方式传播[8]。
MRDD的症状包括发育迟缓,叶片深绿色,叶和鞘背面蜡状突起,花穗和上部叶片畸形,开花抑制,缺穗(或小穗)。目前控制MRDD的方法包括杀虫剂、改变播种日期(即根据预计的昆虫数量)以及改善田间管理[9]。这些方法在一定程度上限制了飞虱的数量,降低了MRDD的严重程度,但风险高,效率低。然而,鉴定耐mrdd菌株可能是将产量损失降到最低的最具成本效益和最环保的方法。因此,通过定位和克隆对MRDD具有抗性的基因和数量性状位点(qtl)来开发和部署抗性杂交种非常重要。
在自然侵染条件下,玉米种质对MRDD表现出不同的抗性[10- - - - - -14]。电阻的主要来源来自美国混合P78599。对96个自交系和136个杂交种的评价表明,抗MRDD是一种数量性状[15]。Wang et al.(2000)报道玉米对MRDD的抗性是一种由许多基因控制的数量性状,每个基因的影响都很小[16]。在阿根廷,部分抗性品系对Mal de Río Cuarto病毒的抗性遗传力中等,范围为0.44至0.56 [4]。使用F2:3qtl定位策略,在箱号1.03和箱号8.03/4上鉴定出两个qtl,共解释了36.2%的表型变异[17]。基于514个基因源性单核苷酸多态性(SNPs),在中国玉米自交系X178 8号染色体上鉴定出一个主要的MRDD抗性QTL。6]。使用F2高抗性品系90110和易感品系Ye478衍生的群体,Luan(2012)在染色体箱6.02、7.02和8.07中发现至少3个qtl具有MRDD抗性[18]。
在这项研究中,我们对24个异种自交系(hif)进行了性状标记关联,并对hif衍生的群体进行了QTL分析,以确定玉米基因组中影响MRDD抗性的区域。然后,我们通过对自花授粉回交家族进行重组衍生后代测试,对主要QTL进行了精细定位。最后是F6利用重组自交系(RIL)群体验证了该QTL的效果。这些结果为研究玉米对MRDD的抗性提供了有价值的信息qMrdd1区域在抗性育种计划中可能是有用的。
结果
评价hfs对MRDD的耐药性
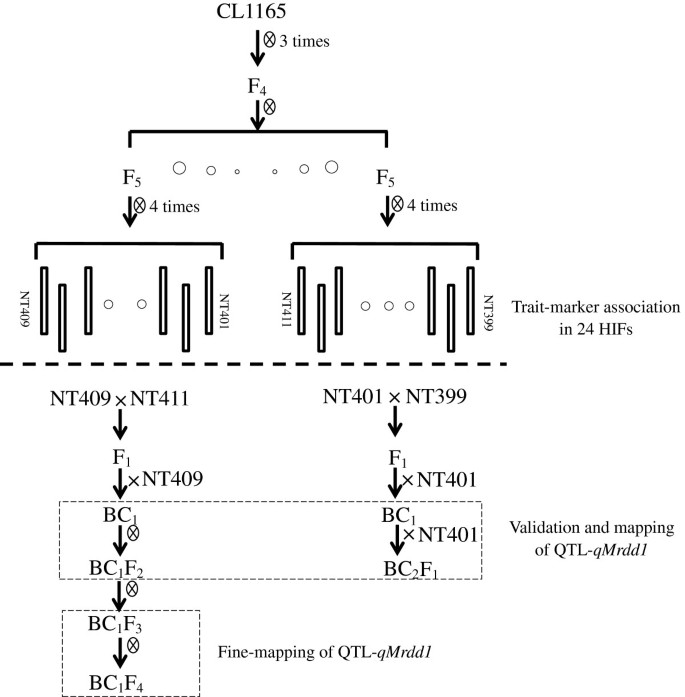
从玉米杂交种CL1165选育的50个hfs分别于2008 - 2010年在泰安和2010年在肥城和济宁进行了MRDD抗性评价。其中9株在不同年份和地点均表现出一致的抗性;而15人在三年内的每个位置都表现出高易感性(附加文件1).因此,这24个hif被用于随后的性状标记分析(图2)1).
hfs的性状标记关联分析
基于≥0.3的聚类分离评分和<50%的缺失数据,对24个hif的56110个snp进行基因分型,产生48384个成功调用。在这48384个snp中,8668个snp多态性,在24个hif中,小等位基因频率> 0.05。重要的是,105个snp与MRDD抗性共分离。在玉米加入黄金路径(AGPv2)上投射后,发现103个共分离snp聚集在6个染色体区域内(表2)1).剩下的两个snp可能是随机错误造成的,因此排除在进一步的分析之外。这6个基因组区域代表候选mrdd耐药位点。
玉米抗MRDD的QTL分析
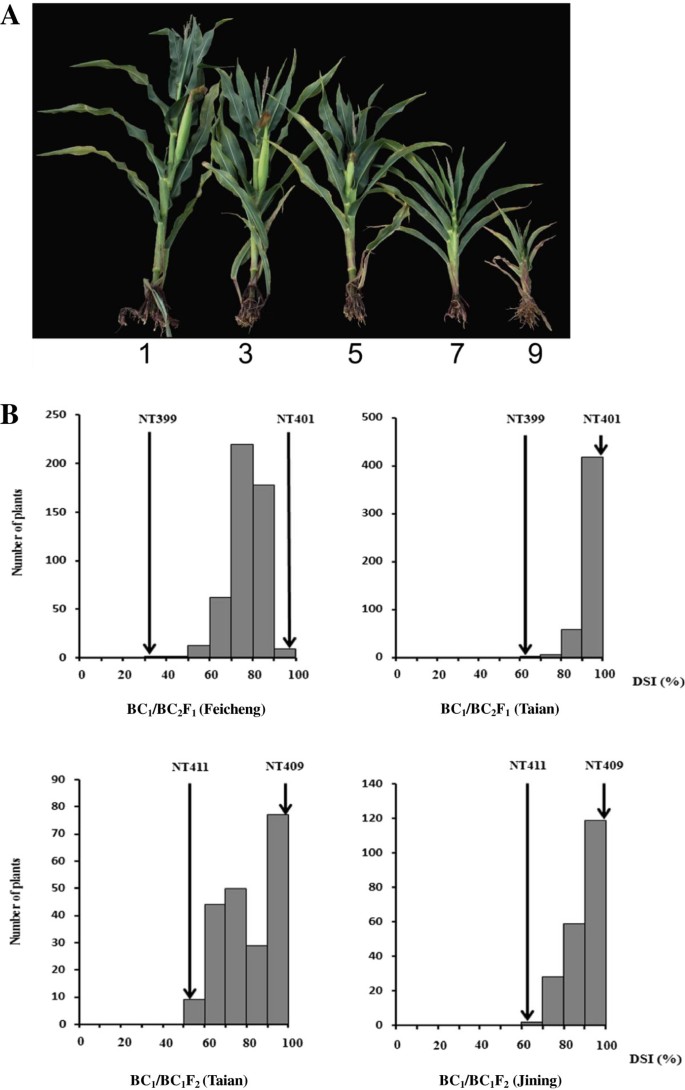
根据基因型和表型,选择NT401(易感)、NT399(耐药)、NT409(易感)和NT411(耐药)4个hif构建分离群体。F1将NT401与NT399的杂种两次回交于感病的NT401,产生BC2F1人群。F1将NT409和NT411的杂种回交到感殖的NT409上,然后自花授粉产生BC1F2数量(图1).公元前485年2F1和公元前211年1F2然后在泰安、肥城、菏泽和济宁四个试验站对各家庭进行MRDD敏感性评估。估计BC的疾病严重程度指数(DSI)值1个人根据他们的BC2F1或公元前1F2家庭。所得DSI值呈连续分布,在台安(BC)为66.7 ~ 100%1/公元前2F1),肥城39.7-100%1/公元前2F1), 51.9-100%在泰安(BC)1/公元前1F2),而济宁(BC省)为67.9-100%1/公元前1F2),分别为(图2B),暗示玉米对MRDD抗性的数量性质。有趣的是,DSI分布倾向于易感亲本,这表明缺乏一个主要的显性抗性QTL。例如,在泰安,BC2F1个体对MRDD和BC极为敏感1F2个体表现出对易感性的分离倾向(图2)2B).此外,地理位置对DSI有很大的影响。济宁种植种群的DSI普遍高于相同BC2F1我在泰安的家人。菏泽没有MRDD暴发,因此几乎每个家庭都出现了MRDD耐药(即使是易感系NT409)。因此,该地点的数据被排除在进一步分析之外。因此,环境条件可能在MRDD抗性方面波动很大(图2)2B)。
在6个候选区域中,从公共数据库中检索到18对SSR引物,另外开发了81对引物。利用这99个SSR标记对亲本间的多态性进行筛选,鉴定出14个多态性SSR标记(表2)2和附加文件2).每一个公元前1然后利用这14个SSR标记对6个候选区域的杂合子和纯合子基因型进行分型。给定BC的表型1个体用其BC计算的DSI值表示1F2或公元前2F1后代。分别计算杂合子和纯合子BC的平均DSI值1六个候选区域的基因型。基于BC的DSI值1F2在泰安和济宁的后代中,8.04/05、bnlg162、umc1670和umc1172三个SSR标记与MRDD抗性显著相关,因为杂合子和纯合子BC的DSI差异显著1基因型(P< 0.01)。bin 5.03中的另外两个SSR标记C5-5和C5-24与泰安(P= 0.04和P= 0.06)(表3.).对于bin 8.04/05,纯合子和杂合子BC的DSI平均差值1泰安和济宁的基因型差异分别为9.6%和7.0%。然而,在其他五个染色体区域,这两个BC之间的DSI差异1基因型均小于4.0%。基于BC的DSI值2F1在泰安和肥城的子代中,箱8.04/05上的3个SSR标记和箱5.03上的2个SSR标记与MRDD抗性极显著相关(表2)3.).纯合子和杂合子BC1基因型的DSI值非常相似(差异<2.0%)。综上所述,8.04/05区最有可能含有MRDD抗性QTL。
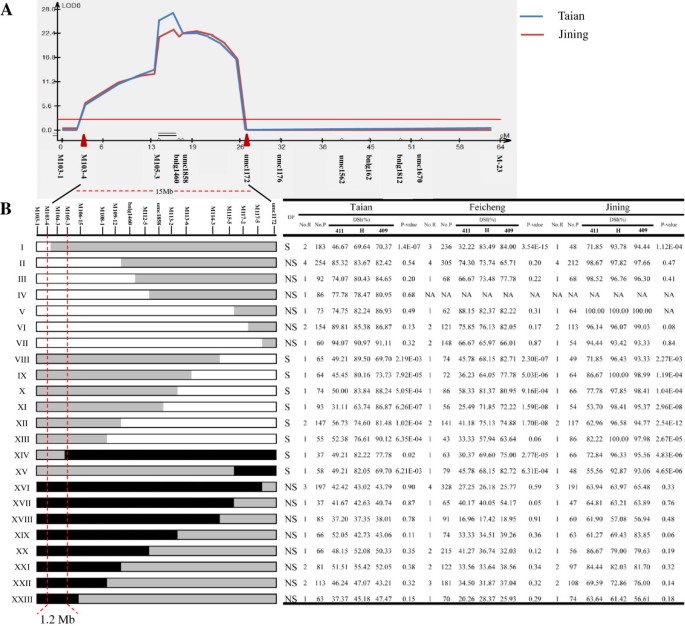
BC1F2由于该群体在MRDD抗性上比BC表现出更强的分离性,因此选择该群体进行抗性QTL定位2F1人口。以B73参考序列为基础,在8.04/05箱中合成了63个pcr标记,其中9个标记在亲本系NT409和NT411之间存在多态性。除了3个SSR标记外,这9个SSR标记也被用于211 BC的基因分型1个人。基于基因型数据和BC的DSI值1F2在济宁和泰安进行了抗性QTL的连锁定位。在标记M103-4和umc1172的15 mb区域内检测到一个抗性QTL(图2)3.A).该抗性QTL,指定qMrdd1,分别解释了济宁和泰安总表型变异的33.7%和41.3%(表2)4).
映射qMrdd1。一个.的QTL图qMrdd1公元前211年1F2家庭。对数的概率剖面,相对位置qMrdd1,并使用QTL cartographer 2.5版本显示相关标记。B.QTL-精细映射qMrdd1基于重组子代。公元前101年1F3.根据17个标记的基因型,重组体可分为23种类型。显示了每种类型的遗传结构。黑色、灰色和白色矩形分别对应纯合子NT411、杂合子NT409/NT411和纯合子NT409等位基因。这些BC自花授粉的后代1F3.利用杂合区标记对植株进行基因分型,得到3个基因型。表中列出了有关种植的重组体数量、种植的后代数量以及所有三种基因型后代的DSI的详细信息。显著差异(P< 0.05),表明qMrdd1定位于杂合区,亲本重组体(s)处于分离状态。P≥0.05),说明qMrdd1定位于纯合子区,亲本重组基因没有分离。对所有重组型的基因型和表型进行分析,使其定位qMrdd1在标记M103-4和M105-3之间的1.2 mb区域内。DP:推断表型,LOD:几率的对数,编号。R:重组数,编号;P:子代数,NA:不可用,411:与耐mrdd亲本NT411基因型相同的纯合子代,H:基因型为杂合子代,409:与mrdd易感亲本NT409基因型相同的纯合子代。
精细定位的qMrdd1
对fine-mapqMrdd1用双侧标记umc1172和M103-4筛选BC的重组体1F2在泰安的家庭。公元前151F2鉴定重组体并自花授粉产生BC1F3.家庭。公元前2685年1F3.筛选了237个重组个体,自花授粉产生BC1F4后代。解析与BC相关的重组1F4子代共设计了269对SSR引物qMrdd1区域,其中34个为多态性。最后,15个SSR标记(M103-4、M104-3、M105-3、M106-15、M108-1、M109-12、bnlg1460、M112-5、umc1858、M113-2、M113-6、M114-3、M115-5、M117-2和M117-5)均匀分布(相邻标记间约1-2 Mb)qMrdd1区域对237个重组基因进行了解析,得到23个类型(图2)3.B,表2).
Recombinant-derived公元前1F4选择后代并在三个地点种植。在台安,我们在公元前2203年增长1F4来自33个重组的个体包括所有23种类型。在肥城,我们培育了2700个个体,这些个体来自37个重组体,包括22种类型。最后,在济宁,我们增长了1805 BC1F4个体来自31个重组体,包括21个类型。自花受粉的公元前1F4后代在杂合部分有三种基因型qMrdd1位点:纯合子NT409,纯合子NT411,杂合子。对每个BC分别计算这三种基因型的dsi1F4家庭。23种重组型的基因型均与表型相匹配。I-VII型(见图)3.B)重组断点上游为纯合子NT409序列,下游为杂合子序列。II-VII型与基因型无关,对MRDD高度敏感,而I型在三种基因型之间表现出显著的MRDD抗性差异。这表明qMrdd1位于M103-4下游,bnlg1460上游。VIII-XIII型重组断点上游为杂合序列,下游为纯合NT409序列。所有类型在三种基因型之间的MRDD抗性均存在显著差异,与实验地点无关。这清楚地表明qMrdd1位于杂合区。XIV型和XV型也表现出MRDD抗性性状的分离,因此受到限制qMrdd1进入断点上游的杂合区。其余类型(XVI-XXIII)与基因型或实验地点无关,均对MRDD耐药。这意味着qMrdd1位于纯合子NT411区而不在杂合子区。只有XIII型表现出不同实验位置的表型。显著差异(PXIII型BC基因型间MRDD耐药差异< 0.05)1F4在泰安和济宁均有发现,肥城(P= 0.06)。这种差异可能是由于BC数量少造成的1F4后代(43只)。因此,XIII型的抗性表型被认为是分离的,放置的qMrdd1在M106-15上游的杂合区域内。与I型和XIV型相关的重组断点最接近qMrdd1,让我们可以绘制精细地图qMrdd1进入M103-4和M105-3之间的区域,物理距离为1.2 Mb(图2)3.B)。
遗传模型qMrdd1耐MRDD
基因效应qMrdd1在卑诗省进行了调查1F4家族(三种基因型和三次复制)。植物为NT411纯合子qMrdd1区域的DSI明显低于其他两个基因型(图2)4).在泰安,对2203 BC的MRDD耐药性进行了评估1F4植物。NT409纯合子植物qMrdd1等位基因的DSI为79.8%,与杂合植株(NT411/NT409;77.1%)。相反,植物对NT411纯合子qMrdd1等位基因的DSI显著降低(49.9%)。公元前1805年,济宁1F4对植物进行评价;虽然dsi普遍较高,但观察到相似的遗传模式。纯合子NT409和杂合子NT409的DSIs分别为95.8%和96.4%qMrdd1分别等位基因。相比之下,携带纯合子NT411的植株qMrdd1等位基因的DSI为71.7%。公元前2700年1F4植物生长在肥城,植物携带qMrdd1NT411纯合子区、NT409杂合子区和NT409纯合子区的DSIs分别为33.2%、67.1%和72.5%。在所有三个测试设施中没有差异(P杂合子NT409基因型与纯合子NT409基因型的DSI差异> 0.05)qMrdd1轨迹,表示qMrdd1QTL以隐性方式赋予对MRDD的抗性。此外,纯合子NT411具有较强的遗传效应qMrdd1结果表明,该QTL是提高玉米抗MRDD能力的有效工具。
的验证qMrdd1在F6瑞来斯
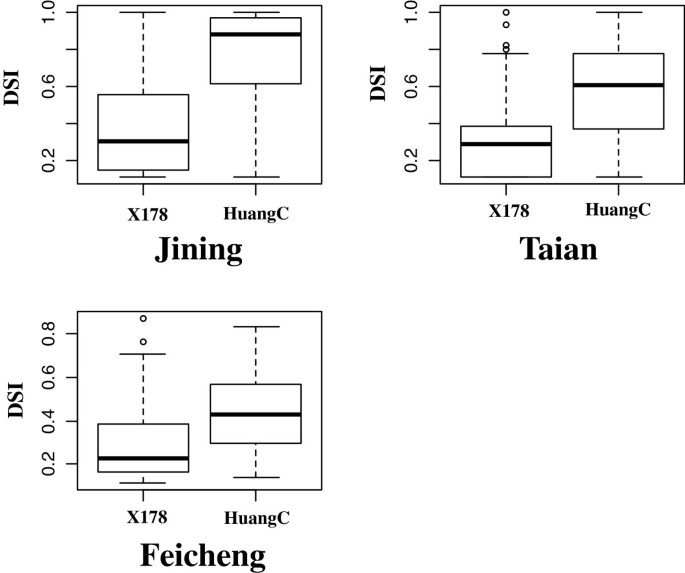
接下来我们决定是否qMrdd1QTL也存在于其他抗mrdd玉米品系中。测量了157f的电阻6由X178与黄c杂交得到的rls。这些研究在三个地点进行:泰安、肥城和济宁。SSR标记的开发qMrdd1利用区域筛选亲本系的多态性。标记M103-7,位于。的1.2 mb区域qMrdd1,对RIL群体进行基因分型。157个ril中,X178和HuangC序列在M103-7处分别有91个和63个纯合子。在M103-7位点只有3个ril是杂合的,因此被排除在后续的分析之外。X178基因型的RILs纯合子在泰安、济宁和肥城的DSIs分别为30.5%、40.3%和29.3%。相比之下,黄c基因型的RILs纯合子在泰安、济宁和肥城分别为56.1%、74.3%和44.5%。因此,在MRDD耐药性方面存在明显差异(P< 0.01)5).这些发现表明qMrdd1QTL可以使RIL群体的DSI降低15.2-34.0%,这与我们之前的精细定位结果一致。
讨论
准确的表型评估对于标记-性状关联分析至关重要,特别是对于数量性状[19]。由于大规模接种MRDD是不可行的,统一侵染是不可靠的,我们依赖于自然侵染过程。在MRDD流行的山东省济宁、肥城、泰安和菏泽等城市种植了植物。由于2011年表现不佳,即没有飞虱,在后续的分析中,菏泽被取消作为试验点。随后的精细映射测试也在泰安、济宁和肥城进行,以避免MRDD逃逸。环境对MRDD的发展有显著影响,济宁比泰安和肥城更为严重。这可能是由于这三个试验点的飞虱数量不同造成的。幸运的是,qMrdd1基因座在不同环境下具有稳定的遗传效应,表明自然侵染法是一种有效的方法,该评分系统适用于MRDD抗性的QTL分析。
病毒耐药性可受到遗传背景和环境的影响[20.,21]。来自同一杂交的hif具有相似的遗传背景,使其成为分析数量性状的理想选择。为了确定与MRDD抗性相关的主要QTL,从我们的育种计划中选择了50个hif用于本研究。对于从两个MRDD抗性水平非常不同的hif制备的群体进行分离,观察到抗性的连续分布,而不是两个不同的类别。这可能是由残留的遗传背景差异或环境条件造成的。全基因组SNP分析显示,在易感株系(NT409)和抗性株系(NT411)之间,20278个SNP中有14.2%存在差异。NT401和NT399分别为易感品系和抗性品系,差异较小(51628个snp中有3.1%)。在这里,我们主要关注MRDD抗性的主要QTL,但其他染色体区域也可能参与其中。例如,5号染色体上的一个区域在两个作图群体中显示出与MRDD抗性的显著相关性。为了生成精细映射的种群,我们自花授粉而不是回交,因为大多数BC2F1由于基因型不同,家庭对MRDD非常敏感qMrdd1在BC中有相似的表型2F12011年的植物。
当易感自交系作为回交群体的回交亲本时,重组子代检验是一种有效而有力的qtl精细定位方法。该方法可以通过分析后代的性状-标记关联来准确地对重组进行表型分析[22- - - - - -24]。在这里,我们将这种方法的应用扩展到包括自花授粉的后代。与回交后代相比,自花授粉后代可以捕获所有三种基因型的效应,并产生更多的重组基因用于精细定位。然而,并不是所有自花授粉产生的重组体都可以用于精细定位,因为当在两侧标记上纯合的重组体自花授粉时,不会在目标区域内产生分离的基因型。杂合子杂交是解决这一问题的有效途径。
将重组子代试验应用于自花授粉子代,qMrdd1被精细映射到一个1.2 mb的区域。该区域DSI下降24.2-39.3%。从公元前8047年又发现了43个重组体1F5用于进一步精细映射(未显示数据)。与以前的报告相比,这代表了克隆和应用方面的重大进展qMrdd1.测试位点之间一致的精细定位结果表明,重组衍生的后代测试为精细定位回交后代的显性QTL或自花授粉后代的部分显性或隐性QTL提供了强有力的解决方案。此外,不同年份(2011年和2012年)的定位结果表明QTL-的遗传效应qMrdd1是可遗传的。最后,qMrdd1使DSI下降15.2-34.0%6RIL种群由157个系组成,表明qMrdd1在不同的遗传背景下具有稳定的遗传效应。
本研究中定位的主要QTL与Di Renzo [17]和Shi [6],这意味着在不同的映射群体中存在相同的QTL功能。然而,在Luan的研究中尚未发现该QTL [18]。这可能是由于Luan采用了不同的评分体系,他采用了MRDD的缩短上节间、蜡质化、穗型、疾病严重程度四项指标,而不是对MRDD的症状进行全面评价。
最重要的农艺性状是数量性状和多基因性状。因此,与单基因或少基因性状相比,这些多基因性状对育种家和病理学家来说是极难管理的[21]。qtl的分离,特别是主要qtl的分离,可以简化数量性状的分析,为性状改良提供重要的资源。在将qtl常规应用于育种计划之前,必须解决一些挑战。这些措施包括改进诊断分析以检测qtl和鉴定用于标记辅助选择的遗传标记[25]。在本研究中,我们使用了一个可靠的评分系统,并开发了一些高密度的标记内和周围qMrdd1地区。这些工具可用于广泛的标记辅助选择,以提高玉米对MRDD的抗性。
植物的病毒抗性分为被动抗性和正抗性两类。被动抗性是由隐性植物因子赋予的,这是病毒完成感染周期所必需的。这些典型的蛋白质形式不能被特定的病毒成分识别。相比之下,积极抗性是由植物的主导因子赋予的,这些因子触发防御机制以应对病毒入侵[21]。的qMrdd1QTL仅在NT411等位基因纯合子的植物中赋予MRDD抗性,表明它涉及一个参与被动抗性的隐性基因。这一信息将有助于确定一个候选基因qMrdd1.
结论
培育具有抗性的玉米杂交品种是减少MRDD造成的产量损失的最经济有效的方法。我们绘制了qMrdd1到一个1.2 mb的区域,表明它在不同的遗传背景下以隐性方式起作用。这一与MRDD抗性相关的主要QTL的发现和精细定位为植物的定位克隆奠定了基础qMrdd1使我们更接近于在玉米生产过程中通过基因控制MRDD的侵害。
方法
植物材料
初步选择QTL分析的植物材料为50f9hif由两个F衍生而来5单科植物4杂种CL1165的个体(图1).在2008年、2009年和2010年夏季,在泰安、肥城和济宁三个地点对这50只hif进行了MRDD耐药性评估。在每个地点,现场试验采用随机完整块设计(RCBD),以地点为完整块。每个HIF种子25粒,单行播种,宽0.6 m,长5 m。24°F9选择表型稳定的MRDD家族,2个耐药hif (NT399和NT411)和2个易感hif (NT401和NT409),分别制备NT409和NT411、NT399和NT401杂交组合。NT411和NT409占20278个被称为snp的85.8%;而NT399和NT401共有51,628个snp的96.9%。2009年,海南冬季苗圃建立了两个杂交品种。2010年,F1在泰安将植株回交到易感亲本系。海南冬季苗圃,公元前211年1由NT409/NT411杂交而来的植株自花授粉产生BC1F2家庭。另外,公元前485年1由NT399/NT401杂交而来的植株与NT401回交产生BC2F1家庭。2011年,bbc2F1和公元前1F2在山东省的菏泽、泰安和济宁(或肥城)三个地点种植这些家族及其亲本系。在每个位置,现场测试都是在RCBD中进行的,每个位置都是完整的区块。每科25粒,单行播种,宽0.6 m,长5 m。
基于QTL定位,来自BC省的植物1F2和公元前1F3.选择在目标QTL区域内含有重组断点的家族进行重复自花授粉。2012年夏天,由此产生的BC1F4后代在济宁、肥城和泰安三个地点无重复种植。所有公元前1F4对植株进行基因分型qMrdd1基因座和MRDD抗性测定。
MRDD症状的实地调查
植物在中国山东省济宁、肥城、菏泽和泰安四个地点种植,并允许在自然条件下感染MRDD,即不进行人工接种。种子在5月24日至26日播种,以配合飞虱的侵扰,使病毒接种更有可能。在灌浆期对抗病性进行评价。对于50个hfs,我们在三年内将它们分为耐药,中等耐药和易感,因为我们只想知道哪些hfs在不同年份不同地点具有一致的耐药或易感。对于QTL分析、制图和精细制图工作,采用基于总体症状的评分系统(1、3、5、7或9)来评估MRDD耐药性。具有不同抗性分数的受感染植物如图所示2A. DSI用于表示家庭的MRDD严重程度,计算为[26]:
不同重复的所有表型数据都是独立评估的。
基因分型
采集叶组织按SDS法提取DNA [27]。使用MaizeSNP50 DNA分析试剂盒(Illumina, San Diego, CA),使用康奈尔大学生命科学核心实验室中心的Illumina BeadStation 500G,可以调查56110个snp,对snp进行基因分型。有关SNP基因分型程序和等位基因评分的细节已被描述[28]。对于基于pcr的标记基因分型,扩增子进行1%琼脂糖凝胶电泳,并使用凝胶成像系统(Bio-Rad Laboratories Inc.)进行可视化。或者,扩增子用6%聚丙烯酰胺凝胶电泳分离,用银染色显示。
性状标记关联分析
缺失数据大于50%或聚类分离评分<0.3的snp被排除在进一步分析之外。利用TASSEL 2.0检索小等位基因频率>0.1的多态性snp,采用一般线性模型分析多态性snp与表型的相关性。然后将紧密连接的snp映射到B73 AGPv2 [29通过BLAST比较。每个区域(<100 kb)包含>2个共分离snp被认为是含有赋予水稻黑条矮病毒抗性的QTL的候选区域。
主要QTL的验证和映射
覆盖所有候选区域的SSR引物对从公共数据库(http://www.maizegdb.org/)或根据张所描述的B73参考序列发展[23]。所有引物均由北京Invitrogen公司合成。首先利用SSR引物鉴定两亲本间的多态性。然后利用多态性SSR标记对BC植株进行基因分型1人群。每个BC的表型1个体用相应BC的DSI表示1F2家庭或BC2F1家庭。性状标记相关性分析采用SAS 9.1的单因素方差分析。对于与MRDD抗性相关的区域,开发了更多基于pcr的标记来定位目标qtl。利用MAPMAKER 3.0b对多态性SSRs进行连锁定位[30.]。使用“Group”命令鉴定连锁组,其对数比值评分≥3.0。利用Kosambi映射函数将重组频率转换为厘米单位[31]。采用复合区间映射法检测qtl [32]如QTL制图师(2.5版)[33]。从1000个排列中获得了鉴定推测QTL的显著性阈值P< 0.05。
精细定位的qMrdd1
重组子代试验[34]进行QTL精细定位。基于winQTLcart所映射的QTL区域,BC1F2对群体进行重组筛选。随后,2011年在山东省进行了自花授粉。将子代种植在海南冬季苗圃中筛选新的重组体。Newly-screened公元前1F3.选择一个侧翼标记为杂合而另一个侧翼标记为纯合的重组体进行进一步自花授粉。这就产生了一个可用于精细绘图的分离种群。基于已开发的标记,BC1F3.重组体被划分为不同的类型。2012年,多元BC的后代1F3.重组型在泰安、肥城和济宁种植,每个类型单田种植籽粒均大于100粒。
对于每个重组qMrdd1区域在重组断点两侧被分成杂合和纯合两段。根据杂合序列内的标记,将自花授粉后代分为纯合子NT409/NT409、纯合子NT411/NT411和杂合子NT409/NT411 3种基因型。这些基因型之间的评分值比较采用SAS 9.1的单因素方差分析。一个重要的(P< 0.05)或不显著(P≥0.05),表明耐药QTL定位于杂合子或纯合子片段qMrdd1,分别。同一BC内三种基因型的表型1F3.重组衍生后代用DSI值表示。如果两个或两个以上BC1F3.个体具有相同的供体片段,它们可以归为一种重组类型。每个重组型的基因型和推断表型的可用性允许对抗性QTL进行精细定位。
验证qMrdd1在RIL群体中的位点
的影响qMrdd1也在F6RIL群体由X178(耐MRDD)和黄c (MRDD敏感)杂交而成,黄c是中国广泛种植的商业杂交种(ND108)。2012年,157 F6以RCBD的3个地点(泰安、济宁和肥城)为完整块,对RCBD的ril及其亲本进行MRDD抗性评价。每个RIL共播种25粒种子,单行播种,宽0.6 m,长5 m。利用精细定位过程中产生的SSR标记对157个ril进行基因分型,即筛选多态性。在SAS 9.1中采用单因素方差分析分析基因型与MRDD耐药之间的相关性。
缩写
- DSI:
-
疾病严重程度指数
- 低氧诱导因子:
-
异种近交系
- m:
-
Megabase双
- MRDD:
-
玉米粗缩病
- 聚合酶链反应:
-
聚合酶链反应
- QTL:
-
数量性状位点
- 瑞来斯:
-
重组自交系
- SNP:
-
单核苷酸多态性
- 苏维埃社会主义共和国:
-
简单的序列重复。
参考文献
- 1.
哈尔帕斯一号:一种新型玉米病毒的针传。自然科学,1959,18(6):77-78。
- 2.
Dovas CI, Eythymiou K, Katis NI:希腊玉米作物中玉米粗矮病毒(MRDV)的首次报告。植物病理学报,2004,53(2):238-238。10.1111 / j.0032-0862.2004.00973.x。
- 3.
Huth W, Maurath R, Imgraben H, Schroder M:首次在德国检测到玉米粗矮病毒。应用科学学报,2007,59(8):173-175。
- 4.
Di Renzo MA, Bonamico NC, DÍaz DD, Salerno JC, IbaÑEz MM, Gesumaria JJ:黄斑病(malde Río Cuarto, MRC)抗性遗传玉米(l)。农业科学学报,2002,39(01):47-53。
- 5.
陶玉峰,刘国强,徐利民:玉米粗缩病研究进展。玉米科学,2013,21(1):149-152。
- 6.
石丽丽,郝志峰,翁建峰,谢春霞,刘春林,张德贵,李明明,白丽,李小华,张世生:基于514个基因单核苷酸多态性连锁图谱的中国玉米自交系X178抗玉米粗矮病毒主要数量性状位点的鉴定。植物育种,2011,30(2):615-625。
- 7.
Milne RG, Lovisolo O:玉米粗矮秆及其相关病毒。Adv病毒学报,1997,21:267-341。
- 8.
Caciagli P, Casetta A:玉米粗矮病毒(一种)及其病媒纹状老年虫与病媒传染性的关系。中国生物医学工程学报,2006,31(2):337-344。10.1111 / j.1744-7348.1986.tb05325.x。
- 9.
王爱莲,王建军,陈超:玉米粗矮病毒发病规律及综合防治技术研究。玉米科学,2005,13(4):114-116。
- 10.
郭秋琴,李志,董志:玉米粗矮病毒病(MRDV)品种抗性观察与分析。植物学报,1995,1:21-23。
- 11.
王光远,韩海林,赵富春,王海东,孔晓明,叶继杰:玉米品种(系)对玉米粗矮病毒的抗性鉴定。浙江农业科学,2011,23(3):564-567。
- 12.
尚云峰,赵军,杜生,卢鑫,王松,孙华,杨超:玉米商品品种和种质苗期抗病能力鉴定与调查。山东农业科学,2001,4:3-5。
- 13.
薛磊,张东,徐磊,金明明,彭俊杰,徐文武:玉米粗矮病抗性种质资源遗传多样性的挖掘与分析及其在玉米育种中的应用。作物学报,2011,37(12):2123-2129。
- 14.
陈玉坤,李小红,肖迈杰,李明明,袁世祥,王晓东,张世生:64个玉米自交系与玉米粗矮病毒的遗传变异。作物学报,2006,32(12):1848-1854。
- 15.
刘志强,迟思敏:玉米基因型对玉米粗矮病毒的抗性。玉米科学,1996,4:68-70。
- 16.
王爱玲,赵德芳,陈志华,王建军,邵绍祥,魏国光:玉米自交系抗MRDV的遗传基础及循环选择效应研究。玉米科学,2000,8:80-82。
- 17.
Di Renzo MA, Bonamico NC, DÍaz DG, IbaÑez MA, Faricelli ME, Balzarini MG, Salerno JC:水稻抗Río瓜尔多病QTL的微卫星标记玉米可能是L.农业科学学报,2004,142(3):289-295。10.1017 / S0021859604004307。
- 18.
栾建伟,王峰,李玉军,张波,张继军:玉米抗水稻黑条病毒数量性状位点的定位(英文)玉米可能是L。).理论与应用,2012,25(4):781-791。10.1007 / s00122 - 012 - 1871 - 1。
- 19.
张志军,张志军,张志军,张志军,张志军。基因分型与基因设计的关系分析。植物细胞,2009,21(8):2194-2202。10.1105 / tpc.109.068437。
- 20.
弗雷泽RSS:抗植物病毒的遗传学。植物酚学报,1990,28:179-200。10.1146 / annurev.py.28.090190.001143。
- 21.
Gómez P, Rodríguez-Hernández AM, Moury B, Aranda MA:植物病毒病害可持续控制的遗传抗性:育种、机制和持久性。植物病理学报,2009,25(1):1-22。10.1007 / s10658 - 009 - 9468 - 5。
- 22.
杨强,尹光光,郭玉玲,张德芳,陈树军,徐明林:玉米抗赤霉素茎腐病的主要QTL。理论与应用,2010,21(4):673-687。10.1007 / s00122 - 010 - 1339 - 0。
- 23.
张德峰,刘玉军,郭玉林,杨强,叶小杰,陈士杰,徐利民:精细映射qRfg2玉米抗赤霉素茎腐病QTL。理论与应用,2012,24(3):585-596。10.1007 / s00122 - 011 - 1731 - 4。
- 24.
张勇,徐磊,范晓明,谭健,陈伟,徐明林:玉米抗灰斑病QTL定位。理论与应用,2012,25(8):1797-1808。10.1007 / s00122 - 012 - 1954 - z。
- 25.
毛利,刘建军,刘建军,等。植物病毒自然抗性来源的研究进展。植物病理学杂志,2007,8(2):223-231。10.1111 / j.1364-3703.2007.00386.x。
- 26.
Grau CR, Radke VL, Gillespie FL:大豆品种对菌核病的抗性。植物学报,1982,66(6):506-508。
- 27.
Murray MG, Thompson WF:高分子量植物DNA的快速分离。中国生物医学工程学报,1998,8(3):422 - 422。10.1093 / nar / 8.19.4321。
- 28.
闫军,杨霞,沙特,Sanchez-Villeda H,李军,Warburton M,周勇,Crouch JH,徐勇:玉米GoldenGate高通量SNP基因分型。植物育种,2010,25(3):441-451。10.1007 / s11032 - 009 - 9343 - 2。
- 29.
Schnable PS, Ware D, Fulton RS, Stein JC, Wei F, Pasternak S, Liang C, Zhang J, Fulton L, Graves TA,等:B73玉米基因组的复杂性、多样性和动态。科学通报,2009,26(5):1112-1115。10.1126 / science.1178534。
- 30.
李建军,李建军,李建军,等。基于MAPMAKER/EXP3.0的基因图谱绘制。剑桥:怀特黑德研究所技术报告;1992.
- 31.
Kosambi DD:从重组值估计地图距离。[j] .中国生物医学工程学报,2014,32(3):559 - 561。
- 32.
曾志斌:数量性状位点的精确定位。遗传学报,1994,18(4):557 - 568。
- 33.
Basten CJ, Weir BS,曾志斌:QTL制图师:QTL制图的参考手册和教程。北卡罗来纳州罗利:北卡罗来纳州立大学统计系;1997.
- 34.
杨强,张德芳,徐明林:基于重组子代的序列数量性状位点精细定位策略。华北农学报,2012,35(4):557 - 557。10.1111 / j.1744-7909.2012.01108.x。
致谢
本研究得到中国农业部(2011ZX08009-003-001)、国家高新技术发展计划(2012AA10A306和2012AA101104)和国家基础研究“973”计划(2009CB118402)的资助。我们感谢中国农业大学的杨晓红博士对56,110个snp的基因分型。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们没有竞争利益。
作者的贡献
YFT和QCL进行分子遗传学研究,进行统计分析,参与表型评价。MLX监督研究,设计实验并参与数据分析。BSL、HHW和YJZ进行玉米田间栽培和授粉,并进行表型评价。XYH, BBW和JSL帮助了RILs群体的发展和基因分型。YFT撰写原稿,MLX和JRY对原稿进行编辑和修改。所有作者都阅读并批准了最终的手稿。
陶永福、刘清才对这项工作也作出了同样的贡献。
电子补充资料
12870 _2013_1355_moesm1_esm.docx
附加文件1:评估50个hif在不同年份和地点对MRDD的耐药性。R代表抗性,IR代表中间抗性,S代表易感。(docx18kb)
SSR标记表
附加文件2:qMrdd1轨迹。(docx15kb)
权利和权限
开放获取本文由BioMed Central Ltd.授权发表。这是一篇开放获取的文章,在知识共享署名许可(https://creativecommons.org/licenses/by/2.0),允许在任何媒体上不受限制地使用、分发和复制,前提是正确引用原创作品。
关于本文
引用本文
陶勇,刘强,王海。et al。QTL的鉴定与精细定位;qMrdd1它赋予玉米粗矮病的隐性抗性。BMC Plant Biol13,145(2013)。https://doi.org/10.1186/1471-2229-13-145
收到了:
接受:
发表:
关键字
- 玉米
- MRDD
- QTL
- 精细定位
- 重组子代试验