摘要
背景
海甘蓝abyssinica在种子油中产生高芥酸(c22: 1,55 -60%),可以通过降低多不饱和脂肪酸(PUFA)水平进一步增加。已知omega-6脂肪酸去饱和酶(FAD2)参与多不饱和脂肪酸的生物合成。克兰伯,三CaFAD2的基因,CaFAD2-C1, CaFAD2-C2而且CaFAD2-C3表达。
结果
每一种的个别效果CaFAD2通过对转基因株系(CaFAD2-RNAi)用于与籽油组成相关的差异表达水平。6株第一代转基因植物(T1)显示C18:1增加(6%至10.5%),PUFA减少(8.6%至10.2%)。这些T1这三种植物的沉默程度都在中等范围内(减少40%到50%)CaFAD2基因以强沉默(95%减少)的CaFAD2-C3一个人。两个T的后代1-plants (WG4-4和WG19-6)进一步分析。在子代中有4或5个转基因插入(T2),而不是在T中单独插入2WG4-4的后代。对于单个T2两科植物(WG19-6和WG4-4)的种子特异性沉默CaFAD2-C1而且CaFAD2-C2在几个个体T2但是,在两个科中,这些基因的沉默水平并不显著。表达水平显著降低(P< 0.01)CaFAD2-C3以及油中C18:1和PUFA含量的显著差异。
结论
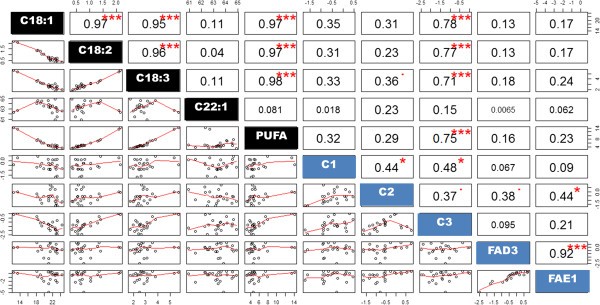
CaFAD2-C3表达与C18:1水平(r = -0.78)和PUFA水平(r = 0.75)高度相关CaFAD2-C3是改变克兰伯油成分的最重要因素。
背景
海甘蓝(海甘蓝abyssinicaHochst ex. R. E. Fr.)属于十字花科植物的家庭。克兰籽油中芥酸含量高(C22:1, 55% ~ 60%),可作为工业油使用[1].芥酸以芥酸酰胺的形式存在,是C22:1的主要衍生物,可用作塑料、润滑剂、尼龙和化妆品中的滑移剂[2].最近,克兰伯油被认为有潜力生产生物燃料[3.].栽培克兰伯的产量可达1吨公顷-1与芥酸含量高的油菜籽(HEAR)相比。此外,提取克兰伯油的加工成本与菜籽油的加工成本在同一范围内[1,4,5].克兰贝的高产量和在自然界中不能与食用油料作物杂交的事实使克兰贝成为生产工业油的理想平台[6,7].克兰伯油除含有高芥酸(C22:1)外,还含有一定量的油酸(C18:1)、亚油酸(C18:2)和亚麻酸(C18:3)。
提高克兰伯油中C22:1的含量,降低多不饱和脂肪酸(PUFA, C18:2 + C18:3)的含量,可以进一步提高克兰伯油的价值。首先,增加C22:1可以降低从c18脂肪酸中纯化C22:1的成本。据估算,油中C22:1含量增加10%,加工成本可降低一半[8].其次,减少多不饱和脂肪酸有利于储存和延长油的保质期,因为多不饱和脂肪酸在储存过程中极易氧化[9].第三,高PUFA含量会导致油脂粘度增高(不利于生物柴油)[10].为了减少石油中的多不饱和脂肪酸,已经做出了相当大的努力。常用的化学方法是通过氢化作用降低PUFA含量或增加C18:1含量[9,11].然而,这种氢化过程是昂贵的,每磅石油价格额外增加2至3美分。12].
改变种子油组成的分子育种方法是针对脂肪酸生物合成途径中的重要基因,这些基因已被广泛研究,许多相关基因已被鉴定。简而言之,C18:1是新创在质体中合成并运输到内质网,其中C18:1被纳入磷脂酰胆碱(PC),并可能通过两种微粒体酶的作用降饱和至C18:2和C18:3;-12脂肪酸去饱和酶(FAD2)[-6脂肪酸去饱和酶]及-15脂肪酸去饱和酶(FAD3)[-3脂肪酸去饱和酶][9,13].另外,通过脂肪酸延伸(FAE)复合物的作用,C18:1可以延伸为非常长的链脂肪酸(例如,VLCFA, C22:1) [2,14- - - - - -17].突变和遗传定位研究表明,FAD2酶主要负责C18:1和PUFA含量,尽管FAD3也在一定程度上影响这些性状[9,18].此外,原核途径(质体途径)和真核途径(主要在ER途径)之间的酰基通量正在影响C18:1池[19- - - - - -21].
基因改造(GM)旨在调控FAD2已在多种油料作物中应用于生产C18:1含量较高的油料[8,22,23].例如,通过反义的压制FAD2在芸苔属植物juncea,获得了C18:1含量较高(73%)、PUFA含量较低(8%)的转基因油品;C18:3的9%)与野生型(C18:1的53%;C18:2的24%;16%的C18:3) [23].同样,当沉默时,可以观察到C18:1和PUFA的显著变化,甚至种子油的C22:1增加FAD2同时具有共抑和反义芸苔属植物carinata[8].RNAi基因沉默被认为是获得稳定的转基因植物的一种特别有效的方法[24,25].rnai介导的沉默GhFAD2使C18:1的产量增加了60%以上[22].同时rnai介导的沉默FAD2而且FAE1在芸苔属植物显著不仅使C18:1显著增加(从62%增加到85%),而且使C22:1和PUFA降低(分别从26%到10%和0.87%到0%)[26].最近,几种有效的crambe转换协议是可用的[27,28而RNAi已被证明是一种有效的基因敲除工具CaFAD2RNAi基因沉默导致C18:1水平增加(从14.5%增加到24.9%)[29].引入两个异种基因,LdLPAAT而且BnFAE1在这样的情况下CaFAD2-RNAi系引导油的生物合成朝向C22:1的掺入sn三酰甘油的-2位置,从而使C22:1水平从野生型的60%提高到最佳转基因克兰伯系的73% [29].
适应这类转基因作物的一个障碍是在许多国家尚未得到部分社区的广泛接受。[30.].此外,在某些情况下,rna介导的性状在产生稳定的靶基因抑制方面并不完全可靠[25].目前,异体六倍体克兰伯的育种主要依靠传统方法,但由于重要农艺性状缺乏遗传变异,育种的可能性受到限制[1,31,32].在这种情况下,特别是当控制表型的基因已知时,通过“TILLING”(针对基因组中诱导的局部病变)识别诱导或自然突变的突变育种[33],提供了一种可靠、稳定、非转基因的方法,以获得理想的油质量。缺点是“耕作”在多倍体作物中仍然是一项具有挑战性的任务,由于基因冗余,多个等位基因在识别理想的遗传变化方面产生了问题。尽管存在这些问题,在多倍体作物中已经报道了靶向诱变的成功案例[34- - - - - -38].例如,定向诱变育种的自然或诱导变异FAD2基因或挖掘自然变异已被用于培育高C22:1或低PUFA的作物[38- - - - - -40].通过结合突变或自然变异的FAD2而且FAD3结果表明,大豆中C18:1含量较高,C18:3含量较低芸苔属植物显著[9,11].在异基因六倍体基因组中海甘蓝abyssinica简历。“卡拉狄加”七FAD2存在基因,其中只有三个基因在植物发育过程中具有转录活性(CaFAD2-C1, CaFAD2-C2而且CaFAD2-C3) [32].活动人员之间功能冗余的可能性CaFAD2通过诱变育种,家族成员可能使具有理想油成分的克兰伯系的获得复杂化。
本研究的目的是具体说明哪一种FAD2crambe基因是提高C18:1水平,降低PUFA含量的关键基因。FAD2- crambe cv的rnai谱。《卡拉狄加》研究了个体之间的功能相关性CaFAD2家庭成员,CaFAD2-C1,CaFAD2-C2而且CaFAD2-C3以及籽油成分。以2个独立家族的二代转基因株系(T2植物)。此外,另外两个基因,CaFAD3而且CaFAE1它们的作用密切相关CaFAD2他们也参与了这项研究。
结果
CaFAD2-RNAi行
我们前面已经说明了major表示CaFAD2基因是影响克兰伯种子发育的重要因素CaFAD2-C3,而另外两个基因CaFAD2-C1而且CaFAD2-C2自然表达的水平要低得多(比CaFAD2-C3分别)[32].一个DNA片段CaFAD2-C2,具有97%和96%的核苷酸同源性CaFAD2-C1而且CaFAD2-C3分别用于触发rnai介导的沉默CaFAD2基因在克拉姆。两种主要的转基因植物(T0种子油中C18:2和C18:3含量较低,而C18:1含量较高[29].对于这两个独立的转基因株系,rna沉默对个体表达的影响CaFAD2对第一代种子(T1)和第二代(T2).在T2确定转基因拷贝数,并将个体基因的相对基因表达与籽油组成的差异相关联,以确定沉默个体的影响CaFAD2基因(s)。
CaFAD2基因沉默与油分组成的关系1代的
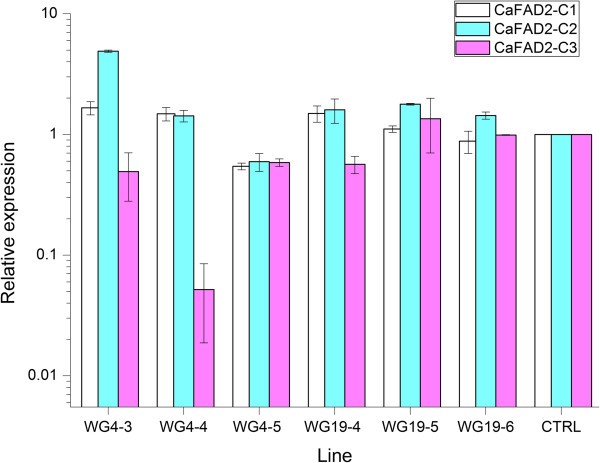
在六株被分析的植物中,三种植物同时但适度地沉默CaFAD2基因(减少40% ~ 50%)仅在一株植物wg3 -5中发现。在两个植株WG19-5和WG19-6中未观察到基因沉默的迹象。其余三株植株(WG4-3、WG4-4和WG19-4)未检测到沉默CaFAD2-C1而且CaFAD2-C2而CaFAD2-C3被沉默到不同的水平,因此强烈的沉默CaFAD2-C3在WG4-4中检测到(95%的减少),其次是中等水平的CaFAD2-C3WG4-3和WG19-4的沉默(减少40% - 50%)(图1).为了测量基因沉默的最终效果,每株植物确定了大约20个成熟种子的油成分。尽管只在一株植物(WG4-4)的发育种子中检测到明显的沉默,但所有6株植物种子中C18:1、C18:2和C18:3的含量均与对照显著不同(表2)1).C18:1含量比对照高6% ~ 10.5%,PUFA (C18:2 + C18:3)含量比对照低4.3% ~ 9.2%。C22:1含量方面,WG4-3、WG4-4和WG19-6分别显著高于对照2.4% (P< 0.01), 3.9% (P< 0.01)和3.1% (P< 0.01),其余3种植物与对照无显著差异(表21).
一个事实的解释,水平CaFAD2消声与油成分相关性不明显1代可能存在于转基因拷贝合子水平的差异1植物。在对5到10个种子的表达谱进行分析时,转基因拷贝数的变化和分离为野生型种子的存在可能掩盖了沉默效应。的确,在WG4-5和WG19-5的单个种子的脂肪酸谱中,观察到了与野生型油成分的分离(附加文件1).
CaFAD2T2代的
两个T1选择C18:1含量稳定和含量高的WG4-4和WG19-6,选育第二代,对“高C18:1,低PUFA”油型的遗传进行广泛研究,并研究两者沉默的相关性CaFAD2基因、油的组成和参与种子油生物合成的另外两个基因的表达(CaFAD3而且CaFAE1).
转基因人类基因组
17 T2随机选取5株WG4-4和12株WG19-6,分别命名为WG4-4和WG19-6科,通过Southern分析确定转基因插入数。在WG19-6的子代中检测到4或5个转基因插入,模式相似。相比之下,在所有五个分析的WG4-4子代植物中都检测到一次插入(附加文件)2).
CaFAD2基因沉默
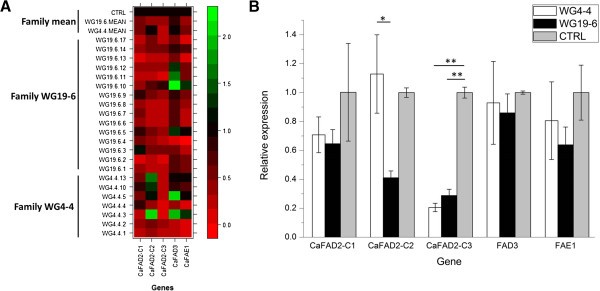
为了测试rnai介导的基因沉默是否以及在多大程度上对T2的表达水平CaFAD2-C1,CaFAD2-C2而且CaFAD2-C3对所有22个T的发育种子(每株5 ~ 10个膨大种子,20dap)进行了定量2qRT-PCR检测植物。相对表达量计算相对于对照中各基因的平均表达量。总的来说,基因表达下调在T2-两种T2WG4-4和WG19-6,这三个家族都观察到不同的沉默模式CaFAD2基因(图2A).主要的CaFAD2在克兰伯种子中表达的基因CaFAD2-C3,在所有7个T2- WG4-4家族的植物,在15个T中有14个2- WG19-6家族的植物。仅在单株植物中,WG19-6-10,轻度消音CaFAD2-C3(减少10%)(图2一个)。
相对表达量CaFAD2Gene家族成员,CaFAD3而且CaFAE1在T2植物的c . abyssinica.一)小麦种子基因表达谱的热图2植物。数据表示5个基因的相对表达值(CaFAD2-C1,CaFAD2-C2,CaFAD2-C3,FAD3而且FAE1(水平)散装(5 ~ 10粒),在20dap与对照(CTRL)相比。对2个科(WG4-4和WG19-6)的21个子代和2个对照植株进行了测定。颜色代表上调或下调(绿色代表上调;红色,向下)。颜色键代表表达调节的尺度。B)两个家族和对照相对表达量的比较。这些数据表明了小麦种子中基因表达水平的平均值2植物。比较采用非参数Kruskal-Wallis检验。只有显著性差异被显示出来。*,P< 0.05;**P< 0.01。
与之相对的是不断而强烈的沉默CaFAD2-C3,在消声方面发现了更多的变化CaFAD2-C2而且CaFAD2-C1在两个家庭。在单拷贝转基因T2- WG4-4家族植物,CaFAD2-C2在WG4-4家族(WG4-4-1, WG4-4-2和WG4-4-4)中,近一半(7个中的3个)表现出强烈的沉默2在WG4-4的植株中,该基因未被沉默(图4-4)2A).在另一个科WG19-6中,T2-植物(15个中的9个)表现出强烈的沉默CaFAD2-C2而其他人则表现出零到中等程度的沉默CaFAD2-C2。同时,CaFAD2-C1两种T23个WG4-4 T均有强沉默的家系2-植物(7个中的3个;43%)和5个WG19-6 T2-植物(15个中的5个;33%)(图2一个)。
计算每个T的各自基因的平均表达量2家庭与对照组比较。在两个家族(WG4-4和WG19-6)中,只有表达CaFAD2-C3与平均控制水平的差异持续且显著(图2B)。CaFAD2-C1而且CaFAD2-C2,两个家族的平均表达水平与对照中观察到的平均表达水平无显著差异(图2B)。
CaFAD2沉默的遗传
比较两代人(T1和T2),携带多重转基因插入的WG19-6的沉默水平从T1分别降低~40%、60%和70%CaFAD2-C1,c2而且c3在T2.经过两代人,T1和T2,单拷贝转基因WG4-4的表达谱CaFAD2基因相似。只有两代人CaFAD2-C3表达显著下调(图1而且2B)。
CaFAD2沉默对CaFAD3和CaFAE1表达的影响
作为结果CaFAD2基因沉默,以及伴随的底物流动在石油生物合成途径的变化,其他基因的表达在该途径可能改变。因此,两个基因的表达,FAD3,参与了C18:2到C18:3的转换,以及FAE1通过C18:1的链伸长,研究了其在生产超长链脂肪酸(即C22:1)中的作用2家族(WG4-4和WG19-6)和对照。两种基因在科内单株间表达均有差异,但在两株间平均无显著差异2家庭和对照组(图2B)。值得注意的是,CaFAD3而且CaFAE1除了WG19-6-11和WG19-6-12这两个植株外,它们在同一株植株中均有上调或下调的现象(图19-6-11和WG19-6-12)2一个)。
油成分
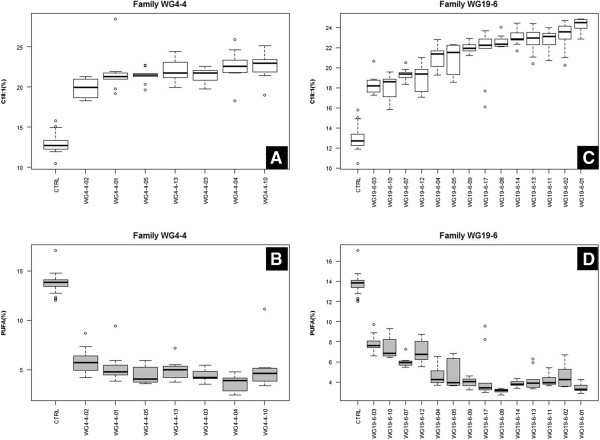
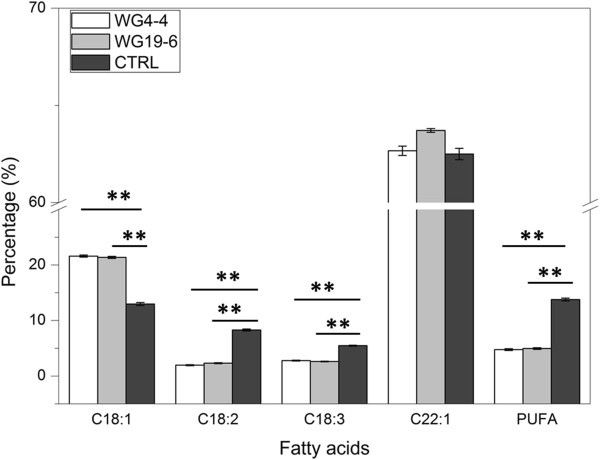
目的基因表达模式的改变导致21 T籽油成分发生显著变化2研究的植物(7种来自WG4-4, 14种来自WG19-6)。根据T1代中,C18:1、C18:2和C18:3含量与对照差异显著(P< 0.01)。然而,在两种T1-plants (WG4-4和WG19-6)在整个T中未观察到2这些植物的后代。C22:1含量仅在4个T中与对照有显著差异2-植物(WG19-6-3, WG19-6-5, WG19-6-7, WG19-6-8)中C22:1的水平升高约2% (P高于对照组(C22:1% = 62.5%)。与对照(C18:1% = 12.9%)相比,各油品中C18:1含量均显著降低2-植物明显更高(P< 0.01),范围为24.3% ~ 18.2%2-plants(81%, 21个中有17个)的C18:1含量超过20%(图3.因此,这些植物的PUFA (C18:2 + C18:3)含量较低(P< 0.01)高于对照(PUFA% = 13.8%),范围为3.4% ~ 7.9%,67%(21株中14株)的PUFA含量低于5%(图3.B和D)。
总的来说,种子来自两个T2与对照相比,WG4-4和WG19-6的C18:1和PUFA含量不同(分别较高或较低)4).在两个T之间2C18:1、C18:2、C18:3、C22:1和PUFA含量无显著性差异(图2)4).然而,家族WG19-6在C18:1和PUFA含量上比家族WG4-4表现出更大的差异(附加文件3.).
基因表达与油成分的相关性
目的:探讨不同目的基因在T2并与油品组成进行了相关分析。所有的相关性和系数绘制在图中5.在个体T中2WG4-4和WG19-6的植株表现出差异CaFAD2表达水平,观察到一些显著相关的表达水平CaFAD2-C1-C3,CaFAD3而且CaFAE1.总的来说,表达CaFAE1被两者协调调节,CaFAD3(r = 0.92,P< 0.001)和CaFAD2-C2(r = 0.44,P< 0.05)(图5).这些相关性在WG4-4家族中更强(r分别为0.943和0.957)。在油成分上,C18:2和C18:3含量均呈负相关(r分别为-0.97和-0.95;P< 0.001)到C18:1含量。而C22:1含量与其他油类化合物的变化无显著相关性(P> 0.1)(图5).根据其在油脂生物合成途径中的作用,研究了其表达水平CaFAD2-C3与C18:1含量呈负相关(r = -0.78,P< 0.001),与C18:2含量呈正相关(r = 0.77,P< 0.01)和C18:3 (r = 0.71,P< 0.01)(图5).然而,在这些脂肪酸与其他基因的表达之间没有发现相关性(图5).
讨论
c . abyssinica克兰伯油是一种未充分利用的作物,遗传变异有限,传统育种对克兰伯油的改良已达到瓶颈。最近,利用基因工程方法,通过沉默获得了具有理想油型的克兰伯系CaFAD2基因(29].在c . abyssinica、三功能FAD2基因存在(CaFAD2-C1-C3) [32].即使一个家族成员的功能缺陷可能由该基因家族的其他成员补充[41],这些家族成员中的一个或几个通常起主要作用,因此在突变育种之前通常需要对基因家族成员进行初步的功能分析[42].我们的研究是为了描述这三种功能的作用CaFAD2基因(CaFAD2-C1-C3),为定向突变方法(TILLING)确定合适的靶点,以开发具有新型油型的非转基因克兰伯系。
的一部分构造CaFAD2-C2序列,与其他表达的序列有96%到97%相同CaFAD2基因,以获得种子特异性沉默(Napin启动子)的内源性CaFAD2基因家族成员在克兰伯。结果证明,一个RNAi触发器能够影响多个基因家族成员的表达,但模式不同(图1).在T2-主要是植物FAD2在克兰伯种子中表达的基因CaFAD2-C3,强烈沉默,而两个低表达基因,CaFAD2-C2而且往上平移(分别比CaFAD2-C3下午20时[32]),消声程度由强至零不等。为什么没有减量的原因CaFAD22个T1WG19-5和WG19-6的种子油组成差异显著,可能是由于种子样品的杂合子性质所致。这可能导致用于表达分析的种子块中存在分离的野生型种子,而油成分是在单个种子上测量的。另一种可能性是,这些品系的沉默发生在授粉后20天表达高峰(DAP)以外的其他时间点。的确,南方分析的结果确实表明T1植物WG19-6是杂合的,因为在其子代中检测到不同数量的转基因插入(T2),以及WG4-4 (T1由于在所有随机测试的子代(T . plant)中都观察到单个转基因插入,因此最有可能是纯合子的2) WG4-4(附加文件2).
超过两代人(T1和T2)的表达模式CaFAD2在携带单一转基因插入的WG4-4中,差异相似,而在WG19-6中观察到不同代间沉默水平的差异。WG19-6中的多个转基因插入可能导致T基因的不同类型的变异2人口,这可能会影响沉默的程度。已知微量的dsRNA足以触发基因沉默[43]且沉默程度与插入拷贝数无关[44].因此,对于不同消声水平的T1和T2WG19-6种子的纯合子水平较高2代导致较低数量的分离野生型种子,这是重要的,如果种子分析表达“批量”。
T2对两株FAD2-RNAi植物(WG4-4和WG19-6)的子代进行了详细的基因表达水平检测CaFAD2基因家族成员(图2A和B)和油成分(图3.而且4).结果表明,基因表达的沉默可以稳定地遗传到后代。rnai沉默的稳定性也反映在种子-油的组成上,例如,在T2WG4-4子代的C18:1水平显著高于对照,PUFA水平显著低于对照(表4-4)1和图3.).重要单体油品的T值接近亲本T的平均值1结果表明,WG4-4和WG19-6的高C18:1和低PUFA性状稳定地遗传给了后代。
相关性及表达调控分析
相比CaFAD2-C1而且CaFAD2-C2,CaFAD2-C3强烈且稳定地被种子特异性RNAi触发器沉默。平均而言,沉默CaFAD2-C3在两个T2(WG4-4和WG19-6的后代)。尽管有些T2-植物表现出明显的沉默CaFAD2-C1而且CaFAD2-C2在两个家庭中,这些基因的整体家庭平均值与对照组没有显著差异。因此,在两种T2家庭的区别在于CaFAD2-C2表达式(图2B)。
综合来看,所有T2-植物和那三个CaFAD2基因CaFAD2-C3是发育克兰伯种子的最高表达素[32],很可能该基因在种子油的合成中起直接作用。这一观点得到了小麦个体籽油研究的支持2植物(图5).基于差分消声的CaFAD2-C2在T2植物的两个科和沉默CaFAD2-C1在几个个体T2在植物中,没有明确的证据表明这两个基因的表达与种子油成分的变化相关(图5).此外,由于油成分的变化CaFAD2-C3-沉默在个体T2-其中的植物CaFAD2-C1而且CaFAD2-C2未受影响,表达到野生型水平。
高C18:1的性状受数量性状位点控制,需要多个位点协同调控[21].之前的研究证明FAD2基因对这一性状起着至关重要的作用[9,38].此外,FAD3,FAE1和其他影响较小的位点可能是石油生物合成过程中建立高C18:1油藏所必需的[21,45].在本研究中,我们还研究了FAD3而且FAE1同时让CaFAD2基因。众所周知,FAD3而且FAE1均受脱落酸的调节[46].在此,我们发现的表达式FAE1是正相关的FAD3其中一个FAD2的基因,CaFAD2-C2(图5).这一发现与之前的研究一致,这些功能相关的基因(FAD3而且FAE1)在拟南芥和芸苔属植物显著[46,47].然而,目前还不清楚为什么会有另外两个CaFAD2基因没有表现出类似的共同调节FAD3而且FAE1.
的CaFAD2-C3基因是利用突变育种改良克兰伯油的靶基因
这里,我们展示一下CaFAD2-C3是主要的CaFAD2-基因参与测定克兰伯油中C18:1和PUFA含量(图5).胚组织是克兰伯种子贮藏油脂的主要部位,因此种子油脂的组成主要由胚油脂的组成决定。因此,CaFAD2-C3很可能是胚胎中脂肪酸合成的原因。另外两个基因,CaFAD2-C1而且CaFAD2-C2,可能会改变其他种室(如种皮和胚乳)的脂肪酸含量。例如在olive (齐墩果欧洲公司)、两个FAD2基因(OeFAD2-1而且OeFAD2-2)在种皮和胚两个种室中均有表达。这两个中的一个OeFAD2基因,表达OeFAD2-2与种皮中C18:2含量呈正相关,而与胚中C18:2含量无显著正相关[48].
结论
这一发现的突出作用CaFAD2-C3观察结果进一步证实了CaFAD2-C3沉默在个体T中没有恢复2具有野生型表达的植物CaFAD2-C2和- - - - - -C1分别。这一发现表明CaFAD2-C3可能为克兰伯油中C18:1和PUFA的显著变化提供重要的TILLING和突变育种的靶基因。
方法
植物材料
c . abyssinica简历。“卡拉狄加”之前是用RNAi结构转换的(水门事件)[29].的反向重复(IR)CaFAD2-C2编码序列(每个IR部分355个碱基对,97%相同CaFAD2-C196%是相同的CaFAD2-C3)采用种子特定启动子(Napin)(附加文件4).作为对照的植物被转化为不含脂肪酸生物合成基因的空结构体(pRCNG) [49].两个T0用这些细胞系来培养6个T1WG4-3、WG4-4、WG4-4、WG4-5、WG19-4、WG19-5和WG19-6在温度为22℃、光周期为16 h的温室条件下生长的植株/品系(WG4-3、WG4-4、WG19-5和WG19-6)1收集授粉后20dap发育的种子进行RNA分离,用于基因表达分析,收获成熟种子用于油成分分析。两个T的种子1用-系WG4-4和WG19-6制备T2植物。T .的嫩叶2-收集植物进行南方分析。结果表明,黄芪种子发育期(20dap)和成熟期(20dap)均有显著差异2分别采集-植物进行RNA分离和油成分分析。
定量反转录PCR (qRT-PCR)及数据分析
为了检测基因沉默的水平,单个crambe FAD2基因的表达,CaFAD2-C1,CaFAD2-C2而且CaFAD2-C3,单位为6t1(WG4-3, WG4-4, WG4-5, WG19-4, WG19-5和WG19-6)在5 - 10个发育种子(授粉后20天)上的表达量,并与对照(用空结构体转化的植物)的表达量进行比较。引物针对不同的crambeFAD2基因是根据它们在c . abyssinica简历。'Galactica ' (GenBank: JX964743, JX964744, JX964745),以及的引物FAD3而且FAE1是在AtFAD3(GenBank: 42570333)和crambeFAE1(基因库:60543786)。的基因β肌动蛋白2 (GenBank: 20465834)作为内参基因。qRT-PCR中使用的所有引物都列在附加文件中5.从块状种子中提取总RNA1——T2-植株(每T 5 ~ 10粒种子)1-plant和per T2-工厂,20 DAP)与RNeasy工厂迷你套件(Qiagen,德国)根据制造商的说明。用RNase-free TURBO DNase (Ambion, USA)处理分离的RNA以去除残留的基因组DNA。用iScript™cDNA Synthesis Kit (Bio-rad, USA)从1 μg总RNA中提取20 μl合成第一链cDNA,每个样品取1 μg RNA,以同样的方法处理,但不添加逆转录酶,作为阴性对照(RT-)。将cDNA稀释20倍,作为实时PCR模板。PCR反应含模板2 μl, SYBR Green Super Mix (Bio-rad, USA) 5 μl,正向引物和反向引物各1 μl (3 μM),共10 μl。循环条件为:在95°C下循环1次,持续3分钟,然后在95°C下循环30次,持续10秒,在60°C下循环1分钟,然后从65°C到95°C,每循环增加0.5°C,以监测特异性。PCR反应重复3次。每个重复的表达由内参基因归一化,β肌动蛋白2,在砷酸盐胁迫下的克兰伯幼苗中均有稳定表达芸苔属植物显著品种(47,50].根据比较CT法计算各重复的相对表达量(用户公告no.;2、ABI PRISM 7700序列检测系统,1997年12月;Perkin-Elmer,应用生物系统公司)。三次重复的平均值表示某一株系的相对表达量。
油品组成及相关性分析
采用气相色谱仪(GC,柱/DB-23, Agilent)提取克兰伯种子脂肪酸(FA),分析脂肪酸甲酯(FAMEs)。对于每个T1-plant 20,每个T2-plant每株分别采集10颗成熟种子进行脂肪酸提取。取单个种子荚果,在带螺旋盖的塑料管中粉碎,加入300 μl己烷和40 μl KOH (5 M)/甲醇,在60℃下涡流加热6 min,冷却至室温,3000 rpm离心5 min,上层用于气相色谱。提取液(1 μl)按1:20的比例注入气相色谱中,烘箱条件为180℃10 min,升温至240℃7 min,每min增加7.5℃。以20或10个单粒值的平均值计算各品系FA化合物的平均百分比。油菜种子中基因表达及油分组成的研究进展2代进行相关分析。对这些数据进行绘制,并运行Pearson相关来确定与R包的相关性[51].
南部的分析
从T幼叶中分离出基因组DNA2用奥尔德里奇和卡利斯所描述的方法[52],但在DNA提取缓冲液中加入1% (w/v)聚乙烯吡咯烷酮-10。设计了686个碱基对的探针nptII基因,并标记为[32P] ATP。用于nptII探针制备的引物在附加文件中列出5.
拷贝数测定用40 μg提取的DNA过夜消化半径标注I是一种酶,在探针序列之外的位置切割T-DNA,在0.8%琼脂糖凝胶上进行分离,并根据制造商的建议转移到Hybond N +膜(Amersham Biosciences, UK)。杂交和可视化的过程如Cheng等所述。[32].
参考文献
- 1.
Mastebroek H, Wallenburg S, Van Soest L:梭鲈(crambe abysensis Hochst)农艺性状的变异。薯条交货)。工业作物学报,1994,2(2):129-136。10.1016 / 0926 - 6690(94) 90094 - 9。
- 2.
杨晓明,王志刚,王志刚,王志刚,王志刚,王志刚:脂肪酸延长酶1 (FAE1)基因的克隆与功能鉴定。植物生态学报,2007,26(5):636-645。10.1111 / j.1467-7652.2007.00268.x。
- 3.
Falasca S, Flores N, Lamas M, Carballo SM, Anschau A:一种几乎不为人知的作物,在阿根廷有希望生产生物柴油。水利水电学报,2010,35(11):5808-5812。10.1016 / j.ijhydene.2010.02.095。
- 4.
郭培生,郭志强,陈志强,陈志强:新型油料作物加工的经济评价。石油学报,2004,29(3):357 - 357。10.1007 / BF02517964。
- 5.
Carlsson A, Clayton D, Salentijn E, Toonen M, Stymne S, Dyer W, Bowles D:工业用油料平台。EPOBIO项目的产出。纽伯里:约克:CPL出版社;2007:146 -
- 6.
王友平,吕鹏:芸苔属与深海蓝蘑属间杂交。生态学报,1998,16(1):1-7。10.1023 /: 1018384130269。
- 7.
萨内蒂F, Vamerali T,博纳S,莫斯卡G:我们能在南欧“培育”芥酸吗?作物学报,2006,1(1):3-10。
- 8.
Jadhav A, Katavic V, Marillia EF, Michael Giblin E, Barton DL, Kumar A, Sonntag C, Babic V, Keller WA, Taylor DC:通过内源FAD2基因的共同抑制和反义抑制,芥酸水平升高。工程学报,2005,7(3):215-220。10.1016 / j.ymben.2005.02.003。
- 9.
杨强,范超,郭忠,秦娟,吴娟,李强,付涛,周勇:甘蓝型油菜基因组FAD2和FAD3基因的鉴定及高油酸和低亚麻酸等位基因特异性标记的开发。应用数学学报,2012,29(4):715-729。10.1007 / s00122 - 012 - 1863 - 1。
- 10.
Ma F, Hanna Ma:生物柴油生产综述。生物技术学报,2004,27(1):1-15。10.1016 / s0960 - 8524(99) 00025 - 5。
- 11.
Pham AT, Shannon JG, Bilyeu KD: FAD2和FAD3基因突变组合制备高油酸和低亚麻酸大豆油。应用数学学报,2012,29(3):344 - 344。10.1007 / s00122 - 012 - 1849 - z。
- 12.
Ohlrogge JB:植物新产品设计:脂肪酸代谢工程。植物营养学报,2004,27(3):344 - 344。
- 13.
脂质生物合成。植物生理学报,2004,27(3):379 - 379。
- 14.
Barret P, Delourme R, Renard M, Domergue F, Lessire R, Delseny M, Roscoe T:油菜FAE1基因连接到与芥酸含量变化相关的E1位点。应用理论与实践。1998,16(2):377 - 377。10.1007 / s001220050725。
- 15.
Rossak M, Smith M, Kunst L: FAE1基因在拟南芥种子发育过程中的表达及启动子活性。植物分子生物学,2001,46(6):717-725。10.1023 /: 1011603923889。
- 16.
Blacklock BJ, Jaworski JG:膜结合3 -酮酰基辅酶a合酶底物特异性影响因素的研究。中国生物医学工程学报,2002,26(4):489 - 498。10.1046 / j.1432-1033.2002.03176.x。
- 17.
萨拉斯JJ, Martínez-Force E, Garcés R:葵花籽中超长链脂肪酸的合成。食品化学学报,2005,53(7):2710-2716。10.1021 / jf047939e。
- 18.
Miquel M:缺乏多不饱和脂肪酸合成的拟南芥突变体:植物油酰-磷脂酰胆碱去饱和酶的生化和遗传特征。中国生物医学工程学报,2002,26(3):344 - 344。
- 19.
Löhden I, Frentzen M:质体酰基载体蛋白的作用:甘油3-磷酸酰基转移酶和酰基酰基载体蛋白水解酶在引导酰基通量通过原核和真核途径。植物学报,1998,26(4):366 - 366。10.1007 / BF00397657。
- 20.
王志强,王志强,王志强,等:甘蓝型油菜可塑性乙酰辅酶a羧化酶的酶学研究。自然科学进展,2012,29(3):357 - 357。10.1073 / pnas.1204604109。
- 21.
关敏,李霞,关春:甘蓝型油菜高、低油酸品系差异表达基因的芯片分析。植物细胞学报,2012,31(5):929-943。10.1007 / s00299 - 011 - 1213 - 9。
- 22.
刘强,孙晓明,王晓明,王晓明等:利用发夹rna介导的转录后基因沉默制备高硬脂和高油酸棉籽油。中国生物医学工程学报,2002,29(4):344 - 344。10.1104 / pp.001933。
- 23.
Sivaraman I, Arumugam N, Sodhi YS, Gupta V, Mukhopadhyay A, Pradhan AK, Burma PK, Pental D: fad2基因反义抑制零芥酸芥菜系高油酸和低亚油酸转基因的发育。生物育种,2004,13(4):365-375。
- 24.
Wesley SV, Helliwell CA, Smith NA, Wang MB, Rouse DT, Liu Q, Gooding PS, Singh SP, Abbott D, Stoutjesdijk PA:植物高效、高效、高通量基因沉默的构建设计。植物学报,2001,27(6):581-590。10.1046 / j.1365 - 313 x.2001.01105.x。
- 25.
Rathore KS, Sundaram S, Sunilkumar G, Campbell LM, Puckhaber L, Marcel S, Palle SR, Stipanovic RD, Wedegaertner TC:超低棉酚棉籽:种子特异性的世代稳定性,rnai介导的表型和种子萌发后萜类特征的恢复。植物学报,2012,10(2):174-183。10.1111 / j.1467-7652.2011.00652.x。
- 26.
彭强,胡勇,魏睿,张勇,管超,阮勇,刘超:同时沉默FAD2和FAE1基因对甘蓝型油菜籽粒油酸和芥酸含量的影响。植物细胞学报,2010,29(4):317-325。10.1007 / s00299 - 010 - 0823 - y。
- 27.
李欣,Ahlman A,闫欣,Lindgren H,朱lh:油料作物黑栗的遗传转化。植物学报,2010,30(2):379 - 379。10.1007 / s11240 - 009 - 9630 - y。
- 28.
Chhikara S, Dutta I, Paulose B, Jaiwal PK, Dhankher OP:农杆菌介导的工业油料作物“BelAnn”稳定转化方法的开发。工业作物学报,2012,37(1):457-465。10.1016 / j.indcrop.2011.07.021。
- 29.
李霞,Van Loo EN, Gruber J,樊俊,关r, Frentzen M, Stymne S,朱lh:工业油料作物黑栗中超高芥酸油的开发。植物学报,2012,10(7):862-870。10.1111 / j.1467-7652.2012.00709.x。
- 30.
Gómez-Galera S, Twyman RM, Sparrow PAC, Van Droogenbroeck B, Custers R, Capell T, Christou P:田间试验与磨难——理解欧洲转基因作物试验性田间试验的规定。植物学报,2012,10(5):511-523。10.1111 / j.1467-7652.2012.00681.x。
- 31.
莱斯曼K,迈耶V:克兰贝作为油源的农艺评价。作物科学,2002,12(2):224-227。10.2135 / cropsci1972.0011183X001200020024x。
- 32.
程杰,黄波,Krens F, Dechesne A, Visser R, Van Loo E:异源六倍体油料作物-6脂肪酸去饱和酶(FAD2)基因家族的分离与鉴定。生物育种,2013,32(3):517-531。10.1007 / s11032 - 013 - 9886 - 0。
- 33.
McCallum CM, Comai L, Greene EA, Henikoff S:诱导突变的靶向筛选。生物技术学报,2000,18(4):455-457。10.1038/74542。
- 34.
陈玲,黄玲,闵东,王山,马德威克,胡永刚:普通面包小麦TILLING新群体的发育与性状分析。PLoS ONE。2012, 7 (7): e41570-10.1371/journal.pone.0041570。
- 35.
Slade AJ, McGuire C, Loeffler D, Mullenberg J, Skinner W, Fazio G, Holm A, Brandt KM, Steine MN, Goodstal JF,等:TILLING对高直链淀粉小麦发育的影响。BMC植物生物学。2012, 12(1): 69-10.1186/1471-2229-12-69。
- 36.
Auld DL, Heikkinen MK, Erickson DA, Sernyk JL, Romero JE:多不饱和脂肪酸水平降低和油酸水平增加的油菜突变体。作物科学。1992, 32(3): 657-662。10.2135 / cropsci1992.0011183X003200030016x。
- 37.
Pham AT, Lee JD, Shannon JG, Bilyeu K: FAD2-1A和FAD2-1B突变等位基因组合产生高油酸种子油性状的大豆。BMC植物生物学。2010, 10(1): 195-10.1186/1471-2229-10-195。
- 38.
Pham AT, Lee JD, Shannon JG, Bilyeu KD:在大豆植物引种中发现的一个新的FAD2-1 A等位基因为生产85%油酸含量的大豆籽油提供了一种替代手段。应用物理学报,2011,29(5):793-802。10.1007 / s00122 - 011 - 1627 - 3。
- 39.
Tanhuanpää P, Vilkki J, Vihinen M:油菜油酸FAD2基因的定位和克隆,建立油菜油酸等位基因特异性PCR。鉴定)。生物育种,1998,4(6):543-550。10.1023 /: 1009642317634。
- 40.
Beló A,郑萍,Luck S, Shen B, Meyer DJ, Li B, Tingey S, Rafalski A:全基因组扫描检测玉米fad2等位变异与油酸水平升高有关。中国生物医学工程学报,2008,39(1):1-10。10.1007 / s00438 - 007 - 0289 - y。
- 41.
Lynch M, Conery JS:重复基因的进化命运和后果。科学通报,2000,29(4):344 - 344。10.1126 / science.290.5494.1151。
- 42.
王王N, Y,田F,国王GJ,张C,长Y, L,孟J:芸苔属植物的功能基因组学资源显著:EMS诱变处理人口发展和发现FAE1点突变的耕作。生态学报,2008,18(4):751-765。10.1111 / j.1469-8137.2008.02619.x。
- 43.
火A: rna触发的基因沉默。植物学报,1999,15(9):358-363。10.1016 / s0168 - 9525(99) 01818 - 1。
- 44.
李娟,谢甫琴科O,梅兰R,马C,斯金纳JS,施特施特斯SH:利用RNAi抑制田间杨树转基因基因的有效性和稳定性。转基因研究。2008, 17(4): 679-694。10.1007 / s11248 - 007 - 9148 - 1。
- 45.
Jagannath A, Sodhi YS, Gupta V, Mukhopadhyay A, Arumugam N, Singh I, Rohatgi S, Burma PK, Pradhan AK, Pental D:消除芥酸编码位点的表达可以识别出“隐藏的”QTL,有助于芥菜(印度芥菜)的油质组分和含油量。应用理论,2011,22(6):1091-1103。10.1007 / s00122 - 010 - 1515 - 2。
- 46.
王晓明,王晓明,王晓明,王晓明,等:拟南芥种子灌浆过程中基因表达的对位网络研究。植物学报,2002,14(6):1191-1206。10.1105 / tpc.000877。
- 47.
胡艳,吴刚,曹颖,吴艳,肖玲,李霞,陆超:转录本谱分析在甘蓝型油菜种子发育中的育种响应。生物化学学报,2009,10(1):49-10.1186/1471-2199-10-49。
- 48.
D’angeli S, Falasca G, Matteucci M, Altamura MM:油橄榄核果冷驯化过程中种皮和胚的冷感知及基因表达差异。植物学报,2013,197(1):123-138。10.1111 / j.1469-8137.2012.04372.x。
- 49.
Schaart JG, Krens FA, Pelgrom KTB, Mendes O, Rouwendal GJA:利用诱导位点特异性重组和双功能选择标记基因有效生产无标记转基因草莓植株。植物生态学报,2004,2(3):344 - 344。10.1111 / j.1467-7652.2004.00067.x。
- 50.
杨晓明,王晓明,王晓明,等。砷胁迫下黑桫椤的基因表达谱分析。BMC植物生物学。2010, 10(1): 108-10.1186/1471-2229-10-108。
- 51.
R:一种用于统计计算的语言和环境。奥地利维也纳:R统计计算基金会;2012: isbn 3-900051-07-0, urlhttp://www.R-project.org/
- 52.
Aldrich J, Cullis CA:亚麻的RAPD分析:利用klen Taq 1 DNA聚合酶、chelex 100和基因组DNA凝胶纯化优化产量和重现性。植物摩尔生物学报告,1993,11(2):128-141。10.1007 / BF02670471。
确认
这项工作得到了欧盟项目ICON(为新型化学品生产附加值油的工业作物)的支持,并得到了荷兰研发项目生物基础经济(Kennis基础生物基础经济)的共同资助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
JC、EMJS和ENVL设计了实验。JC进行表达分析,撰写稿件初稿;EMJS进行了南方分析并修改了手稿。LHZ和JG提供了转基因植物并对稿件进行了评论。ACD和WQ进行气相色谱分析。BH, FAK和RGFV说服了这项研究,并参与了对草稿的修改。所有作者都阅读并批准了最终的手稿。
电子辅助材料
单粒种子中C18:1 (A)和PUFA (B)的含量
附加文件1:1植物。对于每株植物,测量了大约20颗种子。一个点代表一颗种子。(png 489 kb)
T基因拷贝数的测定
附加文件2:2植物的c . abyssinica根据南方的分析。与印迹膜杂交(32页)atp标记的nptII探针。WG19-6家族有4或5个转基因插入,WG4-4家族有1个转基因插入。弄1-12:WG19-6-17;WG19-6-14;WG19-6-13;WG19-6-11;WG19-6-10;WG19-6-9;WG19-6-8;WG19-6-7; WG19-6-5; WG19-6-4; WG19-6-2; WG19-6-1. Lane 13–17: WG4-4-13; WG4-4-10; WG4-4-5; WG4-4-3; WG4-4-1. Lane C1-C2: two wild-type controls. (JPEG 22 KB)
油分组成(C18:1 vs. PUFA)的变化曲线
附加文件3:2WG4-4、WG19-6科植物及对照(CTRL)。每个点代表T的一个种子2——厂房。(jpeg32 kb)
RNAi结构的T-DNA区域示意图(未按比例)。
附加文件4:LB和RB,分别是T-DNA左缘和右缘。Napin启动子,种子特异性启动子芸苔属植物显著.Gateway蛋白BP反应中用到的attB1和attB2位点®.CaFAD2-IF和CaFAD2-IR分别为crambe FAD2-C2序列正反向的355个碱基对反向重复序列,序列与基因相同CaFAD2-C1,C2和- - - - - -C3分别是96%,99%和96%nptII,新霉素磷酸转移酶II基因。折线代表发夹RNA中形成茎的序列。箭头表示用npt II探针(686碱基对)进行杂交。(png 78 kb)
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
程杰,朱,刘。,萨伦廷,E.M.et al。omega-6脂肪酸去饱和酶的功能分析(CaFAD2)油籽作物的基因家族海甘蓝abyssinica.BMC植物生物学13日,146(2013)。https://doi.org/10.1186/1471-2229-13-146
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-13-146
关键字
- 海甘蓝abyssinica
- 脂肪酸去饱和酶2
- 石油产量
- 油酸
- 多不饱和脂肪酸
- RNAi
- 基因表达