摘要
背景
在植物中,类胡萝卜素是C13-诺异戊二烯类,一组异胡萝卜素类化合物,具有多种生物功能。类胡萝卜素裂解双加氧酶(CCD)家族成员催化的类胡萝卜素酶裂解已被证明能在一系列植物物种中产生许多工业上重要的挥发性风味和芳香类异胡萝卜素,包括β-伊诺酮、香叶酮、假伊诺酮、α-伊诺酮和3-羟基-β-伊诺酮。异胡萝卜素有助于许多葡萄酒品种的花和果味属性,因此,至少部分地,负责“品种特征”。尽管它们在葡萄和葡萄酒中很重要;类胡萝卜素的裂解活性仅被描述为VvCCD1,类胡萝卜素分解代谢的机制和调节仍不清楚。
结果
三个葡萄衍生的ccd编码基因已被分离出来,并显示具有独特的底物切割能力。我们的研究结果表明,VvCCD4a和VvCCD4b催化线性和环状类胡萝卜素底物的裂解。的表达VvCCD1,VvCCD4a而且VvCCD4b在叶、花和整个浆果发育过程中均有检测到。VvCCD1表达是构成性的,而VvCCD4a表达主要在叶片和VvCCD4b在浆果。一个有12倍变异范围的转基因群体VvCCD1表达之间缺乏相关性VvCCD1叶片中类胡萝卜素底物和/或异胡萝卜素产物的表达在足底在光合活性组织中,VvCCD1的功能与在体外活动展示。VvCCD4a和VvCCD4b的分离和功能特征确定了另外两个在葡萄中具有功能的ccd。
结论
综上所述,我们的研究结果表明,这三种ccd受到不同水平的控制,包括基因表达(空间和时间)、底物特异性和区隔化,它们分别和/或协调作用,以维持植物中的类胡萝卜素和挥发性异胡萝卜素水平。改变表达VvCCD1在一个转基因葡萄种群中说明了在体外酶活性和在足底这种酶的活性,从而有助于理解酶降解类胡萝卜素在光合作用中是如何发生的。VvCCD4a和VvCCD4b的鉴定和功能特征表明,这些酶主要负责催化塑料类胡萝卜素的裂解。
背景
类胡萝卜素是疏水的40类异戊二烯色素在自然界中普遍存在。在高等植物中,类胡萝卜素通常与质体的光合膜有关,特别是在叶绿体中,它们参与了许多光化学反应。在叶绿体中,类胡萝卜素主要作为光收集天线复合体的辅助色素,还通过猝灭自由基和防止细胞的光氧化损伤来协助光保护。叶绿体中的类胡萝卜素通常不是在水基质中“游离”的,而是结合在类囊体(粒)膜内不同的色素-蛋白质天线复合体中[1].
类胡萝卜素的定位和组成在逆境(如叶黄素循环)和质体转变/分化过程中发生变化:叶绿体向染色体质体转变(如发生在一些水果和花中)或叶绿体向老年质体转变(如发生在衰老过程中)[2].在植物中参与类胡萝卜素生物合成的基因和酶受到了广泛关注,其保守途径的特征相对较好(综述在[3.,4]);类似的,类胡萝卜素代谢途径的基因和酶诉酿酒用葡萄已在前面描述过[5,6].
类胡萝卜素裂解二氧合酶(CCD)酶家族有助于类胡萝卜素的定向酶促生产。异胡萝卜素及其衍生代谢物具有多种生物学作用(见[7])。在拟南芥已鉴定出九种不同的ccd [8].五个的拟南芥CCDs (NCED2, NCED3, NCED5, NCED6和NCED9)催化脱落酸(ABA)生物合成的第一步[9].剩下的四个拟南芥该蛋白家族的成员(CCD1, CCD4, CCD7和CCD8)具有更多样化的活性,并在特定的双键位置催化各种类胡萝卜素底物的裂解。CCD7和CCD8催化的序列裂解参与了枝分枝抑制激素独角内酯的形成[10].CCD1-和ccd4催化的裂解可产生多种风味和香气化合物[11].
CCD1的同源物高度相似,是CCD酶家族中唯一被预测具有胞质(而非质体)定位的成员[8].正交物已被证明能催化各种类胡萝卜素的对称裂解在体外在5,6(5 ',6 ')和9,10(9 ',10 ')双键位置产生了广泛的挥发性C13-norisoprenoids。这些carotenoid-derived C13-类诺异戊二烯存在于许多植物的花、果实和叶子中[12,13],被认为是风味和香气化合物,通常显示非常低的检测阈值。由于他们的贡献,水果和花香品种的葡萄酒感知;C13-类降异戊二烯在酿酒葡萄中引起了广泛的兴趣([14- - - - - -16,并在[17])。以前的尝试是通过对CCD1转录水平的转基因操作来确定CCD1在植物中的作用茄属植物lycopersicum(在番茄果实中)[18];Medicago truncatula(在菌根中)[19];而且栽培稻(在水稻胚乳中)[20.].这些研究表明观察到的在体外CCD1的功能(即催化类胡萝卜素对称的9,10(9,10’)氧化裂解)可能不是它唯一的生物作用在足底其他基因可能编码酶,这些酶主要负责催化质体中的裂解反应[21].
迄今为止,CCD4的同源物只在被子植物(开花植物)中被发现,CCD4酶活性的特征表明,CCD家族的这些成员有助于水果和花的类胡萝卜素衍生的风味和香气。亚细胞定位研究答:芥[22),番红花(藏红花)[23]已经证明了酶是专门针对质体内的质体球蛋白的。不同于CCD1同源物的胞质定位;CCD4本地化使其能够获得类胡萝卜素底物[24].CCD4酶通常以两种异构体出现:CCD4a和CCD4b,它们之间有一定的相似性,在植物中有不同的表达模式和潜在的不同功能。根据来自不同植物的报告,CCD4酶的特定酶活性似乎没有共识。
虽然CCD1和CCD4酶催化类胡萝卜素在相同双键位置的裂解;CCD4酶被认为是底物特异性的,而CCD1酶通常被描述和证明其底物偏好更混杂[25].黄的研究et al。[11]得出结论,CCD4s不能催化线性类胡萝卜素(如番茄红素和独联体-ξ-胡萝卜素),或含有羟基的类胡萝卜素(如玉米黄质和叶黄素),因此目前的假设是CCD4同源物催化环非极性类胡萝卜素裂解(如β-胡萝卜素)。
通过鉴别、分离和描述小道消息CCDS基因被认为与风味和香气相关的异胡萝卜素产生有关,目前的工作旨在阐明这些基因和它们各自的酶在葡萄中的生物学作用。本研究报道了CCD1, CCD4a和ccd4b编码基因的分离葡萄l .简历别具一格。通过测定其在葡萄藤中的表达模式和功能,对其进行了鉴定。通过分析异源类胡萝卜素裂解后形成的挥发性异胡萝卜素来描述其功能大肠杆菌(细菌)系统。此外,转基因葡萄(诉酿酒用葡萄l .简历。的表达改变VvCCD1(上调和下调)在基因和表型上产生和表征。采用高效液相色谱和气相色谱/质谱联用技术对转基因苏达娜株系叶片组织进行了分析,分别检测和定量了类胡萝卜素和挥发性异胡萝卜素。
方法
在网上分析
国家生物技术信息中心(NCBI) Entrez检索系统用于从Genbank数据库(http://www.ncbi.nlm.nih.gov/gquery).对Genbank数据库中的序列进行比对使用相关的Blast算法(http://www.ncbi.nlm.nih.gov/BLAST/) [26].比较基因组学(即基因结构预测和同源物/正交物检索)通过PLAZA (http://bioinformatics.psb.ugent.be/plaza/) [27].
使用ProtComp Version 8.0 (http://www.softberry.com/berry.phtml).诉酿酒用葡萄表达序列标签(ESTs)从美国基因组研究所(TIGR)葡萄基因索引(http://compbio.dfci.harvard.edu/tgi/)或NCBI。的诉酿酒用葡萄基因组序列从NCBI或Genoscope (http://www.cns.fr/externe/GenomeBrowser/Vitis/).用Clustal Omega (http://www.ebi.ac.uk/tools/msa/clustalo/),以及用MEGA [28].
植物材料
用于基因分离、天然表达分析和色素分析的葡萄材料取自田间种植的葡萄葡萄l .简历。在Welgevallen实验农场(Stellenbosch,南非)的皮诺塔奇。采集绿色、véraison和成熟的浆果,以及完全展开的叶子和成熟的花材料,在液氮中快速冷冻。冷冻的组织在液氮中均质,如果不立即使用,则保存在-80°C。
转基因植物被安置在温室中,每3周在添加了硝基溶胶的商业土壤混合物中生长。对完全展开的叶片组织(叶片位置3和4)的组织进行基因表达、色素浓度和挥发性成分分析。叶片在收获后立即在液氮中快速冷冻,并在-80°C的黑暗中保存。对照植株采用与转基因植株相同的组织培养、硬化和玻璃房条件和程序。
核酸的分离、提取和操作
从完全展开的基因组DNA中分离出高分子量的基因组DNA诉酿酒用葡萄正如斯廷坎普所描述的et al。[29].按照Reid描述的方法从不同的葡萄叶子中提取总RNAet al。[30.].除非另有说明,所有用于质粒DNA分离、DNA片段的操作和克隆以及琼脂糖凝胶电泳的标准方法均如Sambrook所述et al。[31].
总cDNA由1 μg DNase i处理的总RNA (Promega, Madison, WI)合成,使用Superscript III铂第一链合成系统(Invitrogen),反应体积为20 μL,如供应商所述。
菌株,培养基,生长条件和转化
大肠杆菌(DH5α和TOP10F)和根癌土壤杆菌(EHA105)培养在LB培养基(1.2% (w/v)色氨酸、1.2% (w/v) NaCl和0.6% (w/v)酵母提取物)中培养。使用Sambrook中描述的热休克方法进行细菌转化et al。[31].在LB板上用适当的抗生素进行筛选。培养假定的阳性菌落,分离其质粒并通过限制性消化验证。除非另有说明大肠杆菌培养在37°C和农文化在30°C。
质粒、克隆和细菌转化
用于进行功能互补试验的类胡萝卜素积累菌株来自F. X. Cunningham(美国马里兰大学细胞生物学和分子遗传学系),并在Cunningham [4),坎宁安et al。[32,33].
引物对VvCCD1_5 '和VvCCD1_3 '用于扩增VvCCD1基因诉酿酒用葡萄l .简历。Pinotage cDNA(附加文件1).用引物对VvCCD4a_5 ', VvCCD4a_3 '和VvCCD4b_5 ', VvCCD4b_3 '进行扩增VvCCD4a而且VvCCD4b从诉酿酒用葡萄l .简历。Pinotage cDNA(附加文件1).根据供应商(Promega)的规格,将合成的PCR扩增子克隆到pGEM-T Easy载体系统中,生成质粒pGEMt-VvCCD1、pGEMt-VvCCD4a和pGEMt-VvCCD4b2).
为了构建用于细菌功能互补的质粒,从pGEMt-VvCCD1中切除1715 bp的VvCCD1编码区濒死经历信用证太平洋标准时间I片段,克隆到pTWIN1的相应位点,生成pTWIN1- vvccd1。从pGEMt-VvCCD4a中切除1722 bp的VvCCD4a编码区濒死经历信用证BglII片段并克隆成兼容的濒死经历l/ BampTWIN1的HI位点生成pTWIN1- vvccd4a。从pGEMt-VvCCD4b中切除1770 bp的VvCCD4b编码区濒死经历l/ BamHI片段并克隆到pTWIN1的相应位点,生成pTWIN1- vvccd4b(附加文件2).
二元向量pART27用于过表达和沉默结构[34].将1715 bp的VvCCD1编码区从pGEMt-VvCCD1中切除萨尔我/Spe我的碎片和克隆成兼容Xho我/XbaI位点pART7生成pART7- vvccd1。表达盒用不I和克隆到pART27的相应位点,生成pART27- vvccd1。
pHANNIBAL载体用于构建VvCCD1 RNAi/沉默载体[35].pcr扩增了该基因3′非翻译区(UTR)的148 bp片段VvCCD1从诉酿酒用葡萄L. cv Pinotage基因组DNA使用引物对VvCCD1_RNAi_5 '和VvCCD1_RNAi_31).使用pGEM®-T Easy载体系统根据供应商(Promega)的规格克隆PCR扩增子,生成pGEM - ccd1 (RNAi)质粒。136年英国石油公司Xho我和生态从pGEMt-CCD1(RNAi)中分离出RI片段,连接到相应的RNAi中Xho我和生态国际扶轮网站在pHANNIBAL。合成的质粒随后用Bam你好,XbaI和148 bpBam你好,XbapGEMt-CCD1(RNAi)的I片段被连接到相应的位点。合成的质粒phannial - ccd1 (RNAi)包含一个148 bp的3 ' -UTR的反向重复VvCCD1.从phannial - ccd1 (RNAi)中取出表达盒不我,与结扎成对应不第27部分是期末考试的考点VvCCD1沉默载体,pART27-CCD1(RNAi)(附加文件2).
葡萄的改造与再生
的体细胞胚性培养诉酿酒用葡萄l .简历。以小苏娜为原料进行遗传转化实验。根据Vasanth和Vivier [36].基因转化方案基本上是根据弗兰克斯的et al。[37],并进行一些修改,以使用液体培养作为起始材料(如Vasanth和Vivier所述[36])。简单地说,根癌土壤杆菌取含有过表达载体或沉默载体的细胞,以5000转/分离心10分钟,重悬于含18.5 μg.mL的NN液体培养基中-1麦芽糖到最终过量6000.8。Acetosyringone(19.7毫克。l-1)加入农菌悬液中,然后加入2 mL体细胞胚性细胞悬液,静置15分钟,在此期间轻轻摇动3 ~ 5次。培养物经过过滤除去多余的液体,用无菌的Whatman no吸干愈伤组织。1滤纸。在添加BAP (0.25 μg.mL)的NN固体培养基上,27℃,黑暗条件下共培养2天-1), NOA (1.0 μg.mL-1)和乙酰丁香酮(19.7 μg.mL-1).然后用含卡菌西林(200 μg.mL)的无菌NN培养基洗涤胚胎-1),用消毒过的滤纸吸干,并按弗兰克议定书处理等.[37].卡那霉素的选择(100 μg.mL)-1),直至在体外得到生根的植株,然后在温室中硬化。
印迹分析
从葡萄叶中提取10 ~ 20 μg基因组DNA进行Southern blot分析。DNA被消化了SpeI,在0.8% (w/v) TBE琼脂糖凝胶中分离,并转移到由供应商(Amersham-Pharmacia Biotech,白金汉郡,英国)描述的带正电的Hybond-N尼龙膜上。根据供应商(德国曼海姆罗氏诊断公司)的规范,使用生物素非放射性核酸标记和检测系统进行探针标记、杂交和生物素检测。
表达式的分析VvCCDs
引物用于qRT-PCR表达分析VvCCD1, VvCCD4a, VvCCD4b, VvCCD4c, VvCCD4d, VvCCD7而且VvCCD8使用Primer Express 3.0(应用生物系统)进行设计(附加文件1).的诉酿酒用葡萄延伸因子1α (VvEF1α)被选为“管家”基因,根据里德的发现来规范基因表达et al。[30.)和Guillaumieet al。[38];相对表达分析VvCCD基因家族分别在3个不同的浆果发育阶段进行了研究,分别对应蓝莓的青莓期、vérasion莓期和成熟莓期诉酿酒用葡萄l .简历别具一格。
表达式的分析VvCCD1通过qRT-PCR对转基因葡萄种群进行了类似的检测。葡萄甘油醛-3-磷酸脱氢酶(VvGAPDH)基因被用作“管家”基因,以规范基因表达。的表达VvGAPDH已被证明在葡萄藤浆果中相对不变[30.].引物被设计用来评估总数VvCCD1表达(即内源性和转基因衍生的表达),以及仅从转基因衍生的表达VvCCD1(附加文件1).
采用Applied Biosystems 7500 Real-time PCR系统进行实时PCR。KAPA SYBR®FAST qRT-PCR试剂盒按照制造商(KAPA生物系统公司,南非开普敦)的说明使用。PCR反应程序为:50°C 2分钟;95°C 10分钟;在95°C和58°C分别为15秒和60秒的40个循环。使用Applied Biosystems SDS软件(1.4版本)对数据进行分析。所有PCR反应都包含至少3个技术重复。相对表达式的计算采用Pfaffl [39]:
(E为PCR效率,CP为荧光过基线的周数)。
细菌顶隙中挥发性异胡萝卜素的功能互补与测定
基于Lücker中描述的方法,从细菌培养物中提取和分析挥发性异胡萝卜素et al。[40].为清晰起见,详细描述了该方法及相关修改。将pTWIN1-VvCCD1、pTWIN1-VvCCD4a和pTWIN1-VvCCD4b质粒引入到类胡萝卜素积累中大肠杆菌菌株。空向量pTWIN1被用作阴性对照。在LB培养基中培养过夜(5 mL)至饱和,接种含有适当抗生素(100 μg.mL)的32 mL LB-134岁的氨苄青霉素μg.mL-1氯霉素和12.5 μg.mL-1四环素)直到过量600海里达到了0.1。培养物在黑暗中孵育,在室温下轻轻摇晃直到OD600海里达到了0.6。为了防止进一步产生彩色类胡萝卜素,将抑制剂二苯胺(DPA)添加到最终浓度为100 μM(如Cunningham和Gantt [41),然后在室温下在黑暗中再培养两小时。在与抑制剂孵育两小时后,将32ml培养物中的8 mL取出并速冻用于类胡萝卜素分析;收集剩下的24 mL培养物用于异花红素分析。为了进行异花红素分析,将细胞重悬在6 mL含有适当抗生素的LB中,0.1 mM异丙基-β- d -巯基半乳糖吡喃苷(IPTG)和1ppm α-萜烯醇(作为内标,IS)。另外加入6 mM抗坏血酸盐,5 μM硫酸亚铁,200 U/mL过氧化氢酶,如Baldermann所述et al。[42]在体外CCD1酶化验。随后将培养物转移到20 ml的SPME小瓶中。小瓶密封采用双金属®卷曲密封,20毫米硅胶/聚四氟乙烯(PTFE)间隔(棕色色谱用品,Wertheim,德国)。样品在黑暗中孵育,在室温下轻轻摇动16小时。16小时后,去除1 mL培养物,检测OD600海里在剩余的5ml培养基中加入5ml的5m NaCl进行挥发性异花红素的提取。
HS-SPME从细菌培养物中提取挥发性异胡萝卜素,使用配备了SPME选项的CTC CombiPal自动采样器(CTC Analytics,瑞士)。萃取条件如下:在50°C培养2分钟后,通过将二乙烯苯/羧基/聚二甲基硅氧烷(DVB/CAR/PDMS) SPME纤维(Supelco, Bellefonte, PA)暴露于顶空,在恒定搅拌下进行15分钟的SPME萃取。随后纤维被解吸,随后用分裂/不分裂注射器将分析物注入气相色谱柱,在240°C操作,不分裂2分钟。纤维在注入器中停留20分钟,270°C,在60 mL/min的吹扫流量下对纤维进行调理。化合物分离在DB-FFAP柱(60 m × 0.25 mm × 0.5 μm)上完成,使用Agilent 6890气相色谱仪与Agilent 5975C质谱(MS)耦合(Agilent Technologies, Little Falls, Wilmington, USA)。通过柱的氦载气流量为1.2 mL/min,烤箱编程从40°C(保持5分钟),从10°C/min上升到230°C(保持2分钟),post运行在240°C(保持2分钟)。总运行时间为30分钟。
MS使用选择离子监测(SIM)在电子冲击(EI)模式(70 eV)下运行,同时获取扫描数据。在SIM模式下检测的m/z片段为α-萜烯醇(IS)(59, 93, 136)、6-甲基-5-庚烯-2-酮(MHO)(69, 111, 126)、香叶酮丙酮(69,136,121)、α-艾奥酮(121,136,192)、β-艾奥酮(136,177,192)和伪艾奥酮(81,109,135)。通过与真实标准和NIST2005质谱库(美国国家标准协会)的保留时间比较来进行化合物鉴定。感兴趣的峰值用真实标准的外部标准曲线进行量化。数据归一化到内标浓度(α-萜烯醇)和外径600HS-SPME分析前的细菌培养。
叶片光合色素和挥发性异胡萝卜素的化学分析
用Lashbrooke中描述的方法分析了叶片的光合色素et al。[43].
按照Lücker描述的方法提取叶片挥发物et al。[40与修改)。冷冻后,将研磨好的叶组织(200 mg)置于20 mL SPME瓶中,10 mL含160 ng 3-辛醇的20% (w/v) NaCl(作为内标,IS)。小瓶用聚四氟乙烯/硅隔膜密封。将密封的SPME小瓶中的样品加热到80°C并培养5分钟,然后将注射针穿过隔膜,将二乙烯苯/羧基/聚二甲基硅氧烷(DVB/CAR/PDMS) 50/30 μm包覆固相微萃取(SPME)纤维(Supelco, Belfonte, PA, USA)暴露到样品的顶空。在提取过程中,样品以500转/分搅拌,并保持在80°C。15分钟后,纤维被取出并注入气相色谱入口,在260°C下解吸10分钟。
提取液分析使用Agilent 6890气相色谱仪耦合Waters GCT飞行时间(TOF)质谱(MS) (Waters Corporation, Milford, MA, USA)分析数据使用Waters Masslynx GC/MS工作站软件。将注入口加热至260°C,采用无分流注入(清洗时间为3分钟)。分离在HP5MS(安捷伦技术公司,帕洛阿尔托,加利福尼亚州)色谱柱上进行(30 mL × 0.25 mm i.d × 0.25 μm f.t),以氦气作为载气,恒定流量为1 mL.min-1.初始烘箱温度为40℃,持续5分钟,之后温度增加5℃-1到150°C,然后在10°C-1至280°C(保持2分钟)。电离过程为电子冲击模式,电子能量为70 eV。质谱检测器设置如下:传递线、离子源和阱温度分别为250、180和150℃。质量范围为35 ~ 650 m/z,扫描速度为4次扫描-1.化合物鉴定通过与真实标准的保留时间和与NIST05质谱库(美国国家标准协会)的比较进行。
结果
推测的ccd编码基因的分离和表征
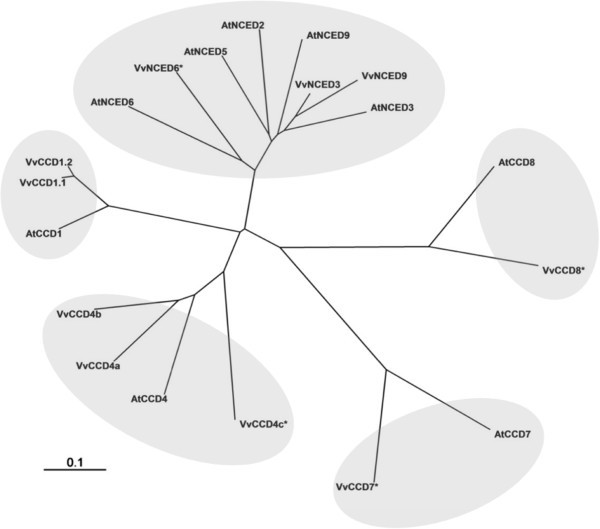
CCD家族的系统发育树答:芥而且诉酿酒用葡萄和基于蛋白质相似度的数据,如图所示1.从分子系统发育分析可以区分出五个分支,分别对应不同的同源基团(对应于酶的功能),即:NCED, CCD1, CCD4, CCD7和CCD8。在这项研究中,有三个假设VvCCD编码基因(VvCCD1[基因库:KF008001], VvCCD4a[基因库:KF008002]VvCCD4b[GenBank:KF008003])诉酿酒用葡萄L. cv Pinotage cDNA使用引物描述在附加文件1.
VvCCD1在葡萄基因组中作为第13号染色体上的串联复制存在[6].两个基因副本彼此相距约78 kb,在核酸水平上显示96%的同一性,在氨基酸水平上显示97%的同一性。此外,这些基因的8.8 kb基因组区域(包括内含子和utr)在核酸水平上具有96%的一致性。这表明VvCCD1异构体在功能上是等同的,在进一步的实验中可以这样处理。RNAi结构设计用来抑制两种异构体,而实时引物不能区分两种转录本。南方印迹分析VvCCD1证实,诉酿酒用葡萄简历。Sultana基因组DNA拥有两个基因拷贝(附加文件3.).根据基因组序列CCD4a而且CCD4b在2号染色体上彼此之间的距离不超过26kb;这两个基因组副本分别包含一个外显子(即没有内含子)和599个aa和589个aa蛋白的编码,在氨基酸水平上具有70%的同一性。
一个额外的CCD4正交物(VvCCD4c)通过序列相似性被识别,并定位在16号染色体上,然而在分析的任何组织中都无法检测到该同源物的表达,因此没有被分离出来。
在网上蛋白定位预测了VvCCD1的胞质定位和VvCCD4a和VvCCD4b的质体定位4).蛋白质之间的CCD正交配位显示高度保守的氨基酸序列(附加文件5).在CCD同源物中发现了4个重要的组氨酸残基VvCCD1,VvCCD4a而且VvCCD4b(附加文件4和额外的文件5) [44].这些氨基酸与铁离子(Fe2 +),这已被证明是类胡萝卜素裂解反应的辅助因素[45].
推测的VvCCD酶的功能大肠杆菌
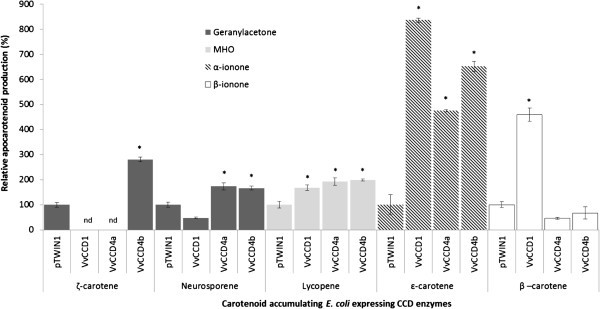
确定分离的ccd编码基因的酶功能;编码区被克隆到一个大肠杆菌表达载体(pTWIN1)。重组蛋白以类胡萝卜素积累的方式共表达大肠杆菌经工程改造积累特定类胡萝卜素的菌株:植物烯(通过pAC-PHYT)、ζ-胡萝卜素(通过pAC-ZETA)、神经孢子素(通过pAC-NEUR)、番茄红素(通过pAC-LYC)、ϵ-carotene(通过pAC-EPSILON)和β-胡萝卜素(通过pAC-BETA)菌株,如Cunningham所述et al。[32,33].在可能的情况下,使用UPLC验证所使用菌株的类胡萝卜素生产(附加文件6).通过顶空(HS)-SPME GC/MS法测定挥发性异胡萝卜素裂解产物的形成,检测重组CCD蛋白诱导后在类胡萝卜素积累菌株中的酶活性。
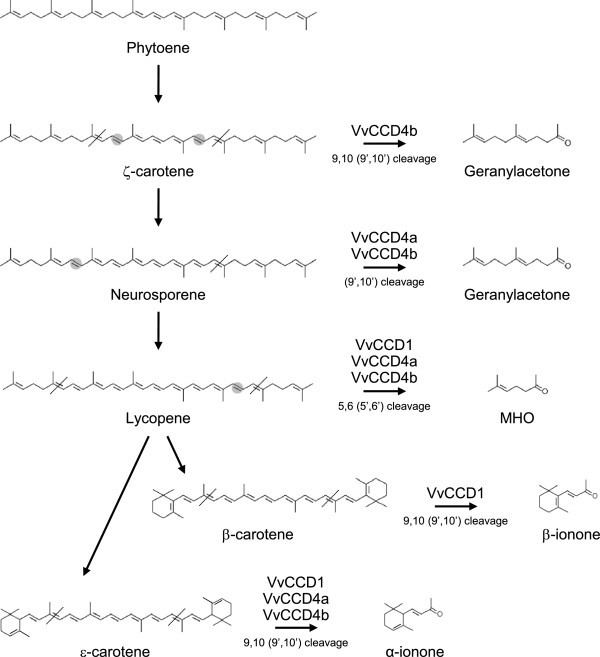
数据,如图所示2和额外的文件6,表明VvCCD1, VvCCD4a和VvCCD4b是功能性的,具有独特的衬底偏好/特异性。VvCCD1, VvCCD4a和VvCCD4b都能催化番茄红素的裂解(形成6-甲基-5-庚烯-2-酮;MHO)和ϵ-carotene(形成α-ionone)。神经孢子裂解仅由VvCCD4a和VvCCD4b(而不是VvCCD1)催化。然而,只有VvCCD1能够催化β-胡萝卜素裂解生成β-ionone;只有VvCCD4b能够催化ζ-胡萝卜素裂解生成香叶酮。三种ccd均未表现出催化植物烯裂解的能力。来自ϵ-carotene的α-紫堇酮的生成证明了VvCCD1、VvCCD4a和VvCCD4b具有催化9,10(9 ',10 ')裂解的能力,而番茄红素生成6-甲基-5-七烯-2-酮具有额外的催化5,6(5 ',6 ')裂解的能力。
CCDs在葡萄器官中的时空表达
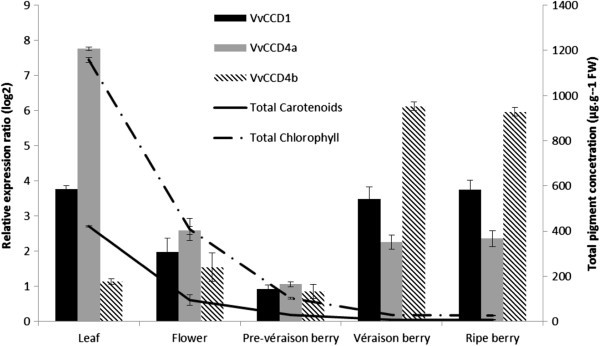
的表达水平VvCCD1,VvCCD4a,VvCCD4b、VvCCD4c VvCCD7而且VvCCD8在叶、花和葡萄浆果发育的三个阶段:绿色、véraison和成熟(图3.和额外的文件7).没有检测到的表达式VvCCD4c, VvCCD7或VvCCD8在任何组织或发育阶段使用qRT-PCR检测(结果未显示),因此仅表达VvCCD1,4和- - - - - -4 b进行了进一步的报道和讨论。数据显示VvCCDs在所有组织中均有表达。然而,在表达谱中有明显的特定模式:VvCCD1在叶片中表现出较高的相对表达量。VvCCD4a在树叶中最为丰富;而VvCCD4b在浆果中表达量最高。VvCCD1,VvCCD4a而且VvCCD4b均在花组织中以较低水平表达。
的最低相对表达水平VvCCD1,VvCCD4a而且VvCCD4b都是青涩的浆果。最高的VvCCD1而且VvCCD4a表达水平在叶片组织中;而最高的表达VvCCD4b是在成熟的浆果中(图3.和额外的文件7).VvCCD1,VvCCD4a而且VvCCD4b在浆果期,表达均随发育(成熟)而增加。VvCCD1而且VvCCD4a表达量在véraison达到峰值并趋于平稳VvCCD4b在整个浆果成熟过程中,表达量显著增加。
VvCCD1水平的转基因调控
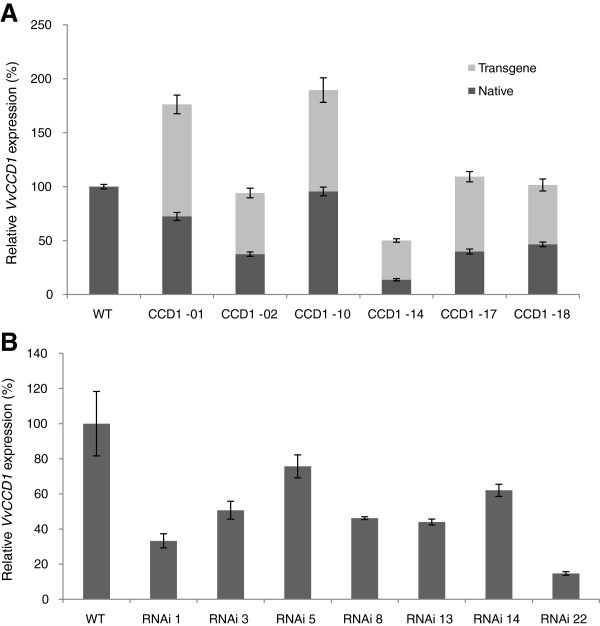
的变换V酿酒用葡萄L. cv Sultana含有pART27-VvCCD1过表达盒,经Southern杂交证实3.).基因组DNA的消化Spe当限制性内切酶在杂交区外消化时,每次整合事件都会产生一个杂交带。对转基因植株的分析表明,9个品系中有6个代表独立的整合事件,其转基因拷贝数在1到4之间。CCD1-10和CCD1-12系以及CCD1-15、CCD1-17和CCD1-19系被认为是克隆性的3.).通过PCR筛选,12个品系对沉默盒转基因的转化/整合呈阳性(数据未显示)。
的水平VvCCD1用qRT-PCR检测转基因株系的表达情况。在与pART27-VvCCD1独立转化的6个细胞系中,只有2个细胞系显著过表达VvCCD1(与野生型相比增加了85%)(图4).qRT-PCR表达分析显示,所有品系均表达内源基因和导入的转基因基因,但共有4个品系表达VvCCD1与野生型相比,没有显著增加的基因表达水平(图4).有趣的是,转基因衍生的表达相当稳定,而内源基因的表达则受到更多的影响。在由pART27-CCD1(RNAi)正转化的12个株系中,与野生型株系相比,有7个株系表现出明显的沉默(图)4).沉默的VvCCD1高达85%(相对于野生型表达)。对表达水平与野生型显著不同的植物品系进行靶向代谢物分析,以确定类胡萝卜素(即卵裂底物)和/或挥发性异胡萝卜素谱(即卵裂产物)是否受到影响/改变。
转基因葡萄品系类胡萝卜素、叶绿素和异胡萝卜素分析
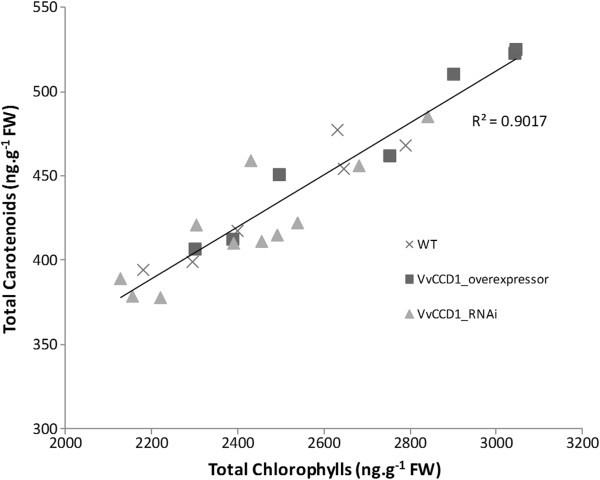
反相高效液相色谱分析表明,从转基因人群中提取的色素与转基因人群之间无显著相关性VvCCD1在测试条件下,葡萄藤叶片组织中类胡萝卜素的表达水平和浓度8).同样,两者之间没有相关性VvCCD1在同一组织中观察到叶片norisoprenoid的表达和水平(附加文件9).总类胡萝卜素含量与叶片总叶绿素含量呈正相关(R2=(图0.90)5).
讨论
VvCCD1, VvCCD4a和VvCCD4b催化了广泛的类胡萝卜素底物的裂解
CCDs催化类胡萝卜素裂解的酶促作用已被证实可在一系列植物物种中产生挥发性风味和芳香类异胡萝卜素,包括α-紫罗兰酮、β-紫罗兰酮和6-甲基-5-庚烯-2-酮(MHO)。异胡萝卜素有助于许多葡萄酒品种的花和果味的属性,因此是部分负责葡萄和葡萄酒的“品种特征”(如白诗南,赛美蓉,长相思,赤霞珠,设拉子)。在这里,我们首次确认了VvCCD1,以及VvCCD4a和VvCCD4b在一系列类胡萝卜素底物上的功能。近年来有报道从葡萄中鉴定CCD4的同源物[6,38];和Guillaumieet al。[38测试了一种分离自诉酿酒用葡萄cv霞多丽在ζ-胡萝卜素、番茄红素、β-胡萝卜素和玉米黄质上的作用,但在测试的任何基质上都不能显示出功能。CCD1和CCD4在其他植物中的同源物已被证明可以催化许多C40类胡萝卜素和C30.-apocarotenoid基质。在这里我们发现VvCCD1, VvCCD4a和VvCCD4b能够催化C的裂解40在9,10(9 ',10 ')的类胡萝卜素底物(ζ-胡萝卜素,β-胡萝卜素和/或ϵ-carotene)和在5,6(5 ',6 ')双键位置的番茄红素释放相应的C13apocarotenoid产品(表1和图6),证实了环状和线性底物的裂解。这是CCD4酶催化线性类胡萝卜素裂解的第一个例子,与黄的结论形成对比et al。[11他在分析了来自五种不同植物(不包括葡萄)的ccd4的功能后得出结论,ccd4催化环非极性类胡萝卜素(如β-胡萝卜素)的裂解,而不是线性类胡萝卜素(如番茄红素或ζ-胡萝卜素)的裂解。有趣的是,只有VvCCD4b能够催化ζ-胡萝卜素的裂解,而VvCCD4a和VvCCD4b都不能催化β-胡萝卜素的裂解。所测ccd均未催化植物烯的裂解。这些结果与沃格尔的假设一致et al。[25],他们认为只有当双键靠近被裂解的键时,才会发生ccd催化的裂解。在5,6(5 ',6 ')或9,10(9 ',10 ')解理的情况下,双键必须分别在7,8(7 ',8 ')或11,12(11 ',12 ')位置上找到。植物烯不具有这些双键,因此不能被裂解。VvCCD4b能够催化ζ-胡萝卜素裂解形成香叶酮,但不能催化MHO,进一步说明了这一点(图6).含有羟基的类胡萝卜素(如叶黄素和玉米黄质)作为VvCCD4催化裂解的潜在底物在我们的研究中没有进行研究,仍有待评估。
马修et al。[54)使用了一个在体外酶分析表明VvCCD1来自诉酿酒用葡萄L. cv设拉子可催化叶黄素、玉米黄质和叶黄素裂解形成3-羟基-β-ionone。作者指出β-胡萝卜素作为底物进行了测试,但在他们的试验中没有被切割。VvCCD1隔绝诉酿酒用葡萄然而,本研究中的L. cv Pinotage能够催化番茄红素、β-胡萝卜素和ϵ-carotene的裂解,但不能催化神经孢子素和ζ-胡萝卜素的裂解(图2和图6).来自不同研究的交叉比较结果往往由于用于这种性质的实验的分析方法的差异而复杂化。在活的有机体内与在体外酶分析)和/或用于生成数据的分析方法的选择(即类胡萝卜素的降解与异类胡萝卜素的形成)。的优点之一在活的有机体内本研究中使用的检测方法是对特定的类胡萝卜素底物进行控制和验证。类胡萝卜素的生物合成大肠杆菌菌株通过添加类胡萝卜素途径抑制剂二苯胺(DPA;根据坎宁安和甘特[40]),而DPA抑制2小时后,各菌株产生的类胡萝卜素在诱导各自的CCDs之前通过UPLC进行验证。进一步采取步骤防止类胡萝卜素的氧化,非酶降解和添加辅助因子,以确保CCD酶的功能在活的有机体内化验(据鲍德曼说)等.[42])。
在活的有机体内隔离vvccd的功能
VvCCD1、VvCCD4a和VvCCD4b影响葡萄的风味和香气潜力
VvCCD1, 4而且4 b,都在成熟过程中上调(图3.),因此,它们都可能参与了类胡萝卜素的酶降解到各自的芳香C13-类诺异戊二烯,有助于葡萄和葡萄酒的独特品种特征。自VvCCD1, 4而且4 b均在成熟过程中表达,可用于卵裂的特定类胡萝卜素底物,以及各自vccd (s)存在的底物特异性,将决定C13-在葡萄中形成的类诺异戊二烯。虽然VvCCD1,VvCCD4a而且VvCCD4b在浆果发育过程中表达;VvCCD4b在果实成熟过程中表现出最具浆果特异性的表达谱和最高的上调(在成熟阶段相对于绿色阶段上调30倍),似乎是最有可能催化成熟果实中类胡萝卜素裂解的亚型。VvCCD4a在叶片和VvCCD1在所有测试的组织中保持相对恒定的水平。根据这里给出的表达式数据,马修et al。[54显示了相似的趋势VvCCD1在浆果中的表达(即在véraison达到峰值),并且,尽管作者注意到C13马斯喀特(和较小程度的设拉子)的-诺异戊二烯类含量,这发生在增加两周后VvCCD1表达式。大量关于葡萄浆果类胡萝卜素组成的研究表明,在成熟过程中,类胡萝卜素浓度下降[14,43,55].类胡萝卜素与C13-norisoprenoids铅Crupiet al。[15的研究结果表明,从véraison期到成熟(采收期),葡萄果实中类胡萝卜素的浓度变化可以用来评估葡萄的芳香潜力。
VvCCD4a和VvCCD4b是在光合作用中维持类胡萝卜素水平的候选者
含氧类胡萝卜素(叶黄素)的相对丰度在光合组织中是保守和严格调节的,这在很大程度上是由于光系统(PS) I和II(主要是β-胡萝卜素)的光合反应中心和光收集天线复合体(主要是叶黄素、紫黄素和新黄素)中的特定色素的参与。
虽然类胡萝卜素的组成被认为在光合作用生物中高度保守,叶黄素、新黄素和紫黄素的普遍存在最为显著;突变体的研究答:芥已经证明植物具有一定程度的可塑性。植物已被证明即使在没有叶黄素、新黄素和紫黄素的情况下也能存活,但这些叶黄素是幼苗最佳发育和光保护所需的,令人惊讶的是光合作用程度较低[56].
VvCCD1转基因株系在成熟光合活性叶片中也表现出叶绿素和类胡萝卜素浓度的正相关(图5;R2= 0.90)。这是意料之中的,因为类胡萝卜素主要参与光合作用,特别是在营养组织中[4].叶绿素浓度的增加表明光合活性的增加,这反过来又对参与光收集和光保护的类胡萝卜素提出了更多的要求[57].因此,类胡萝卜素途径在叶片组织中受到严格调控也就不足为奇了,因为失去这些关键色素将导致植物受损,从而导致植物的次优状态[58- - - - - -61].
贝赛et al。[62的结果表明,类胡萝卜素和叶绿素a在植物成熟叶片中持续合成和降解拟南芥.类胡萝卜素和叶绿素的这种周转对于维持活跃的光合作用和适应不断变化的光照条件至关重要。ccd(特别是叶绿体定位的CCD4同源物)可能参与维持光合组织中最佳的类胡萝卜素组成。静态植物面对不断变化的环境必须能够在光合组织中保持最佳的类胡萝卜素组成。由于其定位和衬底的特殊性,ccd可能会参与这种调节和维护。我们发现胞质VvCCD1催化番茄红素、β-胡萝卜素和ϵ-carotene(而不是ζ-胡萝卜素)裂解(图)2),而叶绿体定位的VvCCD4a和VvCCD4b催化番茄红素、神经孢子素和ϵ-carotene(但不包括β-胡萝卜素)的裂解(图)2).只有VvCCD4b能够催化ζ-胡萝卜素裂解。在这些类胡萝卜素底物中,只有β-胡萝卜素在葡萄叶和浆果中存在可检测的水平(图3.和额外的文件7),形成光系统I和-II的一部分。因此,差异转录调控和类胡萝卜素底物(叶绿体)与VvCCD1酶(细胞质)的物理分离增加了可能的控制层。
改变表达VvCCD1表明亚细胞区隔化调节CCD活性
我们的转基因数据证实了对类胡萝卜素途径操纵的一定程度的保护,特别是对改变水平的VvCCD1.的显著过表达VvCCD1仅在30%的南方阳性葡萄系中观察到。这不是由于非功能性结构,因为qRT-PCR实验验证了内源性和转基因VvCCD1在植物细胞系中的表达(图4).尽管大部分过表达系部分沉默(通过控制内源基因表达水平);产生的细胞系显示出不同程度的过表达VvCCD1(图4).过度表达的系,加上成功沉默的系,导致转基因植物的种群表现出高达12倍的范围VvCCD1表达式(从最沉默的行到最过度表达的行)。
尽管在VvCCD1根据已知的VvCCD1酶活性,对类胡萝卜素(底物)或异胡萝卜素(产物)进行检测的营养(叶)组织中均未观察到直接表型。马修et al。[54对成熟浆果进行监测,发现两者之间存在类似的差异(或缺乏相关性)VvCCD1异胡萝卜素的表达和产生。由于没有对转基因系进行VvCCD1蛋白的定量分析,因此不可能推测两者之间的关系VvCCD1转录本和VvCCD1蛋白之间的正相关关系,但众所周知,mRNA水平和蛋白质水平之间的正相关关系远没有通常认为的那么普遍[63].另一个可能导致在被分析的叶片组织中缺乏可观察到的表型的因素是植物细胞内酶的分隔。在网上分析表明VvCCD1定位于细胞质中。这已被证明是许多CCD1的正交物的情况[25].CCD1催化的类胡萝卜素裂解底物在体外,然而,位于叶绿体膜,因此CCD1酶无法到达[4].
之前试图控制的表达水平CCD1转录本也导致表型与观察到的不一致在体外CCD1活性[18,19].内et al。[18)减少LeCCD1利用反义结构,番茄叶片和果实中mRNA水平下降了90%,但没有观察到果实中类胡萝卜素浓度的任何变化CCD1在选定的沉默系中β-ionone浓度仅下降50%。没有数据显示番茄叶片中类胡萝卜素或类诺异戊二烯的含量降低CCD1的水平。Ilget al。[20.)建议在足底OsCCD1可能催化类胡萝卜素裂解而不是类胡萝卜素裂解。在番茄果实中观察到类似的类诺异戊二烯的减少CCD1葡萄藤树叶中没有发现转录(附加文件9).这些研究,并得到本研究结果的支持,表明在足底CCD1的作用实际上可能不是维持类胡萝卜素水平,而是催化类胡萝卜素裂解。考虑到叶子是植物的主要光合器官,因此需要维持这种功能,这就不足为奇了。观察到叶片中叶绿素浓度与类胡萝卜素浓度之间的相关性(图5)表明,组织的光合活性水平对类胡萝卜素的浓度有更大的影响。在成熟果实的染色体中,叶绿素不需要光保护,CCD1及其类胡萝卜素底物的分离可能减少。然而,尽管CCD1的细胞质定位和其明显缺乏与类胡萝卜素和类诺异戊二烯浓度的转录相关性,类诺异戊二烯仍然在叶片中形成9).这提示了类胡萝卜素裂解和类去异戊二烯生成的另一种作用机制。ccdd是最有可能的候选者,因为事实是VvCCD4a而且VvCCD4b转录本在浆果发育过程中上调(在果实收获时达到峰值VvCCD4b);亚细胞上VvCCD4a和VvCCD4b都被预测在叶绿体中与类胡萝卜素共同定位;并证实了VvCCD4a和VvCCD4b对类胡萝卜素裂解的催化作用。
在亚细胞器水平上,许多类胡萝卜素代谢酶已被确认在质体球蛋白组答:芥,包括CCD1和CCD4。有趣的是,CCD4蛋白占塑蛋白组总质量的3.3% [64].质体球蛋白是质体中发现的类囊体相关脂蛋白颗粒(即细胞器下分隔化)。据认为,脂质交换(即类胡萝卜素、质体醌、生育酚)可以发生在质体球蛋白和类囊体膜之间。叶绿体中质体球蛋白的大小和丰度受许多发育和环境条件的影响,包括胁迫(特别是氧化)和从叶绿体到老年质体的转变(即衰老)和叶绿体到染色体的转变(如发生在花和水果中)。
质体可以分化和去分化,在这些转变过程中,质体的大小和数量都在增加。值得注意的是,CCD1、CCD4和CCD8已经定位于塑料球蛋白;类胡萝卜素底物积累并形成新创在plastoglobules。的在足底ccd在这些脂蛋白结构中的作用还不清楚。是否需要它们来维持类胡萝卜素的组成和/或它是为了产生驱动类胡萝卜素裂解的异胡萝卜素裂解产物,仍有待阐明。
结论
总之,葡萄藤叶片中的VvCCD1似乎处于不同程度的控制之下。考虑到所有因素,类胡萝卜素组成对有效光合作用的重要性是最可能的原因,在叶子中这种控制。对照应用于转录水平,在转基因VvCCD1群体中观察到转录后基因沉默的形式;并且可能在蛋白质水平上,亚细胞区隔化可能阻止VvCCD1与其类胡萝卜素底物之间的相互作用。本研究中描述的各自VvCCDs的底物特异性(即VvCCD1、VvCCD4a和VvCCD4b)表明可以施加控制的另一个水平。尽管VvCCD1具有催化多种类胡萝卜素裂解的能力在体外,在足底裂解的底物可能主要是C27经酶作用裂解产生的异胡萝卜素(由CCD4和/或CCD7产生,Floss建议)et al。[19]或光氧化,然后从叶绿体运输到细胞质。在任何一种情况下,葡萄浆果都可能显示出更密切相关的表型VvCCD1由于成熟过程中渗透应力的增加,导致膜渗漏和叶绿体的伴随降解。葡萄藤(一种多年生木本植物)的漫长的年轻期/成熟期可以持续超过三年,因此排除了本研究范围内产生的转基因群体的浆果分析。
VvCCD4a和VvCCD4b的分离和功能特性为影响叶绿体中类胡萝卜素组成以及葡萄中挥发性类胡萝卜素生产提供了额外的候选裂解酶。CCDs在各种植物组织中的不同表达以及VvCCD1、VvCCD4a和VvCCD4b不同的底物特异性表明CCDs在不同的植物、植物组织甚至植物的不同亚细胞间隔(即质体)中具有不同的作用。未来的研究,例如,从本研究产生的转基因系衰老的叶子和葡萄浆果将是非常重要的,进一步阐明在足底ccd的函数。转基因葡萄的世代VvCCD4本研究产生的转基因品系的衰老叶片和浆果的表达和未来的研究将对进一步阐明这一问题具有重要意义在足底ccd的函数。
支持数据的可用性
支持本文结果的数据集包含在本文(及其附加文件)中。
参考文献
Cogdell RJ:光合作用中的类胡萝卜素。化学学报,2004,25(3):327 - 327。10.1351 / pac198557050723。
叶片衰老过程中的类胡萝卜素分解代谢及其受光的控制。光化学与工程学报,2003,24(3):354 - 354。10.1016 / 1011 - 1344 (95) 07197 - a。
类胡萝卜素的结构和性质与功能的关系。王永平。1997,15(3):359 - 359。
Cunningham FX:植物中类胡萝卜素合成和积累的调控。化学学报,2002,34(4):369 - 371。10.1351 / pac200274081409。
Velasco R, Zharkikh A, Troggio M, Cartwright DA, Cestaro A, Pruss D, Pindo M, FitzGerald LM, Vezzulli S, Reid J, Malacarne G, Iliev D, Coppola G, Wardell B, Micheletti D, Macalma T, Facci M, Mitchell JT, Perazzolli M, Eldredge G, Gatto P, Oyzerski R, Moretto M, Gutin N, Stefanini M, Chen Y, Segala C, Davenport C, Dematté L, Mraz A等:葡萄杂合子品种基因组的高质量共识序列draft consensus sequence。科学通报,2007,2:e1326-10.1371/journal.pone.0001326。
Young P, Lashbrooke J, Alexandersson E, Jacobson D, Moser C, Velasco R, Vivier M:类胡萝卜素代谢途径的基因和酶葡萄中国生物医学工程学报,2012,29(3):366 - 366。
王晓燕,王晓燕,王晓燕。植物类胡萝卜素裂解加氧酶及其类胡萝卜素产物。植物生态学报,2006,9:315-321。10.1016 / j.pbi.2006.03.005。
奥尔德里奇ME, Block A, Vogel JT, Dabney-Smith C, Mila I, Bouzayen M, magallane - lundback M, DellaPenna D, McCarty DR, Klee HJ:三个成员的特征拟南芥类胡萝卜素裂解双加氧酶家族显示了这一多功能酶家族的不同作用。植物学报,2006,29(4):366 - 366。10.1111 / j.1365 - 313 x.2006.02666.x。
切尔尼斯JT, Zeevaart JAD: 9-的特性独联体-环氧类胡萝卜素双加氧酶基因家族与鳄梨脱落酸生物合成的调控。植物生理学报,2004,24(4):356 - 356。10.1104 / pp.124.1.343。
Dun EA, Brewer PB, Beveridge CA:独角内酯:难以捉摸的芽分枝激素的发现。植物科学进展,2009,14:364-372。10.1016 / j.tplants.2009.04.003。
黄春春,Molnar P, Schwab W:类胡萝卜素裂解双加氧酶4基因的克隆及功能鉴定。中国生物医学工程学报,2009,30(5):561 - 561。10.1093 / jxb / erp137。
鲍德曼,李志明,李志明,李志明,李志明,等:油桃类胡萝卜素的酶促降解及香气形成(碧桃).食品科学,2005,38:833-836。10.1016 / j.foodres.2005.02.009。
Cooper CM, Davies NW, Menary RC:植物花发育过程中某些类胡萝卜素和异胡萝卜素的变化芸香料灌木megastigma(需要雇)。农业食品学报,2009,57:1513-1520。10.1021 / jf802610p。
Baumes R, Wirth J, Bureau S, Gunata Y, Razungles A: C13-类诺异戊二烯化合物:支持葡萄中类胡萝卜素途径的实验。化学学报,2002,32(4):354 - 354。10.1016 / s0003 - 2670(01) 01589 - 6。
Crupi P、Coletta A、Milella RA、Palmisano G、Baiano A、La Notte E、Antonacci D:产于阿普里亚地区的一些酿酒葡萄中的类胡萝卜素和叶绿素衍生化合物。食品科学学报,2010,75:S191-S198。10.1111 / j.1750-3841.2010.01564.x。
Ristic R, Bindon K, Francis L, Herderich M, Iland P:黄酮类化合物13-norisoprenoids在葡萄l .简历。设拉子:葡萄与葡萄酒成分、葡萄酒颜色和葡萄酒感官特性的关系。德国葡萄酒杂志,2010,16:369-388。10.1111 / j.1755-0238.2010.00099.x。
门德斯-平托MM:葡萄酒香气中的类胡萝卜素分解产物—诺异戊二烯类。中国生物工程学报,2009,29(4):366 - 366。10.1016 / j.abb.2009.01.008。
Simkin AJ, Schwartz SH, Auldridge M, Taylor MG, Klee HJ:番茄类胡萝卜素裂解双加氧酶1基因有助于风味挥发物β -硫酮、假硫酮和香叶酮的形成。植物学报,2004,29(4):381 - 381。10.1111 / j.1365 - 313 x.2004.02263.x。
Floss DS, Schliemann W, Schmidt J, Strack D, Walter MH: RNA干扰介导的抑制MtCCD1在菌根中的Medicago truncatula导致C的积累27异胡萝卜素,揭示CCD1的功能作用。植物生理学报,2008,29(4):366 - 366。10.1104 / pp.108.125062。
Ilg A, Yu Q, Schaub P, Beye P, Al-Babili S:水稻类胡萝卜素裂解双加氧酶1基因在黄金水稻胚乳中过表达,提示类胡萝卜素为底物在足底.植物生态学报,2010,32(4):691-699。10.1007 / s00425 - 010 - 1205 - y。
Walter MW, Strack D:类胡萝卜素及其裂解产物:生物合成和功能。科学通报,2011,28:663-692。10.1039 / c0np00036a。
叶特伯格,裴尔蒂,范伟克:叶绿体和染色体中塑球蛋白的蛋白质谱。这是代谢酶差异积累的惊人地点。植物生理学报,2006,30(4):394 - 394。10.1104 / pp.105.076083。
Rubio A, Rambla JL, Santaella M, Gómez MD, Orzaez D, Granell A, Gómez-Gómez L:胞质和质体球蛋白靶向类胡萝卜素双加氧酶番红花都参与β-ionone的释放。中国生物医学工程学报,2008,29(4):359 - 359。10.1074 / jbc.M804000200。
Vallabhaneni R, Bradbury LMT, Wurtzel ET:玉米、高粱和水稻中的类胡萝卜素双加氧酶基因家族。中国生物工程学报,2010,38(4):394 - 394。10.1016 / j.abb.2010.07.019。
Vogel JT, Tan BC, McCarty DR, Klee HJ:类胡萝卜素裂解双加氧酶1酶具有广泛的底物特异性,在两个不同的键位裂解多个类胡萝卜素。中国生物医学工程学报,2008,29(4):394 - 394。10.1074 / jbc.M710106200。
Altschul SF, Gish W, Miller W, Myers EW, Lipman DJ:基本的局部对齐搜索工具。中华分子生物学杂志,1999,15:449 - 451。
Proost S, Van Bel M, Sterk L, Billiau K, Van Parys T, Vande Peer Y, Vandepoele K: PLAZA:研究植物基因和基因组进化的比较基因组学资源。植物学报,2009,21:3718-3731。10.1105 / tpc.109.071506。
Tamura K, Dudley J, Nei M, Kumar S: MEGA4:分子进化遗传学分析(MEGA)软件4.0版本。分子生物学与分子生物学杂志,2007,24:1596-1599。10.1093 / molbev / msm092。
Steenkamp J, Wiid I, Lourens A, Vanhelden P:改进的DNA提取方法葡萄.王文华。1994,45:102-106。
王晓燕,王晓燕,王晓燕,王晓燕。葡萄果实发育过程中RNA分离方法的优化及内参基因的统计分析。植物生物学杂志,2006,6:27-10.1186/1471-2229-6-27。
Sambrook J, Fritsch EF, Maniatis T:分子克隆:实验室手册。第二版。纽约州冷泉港:冷泉港实验室出版社;1989.
Cunningham FX, Chamovitz D, Misawa N, Gantt E, Hirschberg J:克隆和功能表达大肠杆菌番茄红素环化酶是一种催化β-胡萝卜素生物合成的酶。中国科学(d辑),1998,28(4):369 - 371。10.1016 / 0014 - 5793(93) 80980 - 9。
Cunningham FX, Sun Z, Chamovitz D, Hirschberg J, Gantt E:蓝藻番茄红素环化酶的分子结构和酶功能聚球藻属PCC7942 sp压力。植物科学学报,1994,12(3):366 - 366。
Gleave AP:一种具有T-DNA组织结构的多功能二元载体系统,有助于将克隆的DNA高效地整合到植物基因组中。植物生物学杂志,1998,19(3):366 - 366。10.1007 / BF00028910。
Wesley SV, Helliwel CA, Smith NA, Wang M, Rouse DT, Liu G, Gooding PS, Singh SP, Abbott D, Stoutjesdijk PA, Robinson SP, Gleave AP, Green AG, Waterhouse PM:植物中高效、有效和高通量基因沉默的构建设计。植物学报,2001,27:581- 589。10.1046 / j.1365 - 313 x.2001.01105.x。
Vasanth K, Vivier MA:葡萄长期同步培养的改良冷冻保存程序优化(葡萄l .)。植物学报,2011,55(2):365-369。10.1007 / s10535 - 011 - 0056 - 0。
何德昌,何德昌。转基因植物的再生葡萄Sultana植物:基因型和表型分析。动物学报,1998,4:381 - 381。10.1023 /: 1009673619456。
Guillaumie S, Fouquet R, Kappel C, Camps C, Terrier N, Moncomble D, Dunlevy JD, Davies C, Boss PK, Delrot S:葡萄果实晚成熟阶段的转录分析。植物生物学杂志,2011,11:165-10.1186/1471-2229-11-165。
Pfaffl MW:实时RT-PCR中相对定量的新数学模型。核酸学报,2001,29:2002-2007。
Lücker J, Bouwmeester HJ, Schwab W, Blaas J, van der Plas LHW, Verhoeven HA:表达山字草转基因矮牵牛植物中的s -芳樟醇合成酶可导致s -芳樟醇-β- d -吡喃葡萄糖苷的积累。植物学报,2001,27(4):326 - 326。10.1046 / j.1365 - 313 x.2001.01097.x。
Cunningham FX, Gantt E:用于类胡萝卜素途径酶鉴定和分析的质粒组合:阿多尼斯-作为一个案例研究。光合作用学报,2007,29(4):359 - 359。10.1007 / s11120 - 007 - 9210 - 0。
Baldermann S, Kato M, Kurosawa M, Kurobayashi Y, Fujita A, Fleischmann P, Watanabe N:植物花发育过程中类胡萝卜素裂解双加氧酶1的功能特征及其与类胡萝卜素积累和挥发性物质释放的关系桂花不悦之色。中国生物医学工程学报,2010,29(5):561 - 561。10.1093 / jxb / erq123。
Lashbrooke JG, Young PR, Strever AE, Stander C, Vivier MA:从葡萄叶和浆果中提取类胡萝卜素和叶绿素用于高效液相色谱分析的方法的开发。德国葡萄酒,2010,16:349-360。10.1111 / j.1755-0238.2010.00097.x。
Kloer DP, Schulz GE:类胡萝卜素裂解的结构和生物学方面。细胞生物学与生命科学,2006,29(3):369 - 369。10.1007 / s00018 - 006 - 6176 - 6。
Poliakov E, Gentleman S, Cunningham FXJ, Miller-Ihli NJ, Redmond TM:保守组氨酸在重组小鼠β -胡萝卜素15,15'-单加氧酶-1活性中的关键作用。中国生物医学工程学报,2004,29(5):557 - 557。10.1074 / jbc.M500409200。
秦晓强,蔡华。杰德:一种新的植物类胡萝卜素裂解双加氧酶的表征。中国生物医学工程学报,2004,24(3):356 - 356。10.1074 / jbc.M102146200。
Schmidt H, Kurtzer R, Eisenreich W, Schwab W:胡萝卜素酶AtCCD1从拟南芥是一个加双氧酶。中国生物医学工程学报,2006,29(5):561 - 561。10.1074 / jbc.M511668200。
Ibdah M、Azulay Y、Portnoy V、Wasserman B、Bar E、Meir A、Burger Y、Hirschberg J、Schaffer AA、Katzir N、Tadmor Y、Lewinsohn E:甜瓜类胡萝卜素切割双加氧酶CmCCD1的功能表征。植物化学学报,2006,29(4):369 - 369。10.1016 / j.phytochem.2006.02.009。
Mathieu S, Bigey F, Procureur J, Terrier N, Gunata Z:重组葡萄类胡萝卜素裂解双加氧酶的制备及其在水混溶有机溶剂中的酶学测定。生物工程学报,2007,29:837-841。10.1007 / s10529 - 007 - 9315 - 8。
Bouvier F, Suire C, Mutterer J, Camara B:染色体类胡萝卜素氧化重塑:类胡萝卜素双加氧酶CsCCD和CsZCD参与基因的鉴定番红花属次生代谢物生物转化。植物学报,2003,15:47-62。10.1105 / tpc.006536。
García-Limones C, Schnäbele K, blaco - portales R, Luz Bellido M, Caballero JL, Schwab W, muallooz - blanco J:草莓果实成熟过程中参与叶黄素降解的类胡萝卜素裂解双加氧酶FaCCD1的功能表征。农业食品学报,2009,56:9277-9285。
大宫A,岸本S, Aida R,吉冈S, Sumitomo K:类胡萝卜素裂解双加氧酶(CmCCD4a)有助于色素的形成菊花花瓣。植物生理学报,2006,29(4):369 - 369。10.1104 / pp.106.087130。
Campbell R, Ducreux LJM, Morris WL, Morris JA, Suttle JC, Ramsay G, Bryan GJ, Hedley PE, Taylor MA:马铃薯类胡萝卜素切割二氧合酶4的代谢和发育作用。植物生理学报,2010,32(4):556 - 564。10.1104 / pp.110.158733。
Mathieu S, Terrier N, Procureur J, Bigey F, Günata Z:类胡萝卜素裂解双加氧酶葡萄L.:葡萄果实发育过程中与C13norisoprenoid积累。中国生物医学工程学报,2005,36(5):381 - 381。10.1093 / jxb / eri265。
Razungles AJ, Babic I, Sapis JC, Bayonove CL:环氧叶黄素在véraison和葡萄成熟过程中的特殊行为。农业食品化学学报,1996,44:3821-3825。10.1021 / jf960260t。
Pogson BJ, Niyogi KK, Bjorkman O, DellaPenna D:改变叶黄素组成对叶绿素积累和非光化学猝灭有不利影响拟南芥突变体。美国国家科学研究院。1998年,95:13324 - 13329。10.1073 / pnas.95.22.13324。
Lichtenthaler HK, Buschmann C, Döll M, Fietz H-J, Bach T, Kozel U, Meier D, Rahmsdorf U:强光和弱光植物以及遮阳和遮荫叶片的光合活性、叶绿体超微结构和叶片特征。中国生物技术学报,2004,15(2):359 - 361。10.1007 / BF00028752。
弗雷泽PD, Enfissi EM, Bramley PM:番茄果实中类胡萝卜素形成的基因工程以及系统和合成生物学方法的潜在应用。中国生物化学学报,2008,29(4):366 - 366。
开花植物类胡萝卜素的生物合成。植物生态学报,2001,27(4):447 - 447。10.1016 / s1369 - 5266(00) 00163 - 1。
Toledo-Ortiz G, Huq E, Rodríguez-Concepción M:光敏色素相互作用因子直接调控植物烯合酶基因表达和类胡萝卜素生物合成。美国国家科学研究院。2010年,107:11626 - 11631。10.1073 / pnas.0914428107。
王晓燕,王晓燕,王晓燕。植物烯合酶在类胡萝卜素合成中的作用及其在光形态建成过程中的调控作用。植物学报,2000,29(4):366 - 366。10.1007 / s004250000352。
裴泽尔KG, Jahnke S, Hofmann D, Köppchen S, Schurr U, Matsubara S:植物成熟叶片中胡萝卜素和叶绿素a的连续转化拟南芥揭示了14有限公司2脉冲追踪标签。植物生理学报,2010,32(4):381 - 381。10.1104 / pp.109.151647。
蛋白质组学和下一代植物分子生物学家。植物生物学杂志,2004,24(3):366 - 366。10.1023 /: 1013736322130。
Lundquist PK, Poliakov A, Bhuiyan NH, Zybailov B, Sun Q, van Wijk KJ:拟南芥基于定量蛋白质组学和全基因组共表达分析的质体蛋白组学。植物生理学报,2012,29(4):347 - 347。10.1104 / pp.111.193144。
确认
作者要感谢Andreas Tredoux博士和Lucky Mokwena先生对细菌顶空挥发物GC/MS分析的帮助,以及Hans Eyéghé-Bickong博士对细菌培养物中类胡萝卜素的UPLC分析。
这项工作得到了葡萄酒工业专业知识和技术网络(Winetech)、工业技术和人力资源计划(THRIP)和国家研究基金会(NRF)的资助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们没有利益冲突。
作者的贡献
JGL、PRY和MAV提出了研究的概念。JGL、PRY和MAV参与了实验布局。JGL、PRY和SJD分离克隆了感兴趣的基因,并进行了细菌功能互补试验。JGL构建了工厂改造结构。KV对葡萄藤进行了转化,并进行了植株的选育和再生。JGL对转基因植株进行了遗传和代谢物筛选。JGL, PRY和MAV起草了最初的手稿。所有作者都参与了结果的讨论、审稿和最终审稿。
电子辅料
12870 _2013_1369_moesm3_esm.pdf
额外的文件3:南部杂交证实了pART27-VvCCD1的整合。λ DNA消化带大小(单位bp)BstE II(1车道)如图所示。基因组DNA被消化Spe一、野生型(巷2)的两个杂交事件表明两个拷贝VvCCD1在Sultana基因组中。CCD1-01巷3;CCD1-02巷4;CCD1-10巷5日;CCD1-12巷6日;巷7,CCD1-14;CCD1-15巷8日;CCD1-17巷9日;CCD1-18巷10日;CCD1-19巷11日。 Estimated number of integration events are displayed at the bottom of each lane. Plants with the same clonal group (a-f) are considered clonal copies. (PDF 114 KB)
12870 _2013_1369_moesm6_esm.pdf
额外的文件6:VvCCD1, VvCCD4a和VvCCD4b在异源蛋白中的功能和底物特异性在活的有机体内细菌的系统。CCDs在大肠杆菌中表达,大肠杆菌工程积累特定的类胡萝卜素。用UPLC测定裂解前产生的类胡萝卜素。用GC-MS测定裂解后产生的挥发性异胡萝卜素。(PDF 215 KB)
12870 _2013_1369_moesm7_esm.pdf
附加文件7:本研究调查的葡萄器官中存在的类胡萝卜素和叶绿素浓度。采用高效液相色谱法分析类胡萝卜素和叶绿素。如Lashbrooke等人(2010)所述,通过与真实标准的比较来识别单个类胡萝卜素和叶绿素,并通过内部标准(β-阿波胡萝卜素)归一化进行量化,并通过外部标准曲线进行量化。(PDF 107 KB)
12870 _2013_1369_moesm8_esm.pdf
额外的文件8:类胡萝卜素浓度与VvCCD1葡萄叶的表达水平。葡萄群体叶片中主要的类胡萝卜素(通过HPLC测定)均未显示出显著的相关性VvCCD1表达式。野生型(绿色三角形符号)、沉默型(蓝色菱形符号)和过表达型(红色方框符号)中β-胡萝卜素(A)、叶黄素(B)、紫黄素(C)、新黄素(D)、花药黄素(E)和玉米黄素(F)的浓度如图所示。(PDF 355 KB)
12870 _2013_1369_moesm9_esm.pdf
额外的文件9:异胡萝卜素浓度与VvCCD1葡萄叶的表达水平。两者之间无显著相关性VvCCD1葡萄群体叶片中异胡萝卜素的表达和挥发性成分(GC/MS测定)。6-甲基-5-庚烯-2-酮(MHO) (A)、假紫罗兰酮(B)、α-紫罗兰酮(C)、β-紫罗兰酮(D)和香叶酮(E)在野生型(蓝色菱形符号)、沉默型(红色方框符号)和过表达(浅绿色三角形符号)谱线中的浓度如图所示。(PDF 348 KB)
权利和权限
开放获取本文由BioMed Central Ltd.授权发布。这是一篇开放获取文章,根据创作共用授权协议(https://creativecommons.org/licenses/by/2.0),它允许在任何媒体上不受限制地使用、分发和复制,只要原著被恰当地引用。
关于这篇文章
引用这篇文章
拉什布鲁克,j.g.,杨,公关,多克拉尔,S.J.et al。三个成员的功能特征葡萄L.类胡萝卜素裂解双加氧酶基因家族。BMC植物杂志13,156(2013)。https://doi.org/10.1186/1471-2229-13-156
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-13-156
关键字
- 葡萄l
- 小道消息
- 类胡萝卜素
- Apocarotenoid
- 解理加双氧酶
- CCD1
- VvCCD4