摘要
背景
功能性共生结节的形成是豆科植物和根瘤菌协调发展的结果。豆科植物的遗传分析已被用于分析建立豆科植物-根瘤菌内共生关系所需的信号传递过程。与共生相互作用的早期事件相比,根瘤菌定殖所需的植物位点和根瘤菌的功能较少受到关注。在这里,我们描述了一些新的遗传位点的鉴定和特征Medicago truncatula这是形成有效固氮结节所必需的。
结果
大约38000个EMS和快中子诱变Medicago truncatula对幼苗进行共生固氮缺陷筛选。选择在结瘤发育和有效固氮方面受损的突变株进行进一步的遗传和表型分析。9个完全缺乏结节形成的突变体(Nod-)代表6个互补组,其中2个新位点已被鉴定。8个无效结节(Fix-)突变体代表7个互补组,其中5个为新的单基因位点。修正-m . truncatula突变体表现出缺氮症状,并形成白色小结节。对固定结核的显微分析表明,突变体在根瘤菌从感染线释放、根瘤菌分化和维持根瘤菌在结核细胞中的持久性方面存在缺陷。此外,我们监测了共生特定基因的转录活性,以确定在每个Fix-突变体中共生过程的哪个转录阶段被阻断。在表型和基因表达分析的基础上,对其进行了功能层次分析修复基因被提出。
结论
新的共生位点m . truncatula本研究中的分离为进一步描述支撑结瘤的机制,特别是与细菌释放和结瘤功能相关的晚期阶段提供了基础。
背景
豆科植物有能力发展与土壤细菌的根内共生,称为根瘤菌。这种关联有助于植物捕获氮,因此豆科植物可以生长在低营养的土壤中,是植物蛋白质的极好来源,也是可持续农业不可缺少的作物[1].根瘤菌调节植物的生长和发育,以促进定殖和建立共生相互作用(有关综述,请参阅[2])。
豆科植物-根瘤菌相互作用始于宿主和根瘤菌信号分子的相互识别。植物对根瘤菌伙伴产生的结瘤(Nod)因子的识别激活了植物中许多与结瘤形成相关的发育过程[3.].根瘤菌附着在根毛上,结合Nod因子的产生,诱导形成一种管状结构,称为感染线(IT),它通过根表皮延伸到发育中的结节原基。细菌从ITs释放到结节细胞的细胞质中[2],细菌被植物来源的膜包围,创造了一个新的亚细胞隔间,称为共生体。共生体中的细菌分裂分化成它们的共生形式[4],称为类细菌。在根结节内,植物伙伴向类细菌提供光合产物,以换取由大气氮转化的氨。
成熟的m . truncatula结节显示细胞发育梯度,形成不确定型结节的典型区[5].在结节顶端有一个持久的分生区(I区),确保了结节的持续生长和发育。细菌定植在感染区(II区)内分枝ITs的结节中,植物细胞中的细菌释放和分化开始于该区域。植物细胞和类细菌的分化都是在区间(II-III区)的少数细胞层中完成的。成熟结节的主要部分由共生区(III区)组成,其中发生固氮作用。老结节的基底部有一个衰老区(IV区),类菌和结节细胞在此降解。
豆科植物模型的开发,Medicago truncatula而且Lotus对虾以及他们基本完整的基因组序列[6,7极大地推进了豆科植物共生关系的分子研究。模型豆科植物的这种遗传解剖已经确定了结瘤所需的许多基因:共生信号通路(Sym)的组成部分(最近由[8- - - - - -12]),即调控结节数量的基因[13- - - - - -16]、细菌感染[17- - - - - -19],细菌分化[20.]、维修[21,22]和营养转运[23,24].在本研究中,我们试图进一步解剖与结节发展相关的过程,特别关注细菌感染和结节成熟的后期阶段。快中子轰击和EMS诱变m . truncatula对群体进行结瘤突变筛选。本研究从候选突变体中筛选出非结瘤突变体(Nod-)和非固氮突变体(Fix-),并对其进行进一步鉴定。已知位点的等位基因测试揭示了许多新的互补组,确定了结节发育早期和晚期所需的新基因。显微镜分析加上Fix-突变体的基因表达研究揭示了结节发展特定阶段所需的遗传位点。
结果
新结节缺陷的识别m . truncatula突变体
为了确定共生固氮所需的其他遗传位点,采用快中子轰击和甲烷磺酸乙酯(EMS)诱变进行了大规模正向遗传筛选m . truncatulajemalong人群。在M2植株中出现叶绿素缺乏(白化)表型的频率为2.6%,表明诱变成功[25].约38,000株幼苗,种植面积约600平方米的家庭[26]在低N含量的培养基中生长,并在接种野生型后5 - 6周筛选共生表型Sinorhizobium meliloti菌株B1。筛选植物结节缺陷,潜在的突变体缺乏结节,携带缺陷结节的突变体被保留进行二次筛选。对假定突变体的后代进行第二轮测试以确认其共生表型,最后选择9个结瘤缺陷(Nod-)和大量无效结瘤(Fix-)突变体进行进一步分析。
Nod-类包括根本不形成结节的突变体,发育小肿块的植物或结节明显减少的植物。根毛变形试验及感染美国meliloti对这些突变体进行分析,分析根毛对细菌Nod因子(NF)的响应以及接种根瘤菌后皮层细胞分裂的诱导。基于早期的共生反应,Nod-突变体被分类并与已知的Nod-突变体交叉以揭示等位关系(附加文件)1A).等位基因测试确定了新的等位基因dmi2而且nsp2还有三个新的等位基因dmi3.后续的序列分析dmi2等位基因(dmi2-5的细胞外结构域有97 bp的缺失DMI2,而dmi3突变体显示相同的7 bp缺失(表明这些突变系代表兄弟姐妹),然后它们将被指定为单个小说dmi3等位基因(dmi3-3).7个bp的缺失dmi3-3从编码序列的771位置开始,生成两个立即连续的停止密码子。另外两个结节缺陷突变体代表新的等位基因林也在这个屏幕中被分离出来,这些已经在[18].另外一个等位基因外祖母是由[26]和一个新的互补基团STA,即结节数目减少,在[27].
涉及结节发展和细菌感染的新位点的特征
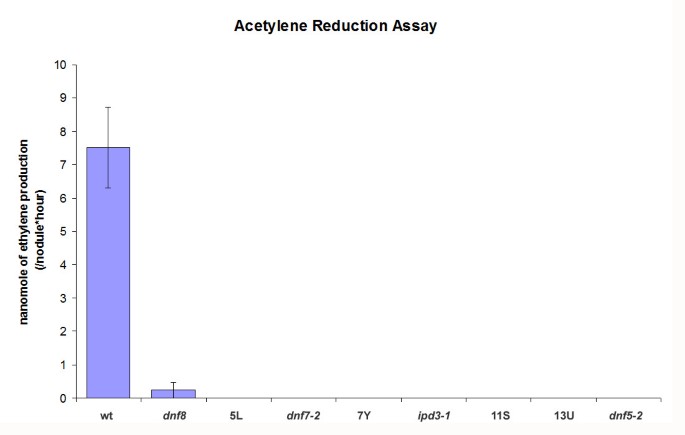
Fix-突变体的特征是在共生条件下氮饥饿的症状和白色小结节的发展(图1).补充复合氮使8个Fix-突变体恢复了正常的生长习惯,这表明在建立适当的固氮条件的能力方面存在特定缺陷。这是进一步验证使用乙炔还原,测量细菌固氮酶的活性[28].接种18 d后用美国meliloti野生型结核显示出高水平的乙炔,但在8个回交Fix-突变体中,除了一个突变体,没有检测到乙炔还原。dnf8(见下文),其中氮固定率非常低(图2).
回交突变体的F2分离率表明,8个Fix-突变体均分离为单个隐性位点(附加文件2).为了评估等位性,固定突变体相互交叉,并与先前鉴定的dnf突变体(29].这揭示了等位基因dnf5而且dnf7(dnf5-2而且dnf7-2)和一个新的互补基团,我们称之为dnf8(附加文件1B).的突变等位基因IPD3该等位基因已在[30.].
另外4个Fix-突变体进行了部分分析。等位基因测试显示5L和11S在同一位点上有突变,但对它们以及7Y和13U的不完全分析意味着我们不能仅通过等位基因测试来确定它们是代表新的遗传位点,还是已经定义的等位基因DNF位点。然而,迄今为止进行的等位基因测试没有显示出与DNF轨迹测试(附加文件1B).我们没有完成等位基因测试,而是决定进行初步的遗传作图,以确定这四个突变体是否映射到已知的位点上。这3个位点的遗传图谱位置的比较(附加文件)3.)和先前确定的dnf突变体(D. Wang,个人通讯)提示突变位点5L/11S, 7Y和13U被映射到具有未知共生基因的基因组位置,或者相应区域的已知共生位点不是等位的(13U和13U)dnf2;[22])。遗传作图数据和突变体表型分析表明,突变体5L/11S、7Y和13U为新位点。
无效突变体在共生固氮的不同阶段表现出停滞
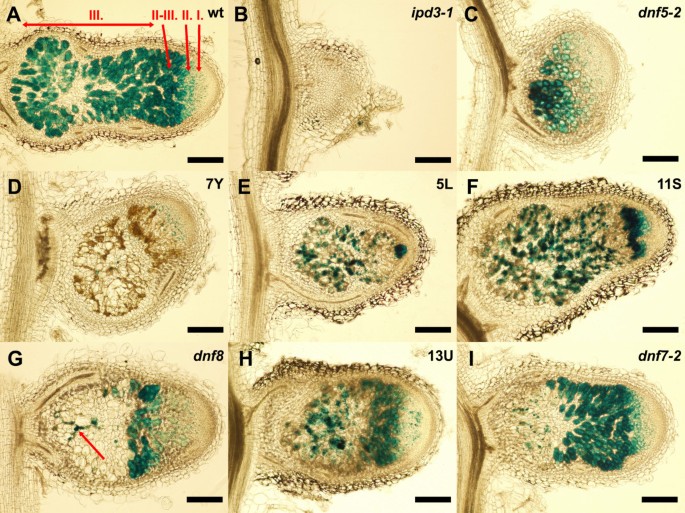
为了评估缺陷在固定突变体中发生的阶段,我们接种美国meliloti1021 (pXLGD4)LacZ报告基因(-:: lacZ;[31])。固定突变体只发育白色球形或略呈圆柱形的结节dnf8上面偶尔可以观察到一个淡粉色的结节。为了观察结节中细菌的存在,我们对21日龄结节进行β-半乳糖苷酶活性测定后进行纵向切片染色。光镜检查结节区细菌定殖的程度(图3.ⅰ)。野生型结节呈典型分带[5)(图3.A),在结节中未观察到这种分带ipd3-1而且dnf5-2(图3.B和C)。大多数结节形成于ipd3-1根呈球形,结节尖异常(图3.B),但少数结节发育成细长的圆柱形结构[30.].两者都不是ipd3-1结节中含有释放细菌的细胞,说明其基本功能IPD3用于细菌释放。相比之下ipd3-1,dnf5-2而且dnf7-2结节有含有细菌的细胞(图3.C和I),但未观察到不确定结节的特征性分带dnf5-2结节(图3.C),固氮区除少数零星感染根瘤菌外无根瘤菌(图3.我)dnf7-2结节。
固定突变体根瘤菌侵染程度。野生型的结节切片(一)和固定突变体(B-我).接种3周后收获结节美国meliloti1021表示lacZ基因。用X-gal染色70 μm厚结节切片检测β-半乳糖苷酶活性。结节的(B)ipd3-1,(C)dnf5-2,(D)7 y,(E)5 l,(F)11,(G)dnf8,(H)13 u和(我)dnf7-2突变体显示不同程度的细菌定殖。野生型结核上的罗马字母(一)表示成熟结节的区域:I.分生组织;2,在fection zone; II-III., interzone; III., nitrogen-fixation zone. The arrow shows an infection thread in panelG.条形代表200 μm。
其他的固定突变体形成或多或少的细长结节(图3.D-I),但根瘤菌对根瘤菌的分带性和占位性均受到影响。7Y结节细菌占比极低;细菌只能在感染区少数细胞中检出,固氮区只有少数感染线存在(图3.D)。此外,整个结节可见广泛的棕色色素沉着。5L和11S结节中也有零星的棕色色素沉着(图3.E和F), 13U结节的病变程度较低(图3.H).我们认为这种棕色色素沉着可能与这些固定突变体结节内细胞的衰老有关。5L和11S突变体出现结节,感染区狭窄,包含多个感染细胞,但中间和固氮区感染细胞出现降解(图3.E和F)dnf8在固氮区未发现感染细胞,仅发现少量感染线(图3.G)。同样,13U结节显示感染区细胞内有细菌,但固氮区感染水平较低(图3.H)。
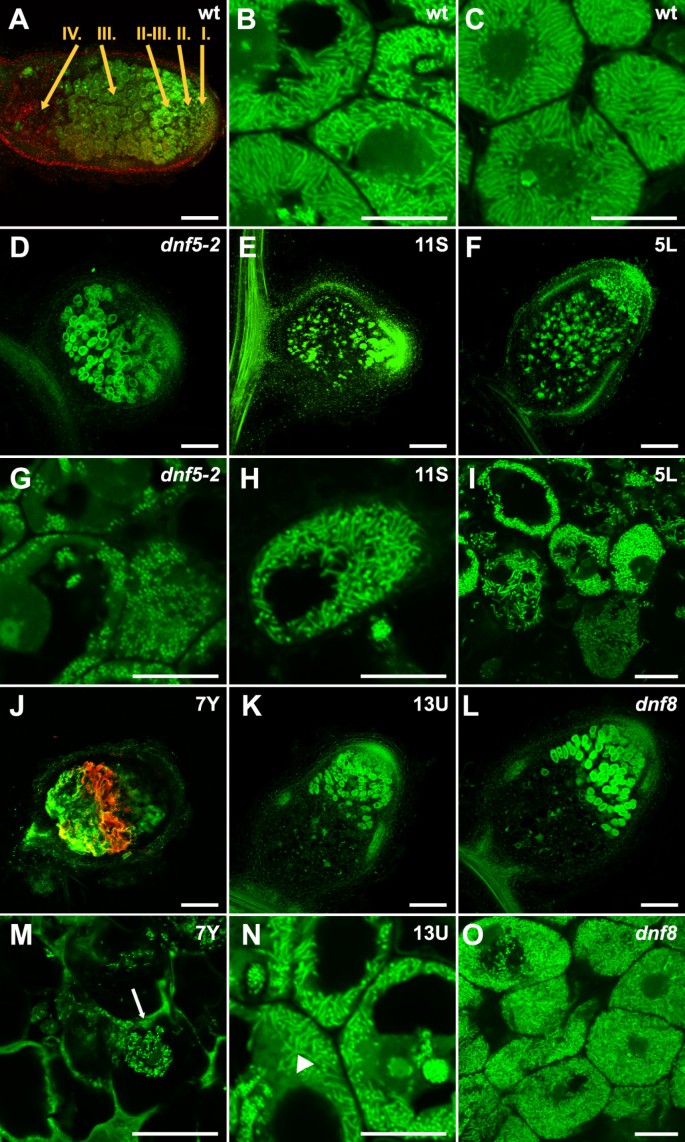
共生根瘤的有效功能伴随着根瘤细胞和根瘤菌的形态分化[32].为了研究Fix-突变体中根瘤菌的分化,用核酸结合染料SYTO13染色后分析细菌形态,并用共聚焦激光扫描显微镜观察[33].野生型植物的结节表现出特征性的类菌分化(图4A-C),区间和固氮区细胞被拉长菌完全占据(图4B和C)dnf5-2含有非细长杆状细菌,表明类菌分化失败(图4D和G)。5L和11S结节上点缀着一些含有放大细菌的细胞,提示局限于这些细胞的类细菌分化(图4E, F, H和I)dnf8结节固氮区不含感染细胞(图4K, L, N和O),但在带间细胞中可检测到细长和分枝的类菌。7Y结节的少数入侵细胞含有稍长的细菌(图4J和M)。7Y结节显示强烈的自身荧光(图4J)这可能与前面描述的棕色色素沉着有关。
固定突变体的根瘤菌分化。根瘤菌定植与细菌形态m . truncatula野生型(两者)固定突变结节(d o).结节纵切面4个wpi美国meliloti用SYTO13染色,共聚焦显微镜分析。成熟野生型结节的区域(一)如图所示2;但也有IV.,衰老区。高倍镜下可见野生型结节间区和固氮区感染细胞中延长的类细菌(B而且C).的减少分带表型dnf5-2(D)是否与缺乏细菌延伸有关(G).细菌发育在其他无效突变体(5L,E而且H;11,F而且我;7 y,J而且米;13你,K而且N;dnf8,l而且O).在7Y结节III区近端观察到强烈的自身荧光(J).在545-645 nm和伪红色之间检测到紫罗兰激光激发(405 nm)的自发荧光(一个而且J).箭头显示面板上有感染线米,箭头表示面板中分支的类细菌N.条形单位为200 μm inA d e f j k而且l,面板为20 μmB c g h i m n而且O.
共生标记基因的表达模式区分了固定突变体
结节的形成和固氮的开始是一个复杂的发育过程的结果,同时伴随着两个共生伙伴的转录变化[32,34].几种差异表达的晚期结节蛋白基因可作为解剖肿瘤的标记物m . truncatula-根瘤菌共生相互作用[29,32,34,35].我们选择了十个特定的共生基因(LEC4,两派,CAM1,N31,CP2,IPD3,NOD25,NOD26,NAP2而且NCR121),其转录谱[36]在附加文件中显示4.我们在接种细菌(dpi) 14天后使用定量RT-PCR监测根瘤菌诱导的这些共生标记基因的表达(附加文件)5、表1).
对应于共生过程的早期阻滞ipd3-1,dnf5-2和7Y(图2),在这些突变体中,所有共生标记基因的转录激活都被阻断或严重降低。然而,有一个有趣的例外NCR121这是在dnf5-2降低到与野生型相当的水平,但在ipd3-1和7 y。的表达式MtNAP2与野生型植物相比,所有无效突变体中编码一种功能未知的结节特异性蛋白的表达都减少了。MtNAP2在固定氮区含有部分感染细胞的结节中表达较低,但在ipd3-1,dnf5-2,dnf8而且dnf7-2与固氮区无结节分区或细菌占用不足有关(图3.).的MtLB1,MtNOD25而且MtNOD26在本研究的无效突变体中,晚期结节素的表达水平低于野生型,而在早期无效突变体中,晚期结节素没有或几乎没有诱导ipd3-1而且dnf5-2.半胱氨酸蛋白酶基因是结节早期衰老的标志基因之一MtCP在无效共生突变体中表达不同,但与野生型植物表达水平相当的仅在dnf7-2结节。的MtN31转录本,编码一种结节特异性富cys蛋白(NCR158)与野生型相比,在所有无效突变体中都能检测到非常低的水平,表明其表达伴随着共生结节的功能。共生标记基因的表达数据与显微镜下观察到的共生结节发育阻滞一致。
讨论
共生固氮的遗传解剖已经确定了共生信号通路的几个基本组成部分[11,12]并揭示了结节功能和细菌感染所需的一些基因[18- - - - - -23,37,38].在这篇文章中,我们描述了额外的遗传解剖,特别是结节功能的晚期阶段。这一基因筛选揭示了几个已定义的遗传位点的新等位基因(dmi2,dmi3,nsp2,外祖母,林,dnf5而且dnf7;[18,29,39- - - - - -43],两个新的互补基团(dnf8而且sta1;[27]),可能还有3个新的基因座。已知共生等位基因数量相对较高的鉴定,要么表明共生信号通路接近饱和,要么表明突变共生位点的偏好偏向m . truncatula.在不同的遗传筛选中使用的相似的生长条件可能会限制可处理的共生位点,而应用更精确或更微妙的条件可能会允许识别更多的共生位点。然而,新的遗传位点的鉴定,特别是与这一过程的后期阶段相关的鉴定,表明迄今为止对结瘤突变体进行的遗传筛选m . truncatula远远没有达到饱和。然而,最近一些基因筛选的联合作用在起作用m . truncatula([44),http://medicago-mutant.noble.org/mutant/FNB.php),可能会将基本的结瘤筛查推向遗传饱和。
根瘤菌对根瘤细胞的定植和共生根瘤的形成涉及细菌和植物的同步和协调发展。细菌从感染线中释放出来,通过内吞作用进入细胞质并分化为类细菌[2].在结节细胞中产生的富含半胱氨酸的小肽被传递给释放的细菌,是类细菌分化所必需的[20.,45].适当的营养物质的输送也被认为是类菌维持所必需的,而硫的输送已被证明在这一步骤中是必不可少的[23].一旦在这里和其他地方确定了位点,就可能为结节定义许多附加函数[29,44,46- - - - - -48),http://medicago-mutant.noble.org/mutant/FNB.php)已被克隆。
接种具有根瘤菌表达的无效突变体LacZ报告基因使我们能够比较新等位基因的结节表型dnf5而且dnf7到先前确定的[29].虽然在本研究和之前的研究中分析了不同年龄的结节[49,我们发现dnf5-2在结节区发育方面表现出与在dnf5-1结节(49].10天大结节切片dnf7-1揭示了根瘤菌在侵染区和中间区潜伏在根瘤菌中[49],与在dnf7-2结节。
对突变表型的描述和基因表达的分析使我们能够确定我们识别的受损基因的功能层次。IPD3而且DNF5似乎是最早的作用基因,具有严重的结节缺陷和共生基因表达大大降低。然而,无论是细菌的入侵程度和表达NCR121表明,DNF5可能会在以后的过程中采取行动IPD3。5L/11S和13U突变体根瘤菌的解体和固定区零星的棕色色素沉着表明细菌相互作用不相容和诱导早期衰老。5L/11S和13U中受损的基因似乎是维持细菌感染所必需的,特别是在结节的固氮区。而DNF8与5L/11S和13U有相似的结瘤缺陷,基因谱提示其发病时间稍晚于5L/11S和13U。的早期发育带中细菌的存在dnf8结瘤和固氮区完全缺乏根瘤菌可能表明该突变体根瘤菌分化停滞。7Y突变体中强烈的棕色色素沉着可能表明植物防御调控不当。如果这是正确的,那么在这个位点序列中定位7Y是有问题的,因为基因功能的时间可能与突变中止的阶段没有直接关系。然而,这样的说法可能是真实的所有遗传位点描述和作用IPD3(独眼巨人)在共生信号传递过程中[12,50,51]掩盖了其明显的晚期突变表型[30.,52].
无效突变体的特征可能暗示受损基因的可能功能,但为了评估它们的实际功能和特征它们的基因产物,这些基因需要克隆。尽管插入突变体有很大的优势,可以恢复转座子整合位点附近的基因组序列[44]的基因组资源m . truncatula还可通过基于地图的克隆或基于转录的克隆快速识别缺失的基因,正如最近几篇论文成功证明的那样[30.,38].缺陷基因的克隆和分子表征在无效m . truncatula本研究的突变体将为固氮结节的侵袭和分化过程提供更多的细节,有助于更好地理解支持固氮结节的分子、发育和分化事件。
结论
植物突变体已被广泛用于鉴定根瘤菌和豆科植物之间固氮共生相互作用所需的基因。这里我们描述了快中子和EMS诱变的共生突变筛选Medicago truncatula植物进行鉴定额外的共生突变体。已知共生基因新等位基因的鉴定Medicago truncatula共生突变体在结节发育和功能上出现缺陷,表明共生筛选远未达到饱和。对无效突变体的详细描述使我们能够对受损的突变体进行定位修复功能层次中的基因,可以选择在共生相互作用的某个不同阶段受损的无效突变体进行进一步分析。这些的分子鉴定修复基因将阐明它们在共生相互作用中的功能和作用。本研究中发现的无效固氮突变体的收集可作为这些新共生基因的鉴定资源。
方法
植物材料、生长条件和菌种
对快中子(FN)轰击和甲磺酸乙酯(EMS)诱变的种子种群进行了大规模共生筛选m . truncatulaJemalong系(FN)和A17基因型m . truncatula(EMS)。Jemalong的种子基因型m . truncatula线暴露于快中子辐射,描述如下[25].如前所述[26],共600 M2快速神经元辐射池和EMS诱变池(10-25科/库,60苗/科)进行表型筛选。
对于共生表型筛选,结瘤试验和表达研究m . truncatula种子被清除,消毒,洗涤和吸收描述Medicago truncatula手册(http://www.noble.org/MedicagoHandbook).将灭菌后的种子在4℃条件下春化5-7天,然后在室温黑暗条件下在倒置琼脂(0.8%水琼脂)板上萌发。对于共生筛选,诱变和控制野生型幼苗在Terragreen和沙子的1:1混合物中生长,如[26].Four-day-oldm . truncatula幼苗接种美国meliloti菌株B1与植物在接种后5 ~ 6周进行共生表型评价。在相同的生长基质中,在步入式生长室中进行确认筛选实验,如所述[26].
为了进行表型表征,将非结瘤突变体和野生型植物分别生长在含有含有0.1 μ L-α-(2-氨基乙氧基乙烯基)- gly (AVG)的缓冲结瘤培养基(BNM)的方板上(Sigma-Aldrich, St. Louis)或含有3:1沸石基质混合物的托盘上(Geoproduct Kft。, Mád,匈牙利)和沙子。Four-day-oldm . truncatula幼苗接种美国meliloti菌株1021携带-:: lacZ报告构造(pXLGD4;[31])。美国meliloti培养物在TA液中生长,在生长曲线的对数期将细菌制粒并在BNM液中重悬。最后稀释1:50 (OD6000.03-0.1)采用菌悬液接种,接种方法为将根淹入平板或每株加500 μl菌悬液。盘子和托盘上的植物在生长室中生长,使用与前面描述的相同的光和温度条件[30.].
共生突变体与基因型之间的遗传交叉按照[53].为了确定无效共生突变体中共生受损位点的图谱位置,将突变体植株进行杂交m . truncatula建立了A20基因型和F2分离群体。通过对定位群体的基因型分析,确定了该群体的定位位置m . truncatula基因组(54,55].
显微分析
为显微分析,结节在接种后3周收获美国meliloti1021 (pXLGD4),用4%甲醛在1xPBS (pH 7.4)中固定在冰上30分钟,并在1xPBS (pH 7.4)中冲洗3×15 min。用5%的琼脂糖(SeaKem®LE琼脂糖,Lonza)包埋结节,用MICROM HM 650V振冲器制备70 μm厚的纵向切片。为了观察β-半乳糖苷酶的活性,切片在含有50-50 mM铁氰化钾和亚铁氰化钾和0,08% X-Gal (Fermentas,立陶宛)的染色溶液中在1xPBS (pH 7.4)室温下孵育30分钟。染色结节切片在Olympus BX41M显微镜下×10 ×20物镜下观察,图像使用Olympus Camedia E-10数码相机拍摄。
为了分析类菌形态,在含有5 μM SYTO13 (Invitrogen, Eugene, Oregon)的1×PBS (pH 7.4)中对结节切片染色20分钟,并用1×PBS冲洗。
共聚焦激光扫描显微镜采用Olympus Fluoview FV1000共聚焦激光扫描显微镜(Olympus Life Science Europa GmbH, Hamburg, Germany)。显微镜配置如下:物镜:UPLSAPO 10×(干,NA:0.4), UPLFLN 40×(油,NA:1.3)和UPLSAPO 60 ×(油,NA:1.35);采样速度:4μs/像素;线平均:2×;扫描方式:顺序单向;激发:488 nm (SYTO13);激光透射率:5%;主二色分束器:DM405/488;中间二向色分束器:sdm490;发射滤波器:505-530 nm。 To capture autofluorescence (Figure4A和J),采用透射率为10%的405 nm激光,光谱探测器设置为545-645 nm范围。
乙炔还原法
采用乙炔还原法(ARA)和GC-14B岛津气相色谱仪检测固氮酶活性。如上所述,从在缓冲结瘤培养基(BNM)板上生长的突变型和野生型植物中接种18 d后收获结瘤的根节。将3 ~ 6个结核放入3 ml的玻璃小瓶中,用橡胶盖密封,立即注入0.15 ml乙炔,在10% (v/v)乙炔中培养结核。孵育2 h后,将500 μl样品和乙烯标准品注入气相色谱仪,测定乙烯的产率。固氮酶活性以ARA单位计算(每小时每结节数的乙烯纳米摩尔)。ARA进行了3次生物重复。
基因表达分析
用于定量RT-PCR实验m . truncatula植物在平板上生长,使用与显微分析相同的条件。接种后14天采集紫花苜蓿根或结瘤根,使用TRI试剂(Sigma, USA)按照制造商的方案提取总RNA。RNA样品按照制造商说明书使用RQ1 DNase I (Promega, USA)处理。RNA用RNeasy Mini Kit (QIAGEN, DE)清洗,然后用NanoDrop -1000分光光度计(NanoDrop Technologies, USA)定量基因组DNA游离总RNA,并通过凝胶电泳检查质量。
根据制造商说明,用SuperScript III第一链合成系统(Invitrogen, USA)从1 μg总RNA中提取互补DNA,使用oligo-dT引物进行RT-PCR。定量实时RT-PCR在MiniOpticon™系统(BIO-RAD, USA)上进行,使用BIO-RAD CFX Manager软件3,0。Maxima™SYBR Green Master Mix (Thermo, USA)用于监测48孔板中的双链(ds) DNA合成。每个基因特异性引物的最终引物浓度为100 nM。PCR条件如下:94°C持续10分钟的单次循环,接着是45-50次94°C持续15秒,58-60°C持续20秒,72°C持续20秒的循环。在每次PCR扩增后,运行熔解曲线以检查基因组DNA污染。为了产生熔化剖面,在完全变性后的20分钟内,随着温度从60°C逐渐增加到95°C,重复测量样品的荧光。引物-二聚体的形成通过没有模板DNA的对照来估计。结果表示为阈值周期(CT)值,该值由三次重复反应平均而成。对于归一化,CT用CT感兴趣基因的值(ΔCT).ΔΔCT值为减去ΔCT来自ΔC的野生型样本T不同突变体的值。折叠感应(2)ΔΔCT)对三个独立实验的结果进行平均,并使用SE进行绘图。
用于qPCR的引物序列在附加文件中列出6.以一个具有泛素结构域的基因(MTR_3g091440)作为内参基因,利用其内含子序列检测cDNA样本的基因组DNA污染,如[56].
参考文献
- 1.
格雷厄姆PH,万斯CP:豆类:重要性和限制更大的使用。植物科学进展,2003,31(3):344 - 344。10.1104 / pp.017004。
- 2.
Jones KM, Kobayashi H, Davies BW, Taga ME, Walker GC:根瘤菌共生体如何入侵植物Sinorhizobium-Medicago模型。微生物学通报,2007,5(8):619-633。10.1038 / nrmicro1705。
- 3.
Oldroyd GED, Downie JA:协调豆科植物根瘤菌感染的结节形态发生。植物学报,2008,29(4):519-546。10.1146 / annurev.arplant.59.032607.092839。
- 4.
马志刚,陈志刚,陈志刚,陈志刚,等:根瘤菌与豆科植物共生过程中细菌细胞周期和分化的真核调控。美国国家科学研究院。中国农业科学,2006,34(3):344 - 344。10.1073 / pnas.0600912103。
- 5.
王志刚,张志刚,张志刚。紫花苜蓿小结菌超微结构分化与氮素固定的关系。中国生物医学工程学报,2000,27(3):344 - 344。
- 6.
Sato S, Nakamura Y, Kaneko T, Asamizu E, Kato T, Nakao M, Sasamoto S, Watanabe A, Ono A, Kawashima K,等:豆科植物Lotus japonicus的基因组结构。DNA学报,2008,15(4):227-239。10.1093 / dnares / dsn008。
- 7.
Young ND, Debelle F, Oldroyd GED, Geurts R, Cannon SB, Udvardi MK, Benedito VA, Mayer KFX, Gouzy J, Schoof H,等人:Medicago基因组为根瘤菌共生的进化提供了洞察。自然科学,2011,38(4):344 - 344。
- 8.
Kouchi H,今津安乐H, Hayashi M,白山T,中川T,梅原Y,杉沼N,川口M:一荚有多少豌豆?豆科植物负责地下共生的基因。植物生理学报,2010,51(9):1381-1397。10.1093 /卡式肺囊虫肺炎/ pcq107。
- 9.
Madsen LH, Tirichine L, Jurkiewicz A, Sullivan JT, Heckmann AB, Bek AS, Ronson CW, James EK, Stougaard J:模型豆科植物Lotus japonicus结节发生和侵染的分子网络。网络通信,2010,1:e10-
- 10.
穆雷JD:邀请入侵:豆科植物的根瘤菌感染。植物化学学报,2011,24(6):631-639。10.1094 / mpmi - 08 - 10 - 0181。
- 11.
王晓明,王晓明,王晓明,王晓明:植物的共生关系与社会网络。植物学报,2013,16(1):118-127。10.1016 / j.pbi.2012.11.007。
- 12.
奥尔德罗伊德·GED:说话,朋友,请回答:促进植物有益共生关系的信号系统。微生物学通报,2013,11(4):252-263。10.1038 / nrmicro2990。
- 13.
Nishimura R, Ohmori M, Fujita H, Kawaguchi M:一种具有环指基序的Lotus碱性亮氨酸拉链蛋白负向调控结瘤的发育程序。美国国家科学研究院。2002, 99(23): 15206-15210。10.1073 / pnas.222302699。
- 14.
Krusell L, Madsen LH, Sato S, Aubert G, Genua A, Szczyglowski K, Duc G, Kaneko T, Tabata S, de Bruijn F,等:芽对根发育和结瘤的控制是由受体激酶介导的。自然科学学报,2002,26(4):344 - 344。10.1038 / nature01207。
- 15.
Schnabel E, Journet EP, de Carvalho-Niebel F, Duc G, Frugoli J:截叶苜蓿SUNN基因编码clv1样富亮氨酸重复受体激酶,调节根瘤数量和根长。植物分子生物学,2005,58(6):809-822。10.1007 / s11103 - 005 - 8102 - y。
- 16.
Penmetsa R, Uribe P, Anderson J, Lichtenzveig J, Gish J, Nam Y, Engstrom E, Xu K, Sckisel G, Pereira M,等:拟南芥短叶苜蓿EIN2的共生和致病微生物关联负调控因子。植物学报,2008,35(4):379 - 379。10.1111 / j.1365 - 313 x.2008.03531.x。
- 17.
Arrighi J, Godfroy O, de Billy F, Saurat O, Jauneau A, Gough C:截叶苜蓿的RPG基因控制根瘤菌在感染期间的极性生长。美国国家科学研究院。2008, 35(4): 457 - 457。10.1073 / pnas.0710273105。
- 18.
Kiss E, Olah B, Kalo P, Morales M, Heckmann A, Borbola A, Lozsa A, Kontar K, Middleton P, Downie J,等:一种新型U-Box/WD40蛋白LIN控制豆科植物根瘤菌早期侵染。植物学报,2009,29(3):349 - 349。10.1104 / pp.109.143933。
- 19.
Yano K, Shibata S, Chen W, Sato S, Kaneko T, Jurkiewicz A, Sandal N, Banba M, Imaizumi-Anraku H, Kojima T,等:CERBERUS是一种含有bd -40重复序列的新型U-box蛋白,是豆科-根瘤菌共生中感染线的形成和结节发育所必需的。植物学报,2009,30(1):379 - 379。10.1111 / j.1365 - 313 x.2009.03943.x。
- 20.
王d, Griffitts J, Starker C, Fedorova E, Limpens E, Ivanov S, Bisseling T, Long S:固氮共生所需的结节特异性蛋白分泌途径。科学通报,2010,27(6):529 - 529。10.1126 / science.1184096。
- 21.
Kumagai H, Hakoyama T, Umehara Y, Sato S, Kaneko T, Tabata S, Kouchi H:一种新型的ankyrinrepeat膜蛋白IGN1是荷花根瘤固氮共生持久所必需的。中国农业科学,2007,27(3):344 - 344。10.1104 / pp.106.095356。
- 22.
Bourcy M, Brocard L, Pislariu CI, Cosson V, Mergaert P, Tadege M, Mysore KS, Udvardi MK, Gourion B, Ratet P: Medicago truncatula DNF2是一种含有pi - plc - xd的蛋白质,用于类菌持久性和预防结节早期衰老和防御样反应。植物保护学报,2013,27(4):339 - 339。10.1111 / nph.12091。
- 23.
Krusell L, Krause K, Ott T, Desbrosses G, Kramer U, Sato S, Nakamura Y, Tabata S, James EK, Sandal N,等:硫酸盐转运蛋白SST1在莲叶根瘤共生固氮中的作用。植物细胞学报,2005,17(5):1625-1636。10.1105 / tpc.104.030106。
- 24.
Bagchi R, Salehin M, Adeyemo OS, Salazar C, Shulaev V, Sherrier DJ, Dickstein R: Medicago truncatula NIP/LATD蛋白的功能评价表明它是一种高亲和力硝酸盐转运蛋白。中国生物医学工程学报,2012,26(2):357 - 357。10.1104 / pp.112.196444。
- 25.
陈锐,陈志强,陈志强,陈志强:基于缺失的紫花苜蓿逆向遗传学研究。植物学报,2009,32(3):379 - 379。10.1104 / pp.109.142919。
- 26.
Marsh JF, Rakocevic A, Mitra RM, Brocard L, Sun J, Eschstruth A, Long SR, Schultze M, Ratet P, Oldroyd GED:截叶苜蓿是由自活性钙/钙调素依赖性蛋白激酶诱导的根瘤菌不依赖根瘤菌的结节器官发生所必需的。植物学报,2007,44(1):324- 324。10.1104 / pp.106.093021。
- 27.
丁艳,杨建军,梁勇,马西,李志刚,杨志刚,孙娟:脱落酸在截叶紫花苜蓿结瘤过程中Nod因子和细胞分裂素的调控。植物学报,2008,20(10):2681-2695。10.1105 / tpc.108.061739。
- 28.
杨晓明,杨晓明,陈晓明,等:固氮酶的测定2H2)在野外活动。微生物生态学研究中的现代方法。卷。17。斯德哥尔摩:Oikos编辑部;1973247 - 254。
- 29.
Starker CG, Parra-Colmenares AL, Smith L, Mitra RM, Long SR:截叶苜蓿固氮突变体不能支持植物和细菌共生基因的表达。植物学报,2006,40(2):379 - 379。10.1104 / pp.105.072132。
- 30.
Horvath B, Yeun LH, Domonkos A, Halasz G, Gobbato E, Ayaydin F, Miro K, Hirsch S, Sun JH, Tadege M,等:截叶苜蓿IPD3是根瘤菌和菌根共生所必需的共同共生信号通路的成员。植物化学学报,2011,24(11):1345-1358。10.1094 / mpmi - 01 - 11 - 0015。
- 31.
Boivin C, Camut S, Malpica C, Truchet G, Rosenberg C:根瘤菌meliloti在共生条件下诱导编码葫芦巴碱分解代谢的基因。中国生物医学工程学报,2000,12(2):357 - 357。
- 32.
Maunoury N, Redondo-Nieto M, Bourcy M, Van de Velde W, Alunni B, Laporte P, Durand P, Agier N, Marisa L, Vaubert D,等:Medicago truncatula结节中共生细胞和内共生细胞的分化与两个转录组开关耦合。公共科学学报,2010,5 (3):e9519-10.1371/journal. peer .0009519。doi: 9510.1371 / journal.pone.0009519
- 33.
王晓明,王志强,王志强,王志强,王志强,等:利用共聚焦显微镜对豆科植物根瘤发育的快速分析。植物生态学报,2004,27(3):344 - 344。10.1111 / j.1469-8137.2004.01138.x。
- 34.
莫罗S, Verdenaud M, Ott T, Letort S, de Billy F, Niebel A, Gouzy J, de Carvalho-Niebel F, Gamas P:截叶苜蓿根结节发育过程中的转录重编程。公共科学学报,2011,6 (1):e16463-10.1371/journal.pone.0016463。
- 35.
Mitra RM, Long SR:植物和细菌共生突变体在Medicago truncatula/Sinorhizobium meliloti共生的发展中定义了三个转录不同的阶段。植物科学进展,2004,34(2):366 - 366。10.1104 / pp.103.031518。
- 36.
Benedito V, Torres-Jerez I, Murray J, Andriankaja A, Allen S, Kakar K, Wandrey M, Verdier J, Zuber H, Ott T,等:模型豆科植物Medicago truncatula基因表达图谱。植物学报,2008,29(3):344 - 344。10.1111 / j.1365 - 313 x.2008.03519.x。
- 37.
Yendrek C, Lee Y, Morris V, Liang Y, Pislariu C, Burkart G, Meckfessel M, Salehin M, Kessler H, Wessler H,等:一种可能的转运蛋白在截叶苜蓿(Medicago truncatula)营养和激素信号通路与侧根生长和结节发育的整合中至关重要。植物学报,2010,29(3):344 - 344。10.1111 / j.1365 - 313 x.2010.04134.x。
- 38.
Murray JD, Muni RRD, Torres-Jerez I, Tang YH, Allen S, Andriankaja M, Li GM, Laxmi A,程晓峰,温建青,等:在截叶苜蓿(Medicago truncatula)根瘤菌共生中,丛枝菌根共生的胞内进展必需基因Vapyrin也是根瘤菌侵染的必需基因。植物学报,2011,26(2):344 - 344。10.1111 / j.1365 - 313 x.2010.04415.x。
- 39.
Endre G, Kereszt A, Kevei Z, Mihacea S, Kalo P, Kiss G:调节共生结节发育的受体激酶基因。自然科学学报,2002,26(3):344 - 344。10.1038 / nature00842。
- 40.
Mitra RM, Gleason CA, Edwards A, Hadfield J, Downie JA, Oldroyd GED, Long SR:共生结节发展所需的Ca2+/钙调蛋白依赖性蛋白激酶:基于转录克隆的基因鉴定。美国国家科学研究院。2004, 21(3): 379 - 379。10.1073 / pnas.0400595101。
- 41.
Oldroyd G, Long S: Medicago truncatula Nod因子信号通路2基因的鉴定与鉴定。植物学报,2003,31(3):1027-1032。10.1104 / pp.102.010710。
- 42.
Kalo P, Gleason C, Edwards A, Marsh J, Mitra RM, Hirsch S, Jakab J, Sims S, Long SR, Rogers J,等:豆科植物结瘤信号需要NSP2, GRAS家族转录调控因子的成员。科学通报,2005,38(4):379 - 379。10.1126 / science.1110951。
- 43.
Kuppusamy K, Endre G, Prabhu R, Penmetsa R, Veereshlingam H, Cook D, Dickstein R, VandenBosch K: LIN,根瘤菌感染根瘤分化和持久性所需的截叶苜蓿基因。植物科学进展,2004,26(3):344 - 344。10.1104 / pp.104.045575。
- 44.
Pislariu CI, Murray JD, Wen JQ, Cosson V, Muni RRD, Wang MY, Benedito VA, Andriankaja A, Cheng XF, Jerez IT,等:一个具有肿瘤发育和共生固氮缺陷的截叶苜蓿烟草逆转录转座子插入突变体集合。中国生物医学工程学报,2012,29(4):344 - 344。10.1104 / pp.112.197061。
- 45.
Van de Velde W, Zehirov G, Szatmari A, Debreczeny M, Ishihara H, Kevei Z, Farkas A, Mikulass K, Nagy A, Tiricz H,等:植物多肽控制共生细菌的末端分化。科学通报,2010,27(6):528 - 528。10.1126 / science.1184057。
- 46.
Perry JA, Wang TL, Welham TJ, Gardner S, Pike JM, Yoshida S, Parniske M:一种TILLING反向遗传学工具和豆科植物Lotus japonicus突变体的网络可访问集合。植物学报,2003,31(3):866-871。10.1104 / pp.102.017384。
- 47.
Bolon YT, Haun WJ, Xu WW, Grant D, Stacey MG, Nelson RT, Gerhardt DJ, Jeddeloh JA, Stacey G, Muehlbauer GJ,等:大豆快中子突变群体资源的表型和基因组分析。中国生物医学工程学报,2011,26(1):344 - 344。10.1104 / pp.110.170811。
- 48.
Fukai E, Soyano T, Umehara Y, Nakayama S, Hirakawa H, Tabata S, Sato S, Hayashi M:利用外显子靶向内源性逆转录转座子LORE1建立莲子基因标记群体。植物学报,2012,29(4):344 - 344。10.1111 / j.1365 - 313 x.2011.04826.x。
- 49.
皮斯拉柳CI,迪克斯坦R:安愤怒类似AGC激酶基因MtIRE在根结节发育的侵袭区有独特的表达Medicago truncatula.植物科学进展,2007,29(3):344 - 344。10.1104 / pp.106.092494。
- 50.
mesinese E, Mun J, Yeun L, Jayaraman D, Rouge P, Barre A, Lougnon G, Schornack S, Bono J, Cook D,等:一种新的核蛋白与共生DMI3钙和钙调素依赖性蛋白激酶相互作用Medicago truncatula.植物学报,2007,20(8):912-921。10.1094 / mpmi - 20 - 8 - 0912。
- 51.
辛格,帕niske M:钙调素依赖性蛋白激酶(CCaMK)的激活,植物根内共生的中心调节因子。植物学报,2012,15(4):444-453。10.1016 / j.pbi.2012.04.002。
- 52.
刘伟,张晓霞,张晓霞,刘晓霞,刘晓霞,等:IPD3对豌豆和紫花苜蓿固氮共生体形成的调控作用。植物营养学报,2011,24(11):1333-1344。10.1094 / mpmi - 01 - 11 - 0013。
- 53.
杨晓明,王晓明,王晓明,王晓明。花粉春化、杂交及花粉活力测定。截叶苜蓿手册。编辑:UM, EPJ, LWS。阿德莫尔,好:塞缪尔·罗伯茨诺布尔基金会;2007:1-13。
- 54.
崔h, Kim D, Uhm T, Limpens E, Lim H, Mun J, Kalo P, Penmetsa R, Seres A, Kulikova O,等:截叶苜蓿的序列遗传图谱及其与M-sativa的共线性比较。遗传学杂志,2004,166(3):1463-1502。10.1534 / genetics.166.3.1463。
- 55.
文俊华,金金杰,崔洪杰,Gish J, Debelle F, Mudge J, Denny R, Endre G, Saurat O, Dudez AM,等:微卫星在植物基因组中的分布Medicago truncatula:整合遗传和物理图谱的遗传标记资源。中国生物医学工程学报,2006,27(4):344 - 344。
- 56.
Kakar K, Wandrey M, Czechowski T, Gaertner T, Scheible W, Stitt M, Torres-Jerez I, Xiao Y, Redman J, Wu H,等:截叶苜蓿转录因子基因表达的高通量定量RT-PCR分析。植物学报,2008,4:e18-10.1186/1746-4811- 18。
确认
这项工作得到了OTKA拨款67576,104334和106068以及匈牙利-法国双边合作项目(NFÜ拨款TÉT_10-1-2011-0397来自匈牙利方面)的支持。作者特别感谢2003年在诺维奇John Innes中心进行的共生突变筛选的参与者。我们感谢I. Szívós和K. Miró提供的技术援助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
AD和BH同样有助于这项研究。AD进行了基因表达分析和表型表征。BH进行表型表征,光学显微镜分析和生产共聚焦成像的植物材料。JFM设计并管理正向基因筛选。GH参与了本研究中鉴定的突变位点的遗传分析。FA进行共聚焦显微成像。GEDO构思并设计了突变筛选,讨论了结果并编辑了稿件。PK参与突变体筛选,进行ARA试验,设计管理突变体表征实验,撰写稿件。所有作者都阅读并批准了最终的手稿。
Agota Domonkos, Beatrix Horvath对这项工作做出了同样的贡献。
电子辅助材料
本研究中鉴定的突变体与已知的共生突变体之间的等位性测试
附加文件1:m . truncatula+表示后代表现为野生型共生表型。-表示F1杂交植株在共生条件下没有形成结节(A)或表现出缺氮症状(B)。括号内的数字表示具有共生表型的植株数量和种子起源的荚果数量。等位基因关系用灰色突出显示。(doc 112kb)
共生突变体筛选中筛选出的8个无效突变体的无效共生表型分离分析。
附加文件2:回交和F2分离种群的分离数据。Χ2数值根据3:1的偏析比计算;P > 0.05;*在0.025显著水平;**在0.01显著水平;***为0.005显著水平。(doc 69 kb)
13U、5L/11S和7Y 3个共生位点的图谱位置。
附加文件3:利用3个F2定位群体(分别为238、288和81个个体)确定了3个共生位点的定位位置。用于作图的遗传标记被标记在代表各连锁群的比例条旁m . truncatula.红色竖条表示共生位点可能所在的区域。遗传标记(cM)的图谱位置是从遗传标记(cM)中转移而来的m . truncatulaMun等人绘制的基因图谱。[55].(tiff 88 kb)
在此基础上建立了10个共生标记基因的表达谱
附加文件4:m . truncatula基因表达图谱(http://mtgea.noble.org/v3/).(tiff 359 kb)
肿瘤特异性基因的表达分析
附加文件5:m . truncatula接种14 d后失效突变体美国meliloti1021.基因的表达MtLEC4, MtLB, MtCAM1, MtN31, MtCP, MtIPD3, MtNOD25, MtNOD26, MtNAP2而且MtNCR121采用real-time RT-PCR与野生型比较分析。每个突变体3个生物重复,3个技术重复用于分析。Kakar及其同事建议使用泛素蛋白家族成员基因(MTR_3g091440)进行数据归一化[56].误差条表示SE。(doc 182kb)
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
多蒙科斯,A,霍瓦特,B,马什,J.F.et al。新基因座的鉴定需要适当的结节发展Medicago truncatula.BMC植物生物学13日,157(2013)。https://doi.org/10.1186/1471-2229-13-157
收到了:
接受:
发表:
关键字
- Medicago truncatula
- 豆类
- 共生
- 突变的屏幕
- 无效固氮突变体